UNIVERSITE MOHAMMED V- RABAT
FACULTE DE MEDECINE ET DE PHARMACIE -RABAT-
ANNEE: 2015
THESE N°: 62
CHROMOMYCOSE ET SON DIAGNOSTIC BIOLOGIQUE :
À PROPOS DE DEUX CAS OBSERVÉS À L’HÔPITAL MILITAIRE
D’INSTRUCTION MOHAMED V DE RABAT
THESE
Présentée et soutenue publiquement le :………..
PAR
Mlle BAHOU SOUMIA
Née le 20 Juin 1989 à Er-Rachidia
Pour l'Obtention du Doctorat en Pharmacie
Mots clés: Chromomycose -Cellule fumagoïde - Diagnostic biologique
JURY
Mr. M. BOUI
PRESIDENT
Professeur de Dermatologie
Mr. B. E. LMIMOUNI
RAPPORTEUR
Professeur de Parasitologie
Mme. H. KABBAJ
Professeur Agrégé de microbiologie
Mr. A. BENNANA
Professeur Agrégé en Gestion Pharmaceutique
Mr. Y. SEKKACH
Professeur Agrégé de Médecine Interne
UNIVERSITE MOHAMMED V DE RABAT
FACULTE DE MEDECINE ET DE PHARMACIE - RABAT
DOYENS HONORAIRES :
1962 – 1969 : ProfesseurAbdelmalek FARAJ 1969 – 1974 : Professeur Abdellatif BERBICH 1974 – 1981 : Professeur Bachir LAZRAK 1981 – 1989 : Professeur Taieb CHKILI
1989 – 1997 : Professeur Mohamed Tahar ALAOUI 1997 – 2003 : Professeur Abdelmajid BELMAHI 2003 – 2013 : Professeur Najia HAJJAJ - HASSOUNI
ADMINISTRATION :
Doyen : Professeur Mohamed ADNAOUI
Vice Doyen chargé des Affaires Académiques et estudiantines
Professeur Mohammed AHALLAT
Vice Doyen chargé de la Recherche et de la Coopération
Professeur Taoufiq DAKKA
Vice Doyen chargé des Affaires Spécifiques à la Pharmacie
Professeur Jamal TAOUFIK
Secrétaire Général : Mr. El Hassane AHALLAT
1- ENSEIGNANTS-CHERCHEURS MEDECINS
ET
PHARMACIENS
PROFESSEURS :
Mai et Octobre 1981
Pr. MAAZOUZI Ahmed Wajih Chirurgie Cardio-Vasculaire
Pr. TAOBANE Hamid* Chirurgie Thoracique
Mai et Novembre 1982
Pr. BENOSMAN Abdellatif Chirurgie Thoracique
Novembre 1983
Pr. HAJJAJ Najia ép. HASSOUNI Rhumatologie
Décembre 1984
Pr. MAAOUNI Abdelaziz Médecine Interne – Clinique Royale
Pr. MAAZOUZI Ahmed Wajdi Anesthésie -Réanimation
Pr. SETTAF Abdellatif pathologie Chirurgicale
Novembre et Décembre 1985
Pr. BENJELLOUN Halima Cardiologie
Pr. BENSAID Younes Pathologie Chirurgicale
Pr. EL ALAOUI Faris Moulay El Mostafa Neurologie
Janvier, Février et Décembre 1987
Pr. AJANA Ali Radiologie
Pr. CHAHED OUAZZANI Houria Gastro-Entérologie
Pr. EL YAACOUBI Moradh Traumatologie Orthopédie
Pr. ESSAID EL FEYDI Abdellah Gastro-Entérologie
Pr. LACHKAR Hassan Médecine Interne
Pr. YAHYAOUI Mohamed Neurologie
Décembre 1988
Pr. BENHAMAMOUCH Mohamed Najib Chirurgie Pédiatrique
Pr. DAFIRI Rachida Radiologie
Pr. HERMAS Mohamed Traumatologie Orthopédie
Décembre 1989
Pr. ADNAOUI Mohamed Médecine Interne –Doyen de la FMPR
Pr. BOUKILI MAKHOUKHI Abdelali* Cardiologie
Pr. CHAD Bouziane Pathologie Chirurgicale
Pr. OUAZZANI Taïbi Mohamed Réda Neurologie
Janvier et Novembre 1990
Pr. CHKOFF Rachid Pathologie Chirurgicale
Pr. HACHIM Mohammed* Médecine-Interne
Pr. KHARBACH Aîcha Gynécologie -Obstétrique
Pr. MANSOURI Fatima Anatomie-Pathologique
Pr. TAZI Saoud Anas Anesthésie Réanimation
Février Avril Juillet et Décembre 1991
Pr. AL HAMANY Zaîtounia Anatomie-Pathologique
Pr. AZZOUZI Abderrahim Anesthésie Réanimation –Doyen de la FMPO
Pr. BAYAHIA Rabéa Néphrologie
Pr. BELKOUCHI Abdelkader Chirurgie Générale Pr. BENCHEKROUN Belabbes Abdellatif Chirurgie Générale
Pr. BENSOUDA Yahia Pharmacie galénique
Pr. BERRAHO Amina Ophtalmologie
Pr. BEZZAD Rachid Gynécologie Obstétrique
Pr. CHABRAOUI Layachi Biochimie et Chimie
Pr. CHERRAH Yahia Pharmacologie
Pr. CHOKAIRI Omar Histologie Embryologie
Pr. KHATTAB Mohamed Pédiatrie
Pr. TAOUFIK Jamal Chimie thérapeutique
Décembre 1992
Pr. AHALLAT Mohamed Chirurgie Générale
Pr. BENSOUDA Adil Anesthésie Réanimation
Pr. BOUJIDA Mohamed Najib Radiologie
Pr. CHAHED OUAZZANI Laaziza Gastro-Entérologie
Pr. CHRAIBI Chafiq Gynécologie Obstétrique
Pr. DAOUDI Rajae Ophtalmologie
Pr. DEHAYNI Mohamed* Gynécologie Obstétrique
Pr. EL OUAHABI Abdessamad Neurochirurgie
Pr. FELLAT Rokaya Cardiologie
Pr. GHAFIR Driss* Médecine Interne
Pr. JIDDANE Mohamed Anatomie
Pr. TAGHY Ahmed Chirurgie Générale
Pr. ZOUHDI Mimoun Microbiologie
Mars 1994
Pr. BENJAAFAR Noureddine Radiothérapie
Pr. BEN RAIS Nozha Biophysique
Pr. CAOUI Malika Biophysique
Pr. CHRAIBI Abdelmjid Endocrinologie et Maladies Métaboliques
Pr. EL AMRANI Sabah Gynécologie Obstétrique
Pr. EL AOUAD Rajae Immunologie
Pr. EL BARDOUNI Ahmed Traumato-Orthopédie
Pr. EL HASSANI My Rachid Radiologie
Pr. ERROUGANI Abdelkader Chirurgie Générale- Directeur CHIS
Pr. ESSAKALI Malika Immunologie
Pr. ETTAYEBI Fouad Chirurgie Pédiatrique
Pr. HADRI Larbi* Médecine Interne
Pr. HASSAM Badredine Dermatologie
Pr. IFRINE Lahssan Chirurgie Générale
Pr. JELTHI Ahmed Anatomie Pathologique
Pr. MAHFOUD Mustapha Traumatologie – Orthopédie
Pr. MOUDENE Ahmed* Traumatologie- Orthopédie Inspecteur du SS
Pr. RHRAB Brahim Gynécologie –Obstétrique
Pr. SENOUCI Karima Dermatologie
Mars 1994
Pr. ABBAR Mohamed* Urologie
Pr. ABDELHAK M’barek Chirurgie Pédiatrique
Pr. BELAIDI Halima Neurologie
Pr. BRAHMI Rida Slimane Gynécologie Obstétrique
Pr. BENTAHILA Abdelali Pédiatrie
Pr. BERRADA Mohamed Saleh Traumatologie – Orthopédie
Pr. CHAMI Ilham Radiologie
Pr. CHERKAOUI Lalla Ouafae Ophtalmologie
Pr. EL ABBADI Najia Neurochirurgie
Pr. HANINE Ahmed* Radiologie
Pr. JALIL Abdelouahed Chirurgie Générale
Pr. LAKHDAR Amina Gynécologie Obstétrique
Pr. MOUANE Nezha Pédiatrie
Mars 1995
Pr. ABOUQUAL Redouane Réanimation Médicale
Pr. AMRAOUI Mohamed Chirurgie Générale
Pr. BAIDADA Abdelaziz Gynécologie Obstétrique
Pr. BARGACH Samir Gynécologie Obstétrique
Pr. CHAARI Jilali* Médecine Interne
Pr. DIMOU M’barek* Anesthésie Réanimation – Dir. HMIM
Pr. DRISSI KAMILI Med Nordine* Anesthésie Réanimation
Pr. EL MESNAOUI Abbes Chirurgie Générale
Pr. ESSAKALI HOUSSYNI Leila Oto-Rhino-Laryngologie
Pr. HDA Abdelhamid* Cardiologie - Directeur ERSM
Pr. IBEN ATTYA ANDALOUSSI Ahmed Urologie
Pr. OUAZZANI CHAHDI Bahia Ophtalmologie
Pr. SEFIANI Abdelaziz Génétique
Pr. ZEGGWAGH Amine Ali Réanimation Médicale
Décembre 1996
Pr. AMIL Touriya* Radiologie
Pr. BELKACEM Rachid Chirurgie Pédiatrie
Pr. BOULANOUAR Abdelkrim Ophtalmologie
Pr. EL ALAMI EL FARICHA EL Hassan Chirurgie Générale
Pr. GAOUZI Ahmed Pédiatrie
Pr. MAHFOUDI M’barek* Radiologie
Pr. MOHAMMADI Mohamed Médecine Interne
Pr. OUADGHIRI Mohamed Traumatologie-Orthopédie
Pr. OUZEDDOUN Naima Néphrologie
Pr. ZBIR EL Mehdi* Cardiologie
Novembre 1997
Pr. ALAMI Mohamed Hassan Gynécologie-Obstétrique
Pr. BEN SLIMANE Lounis Urologie
Pr. BIROUK Nazha Neurologie
Pr. CHAOUIR Souad* Radiologie
Pr. ERREIMI Naima Pédiatrie
Pr. FELLAT Nadia Cardiologie
Pr. HAIMEUR Charki* Anesthésie Réanimation
Pr. KOUTANI Abdellatif Urologie
Pr. LAHLOU Mohamed Khalid Chirurgie Générale
Pr. MAHRAOUI CHAFIQ Pédiatrie
Pr. OUAHABI Hamid* Neurologie
Pr. TAOUFIQ Jallal Psychiatrie
Pr. YOUSFI MALKI Mounia Gynécologie Obstétrique
Novembre 1998
Pr. AFIFI RAJAA Gastro-Entérologie
Pr. BENOMAR ALI Neurologie – Doyen Abulcassis
Pr. BOUGTAB Abdesslam Chirurgie Générale
Pr. ER RIHANI Hassan Oncologie Médicale
Pr. EZZAITOUNI Fatima Néphrologie
Pr. LAZRAK Khalid * Traumatologie Orthopédie
Pr. BENKIRANE Majid* Hématologie
Pr. KHATOURI ALI* Cardiologie
Pr. LABRAIMI Ahmed* Anatomie Pathologique
Janvier 2000
Pr. ABID Ahmed* Pneumophtisiologie
Pr. AIT OUMAR Hassan Pédiatrie
Pr. BENJELLOUN Dakhama Badr.Sououd Pédiatrie
Pr. BOURKADI Jamal-Eddine Pneumo-phtisiologie Pr. CHARIF CHEFCHAOUNI Al Montacer Chirurgie Générale
Pr. ECHARRAB El Mahjoub Chirurgie Générale
Pr. EL FTOUH Mustapha Pneumo-phtisiologie
Pr. EL MOSTARCHID Brahim* Neurochirurgie
Pr. ISMAILI Hassane* Traumatologie Orthopédie
Pr. MAHMOUDI Abdelkrim* Anesthésie-Réanimation
Pr. TACHINANTE Rajae Anesthésie-Réanimation
Pr. TAZI MEZALEK Zoubida Médecine Interne
Novembre 2000
Pr. AIDI Saadia Neurologie
Pr. AIT OURHROUI Mohamed Dermatologie
Pr. AJANA Fatima Zohra Gastro-Entérologie
Pr. BENAMR Said Chirurgie Générale
Pr. CHERTI Mohammed Cardiologie
Pr. ECH-CHERIF EL KETTANI Selma Anesthésie-Réanimation
Pr. EL HASSANI Amine Pédiatrie
Pr. EL KHADER Khalid Urologie
Pr. EL MAGHRAOUI Abdellah* Rhumatologie
Pr. GHARBI Mohamed El Hassan Endocrinologie et Maladies Métaboliques
Pr. HSSAIDA Rachid* Anesthésie-Réanimation
Pr. MAFTAH Mohamed* Neurochirurgie
Pr. MAHASSINI Najat Anatomie Pathologique
Pr. MDAGHRI ALAOUI Asmae Pédiatrie
Pr. NASSIH Mohamed* Stomatologie Et Chirurgie Maxillo-Faciale
Pr. ROUIMI Abdelhadi* Neurologie
Décembre 2000
Pr. ZOHAIR ABDELAH* ORL
Décembre 2001
Pr. ABABOU Adil Anesthésie-Réanimation
Pr. BALKHI Hicham* Anesthésie-Réanimation
Pr. BENABDELJLIL Maria Neurologie
Pr. BENAMAR Loubna Néphrologie
Pr. BENAMOR Jouda Pneumo-phtisiologie
Pr. BENELBARHDADI Imane Gastro-Entérologie
Pr. BENNANI Rajae Cardiologie
Pr. BENOUACHANE Thami Pédiatrie
Pr. BEZZA Ahmed* Rhumatologie
Pr. BOUCHIKHI IDRISSI Med Larbi Anatomie
Pr. BOUMDIN El Hassane* Radiologie
Pr. CHAT Latifa Radiologie
Pr. DAALI Mustapha* Chirurgie Générale
Pr. DRISSI Sidi Mourad* Radiologie
Pr. EL HIJRI Ahmed Anesthésie-Réanimation
Pr. EL MAAQILI Moulay Rachid Neuro-Chirurgie
Pr. EL MADHI Tarik Chirurgie-Pédiatrique
Pr. EL OUNANI Mohamed Chirurgie Générale
Pr. ETTAIR Said Pédiatrie
Pr. GAZZAZ Miloudi* Neuro-Chirurgie
Pr. HRORA Abdelmalek Chirurgie Générale
Pr. KABBAJ Saad Anesthésie-Réanimation
Pr. KABIRI EL Hassane* Chirurgie Thoracique
Pr. LAMRANI Moulay Omar Traumatologie Orthopédie
Pr. LEKEHAL Brahim Chirurgie Vasculaire Périphérique
Pr. MAHASSIN Fattouma* Médecine Interne
Pr. MEDARHRI Jalil Chirurgie Générale
Pr. MIKDAME Mohammed* Hématologie Clinique
Pr. MOHSINE Raouf Chirurgie Générale
Pr. NOUINI Yassine Urologie
Pr. SABBAH Farid Chirurgie Générale
Pr. SEFIANI Yasser Chirurgie Vasculaire Périphérique
Décembre 2002
Pr. AL BOUZIDI Abderrahmane* Anatomie Pathologique
Pr. AMEUR Ahmed * Urologie
Pr. AMRI Rachida Cardiologie
Pr. AOURARH Aziz* Gastro-Entérologie
Pr. BAMOU Youssef * Biochimie-Chimie
Pr. BELMEJDOUB Ghizlene* Endocrinologie et Maladies Métaboliques
Pr. BENZEKRI Laila Dermatologie
Pr. BENZZOUBEIR Nadia Gastro-Entérologie
Pr. BERNOUSSI Zakiya Anatomie Pathologique
Pr. BICHRA Mohamed Zakariya* Psychiatrie
Pr. CHOHO Abdelkrim * Chirurgie Générale
Pr. CHKIRATE Bouchra Pédiatrie
Pr. EL ALAMI EL FELLOUS Sidi Zouhair Chirurgie Pédiatrique
Pr. EL HAOURI Mohamed * Dermatologie
Pr. EL MANSARI Omar* Chirurgie Générale
Pr. FILALI ADIB Abdelhai Gynécologie Obstétrique
Pr. HAJJI Zakia Ophtalmologie
Pr. IKEN Ali Urologie
Pr. JAAFAR Abdeloihab* Traumatologie Orthopédie
Pr. KRIOUILE Yamina Pédiatrie
Pr. LAGHMARI Mina Ophtalmologie
Pr. MABROUK Hfid* Traumatologie Orthopédie
Pr. MOUSSAOUI RAHALI Driss* Gynécologie Obstétrique
Pr. MOUSTAGHFIR Abdelhamid* Cardiologie
Pr. NAITLHO Abdelhamid* Médecine Interne
Pr. OUJILAL Abdelilah Oto-Rhino-Laryngologie
Pr. RACHID Khalid * Traumatologie Orthopédie
Pr. RAISS Mohamed Chirurgie Générale
Pr. RGUIBI IDRISSI Sidi Mustapha* Pneumophtisiologie
Pr. RHOU Hakima Néphrologie
Pr. SIAH Samir * Anesthésie Réanimation
Pr. THIMOU Amal Pédiatrie
Pr. ZENTAR Aziz* Chirurgie Générale
Janvier 2004
Pr. ABDELLAH El Hassan Ophtalmologie
Pr. AMRANI Mariam Anatomie Pathologique
Pr. BENBOUZID Mohammed Anas Oto-Rhino-Laryngologie
Pr. BENKIRANE Ahmed* Gastro-Entérologie
Pr. BOUGHALEM Mohamed* Anesthésie Réanimation
Pr. BOULAADAS Malik Stomatologie et Chirurgie Maxillo-faciale
Pr. BOURAZZA Ahmed* Neurologie
Pr. CHAGAR Belkacem* Traumatologie Orthopédie
Pr. EL FENNI Jamal* Radiologie
Pr. EL HANCHI ZAKI Gynécologie Obstétrique
Pr. EL KHORASSANI Mohamed Pédiatrie
Pr. EL YOUNASSI Badreddine* Cardiologie
Pr. HACHI Hafid Chirurgie Générale
Pr. JABOUIRIK Fatima Pédiatrie
Pr. KHABOUZE Samira Gynécologie Obstétrique
Pr. KHARMAZ Mohamed Traumatologie Orthopédie
Pr. LEZREK Mohammed* Urologie
Pr. MOUGHIL Said Chirurgie Cardio-Vasculaire
Pr. OUBAAZ Abdelbarre* Ophtalmologie
Pr. TARIB Abdelilah* Pharmacie Clinique
Pr. TIJAMI Fouad Chirurgie Générale
Pr. ZARZUR Jamila Cardiologie
Janvier 2005
Pr. ABBASSI Abdellah Chirurgie Réparatrice et Plastique Pr. AL KANDRY Sif Eddine* Chirurgie Générale
Pr. ALAOUI Ahmed Essaid Microbiologie
Pr. ALLALI Fadoua Rhumatologie
Pr. AMAZOUZI Abdellah Ophtalmologie
Pr. AZIZ Noureddine* Radiologie
Pr. BAHIRI Rachid Rhumatologie
Pr. BARKAT Amina Pédiatrie
Pr. BENHALIMA Hanane Stomatologie et Chirurgie Maxillo Faciale
Pr. BENYASS Aatif Cardiologie
Pr. BERNOUSSI Abdelghani Ophtalmologie
Pr. CHARIF CHEFCHAOUNI Mohamed Ophtalmologie
Pr. DOUDOUH Abderrahim* Biophysique
Pr. EL HAMZAOUI Sakina* Microbiologie
Pr. HAJJI Leila Cardiologie (mise en disponibilité)
Pr. HESSISSEN Leila Pédiatrie
Pr. JIDAL Mohamed* Radiologie
Pr. LAAROUSSI Mohamed Chirurgie Cardio-vasculaire
Pr. LYAGOUBI Mohammed Parasitologie
Pr. NIAMANE Radouane* Rhumatologie
Pr. RAGALA Abdelhak Gynécologie Obstétrique
Pr. SBIHI Souad Histo-Embryologie Cytogénétique
Pr. ZERAIDI Najia Gynécologie Obstétrique
Décembre 2005
Avril 2006
Pr. ACHEMLAL Lahsen* Rhumatologie
Pr. AKJOUJ Said* Radiologie
Pr. BELMEKKI Abdelkader* Hématologie
Pr. BENCHEIKH Razika O.R.L
Pr. BIYI Abdelhamid* Biophysique
Pr. BOUHAFS Mohamed El Amine Chirurgie - Pédiatrique Pr. BOULAHYA Abdellatif* Chirurgie Cardio – Vasculaire Pr. CHENGUETI ANSARI Anas Gynécologie Obstétrique
Pr. DOGHMI Nawal Cardiologie
Pr. ESSAMRI Wafaa Gastro-entérologie
Pr. FELLAT Ibtissam Cardiologie
Pr. FAROUDY Mamoun Anesthésie Réanimation
Pr. GHADOUANE Mohammed* Urologie
Pr. HARMOUCHE Hicham Médecine Interne
Pr. HANAFI Sidi Mohamed* Anesthésie Réanimation
Pr. IDRISS LAHLOU Amine* Microbiologie
Pr. JROUNDI Laila Radiologie
Pr. KARMOUNI Tariq Urologie
Pr. KILI Amina Pédiatrie
Pr. KISRA Hassan Psychiatrie
Pr. KISRA Mounir Chirurgie – Pédiatrique
Pr. LAATIRIS Abdelkader* Pharmacie Galénique
Pr. LMIMOUNI Badreddine* Parasitologie
Pr. MANSOURI Hamid* Radiothérapie
Pr. OUANASS Abderrazzak Psychiatrie
Pr. SAFI Soumaya* Endocrinologie
Pr. SEKKAT Fatima Zahra Psychiatrie
Pr. SOUALHI Mouna Pneumo – Phtisiologie
Pr. TELLAL Saida* Biochimie
Pr. ZAHRAOUI Rachida Pneumo – Phtisiologie
Octobre 2007
Pr. ABIDI Khalid Réanimation médicale
Pr. ACHACHI Leila Pneumo phtisiologie
Pr. ACHOUR Abdessamad* Chirurgie générale
Pr. AIT HOUSSA Mahdi* Chirurgie cardio vasculaire
Pr. AMHAJJI Larbi* Traumatologie orthopédie
Pr. AMMAR Haddou* ORL
Pr. AOUFI Sarra Parasitologie
Pr. BAITE Abdelouahed* Anesthésie réanimation
Pr. BALOUCH Lhousaine* Biochimie-chimie
Pr. BENZIANE Hamid* Pharmacie clinique
Pr. BOUTIMZINE Nourdine Ophtalmologie
Pr. EHIRCHIOU Abdelkader* Chirurgie générale
Pr. ELABSI Mohamed Chirurgie générale
Pr. EL MOUSSAOUI Rachid Anesthésie réanimation
Pr. EL OMARI Fatima Psychiatrie
Pr. GANA Rachid Neuro chirurgie
Pr. GHARIB Noureddine Chirurgie plastique et réparatrice
Pr. HADADI Khalid* Radiothérapie
Pr. ICHOU Mohamed* Oncologie médicale
Pr. ISMAILI Nadia Dermatologie
Pr. KEBDANI Tayeb Radiothérapie
Pr. LALAOUI SALIM Jaafar* Anesthésie réanimation
Pr. LOUZI Lhoussain* Microbiologie
Pr. MADANI Naoufel Réanimation médicale
Pr. MAHI Mohamed* Radiologie
Pr. MARC Karima Pneumo phtisiologie
Pr. MASRAR Azlarab Hématologie biologique
Pr. MOUTAJ Redouane * Parasitologie
Pr. MRABET Mustapha* Médecine préventive santé publique et hygiène
Pr. MRANI Saad* Virologie
Pr. OUZZIF Ez zohra* Biochimie-chimie
Pr. RABHI Monsef* Médecine interne
Pr. RADOUANE Bouchaib* Radiologie
Pr. SEFFAR Myriame Microbiologie
Pr. SEKHSOKH Yessine* Microbiologie
Pr. SIFAT Hassan* Radiothérapie
Pr. TABERKANET Mustafa* Chirurgie vasculaire périphérique
Pr. TACHFOUTI Samira Ophtalmologie
Pr. TAJDINE Mohammed Tariq* Chirurgie générale
Pr. TANANE Mansour* Traumatologie orthopédie
Pr. TLIGUI Houssain Parasitologie
Pr. TOUATI Zakia Cardiologie
Décembre 2007
Pr. DOUHAL ABDERRAHMAN Ophtalmologie
Décembre 2008
Pr ZOUBIR Mohamed* Anesthésie Réanimation Pr TAHIRI My El Hassan* Chirurgie Générale
Mars 2009
Pr. ABOUZAHIR Ali* Médecine interne
Pr. AGDR Aomar* Pédiatre
Pr. AIT ALI Abdelmounaim* Chirurgie Générale Pr. AIT BENHADDOU El hachmia Neurologie
Pr. AKHADDAR Ali* Neuro-chirurgie
Pr. AMAHZOUNE Brahim* Chirurgie Cardio-vasculaire
Pr. AMINE Bouchra Rhumatologie
Pr. ARKHA Yassir Neuro-chirurgie
Pr. AZENDOUR Hicham* Anesthésie Réanimation
Pr. BELYAMANI Lahcen* Anesthésie Réanimation
Pr. BJIJOU Younes Anatomie
Pr. BOUHSAIN Sanae* Biochimie-chimie
Pr. BOUI Mohammed* Dermatologie
Pr. BOUNAIM Ahmed* Chirurgie Générale
Pr. BOUSSOUGA Mostapha* Traumatologie orthopédique
Pr. CHAKOUR Mohammed * Hématologie biologique
Pr. CHTATA Hassan Toufik* Chirurgie vasculaire périphérique
Pr. DOGHMI Kamal* Hématologie clinique
Pr. EL MALKI Hadj Omar Chirurgie Générale
Pr. EL OUENNASS Mostapha* Microbiologie
Pr. ENNIBI Khalid* Médecine interne
Pr. FATHI Khalid Gynécologie obstétrique
Pr. HASSIKOU Hasna * Rhumatologie
Pr. KABBAJ Nawal Gastro-entérologie
Pr. KABIRI Meryem Pédiatrie
Pr. KARBOUBI Lamya Pédiatrie
Pr. L’KASSIMI Hachemi* Microbiologie
Pr. LAMSAOURI Jamal* Chimie Thérapeutique
Pr. MARMADE Lahcen Chirurgie Cardio-vasculaire
Pr. MESKINI Toufik Pédiatrie
Pr. MESSAOUDI Nezha * Hématologie biologique
Pr. MSSROURI Rahal Chirurgie Générale
Pr. NASSAR Ittimade Radiologie
Pr. OUKERRAJ Latifa Cardiologie
Pr. RHORFI Ismail Abderrahmani * Pneumo-phtisiologie
Pr. ZOUHAIR Said* Microbiologie
PROFESSEURS AGREGES :
Octobre 2010
Pr. ALILOU Mustapha Anesthésie réanimation
Pr. AMEZIANE Taoufiq* Médecine interne
Pr. BELAGUID Abdelaziz Physiologie
Pr. BOUAITY Brahim* ORL
Pr. CHADLI Mariama* Microbiologie
Pr. CHEMSI Mohamed* Médecine aéronautique
Pr. DAMI Abdellah* Biochimie chimie
Pr. DARBI Abdellatif* Radiologie
Pr. DENDANE Mohammed Anouar Chirurgie pédiatrique
Pr. EL HAFIDI Naima Pédiatrie
Pr. EL MAZOUZ Samir Chirurgie plastique et réparatrice
Pr. EL SAYEGH Hachem Urologie
Pr. ERRABIH Ikram Gastro entérologie
Pr. LAMALMI Najat Anatomie pathologique
Pr. LEZREK Mounir Ophtalmologie
Pr. MALIH Mohamed* Pédiatrie
Pr. MOSADIK Ahlam Anesthésie Réanimation
Pr. MOUJAHID Mountassir* Chirurgie générale
Pr. NAZIH Mouna* Hématologie
Pr. ZOUAIDIA Fouad Anatomie pathologique
Mai 2012
Pr. AMRANI Abdelouahed Chirurgie Pédiatrique Pr. ABOUELALAA Khalil* Anesthésie Réanimation
Pr. BELAIZI Mohamed* Psychiatrie
Pr. BENCHEBBA Driss* Traumatologie Orthopédique
Pr. DRISSI Mohamed* Anesthésie Réanimation
Pr. EL ALAOUI MHAMDI Mouna Chirurgie Générale Pr. EL KHATTABI Abdessadek* Médecine Interne Pr. EL OUAZZANI Hanane* Pneumophtisiologie
Pr. ER-RAJI Mounir Chirurgie Pédiatrique
Pr. JAHID Ahmed Anatomie pathologique
Pr. MEHSSANI Jamal* Psychiatrie
Pr. RAISSOUNI Maha* Cardiologie
Février 2013
Pr. AHID Samir Pharmacologie – Chimie
Pr. AIT EL CADI Mina Toxicologie
Pr. AMRANI HANCHI Laila Gastro-Entérologie
Pr. AMOUR Mourad Anesthésie Réanimation
Pr. AWAB Almahdi Anesthésie Réanimation
Pr. BELAYACHI Jihane Réanimation Médicale Pr. BELKHADIR Zakaria Houssain Anesthésie Réanimation
Pr. BENCHEKROUN Laila Biochimie-Chimie
Pr. BENKIRANE Souad Hématologie biologique Pr. BENNANA Ahmed* Informatique Pharmaceutique
Pr. BENSEFFAJ Nadia Immunologie
Pr. BENSGHIR Mustapha* Anesthésie Réanimation Pr. BENYAHIA Mohammed* Néphrologie
Pr. BOUATIA Mustapha Chimie Analytique
Pr. BOUABID Ahmed Salim* Traumatologie Orthopédie
Pr. BOUTARBOUCH Mahjouba Anatomie
Pr. CHAIB Ali* Cardiologie
Pr. DENDANE Tarek Réanimation Médicale
Pr. ECH-CHERIF EL KETTANI Mohamed Ali Anesthésie Réanimation Pr. ECH-CHERIF EL KETTANI Najwa Radiologie
Pr. ELFATEMI Nizare Neuro-Chirurgie
Pr. EL GUERROUJ Hasnae Médecine Nucléaire
Pr. EL HARTI Jaouad Chimie Thérapeutique
Pr. EL JOUDI Rachid* Toxicologie
Pr. EL KABABRI Maria Pédiatrie
Pr. EL KHANNOUSSI Basma Anatomie Pathologie
Pr. EL KHLOUFI Samir Anatomie
Pr. EL KORAICHI Alae Anesthésie Réanimation
Pr. EN-NOUALI Hassane* Radiologie
Pr. ERRGUIG Laila Physiologie
Pr. FIKRI Meryim Radiologie
Pr. GHANIMI Zineb Pédiatrie
Pr. GHFIR Imade Médecine Nucléaire
Pr. IMANE Zineb Pédiatrie
Pr. IRAQI Hind Endocrinologie et maladies métaboliques
Pr. KABBAJ Hakima Microbiologie
Pr. KADIRI Mohamed* Psychiatrie
Pr. LATIB Rachida Radiologie
Pr. MAAMAR Mouna Fatima Zahra Médecine Interne
Pr. MEDDAH Bouchra Pharmacologie
Pr. MELHAOUI Adyl Neuro-chirurgie
Pr. MRABTI Hind Oncologie Médicale
Pr. NEJJARI Rachid Pharmacognosie
Pr. OUBEJJA Houda Chirurgie Pédiatrique
Pr. OUKABLI Mohamed* Anatomie Pathologique
Pr. RAHALI Younes Pharmacie Galénique
Pr. RATBI Ilham Génétique
Pr. RAHMANI Mounia Neurologie
Pr. REDA Karim* Ophtalmologie
Pr. REGRAGUI Wafa Neurologie
Pr. RKAIN Hanan Physiologie
Pr. ROSTOM Samira Rhumatologie
Pr. ROUAS Lamiaa Anatomie Pathologique
Pr. ROUIBAA Fedoua* Gastro-Entérologie
Pr. SALIHOUN Mouna Gastro-Entérologie
Pr. SAYAH Rochde Chirurgie Cardio-Vasculaire
Pr. SEDDIK Hassan* Gastro-Entérologie
Pr. ZERHOUNI Hicham Chirurgie Pédiatrique
Pr. ZINE Ali* Traumatologie Orthopédie
Avril 2013
Pr. EL KHATIB Mohamed Karim* Stomatologie et Chirurgie Maxillo-faciale
Pr. GHOUNDALE Omar* Urologie
2- ENSEIGNANTS – CHERCHEURS SCIENTIFIQUES
PROFESSEURS / PRs. HABILITES
Pr. ABOUDRAR Saadia Physiologie
Pr. ALAMI OUHABI Naima Biochimie – chimie
Pr. ALAOUI KATIM Pharmacologie
Pr. ALAOUI SLIMANI Lalla Naïma Histologie-Embryologie
Pr. ANSAR M’hammed Chimie Organique et Pharmacie Chimique
Pr. BOUHOUCHE Ahmed Génétique Humaine
Pr. BOUKLOUZE Abdelaziz Applications Pharmaceutiques
Pr. BOURJOUANE Mohamed Microbiologie
Pr. BARKYOU Malika Histologie-Embryologie
Pr. CHAHED OUAZZANI Lalla Chadia Biochimie – chimie
Pr. DAKKA Taoufiq Physiologie
Pr. DRAOUI Mustapha Chimie Analytique
Pr. EL GUESSABI Lahcen Pharmacognosie
Pr. ETTAIB Abdelkader Zootechnie
Pr. FAOUZI Moulay El Abbes Pharmacologie
Pr. HAMZAOUI Laila Biophysique
Pr. HMAMOUCHI Mohamed Chimie Organique
Pr. IBRAHIMI Azeddine Biologie moléculaire
Pr. KHANFRI Jamal Eddine Biologie
Pr. OULAD BOUYAHYA IDRISSI Med Chimie Organique
Pr. REDHA Ahlam Chimie
Pr. TOUATI Driss Pharmacognosie
Pr. ZAHIDI Ahmed Pharmacologie
Pr. ZELLOU Amina Chimie Organique
Mise à jour le 09/01/2015 par le Service des Ressources Humaines
Liste des Abréviations
CBM : Chromoblastomycose
C. C: Cladosporium carrionii
CIE : Contre Immunoélectrophorèse
DID : Double Immunodiffusion
E.J: Exophiala jeanselmei
F. P: Fonsecaea pedrosoi
HMIM V : Hôpital Militaire d’Instruction Mohammed V
IDR : Tuberculin Intradermal Reaction ou test à la
tuberculine
Met Ag : Antigène Métabolique
P.V: Phialophora verrucosa
Som Ag : Antigène Somatique
Sommaire
I.
Introduction
...
1
II.
Observations...2
III.
Discussion...6
III.1. Définition...6
III.2. Agent pathogène...6
III.3. Epidémiologie générale...9
III.4. Physiopathologie...15
III.5. Facteurs de risque...21
III.6. Aspects cliniques
...
...
...22
III.7. Diagnostic biologique...35
III.8. Traitement…………...54
III.9. Prophylaxie...72
IV.
Conclusion…...73
Résumé
...
...
74
Références bibliographiques
...
...
...77
1
I. Introduction :
La chromomycose, ou chromoblastomycose ou encore maladie de LANE et PEDROSO [155],
est une dermatose verruqueuse et végétante due à différentes espèces de champignons appartenant au groupe des dématiés ou « champignons noirs »[98].
Les espèces responsables sont: Cladosporium carrionii, Fonsecaea pedrosoi, Fonsecaea
compacta, Phialophora verrucosa, Rhinocladiella aquaspersa [126, 146, 206, 61, 166]. Ce sont des
champignons filamenteux plus volontiers saprophytes des sols ou des matières organiques. Bien qu’ils soient ubiquitaires. La maladie se contracte surtout en région tropicale et subtropicale [126]. Elle affecte généralement les patients du milieu rural [121], surtout du sexe masculin et marchant pieds nus [126], la contamination ayant lieu par inoculation du germe, ce qui explique la localisation des lésions aux parties du corps soumises à d’éventuels traumatismes végétaux : les membres inferieurs. D’autres localisations sont cependant possibles [23, 35]
Les lésions cutanées de la chromomycose sont chroniques, polymorphes (nodulaires, verruqueuses, en plaques, ou cicatricielles), bien délimitées.
Elles peuvent cependant adopter d’autres aspects atypiques, posant des problèmes de diagnostic différentiel [146]. Une présentation clinique telle que celle de notre patiente, avec des aspects sporotrichoïdes associés à des lésions molluscoïdes ombiliquées et des lésions sous-cutanées, n’a jamais été rapporté à notre connaissance. Des formes diffuses et des formes généralisées et systémiques ont été décrites dans la littérature ; elles ont donné lieu à des explications variées.
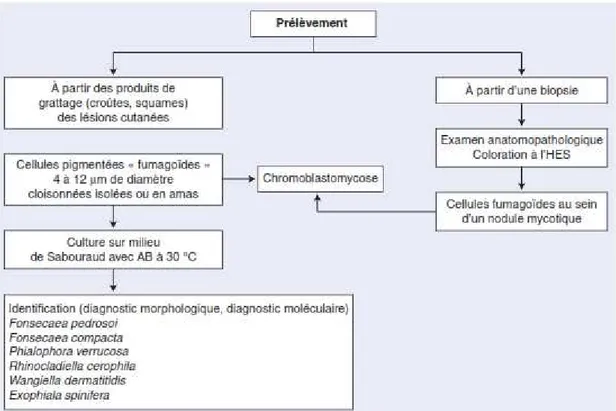
Le diagnostic clinique de la chromomycose est souvent difficile. Sa confirmation repose sur la présence des corps fumagoïdes dans la biopsie cutanée ou sur un frottis de la couche cornée. L’aspect histologique n’est pas spécifique lorsque les champignons ne sont pas visibles [98, 89,
150]
. Il est cependant évocateur en cas de présence d’une hyperplasie pseudo- épithéliomateuse de l’épiderme et de micro-abcès intra-épidermiques à neutrophiles. L’espèce précise est identifiée par la culture sur milieu Sabouraud.
La chronicité des lésions de chromomycose et leur résistance fréquente aux traitements médicamenteux sont bien connues. Pour ces raisons, le traitement de choix est généralement la chirurgie mais elle n’est possible qu’en cas de lésions localisées et de dimensions pas trop
2
grandes. En cas de lésions étendues et diffuses les antifongiques (5-fluorocytosine, itraconazole, la terbinafine) [197] utilisés par voie systémique et d’une façon prolongée en monothérapie ou en combinaison semblent offrir des meilleurs résultats mais au dépend d’un coût élevé et d’un risque d’effets indésirables (toxicité rénale et hépatique notamment). La rechute et les récidives restent fréquentes [123].
II. Observations :
Observation 1 :
Monsieur S. Driss, marocain de 70 ans, sans profession précise, habitant Salé, marié, père de
9 enfants, a été admis au service de dermatologie de l’HMIM
V, en
mai 1998 pour le diagnostic étiologique d’une lésion superficielle siégeant sur le membre supérieur droit.
Le début remonté à un an environ avec apparition au niveau de l’avant-bras droit, à quelques centimètres de coude, de pustules puis de nodules se ramollissant et confluant au fil des jours sans se fistuliser.
Puis, de la même manière était apparue une seconde lésion de l’autre côté de coude sur la partie inférieure du bras. Leur taille était d’environ 5cm sur 8 cm (figure1).
Dans ses antécédents médicaux on notait une lithiase vésiculaire révélée par une échographie. Dans ses antécédents familiaux, on retrouvait un frère diabétique non insulino-dépendant. Le bilan initial a comporté : une IDR tuberculinique, révélée positive, une radiographie pulmonaire, normale _ un hémogramme ayant montré une légère thrombopénie avec des plaquettes à 105.000/mm3 du sang.
Les diagnostics évoqués alors étaient : une tuberculose cutanée, une leishmaniose cutanée, une mycose sous-cutanée ou profonde.
Les prélèvements biopsiques pratiqués au niveau des lésions sont adressés à la fois aux services d’Anatomo-pathologie et de Parasitologie- Mycologie.
Le malade n’a malheureusement pas été adressé aux laboratoires ce jour là pour y subir un prélèvement des squames.
Au laboratoire de Parasitologie_ Mycologie, le prélèvement biopsique reçu a été exploité pour l’examen direct et la culture.les appositions étaient colorées selon des techniques diverses : Bleu de méthylène, Giemsa, MGG, Gram et les fragments écrasés entre deux lames étaient observés soit dans une goutte de potasse à 30% soit dans du lugol.
3
Dans tous les cas l’examen microscopique révèle des cellules fumagoïdes : éléments sphériques dont la taille et forme évoquent des hématies, le plus souvent munis d’un sillon de division (figure 2et3). Les techniques anatomopathologique sont très adaptées et offrent de meilleures images des cellules fumagoïdes (figure 4) : vésicules brun noir cuivré, plus ou moins septées, isolées ou en amas mûriformes.
Le diagnostic de chromomycose était posé. Les cultures pratiquées sur milieu de Sabouraud+Chloramphénicol et sur gélose au sang du cheval n’ont données aucune pousse. Quelques jours plus tard, le malade était adressé au service de Parasitologie-Mycologie pour un prélèvement de squames-croûtes au niveau des lésions.
L’examen microscopique de ce prélèvement montré entre lame et lamelle dans une goutte de potasse à 30% a également révélé la présence des cellules fumagoïdes (figure 5). La culture effectuée sur Sabouraud+Chloramphénicol et incubée à 29±2 a donné au bout d’une semaine, une colonie noirâtre s’étalant petit à petit, laissant apparaitre au centre un mycélium aérien gris. L’étude microscopique des fructifications présentées par ce champignon a permis de retrouver des phialides à collerette mesurant 3 à 6 µm et surmontées de conidies rondes. L’association des aspects macroscopiques des colonies et des aspects microscopiques a permis d’identifier Phialophora verrucosa (figure 6).
Le traitement par cryothérapie par l’azote liquide a été préconisé.
Figure1 : Lésion multinodulaire et verruqueuse de teinte rosée (photo service parasitologie à l’HMI-Mv)
Figure2 : Aspect de la cellule fumagoïde colorée au Gram et observée au grossissement (×100) à l’immersion à partir d’un éclatement (photo service parasitologie à l’HMI-Mv)
4
Figure3 : Amas de cellules fumagoïdes colorées au lugol sur un fragment biopsique écrasé entre lame et lamelle (×40) (photo service parasitologie à l’HMI-Mv)
Figure4 : Aspect général sur
coupe histologique coloré selon la
technique à l’HES: amas de cellules fumagoïdes entourées de polynucléaires neutrophiles et en périphérie les macrophages et les cellules géantes. C’est le nodule mycotique (×100 immersion) (photo service parasitologie à l’HMI-Mv)
Figure5 : Cellules fumagoïdes observées entre lame et lamelle dans une goutte de potasse à 30% (objectif ×40) au niveau des squames
surmontant les lésions (photo service parasitologie à l’HMI-Mv)
Figure6 : Aspect au microscope (×40) des fructifications de Phialophora verrucosa. Montage entre lame et lamelle dans le bleu lactique (photo service parasitologie à l’HMI-Mv)
5
Observation 2 :
M.B. El Houcine ; marocain de 41ans et travaillant dans un atelier de menuiserie à Rabat. Habitant à Salé, marié, père de 4 enfants était admis en consultation au service de Dermatologie en juillet 1998 pour le diagnostic étiologique d’une lésion érythémato-squameuse superficielle d’environ 1cm de diamètre, située sur la face postérieure du bras gauche et évoluant depuis 15 jours (figure 7). Le reste de l’examen clinique se limitait à un disidrose palmaire et plantaire avec un aspect d’une mycose des ongles des pieds et des espaces interorteils.
Dans les antécédents chirurgicaux du patient on retrouvait une intervention en 1995 sur le tendon de l’auriculaire droit.
Le diagnostic clinique évoqué était une leishmaniose cutanée qui n’a pas été confirmée par la Parasitologie. Nous avons pensé alors à la chromomycose lorsque le malade nous a répondu qu’il habitait à Salé, nous rappelant en cela la première observation. Il est vrai que cette fois, la lésion de chromomycose était suspectée précocement.
Nous avons procédé immédiatement à l’examen des squames dans la potasse à 30% et à leur culture dans les mêmes conditions que la première observation.
Les cellules fumagoïdes présentes dans les squames ont donné des colonies rattachées d’après leurs aspects macroscopique et microscopique à Phialophora verrucosa.
Le traitement préconisé a été l’ablation chirurgicale de la lésion qui a été pratiquée quelques jours plus tard.
La pièce d’exérèse a été adressée aux services d’Anatomo-pathologie et de Parasitologie - Mycologie selon les recommandations habituelles.
L’examen direct a révélé des amas des cellules fumagoïdes infiltrant les différents étages de lésions. L’histologie a confirmé le diagnostic de chromomycose.
Figure7 : lésion débutante : papules érythémateuse surmontée d’une squame-coûte
6
III. Discussion :
III.1.Définition :
La Chromomycose est une dermatose verruqueuse d’évolution chronique, habituellement sans tendance à la dissémination, sévissant essentiellement dans les régions tropicales et subtropicales. Madagascar est le foyer francophone le plus touché [34, 36].
Elle est due au développement dans les tissus sous-cutanés de champignons noirs (dématiés) suite à une blessure avec souillure tellurique ou par l'introduction accidentelle d'un végétal (écharde) [33].
Le diagnostic immédiat repose sur la mise en évidence des cellules fumagoïdes (formes parasitaires du champignon inoculé) objectivées dans les prélèvements cutanés superficiels ou à partir d’un examen anatomopathologique.
Le traitement est long et difficile, souvent peu accessible pour les populations touchées et les rechutes sont fréquentes [36].
III.2.Agent pathogène :
Les agents étiologiques responsables de la chromoblastomycose appartiennent au règne des
Eumycotina (champignons vrais), à la division des « Fungi imperfecti » ou « champignons
imparfaits » car la reproduction sexuée n’est pas connue ou généralement absente.
Ils sont rassemblés dans le phylum des Deuteromycotina, dans la classe des Hyphomycètes (mycélium septé), dans l’ordre des Moniliales et dans la famille des Herpotrichiellaceae ou des Dematiaceae (mycélium mélanisé) selon les auteurs [139].
La couleur foncée de ces champignons est due à un pigment dérivé de la mélanine, la dihydroxynaphtalène mélanine. La production de ces pigments semble contribuer à la pathogénicité des champignons [161]. Il a été démontré que la mélanine de Fonsecaea pedrosi est une structure fongique immunologiquement active qui stimule les réponses humorales et cellulaires [60].
Ce sont des champignons dimorphiques présentant deux morphologies différentes selon leur développement :
7
a) Cellule fumagoïde : (forme parasitaire caractéristique retrouvée au niveau
sous-cutané)
Les cellules fumagoïdes, ou corps de Medlar, ou cellules sclérotiques, représentent la forme parasitaire des agents de chromoblastomycose. Cette Forme est retrouvée in vivo dans les lésions des patients et dans certains végétaux. Ces cellules (figure 8) sont caractéristiques de la chromoblastomycose. Elles sont arrondies à paroi épaisse, brune, mesurant 4 à 12 µm de diamètre, entourées d’une membrane à double contour. Elles sont groupées ou isolées, parfois dotées d’un septum médian. Elles se reproduisent par division plutôt que par bourgeonnement. Lors de la multiplication, les cellules s’allongent et produisent la première cloison à travers le plus petit diamètre puis se séparent. Des divisions cellulaires dans d’autres plans précèdent souvent la séparation des cellules, ce qui conduit à une forme pluricellulaire transitoire. La séparation des cellules divisées crée généralement des grappes de trois ou quatre cellules.
Figure8 : cellule fumagoïde retrouvée après grattage superficiel d’une lésion squameuse et éclaircissement dans de la potasse à 30% (x1000)[67].
8
b) une forme mycélienne, colorée en brun ou noir lors de la mise en culture,
d’où le nom « champignons noirs » ou « dématiés » qui leur est aussi donné. Actuellement six espèces fongiques appartenant à cinq genres différents aux télomorphes souvent inconnus sont responsables des lésions de chromomycose [87, 92, 93].la biologie moléculaire permet de confirmer certains regroupements taxonomiques [102, 101].
_Fonsecaea pedrosoi (Brumpt, Negroni 1986)
-Cladophialophora (Cladosporium) carrionii (Trejos 1954)
- Phialophora verrucosa [americana] (Medlar 1915) - Fonsecaea compacta(Carrion1940)
- Rhinocladiella (Acrotheca) aquaspersa (Borelli 1972)
- Exophiala spinifera (McGinnis 1977) [65] : agent classique de chromomycose, est à l’origine d’une vingtaine de cas de phaeohyphomycoses cutanées ou systémiques, principalement chez des patients immunodéprimés (transplantation d’organes) [37].
Chaetomium funicola, a été signalée en 2007 à partir de l'ouest du Panama comme un seul
rapport de cas [157].
Autres espèces récemment décrites dans la chromomycose comprennent Fonsecaea nubica
[141]
Fonsecaea monophora [193, 49] et Phialophora richardsiae [190]. Dans la littérature des cas bien documentés d'infections fongiques sont signalés. Ils sont dûs à
Aureobasidium pullulans chez un patient après une greffe du foie [170] et Rhytidhysteron sp chez un patient suivant une greffe de rein en Inde [42].
Exophiala dermatitidis ou Wangiella dermatitidis, agent classique de chromomycose, est de
plus en plus incriminé dans des atteintes superficielles (post-traumatiques) ou profondes (cérébrales, cardiaques et pulmonaires) [158].
Cladosporium yegresii est une espèce nouvellement introduite, similaire à C carrionii, qui
9
Les rapports rares ou isolées de la maladie causée par Botryomyces caespitosus,
Cladophialophora arxii, Cladophialophora boppii et Dermatioides phaeosclera ont été
publiés [110, 10, 157].
En outre, dans le Centraalbureau voor Schimmelcultures (CBS) : le bureau central des cultures fongiques (Centre hollandais de la biodiversité), une souche de Catenulostroma
chromoblastomycosum est déposée avec l’information qu'il est le cas de CBM du Zaïre [46] (actuellement République démocratique du Congo). Cependant, aucune description clinique fiable n’existe que si la biopsie a été effectuée et si les caractéristiques de CBM ont été identifiées [26].
Certains auteurs se réfèrent également à Sporothrix schenckii var. luriei en tant qu'agent étiologique [148].
III.3.Epidémiologie générale :
III.3.1.Données historiques :
La chromoblastomycose a été noté pour la première fois au Brésil à Sao Paulo en 1911 par Pedroso de Moraes [28, 47] ; Pedroso a étudié des cas avec des lésions dermiques, nodulaires et ulcéreuses au pied et au tibia. Il l’a nommé blastomycose negra. Toutefois Pedroso and Jose Maria Gomes ont publié leurs observations plus tard en 1922[154]. Entre-temps en 1914, Max Rudolph, un physicien allemand vivant en Brazil, a décris six cas de la maladie laquelle il l’a nommé figueira (fig tree). En outre, il a été capable d’isoler les champignons dématiés d’après 4 cas, lesquels il a accrédité qu’il est reconnu comme appartenir à la variété de Blastomycètes. Il l’a mené à infecter des rats blancs et des singes par ce champignon. La description de cette maladie et les inventions mycologiques reportées par Rudolph indiquent qu’il a été le même champignon que Pedroso a été découvert quelques années plus tôt [32, 178]. Une année plus tard, en 1915, Medlar [131] et Lane [113] ont publié aux Etats-Unis un cas d’un patient du Boston qui a souffert d’une maladie causée par un champignon de type inconnu.
Ils trouvent des lésions pouvant être blastomycotiques.
Les lésions ont inclus un nombre de cellules parasitaires sphériques et pigmentées (corps de Medlar) [153]. A cette époque, le champignon isolé a été appelé Phialophora verrucosa [59].
10
En 1922, Brumpt [48] a démontré qu’il n’a pas été Phialophora verrucosa qui a causée l’infection dans le cas décrit par Pedroso, mais un différent champignon qu’il a nommé
Hormodendrum pedrosoi. En 1923, Fonseca et Leao a decrit une différente méthode de
sporulation de ce champignon, qu’il le lié avec le genre Acrothec (reclassification des espèces pour le genre Acrotheca Pedrosoi) [153].
Terra Et al ont défini cette pathologie en 1922 comme une dermatose verruqueuse causée par des champignons pigmentés [199]. Ils ont utilisé le terme « chromoblastomycose » en premier temps [200 (cité par) 134]. Le premier cas en dehors de continent Américain est décrit à l’institut pasteur en Algérie en 1927, et quelques années plus tard des séries de 129 cas, documentés durant 4 ans ont été publiés à Madagascar [130].
En 1935, une autre méthode de sporulation a été décrite pour Acrotheca (Hormodendrum)
pedrosoi. Dans cette méthode les spores ont été créées dans des phialides qui ont relié le
champignon au genre Phialophora décrit par Medlar (le nom de Phialophora pedrosoi a été suggéré).
En 1935_ 1936, Carrion à Puerto Rico a décrit le troisième agent étiologique de CBM :
Hormodendrum compacta [202]ouHormodendrum compactum [28,47].
En 1936, Pablo Negroni a proposé un nom générique « Fonsecaea », qui a été accepté comme correcte. Il a été utilisé jusqu’à présent. [202].
En 1937, Connant a isolé Phialophora verrucosa (un des agents pathogènes responsables de cette maladie) du sol et a constaté sa nature saprophyte [130].
En 1950, une autre espèce fongique a été ajoutée aux agents étiologiques de CBM, nommée
Cladosporium (actuellement Cladophialophora) carrionii. Il a été décrit en premier temps par
Trejos en 1954.
. Il a résolu le problème de décrire un nombre croissant des espèces classées dans le genre
Cladosporium, qui sont responsables des cas de CBM [202].
Les études de la similarité et des agents étiologiques de CBM sont encore continuées.
En 2004, des scientifiques de l’université de Chiba au Japon ont trouvés qu’il n’y a pas de différence dans les sous-unités ribosomiales de la séquence de l’ADN domaine D1/D2 entre
11
F. pedrosoi et F. compacta, ce qui peut indiquer que la dernière est simplement une variété
morphologique de la première [1].
Dans la même année, Sybren de Hoog et al ont reclassé monophora botryoides sp.
Il a été déposé dans la collection de culture CBS 269,37 dans le nouveau genre Fonseca, et ainsi, une nouvelle espèce a été créée : Fonsecaea monophora, morphologiquement très similaire à F. pedrosoi. Actuellement, le diagnostic standard ne fait pas de distinction entre ces espèces rétrécissant le diagnostic du complexe F. pedrosoi / monophora [54].
En 2005, le genre Fonsecaea a été examiné, et Fonsecaea monophora a été décrite à partir de l'analyse moléculaire des isolats, la plupart d'eux sont originalement identifiés comme
Fonsecaea pedrosoi. Plus récemment, une nouvelle espèce a été décrite similaire aux derniers,
Fonsecaea nubica [216].
Tableau n°1: Noms synonymes des agents étiologiques de chromoblastomycose [153]
Synonymes de Fonsecaea pedrosoi (Brumpt) Negroni 1936 Hormodendrum pedrosoi Brumpt 1922
Acrotheca pedrosoi (Brumpt) Fonseca & Leào 1923 Trichosporum pedrosianum (Brumpt) M. Ota 1927 Trichosporum pedrosoi (Brumpt) Brumpt 1927 Gomphinaria pedrosoi (Brumpt) C.W. Dodge 1935 Hormodendroides pedrosoi (Brumpt) M. Moore & F.P.
Almeida 1936
Phialophora pedrosoi (Brumpt) Redaelli & Cif. 1941 Carrionia pedrosoi (Brumpt) Bric.-Irag. 1942
Rhinocladiella pedrosoi (Brumpt) Schol-Schwarz 1968
Synonymes de Fonsecaea compacta (Carrion) Carrion 1940 Hormodendrum compactum Carrion 1935
Phialoconidiophora compacta (Carrion) M. Moore & F.P.
Almeida 1936
Phialophora compacta (Carrion) Redaelli & Cif. 1942 Rhinocladiella compacta (Carrion) Schol-Schwarz 1968 Synonymes de Cladophialophora carrionii (Trejos) de Hoog, Kwon-Chung & McGinnis 1995
12
III.3.2.Répartition géographique :
La maladie est fréquente dans le monde. Néanmoins la plupart des cas sont rapportés des zones humides à climat tropical et subtropical en Amérique, l’Asie et l’Afrique. Les taux de prévalence les plus élevés sont rapportés du Mexique (Oaxaca and Veracruz) [18], Cuba [55],
Venezuela [156], la république dominicaine, la Colombie [172], Brésil (principalement dans la région de l’Amazone) [134, 124, 186] et Costa Rica [176] (figure 9).
Le premier cas de CBM en dehors du continent américain a été rapporté à l’institut Pasteur en Algérie en 1927[137]. En Afrique la plupart des cas [153], localisés aux zones centrales et aux sud du continent [134,63], ont été rapportés à Madagascar (1955-1994, 1323 cas) [63], Rwanda, Cameron, Nigeria, Zambie, Botswana [134,63] et en Afrique de sud [153].
La prévalence da la maladie au Gabon est de 1/12500 habitants voisine de celle de Costa Rica mais quatre fois plus faible qu’à Madagascar [105].
Dans une étude de 1343 cas de la maladie en plus de 40 ans dans ce pays(Madagascar), la prévalence de 1 cas /1920 habitants dans la région du désert méridional a été décrie, avec une
prévalence incroyable, 1sur 910 dans un seul quartier de cette région [56].
13
En Asie CBM est plus fréquemment rapporté au Japon [78], Sri Lanka [7], Malaisie [176] et l’Inde [187]. De plus, la maladie est assez commune à la chine, notamment dans les provinces de Shandong et Henan. Le premier cas a été rapporté en 1958.
Depuis ce temps en plus de 500 cas de 20 provinces ont été rapportés [216]. Au Japon environ 10 cas sont rapportés annuellement. Le taux d’occurrence des espèces individuelles dans les deux dernières décennies du 20 ème siècle était le suivante :
_ F. pedrosoi – 71%,
_ E. jeanselmei – 20%,
_ Phialophora verrucosa 4.5%, _ Exophiala dermatitidis 2% [108].
Pas de beaucoup de cas ont été rapports en Australie, ils sont surtout causés par
Cladophialophora carrionii [117, 183].
En un climat tempéré, par exemple, en Europe, CBM est rare et est plutôt une maladie non-endogène.
En 1928, à Leningrad, Tschernjawski a identifié la CBM chez une femme polonaise qui a plus probablement développé l’infection après une chute de cheval près de Vilnius.
Il était sans doute le premier cas décrit de CBM en Europe. Le champignon isolé a été classé en Hormodendrum rossicum sp, qui ultérieurement devient un synonyme de F. pedrosoi
[203]
. En 1938, 14 cas de CBM ont été rapportés à la Russie. Cependant chacun d'entre eux ont eu lieu dans la région asiatique du pays [195]. En Europe, des cas indigènes ont été rapportés à la Finlande [189].
En outre, en ancienne Tchécoslovaquie [40-147] et en Allemagne [104], des cas de la maladie ont été rapportés. Au royaume uni, les premiers cas décrits ont été liés aux immigrants de la Jamaïque et Sri Lanka [195]. Le premier cas de CBM en Pologne a été rapporté en 1972 à Przegląd Dermatologiczny [109]. Jusqu’à présent 4 cas documentés de la maladie en Pologne
ont été connus [159].
Actuellement, les études sur la corrélation entre la distribution géographique du champignon espèces/variétés responsable de CBM et les formes de l’infection sont poursuivies.
14
Les différences entre les espèces qui sont les agents de CBM ont été observés. En fonction de la région, F. pedrosoi est lié aux zones humides de climat tropical et subtropical, alors que C.
carrionii est dominant dans un climat semi-aride [18, 156, 186, 117,8].
Ceci est particulièrement visible à Madagascar où dans la zone de forêt tropicale humide au nord de l'île, F. pedrosoi est fréquente, bien qu’au sud de l’île avec le difficile climat désertique, Cladophialophora carrionii est plus commun [63, 64].
Au Nord de la Chine C. carrionii est dominant alors qu’au Sud F. monophora est fréquent
[216]
.
En basant sur les régions espaceurs transcrits internes (ITS) de l'analyse de l'ADN fongique, le genre Fonsecaea a été divisé en trois groupes ; groupe A – F. pedrosoi, groupe B – F.
Monophora and groupe C – différentes espèces du genre Fonsecaea [140].
Les études ultérieures de Yaguchi et al [217] et Xi et al. [216] ont abouti à la division du groupe de F. Pedrosoi en sous groupes : A1et A2 et le groupe de F. Monophora en sous groupes : B1, B2 et B3. Il a été trouvé que les sous groupes individuels ont eu lieu dans des différentes parties du monde. Il peut être considérable dû à la relation des agents étiologiques et la distribution géographique avec la forme de CBM. Il a été constaté que dedans du genre
Fonsecaea le sous-groupe A1 se produit en Thaïlande, Australie, Amérique du Sud, Afrique,
Sud et Est de la Chine; le sous-groupe A2 en Amérique centrale et du Sud; le sous-groupe de B1 en Amérique centrale et du Sud, et le Sud de la Chine; le sous-groupe B2 en Amérique centrale, le Japon et la Chine de l'Est. Enfin, le sous-groupe B3 se produit aux Etats-Unis, le Royaume-Uni et de la Chine du Sud [116, 117]. Dans l'étude sur les isolats de Corée du Sud, une forte différenciation a été observée : des souches de F. pedrosoi sont similaires aux souches rapportées dans le Sud et l’Est de la Chine, deux groupes de F. monophora sont similaires aux souches du Sud et de l’Est de la Chine et du Japon. En outre, une souche identique à celle au Costa Rica a été identifiée et une souche similaire à des souches thaïlandaises a été isolée à partir d'un immigrant (ce qui signifie que l'infection avait développé plus tôt en Thaïlande)
[118]
. F.compacta est observée dans l’Amérique latine, en Asie et dans les rares cas Européens tandis que P. verrucosa est plus localisé en Amérique et en Asie notamment en Japon et R.
15
aquaspersa est uniquement sur le continent américain [128, 185]. La figure 9 montre une forte
prévalence de CBM [142].
La chromoblastomycose est inhabituel chez les enfants et les adolescents. Sauf au Japon, les hommes contractent la maladie beaucoup plus fréquemment que les femmes, réfléchissant l’importance de l’exposition professionnelle. Les hommes ont une supérieure opportunité pour contacter le sol et une prédisposition de blesser pendant qu’ils travaillent dans les champs. La majorité est âgée de 30 à 50 ans. La rareté de la maladie chez les enfants exposés aux mêmes conditions environnementales que les adultes suggère une longue période de latence [56].
III.4.Physiopathologie :
III.4.A. Source d’infection :
La découverte des habitats naturels du champignon et la source de l’infection parasitaire fongique pour l’homme est fondamental pour comprendre le développement de la
pathogénicité dans ces organismes [142]. Les champignons responsables de la CBM sont trouvés à l’environnement dans le monde et sont partis d’un microbiote qui décompose la matière organique au sol et en eau. Ils apparaissent également dans les plantes[124, 179].
Conant fut le premier à isoler Phialophora verrucosa du sol en 1937, prouvant ainsi la nature de ces champignons saprophytes. En Japon, P. verrucosa (n=17) et F. pedrosoi
(n=1) sont isolés principalement du bois pourri. La plupart des souches saprophytes étaient
capables d'induire l'infection chez des animaux de laboratoire [96].
Fonsecaea pedrosoi a été isolée des épines de Mimosa pudica à l’endroit indiqué par le
patient avec CBM où l’infection a probablement survenu. Néanmoins Fonsecaea pedrosoi n’a pas été isolée des épines de la plante dans des localisations différentes, qui suggère le “réservoir-type” d’infection [179]. Rubin et al ont décrit un incident bien documenté d’une blessure causée par une branche de l’arbre. F. pedrosoi a été isolée des deux la plante et la lésion [177].
Gezuele et al. Ont rapporté une proportion relativement élevé (approximativement 20%) des
16
plantes, sols et différents matériels, en employant la méthode d’inoculation mince et la reproduction directe. Sur les 64 échantillons de parties mortes des arbres et des troncs de palmiers, 32 contenaient un ou l'autre des espèces fongiques ci-dessus.
De 11% des échantillons de sol qui contenaient le plus souvent des débris végétaux, des espèces pathogènes sont isolées. Les scientifiques indiquent la discordance entre l’isolation des agents étiologiques de CBM de l’environnement et une occurrence relativement rare de CBM à l’Uruguay [81].Vicente et al ont étudié l’aspect de la levure noire au lieu de résidence des patients présentant des symptômes cliniques de CBM à Paraná, Brésil.
Ils trouvent que les souches isolées de l’environnement diffèrent des agents étioliques communs de CBM. La levure noire a appartenu au même ordre, mais ils ont constitué des espèces séparées inconnues. (Ils ne sont pas parvenus à isoler Fonsecaea pedrosoi de 56 emplacements étudiés [212].
III.4.B. Relation hôtes - champignons :
Pathomorphologie :
L'infection est acquise par l'inoculation accidentelle de l'agent étiologique dans les tissus sous-cutanés du sujet en pénétrant des aubépines ou des épines des plantes diverses [134]. Peu de patients rappellent les antécédents de traumatisme ou de blessures dans la zone affectée ou encore ont été blessés tant de fois à travers l'exposition professionnelle à rendre les incidences spécifiques impossibles à rappeler. Une fois intégré dans le tissu, le champignon se transforme d'une forme filamenteuse au stade parasitaire caractéristique de la maladie connue sous le nom de cellules fumagoïdes ou organismes muriformes. La cellule fumagoïde n’est pas une forme de dissémination (pas de transmission directe d la maladie) mais il s’agit d’une forme de résistance.
On peut l’obtenir et l’entretenir in vitro sur milieu de Francis au sang de cheval incubé à 37°. L’existence de cette forme permet de classer les agents de la chromomycose parmi les champignons dimorphiques [90, 91, 103, 145]. Des essais in vitro ont montré que la conversion prend environ 6 jours [88]. L’étude de la transformation in vitro de la forme filamenteuse saprophytique en forme tissulaire fumagoïde a été réalisée avec F.pedrosoi et C.carrionii et a montré l’importance du pH et de la température [92, 93] avec notamment la synthèse des
17
protéines de choc thermique dites HSP [65]. Cependant le délai pour ce dimorphisme de se produire chez des sujets humains n'a pas été étayée.
Les cellules fumagoïdes matures se développent des cloisons parallèles et perpendiculaires, en provoquant la fragmentation de la structure.
De chaque fragment une nouvelle cellule fumagoïdes mature est formée. Les cellules phagocytaires professionnelles (macrophages et polynucléaires) sont incapables de détruire ces formes parasitaires [176].
La réponse tissulaire à CBM est non spécifique et peut être similaire à la réponse en mycoses profondes. Les principaux changements observés dans le domaine de l'épiderme et de l'épiderme kératinisé sont hyperkératose et hyperplasie pseudoépithéliomateuse. Quelques microulcerations avec des mycoses peuvent être trouvés [208]. Les cellules muriformes typiques (organismes de Medlar) sont habituellement observées dans l'épiderme, mais ils peuvent se transformer en formes filamenteuses, en particulier dans les croûtes couvrant les lésions [114]. Les cellules muriformes peuvent se diviser et se multiplier en formant des cloisons (cloisonnement). Cependant, elles ne bourgeonnent jamais, ce qui les distingue des formes trouvées dans la blastomycose [4]. Dans les tissus cutanés et sous-cutanés, des infiltrations diffuses non spécifiques, sont observées.
Les foyers de cellules polymorphonucléaires et des micro-abcès sont vus dans les deux l'épiderme et le derme. Dans le derme, les granulomes qui comprennent des cellules géantes multinucléées et des cellules épithélioïdes sont présents, avec des quantités variables de la fibrose.
La fibrose est augmentée dans les lésions plus anciennes et peut prolonger dans le tissu sous-cutané, bien que la maladie se prolonge rarement en profondeur dans le tissu sous-cutané. La caractéristique de chromoblastomycose, les cellules muriformes appelé aussi sclérosée, penny de cuivre, ou des organismes de Medlar peut être trouvé dans les macrophages intracellulaire ou extracellulaire dans les abcès.
Ce sont des cellules arrondies de pigmentation foncée (brun-or), à paroi épaisse, de 4 à 12um de diamètre, avec des parois transversales en une ou deux plans (figure 9). Les hyphes peuvent aussi parfois être vus, généralement dans l'épiderme. La réponse de l'hôte à ces
18
structures se traduit par un processus appelé élimination transépithéliale, dans lequel les champignons et les tissus endommagés sont expulsés à travers l'épiderme, un processus similaire à celui observé dans le calcinose cutanée [12].
Immunologie de l'infection :
Il est encore inconnu, quelle forme de champignon (les hyphes, les spores ou les organismes sclérosés) est la forme invasive [180]. Sur la surface des épines de Mimosa pudica, la présence d'hyphes et des spores de F. pedrosoi a été détectée. Toutefois, les organismes sclérosés, similaires à ceux observés dans les tissus de patients ont été trouvés à l'intérieur des épines
[179]
. La préparation d'un milieu spécial, qui induit la production de corps sclérosées permis d'effectuer des études à diverses formes de mycélium [50]. Les neutrophiles et les macrophages sont des cellules cruciales dans la réponse immunologique chez CBM. Une réaction typique de granulation, réglementé par polynucléaires neutrophiles est observée chez les patients [208].
La première ligne de défense est des cellules dendritiques. Macrophages dermiques ont été montrés à présenter les antigènes fongiques dans leur cytoplasme. Propriétés similaires ont été trouvées dans des dendrocytes dermiques et dans les cellules de Langerhans [191].
Chez les patients avec CBM ces cellules présentent une expression accrue des récepteurs CD 86, HLA-DR et CD 83. En réponse aux spores, des cellules dendritiques produisent TNF-α, IL-10 et IL-12. Après stimulation antigénique de pedrosoi F., chez les patients atteints d'une forme sévère de CBM, les cellules dendritiques produisent de grandes quantités d'IL-10 et de petites quantités d'IFN-γ [129].
Populations de lymphocytes T CD4 et CD8, les lymphocytes B et les macrophages jouent un rôle important dans la réponse à médiation cellulaire [191].Du thymus des souris privées infectant entraîné le développement des lésions caractéristiques de CBM, alors que chez les souris privées de cellules NK et les macrophages et chez les souris en bonne santé, les lésions récupérés 4-6 semaines après l’infection [3].
Un grand nombre de cellules sclérosées ont été trouvés dans les lésions. L’hypersensibilité retardée et des anticorps contre les antigènes de F. pedrosoi ont été détectés. Lymphocytes influencent la réponse immunitaire chez CBM, qui a été confirmé par le fait que le transfert de lymphocytes de souris saines a entraîné un rétablissement complet dans les 2 mois [3].
![Figure 9 : Distribution géographique de la chromoblastomycose [142]](https://thumb-eu.123doks.com/thumbv2/123doknet/15041270.691730/46.892.108.793.143.536/figure-distribution-géographique-de-la-chromoblastomycose.webp)
![Figure 11: les cinq types de lésions de chromoblastomycoses, selon Carrion, 1950. (A) nodulaire, (B) tumorale, (C) cicatricielle, (D) plaque et (E) verruqueuse Telles et al, 2009) [164]](https://thumb-eu.123doks.com/thumbv2/123doknet/15041270.691730/58.892.108.790.524.831/figure-lésions-chromoblastomycoses-carrion-nodulaire-tumorale-cicatricielle-verruqueuse.webp)
![Figure 12 : Les lésions de chromoblastomycose montrant différents degrés de gravité. (A) Des lésions bénignes, (B) des lésions modérées, et (c) de graves lésions [164]](https://thumb-eu.123doks.com/thumbv2/123doknet/15041270.691730/59.892.115.791.106.423/lésions-chromoblastomycose-montrant-gravité-lésions-bénignes-lésions-modérées.webp)
![Figure 14 : Lésions de bras [43]](https://thumb-eu.123doks.com/thumbv2/123doknet/15041270.691730/60.892.312.640.592.938/figure-lésions-de-bras.webp)
![Tableau 2 : Cas de transformation néoplasique d’une lésion de chromomycose publiés dans la littérature [72] Sexe/âge Evoluti on (ans) Localisation Plus grand diamètre (cm) Particularité/ traitement Espèce fongique probable Evolution (Réf.) Anné](https://thumb-eu.123doks.com/thumbv2/123doknet/15041270.691730/67.892.47.852.208.826/transformation-néoplasique-chromomycose-littérature-localisation-particularité-traitement-evolution.webp)
![Figure 22: Tumeurs Noir pigmentée de la peau en fleur sur le moignon d'amputation de l'index gauche [97]](https://thumb-eu.123doks.com/thumbv2/123doknet/15041270.691730/68.892.193.694.100.471/figure-tumeurs-noir-pigmentée-fleur-moignon-amputation-gauche.webp)
![Figure 27 : Fonsecaea pedrosoi : aspect en culture montrant les formes denticulées caractéristiques (X400) [65]](https://thumb-eu.123doks.com/thumbv2/123doknet/15041270.691730/75.892.103.780.161.659/figure-fonsecaea-pedrosoi-aspect-culture-montrant-denticulées-caractéristiques.webp)
![Figure 33 : sporulation de type Rhinocladiella [66]](https://thumb-eu.123doks.com/thumbv2/123doknet/15041270.691730/77.892.328.570.105.390/figure-sporulation-type-rhinocladiella.webp)
![Figure 34 : Cellules fumagoïdes à l’intérieur de cellules géantes, coloration à safran (×400) [65]](https://thumb-eu.123doks.com/thumbv2/123doknet/15041270.691730/80.892.268.601.105.372/figure-cellules-fumagoïdes-intérieur-cellules-géantes-coloration-safran.webp)