Régulation du cotransporteur K
+-Cl
-de type 4 (KCC4)
par la WNK lysine deficient protein kinase 4 (WNK4)
Thèse
Rachelle Frenette-Cotton
Doctorat en médecine expérimentale
Philosophiæ Doctor (Ph. D.)
Québec, Canada
Régulation du cotransporteur K
+-Cl
-de type 4 (KCC4)
par la WNK lysine deficient protein kinase 4 (WNK4)
Thèse
Rachelle Frenette-Cotton
Sous la direction de :
Résumé
Cette thèse de doctorat porte sur la régulation du cotransporteur K+-Cl- de type 4 (KCC4) par la « WNK lysine deficient protein kinase 4 » (WNK4), une sérine-thréonine kinase qui a été découverte en 2001. Le cotransporteur KCC4 fait partie de la famille des cotransporteurs cation-Cl- (CCC) qui compte neuf membres. Le cotransporteur KCC4, et les autres isoformes de type KCC, sont des protéines de surface qui couplent l’efflux du Cl -à celui du K+ de manière électroneutre. Ce faisant, ils régulent le Cl- intracellulaire (Cl-i), le volume cellulaire (Vi) et la réabsorption basolatérale du Cl- dans les épithélia. Bien qu’ils soient activés par une augmentation du Cl-i et du Vi, les intermédiaires signalétiques impliqués demeurent mal caractérisés à ce jour. À cet effet, WNK4 pourrait correspondre à l’un de ces intermédiaires puisqu’elle régule plusieurs systèmes de transport, dont les KCC. Les objectifs de cette thèse étaient donc de déterminer si WNK4 régule l’activité de KCC4 suite à des changements de Vi et de Cl-i, et si c’est le cas, par quels mécanismes. Pour répondre à ces objectifs, nous avons adopté une approche structure-fonction par laquelle des mutations ont été introduites dans les protéines KCC4 ou WNK4. L’effet de ces mutations a été analysé dans le système d’expression hétérologue des ovocytes de Xenopus
laevis grâce à des études fonctionnelles, d’expression de surface, d’immunofluorescence et
de phosphorylation. Nos travaux ont permis de montrer pour la première fois que WNK4 et PP1 sont bel et bien impliquées dans la régulation de KCC4 suite à une augmentation du Vi, mais que contrairement à des hypothèses avancées antérieurement, PP1 agirait en aval plutôt qu’en amont de WNK4, et qu’elle agirait aussi sur KCC4 par l’intermédiaire d’autres intervenants signalétiques. Nous avons aussi identifié deux résidus dans le domaine C-terminal de KCC4 qui soutiennent l’effet de WNK4 et de PP1. En somme, ces travaux pourraient permettre d’identifier de nouvelles voies de signalisation impliquées dans la régulation de KCC4 par WNK4 et PP1 et, par conséquent, d’offrir d’autres cibles thérapeutiques pour traiter des désordres électrolytiques.
Abstract
This Ph.D. thesis focuses on the regulation of K+-Cl- cotransporter type 4 (KCC4) by WNK lysine deficient protein kinase 4 (WNK4), a serine threonine kinase that was discovered in 2001. The cotransporter KCC4 belongs to the cation-Cl- cotransporter (CCC) family that includes nine members. This transporter, along with the three other KCC isoforms, corresponds to cell surface proteins that couple elctroneutral efflux of Cl- with that of K+. In doing so, KCC family members regulate intracellular Cl- (Cl-i), cell volume (Vi) and basolateral reabsorption of Cl- across a variety of epithelia. Although they are activated by an increase in Cl-i and Vi, the signaling intermediates involved remain largely unknown to date. In this regard, WNK4 could correspond to one such intermediate given that it regulates several transport systems including KCC. On the basis of these premises, the main objectives of this thesis were to determine whether WNK4 regulates KCC4 activity during changes in Cl
-i and Vi and if so, through which mechanisms. To address these objectives, I exploited a structure-function approach in which mutations were introduced in both KCC4 or WNK4 and in which the effect of such mutations were analyzed in the
Xenopus laevis expression system through functional, expression, immunofluorescence
studies and phosphorylation. My studies allowed to show for the first time that WNK4 et PP1 are indeed involved in KCC4 regulation during an increase in Vi, but that in contrast to previous assumptions, PP1 would act downstream instead of upstream of WNK4, and that it would also act on KCC4 through additional signaling intermediates. Lastly, we have identified two residues in the C-terminus of KCC4 that mediate the effect of WNK4 and PP1. Taken together, these results could help identifying new signaling pathways of KCC4 regulation by WNK4 and PP1, and thus offer other therapeutic targets to treat electrolyte disorders.
Table des matières
Résumé ... iii
Abstract ... iv
Table des matières ... v
Liste des tableaux ... viii
Liste des figures ... ix
Liste des abréviations ... xi
Remerciements ... xiii
Avant-propos ... xiv
Chapitre 1 : INTRODUCTION ... 1
1.1 Généralités sur le transport membranaire ... 1
1.2 Les cotransporteurs cation-Cl- (CCC) ... 4
1.2.1 Généralités ... 4 1.3 Les cotransporteurs K+-Cl- (KCC) ... 8 1.3.1 Généralités ... 8 1.4 Le KCC4 ... 10 1.4.1 Découverte ... 10 1.4.2 Caractéristiques fonctionnelles ... 11 1.4.3 Distribution ... 12 1.4.4 Rôles physiologiques ... 12 1.4.5 Gènes et protéines ... 13 1.4.6 Structure ... 14 1.4.7 Régulation ... 14
1.5 Les WNK lysine deficient protein kinases ... 16
1.5.1 Généralités ... 16 1.5.2 Découverte ... 16 1.5.3 Gènes et protéines ... 17 1.5.4 Domaines importants ... 17 1.5.5 Fonctions générales ... 18 1.5.6 Régulation ... 20 1.6 WNK4 ... 21 1.6.1 Découverte ... 21 1.6.2 Distribution ... 21 1.6.3 Étude du gène ... 22 1.6.4 Structure ... 22 1.6.5 Régulation ... 23
1.6.6 Rôle de WNK4 dans la régulation du transport membranaire ... 25
1.6.7 Rôle de WNK4 et de SPAK dans la régulation des KCC ... 27
1.6.8 Le Pseudohypoaldostéronisme de type II ... 28
1.6.9 Les modèles animaux ... 29
1.7 Raisonnement... 30
Chapitre 2 : HYPOTHÈSES, OBJECTIFS ET APERÇU DE LA THÈSE... 32
Chapitre 3 : MÉTHODES SUPPLÉMENTAIRES ... 34
Chapitre 4 : Regulation of the K+-Cl- cotransporter by WNK lysine deficient protein
kinases during cell swelling : novel insights ... 35
4.1 Résumé de l’article ... 35 4.2 Title Page ... 36 4.3 Abstract ... 37 4.4 Introduction ... 37 4.5 Experimental Procedures ... 41 4.5.1 Supplies ... 41 4.5.2 cDNAs ... 41
4.5.3 Expression in Xenopus laevis oocytes and general protocol ... 43
4.5.4 Rationale behind the use of certain solutions ... 44
4.5.5 Influx studies in Xenopus laevis oocytes ... 45
4.5.6 Expression studies ... 46
4.5.7 Phosphorylation studies ... 46
4.5.8 Immunofluorescence ... 46
4.5.9 Sequence Analyses and Statistics ... 47
4.6 Results ... 47
4.6.1 Basal regulation of KCC4 by WNK4 ... 47
4.6.2 Mechanisms of KCC4 regulation by WNK4 ... 49
4.6.3 Dependence of swelling-induced KCC4 activation on the WNK4-PP1 interaction ... 51
4.6.4 Identification of residues that underlie the effect of WNK4 on cotransporter activity ... 52
4.6.5 Phosphorylation studies ... 56
4.7 Discussion ... 57
4.8 References ... 61
Chapitre 5 : RÉSULTATS SUPPLÉMENTAIRES ... 66
5.1 La présence des mutations T926A et T980A sur KCC4 ne modifie pas l’expression à la membrane du transporteur ... 66
5.2 Absence d’interaction directe entre WNK4 et KCC4 ... 67
5.3 Effet de WNK4 sur la capacité de KCC4 à former des oligomères ... 68
Chapitre 6 : DISCUSSION, CONCLUSIONS ET PERSPECTIVES ... 70
6.1 Discussion ... 70
6.1.1 Choix du modèle expérimental ... 70
6.1.2 L’hypotonicité diminue l’activité endogène de WNK4 ou augmente l’activité celle de PP1 ... 71
6.1.3 WNK4 et PP1 font toutes deux partie d’une voie de signalisation commune . 73 6.1.4 Identification de deux résidus importants dans la régulation de KCC4 ... 76
6.2 Conclusions ... 79
6.3 Persceptives ... 80
Chapitre 7 : Bibliographie ... 81
Annexe 1 : Phosphoregulation of K-Cl cotransporters during cell swelling : novel insights ... 91
Résumé de l’article ... 91
Title Page ... 92
Abstract ... 93
Introduction ... 94 Methods ... 95 Results ... 97 References ... 101 Authors’ Contributions ... 104 Competing of Interest ... 104 Footnote ... 104 Legends ... 105 Tables ... 108 Figures ... 110
Liste des tableaux
Chapitre 1 : Introduction
Tableau 1-1. Concentration ionique dans différents types cellulaires (mmol/L) ... 1 Tableau 1-2. Noms des gènes et protéines utilisés pour les membres de la famille des CCC ... 5 Tableau 1-3. Résumé des caractéristiques fonctionnelles des CCC transporteurs d’ions ... 10 Tableau 1-4. Numéros d’accession NCBI du gène KCC4 chez différentes espèces. ... 13 Tableau 1-5. Résumé de l’effet de WNK4 sur différents transporteurs et leur dépendance à l’activité catalytique de la kinase ... 25 Chapitre 4 : Regulation of the K+-Cl- cotransporter by WNK lysine deficient protein
kinases during cell swelling : novel insights
Table 4-1. Mutagenic, FLAG epitope tag or PCR amplification primers used ... 42 Table 4-2. Composition of various solutions ... 45 Annexe 1 : Phosphoregulation of K-Cl cotransporters during cell swelling : novel insights
Table 1. Oligonucleotide used ... 108 Table 2. Composition of media ... 109
Liste des figures
Chapitre 1 : Introduction
Figure 1-1. Représentation des trois types de transporteurs ... 3
Figure 1-2. Homologie de séquences entre les différents membres de la famille des CCC. . 5
Figure 1-3. Régulation du volume cellulaire par les NKCC et les KCC. ... 6
Figure 1-4. Représentation de la localisation et de la direction du transport ionique de NKCC1, NKCC2 et des KCC dans la membrane cellulaire... 7
Figure 1-5. Implication de KCC4 dans la sécrétion de l’acide des cellules α-intercalaires 13 Figure 1-6. Modèle hydropathique de msKCC4 avec la position des sites de N-glycosylations ... 14
Figure 1-7. Structure des hWNK avec les domaines importants, les sites de liaison de SPAK/OSR1 et les sites d’autophosphorylations présents sur WNK1 ... 18
Figure 1-8. Implication de L-WNK1 et de WNK2 dans la voie MAP kinase ... 20
Figure 1-9. Représentation de msWNK4 avec les domaines importants ... 22
Figure 1-10. Implication de SPAK/OSR1 dans la régulation phosphodépendante des transporteurs ... 25
Figure 1-11. Mécanismes de régulation des protéines de transport par WNK4 ... 26
Figure 1-12. Effet de WNK4 avec une mutation hypomorphe sur la réabsortion des sels dans le rein selon le modèle proposé par Ohta A. et al. ... 30
Chapitre 4 : Regulation of the K+-Cl- cotransporter by WNK lysine deficient protein kinases during cell swelling : novel insights Figure 4-1. Localisation of putative phosphorylation sites ... 40
Figure 4-2. Structure of WNK4 ... 43
Figure 4-3. Schematics of the general protocol used ... 44
Figure 4-4. WNK4 inhibits the activity of KCC4 but not its expression ... 48
Figure 4-5. PP1 is implicated in the regulation of KCC4 and acts downstream WNK4 ... 50
Figure 4-6. The motifs KXVTF are essential for the inhibiting activity of WNK4 ... 51
Figure 4-7. KCC4(T926A) and KCC4(T926A/T980A) are much more active that KCC4 and are insensitive to cell swelling ... 53
Figure 4-8. KCC4(T926A), KCC4(T980A) and KCC4(T926A/T980A) are not inhibited by WNK4 or WNK4(D318A). ... 54
Figure 4-9. Following cell swelling, KCC4(T926A), KCC4(T980A) and KCC4(T926A/T980A) are less sensitive to calyculin A relative to KCC4. ... 55
Figure 4-10. WNK4, WNK4(D318A) or WNK4(KXVTF1/2) do not change the phosphorylation level of KCC4-myc ... 56
Chapitre 5 : Résultats supplémentaires Figure 5-1. Expression de surface de KCC4, KCC4(T926A), KCC4(T980A) et KCC4(T926A/T980A) ... 66
Figure 5-3. Co-immunoprécipitation entre KCC4-myc et KCC4-HA en présence ou non de WNK4 ... 68
Annexe 1 : Phosphoregulation of K-Cl cotransporters during cell swelling : novel insights
Figure 1. Structure of KCC4 and WNK4 ... 110 Figure 2.Schematic of the general protocol used ... 111 Figure 3. KCC4 activity and expression in the presence or absence of WNK4 or WNK4D318A ... 112 Figure 4.Effect of staurosporine, okadaic acid or calyculin A on KCC4 activity in the presence or absence of WNK4 or WNK4D318A ... 113 Figure 5. KCC4 activity in the presence or absence of WNK4 or WNK4VTF→AAA ... 114 Figure 6. Effect of PP1α on KCC4 activity in the presence or absence of WNK4, WNK4D318A or WNK4VTF→AAA ... 115 Figure 7. Effect of SPAK on KCC4 activity in the presence or absence of WNK4, WNK4D318A or WNK4VTF→AAA ... 116 Figure 8. .KCC4T926A, KCC4T980A and KCC4T926A/T980A activities and expression at different osmolalities ... 117 Figure 9. KCC4T926A and KCC4T980A activities in the presence of WNK4 or WNK4D318A ... 118 Figure10. Effect of calyculin A or okadaic acid on KCC4T926A and KCC4T980A activities ... 119 Figure 11. Phosphorylation levels of KCC4 or KCC4T926A under a variety of conditions 120
Liste des abréviations
ADNc acide désoxyribonucléique complémentaire
Ap-2α facteur de transcription AP-2 alpha
AQP aquaporine
ARNc acide ribonucléique complémentaire ARNm acide ribonucléique messager
ATP adénosine-5'-triphosphate
C/EBP « CCAAT-enhancer-binding proteins »
C-terminale carboxy-terminale
DCT « distal convoluted tubule »
DIDS 4,4'-Diisothiocyano-2,2'-stilbenedisulfonique acide DIOA [(Dihydroindenyl)oxy]acetique acide
4E-BP1 « Eukaryotic translation initiation factor 4E-binding protein 1 » ENaC « epithelial sodium channel »
ERK « Extracellular signal-regulated kinases » EST « expressed sequence tag »
GABA Acide γ-aminobutyrique GR récepteur des glucocorticoïdes
HEK-293 cellules embryonnaires de rein humain Hsp « heat shock proteins »
kDa kilo Dalton
kb kilobase
MEK « Dual specificity mitogen-activated protein kinase kinase 5 » NFAT5 « nuclear factor of activated T-cell 5 »
N-terminale amino-terminale ORF « open reading frame »
OSR1 « regulate oxidative stress response 1 » PAK1 « p21-activated kinase 1 »
pb paires de bases
PCR réaction en chaîne par polymérase PKC protéine kinase C
PMA phorbol 12-mystrate 13-acétate PP1 protéine phosphatase de type 1 PP2 protéine phosphatase de type 2
Ppp1r3c « protein phosphatase 1, regulatory subunit 3C » Ppp1r15a « protein phosphatase 1, regulatory subunit 15a » PTG « protein phosphatase 1 binding protein G » Rac1 « Ras-related C3 botulinum toxin substrate 1 »
RACE-PCR « Rapid amplification of cDNA ends » par réaction de polymérisation en chaîne
RhoA « Ras homolog gene family, member A »
RT-PCR réaction de polymérisation en chaîne après transcription inverse S6K protéine ribosomale S6 kinase
ROMK « renal outer medullary potassium channel »
SMAD2 « SMAD family member 2 » Sp1 « specificity protein 1 »
SPAK « STE20/SPS1-related proline/alanine-rich kinase »
TGF-β « transforming growth factor-beta » TRPV « transient receptor potential vanilloid »
TonEBD « tonicity-responsive enhancer-binding domain » ZO-1 « tight junction protein 1 »
Remerciements
Je remercie tout d’abord mon directeur de recherche, le Dr Paul Isenring, pour m’avoir accueillie dans son laboratoire. J’ai appris énormément à ses côtés et j’ai profité de ses nombreux conseils durant toutes mes études. Je tiens à souligner sa disponibilité malgré son horaire chargé. Merci beaucoup.
Je tiens à remercier Luc Caron, Micheline Noël, Mariève Jacob-Wagner et François Coté qui ont été des professionnelles de recherche hors pair, ainsi que Michael Simard, Andrée-Anne Marcoux, Charles Simard, Nikolas Daigle, Gabriel Carpentier, Alexandre Garneau et Marc Bergeron, mes collèges étudiants et amis du laboratoire, pour leur aide et leur amitié. Merci également à tous les membres du personnel du Centre de recherche L’Hôtel-Dieu de Québec pour leur travail remarquable et leur générosité.
Un merci tout spécial à mes parents et à mon frère pour leur amour inconditionnel et leurs encouragements tout au long de mes études. Un merci aussi spécial à mes amies, qui ont toujours été là pour moi dans les moments les plus difficiles et qui m’offrent un soutien indispensable.
Finalement, je souligne avec gratitude l’implication des IRSC qui m’aura permis l’obtention d’un soutien financier durant mes quatre années d’études au doctorat. Je souligne aussi celle des IRSC et de la FCI qui aura permis l’achat de réactifs et d’équipements pour le bon déroulement de mes expériences de laboratoire.
Avant-propos
Le chapitre 4 de cette thèse est un article inséré. Il s’intitule Regulation of the K+-Cl
-cotransport by WNK lysine deficient protein kinases during cell swelling: novel insights. Il
s’agit de la première version du manuscrit soumis pour évaluation qui est présenté en annexe 1. Effectivement, durant la période entre le dépôt initial et le dépôt final, nous avons obtenu plusieurs nouveaux résultats qui nous ont permis d’améliorer grandement la qualité de l’article sous sa forme finale. Les autres auteurs de l’article sous sa forme initiale sont monsieur Luc Caron et le docteur Paul Isenring. En tant que première auteure, j’ai réalisé la totalité des expériences, la totalité des figures et contribué à la rédaction de l’article. Pour sa part, monsieur Luc Caron a réalisé le clonage de WNK4(wt) et WNK4(D318A) dans le vecteur d’expression pour les ovocytes et le docteur Paul Isenring a agi à titre de directeur de recherche et a peaufiné la rédaction de l’article.
L’annexe 1 de cette thèse est un manuscrit qui à été soumis a Open Biology le 25 novembre 2015. Il s’intitule Phosphoregulation of K-Cl cotransporters during cell
swelling: novel insights. Les autres auteurs de cet article sont madame Andrée-Anne
Marcoux, monsieur Alexandre Garneau, madame Micheline Noël et le docteur Paul Isenring. En tant que première auteure, j’ai réalisé la presque totalité des expériences, la totalité des figures, analysé les résultats et contribué à la rédaction de l’article. Pour sa part, madame Andrée-Anne Marcoux a réalisé le clonage de SPAK et participé aux études d’expression de surface, monsieur Alexandre Garneau a participé à la rédaction de l’article, madame Micheline Noël a apporté de l’assistance technique et le docteur Paul Isenring a agi à titre de directeur de recherche et a peaufiné la rédaction de l’article.
Chapitre 1 : INTRODUCTION 1.1 Généralités sur le transport membranaire
La cellule est séparée du milieu extracellulaire par la membrane plasmique. Cette membrane est composée d’une double couche de phospholipides dans laquelle on retrouve plusieurs protéines de transport responsables du maintien des concentrations intracellulaires de plusieurs solutés, sucres et ions. Elle joue donc le rôle de barrière sélective en permettant le passage de certaines molécules dans le but de fournir des substrats essentiels ou pour se débarrasser de substrats nuisibles. De plus, elle permet le maintien du gradient de concentration ionique entre les milieux intracellulaire et extracellulaire. Dans les cellules de mammifères, la concentration de Na+ et de Cl- est généralement supérieure dans le milieu extracellulaire tandis que celle K+ est généralement supérieure dans le milieu intracellulaire [1]. Des exemples de concentration ionique dans différents types cellulaires sont présentés dans le tableau 1-1. Ce gradient ionique permet à la cellule de maintenir son potentiel électrochimique (pour les cellules excitables). Les substrats peuvent traverser la membrane de deux façons, soit par diffusion simple ou par diffusion facilitée.
Type cellulaire ions Concentration intracellulaire Concentration extracellulaire Musculaire lisse [2] Na+ 12 145 K+ 155 4 Cl- 4 120 Neurone [3] Na+ 5-15 145 K+ 140 5 Cl- 4-30 110 Myocyte [4] Na+ 15 145 K+ 150 44 Cl- 5 120
Tableau 1-1. Concentration ionique dans différents types cellulaires (mmol/L).
diffusion facilitée, lui, peut se faire non seulement dans le sens du gradient, mais aussi contre le gradient et requiert la participation de protéines de transport. Il est saturable sur des périodes plus courtes, plus rapide que la diffusion simple, typiquement régulé et il est soit passif soit actif [1].
Le transport passif par diffusion facilitée ne consomme pas d’énergie et le mouvement des substrats se fait dans le sens du gradient. Contrairement au transport passif, le transport actif s’effectue dans le sens contraire du gradient. Il nécessite généralement de l’énergie provenant le plus souvent de la consommation d’ATP : on parle alors de transport actif primaire. Dans certaines formes de cotransport, l’un des substrats peut être déplacé contre son gradient sans consommation d’énergie : on parle alors de transport actif secondaire. Chacune des principales classes de protéines impliquées dans les différents types de transports membranaires sera décrite dans les prochains paragraphes. Il s’agit des canaux, des pompes et des cotransporteurs.
Les canaux sont des protéines qui permettent le passage rapide de molécules à travers la paroi cellulaire, dans le sens du gradient. Les canaux jouent un rôle particulièrement important dans les cellules excitables, telles les neurones et les cellules musculaires, où ils génèrent un mouvement rapide de molécules chargées dans le but d’ajuster le potentiel de repos ou de permettre la propagation du potentiel d’action. Ils jouent aussi un rôle important dans les épithélia en modulant l’absorption ou la sécrétion des sels. Le pore des canaux peut être constitutivement ouvert ou régulé par le voltage, des kinases ou un ligand. Une des caractéristiques majeures qui diffère les canaux des pompes et des transporteurs est l’absence de modification conformationnelle importante suite à sa liaison avec les substrats transportés.
Tel que mentionné ci-dessus, les pompes permettent le passage de substrats (un ou plusieurs à la fois) contre un gradient de concentration, et ce, en consommant de l’énergie, très souvent sous forme d’ATP. Elles jouent un rôle important dans le maintien hors équilibre des concentrations ioniques intracellulaires. Par exemple, la pompe Na+-K+ ATPase permet d’établir une différence de potentiel membranaire en maintenant le Na+ intracellulaire bas [5]. Ici, la translocation des ions s’effectue suite à une modification conformationnelle importante de la protéine. En effet, l’interaction du substrat à son site de
liaison spécifique induit un changement de conformation de la pompe, conduisant à l’exposition de ce site de l’autre côté de la membrane.
Les transporteurs ressemblent aux pompes dans leur mode de fonctionnement sauf qu’ils permettent le passage des substrats selon un gradient électrochimique d’ensemble (selon le produit final des gradients de tous les substrats transportés). Un substrat peut donc être transporté contre son gradient par un transporteur multisubstrats, on parle alors de mouvement facilité secondaire. On retrouve trois types de transporteurs. Il y a les uniporteurs et les symporteurs qui transportent les substrats dans la même direction ainsi que les antiporteurs qui transportent les substrats dans des directions opposées. De plus, les uniporteurs favorisent le transport des substrats dans le sens du gradient, tandis que les symporteurs et les antiporteurs favorisent le transport d’un des substrats contre son gradient en utilisant la force électrochimique des autres substrats (figure 1-1).
Dans notre laboratoire, nous étudions plus particulièrement une famille de transporteurs dont la plupart des membres agissent à titre de symporteurs. Il s’agit des cotransporteurs cation-Cl- (CCC) qui couplent le transport du Na+ et /ou de K+ à celui du Cl- et qui n’induisent pas de changement de charge lors du mouvement des substrats. Il existe quatre sous-familles de CCC : le cotransporteur Na+-Cl- (NCC), les cotransporteurs Na+-K+-Cl- dont il existe deux isoformes (NKCC1 et NKCC2), les cotransporteurs K+-Cl
-Figure 1-1 Représentation des trois types de transporteurs, adaptée de M. Gilbert pour FacBio.
dont il existe quatre isoformes (KCC1 à KCC4) ainsi que deux transporteurs de polyamines et d’acides aminés (CCC8 et CCC9) [6]. Les CCC sont importants pour la régulation du volume cellulaire, le maintien des concentrations ioniques intracellulaires et le mouvement des sels à travers les épithélia.
1.2 Les cotransporteurs cation-Cl- (CCC)
1.2.1 Généralités
C’est en 1993 que les premiers CCC ont été identifiés. Il s’agit de NCC et de NKCC1. Le cotransporteur NCC à été identifié par clonage d’expression dans les ovocytes de Xenopus laevis. L’ADNc provenait de la vessie du Pseudopleuronectes americanus [7]. Le cotransporteur NKCC1 a été cloné à partir d’une banque d’ADNc provenant de la glande rectale de requin (Squalus acanthias). Ici, la stratégie de clonage a été de cribler cette banque, dont les différents ADNc ont été exprimés dans le vecteur γZAP, à l’aide d’un anticorps spécifique et de caractériser la fonction de la protéine dans des cellules humaines (HEK-293) [8]. NKCC2, lui, a été isolé en 1994 par homologie de séquence avec NKCC1. Le groupe de Payne et Forbush a utilisé une banque d’ADNc provenant de reins de lapin [9], tandis que le groupe de Gamba a utilisé une banque d’ADNc provenant de reins de rat [10]. Finalement, les autres CCC ont été identifiés de 1996 à 2002 grâce aux banques EST et les ADNc isolés à partir de différentes sources : KCC1 de reins de lapin et de cerveaux de rat (rbKCC1 et rtKCC1) [11], KCC2 de cerveaux de rat (rtKCC2) [11], KCC3 de reins de souris et d’humains (mKCC3 et hKCC3) [12], KCC4 de muscles humains (hKCC4) [12], CCC8 (CIP) de cœurs humains et CCC9 (LNG) de poumons humains [13].
La famille des CCC est codée par les gènes SLC12A1 à SLC12A9 et est divisée phylogénétiquement en quatre groupes (figure 1-2). Tel que présenté, on retrouve des transporteurs Na+-indépendants (KCC1, KCC2, KCC3 et KCC4 codés par SLC12A4,
SLC12A5, SLC12A6 et SLC12A7) qui partagent environ 70 % d’homologie entre eux [14],
des transporteurs Na+-dépendants (NKCC2 et NKCC1 et NCC codés par SLC12A1,
SLC12A2 et SLC12A3) qui partagent 50 % à 60 % d’homologie entre eux, et les
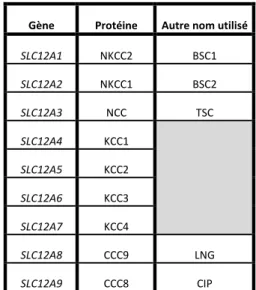
groupe séparé. Ces derniers étaient connus jusqu'à tout récemment comme des transporteurs orphelins, mais aujourd’hui, on sait qu’ils transportent des polyamines de même que des acides aminés [6]. À cet effet, le tableau 1-2 résume le gène correspondant à chaque protéine ainsi que les autres noms utilisés pour désigner les membres de la famille des CCC.
Gène Protéine Autre nom utilisé
SLC12A1 NKCC2 BSC1 SLC12A2 NKCC1 BSC2 SLC12A3 NCC TSC SLC12A4 KCC1 SLC12A5 KCC2 SLC12A6 KCC3 SLC12A7 KCC4 SLC12A8 CCC9 LNG SLC12A9 CCC8 CIP
Tableau 1-2 Noms des gènes et protéines utilisés pour les membres de la famille des CCC.
La direction du flux ionique et la stœchiométrie du transport par les CCC dépendent de l’isoforme à l’œuvre. Par exemple, de manière générale, les KCC transportent un ion K+ pour un ion Cl- [15] de l’intérieur vers l’extérieur de la cellule, tandis que les NKCC transportent un ion K+ et un ion Na+ pour deux ions Cl- [16] de l’extérieur vers l’intérieur de la cellule. De plus, les CCC ont une sensibilité différente aux diurétiques (tels le furosémide, le bumétanide et l’hydrochlorothiazide) selon l’isoforme. En effet, les NKCC sont inhibés par le bumétanide et le furosémide, deux diurétiques de l’anse, de manière équivalente [16, 17], les KCC sont davantage inhibés par le furosémide que par le bumétanide [18, 19] et le NCC est inhibé par l’hydrochlorothiazide (un diurétique agissant au néphron distal) alors qu’il est insensible aux diurétiques de l’anse [20]. Ces différents Figure 1-2 Homologie de séquences entre les
différents membres de la famille des CCC, modifié de Gamba [1].
(furosémide et bumétanide) et l’hypertension artérielle (hydrochlorothiazide). Pour ce qui est de CCC8 et CCC9, il a été démontré que le transport des polyamines est inhibé par la pentamidine [6].
Le contrôle du volume cellulaire par les CCC se fait par les mécanismes du « regulatory volume increase » (RVI) et « regulatory volume decrease » (RVD) tel qu’illustré à la figure 1-3. Dans le cas du RVI, ce sont les NKCC qui entrent surtout en jeu. Lorsqu’il y a un stress hyperosmotique avec rétrécissement cellulaire, il y aussi activation des NKCC pour promouvoir le mouvement d’ions vers l’intérieur de la cellule favorisant ainsi l’entrée d’eau par les AQP ce qui rétablie le volume cellulaire [21, 22]. Dans le cas du RVD, ce sont alors les KCC qui sont davantage impliqués. Lorsqu’il y a un stress hypo-osmotique avec gonflement cellulaire, il y a alors activation des KCC pour promouvoir le mouvement d’ions vers l’extérieur de la cellule favorisant ainsi la sortie d’eau par les AQP ce qui rétablie le volume cellulaire [21, 23, 24].
Figure 1-3 Régulation du volume cellulaire par les NKCC et les KCC (adapté de Nature
Clinical Practice Neurology, 2008).
Le contrôle du contenu ionique par les CCC est rendu possible par le fait qu’un transfert net d’ions par ces protéines n’engendre pas un transfert quantitativement équivalent d’eau, ce qui a pour effet de modifier le contenu ionique autant intracellulaire qu’extracellulaire. Généralement, les KCC favorisent une diminution du contenu ionique des cellules, tandis que les NKCC produisent l’effet inverse. De tels changements sont importants puisqu’ils soutiennent une variété de fonctions physiologiques. Par exemple, lorsque KCC2 est activé dans les cellules neuronales, il s’en suit une diminution de la
concentration du Cl- intracellulaire, ce qui permet un afflux plus important de Cl- par les canaux à Cl- GABA et, ainsi, de garder la cellule dans un état d’hyperpolarisation et d’hypoexcitabilité secondaire [25]. Dans le même ordre d’idée, lorsque NKCC1 est activé dans l’oreille interne, il s’en suit une diminution du K+ dans le milieu extracellulaire (ou l’endolymphe), ce qui permet aux cellules neuronales qui baignent dans ce liquide de se développer durant l’embryogenèse et survivre à plus long terme [26].
La présence des CCC dans les cellules épithéliales, des cellules polarisées dont l’un des pôles fait face au milieu extracellulaire et l’autre à l’environnement extérieur, permet aussi l’accomplissement d’un autre rôle physiologique crucial chez les vivants, celui de sous-tendre le mouvement vectoriel d’ions et d’eau vers le milieu extérieur (la sécrétion) ou vers le milieu extracellulaire (la réabsorption). Le mouvement vectoriel induit par les CCC peut se faire dans un sens ou dans l’autre dépendant de l’isoforme exprimé et du pôle où il est localisé (Figure 1-4). En effet, si un NKCC est exprimé dans la membrane apicale, il permet la réabsorption étant donné qu’il effectue le transport de l’extérieur vers l’intérieur de la cellule. Par contre, s’il est exprimé dans la membrane basolatérale, il favorise la sécrétion étant donné qu’il effectue aussi le transport de l’extérieur vers l’intérieur de la cellule. Par exemple, NKCC2 est exprimé dans la membrane apicale de l’anse de Henle où il contribue à la réabsorption d’une quantité importante de NaCl [27]. Pour ce qui est des KCC, ils permettent en général la réabsorption des sels puisqu’ils sont exprimés pour la plupart dans les membranes basolatérales et qu’ils effectuent le transport de l’intérieur vers l’extérieur de la cellule. [28, 29]. À ce chapitre, KCC4 constitue une exception puisque dans certains épithélia, comme ceux des plexus choroïdes ventriculaires et des parois gastriques, il est exprimé dans la membrane apicale et favorise donc la sécrétion de sels et d’eau [30].
Figure 1-4 Représentation de la localisation et de la direction du transport ionique de NKCC1, NKCC2 et des KCC dans la membrane
Sur le plan de la structure, tous les CCC à l’exception de CCC9 possèdent 12 domaines transmembranaires (TM) [7, 8, 10-12, 31, 32] flanqués par des extrémités N et C-terminales à localisation cytosolique. Pour ce qui est de CCC9, le modèle hydropathique est incertain, car les deux études à ce sujet sont contradictoires. Pour Hebert et al., il s’agirait d’une protéine à 11 TM [33], tandis que pour Daigle et al., il s’agirait plutôt d’une protéine à 10 TM selon des expériences mutagéniques et des simulations hydropathiques diverses [6]. Par ailleurs, des sites de glycosylation et de phosphorylation sont retrouvés chez tous les CCC [34] et il est maintenant bien établi que les différents isoformes peuvent s’associer pour former des homo-oligomères et des hétéro-oligomères [35]. Par exemple, CCC8 semble pouvoir s’associer avec NKCC1 pour en inhiber l’activité [32] et avec KCC2 pour en augmenter l’activité [36]. Par ailleurs, l’impact fonctionnel de l’association des autres isoformes entre eux demeure peu connu à ce jour.
Tel que mentionné auparavant, les CCC affectent les propriétés cellulaires de plusieurs manières, ce qui explique sans doute pourquoi ils sont impliqués dans plusieurs pathologies. Chez l’humain, une inactivation de NCC ou de NKCC2 cause les syndromes de Gitelman [37] et de Bartter [38], respectivement, maladies qui se soldent par une perte de sels rénaux avec tendance à l’hypotension artérielle. De plus, une inactivation du gène codant pour NKCC1 chez la souris provoque une diminution de la pression artérielle, un dysfonctionnement auditif [39], de l’infertilité, une diminution de la production de salive [40] et une modification des perceptions sensorielles [41]. Par ailleurs, l’ablation de KCC2 aussi chez la souris se traduit par de l’épilepsie à la stimulation et des troubles de perceptions de la douleur [42]. Finalement, une mutation dans le gène codant pour KCC3 mène à la formation d’une protéine tronquée et à un syndrome neurologique dit d’Anderman [43] qui se manifeste par une atrophie du corps calleux et des problèmes de coordination.
1.3 Les cotransporteurs K+-Cl- (KCC)
1.3.1 Généralités
L’homologie entre les KCC et les autres membres de la famille des CCC est seulement de 27 % à 33 %, mais elle est beaucoup plus élevée si on ne tient compte que des
domaines transmembranaires, de la boucle extracellulaire et de l’extrémité C-terminale [12]. Malgré le fait que les KCC partagent beaucoup de caractéristiques similaires aux autres membres des CCC, ils se distinguent de ceux-ci à plusieurs égards. Ces différences seront présentées dans les prochains paragraphes.
Les C-termini des KCC sont pratiquement identiques entre les isoformes, alors que les TM2 et TM4 sont les domaines qui divergent le plus. Il a d’ailleurs été démontré que ces domaines étaient sans doute directement impliqués dans le transport des cations (TM2) [44] et des anions (TM4) [45] dans la famille des CCC transporteurs d’ions. Par ailleurs, de façon intéressante, les KCC peuvent se subdiviser phylogénétiquement en deux sous-groupes, l’un comprenant KCC1 et KCC3 qui partagent 76 % d’homologie entre eux et l’autre qui comprend KCC2 et KCC4 qui partagent 72 % d’homologie entre eux (figure 1-2).
Sur le plan de la structure, les différences principales entre les KCC et les autres CCC transporteurs d’ions sont la position des sites de N-glycosylation (qui se situent entre les TM5 et TM6 pour les KCC et entre les TM7 et TM8 pour les autres) et la longueur de l’extrémité N-terminale qui est plus courte chez les KCC. Entre les KCC eux-mêmes, les différences principales, outre celles déjà mentionnées, sont les positions des sites potentiels de phosphorylation aux extrémités N et C-terminales.
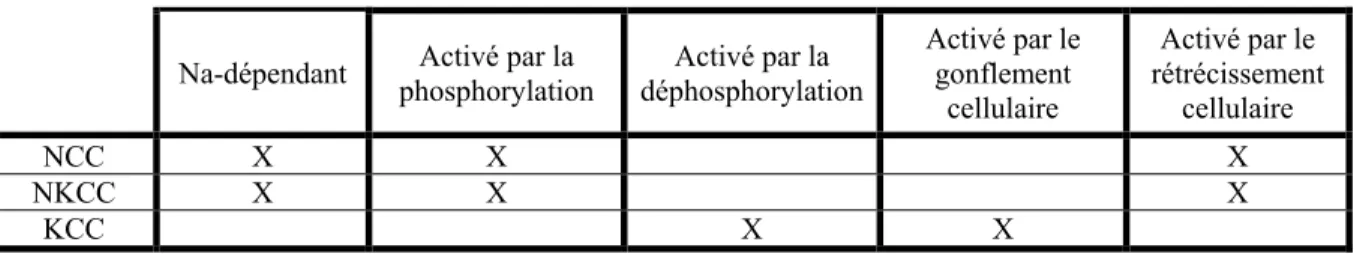
Sur le plan fonctionnel, rappelons ici les différences qui existent entre les NKCC ou le NCC et les KCC (tableau 1-3) : 1) les KCC ne dépendent pas de la présence du Na+ pour effectuer le transport, 2) ils permettent l’efflux cellulaire des ions sauf dans certaines circonstances, 3) ils sont activés par le gonflement cellulaire et l’augmentation du Cl -intracellulaire, et 4) ils seraient vraisemblablement activés par la déphosphorylation, bien qu’aucune preuve directe n’existe à cet effet [12]. De fait, le comportement des KCC est en miroir avec celui des NKCC ou de NCC qui eux sont activés par le rétrécissement cellulaire et par la phosphorylation. Pour ce qui est de la stœchiométrie apparente du transport ionique par les KCC, celle-ci serait d’un cation transporté pour un anion transporté [15].
Na-dépendant phosphorylation Activé par la déphosphorylation Activé par la Activé par le gonflement cellulaire Activé par le rétrécissement cellulaire NCC X X X NKCC X X X KCC X X
Tableau 1-3 Résumé des caractéristiques fonctionnelles des CCC transporteurs d’ions. Les KCC sont exprimés dans plusieurs types cellulaires, ce qui contribue à la diversité de leurs rôles physiologiques. Certains exemples ont déjà été mentionnés. Bien que plusieurs types cellulaires soient capables d’exprimer deux à trois des isoformes, ils auraient néanmoins tendance à en exprimer un plus que les autres [46-49]. Par exemple, dans le réticulocyte, KCC3 correspond au CCC dont l’expression est la plus grande, ce qui en fait sans doute le joueur le plus important dans le RVD [48]. Dans plusieurs types de cellules neuronales, KCC2 correspond aussi au KCC donc l’implication dans le contrôle de l’excitabilité neuronale est la plus importante [49].
1.4 Le KCC4 1.4.1 Découverte
Initialement, KCC4 a été cloné à partir de banques EST humaines, mais sa séquence d’ADNc était incomplète [12]. Puisque des études de type Northern avaient révélé que le muscle correspondait au tissu où KCC4 était le plus fortement exprimé, ce tissu avait donc été utilisé pour cloner la partie manquante de KCC4 par 5’-RACE-PCR. La séquence complète de hKCC4 code ainsi pour une protéine de 1 083 acides aminés qui est très homologue aux autres membres de la famille des KCC (71 % avec hKCC1, 66 % avec rKCC2 et 66 % avec hKCC3) [12]. Une forme tronquée authentique de la protéine humaine a aussi été identifiée dans les cellules de neuroblastomes humains. Elle contient 266 acides aminés suite à la délétion des exons 7 à 23 [50]. Son rôle demeure inconnu pour le moment. Notons aussi qu’il existe deux variantes d’épissages de KCC4 chez le lapin. La première, dite forme longue, est composée de 1 106 acides aminés, et la seconde, dite forme tronquée, est plus courte de 92 acides aminés dans une région peu conservée du N-terminus [29]. Son rôle demeure tout aussi inconnu à ce jour.
1.4.2 Caractéristiques fonctionnelles
Tout comme les autres membres de la famille des KCC, KCC4 est activé par le gonflement cellulaire et il est celui qui a la plus forte activation par l’hypotonicité tout en ayant une très faible capacité de transport en conditions isotoniques. De plus, KCC4 montre un profil de sensibilité à des inhibiteurs divers et des constantes ioniques qui diffèrent de celles des autres isoformes. Il est important de mentionner ici que toutes les données présentées dans les prochaines lignes, c’est-à-dire celles concernant la sensibilité de KCC4 à certains inhibiteurs ainsi que celles portant sur l’affinité du transporteur pour les ions, proviennent d’études qui ont été faites dans le système d’expression hétérologue des ovocytes de Xenopus laevis.
Les principaux inhibiteurs de KCC4 sont les diurétiques, le DIDS ainsi que le DIOA, mais leur efficacité varie selon la concentration extracellulaire de K+ (Ke). Par exemple, le furosémide inhibe KCC4 de manière maximale lorsque le Ke est de 6 mM et minimale lorsque le Ke est de 2 mM, mais de manière relativement faible par rapport aux autres KCC (le Ki approche le mM). Le trichlorométhiazide inhibe aussi KCC4 alors qu’il n’a aucun effet sur les autres KCC. Cette inhibition est de 20 % avec un Ke à 2 mM et de 40 % avec un Ke à 50 mM. Pour ce qui du DIDS, un inhibiteur non spécifique de transporteurs d’anions, il diminue l’activité de KCC4 de 65 % lorsque le Ke est de 50 mM et de 13 % lorsque le Ke est de 2 mM. Finalement, contrairement aux diurétiques et au DIDS, le DIOA inhibe l’activité de KCC4 très efficacement et davantage lorsque le Ke est bas. Notons aussi que l’activité de transport de KCC4 est bloquée par des doses élevées de BaCl2 [19].
Pour ce qui est des constantes d’affinité (Km) de KCC4 pour les ions transportés (K+ et Cl-) elles sont de 17,5 mM pour le K+ et de 16,12 mM pour le Cl- avec un Vmax de 32 370 pmol/ovocyte/h et de 41 440 pmol/ovocyte/h, respectivement. Les coefficients de Hill observés sont de 1,08 pour le K+ et de 1,06 pour le Cl-. Outre le K+ et le Cl-, KCC4 conserve une capacité de transport de 58 % lorsque le Cl- est substitué par le Br-, de 20 % s’il est substitué par le H2PO4- et de 17 % s’il est substitué par l’I- [19]. De plus, il a été démontré que KCC4 pouvait transporter le NH4+ à la place de K+ avec un Km d’environ
1.4.3 Distribution
KCC4 est exprimé dans plusieurs organes. On le retrouve principalement dans le muscle, le système nerveux central, les poumons, le cœur et les reins [12]. Dans le système nerveux central, une étude effectuée chez le rat a montré que KCC4 est présent dans le plexus choroïde, le noyau suprachiasmatique de l’hypothalamus, les cellules gliales, dont les astrocytes et la moelle épinière [52]. Dans le rein, une étude effectuée chez le lapin a montré que KCC4 est présent dans plusieurs segments du néphron. C’est dans le tubule contourné distal, le tubule connecteur et l’anse ascendante large de Henle qu’il y a la plus forte expression. On le retrouve aussi plus faiblement dans le tubule proximal et le tubule collecteur. [29, 53].
1.4.4 Rôles physiologiques
En plus de participer au RVD et au contrôle de la concentration intracellulaire des ions K+ et Cl-, KCC4 participe aussi à la régulation acide-base en permettant le mouvement transmembranaire des ions NH4+ dont une partie se dissocie en NH3 et H+ à l’intérieur de la cellule [51]. L’activité de cet isoforme est d’ailleurs non seulement sensible au gonflement cellulaire et aux changements de Cl- intracellulaire, mais il est aussi sensible aux changements de pH intracellulaire, ce qui lui permet d’ajuster ses réponses en fonction des besoins de l’environnement cellulaire [51].
Tel que mentionné ci-dessus, KCC4 joue des rôles physiologiques variés en fonction du type cellulaire où il est exprimé, et ce, grâce aux changements qu’il produit dans le contenu ionique et hydrique des cellules. Dans les cellules intercalaires du rein, KCC4 participe à l’acidification urinaire distale en favorisant l’échange Cl--HCO3- grâce au maintien d’un Cli abaissé (figure 1-5). Le rôle de KCC4 in vivo est d’ailleurs illustré par le développement d’une acidose rénale tubulaire chez la souris KCC4-/- [53]. Dans l’appareil de Corti, KCC4 assure un rôle développemental important en participant au recyclage du K+. La souris KCC4-/- est d’ailleurs également sourde. Dans les vaisseaux, le cotransporteur pourrait moduler la contractilité des cellules vasculaires [54]. Dans les cellules musculaires, il pourrait servir au tamponnement de K+ extracellulaire qui s’accumule durant la contraction [55, 56]. Dans l’estomac, il pourrait aussi participer à la sécrétion d’acide
chlorhydrique dans la lumière en s’associant à la pompe H+/K+-ATPase présente dans la membrane apicale [30]. 6) Finalement, il a été proposé que KCC4 puisse aussi jouer le rôle de protéine d’échafaudage dans la progression tumorale. En effet, KCC4 s’associe avec Ezrin dans les cellules cancéreuses lors de la réorganisation du cytosquelette, contribuant ainsi au maintien de la forme et des propriétés adhésives des cellules qui sont essentielles pour la migration et l’invasion tumorales [57].
1.4.5 Gènes et protéines
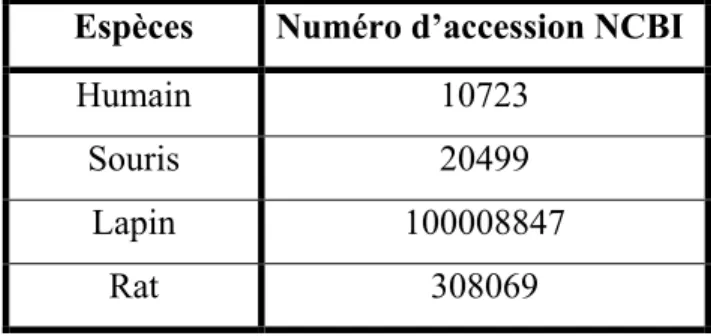
Le gène codant pour KCC4 se situe sur le locus chromosomique 5p15.3 chez l’humain, sur le chromosome 13 chez la souris et sur le chromosome 1 chez le lapin et le rat. Il est composé de 24 exons chez la plupart des espèces. Il s’étend sur plusieurs kb (61,65 humain, 53,05 souris, 4,47 lapin, 53,38 rat), produit des transcrits d’environ 5000 pb (5 272 humain, 5 131 souris, 4 331 lapin, 5 063 rat) et code pour une protéine d’environ 1000 acides aminés (1 083 humain, souris et rat, 1 106 lapin) [29] (les numéros d’accession NCBI de ces gènes sont listés dans le tableau 1-4).
Espèces Numéro d’accession NCBI
Humain 10723
Souris 20499
Lapin 100008847
Rat 308069
Figure 1-5 Implication de KCC4 dans la sécrétion de l’acide des cellules α-intercalaires (adapté de
Nature 416, 874-878, 2002
(CA II = anhydrase carbonique II).
Tableau 1-4 Numéros d’accession NCBI du gène codant pour KCC4 chez différentes espèces.
1.4.6 Structure
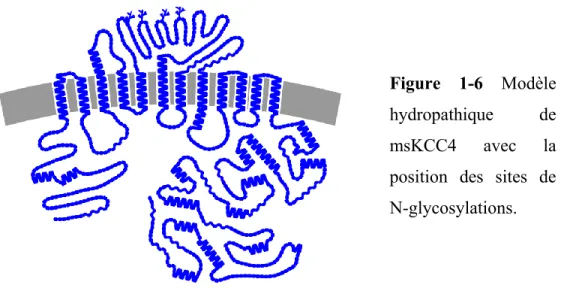
La structure générale de KCC4 ne diffère pas de celle des autres membres de la famille des CCC, soit 12 domaines transmembranaires flanqués d’extrémités N et C-terminales cytosoliques. Il y a 4 sites de N-glycosylation dans la large boucle extracellulaire présente entre le TM5 le TM6 [12] (figure 1-6). La protéine a un poids de ~150 kDa sous sa forme glycosylée et de ~120 kDa sous sa forme déglycosylée.
Outre une structure générale commune aux autres membres de la famille, KCC4 possède plusieurs caractéristiques structurales qui lui sont propres, surtout à ce qui à trait à la position des sites potentiels de phosphorylation. Entre autres, il y a 6 sites de phosphorylations pour la protéine kinase C, 1 site tyrosine kinase et 6 sites pour la caséine kinase II (sites prédits par « SIB Bioinformatics Resource Portal (ExPASy) » avec la ressource « Prosite »). Tel que mentionné plus tôt, rappelons aussi que KCC4 peut former des structures oligomériques avec les autres KCC de même qu’avec NKCC1, mais que la signification fonctionnelle de telles entités demeure inconnue à ce jour [35, 58].
1.4.7 Régulation
L’activité de KCC4 serait régulée par la phosphorylation et la déphosphorylation du cotransporteur, mais les intermédiaires signalétiques impliqués, dont certaines phosphatases ainsi que des WNK, ont été déduits surtout à partir d’évidences indirectes. Trois études
Figure 1-6 Modèle hydropathique de msKCC4 avec la position des sites de N-glycosylations.
principales ont été faites à ce sujet : deux de celles-ci portaient spécifiquement sur KCC4 tandis que la troisième portait principalement sur KCC3.
Dans la première étude parue en 2000, il a été montré que l’activation de KCC4 par l’hypotonicité est inhibée par la calyculine A (un inhibiteur de PP1 et de PP2A), mais que cette activation n’est pas affectée par l’acide okadaïque (un inhibiteur de PP2A seulement) ni par la cypermethrine (un inhibiteur de PP2B). Ceci suggère donc, de manière indirecte, que PP1 est la principale phosphatase impliquée dans la régulation de KCC4 [19].
Dans la deuxième étude parue en 2009, il a toutefois été montré que l’inhibition de KCC4 par la calyculine A en conditions hypo-osmolaires n’est pas associée à une augmentation importante du niveau de phosphorylation du transporteur, que celui-ci est aussi diminué suite à une augmentation du Cl-i et une diminution du volume cellulaire, mais qu’il demeure inchangé suite à une augmentation du volume cellulaire. Cette étude a aussi permis de montrer que KCC4 n’est pas phosphorégulé par les PKC sensibles au PMA. En effet, même si l’activité de KCC4 est diminuée de ~70 % par le PMA, son niveau de phosphorylation reste inchangé. Dans cette étude, où ce sont les niveaux de phosphorylation de la protéine complète qui ont été mesurés, il est proposé que la régulation de KCC4 n’implique pas comme acteur principal des phosphatases sensibles à la calyculine A ou des PKC sensibles au PMA [59].
Enfin, la troisième étude parue en 2009 et portant principalement sur KCC3, montre l’existence de deux résidus, les thréonines 991 et 1048, qui seraient déphosphorylés en condition hypotonique. De plus, la mutation de ces sites en résidus non-phosphorylables conduirait à une augmentation de l’activité de KCC3 en condition isotonique et hypotonique. Les résidus équivalents chez KCC4 correspondent aux thréonines 926 et 980 et des expériences faites avec des anticorps phosphospécifiques ont montré que la phosphorylation de ces sites était diminuée en présence d’un mélange de PP1/PP2A dans les cellules HEK-293. Il s’agirait donc ici de résultats contradictoires avec ceux obtenus précédemment [60]. En même temps, les techniques utilisées pour démontrer des changements de phosphorylation différaient entre les deux études.
La régulation de KCC4 par le pH n’a pas été étudiée de façon approfondie non plus. Des études ont montré que cette protéine est plus active lorsque le pH est inférieur à 7,5, ce qui est contraire aux autres KCC, suggérant qu’elle serait spécialisée pour fonctionner dans un environnement plus acide. Ces données sont compatibles avec un rôle important de KCC4 dans la physiologie de la cellule pariétale de l’estomac et α-intercalaire du tubule collecteur qui sont toutes deux impliquées dans la sécrétion d’ions H+ [51].
Enfin, il a récemment été montré que la glycosylation de KCC4 avait aussi un rôle à jouer dans la régulation du transporteur. Pour ce faire, les auteurs ont utilisé des mutants sur lesquels les quatre sites de glycosylation ont été mutés simultanément ou selon différentes combinaisons pour en étudier l’effet sur l’activité et l’expression de KCC4. Ils ont montré que les deux sites centraux (N331 et N344 chez la souris) étaient particulièrement importants pour l’expression à la surface de KCC4 et donc pour son activité [61].
1.5 Les WNK lysine deficient protein kinases 1.5.1 Généralités
Les WNK sont des sérine-thréonine kinases dont il existe 4 membres (WNK1 à WNK4). Le premier membre de la famille (WNK1) a été identifié en 2000 par Cobb et son équipe qui étaient alors à la recherche de nouvelles « mitogen-activated protein » (MAP) kinase [62]. Le nom de cette famille de kinases vient du fait que celles-ci possèdent la lysine catalytique dans le sous-domaine I tandis qu’on la retrouve habituellement dans le sous-domaine II. Les WNK sont impliquées dans la régulation de plusieurs systèmes de transport ionique. Entre autres, elles modulent l’activité et/ou l’expression du canal à Na+ (ENaC), le canal à K+ (ROMK) et certains membres de la famille des CCC. Elles possèdent plusieurs domaines importants qui leur confèrent de nombreuses fonctions biologiques [63].
1.5.2 Découverte
Le premier membre de la famille à avoir été cloné est en fait ce qu’on appelle aujourd’hui la forme longue de WNK1 (L-WNK1) et il l’a été à partir d’une banque ADNc de cerveau de rat [62]. L’année suivante, Verìssimo et Jordan ont identifié et obtenu des
clones incomplets des formes humaines de L-WNK1, WNK2, WNK3 et WNK4 par RT-PCR à partir de différents tissus [64]. Toujours en 2001, Wilson et al. ont obtenu les clones complets des formes humaines de L-WNK1 et WNK4 et ont aussi fait le lien entre ces kinases et une rare maladie appelée pseudohypoaldostéronisme de type 2 (PHAII) qui se manifeste par une hypertension et de l’hyperkaliémie [65]. En 2003, Delaloy et al. ont identifié et caractérisé une forme courte de WNK1 (KS-WNK1) qui est tronquée en N-terminal et qui est particulièrement abondante dans le rein. Dans la forme tronquée, qui est causée par la transcription du gène par un promoteur alternatif, les 437 premiers acides aminés de L-WNK1 sont remplacés par une séquence unique de 30 acides aminés et l’activité kinase est abolie [66]. Les formes complètes de WNK2 et de WNK3 ont finalement été clonées en 2007 [67] et 2003 [68] respectivement.
1.5.3 Gènes et protéines
Chez l’humain, c’est le gène WNK1 présent sur le chromosome 12p13 qui code pour WNK1, une protéine de 2 382 acides aminés sous sa forme longue et de 1 975 sous sa forme courte peuvent être produites [65, 66]. Chez l’humain toujours, les gènes WNK2 (9q22.3), WNK3 (Xp11.21-23) et WNK4 (17q) codent pour WNK2 [67], WNK3 [68] et WNK4 [65] respectivement, pour des protéines de 2 217, 1 743 ou 1 800 et 1 243 acides aminés. Il existe deux variantes de WNK3, causé par un épissage alternatif de l’exon 18 et 22. La première est fortement exprimée dans le rein, alors que la seconde est exprimée uniquement dans le cerveau. Il existe plusieurs autres isoformes de chacune des WNK, mais ils sont beaucoup moins abondants et leurs rôles demeurent inconnus.
1.5.4 Domaines importants
Les WNK possèdent plusieurs domaines importants qui permettent à la kinase d’avoir des modes d’action variés sur les protéines qu’elles régulent (figure 1-7). Le domaine kinase (en rose) est à l’extrémité N-terminale. C’est dans celui-ci qu’on retrouve le plus d’homologie (de 83 % à 93 %) entre les différents isoformes [64], quoique les quelques différences présentes confèrent aux WNK une certaine spécificité. Par exemple, WNK1 phosphoryle beaucoup plus efficacement la synaptotagmine, SPAK et OSR1 que
maintient l’activité kinase réprimée jusqu'à l’arrivée d’un signal d’activation. Une seconde modification peut aussi être nécessaire pour obtenir la pleine activation, il s’agit de l’autophosphorylation des résidus 378 et 382 (WNK1) dans la boucle d’activation du domaine kinase. Les domaines « coiled-coil » (en jaune) sont caractérisés par la répétition de sept résidus dans lequel le premier et le quatrième sont hydrophobes et le cinquième et le septième sont chargés ou polaires. Ils pourraient être responsables de nombreuses interactions protéines-protéines, dont celles entre les WNK incluant des interactions entre L-WNK1 et KS-WNK1 ou entre WNK3 et WNK4 [70]. Finalement, on retrouve des domaines riches en prolines (PXXP) qui lient des protéines qui sont souvent impliquées dans la modulation de plusieurs voies de signalisation. Le module le plus couramment lié par ce domaine est le « Src homology domain » 3 (SH3) [71].
Figure 1-7 Structure des hWNK avec les domaines importants, les sites de liaison de SPAK/OSR1 et les sites d’autophosphorylations présents sur WNK1 (Physiol Rev 91 :
177-219, 2011).
1.5.5 Fonctions générales
Les principales protéines de transport régulées par les WNK sont les membres de la famille des CCC, les canaux à K+ ROMK et maxi-K, le canal à Na+ ENaC ainsi que les canaux à Ca2+ de la sous-famille TRPV. Par contre, l’effet des différents WNK sur un système de transport donné peut se faire dans des directions opposées et impliquer des
mécanismes différents. Par exemple, WNK4 inhibe le NCC en bloquant l’insertion du CCC dans la membrane [72], tandis que WNK3 l’active en augmentant son niveau de phosphorylation indirectement [73]. C’est d’ailleurs des dysfonctions de la régulation par les WNK de différents systèmes de transport qui sont responsables du PHAII, de même que d’une forme héréditaire d’autisme. Dans le PHAII, par exemple, l’hypertension serait causée par une dérégulation de NCC menant à une augmentation de la réabsorption du NaCl dans le tubule distal, tandis que l’autisme serait causé par une dérégulation des transporteurs de Cl- (NKCC1 et les KCC) dans le cerveau. À cet effet, une large délétion sur le gène Xp11.22 a été identifiée chez deux frères autistiques [74].
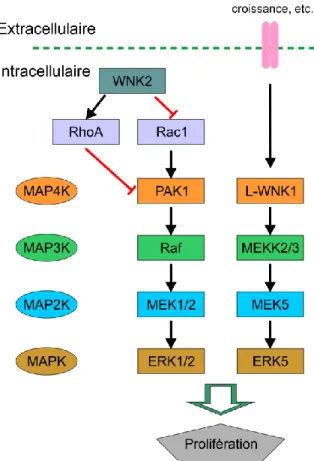
En plus de réguler les systèmes de transport ionique, les WNK sont aussi impliquées dans la voie des MAP kinases (figure 1-8). Cette voie débute par l’activation d’un récepteur par son ligand, finit par l’activation de la MAPK effectrice par la MAP2K spécifique et régule à son tour plusieurs facteurs de transcription. Dans le cas des WNK, les voies MAPK impliquées sont celles qui sont responsables de la prolifération cellulaire. Par exemple, il a été démontré que L-WNK1 conduit à la phosphorylation d’ERK5 en présence de MEKK2/3 et de MEK5, ce qui situe L-WNK1 au niveau des MAP4K, conduisant ainsi à la prolifération cellulaire [75]. Il a aussi été démontré que WNK2 était un régulateur négatif de la voie MAPK en modulant l’activité de RhoA et de Rac1, des GTPases qui agissent de manière opposée sur PAK1 (RhoA l’inhibe, et Rac1 l’active). Dans ce modèle de régulation, une augmentation de l’expression de WNK2 provoque une activation de RhoA et une inhibition de Rac1 menant à une inhibition de la voie ERK1/2 et donc à une diminution de la prolifération cellulaire [76]. WNK2 a d’ailleurs été identifiée comme un suppresseur de tumeur potentiel, car la réduction de son expression augmente la sensibilité à l’EGF et augmente l’activité d’ERK1/2, favorisant ainsi la progression du cycle cellulaire. En effet, la présence de WNK2 nuit à la phosphorylation de la Ser298 de MEK1, qui a un rôle important pour l’activation de la kinase [77], ce qui diminue la capacité de MEK1 à activer ERK1/2 en réponse à des facteurs de croissance. En conséquence, la baisse de l’expression de WNK2 favorise la prolifération cellulaire au dépend de la sénescence [67]. Plusieurs mutations somatiques dans les WNK ont aussi été associées au cancer [78].
Figure 1-8 Implication de L-WNK1 et de WNK2 dans la voie MAP kinase (adapté de
Physiol Rev, 2011 Jan, 91(1):177-219).
D’autres fonctions sont aussi attribuées aux WNK. Par exemple, WNK2 et WNK1 sont impliquées dans la régulation de l’exocytose par la phosphorylation de la synaptotagmine 2, une protéine qui agit à titre de senseur de Ca2+ afin de contrôler la sécrétion d’hormones et de neurotransmetteurs [79]. De même, WNK1 et WNK4 participent à la régulation par le TGF-β de la phosphorylation de SMAD2 [80]. Les mécanismes moléculaires de ces autres fonctions biologiques sont toutefois moins bien caractérisés.
1.5.6 Régulation
Le niveau d’activité des WNK peut être modulé de différentes façons. En effet, il a été montré que L-WNK1 était plus active en milieu hypo-osmolaire et hyperosmolaire, et que WNK4 était aussi plus active en milieu hyperosmolaire. En condition hyperosmolaire, par exemple, la sérine 382 de L-WNK1 devient phosphorylée, ce qui est requis pour
l’activation maximale de la kinase et permet sa relocalisation dans des vésicules [81]. Pour WNK4, il y a aussi une redistribution de la kinase en hypertonicité, mais dans un compartiment cellulaire qui n’a pas encore été identifié [82]. Mentionnons, finalement, que WNK1 et WNK3 sont capables de phosphoryler WNK4 in vitro, et que le domaine d’autoinhibition de WNK4 est capable d’inhiber l’activité catalytique de WNK1, WNK2 et WNK3 in vitro [73, 83].
1.6 WNK4 1.6.1 Découverte
Le clonage de WNK4 a été rendu possible en grande partie grâce à l’information contenue dans les banques génomiques et EST de différentes espèces. Une fois la séquence déduite par alignements et prédictions, des amorces ont été dessinées de manière à amplifier hWNK4 à partir de banques d’ADNc de reins humains [65].
1.6.2 Distribution
Tel que mentionné auparavant, WNK4 est exprimée dans le rein où elle se retrouve en abondance dans le tubule distal tout en diminuant progressivement à mesure que l’on se dirige vers l’anse ascendante large de Henle médullaire et cortical (mTAL et cTAL) et vers le canal collecteur. Elle a aussi été identifiée dans la macula densa et dans les podocytes du glomérule [84]. En dehors du rein, on la retrouve aussi dans les cellules polarisées de plusieurs autres organes tels que le testicule, le colon, le cœur, le foie, le cerveau, le poumon, la rate et la prostate [85].
Quant à la localisation cellulaire, deux observations s’opposent. D’une part, des études montrent que WNK4 colocalise avec un marqueur des jonctions intercellulaires (ZO-1) [65, 85] et d’autre part, une étude plus récente montre que WNK4 ne colocalise pas avec ZO-1 mais qu’elle se situe plutôt dans la partie subapicale du cytosol [86]. Il faut mentionner, toutefois, que la colocalisation de WNK4 avec le marqueur ZO-1 a été démontrée dans des reins de souris avec des anticorps dirigés contre la forme humaine de WNK4 alors que l’homologie des séquences antigéniques entre les deux espèces était
seulement de 60 %. Des études additionnelles devront être effectuées afin de confirmer la localisation cellulaire de WNK4.
1.6.3 Étude du gène
Dans le gène WNK4, on retrouve plusieurs îlots CpG entre la position -380 et +425 par rapport au codon d’initiation [63]. Les îlots CpG sont des structures sujettes à la méthylation et qui jouent donc un rôle clé dans la transcription [87, 88]. Dans certains cancers, des gènes suppresseurs de tumeur deviennent ainsi réprimés suite à la méthylation de ces structures [87]. Pour WNK4, aucune étude ne s’est penchée sur le rôle des îlots CpG dans la régulation transcriptionnelle de la kinase. Dans la séquence promotrice de WNK4, il a aussi deux éléments négatifs de réponse aux glucocorticoïdes, l’un en position -285 et l’autre en position -337, de même qu’un élément essentiel pour l’initiation de la transcription en position -1 par rapport au promoteur et plusieurs sites de liaisons potentiels pour des facteurs de transcription (GR, Sp1, AP-2α et C/EBP) [89]. Un deuxième isoforme a aussi été identifié dans le cerveau de la souris. Ce dernier possède une séquence différente en C-terminal [90].
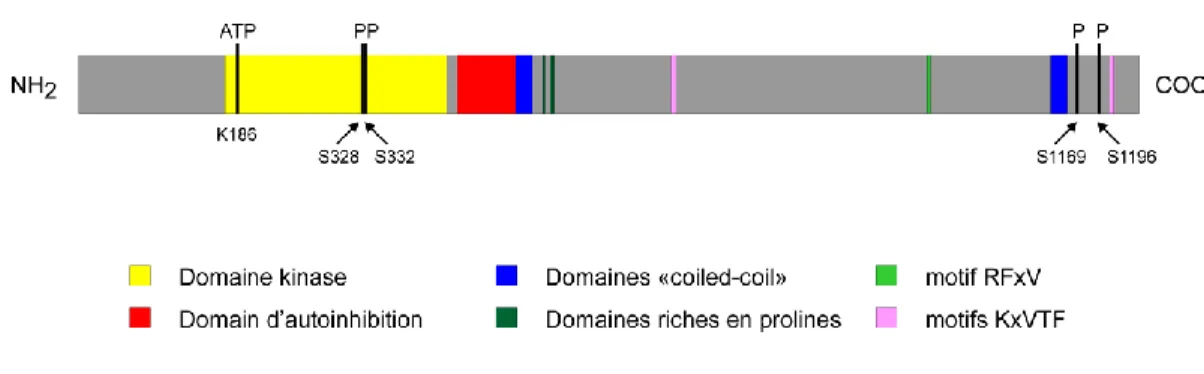
1.6.4 Structure
Comme il a déjà été mentionné, WNK4 est une kinase de 1 243 acides aminés composés des plusieurs domaines importants (figure 1-9). Cependant, la majorité des informations concernant la structure précise de WNK4 sont déduites par homologie de séquences avec L-WNK1, qui est le membre de la famille le mieux caractérisé.
Le domaine kinase inclut les acides aminés 174 à 432, et la lysine catalytique responsable de la liaison à l’ATP se trouve à la position 186. Comme pour WNK1, il y a aussi deux sérines (S328 et S332) qui doivent être phosphorylées pour permettre la pleine activation de la kinase [91].
Le domaine d’autoinhibition, lui, se trouve en C-terminal du domaine kinase et est composé de 70 acides aminés (résidus 443 à 513). Tout comme pour L-WNK1, il inclut deux phénylalanines conservées qui jouent un rôle important dans l’activité de ce domaine [69], comme celui de diminuer l’autophosphorylation de L-WNK1 in vitro [83].
Pour ce qui est des domaines d’interaction en C-terminal, on retrouve deux « coiled-coil » putatifs chez WNK4, l’un juste après le domaine d’autoinhibition et le second en C-terminal de la protéine [92], et trois domaines adjacents riches en prolines (PXXP) débutant aux résidus P545, P552 et P555. Ces derniers réguleraient à la baisse l’expression de ROMK en interagissant avec l’intersectine (ITSN1), une protéine d’échafaudage impliquée dans l’endocytose [93]. Un autre motif, de type RFXV (résidus 996 à 999), est capable de se lier à un domaine conservé du C-terminus (appelé CCT) de SPAK et OSR1 [90], deux kinases qui sont impliquées dans la régulation par les WNK de plusieurs systèmes de transport. Finalement, WNK4 possède 47 acides aminés (résidus 1 175 à 1 222) qui sont essentiels pour la régulation négative de NCC [94] et deux sites de liaison pour la protéine phosphatase de type 1 (PP1) entre les résidus 695-699 (KMVTF) et 1211-1215 (KGVTF) [95].
1.6.5 Régulation
Une étude effectuée chez la souris a montré que le nombre de transcrits produits à partir du gène codant pour WNK4 pouvait aussi changer suite à une modification en électrolytes de la diète. En effet, il a été observé que la quantité d’ARNm de WNK4 présente dans le rein augmente suite à une diète riche en K+, mais qu’elle demeure inchangée suite à une diète faible en K+ ou une diète riche ou faible en Na+, et ce, indépendamment de l’aldostérone. Pour expliquer cette augmentation de l’expression, les auteurs proposent le modèle suivant : l’augmentation de WNK4 conduit à une plus forte