JEAN-LIONEL PAYEUR-POIRIER
FLUX DE CO
2D’UNE CHRONOSÉQUENCE
D’ÉCOSYSTÈMES D’ÉPINETTE NOIRE DE LA
FORÊT BORÉALE DE L’EST DE L’AMÉRIQUE DU
NORD
Mémoire présenté
à la Faculté des études supérieures de l’Université Laval dans le cadre du programme de Maîtrise en sciences forestières
pour l’obtention du grade de Maître ès sciences (M. Sc.)
DÉPARTEMENT DES SCIENCES DU BOIS ET DE LA FORÊT FACULTÉ DE FORESTERIE, DE GÉOGRAPHIE ET DE GÉOMATIQUE
UNIVERSITÉ LAVAL QUÉBEC
2011
Résumé court
Les flux de dioxyde de carbone (CO2) d’une chronoséquence de récolte d’écosystèmes d’épinette noire de la forêt boréale de l’Est de l’Amérique du Nord ont été mesurés sur une période d’un an. Sur une base annuelle, le site pré-récolte (105 ans) était un faible puits de carbone (6 ± 4 g C m-2 an-1), le site récemment récolté (8 ans) était une source (-87 ± 3 g C m-2 an-1) et le site juvénile (33 ans) était un puits moyen à fort (143 ± 35 g C m-2 an-1). La production primaire brute (GEP) annuelle au site pré-récolte était seulement 28% plus élevée qu’au site récemment récolté. Celle au site juvénile était 71% plus élevée que la GEP annuelle au site pré-récolte, ce qui suggère une limitation physiologique de la photosynthèse au site pré-récolte. La respiration annuelle de l’écosystème (Re) ainsi que la respiration annuelle du sol (Rs) ont suivi la même tendance mais les différences entre sites étaient moindres. Le Q10 et le R10 moyen de la Rs étaient différents entre les sites et semblaient reliés à la GEP annuelle. Le rapport annuel de la Rs à la Re était plus bas au site juvénile qu’au site pré-récolte et au site récemment récolté. Ces résultats caractérisent l’évolution des processus physiologiques majeurs influençant le cycle du carbone des écosystèmes boréaux d’épinette noire suite à la récolte et devraient être utiles à l’incorporation des effets de l’âge des écosystèmes dans les modèles régionaux et globaux.
Mots-clés: forêt boréale; flux de CO2; aménagement forestier; chronoséquence; récolte; respiration du sol; covariance de turbulences
Résumé long
L’aménagement forestier perturbe le cycle du carbone des écosystèmes de la forêt boréale. Les deux principales composantes de ce cycle, soit la photosynthèse et la respiration, déterminent l’état de puits ou de source de carbone d’un écosystème. Cet état varie en fonction des conditions édapho-climatiques mais est principalement influencé par le stade de développement d’un écosystème.
En Amérique du Nord, l’aménagement forestier influe sur la superficie relative de parterres de coupe, de peuplements juvéniles et de peuplements matures. La quantification de la perturbation du cycle du carbone des écosystèmes forestiers boréaux induite par l’aménagement forestier est nécessaire à l’estimation du bilan en carbone de la forêt boréale et à l’établissement de prédictions concernant les variations de ce bilan en carbone dans un contexte de changement climatique. C’est pourquoi les flux de dioxyde de carbone (CO2) d’une chronoséquence de récolte d’écosystèmes d’épinette noire (Picea mariana (Mill.) B.S.P.) de la forêt boréale de l’Est de l’Amérique du Nord ont été mesurés sur une période d’un an à l’aide de la technique par covariance de turbulences à l’échelle de l’écosystème et l’efflux de CO2 des sols a été mesuré à l’aide d’un analyseur de gaz à infrarouges portable. L’objectif de l’étude était de quantifier les composantes du bilan annuel en carbone des sites afin d’identifier les processus physiologiques majeurs contribuant au passage d’une source à un puits de carbone suivant la récolte.
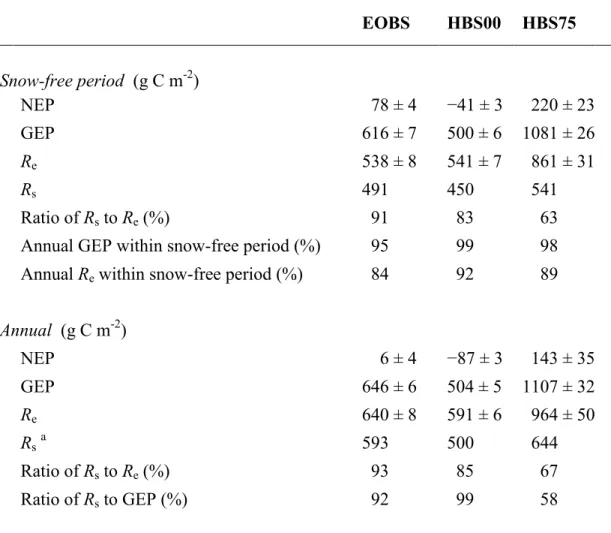
Sur une base annuelle, le site pré-récolte (105 ans) était un faible puits de carbone (6 ± 4 g C m-2 an-1), le site récemment récolté (8 ans) était une source (-87 ± 3 g C m-2 an-1) et le site juvénile (33 ans) était un puits moyen à fort (143 ± 35 g C m-2 an-1). La production primaire brute (GEP) annuelle au site pré-récolte était seulement 28% plus élevée qu’au site récemment récolté (646 ± 6 contre 504 ± 5 g C m-2 an-1). La GEP annuelle au site juvénile (1107 ± 32 g C m-2 an-1) était 71% plus élevée que la GEP annuelle au site pré-récolte, ce qui suggère une limitation physiologique de la photosynthèse au site pré-récolte. La respiration de l’écosystème (Re) annuelle a suivi la même tendance mais les différences entre sites étaient moindres (640 ± 8 à 591 ± 6 à 964 ± 50 g C m-2 an-1). Le facteur de
sensibilité aux variations de la température du sol de la respiration du sol (Q10) et le taux moyen de respiration du sol de base (R10) pour la période sans neige étaient différents entre les sites et étaient les plus bas au site récemment récolté. Le Q10 et le R10 de la respiration du sol (Rs) semblaient reliés à la GEP annuelle. La Rs annuelle a diminué suivant la récolte et a augmenté avec le temps depuis la récolte (593 à 500 à 644 g C m-2 an-1). Le rapport annuel de la Rs à la Re était plus bas au site post-récolte qu’aux deux autres sites (67% contre 93% et 85%). Ces résultats caractérisent l’évolution des processus physiologiques majeurs influençant le cycle du carbone des écosystèmes boréaux d’épinette noire suite à la récolte et devraient être utiles à l’incorporation des effets de l’âge des écosystèmes dans les modèles régionaux et globaux.
Abstract
Forest harvest and subsequent stand development can have major effects on the carbon cycle of boreal stands. Carbon dioxide (CO2) fluxes of a three-point black spruce harvest chronosequence located in the boreal forest of eastern North America were measured over a one-year period at the ecosystem scale with the eddy covariance technique and CO2 efflux from soils was measured with a portable infrared gas analyzer. The three sites (pre-harvest, recently-harvested, and juvenile) were 105-, 8- and 33-years old, respectively. On an annual basis, the pre-harvest site (EOBS) was a weak carbon sink (6 ± 4 g C m-2 yr-1), the recently-harvested site (HBS00) a source (-87 ± 3 g C m-2 yr-1) and the juvenile site a moderate to strong sink (143 ± 35 g C m-2 yr-1). Annual gross ecosystem production (GEP) at the pre-harvest site was only 28% greater than at the recently-pre-harvested site (646 ± 6 versus 504 ± 5 g C m-2 yr-1) while GEP at the juvenile site (1107 ± 32 g C m-2 yr-1) was 71% greater than at the pre-harvest site, suggesting significant physiological constraints to photosynthesis at the pre-harvest site. Annual ecosystem respiration (Re) followed the same pattern, but intersite differences were somewhat less (640 ± 8 to 591 ± 6 to 964 ± 50 g C m-2 yr-1). Annual soil respiration (Rs) decreased following harvest from 593 to 500 g C m-2 yr-1 and increased with further stand development to 644 g C m-2 yr-1, although the changes were less than for GEP and Re. Q10 and R10 of Rs for the snow-free period varied between sites, were lowest for the recently-harvested site and appeared to be related to GEP via substrate supply. The annual ratio of Rs to Re was lower for the juvenile site (67%) than for the pre-harvest and recently-pre-harvested sites (93 and 85%, respectively). These results quantify how some of the major physiological processes that influence the carbon cycle of boreal black spruce stands evolve following harvest and should be useful for better incorporating stand-age effects into regional and global scale models.
Keywords: boreal forest; CO2 fluxes; harvest; chronosequence; disturbance; soil respiration; eddy covariance
Avant-Propos
Je tiens tout d’abord à remercier Carole Coursolle, coordonatrice du Programme Canadien du Carbone (PCC), dont la contribution à la rédaction du présent mémoire fût très appréciée. Elle a su codiriger avec efficacité le projet de maîtrise dont le présent mémoire résulte tout en maintenant un côté humain à la tâche. Je remercie également Hank Margolis, directeur du Programme Canadien du Carbone, de m’avoir offert la chance de continuer mes études dans le cadre du PCC, d’avoir dirigé ce projet de maîtrise et de m’avoir fait bénéficier de son expérience en recherche scientifique par ses judicieux commentaires et conseils. Mes remerciements vont également à Marc-André Giasson, professionnel de recherche au Programme Canadien du Carbone, dont les connaissances, la persévérance et la patience m’ont permis d’en apprendre énormément sur une panoplie de domaines de la recherche scientifique. Je tiens également à remercier Debra Christiansen-Stowe, professionnelle de recherche au PCC, Sylvie Carles, stagiaire post-doctorale, Sébastien Dagnault, technicien forestier au Service Canadien des Forêts, et Guillaume Drolet, candidat au doctorat au PCC, de leur aide ponctuelle et combien appréciée pour la réalisation de ce projet de maîtrise. Mes remerciements vont à Pierre Bernier, chercheur scientifique au Service Canadien des Forêts, et à Steeve Pépin, professeur à la Faculté des sciences de l'agriculture et de l'alimentation de l’Université Laval, d’avoir accepté d’évaluer ce mémoire.
Je remercie également les organismes qui subventionnent le PCC, soit la Fondation canadienne pour les sciences du climat et de l'atmosphère, BIOCAP Canada, Environnement Canada et Ressources Naturelles Canada.
Table des matières
Résumé court ... i
Résumé long ... ii
Abstract ... iv
Avant-Propos ... vi
Table des matières ... vii
Liste des tableaux ... x
Liste des figures ... xi
Définition des acronymes ... xii
INTRODUCTION GÉNÉRALE ... 1
Bibliographie ... 5
CHAPITRE 1 – REVUE DE LITTÉRATURE ... 7
1. Le cycle du carbone ... 7
1.1 Le carbone ... 7
1.2 Le cycle global du carbone ... 8
1.3 Le cycle du carbone de l’écosystème forestier ... 12
1.3.1 La production nette de l’écosystème ... 12
1.3.2 La production primaire brute de l’écosystème ... 13
1.3.3 La respiration de l’écosystème ... 15
2. La respiration du sol ... 17
2.1 Processus ... 17
2.2 Facteurs de variabilité ... 18
2.3 Thèmes de recherche actuels ... 21
3. La forêt boréale ... 23
3.1 Principales caractéristiques ... 24
3.2 Le cycle du carbone de la forêt boréale ... 27
3.2.1 Effets de l’aménagement forestier sur le cycle du carbone de la forêt boréale ... 31
4. Les flux de dioxyde de carbone et leur mesure ... 32
4.1 La turbulence dans la couche limite planétaire ... 32
4.2 Techniques de mesure des flux de dioxyde de carbone ... 34
4.3 La technique par covariance de turbulences ... 34
4.3.1 Théorie ... 34
4.3.2 Instruments requis ... 38
5. La mesure de la respiration du sol ... 40
5.1 Techniques de mesure de la respiration du sol ... 40
5.2 La technique par chambre dynamique fermée ... 41
5.2.1 Théorie ... 41
5.2.2 Avantages et inconvénients ... 42
6. Les études par chronoséquence ... 43
7. Contexte et pertinence de la présente étude ... 44
8. Objectifs et hypothèses de recherche ... 45
8.1 Objectifs de recherche ... 45
8.2 Hypothèses de recherche ... 45
Bibliographie ... 47
CHAPITRE 2 – CO2 FLUXES OF A BOREAL BLACK SPRUCE CHRONOSEQUENCE IN EASTERN NORTH AMERICA ... 62
Abstract ... 63
1. Introduction ... 64
2. Methods ... 66
2.1 Site description ... 66
2.2 Ecosystem CO2 fluxes ... 67
2.3 Soil respiration ... 68
2.4 Environmental conditions ... 69
2.5 Soil properties ... 70
2.6 Leaf area index ... 71
2.7 Data Analysis ... 71
2.7.1 Ecosystem CO2 fluxes ... 71
2.7.2 Soil respiration modelling and scaling ... 73
2.7.3 Maximum rate of photosynthesis, growing season length and snow-free period 75 3. Results ... 76
3.1 Environmental conditions ... 76
3.2 Soil properties ... 77
3.3 Annual and seasonal ecosystem CO2 fluxes ... 77
3.4 Soil respiration ... 78
3.4.1 Soil respiration model and temperature sensitivity ... 78
3.4.2 Annual and seasonal soil respiration ... 79
4. Discussion ... 80
4.1 Ecosystem CO2 fluxes ... 80
4.2 Soil respiration ... 82
4.2.1 Soil respiration model and temperature sensitivity ... 82
4.2.2 Soil respiration along the chronosequence ... 84
4.3 Contribution of soil respiration to ecosystem respiration ... 86
5. Conclusions ... 87
Acknowledgements ... 88
References ... 89
Tables and Figures ... 98
CONCLUSION GÉNÉRALE ... 110
Sommaire des résultats ... 110
Implications des résultats ... 111
Limites de l’étude ... 113
Recommandations pour des travaux de recherche ultérieurs ... 114
Liste des tableaux
Tableau 2.1 − Selected stand and soil characteristics of the pre-harvest (EOBS), recently-harvested (HBS00) and juvenile (HBS75) sites.
Tableau 2.2 − Environmental conditions for the 2008 snow-free period at the pre-harvest (EOBS), recently-harvested (HBS00) and juvenile (HBS75) sites.
Tableau 2.3 − Snow-free period and annual totals of net ecosystem production (NEP), gross ecosystem production (GEP), ecosystem respiration (Re) and soil respiration (Rs) at the pre-harvest (EOBS), recently-harvested (HBS00) and juvenile (HBS75) sites.
Tableau 2.4 − Parameters derived from Eq. (3) and estimates of Q10 and R10 values for soil respiration over the snow-free period at the pre-harvest (EOBS), recently-harvested (HBS00) and juvenile (HBS75) sites.
Liste des figures
Fig. 1.1 − Principaux flux et stocks de carbone annuels moyens (gigatonne par année, Gt C an-1) de la décennie 1990.
Fig. 1.2 − L’étendue circumpolaire de la forêt boréale.
Fig. 2.1 − Daily mean soil temperature at 10-cm depth (Ts10cm) and daily mean soil water content at 5-cm depth (SWC5cm) at the pre-harvest (EOBS), recently-harvested (HBS00) and juvenile (HBS75) sites as a function of time (day of year (DOY) and month) over the 2008 snow-free period.
Fig. 2.2 − Daily gross ecosystem production (GEP), ecosystem respiration (Re) and net ecosystem production (NEP), respectively, at the (a, d, g) pre-harvest (EOBS), (b, e, h) recently-harvested (HBS00) and (c, f, i) juvenile (HBS75) sites as a function of time (day of year, DOY) over the 2008 snow-free period.
Fig. 2.3 − Measured soil respiration (Rs) of ecoplots as a function of soil temperature (Ts15cm, near collar) at the (a) pre-harvest (EOBS), (b) recently-harvested (HBS00) and (c) juvenile (HBS75) sites.
Fig. 2.4 − Measured soil respiration of ecoplots (Rs, □, ◊, ●) and modelled daily mean soil respiration (Rs, −) at the (a) pre-harvest (EOBS), (b) recently-harvested (HBS00) and (c) juvenile (HBS75) sites as a function of time (day of year, DOY) over the 2008 snow-free period.
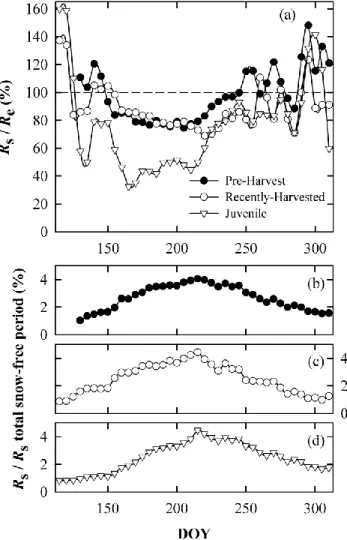
Fig. 2.5 − Ratio of (a) daily mean soil respiration (Rs) to daily mean ecosystem respiration (Re) at the pre-harvest (EOBS), recently-harvested (HBS00) and juvenile (HBS75) sites and (b, c, d) daily mean soil respiration to total snow-free period soil respiration as a function of time (day of year, DOY) over the 2008 snow-free period (5-day running means).
Fig. 2.6 – Q10 and average (Avg) R10 for soil respiration as a function of annual gross ecosystem production (GEP). Error bars represent the standard error (SE) of the values.
Définition des acronymes
C Carbone
CCP Canadian Carbon Program CLP Couche limite planétaire CSC Campbell Scientific Canada
EC Eddy covariance (Covariance de turbulences) EOBS Eastern old black spruce (site pré-récolte)
Fc Flux de CO2
GEP Gross ecosystem production (Production primaire brute de l’écosystème) HBS00 Harvested black spruce 2000 (site récemment récolté)
HBS75 Harvested black spruce 1975 (site post-récolte)
IRGA Infrared gas analyzer (Analyseur de gaz à infrarouges) LAI Leaf area index (Indice de surface foliaire)
LUE Light use efficiency (Efficacité de l’usage de la lumière) NBP Net biome production (Production nette du biome) NEE Net ecosystem exchange (Échange net de l’écosystème) NEP Net ecosystem production (Production nette de l’écosystème)
PAR Photosynthetically active radiation (Radiation photosynthétiquement active) PCC Programme Canadien du Carbone
PPFD Photosynthetic photon flux density (Densité du flux de photons photosynthétiques)
Q10 Facteur de multiplication du taux de respiration du sol pour chaque augmentation de 10 ºC de la température du sol
R10 Taux de respiration du sol de base (taux de respiration du sol à 10 ºC, température du sol)
Ra Respiration autotrophique (dans le Chapitre 2, respiration autotrophique de la partie aérienne de la végétation)
Re Respiration de l’écosystème
Rh Respiration hétérotrophique
Rr Respiration rhizosphérique
Rs Respiration du sol
Sc CO2 storage (Accumulation de CO2)
SWC5cm Soil water content (Contenu en eau du sol, volumétrique) à 5 cm de profondeur
SWC15cm Soil water content (Contenu en eau du sol, volumétrique) intégré sur15 cm de profondeur, près du collet de respiration du sol
Ta Température de l’air
Ts10cm Température du sol à 10 cm de profondeur
Ts15cm Température du sol à 15 cm de profondeur, près du collet de respiration du sol
INTRODUCTION GÉNÉRALE
Le carbone est l’élément de base des molécules desquelles dépend toute forme de vie sur la planète Terre. Il est présent dans toutes les sphères de l’environnement et est transféré entre ces sphères selon un cycle, soit le cycle global du carbone. Certaines des caractéristiques de l’environnement des êtres vivants peuvent être modifiées par une variation de la concentration en carbone de l’environnement. La concentration de l’atmosphère en composés de carbone sous forme gazeuse détermine la capacité de la planète Terre à évacuer une partie de l’énergie qu’elle reçoit par le rayonnement solaire. Depuis des millénaires, la variation de cette concentration, résultant de la variation des taux de transfert de carbone, conditionne la variation de la température moyenne globale, et ainsi le cycle de glaciation−déglaciation (Falkowski et al., 2000).
Depuis environ le début de l’ère industrielle, les activités humaines perturbent le cycle global du carbone principalement par l’émission de dioxyde de carbone (CO2) provenant de la combustion d’énergie fossile et par le changement d’affectation des terres. La conséquence majeure de cette perturbation est une augmentation de la concentration en CO2 de l’atmosphère, qui est passée de 280 parties par million (ppm) à l’ère préindustrielle à 379 ppm en 2005 (IPCC, 2007). Cette valeur de concentration en CO2 de l’atmosphère n’a pas été atteinte depuis au moins des centaines de milliers d’années et on croit que le taux d’augmentation actuel n’a jamais été égalé. Ces conditions pourraient induire une variation significative de la température moyenne globale et ainsi modifier l’environnement terrestre.
Le flux net annuel de CO2 entre l’atmosphère et les autres sphères environnementales est moins élevé que les émissions annuelles de CO2 de source anthropogénique, ce qui cause une accumulation dans l’atmosphère. Cependant, par la photosynthèse, la végétation terrestre retire de l’atmosphère en moyenne un tiers du CO2 émis annuellement par
l’activité humaine. La forêt contient la grande majorité de cette végétation. La capacité de la forêt à séquestrer le carbone dépend de son développement et des perturbations qui s’y produisent. La croissance de la forêt est associée à une plus grande capacité tandis que la perturbation de la forêt ou la stagnation de sa croissance est associée à une diminution de sa capacité de séquestration (Hyvönen et al., 2007).
Les observations indiquent que, sur une base annuelle, la forêt boréale semble généralement être un puits de CO2 (Bonan, 2008). Sa vaste étendue compense pour son faible taux moyen de séquestration. Cependant, deux caractéristiques la rendent apte à devenir une source de CO2: son important stock de carbone et l’importance des perturbations qui s’y produisent. Le feu, les épidémies d’insectes et l’aménagement forestier induisent des émissions de CO2 qui influencent grandement le bilan en carbone de la forêt boréale (Kurz et al., 2008). De plus, la forêt boréale est située à des latitudes où, selon les prédictions, l’augmentation de la température moyenne sera la plus grande. Cette augmentation proviendra en partie d’une modification de l’albédo moyen des écosystèmes par des changements dans la couverture de neige. Piao et al. (2008) ont estimé qu’une augmentation significative de la température automnale des écosystèmes nordiques résultera en une diminution de leur capacité à séquestrer le carbone annuellement.
L’augmentation à court terme de la capacité de séquestration de carbone de la forêt boréale peut être considérée comme un élément de la solution au problème du réchauffement climatique. Cependant, cette augmentation nécessite préalablement une augmentation de la surface foliaire de la forêt boréale, étant donné la forte relation existant entre la surface foliaire d’un écosystème et sa capacité de séquestration de carbone (Gower, 2003). En forêt boréale, une augmentation de la surface foliaire peut se traduire par une diminution de l’albédo, puisque la proportion de neige (ayant un albédo plus élevé que les feuilles de la végétation) exposée au soleil diminue généralement. Une diminution de l’albédo résulte en une plus grande absorption par la surface terrestre du rayonnement solaire et, conséquemment, du réchauffement de l’environnement terrestre (Randerson et al., 2006). L’augmentation de la capacité de séquestration de carbone de la forêt boréale peut donc contribuer au réchauffement climatique. Toutefois, une augmentation de la surface foliaire
de la forêt boréale peut résulter en une augmentation des taux d’évapotranspiration et ainsi faire augmenter la concentration en vapeur d’eau de l’atmosphère. À l’aide d’un modèle du transfert radiatif, Spracklen et al. (2008) ont rapporté qu’un plus grand taux de formation de nuages pourrait s’ensuivre, ce qui ferait augmenter l’albédo global. Dépendamment des régions, la forêt boréale pourrait alors contribuer ou mitiger le réchauffement climatique.
La diminution des émissions de CO2 de la forêt boréale peut également être considérée comme un élément de la solution au problème du changement climatique. L’humain peut, jusqu’à un certain point, y contribuer en adoptant des pratiques d’aménagement forestier à faibles émissions de CO2. Un premier pas à faire dans cette direction est de mesurer les émissions de CO2 induites par les pratiques d’aménagement forestier en vigueur afin d’établir une base de comparaison et de comprendre les processus sous-jacents à ces émissions. En vertu des résultats de cette analyse, l’humain pourra modifier ses pratiques d’aménagement forestier afin de réduire les émissions de CO2 qu’elles induisent et ainsi contribuer à mitiger la modification de l’environnement terrestre.
Le premier Chapitre de ce mémoire consiste en une revue de littérature. Le cycle global du carbone y est brièvement décrit et une attention particulière est portée au cycle du carbone de l’écosystème forestier. La section 2 porte sur la respiration du sol. Les caractéristiques de la forêt boréale font l’objet de la section 3. Les effets des perturbations, notamment de l’aménagement forestier, sur le cycle du carbone de la forêt boréale y sont détaillés. Suivent des sections portant sur la mesure des flux de CO2, notamment par la technique par covariance de turbulences, et la mesure de la respiration du sol. La section 6 porte sur les études par chronoséquence et la section 7 décrit le contexte de l’étude présentée au Chapitre 2 du présent mémoire. Finalement, les objectifs et hypothèses de recherche de cette étude sont présentés à la section 8.
Le deuxième Chapitre du présent mémoire est présenté sous la forme d’un article scientifique et a été rédigé dans la langue anglaise. L’étude dont ce Chapitre résulte porte
sur les effets de l’aménagement forestier sur les flux de CO2 d’écosystèmes d’épinette noire de la forêt boréale de l’Est de l’Amérique du Nord.
La conclusion générale présente un sommaire des résultats, leurs implications, les limites de l’étude et certaines recommandations et suggestions pour des travaux de recherche ultérieurs.
Bibliographie
Bonan, G.B., 2008. Forests and climate change: forcings, feedbacks, and the climate benefits of forests. Science 320, 1444−1449.
Falkowski, P., Scholes, R.J., Boyle, E., Canadell, J., Canfield, D., Elser, J., Gruber, N., Hibbard, K., Högberg, P., Linder, S., Mackenzie, F.T., Moore III, B., Pedersen, T., Rosenthal, Y., Seitzinger, S., Smetacek, V., Steffen, W., 2000. The global carbon cycle: a test of our knowledge of Earth as a system. Science 290, 291−295. Gower, S.T., 2003. Patterns and mechanisms of the forest carbon cycle. Annu. Rev.
Environ. Resour. 28, 169–204.
Hyvönen, R., Ågren, G.I., Linder, S., Persson, T., Cotrufo, M.F., Ekblad, A., Freeman, M., Grelle, A., Janssens, I.A., Jarvis, P.G., Kellomäki, S., Lindroth, A., Loustau, D., Lundmark, T., Norby, R.J., Oren, R., Pilegaard, K., Ryan, M.G., Sigurdsson, B.D., Strömgren, M., van Oijen, M., Wallin, G., 2007. The likely impact of elevated [CO2], nitrogen deposition, increased temperature and management on carbon sequestration in temperate and boreal forest ecosystems: a literature review. New Phytol. 173, 463–480.
IPCC (International Panel on Climate Change), 2007. Climate Change 2007: Synthesis Report−Contribution of Working Groups I, II and III to the Fourth Assessment Report of the Intergovernmental Panel on Climate. IPCC, Genève, Suisse, 104 p. Kurz, W.A., Stinson, G., Rampley, G.J., Dymond, C.C., Neilson, E.T., 2008. Risk of
natural disturbances makes future contribution of Canada’s forests to the global carbon cycle highly uncertain. Proc. Natl. Acad. Sci. USA 105, 1551–1555.
Piao, S., Ciais, P., Friedlingstein, P., Peylin, P., Reichstein, M., Luyssaert, S., Margolis, H., Fang, J., Barr, A., Chen, A., Grelle, A., Hollinger, D.Y., Laurila, T., Lindroth, A.,
Richardson, A.D., Vesala, T., 2008. Net carbon dioxide losses of northern ecosystems in response to autumn warming. Nature 451, 49-53.
Randerson, J.T., Liu, H., Flanner, M.G., Chambers, S.D., Jin, Y., Hess, P.G., Pfister, G., Mack, M.C., Treseder, K.K., Welp, L.R., Chapin, F.S., Harden, J.W., Goulden, M.L., Lyons, E., Neff, J.C., Schuur, E.A.G., Zender, C.S., 2006. The impact of boreal forest fire on climate warming. Science 314, 1130-1132.
Spracklen, D.V., Bonn, B., Carslaw, K.S., 2008. Boreal forests, aerosols and the impacts on clouds and climate. Phil. Trans. R. Soc. 366, 4613-4626.
CHAPITRE 1 – REVUE DE LITTÉRATURE
1. Le cycle du carbone
1.1 Le carbone
Le carbone est un élément qui se trouve en milieu naturel dans les différentes sphères de l’environnement, soit la lithosphère (croûte terrestre), l’hydrosphère (eau), la biosphère (organismes vivants et sols), l’atmosphère (air) et la cryosphère (eau gelée, dans l’air qu’elle contient). L’atome de carbone se compose de six neutrons (particule de noyau électriquement neutre), six protons (particule de noyau chargée d’électricité positive) et six électrons (particule fondamentale portant une charge électrique négative), ce qui lui donne une masse atomique de 12 dans la Table périodique des éléments. Trois caractéristiques rendent le carbone apte à être un élément majeur du cycle global des éléments: il est classifié comme non-métal, il n’a que quatre électrons de valence et il a un faible numéro atomique. Or, les non-métaux forment généralement des liaisons covalentes entres eux ainsi que des liaisons ioniques avec les métaux tandis que les métaux forment généralement seulement des liaisons ioniques avec les non-métaux. L’espace disponible pour quatre autres électrons sur la couche de valence du carbone permet l’interaction avec au plus quatre autres atomes ce qui rend possible la création d’une panoplie de composés chimiques. Lorsque des atomes de carbone se lient entre eux, d’énormes chaînes de carbone qui servent de base aux composés vitaux des êtres vivants sont créées.
Le carbone est inévitablement associé à la vie, puisque la plupart des molécules biologiques sont formées à partir de chaînes de carbone et les tissus des êtres vivants sont faits de ces molécules. De plus, tant que le carbone n’est pas oxydé (COx), les composés de carbone renferment de l’énergie qui peut être utilisée par les êtres vivants pour leur croissance ou la maintenance de leur métabolisme. L’environnement dans lequel vivent la
grande majorité des êtres vivants est régulé par les échanges de carbone. Certains chercheurs estiment même que la diversité biologique reflète la diversité des composés de carbone et de leurs interactions (Mackenzie et Lerman, 2006; Mannion, 2006; Adams, 2007).
On estime que la planète Terre contient 1023 grammes de carbone (g C) dont ~80% se trouvent dans les roches sédimentaires sous forme de composés organiques et de carbonates (Schlesinger, 1997). Les gisements d’énergie fossile (pétrole, gaz naturel, charbon) sont classifiés comme roches sédimentaires, même s’ils résultent de l’accumulation de matière organique végétale. Près de la surface terrestre, le carbone se trouve dans les océans, rivières, lacs et eaux souterraines (hydrosphère), principalement sous forme de carbone inorganique dissous. Dans la biosphère, la majorité du carbone est contenue dans les tissus végétaux, la matière organique du sol et les tissus du phytoplancton. L’atmosphère constitue un important réservoir de carbone, où il se trouve principalement sous forme de CO2 mais également sous forme de méthane (CH4) et de monoxyde de carbone (CO). L’atmosphère et les océans ont en commun une certaine homogénéité de la répartition spatiale des différents composés de carbone, mais l’atmosphère contient ~50 fois moins de carbone que les océans (Mackenzie et Lerman, 2006; Mannion, 2006; Jacques et Saugier, 2008).
1.2 Le cycle global du carbone
Selon le dictionnaire (Larousse, 2005), un cycle est défini comme une « suite
ininterrompue de phénomènes qui se renouvellent dans un ordre immuable ». Dans le cas
du cycle global du carbone, les « phénomènes » sont les flux de carbone qui s’y produisent et, conséquemment, les variations des stocks de carbone contenus dans les réservoirs mentionnés ci-haut. Il est tout d’abord essentiel de différencier les flux de carbone des stocks de carbone. Un flux de carbone est le transfert d’une quantité de carbone d’un
environnement défini (réservoir) à un autre en fonction de variables spatiales et temporelles, comme par exemple le processus de photosynthèse en g C m-2 s-1; tandis qu’un stock de carbone est une quantité de carbone contenue dans un réservoir à un temps donné, comme par exemple le nombre de g C se trouvant dans les roches sédimentaires de la planète en 2008.
Le caractère « global » du cycle du carbone fait référence à l’échelle spatiale à laquelle il est considéré, soit l’échelle planétaire. Cependant, il n’englobe que les flux et réservoirs de carbone s’effectuant et se trouvant près de la surface, de la partie supérieure de la lithosphère à la partie supérieure de l’atmosphère. Ceci est dû au fait que le cycle global du carbone est caractérisé par une échelle temporelle relativement courte, soit celle de la vie humaine (Jacques et Saugier, 2008). Ceci exclut la majorité des stocks et flux de carbone des roches sédimentaires. Ce stock de carbone souterrain fait partie du cycle géologique du carbone qui se différencie du cycle global du carbone par un stock beaucoup plus important et des valeurs relatives de flux moins élevées. Toutefois, malgré le fait que ces deux cycles se perpétuent sur des échelles temporelles différentes, on observe des flux entre ces cycles. Par exemple, les volcans et les sources hydrothermales libèrent chaque année des tonnes de carbone dans l’atmosphère et l’hydrosphère sous forme de gaz et de carbone dissous. Dans les bassins océaniques, il y a déposition et accumulation constante de carbone provenant de la précipitation inorganique et de squelettes d’organismes vivants. Combinée à la pression, cette accumulation entraîne la formation de roches sédimentaires (lithification), retirant une certaine quantité de carbone du cycle global. Depuis peu, l’extraction d’énergie fossile de la lithosphère et l’émission du carbone qu’elle contient dans l’atmosphère constituent des flux de carbone non-négligeables. Également, les changements d’affectation des terres sont reconnus pour indirectement engendrer des émissions de carbone. Ces flux se différencient des autres car ils sont de source anthropogénique. Désormais, l’importance de ces flux nous oblige à les considérer comme faisant partie intégrante du cycle global du carbone (Mackenzie et Lerman, 2006; Mannion, 2006; Jacques et Saugier, 2008).
À l’échelle planétaire, ~4,4 × 10-4% du carbone fait partie du cycle global du carbone. On estime le réservoir océanique de carbone à 38000 × 1015 g C (Pg C) tandis que le réservoir atmosphérique est estimé à 750 Pg C. La végétation terrestre contient au total ~560 Pg C et les sols ~1500 Pg C. Les gisements d’énergie fossile extractible contiennent ~4000 Pg C (Schlesinger, 1997). Des flux de carbone ont lieu entre tous ces réservoirs mais ils ne sont pas proportionnels aux stocks. La Fig. 1.1 présente les principaux flux de carbone annuels moyens de la dernière décennie du 20ième siècle.
Fig. 1.1 Principaux flux et stocks de carbone annuels moyens (gigatonne par année, Gt C an-1) de la décennie
1990. GPP = photosynthèse. Les flux préindustriels, dits naturels, sont en noir et les flux de source anthropogénique sont en rouge. Les chiffres précédés d’un ± sont des variations de stock (tirée de Denman et
al., 2007).
La photosynthèse et la respiration, qui ont lieu entre l’atmosphère et la biosphère, sont les flux de carbone les plus importants. Les valeurs annuelles moyennes de ces deux flux sont presque égales mais de signes opposés, et la balance penche d’avantage du côté de la photosynthèse ce qui fait des écosystèmes terrestres un faible puits de carbone. Par la photosynthèse, la végétation produit des hydrates de carbone (CH2O) à partir de CO2 et de vapeur d’eau (H2O) et s’en sert pour sa croissance ou la maintenance de son métabolisme. La photosynthèse engendre une émission d’oxygène moléculaire (O2) et de vapeur d’eau selon l’Éq. 1.1 (tirée de Mackenzie et Lerman, 2006) :
(Éq. 1.1)
où la photosynthèse est une fixation de carbone. La respiration consiste en une émission de carbone sous forme de CO2 par l’oxydation des hydrates de carbone. Cette oxydation requiert la consommation d’oxygène moléculaire et de vapeur d’eau et s’accompagne d’une émission de vapeur d’eau. La photosynthèse est donc un processus réversible. Une fois le carbone fixé par la photosynthèse, il peut prendre différent chemins. Il peut être transféré aux racines sous forme d’hydrates de carbone, utilisé pour l’énergie qu’il contient (oxydation) et réémis dans l’atmosphère, être stocké dans le sol forestier sous forme de débris ligneux ou de matière organique, être transporté par les rivières, se dissoudre dans l’océan et ne refaire surface que dans 5000 ans, et plusieurs autres (Adams, 2007). Plus de la moitié du carbone fixé par la photosynthèse est respiré par la végétation, mais la principale composante de la respiration des écosystèmes terrestres est la respiration du sol (Schlesinger, 1997) qui fait l’objet de la section 2 du présent Chapitre.
Les émissions dans l’atmosphère de gaz à effet de serre de source anthropogénique se distinguent des flux dits « naturels » par l’échelle temporelle sur laquelle elles se produisent. En conditions naturelles, le carbone contenu dans l’énergie fossile de la lithosphère est émis dans l’atmosphère sur des périodes de temps relativement longues. Or, depuis environ le début de l’ère industrielle, des quantités importantes de carbone sont émises dans l’atmosphère sur de courtes périodes de temps. Ceci est évident lorsqu’on compare les taux auxquels ce carbone est émis dans l’atmosphère à ses taux d’accumulation dans la lithosphère (Schlesinger, 1997). De plus, le fort lien existant entre les changements d’affectation des terres et l’émission de carbone place l’être humain au coeur du phénomène de perturbation du cycle global du carbone. Selon Mackenzie et Lerman (2006), l’émission de carbone par l’utilisation d’énergie fossile et les changements d’affectation des terres a totalisé ~480 Pg C entre les années 1850 et 2000, dont 156 Pg C attribuables à l’aménagement et aux changements d’affectation des terres (Houghton,
2003). Le résultat fût une augmentation de la concentration moyenne en CO2 de l’air ambiant, de 280 à 379 parties par million (IPCC, 2007).
1.3 Le cycle du carbone de l’écosystème forestier
Malgré des particularités régionales en fonction des divers types de forêt et des conditions édapho-climatiques, le cycle du carbone de l’écosystème forestier peut universellement se résumer à l’équation suivante:
NEP = GEP − Re (Éq. 2.1)
où NEP est la production nette de l’écosystème (Net Ecosystem Production, accumulation ou émission nette de carbone), GEP est la production brute de l’écosystème (Gross Ecosystem Production, fixation de carbone par la photosynthèse) et Re est la respiration de l’écosystème (émission de carbone par la respiration). Les unités les plus couramment utilisées pour quantifier ces flux sont le g C m-2 an-1 et le Mg C ha-1 an-1.
1.3.1 La production nette de l’écosystème
La NEP est donc la différence entre la fixation de carbone par la photosynthèse à partir de CO2 atmosphérique et l’émission de carbone dans l’atmosphère par la respiration sous forme de CO2, sur une période de temps déterminée et dans un espace déterminé (Woodwell et Whittaker, 1968). La NEP indique si l’écosystème est neutre, un puits ou une source de carbone. Les taux de NEP varient en fonction de la variation relative des taux de GEP et de Re. Cette définition de la NEP convient pour la plupart des études de l’écosystème forestier dont l’étude présentée au Chapitre 2 du présent mémoire (elle est également utilisée dans la suite de cette revue de littérature). Pourtant, elle ne tient pas compte des autres phénomènes qui peuvent contribuer aux échanges de carbone, principalement à l’émission de carbone. De plus, le CO2 métabolique n’est pas le seul
composé par lequel le carbone peut être transféré d’un milieu à un autre. Le feu, l’érosion, la récolte, le lessivage, le transfert de carbone organique et inorganique dissous, l’émission de composés organiques volatils et le transfert de matière organique par les herbivores sont aussi des phénomènes qui génèrent des échanges de carbone. Pour la grande majorité des études de l’écosystème forestier portant sur de courtes périodes, la contribution de ces phénomènes aux échanges de carbone est négligeable. Cependant, lorsque des études portent sur des échelles spatiales et/ou temporelles considérables, elles se doivent d’inclure les échanges de carbone non-respiratoires et sous forme autre que le CO2 dans la définition et le calcul de la NEP. À l’échelle globale, ces échanges représentent une émission de carbone équivalente à ~10% de la GEP (Randerson et al., 2002). De plus, dans le calcul de la NEP à grande échelle, les échanges de carbone issus des perturbations de l’écosystème de source anthropogénique doivent être pris en compte. Des exemples de ces perturbations sont: la récolte de matière ligneuse, l’agriculture et le changement d’affectation des terres. Schulze et Heimann (2000) ont introduit le concept de la production nette du biome (NBP, Net Biome Production), afin d’inclure dans le calcul de la NEP les échanges de carbone issus de tous les phénomènes et de toutes les perturbations de l’écosystème.
1.3.2 La production primaire brute de l’écosystème
La GEP des écosystèmes forestiers est exclusivement la photosynthèse et les taux de GEP peuvent varier en fonction des taux de radiation photosynthétiquement active (PAR, Photosynthetically Active Radiation) reçue par l’écosystème, de la capacité photosynthétique de l’écosystème et des conditions climatiques (Law et al., 2002; Gower, 2003).
Les taux de PAR varient en fonction du degré de couverture nuageuse et de la latitude. Néanmoins, par l’étude de forêt européennes, Valentini et al. (2000) ont trouvé que les taux moyens de GEP sont largement indépendants de la latitude. Le type de lumière (directe ou diffuse) peut influencer les taux de GEP, puisque l’efficacité de l’usage de la lumière (LUE, Light Use Efficiency, pente de la courbe du taux de NEP en fonction du
taux de PAR) de la canopée forestière peut être près de deux fois plus élevée sous une lumière diffuse que sous une lumière directe (Gu et al., 2003; Baldocchi, 2008). Ceci est probablement dû à la capacité plus élevée de la lumière diffuse à pénétrer la canopée, résultant en une plus grande proportion de feuilles recevant la lumière. De plus, la lumière directe peut être saturante pour les feuilles de la canopée et ainsi faire diminuer la LUE (Law et al., 2002). La proportion de lumière diffuse dépend du degré de couverture nuageuse, du type de nuage et de la quantité de matière en suspension dans l’atmosphère. La quantité et le type de lumière reçue par l’écosystème forestier peut également influencer la température des tissus photosynthétiques, dont l’effet sur les taux de GEP est expliqué plus loin dans ce paragraphe.
La capacité photosynthétique de l’écosystème forestier peut varier en fonction de la conductance de la canopée et de l’indice de surface foliaire (LAI, Leaf Area Index), deux facteurs qui eux-mêmes peuvent varier en fonction des caractéristiques de la végétation et des conditions édapho-climatiques. La conductance de la canopée est reliée au degré d’ouverture des stomates et est l’élément principal qui lie le cycle du carbone de l’écosystème forestier au cycle de l’eau. Les taux de photosynthèse et de respiration de la végétation dépendent du degré d’ouverture des stomates qui peut varier en fonction du déficit de pression de vapeur d’eau et de la disponibilité en eau du sol. Sous stress hydrique et/ou déficit de pression de vapeur d’eau élevé, la végétation a généralement un faible degré d’ouverture des stomates afin de maintenir son contenu en eau au-dessus d’un niveau dommageable pour son métabolisme. Ce faible degré d’ouverture influence à la baisse les taux de GEP et de respiration de la végétation. De plus, le stade de développement de la végétation ligneuse peut influencer le degré d’ouverture des stomates, via la résistance hydraulique des composantes internes de la végétation ligneuse. Passé un certain âge, il se produit une augmentation de la résistance hydraulique et une concurrente diminution de la conductance de la canopée (Gower et al., 1996). Considérant le lien qui existe entre le cycle du carbone et celui de l’eau, il n’est pas surprenant d’observer une corrélation entre la LAI et la précipitation à l’échelle du biome. À plus petite échelle, la LAI est corrélée à la capacité de rétention en eau du sol (Gower, 2003). Étant donné que les feuilles sont les tissus végétaux où se trouve la plus grande concentration de nutriments, la disponibilité de nutriments dans le sol peut également influencer la LAI. La capacité photosynthétique de
l’écosystème peut aussi varier en fonction du type de végétation prédominant (feuillu−angiosperme ou conifère−gymnosperme) et de la physiologie de la végétation prédominante (feuilles caduques ou persistantes). Les feuilles des gymnospermes ont en moyenne des taux de photosynthèse plus faibles que celles des angiospermes (Hall et Rao, 1999). De plus, dans les écosystèmes forestiers à prédominance de feuilles caduques, la capacité photosynthétique de l’écosystème peut varier à l’intérieur de la saison de croissance puisque la LAI varie à l’intérieur de cette même saison.
Les taux de GEP peuvent varier en fonction des conditions climatiques de par leur influence sur les facteurs susmentionnés. En général, le lien cycle du carbone – cycle de l’eau est au cœur des variations des taux de GEP en fonction des conditions climatiques. La température des tissus photosynthétiques, fortement corrélée à la température de l’air, peut influencer les taux de GEP. Dû aux caractéristiques intrinsèques des cellules photosynthétiques, la photosynthèse ne s’effectue qu’à l’intérieur de limites de température qui varient selon les espèces et les régions. Près du point de congélation, l’eau n’est pas disponible pour la translocation des éléments nécessaires à la photosynthèse alors qu’au-dessus de ~40º C, des changements dans le chloroplaste et dans l’activité enzymatique des cellules photosynthétiques s’opèrent. Ces deux conditions peuvent réduire les taux de photosynthèse (Waring et Running, 1998). Les taux de GEP peuvent être augmentés par un enrichissement de l’air en CO2, mais l’effet varie grandement entre les espèces (Poorter, 1993).
1.3.3 La respiration de l’écosystème
La Re est la somme de deux composantes: la respiration autotrophique (Ra), qui est l’efflux de CO2 par la respiration de la végétation, et la respiration hétérotrophique (Rh), qui est l’efflux de CO2 par la respiration des êtres hétérotrophes. Toutefois, la Re est généralement divisée en la Ra de la partie aérienne de la végétation et en la somme de la Ra et de la Rh se produisant dans le sol (voir la section 2 du présent Chapitre sur la respiration du sol). De plus, dépendamment de l’échelle spatiale et temporelle à laquelle elle est mesurée, la Re
peut également inclure l’efflux de CO2 provenant des perturbations naturelles et anthropogéniques. Il est possible de calculer la production primaire nette (NPP, Net Primary Production) de la végétation en soustrayant la Ra de la GEP. Pour ce, on utilise généralement la Ra de la partie aérienne de la végétation.
Ultimement, la Re est un produit de la GEP. Il ne peut y avoir de Ra sans photosynthèse et il ne peut y avoir de Rh sans matière organique précédemment créée par la photosynthèse. Donc, les facteurs qui influencent les taux de GEP influencent également les taux de Re. Baldocchi (2008) a affirmé que, à l’échelle du biome, les taux de Re sont corrélés aux taux de GEP. Toutefois, la double nature et la proportion variable des deux composantes de la Re font que la variation de cette dernière en fonction de facteurs physiologiques et édapho-climatiques est variable et peut différer de celle de la GEP (Falge et al., 2002). À l’échelle du site et à une échelle temporelle relativement courte (≤ 1 an), la
Re est corrélée à la température de l’air et à la température du sol (Valentini et al., 2000). Cependant, Valentini et al. (2000) ont observé une augmentation de la Re annuelle avec la latitude et une concurrente diminution de la température annuelle moyenne de l’air. Ceci peut être en partie expliqué par l’influence de la disponibilité en eau du sol sur la Re, la Ra et la Rh étant deux processus biologiques nécessitant de l’eau pour pouvoir s’effectuer. Les résultats de Migliavacca et al. (2010) ont indiqué que la Re est fortement influencée à la fois par des facteurs physiologiques et par des facteurs édapho-climatiques.
La Ra a deux sources: la respiration de maintenance, soit la respiration associée à l’entretient des tissus existants, et la respiration associée à la création de nouveaux tissus (Waring et Running, 1998). À l’échelle globale, les taux de Ra varient en fonction de la température moyenne annuelle de l’air puisque la Ra est un processus métabolique, le taux d’activité métabolique étant relié à la température ambiante. Les taux de Ra varient également en fonction de la quantité de biomasse vivante puisque toutes les composantes de la végétation (feuilles, troncs, racines) émettent du CO2 par la respiration. L’âge de la végétation ainsi que la concentration en azote des tissus végétaux ont aussi été cités comme facteurs pouvant influencer les taux de Ra (Piao et al., 2010). L’effet combiné de plusieurs facteurs sur les taux de Ra a été mis en lumière par DeLucia et al. (2007) qui ont affirmé que la Ra n’est pas une fraction constante de la GEP.
2. La respiration du sol
2.1 Processus
La respiration du sol (Rs) est, à l’échelle globale, la composante majeure de la Re (Raich et Schlesinger, 1992). La Rs est définie comme « l’efflux total de CO2 produit par la somme de la respiration rhizosphérique (racines, mycorhizes, mycélium et microorganismes de la rhizosphère) et de la respiration microbienne provenant de la décomposition de matière organique » (Luo et Zhou, 2006). Certains chercheurs ajoutent à la définition de la Rs la respiration de la végétation de la couverture du sol et ce pour des considérations plus souvent techniques que de recherche. C’est le cas de l’étude présentée au Chapitre 2 du présent mémoire.
La respiration rhizosphérique (Rr) englobe la respiration des racines et celle des mycorhizes et microorganismes associés aux racines qui se nourrissent d’exsudats racinaires (principalement des hydrates de carbone). L’apport en carbone aux racines provient du carbone fixé par la photosynthèse. Selon Litton et al. (2007), la quantité de carbone transférée aux racines est corrélée au taux de GEP. Concernant la proportion du carbone fixé par la photosynthèse qui est transférée aux racines, elle diminue avec l’âge de la végétation et avec l’augmentation de la disponibilité en eau et en nutriments du sol (Litton et al., 2007). En utilisant le carbone pour leur croissance et la maintenance de leur métabolisme, les racines respirent et émettent du carbone dans le sol sous forme de CO2. Elles transfèrent également des hydrates de carbone aux mycorhizes et microorganismes associés dont la croissance et la survie en dépendent et qui à leur tour respirent et émettent du CO2 dans le sol. La majeure partie du CO2 émis dans le sol est ultimement transportée vers la surface et retourne à l’atmosphère.
Le terme hétérotrophique est dérivé de « hétérotrophe », qui désigne un « être vivant se
nourrissant de substances organiques » (Larousse, 2005) comme les animaux, les microbes
et la faune du sol, et qui, selon la définition, comprend les mycorhizes et les microorganismes. Cependant, la Rh du sol n’englobe que la respiration des hétérotrophes qui se trouvent à l’extérieur de l’environnement rhizosphérique. La matière organique dont se nourrissent les communautés de champignons et microbes du sol provient majoritairement de la végétation par mort racinaire et par apport de biomasse aérienne. L’apport de matière organique est corrélé au taux de NEP (Luo et Zhou, 2006). Il peut également varier en fonction de la physiologie de la végétation. Les microbes décomposent la matière organique en éléments minéraux, mais une fraction (10 à 20%) de la matière organique n’est pas minéralisée et s’accumule pour constituer l’humus, cette couche superficielle de matière organique récalcitrante répandue en forêt (Jacques et Saugier, 2008). Dans l’écosystème forestier, la fonction biologique des décomposeurs est de minéraliser la matière organique pour que les éléments minéraux deviennent accessibles à la végétation. La respiration des microbes constitue donc une source de CO2 dans le sol et est directement reliée au niveau d’activité de ces derniers.
2.2 Facteurs de variabilité
À travers la communauté scientifique, on affirme que les facteurs majeurs de variabilité spatiale et temporelle des taux de Rs sont: la température du sol, le contenu en eau du sol, les taux de NEP, la stratégie d’allocation du carbone de la végétation, le stade de développement du peuplement, la qualité du substrat, les conditions édapho-climatiques et les effets des perturbations (Raich et Tufekcioglu, 2000; Rustad et al., 2000; Schlesinger et Andrews, 2000; Xu et Qi, 2001; Reichstein et al., 2003). Chacun de ces facteurs peut avoir différents effets sur les taux de Rr et de Rh. La réponse de la Rs aux facteurs de variabilité peut elle-même varier, puisque les proportions de la Rs des deux composantes peuvent varier entre les sites et à l’intérieur d’une année.
La température et le contenu en eau du sol sont reconnus comme les facteurs abiotiques ayant le plus d’influence sur les taux de Rs (Subke et Bahn, 2010). Les réactions biochimiques, dont la respiration, augmentent en intensité en suivant généralement une courbe exponentielle en fonction de la température (van’t Hoff, 1898). Les organismes produisant la Rs ont besoin d’eau pour croître et maintenir leur métabolisme. Or, dans les écosystèmes forestiers, une augmentation de la température de l’air (et conséquemment, du sol) entraîne généralement une diminution du contenu en eau du sol par des taux d’évapotranspiration plus élevés; tandis que de basses températures du sol font diminuer la quantité d’eau disponible pour la translocation des éléments. On observe donc une insensibilité de la Rs aux variations de la température du sol sous de bas niveaux de contenu en eau du sol (< ~7,5% volumétrique) et une insensibilité de la Rs au contenu en eau du sol sous de basses valeurs de température (< 5º C) (Luo et Zhou, 2006). Des valeurs élevées de température et de contenu en eau du sol peuvent réduire les taux de Rs par la possible dégradation des enzymes et le manque d’oxygène, respectivement. À l’intérieur de certaines limites de température et de contenu en eau du sol, la sensibilité de la Rs aux variations de la température peut varier selon la température elle-même et selon le contenu en eau du sol (Qi et al., 2002). On exprime généralement la sensibilité de la Rs aux variations de la température du sol avec le facteur Q10, soit le facteur de multiplication du taux de Rs pour chaque augmentation de 10 ºC de la température du sol.
Les taux de NEP, la stratégie d’allocation du carbone de la végétation et le stade de développement du peuplement sont des facteurs biotiques qui varient de l’échelle locale à l’échelle globale et qui peuvent influencer les taux de Rs. De l’observation généralisée que les variations des stocks de carbone récalcitrant dans le sol (qui forment la majeure partie des stocks de carbone du sol) sont faiblement corrélées aux taux de Rs, on peut déduire que la majorité de la Rs provient de la décomposition de matière organique fraîche et de l’utilisation de carbone récemment fixé par la photosynthèse (Ryan et Law, 2005). Cette déduction mène à la conclusion que la Rs est un bon indicateur du niveau de métabolisme de l’écosystème forestier qui est fortement relié aux trois facteurs concernés dans ce paragraphe. L’apport de matière organique sous forme de hydrates de carbone aux racines
et sous forme de biomasse décomposable aux microbes dépend de plusieurs facteurs mais, principalement, de ces trois facteurs. Les taux de Rs augmentent avec l’apport en matière organique qui généralement augmente avec le taux de NEP. Comme mentionné ci-haut, la proportion du carbone fixé par la photosynthèse qui est transférée aux racines diminue avec l’âge de la végétation mais la quantité de matière organique provenant de la partie aérienne de la végétation augmente généralement avec l’âge du peuplement. Aussi, la quantité de racines et de microorganismes du sol effectuant la respiration peuvent varier en fonction de l’âge du peuplement.
Pour l’étude de la respiration du sol, la qualité du substrat est généralement mesurée par son contenu en azote ou son rapport C:N. Une augmentation de la disponibilité en azote du sol, sans atteindre la saturation, résulte généralement en une augmentation des taux de NEP (Magnani et al., 2007) qui, comme mentionné ci-haut, influence à la hausse les taux de Rs par un apport accru de matière organique. Des taux de décomposition de la matière organique plus élevés augmentent la disponibilité de l’azote du sol et augmentent du fait même la productivité de l’écosystème forestier. Un contenu élevé en azote du sol résulte généralement en un contenu élevé en azote des tissus racinaires. Ce dernier est relié à des taux de croissance élevés, auxquels on associe des taux de respiration racinaire élevés (Ryan, 1991; Luo et Zhou, 2006). Toutefois, les effets d’une augmentation de la disponibilité en azote du sol sont multiples et peuvent ne résulter en aucune variation significative ou en une réduction des taux de Rs (Luo et Zhou, 2006). La qualité du substrat peut aussi être mesurée par les fractions labile et récalcitrante de matière organique du sol, puisque les taux de Rh provenant de la décomposition de chacune de ces fractions peuvent différer.
Les conditions édapho-climatiques peuvent influencer le transport de CO2 de la source jusqu’à la surface du sol, et ainsi influencer l’efflux de CO2. Lorsqu’une mesure de Rs est prise à la surface du sol, comme dans la majorité des cas, c’est l’efflux de CO2 du sol qui est mesuré et non pas nécessairement la Rs. L’efflux de CO2 du sol résulte de la production
de CO2 dans le sol et du transport de CO2 jusqu’à la surface. L’efflux de CO2 du sol est égal à la Rs lorsque la production et le transport de CO2 sont stables. Le transport de CO2 d’une source jusqu’à la surface du sol est donc un régulateur d’efflux. Le mouvement de l’air à l’intérieur du sol est très faible, et le CO2 se déplace le long d’un gradient de concentration qui diminue du sol profond vers la surface; il peut également se déplacer entre des zones de pressions totales différentes sous l’action du transfert de masse. Le transport de CO2 vers la surface est favorisé par des substrats poreux qui contiennent des micro-espaces reliés entre eux et remplis d’air. La présence d’eau dans les pores du substrat peut diminuer la capacité de diffusion du sol, mais on observe aussi une phase liquide de transport par diffusion (Luo et Zhou, 2006). À l’opposé, les sols compacts présentent de faibles valeurs de diffusivité de l’air. Cette variabilité de diffusivité des sols peut être un facteur à considérer lors de l’analyse des valeurs de Rs, dépendamment de l’échelle temporelle de l’analyse. Par exemple, le délai entre la production de CO2 et son émission à la surface est négligeable si on évalue le taux annuel de Rs. Cependant, il peut être non-négligeable si on analyse la réponse à haute fréquence de la Rs à des phénomènes climatiques soudains. La concentration en CO2 de l’air ambiant près du sol est également un régulateur d’efflux. Une augmentation de cette concentration fait diminuer le transport par diffusion, selon la première loi de diffusion de Fick, et ainsi entraîne une diminution des taux d’efflux de CO2 (McDermitt et al., 2008). Ce phénomène se produit généralement la nuit, lorsque la vitesse du vent est faible ou nulle et que le CO2 s’accumule près du sol.
Les facteurs de variabilité des taux de Rs mentionnés ci-haut peuvent subir des modifications par les perturbations de l’écosystème forestier. Les effets de ces perturbations sur les composantes du cycle du carbone de la forêt boréale, dont la Rs, sont décrits à la section 3.2 du présent Chapitre.
Malgré l’avancement de la science de la respiration du sol depuis la publication de l’article de Lundegårdh (1927), beaucoup d’interrogations sur les processus de la Rs et la variabilité des taux de Rs subsistent. Les observations sont très variables, ce qui limite notre capacité à tirer des conclusions générales. La respiration du sol est un phénomène qui se produit à l’échelle globale et dont les répercussions sont à l’échelle globale (émission de CO2 dans l’atmosphère). Or, dans un contexte de changements climatiques, des conclusions générales sur la Rs sont nécessaires pour pouvoir étudier et prédire ses répercussions à l’échelle globale.
Les efforts pour améliorer la précision des mesures de Rs sont considérables. Plusieurs études portent sur l’évaluation de la précision des différentes techniques et dispositifs de mesure et sur la comparaison entre ces derniers (Janssens et al., 2000; Wang et al., 2005). L’utilisation en laboratoire de dispositifs pouvant simuler la Rs est une voie intéressante en ce sens (Martin et al., 2004; Butnor et al., 2005). D’autres études examinent les défauts des techniques et dispositifs de mesure et y associent des erreurs systématiques (Rayment, 2000; Bain et al., 2005). Certaines études explorent les moyens de construire des dispositifs de mesure en minimisant les erreurs systématiques (Davidson et al., 2002; Subke et al., 2004). D’autres études portent sur l’influence des propriétés du sol sur les mesures de Rs (Butnor et al., 2005; Venterea et Baker, 2008). Les résultats de ces études serviront ultimement à rendre les mesures plus précises afin de les relier à d’autres mesures précises de l’écosystème forestier et des conditions édapho-climatiques. Ils serviront également à uniformiser les techniques et dispositifs de mesure afin de faciliter les comparaisons.
La mise à l’échelle et la modélisation des mesures de Rs sont aussi l’objet de plusieurs études. Certaines études portent sur la quantité et la fréquence d’échantillonnage requises pour pouvoir bien caractériser la variabilité spatiale et temporelle des taux de Rs (Savage et Davidson, 2003; Rodeghiero et Cescatti, 2008). À des fins de modélisation, l’avancement des connaissances sur la sensibilité de la Rs aux variations de la température du sol et autres
facteurs se poursuit car une panoplie d’études s’y consacrent (Qi et al., 2002; Curiel Yuste et al., 2004; Davidson et al., 2006; Kirschbaum, 2006; Subke et Bahn 2010).
La division de la Rs en la Rr et la Rh est un sujet d’étude actuel. Ces deux composantes de la
Rs sont reconnues comme ayant des valeurs de sensibilité aux variations de la température du sol différentes. Les techniques utilisées sont principalement l’exclusion des racines, la séparation physique des composantes responsables de la respiration, les méthodes isotopiques et les méthodes indirectes (Hanson et al., 2000; Subke et al., 2006).
D’autres études portent sur la réponse de la Rs aux perturbations et aux changements des conditions édapho-climatiques dans un contexte de changements climatiques. La possibilité d’une éventuelle rétroaction de la Rs suite à une augmentation de la concentration atmosphérique en CO2 et de la température de l’air est l’objet de plusieurs études (Kirschbaum, 2000). Les effets d’une concentration atmosphérique en CO2 plus élevée sur les taux de Rs sont évalués (King et al., 2004) de même que ceux de températures de l’air et du sol plus élevées (Eliasson et al., 2005; Bronson et al., 2008). Puisqu’on prédit que la fréquence des perturbations naturelles augmentera avec les changements climatiques, des études examinent les effets du feu et des épidémies d’insectes sur les taux de Rs (Czimczik et al., 2006; Morehouse et al., 2008; Smith et al., 2009). L’influence sur les taux de Rs des perturbations de la forêt de source anthropogénique est également l’objet de nombreuses études (Irvine et Law, 2002; Peng et Thomas, 2006).
3.1 Principales caractéristiques
La forêt boréale s’étend sur près de 15 millions de km2, ce qui représente ~11% de la surface terrestre (Fig. 1.2) (Bonan et Shugart, 1989). Son extrême limite nord est située à ~70º de latitude (Scandinavie) tandis que son extrême limite sud est située à ~45º (Eurasie). Sa largeur est variable et peut dépasser 1000 km en Amérique du Nord et en Eurasie. Les espèces ligneuses qu’on y retrouve appartiennent principalement aux genres Abies, Picea,
Pinus, Larix, Betula, Populus, Alnus et Salix et forment le plus souvent des peuplements
monospécifiques (OIFQ, 2009). La strate arbustive et herbacée de la forêt boréale se compose d’une panoplie d’espèces, tandis que la strate muscinale est dominée par les mousses (Hylocomium spp., Hypnum spp., Pleurozium spp., Sphagnum spp.) et les lichens.
Fig. 1.2 L’étendue circumpolaire de la forêt boréale (Ressources Naturelles Canada, 2004).
Les sols de la forêt boréale sont principalement des podzols et résultent du processus de podzolisation. Ce processus s’opère dans des conditions froides, humides et acides et en présence d’une roche-mère perméable. Il consiste en un mouvement du fer, de l’aluminium et d’éléments solubles constituant la matière organique (calcium, sodium, potassium) de la couche superficielle vers une couche plus profonde du sol par la percolation d’eau. Le fer et l’aluminium précipitent dans la couche profonde et la matière organique décomposée s’y