Exposition des travailleurs aux bioaérosols
dans les usines de biométhanisation des
matières organiques putrescibles
Mémoire
Marie-Eve Dubuis
Maîtrise en microbiologie
Maître ès sciences (M. Sc.)
Québec, Canada
© Marie-Eve Dubuis, 2017
Exposition des travailleurs aux bioaérosols
dans les usines de biométhanisation des
matières organiques putrescibles
Mémoire
Marie-Eve Dubuis
Sous la direction de :
iii
Résumé
La livraison et la manutention de la matière organique putrescible effectuées dans les usines de biométhanisation produisent des bioaérosols, mettant en suspension dans l’air les microorganismes retrouvés dans les matières premières qui peuvent varier en nature et en état de décomposition. Les travailleurs des usines de biométhanisation se retrouvent exposés à ces microorganismes, dont certains peuvent être nuisibles à la santé. La biométhanisation étant une méthode récente de traitement et de valorisation des déchets, aucune étude ne fait mention de la présence de bioaérosols dans l’air des bâtiments en émergence au Québec. Il est donc nécessaire de procéder à une évaluation exploratoire de l’air des usines de biométhanisation afin d’en connaitre la composition en microorganismes. Deux usines ont été visitées une fois en été et une fois en hiver, pour un total de 4 visites, ceci dans le but de tenir compte de la variation saisonnière des conditions de travail. L’échantillonnage effectué était de type stationnaire. Les six échantillonneurs utilisés ont servi à l’analyse des microorganismes cultivables et à l’analyse moléculaire des bioaérosols. Des concentrations en bactéries et en moisissures supérieures aux recommandations émises par l’IRSST ont été observées. La quantification par qPCR a permis la détection de quelques microorganismes potentiellement pathogènes, tels Saccharopolyspora rectivirgula, Legionella spp. et Mycobacterium spp. Des concentrations d’endotoxines inférieures à la valeur suggérée ont été décrites. Finalement, une meilleure vue d’ensemble de la diversité bactérienne a été possible grâce au séquençage nouvelle génération. La technologie utilisée pour le traitement des déchets étant encore nouvelle, ce projet constitue un ajout important à la littérature. Des moyens de protection pourront être suggérés pour les travailleurs œuvrant dans ce secteur d’activités.
iv
Abstract
Delivery and handling of putrescible organic matter in biomethanization facilities produce bioaerosols, suspending microorganisms found in the raw matter, which may vary in nature and decomposition state. Workers in biomethanization facilities are exposed to these microorganisms, some of which may be harmful to their health. Nowadays, biomethanization is used as a method of waste processing and valorization. To our knowledge, there is no study mentioning the presence of bioaerosols in these emerging facilities in the Quebec province. Consequently, there is a need to study the air of biomethanization facilities to better understand its composition in microorganisms. Two facilities were visited once in summer and once in winter for a total of 4 visits. The goal was to consider the seasonal variation of working conditions. Stationary sampling was performed with six devices used for culture of airborne microorganisms and molecular analysis. Bacterial and fungal concentrations above the IRSST recommendations were observed. qPCR lead to the detection of some potentially pathogenic microorganisms, such as
Saccharopolyspora rectivirgula, Legionella spp. and Mycobacterium spp. The
endotoxin concentrations were below the recommended value. Finally, a better view of bacterial diversity was possible due to next-generation sequencing. Because biomethanization is an emerging waste treatment technology, this study brings a major contribution to the literature. It may also lead to recommendations for the protection of workers in this activity area.
v
Table des matières
Résumé ... iii
Abstract ... iv
Table des matières ... v
Liste des tableaux ... ix
Listes des figures ... x
Liste des abréviations et des sigles ... xii
Remerciements ... xiv
Avant-propos ... xvii
Chapitre 1 : Introduction ... 1
1.1 Les Bioaérosols ... 1
1.2 L’étude des bioaérosols et l’échantillonnage ... 3
1.2.1 Les échantillonneurs d’air ... 5
1.2.2 Biais et limites ... 7
1.3 La biométhanisation ... 10
1.3.1 Réactions chimiques et procédé ... 11
1.3.2 Optimisation du procédé de biométhanisation ... 12
1.3.3 Biogaz et traitement des extrants ... 14
1.3.4 Principaux avantages de la biométhanisation ... 14
1.4 Les bioaérosols dans les usines de biométhanisation et de compostage et la santé occupationnelle ... 15
1.4.1 Les microorganismes et les composés d’intérêt ... 17
1.4.2 Les valeurs limites d’exposition ... 22
1.4.3 Problèmes de santé chez les travailleurs ... 22
1.4.4 Usines de biométhanisation à l’étude ... 24
1.5 Mise en contexte du projet ... 24
1.6 Problématique ... 26
1.7 Hypothèses ... 27
vi
Chapitre 2 : Concentrations des bioaérosols retrouvés aux aires de travail des usines de biométhanisation. Article - Bioaerosols concentrations in working areas in
biomethanization facilities. ... 28
2.1 Résumé ... 29
2.2 Abstract ... 30
2.3 Introduction ... 31
2.4 Materials and Methods ... 34
2.4.1 Sampling sites ... 34
2.4.2 Air sampling ... 34
2.4.3 DNA extraction ... 35
2.4.4 Quantification of microorganisms by quantitative PCR (qPCR) ... 36
2.4.5 Endotoxin quantification ... 36
2.4.6 Next-generation sequencing (NGS) ... 37
2.4.7 Statistical analysis ... 39
2.5 Results ... 40
2.5.1 Comparison of bacterial culture and qPCR ... 40
2.5.2 Culture of mesophilic molds ... 40
2.5.3 Quantification of microorganisms with qPCR ... 40
2.5.4 Endotoxin quantification ... 41
2.5.5 Next-generation sequencing (NGS) ... 42
2.6 Discussion ... 43
2.6.1 Total bacterial quantification comparison using culture and qPCR ... 43
2.6.2 Culture of mesophilic molds ... 44
2.6.3 Specific quantification of microorganisms of interest using qPCR ... 44
2.6.4 Endotoxin quantification ... 46 2.6.5 Next-generation sequencing (NGS) ... 47 2.7 Conclusion ... 49 2.8 Acknowledgements ... 50 2.9 Table list ... 51 2.10 Figure list ... 55 2.11 Bibliography ... 58
vii
Chapitre 3 : Matériel et Méthodes, éléments additionnels non présentés dans l’article
... 63
3.1 Recrutement des établissements ... 63
3.2 Échantillonnage et analyse des échantillons ... 63
3.2.1 Sites d’échantillonnage ... 63
3.2.2 Échantillonnage de l’air ... 67
3.3 Transport, conservation, incubation et traitement des échantillons ... 70
3.4 Analyses en séquençage nouvelle génération ... 72
3.5 Statistiques ... 72
Chapitre 4 : Résultats, éléments additionnels non présentés dans l’article ... 73
4.1 Comparaison Andersen 6 étages et Coriolis µ ... 73
4.2 Comparaison des échantillonneurs 1 étage ... 75
4.3 Séquençage nouvelle génération ... 78
4.3.1 Diversité α ... 78
4.3.2 Diversité β ... 80
4.3.3 Top 20 des genres bactériens ... 82
4.3.4 Comparaison de la qPCR et du séquençage nouvelle génération ... 83
Chapitre 5 : Discussion ... 84
5.1 Comparaison Andersen 6 étages et Coriolis µ ... 84
5.2 Comparaison des échantillonneurs 1 étage ... 86
5.3 Séquençage nouvelle génération ... 88
5.3.1 Diversité α ... 88
5.3.2 Diversité β ... 88
5.3.3 Top 20 des genres bactériens ... 89
5.3.4 Comparaison de la qPCR et du séquençage nouvelle génération ... 89
Chapitre 6 : Conclusion et perspectives ... 90
Bibliographie ... 92
Annexe 1 ... 108
Table de conversion des trous positifs – Andersen N6 ... 108
Table de conversion des trous positifs – SAS Duo ... 109
ix
Liste des tableaux
Tableau 1-1 : Rôle de chaque collaborateur du projet biométhanisation Tableau 1-2 : Liste des membres du comité de suivi
Table 2-1: Description of the selected biomethanization facilities sites
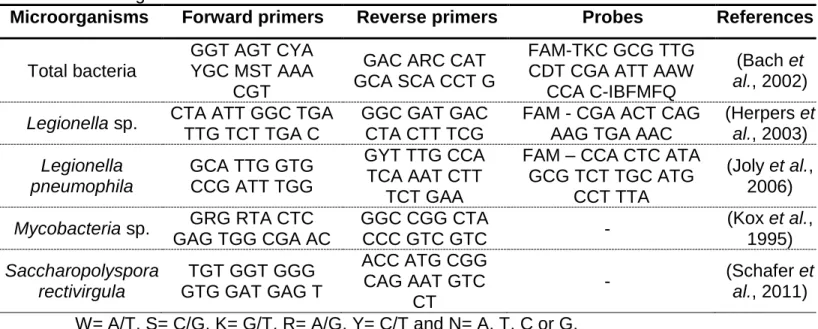
Table 2-2: Primers and probes used for qPCR quantification of selected microorganisms
Table 2-3. qPCR mixtures for each microorganism
Table 2-4. qPCR cycling protocols for each microorganism
Table 2-5: qPCR detection of specific airborne microorganisms found in biomethanization facilities during summer (16S copies/m3).
Table 2-6: qPCR detection of specific airborne microorganisms found in biomethanization facilities during winter (16S copies /m3).
Table 2-7: Endotoxin concentrations (EU/m3) at each sampling site during summer
and winter
Tableau 3-1 : Temps d’échantillonnage, débit (L/min), utilisation et microorganismes recherchés pour les six échantillonneurs utilisés
x
Listes des figures
Figure 1-1 : Mécanismes de déposition des particules en suspension de l’air en fonction de leur diamètre aérodynamique
Figure 1-2 : Échantillonneurs utilisés dans les usines de biométhanisation
Figure 2-1: Correlation of total bacteria for qPCR and culture at both facilities during summer and winter.
Figure 2-2: Concentrations of mesophilic molds (CFU/m3) in both facilities during
summer and winter.
Figure 2-3: 20 most abundant genders during summer (left) and winter (right). Figure 2-4: 20 most abundant genders in BF 1 (left) and BF 2 (right).
Figure 3-1 : UB 1 A : Réception des MOP
Figure 3-2 : UB 1 A : Entreposage/maturation (visite d’été) Figure 3-3 : UB 1 B : Filtres-presses
Figure 3-4 : UB 2 : Réception (visite d’été)
Figure 3-5 : Colonie d’Aspergillus fumigatus ayant poussé sur MEA.
Figure 4-1 : Comparaison des comptes bactériens (UFC/m3) obtenus avec les
échantillonneurs Andersen 6 étages et Coriolis µ
Figure 4-2 : Comparaison des comptes fongiques (UFC/m3) obtenus avec les
échantillonneurs Andersen 6 étages et Coriolis µ
Figure 4-3 : Comparaison des comptes d’actinomycètes thermophiles (UFC/m3)
obtenus avec l’Andersen N6, le SAS Duo et le MAS 100-NT
Figure 4-4 : Comparaison des comptes de moisissures thermophiles (UFC/m3)
obtenus avec l’Andersen N6, le SAS Duo et le MAS 100-NT
Figure 4-5 : Comparaison des comptes d’Aspergillus fumigatus (UFC/m3) obtenus
avec l’Andersen N6, le SAS Duo et le MAS 100-NT
Figure 4-6 : Comparaison des indices de diversité α pour le Coriolis µ et le SASS 3100
Figure 4-7 : Diagramme de Venn représentant les UTO spécifiques et communs récupérés par le SASS 3100 et le Coriolis µ
xi
Figure 4-9 : Comparaison de la diversité β pour le Coriolis µ (rouge) et le SASS 3100 (bleu).
Figure 4-10 : Comparaison des 20 genres bactériens les plus abondants pour chaque échantillonneur
xii
Liste des abréviations et des sigles
ADN: acide désoxyribonucléiqueAMS: 6-stage Andersen Microbial Sampler, échantillonneur Andersen 6 étages
ARN: acide ribonucléique
BF: biomethanization facility, usine de biométhanisation CFU: colony forming units, unités formatrices de colonies
cm3: centimètre cube
COVM : composés organiques volatils d'origine microbienne DAPI : 4',6-diamidino-2-phénylindole
EU: endotoxin units, unités d’endotoxines
g: gramme
IBIS : Institut de Biologie Intégrative et des Systèmes INRS : Institut National de Recherche et de Sécurité
IRSST : Institut de recherche Robert-Sauvé en Santé et en Sécurité du Travail L/min : litres par minute
LAL : limulus amebocyte lysate, lysat d’amoebocyte de limule
LPS : lipopolysaccharides m3: mètre cube
MAS-100 NT: Microbial Air Sampler-100 NT
MEA: malt extract agar, gélose à l’extrait de malt
min: minute mL: millilitre
MNT : mycobactéries non tuberculeuses MOP: matière organique putrescible
MVOC: microbial volatile organic compounds, composés organiques volatils
d'origine microbienne NEB: New England Biolabs ng: nanogramme
NGS: next-generation sequencing, séquençage nouvelle génération
ODTS: organic dust toxic syndrome, syndrome toxique d’exposition aux poussières
xiii
OTU: operational taxonomic unit, unité taxonomique opérationnelle
pb: paires de bases
POM: putrescible organic matter, matière organique putrescible
qPCR: quantitative polymerase chain reaction, réaction en chaine de la polymérase quantitative
SAS Duo: Super Air Sampler Duo
SASS 3100: Smart Air Sampler System 3100 SNG: séquençage nouvelle génération SR: Saccharopolyspora rectivirgula
STEPO : syndrome toxique d’exposition aux poussières organiques
TSA: tryptic soy agar, gélose trypticase soja
UB : usine de biométhanisation UE : unité d’endotoxine
UFC : unités formatrices de colonies UTO : unité taxonomique opérationnelle VLE : valeur limite d’exposition
µm: micromètre %: pourcentage °C: degrés Celcius
xiv
Remerciements
Le plus gros merci est dédié à Caroline Duchaine, ma directrice de recherche, qui est une source perpétuelle de motivation et de rires. Je me considère énormément chanceuse de pouvoir côtoyer une femme aussi exceptionnelle et de faire partie de son équipe. Merci de m’avoir accueillie dans ton labo et de m’avoir confié le projet biométhanisation. Je suis persuadée que les trois ou quatre prochaines années seront encore plus palpitantes. Je suis maintenant prête à diriger mon propre projet, et c’est grâce à toi. Je t’embrasse bien fort.
Un merci tout spécial à ma chère Laeti d’amour, qui m’a formée aussi bien pour les sorties terrain que pour la pesée de fumier ou de morceaux de cochon décomposés. J’ai eu un plaisir fou à pouvoir travailler avec toi. Je suis très honorée de pouvoir poursuivre le projet Noro, mais un peu moins d’avoir à fouiller dans tes cahiers. Je souhaite de tout mon cœur que tu puisses revenir du bon côté de l’Atlantique. Et même si je commence un doctorat, je resterai à jamais ta petite stagiaire. Je t’aime.
Merci à Pop et Mom, qui m’ont toujours encouragée à faire ce qui me passionne, bien que cette passion peut impliquer des odeurs corporelles douteuses après des sorties terrain. Merci de me faire pratiquer mes présentations orales, de vous intéresser à ce que je fais et de vous investir autant dans ma réussite et dans celle de mon frère. N’oubliez pas que je vous aimerai toujours et j’ai trois ou quatre ans pour attraper la gastroentérite.
À Simon, mon petit frère que j’aime très fort (oui il mesure 6 pieds, mais qu’est-ce que ça change?). Merci d’avoir fait semblant de m’écouter et de m’avoir dit souvent « est bonne »! Je te souhaite d’avoir autant de plaisir que moi à travailler en recherche, même si ça implique des lasers, des recettes de verre ou des concepts un peu trop spéciaux pour mon cerveau. Ça m’arrive à moi aussi de faire semblant de t’écouter… Profite des opportunités qui s’offrent à toi et ne lâche surtout pas, tu es bien parti!
xv
Je remercie Hamza, Vanessa, Evelyne et Jonathan, les étudiants gradués avec qui j’ai passé ces deux dernières années. J’aimerais leur dédier un merci culinaire puisque la majorité de nos conversations ont tourné autour de la nourriture. Travailler avec vous a été une partie de plaisir. Je vous souhaite bien du succès et de la bonne bouffe à profusion!
Merci à Marc, Nathalie et Valérie, les trois professionnels de recherche Duchaine, pour votre savoir-faire, votre disponibilité et vos conseils. J’espère que vous vous rendez compte à quel point c’est motivant de pouvoir échanger avec vous. Soyez rassurés, je continuerai de vous apporter du chocolat (note aux étudiants gradués : c’est toujours pratique d’avoir du chocolat à son bureau).
Même si techniquement Camille a travaillé avec moi pour mon projet de doctorat, je ne la remercierai jamais assez d’avoir coulé des centaines de litres de
TSA et rempli des milliers de tubes de top agar. Je suis très heureuse de t’avoir eu
comme stagiaire. Je t’aime fort et s’il ne fait pas ton affaire, « cancelle ».
J’aimerais remercier le Laboratoire de Mycologie Alimentaire, le tout premier laboratoire qui m’a accueillie alors que je n’avais pratiquement pas d’expérience. Merci à Steve Labrie et à Catherine Viel de m’avoir transmis votre passion de travailler en recherche. Merci à Marie-Hélène, Geneviève, Marilyne et Ariane pour ce fantastique été passé avec vous.
Je remercie Steve Charette et Guillaume Bilodeau pour avoir accepté de faire partie de mon Comité d’encadrement et pour m’avoir donné de judicieux conseils tout au long de mon cheminement.
Merci à tous les membres du comité de suivi, ainsi qu’à Marie-France d’Amours pour avoir coordonné la valorisation du projet et le comité.
xvi
Je termine par remercier le CRSNG pour m’avoir octroyé une bourse de recherche pour la maîtrise et l’IRSST pour avoir subventionné le projet biométhanisation.
xvii
Avant-propos
Cet ouvrage est composé de six parties. Une mise à jour des connaissances sur l’aérobiologie, la biométhanisation et les bioaérosols dans les usines de biométhanisation est présentée en introduction au premier chapitre. Le deuxième chapitre consiste en une partie de la méthodologie et des résultats, présentés sous la forme d’un article scientifique. Les chapitres trois et quatre contiennent, respectivement, de la méthodologie et desrésultats supplémentaires qui n’ont pas été présentés dans l’article scientifique. Le cinquième chapitre est la discussion des résultats obtenus (chapitres 2, 3 et 4) lors de ce projet et le lien entre ceux-ci et la littérature. Finalement, la conclusion et les perspectives associées au projet sont présentées au dernier chapitre.
Article scientifique
« Bioaerosols concentrations in working areas in biomethanization facilities ». Cet article a été soumis le 20 février 2017 dans la revue Journal of the Air & Waste Management Association (JA&WMA). À titre de première auteure, j’ai effectué les expérimentations et écrit la première ébauche de l’article scientifique. Hamza M’Bareche et Marc Veillette ont contribué à la récupération des échantillons lors des sorties terrain, au traitement des données de séquençage nouvelle génération et à la correction du manuscrit. Jacques Lavoie, Bouchra Bakhiyi et Dr Joseph Zayed ont participé au projet, mais se sont attardés à d’autres volets de caractérisation de cet environnement de travail et à la révision de l’article. La conception de l’étude, la supervision des travaux, ainsi que la correction finale de l’article ont été réalisées par Dre Caroline Duchaine.
1
Chapitre 1 : Introduction
1.1 Les Bioaérosols
Un aérosol est constitué de particules d’un solide ou d’un liquide en suspension dans un gaz, généralement l’air. Ces particules mesurent en moyenne de 0,002 à 100 μm de diamètre et peuvent même atteindre 200 μm (Burge, & Solomon, 1987; W. C. Hinds, 1999). Les bioaérosols (du mot grec, bios signifiant «vie») sont des aérosols constitués de toute entité biologique. Ils sont composés d’organismes vivants ou morts, tels des microorganismes pathogènes ou non (bactéries, moisissures et virus), des plantes, des animaux, ainsi que de leurs composantes comme des allergènes, différentes toxines (endotoxines et mycotoxines), du peptidoglycane, des β(1→3)-glucanes, du pollen ou des fibres de plantes. (Douwes et al., 2003; Sykes et al., 2011).
Plusieurs facteurs peuvent influencer la composition et la concentration des bioaérosols, tels que les mécanismes de dispersion, les conditions environnementales (température, humidité, vents ou climat) ou encore la source d’émission (Epstein et al., 2001; Persoons et al., 2010). La quantité, la viabilité et le potentiel infectieux des microorganismes en suspension dans l’air peuvent aussi être altérés par ces conditions (Pillai, & Ricke, 2002; Tang, 2009).
Les sources de bioaérosols sont abondantes et variées. Les bioaérosols peuvent être produits par des sources naturelles tels les océans, les lacs, les rivières, les geysers, les forêts ou les plantes. Les humains génèrent également des bioaérosols par la voie respiratoire, la toux, les éternuements ou encore par la peau. L’industrialisation apporte également son lot de bioaérosols. Le secteur agricole (porcheries, poulaillers, fermes laitières, tourbières) ainsi que diverses usines (traitement des eaux usées, gestion des déchets) produisent des bioaérosols en énorme quantité.
Le diamètre aérodynamique des particules est un concept employé afin d’être en mesure de décrire le comportement des particules dans l’air qui ne sont pas
2
nécessairement sphériques. Il correspond ainsi au diamètre d’une particule ayant la densité de l’eau (1 g/cm3) et qui possède la même vitesse de déposition que la
particule à l’étude. Par conséquent, une particule solide en suspension dans l’air aura le même comportement qu’une particule d’eau de même diamètre aérodynamique.
Le comportement des bioaérosols est régi par des lois de physique. Selon la loi de Stokes, les forces physiques d’inertie agissant sur les aérosols seront négligeables par rapport à la viscosité de l’air (W. Hinds, 1999). Ainsi, en fonction de leur diamètre aérodynamique, les particules en suspension dans l’air ne tomberont pas toutes à la même vitesse et se déposeront par sédimentation, impaction par inertie, interception, diffusion ou attraction électrostatique (figure 1-1). La sédimentation a lieu lorsque les forces d’attraction gravitationnelle et de résistance de l’air sont trop élevées pour annuler la flottabilité d’une particule, qui a généralement un diamètre aérodynamique de plus d’un micron. L’impaction par inertie fait appel à une notion de physique. L’inertie d’une particule est inversement proportionnelle à sa masse. Les forces externes appliquées sur une particule possédant une masse élevée doivent être plus importantes pour parvenir à faire dévier cette particule de sa trajectoire. Lorsqu’elles ne sont pas suffisantes, la particule conserve sa trajectoire et s’impacte sur une surface. L’interception se produit lorsqu’une particule suivant le courant d’air entre en contact avec une surface sans être déviée. La diffusion est le mouvement aléatoire d’une particule de moins de 0,5 micron. Celle-ci est bombardée par les molécules de gaz qui l’entourent, ce qui la fait vibrer, augmentant ainsi la possibilité d’entrer en contact avec une surface. L’attraction électrostatique se produit lorsqu’une particule chargée s’approche d’une surface de charge opposée.
3
Figure 1-1 : Mécanismes de déposition des particules en suspension de l’air en
fonction de leur diamètre aérodynamique (figure adaptée de (W. C. Hinds, 1999)).
1.2 L’étude des bioaérosols et l’échantillonnage
L’étude des bioaérosols est un champ de recherche complexe et fastidieux qui nécessite de nombreux outils afin d’obtenir une vue d’ensemble de l’environnement étudié. Plusieurs difficultés techniques peuvent être rencontrées, ce qui peut empêcher ou limiter l’échantillonnage ou la croissance des microorganismes présents dans l’air. Jusqu’à présent, aucune méthode standard d’échantillonnage n’est disponible. Différents appareils de récupération d’échantillons d’air sont maintenant sur le marché, chacun s’appuyant sur les principes physiques du comportement des particules, soit l’impaction par inertie, l’interception, la diffusion et l’attraction électrostatique.
Dans la littérature, deux types d’échantillonneurs sont privilégiés pour la récupération des bactéries et des moisissures dans les usines de compostage et de
4
biométhanisation: les filtres et les impacteurs (Albrecht et al., 2007; Bru-Adan et al., 2009; Hryhorczuk et al., 2001). Pour la présente étude, quatre impacteurs, un filtre électrostatique et un échantillonneur de type cyclone liquide ont été employés (voir section 1.2.1).
Plusieurs aspects, dont la géométrie de l’échantillonneur, la vitesse du vent, le débit de la pompe ou encore la charge ou la grosseur des pores du filtre, peuvent influencer l’efficacité globale d’un appareil (Masclet, & Marchand, 2004).
Il est également difficile de conserver la viabilité des microorganismes vivants lors de la récupération des bioaérosols. Leur survie dépendra de plusieurs facteurs, dont des conditions de croissance avant l’aérosolisation, des conditions environnementales lors de l’aérosolisation et des méthodes de récupération et d’énumération (Benbough, 1967; Blakeman, & Fokkema, 1982; Cox, 1968, 1969, 1971; Cox, & Baldwin, 1967; Ehrlich et al., 1970; Hatch, & Dimmick, 1966; Hess, 1965). De plus, l’aérosolisation est un processus stressant pour les microorganismes et peut altérer leur intégrité et leur viabilité (Benbough, 1967; Cox, 1969, 1971; Poon, 1966).
Pour l’étude d’échantillons terrains, il est nécessaire d’utiliser plusieurs méthodes afin d’obtenir un portrait plus global de la charge bactérienne et de sa composition. La description de chacun des échantillonneurs utilisés est disponible ci-dessous.
5
1.2.1 Les échantillonneurs d’air
Figure 1-2 : Échantillonneurs utilisés dans les usines de biométhanisation :
l’Andersen 6 étages (A), l’Andersen N6 (B), le SAS Duo (C), le MAS 100-NT (D), le SASS 3100 (E) et le Coriolis µ® (F)
1.2.1.1 L’Andersen 6 étages
L’Andersen 6 étages (Figure 1-2A) est un appareil utilisé depuis des décennies pour l’échantillonnage des bioaérosols. Cet échantillonneur a été conçu et construit par Ariel A. Andersen en ayant comme objectif de représenter l’arbre respiratoire humain et de séparer les bioaérosols en fonction de leur taille (Andersen, 1958).
Les particules entrant dans l’arbre respiratoire se déposent plus ou moins profondément en fonction de leur taille. Les plus grosses particules (5 µm et plus) vont s’arrêter dans la zone nasopharyngée, les particules de taille moyenne (entre 1 et 5 µm) vont se rendre dans la zone trachéobronchiale et les fines particules (1
(B) (C)
(D) (E) (F)
6
µm et moins) vont pouvoir pénétrer la zone pulmonaire et se déposer dans les alvéoles (J. H. Brown et al., 1950). Les deux premiers étages de l’Andersen 6 étages correspondent à la zone nasopharyngée, ceux du milieu à la zone trachéobronchiale et les deux derniers à la zone pulmonaire (Andersen, 1958).
L’Andersen 6 étages se base sur le principe d’impaction par inertie afin de séparer les bioaérosols selon leur diamètre aérodynamique. L’inertie est directement reliée à la masse d’une particule, qui influence son diamètre aérodynamique. Plus sa masse est élevée, plus son inertie est grande (Benson, 2004). Il faut alors appliquer plus de forces externes pour être en mesure de la faire dévier sa trajectoire. Cet échantillonneur utilise la vitesse de l’air comme force extérieure. Chaque étage est composé de 400 trous de diamètre de plus en plus petit, faisant en sorte que la vitesse de l’air augmente d’étage en étage. Les grosses particules, ayant une inertie élevée, vont s’impacter sur le milieu de culture du premier étage alors que les particules plus petites vont être déviées et vont se rendre à l’étage inférieur. Ce principe s’applique pour chacun des six étages. L’air à échantillonner est aspiré par une pompe à haut volume (Gast Manufacturing Inc., Benton Harbor, E.-U.) préalablement calibrée à un débit d’air de 28,3 L/min.
1.2.1.2 L’Andersen N6
L’Andersen N6 (Figure 1-2B) est seulement constitué du sixième étage de l’impacteur complet, soit l’étage composé des plus petits trous. La vitesse de l’air étant élevée, les bioaérosols de toutes grosseurs vont s’impacter sur la gélose. Celui-ci possède un d50 de 0,65µm, c’est-à-dire que 50% des particules de cette
grosseur sont échantillonnés (Andersen, 1958).
1.2.1.3 Le Super Air Sampler Duo (SAS Duo)
Le SAS Duo (Figure 1-2C) est un impacteur d’un seul étage composé de deux boîtes de Petri. Il fonctionne selon le même principe que l’Andersen N6. Toutefois, un plus grand volume d’air (200 L par tête) est récupéré à plus fort débit (180 L/min par tête). Une particularité de cet appareil est que la totalité des particules de 1 µm et plus est captée (Bioscience International, 2012).
7
1.2.1.4 Le Microbial Air Sampler-100 NT (MAS-100 NT)
Tout comme le SAS Duo et l’Andersen N6, le MAS-100 NT (Figure 1-2D) est un impacteur à un étage. Celui-ci échantillonne 250 L d’air sur une boîte de Petri à un débit de 100 L/min.
1.2.1.5 Le Smart Air Sampler System 3100 (SASS 3100)
Le SASS 3100 (Figure 1-2E) est le seul échantillonneur haut débit utilisé dans le cadre de ce projet. Le débit peut être ajusté entre 50 et 310 L/min. Cet échantillonneur récupère les bioaérosols sur des filtres fibreux chargés. Chaque fibre du filtre possède un champ électrique qui charge les particules.
1.2.1.6 Le Coriolis μ®
Le Coriolis μ® (Figure 1-2F) est un impacteur de type cyclone liquide. Un vortex est créé, ce qui fait monter le liquide de collection (15 mL de tampon salin 0,85%) sur les parois de la coupe de plastique. Les bioaérosols échantillonnés s’impactent donc dans le tampon. Le débit utilisé par cet échantillonneur est modifiable. Celui-ci permet la collecte de bioaérosols dans un liquide (15 mL de tampon salin 0,85%) qui peut par la suite être utilisé pour des analyses moléculaires.
1.2.2 Biais et limites
Une particularité de l’étude des bioaérosols est que, mis à part l’utilisation du séquençage nouvelle génération (SNG), ce qui est trouvé correspond à ce qui est recherché. Le milieu de culture choisi ne va permettre la croissance que d’un seul groupe de microorganismes (ex. : bactéries hétérotrophes mésophiles sur tryptic soy agar). Les amorces et sondes utilisées en qPCR, qu’elles soient spécifiques ou non, ne vont cibler que les microorganismes possédant la séquence correspondante. À titre d’exemple, les amorces et sondes EUB (Bach et al., 2002) permettent la détection de toutes les bactéries en ciblant l’ARN 16S bactérien, qui est un gène universel (Woese, 1987), alors que celles du Sac ciblent spécifiquement un fragment d’environ 100 paires de bases (pb) de l’ARNr 16S de
8
La principale limite des études terrain est que l’échantillonnage constitue une « photo instantanée » d’une situation et que cela entraine un biais dans l’évaluation. La plupart du temps, les quantités de microorganismes sont surestimées ou sous-estimées en fonction des conditions changeantes dans l’environnement (variabilité spatiale et temporelle). Par exemple, il est logique de penser qu’une ouverture soudaine d’une entrée d’air aura comme conséquence de diluer la charge microbienne présente. Aussi, la manutention, la livraison et le déchiquetage des MOP peut générer de façon ponctuelle des bioaérosols et, ainsi induire une modification rapide des concentrations (Albrecht et al., 2007; Epstein et al., 2001; Le Goff et al., 2010; Sanchez-Monedero et al., 2005; Schlosser et al., 2009; Vinneras
et al., 2006; Wouters et al., 2006).
Les temps d’échantillonnage des appareils sont variables, mais plus ce temps est court, plus les chances sont grandes de récolter des échantillons lors de ces fluctuations. Des temps plus longs réduisent l’impact des changements de concentrations, mais peuvent réduire la viabilité des microorganismes déjà stressés et endommagés par leur aérosolisation. Selon les temps d’échantillonnage et des débits utilisés, l’image spatiale et temporelle obtenue représentera plus ou moins la réalité : Les échantillonneurs à haut débit utilisés pendant une courte période donneront une image plus restreinte, mais très complète des conditions à un temps donné tandis que les échantillonneurs à plus bas débit utilisés sur de plus longues périodes adouciront les fluctuations, mais pourraient endommager la viabilité des microorganismes (Macher, & Willeke, 1992; Nevalainen et al., 1993; Terzieva et al., 1996). Les surfaces ou les milieux de récupération sont un autre facteur pouvant influencer la survie. L’échantillonnage effectué par le Coriolis µ dans un tampon liquide ou encore par l’Andersen 6 étages sur milieux gélosés est plus doux que celui du SASS 3100 qui se fait sur un filtre électrostatique ou des cassettes IOM développées par l’Institute of Occupational Medicine, qui récupèrent la fraction inhalable des bioaérosols sur des filtres.
Les milieux de culture non sélectifs s’avèrent être un choix judicieux puisque la composition d’échantillons environnementaux est très diversifiée, la plupart du
9
temps inconnue et que les microorganismes sont souvent abimés par leur passage dans l’air (Duchaine et al., 2002; EMSL analytical, 2014; Fletcher, & Fiscus, 1979). Toutefois, ces milieux ne permettent pas la croissance de toutes les bactéries et moisissures (Hess-Kosa, 2016) et n’empêchent pas la croissance rapide de certains microorganismes envahissants, comme les moisissures du genre Mucor. Celles-ci sont fréquemment retrouvées dans le sol, la matière organique, la matière végétale en décomposition, ainsi qu’à la surface des plantes (The Regents of the University of California, Davis campus, 2014). Il n’est donc pas surprenant de retrouver des spores en suspension dans l’air. Ces microorganismes envahissants, lorsqu’en culture sur boîtes de Petri, empêchent l’obtention d’un compte précis.
Les appareils, ainsi que les méthodes d’analyse subséquentes, ont également une limite de détection, ce qui peut faire en sorte que des microorganismes présents en faible concentration dans l’air ne seront pas détectés (Douwes et al., 2003; Organics Recycling Buyer's Guide, 2009; Harrison, 2007b).
Il faut garder en tête que les impacteurs (Figure 1-2 A, B, C et D) doivent être utilisés avec leurs tables respectives de conversion des trous positifs. En effet, chaque zone de croissance provient de l’impaction d’une ou plusieurs particules contenant un ou plusieurs microorganismes. L’œil compte donc les zones de croissance et des tables de correction construites à partir de modèles mathématiques permettent d’estimer la coïncidence des impactions lorsqu’il y a des trous d’impaction demeurés vides (Andersen, 1958; International pbi Spa Milan, 2001; MBV). Cette estimation permet de mieux évaluer la concentration de microorganismes dans l’air et contourne la limite des impactions multiples. Les résultats sont exprimés en unités formatrices de colonies par mètre cube (UFC/m3).
Deux biais co-agissent sur la sensibilité de la quantification moléculaire. Premièrement, le volume d’air d’où provient l’ADN servant à l’analyse aura une influence directe sur la sensibilité : plus le volume échantillonné est important, plus le seuil de détection sera faible. Deuxièmement, une fraction de cet ADN est utilisé pour le protocole de quantification, qui lui aussi possède une certaine limite de détection. Selon les agents quantifiés, les volumes d’air échantillonnés, la sensibilité
10
des protocoles qPCR, un seuil de détection peut être calculé. Il est possible d’améliorer chacun de ces facteurs en jouant sur les temps d’échantillonnage et l’optimisation du protocole qPCR afin de minimiser les seuils de détection. Il est toujours possible que les concentrations de certains microorganismes auxquels sont exposés les travailleurs ne soient pas détectées dans nos conditions expérimentales.
Le traitement des échantillons avant le SNG est critique puisque des contaminations en matériel génétique peuvent être traînées et amplifiées lors du séquençage. Il devient alors difficile de discriminer entre l’ADN échantillonné et l’ADN contaminant (Mbareche, et al. Sous presse). La technologie utilisée, soit l’Illumina, produit également des millions de séquences aux dépens d’un certain taux d’erreurs, d’où l’importance du traitement des données avec la bio-informatique afin d’éliminer ces erreurs de séquençage (Ross et al., 2013).
Une autre limite est que de faibles températures ambiantes peuvent endommager les appareils, ce qui est un problème considérable pour les études terrain se déroulant l’hiver. Par conséquent, des données ne peuvent être compilées pour certains sites ou encore pour les contrôles extérieurs lors de la saison hivernale.
Pour terminer, les résultats d’échantillonnages terrain dans les usines de biométhanisation devraient être comparés avec les résultats de milieux similaires. Toutefois, les usines de compostage sont la seule référence disponible pour le moment, car la biométhanisation est un procédé trop récent, mais puisque le même type de matières organiques putrescibles y est manipulé et transformé, cette comparaison nous semble valable.
1.3 La biométhanisation
La biométhanisation est un procédé par lequel les bactéries anaérobies transforment les matières organiques putrescibles (MOP) en biogaz et en digestat (ADEME, 2015; Amarante, 2010; Pain, & Hepherd, 1985). Les MOP peuvent être
11
composées de fumier de vache, de boues d’épuration des eaux usées, de déchets municipaux, de résidus verts, etc. (Holm-Nielsen et al., 2009; Macias-Corral et al., 2008; Ward et al., 2008).
1.3.1 Réactions chimiques et procédé
Quatre réactions chimiques se déroulent dans les digesteurs : l’hydrolyse, l’acidogenèse, l’acétogenèse et la méthanogenèse. L’hydrolyse consiste à réduire enzymatiquement la matière organique complexe (lipides, polysaccharides, protéines, graisses et acides nucléiques) en composés plus simples (monosaccharides, acides aminés, acides gras, etc.). Cette étape est prise en charge par des bactéries anaérobies strictes, telles que Clostridia et Bactericides, et des bactéries aérobies facultatives comme Streptococci (Ostrem, 2004; Yadvika et
al., 2004). L’hydrolyse est considérée comme étant l’étape limitante de la
biométhanisation (Pavlostathis, & Giraldogomez, 1991) puisque ce sont les composés simples qui servent de source de carbone ou d’énergie aux bactéries (Yadvika et al., 2004). D’autres bactéries s’occupent de la deuxième étape de la biométhanisation, soit l’acidogenèse qui, comme son nom l’indique, est une production d’acide. Les composés simples de l’hydrolyse sont fermentés, ce qui résulte en la production d’acide acétique, d’hydrogène, de dioxyde de carbone, de méthanol, d’acide propionique, d’acide butyrique, d’acide formique, d’acide lactique, d’éthanol, etc. Les quatre premiers peuvent être immédiatement utilisés par les bactéries méthanogènes, alors que les autres produits doivent passer par la troisième étape, soit l’acétogenèse. Les bactéries responsables de cette étape convertissent ces produits (acide propionique, acide butyrique, acide formique, acide lactique et éthanol) en acide acétique, en hydrogène et en dioxyde de carbone. Lors de la méthanogenèse, la dernière étape de la biométhanisation, les bactéries méthanogènes telles que Methanosarcina spp., Methanothrix spp.,
Methanobacterium et Methanococcus utilisent l’acide acétique, l’hydrogène, le
dioxyde de carbone et le méthanol pour produire du méthane et du dioxyde de carbone (Rapport et al., 2008; Yadvika et al., 2004). Les trois réactions sont présentées ci-dessous (Rapport et al., 2008).
12
1. Méthanogenèse acétotrophe : 4 CH3COOH 4 CO2 + 4 CH4
2. Méthanogenèse hydrogénotrophe: CO2 + 4 H2 CH4 + 2 H2O
3. Méthanogenèse méthylotrophe: 4 CH3OH + 6 H2 3 CH4 + 2 H2O
Ces quatre réactions chimiques (hydrolyse, acidogenèse, acétogenèse et méthanogenèse) peuvent se dérouler dans le même digesteur, ce qu’on appelle la biométhanisation en une étape. L’hydrolyse peut se dérouler dans un digesteur différent, on va alors qualifier le procédé de biométhanisation en deux étapes (Ostrem, 2004; Rapport et al., 2008).
L’hydrolyse, l’acidogenèse, l’acétogenèse et la méthanogenèse sont dépendantes de la flore microbienne présente dans les MOP (Moletta, 2002). Cette flore peut varier en fonction du type et de l’origine des MOP, ainsi qu’en fonction des saisons (ADEME, 2014; Buffiere, Carrere et al., 2007).
1.3.2 Optimisation du procédé de biométhanisation
Certaines usines choisissent de réutiliser une partie du produit fini comme inoculum d’un nouveau lot de matières premières puisqu’il s’agit d’un moyen efficace de s’assurer que les bactéries ayant un rôle dans le processus de biométhanisation soient présentes dès le début du procédé (Malik and Dahiya, 1990; Santosh et al., 1999).
Les MOP peuvent subir un prétraitement avant leur entrée dans les digesteurs. Ce prétraitement peut être mécanique, biologique ou physico-chimique, son objectif étant de réduire la taille des particules et d’uniformiser les matières premières qui seront introduites dans le digesteur, engendrant ainsi une digestion plus rapide et une augmentation de la production de biogaz (Buffiere et al., 2007; Mata-Alvarez et al., 2000; Palmoswki, & Muller, 1999). Le prétraitement employé dans les usines de biométhanisation visitées lors du projet est mécanique. La réception des MOP et ce prétraitement sont semblables aux usines de compostage.
13
Plusieurs autres paramètres sont susceptibles d’influencer le procédé de biométhanisation, tels que le pH, la teneur en matières organiques volatiles, la teneur en matières sèches, le rapport carbone/azote et le potentiel méthanogène (ADEME, 2014; Amarante, 2010; Buffiere et al., 2007). Le pH optimal du mélange de MOP est neutre et se situe entre 6,8 et 7,2 (Yadvika et al., 2004). Le pouvoir tampon, quant à lui, permet une résistance aux changements drastiques de pH et est donc d’une importance capitale. La dégradation des matières organiques volatiles se fait facilement, mais les produits font baisser le pH du digesteur. Cela a comme principale conséquence d’inhiber la croissance des bactéries méthanogènes et donc la production de biogaz (Mosey, & Fernandes, 1989). Une haute teneur en matières sèches (plus de 40%) peut également freiner le processus de biométhanisation. Tous les substrats contiennent de la matière sèche, mais la teneur peut varier. Par exemple, les fruits et les légumes contiennent souvent moins de 10% de matière sèche alors que des restes de tables (pain, pâtes) mélangés à des résidus de jardin en contiennent de 20 à 25% (Mata-Alvarez, 2003). Les microorganismes utilisent le carbone de 25 à 30 fois plus rapidement qu’ils utilisent l’azote. Par conséquent, un rapport carbone/azote de 20-30 :1 permet une meilleure digestion (Bardiya and Gaur, 1997; Malik et al., 1987). La co-digestion, abordée ci-dessous, est une façon efficace de gérer ce rapport. Dans le but d’obtenir un ratio optimal, des matières premières riches en carbone peuvent être mélangées avec d’autres riches en azote (Barnett, 1978; Fry and Merill, 1973; Gotass, 1956; Singh, 1974). Le potentiel méthanogène est la quantité de méthane obtenue expérimentalement, en mètres cubes par kilogramme de MOP (Buffiere et al., 2007; Ward et al., 2008). Ce potentiel varie en fonction de la composition des MOP. Par exemple, les résidus de maïs produisent plus de méthane que le fumier de bovin (Ward et al., 2008).
La digestion se produit soit en conditions mésophiles (30-40°C) pour un total de 20 jours, soit de 10 à 15 jours en conditions thermophiles (50-65°C), dépendamment de la technologie utilisée.
14
1.3.3 Biogaz et traitement des extrants
Le biogaz est constitué d’un mélange de méthane (55 à 70%), de dioxyde de carbone (30 à 45%), de sulfure d’hydrogène et d’autres composés chimiques (Deublein , & Steinhauser, 2010). Ce mélange varie en fonction du type de MOP traitées et des paramètres utilisés lors de la digestion anaérobie (température, temps de séjour, pH, etc.) (MDDEP, 2011).
Puisque les usines participant à l’étude utilisent des conditions de température, des temps d’incubation et des matières premières différentes, il est attendu que la composition et la quantité du biogaz produit ne soient pas identiques. Une fois le processus de biométhanisation complété, les digesteurs sont déchargés et le digestat est entreposé, séché et traité. En effet, celui-ci est trop humide et contient des acides gras volatils, qui peuvent s’avérer phytotoxiques (Poggi-Varaldo et al., 1999). Il peut ensuite servir à l’épandage agricole. Le biogaz produit est épuré en fonction de sa valorisation finale. En effet, plusieurs techniques sont disponibles. Il peut être utilisé pour chauffer les installations, être injecté dans le réseau public de gaz naturel ou être liquéfié (RecycQuébec, 2012). Le biogaz liquéfié sert de carburant pour les automobiles et autres moyens de transport. Les eaux de procédés peuvent être utilisées comme matières fertilisantes ou celles-ci sont traitées et acheminées dans les égouts municipaux (RecycQuébec, 2012).
1.3.4 Principaux avantages de la biométhanisation
Étant donné que le potentiel économique est non-négligeable, plusieurs études ont été menées afin de trouver des moyens d’optimiser le procédé de biométhanisation. Une façon d’accroître la production de biogaz est de faire de la co-digestion, qui consiste à mélanger des matières premières, ce qui va créer un effet synergique. Ce mélange peut également permettre d’atteindre un pourcentage d’humidité optimal pour les réactions biochimiques (Mata-Alvarez et al., 2000). Il faut toutefois prendre en considération que les couts d’installation et d’opération des usines de biométhanisation sont plus élevés comparativement aux usines de
15
compostage et que le procédé est plus complexe (Mata-Alvarez et al., 2000; RecycQuébec, 2012).
Schlegelmilch et al. ont souligné que les odeurs peuvent être contrôlées et minimisées par une bonne gestion du compostage et des biogaz (Schlegelmilch et
al., 2005), ce qui est un argument favorable à l’implantation des usines de
biométhanisation dans les centres urbains.
La biométhanisation est une alternative écologique à l’enfouissement des MOP et a un potentiel économique plus élevé que le compostage. Son principal avantage est la récupération du biogaz, qui est autrement relâché dans l’environnement. Ce biogaz peut être vendu, rendant le processus en partie lucratif. De plus, la combustion du méthane produit du dioxyde de carbone, un gaz à effet de serre 21 fois moins puissant (Olivier, 2009). Des microorganismes pathogènes, des substances chimiques nuisibles et des métaux lourds contenus dans les matières premières pourraient être présents dans le lixiviat, même après le processus de biométhanisation. Contrairement aux sites d’enfouissement, le lixiviat est récupéré et est recirculé, empêchant ainsi la contamination du sol et des eaux souterraines (Amarante, 2010). Edelmann et al. ont déterminé que la balance énergétique était beaucoup plus élevée pour la biométhanisation que pour le compostage et l’incinération, rendant ce traitement supérieur d’un point de vue écologique (Edelmann et al., 1999).
1.4 Les bioaérosols dans les usines de biométhanisation et de
compostage et la santé occupationnelle
Jusqu’à présent, aucune étude ne s’est penchée sur la description des bioaérosols dans les usines de biométhanisation. Comme mentionné plus haut, les usines visitées utilisent les mêmes premières étapes de traitement des MOP (réception et prétraitement mécanique). Les matières utilisées sont également similaires. Il est donc possible de suspecter que les microorganismes aérosolisés seront semblables à ceux retrouvés dans l’air des usines de compostage.
16
Bien que les humains soient continuellement en contact avec les bioaérosols (nature, plantes, animaux, hommes), la dégradation des matières organiques par activité biologique, l’abondance des sources, ainsi que les activités de manutention dans les usines de compostage et de biométhanisation font augmenter considérablement la charge microbienne présente dans l’air (Albrecht et al., 2007; Harrison, 2007; Schlosser et al., 2009; Vinneras et al., 2006). Dans les usines de biométhanisation visitées, la matière organique et l’air extérieur sont les deux sources principales de bioaérosols. Les portes de l’usine s’ouvrent plusieurs fois par jour pour permettre l’entrée des camions de livraison, laissant pénétrer de grands volumes d’air extérieur.
La livraison, la manutention, le tri et le retournement du compost produisent de grandes quantités de bioaérosols, mettant en suspension dans l’air les microorganismes retrouvés dans les matières premières et le produit final (Epstein
et al., 2001; Le Goff et al., 2010; Sanchez-Monedero et al., 2005; Schlosser et al.,
2009; Wouters et al., 2006). Les charges électrostatiques, les flux de convection causés par des différences de températures, le mouvement des roues et des pneus d’équipement, ainsi que la circulation des véhicules peut également générer des bioaérosols (Pankhurst et al., 2011; Persoons et al., 2010; Schlosser et al., 2009).
La flore microbienne des bioaérosols peut varier, principalement en fonction de la composition des MOP traitées. Il est donc difficile de prédire à quelles étapes du traitement de biométhanisation les travailleurs sont les plus à risque (Persoons
et al., 2010; Reinthaler et al., 1999).
Hryhorczuk et al. ont confirmé que le nombre de bactéries aérosolisées peut varier en fonction du moment de la journée et qu’il augmente lors du retournement des piles de compost (Hryhorczuk et al., 2001). L’échantillonnage de l’air est donc une photo instantanée d’une situation variable dans le temps. Mais ceci est vrai pour toutes les études d’évaluation de l’exposition avec des approches stationnaires sur des courtes périodes de temps.
17
Les travailleurs des usines de compost et de biométhanisation sont donc en contact avec ces microorganismes, dont certains peuvent être nuisibles à la santé (Searl, 2008; Swan et al., 2003; Sykes et al., 2011; Wery, 2014). Les bioaérosols produits dans les usines de compostage sont complexes et comprennent des bactéries, des actinomycètes, des endotoxines, des virus, des levures, des moisissures, des β-D-glucanes et des composés organiques volatils d'origine microbienne (COVM) (Douwes et al., 2003; Duchaine, 2012; Schlosser et al., 2009; Sykes et al., 2011). Puisqu'une des phases du compostage est thermophile, il est normal de retrouver des microorganismes dont la plupart sont thermotolérants, thermophiles ou sporulants (Le Goff et al., 2010). Ceux-ci ne devraient être présents qu’en faibles concentrations dans les usines de biométhanisation, la phase thermophile se déroulant dans des digesteurs fermés.
1.4.1 Les microorganismes et les composés d’intérêt
1.4.1.1 Les bactéries
La quantité de bactéries présente dans l’air peut être un indicateur du niveau de contamination de l’environnement étudié. La recherche des bactéries totales par culture et par méthode moléculaire (qPCR) s’avère aujourd’hui indispensable dans la caractérisation des échantillons d’air. Dans les usines de compostage, un nombre total de 105 – 106 bactéries/m3 d’air ont été détectées par qPCR (Bru-Adan et al.,
2009; Moletta et al., 2007; Wheeler et al., 2001). Ce nombre est d’environ 3 X 104
UFC/m3 pour les bactéries cultivables (Bru-Adan et al., 2009). L’étude de Schäfer et al. a quant à elle démontré des concentrations de 3,4 X 104 à 1,6 X 108 bactéries/m3
d’air à l’aide de la coloration au 4',6-diamidino-2-phénylindole (DAPI) et d’un compte
en microscopie, cette variation étant attribuable aux sites échantillonnés (sites de livraison, chargement, zone de tamisage) (Schafer et al., 2013). Des concentrations de 106 à 109 bactéries/m3 d’air ont aussi été trouvées par coloration au DAPI par
Albrecht et al. lors des étapes de retournement du compost, ce qui appuie le fait que certaines activités génèrent plus de bioaérosols (Albrecht et al., 2007). Cette même étude a obtenu des comptes en bactéries cultivables entre 105 et 107 UFC/m3.
18
microorganismes selon les opérations et les lieux de compostage, les espèces mésophiles étant présentes en plus grandes quantités (Fischer et al., 2000).
1.4.1.2 Les endotoxines des bactéries à Gram négatif
Les bactéries à Gram négatif produisent des endotoxines, qui sont des lipopolysaccharides (LPS) ancrés dans leur paroi (Thorn, 2001). Lors de la lyse des cellules, ces composés sont libérés et peuvent se retrouver dans les bioaérosols sous forme de particules inhalables. Il est connu que les endotoxines peuvent causer des symptômes respiratoires et des manifestations systémiques, comme une réponse inflammatoire générale démesurée. Les principaux effets causés par l’inhalation d’endotoxines sont l’allergie, la dyspnée, l’asthme, l’obstruction des voies aériennes, l’accélération du déclin de la fonction pulmonaire, l’hyper réactivité bronchique et le syndrome toxique d’exposition aux poussières organiques (STEPO) (Liebers et al., 2008; Rylander, 2002; Smit et al., 2008).
Rylander fait mention de la présence d’endotoxines dans plusieurs milieux de travail contenant de la matière organique favorisant la croissance bactérienne (Rylander, 2002). Les concentrations retrouvées varient entre 10-1 et 106 ng/m3
(Dutkiewicz, 1997; Olenchock et al., 1990). La détection des endotoxines grâce au lysat d’ameobocyte de limule (LAL) s’avère un outil essentiel pour la détermination de milieux de travail à risque, en plus de servir d’indicateur d’activité biologique.
Wouters et al. se sont intéressés aux concentrations d’endotoxines présentes dans les usines de compostage. Ils ont remarqué que les installations traitant des déchets résidentiels et mixtes avaient de plus fortes concentrations d’endotoxines dans l’air que les installations traitant des déchets verts. Ils ont aussi constaté que la quantité et la variabilité sont plus élevées lorsqu’il y a plus de poussière (Wouters
et al., 2000; Wouters et al., 2006). Puisque les usines de biométhanisation visitées
traitent des déchets résidentiels et commerciaux (restes de table, fruits et légumes non vendus, pain, feuilles mortes et branches), il est difficile de prédire si les quantités d’endotoxines seront plus élevées à l’une des deux usines.
19
Un seuil limite d’exposition aux endotoxines de 50 unités d’endotoxines/m3
(UE/m3) (4,5 ng/m3) pour une période de huit heures a été proposé par le Comité
d’experts néerlandais sur les normes professionnelles du Conseil National de la Santé des Pays-Bas (Heederik, & Douwes, 1997). En 2010, ce seuil est passé à 90 UE/m3 (DECOS, 2010). Il faut toutefois prendre en note que le seuil limite n’est pas
une norme officielle, mais bien une recommandation. Un autre aspect à considérer est que les mesures effectuées sur le terrain ne sont qu’une « photo » de la situation en usine. Les variations en fonction des heures, des journées ou encore des mois ne sont pas compilées avec les mesures ponctuelles réalisées. À titre d’exemple, certains auteurs ont rapporté des concentrations médianes d’endotoxines de 6,5 X 103 UE/m3 durant l’été et de 2,6 X 104 UE/m3 durant l’hiver dans des porcheries du
Québec (Bonlokke et al., 2009), ce qui représente une différence d’un ordre de grandeur.
1.4.1.4 Saccharopolyspora rectivirgula
Il est connu que Saccharopolyspora rectivirgula, un actinomycète thermophile, est l’une des causes majeures du développement de l’alvéolite allergique extrinsèque chez les travailleurs (Pepys et al., 1990; Reboux et al., 2001; Schafer et al., 2013; Wery, 2014). Cette maladie pulmonaire d’hypersensibilité, lorsqu’elle est causée par l’inhalation d’actinomycètes, est également connue sous le nom de « poumon du fermier » (Douwes et al., 2003; Schafer et al., 2013). Schäfer
et al. ont montré, à l’aide de la qPCR, une forte présence de S. rectivirgula dans l’air
des usines de compostage, allant de 1,24 x 102 à 1,5 x 107 cellules/m3 (Schafer et al., 2013). Les MOP des usines de biométhanisation ne passant pas par une phase
thermophile, les concentrations retrouvées de S. rectivirgula pourraient être plus faibles que dans les usines de compostage.
1.4.1.5 Legionella spp.
Dans plusieurs pays, outre le Canada, des bactéries du genre Legionella ont été retrouvées dans le compost. (O'Connor et al., 2007; Steele et al., 1990; Whiley, & Bentham, 2011). Conza et al. ont réussi à montrer la présence de L. pneumophila dans l’air des usines de compostage (Lisa Conza et al., 2013). Lorsqu’inhalées sous forme de bioaérosols, ces bactéries sont responsables de la légionellose, une
20
maladie grave causant des pneumonies, ou de la fièvre de Pontiac, maladie plus bénigne ressemblant à la grippe (C. H. Brown, 2016; Casati et al., 2010; L. Conza
et al., 2013). Deux études font mention de plusieurs cas de maladies pulmonaires
associées aux légionelles dans les usines de compostage ou lors du compostage domestique (Bru-Adan et al., 2009; Le Goff et al., 2010). Legionella est donc un microorganisme à surveiller dans les usines de biométhanisation puisque les matières premières et certaines activités sont semblables à celles des usines de compostage.
1.4.1.6 Les mycobactéries non tuberculeuses
Des mycobactéries non tuberculeuses (MNT) peuvent être retrouvées dans les MOP. Les MNT ne sont pas nécessairement pathogènes, mais l’inhalation de bioaérosols contenant ces microorganismes peut être à l’origine de plusieurs problèmes de santé, dont des infections des os, des poumons (pneumopathies d’hypersensibilité), des articulations, de la lymphe ou de la peau (Prendki et al., 2008). Jusqu’à présent, une seule étude s’est intéressée à la détection de bactéries du genre Mycobacterium dans l’air d’usines de compostage (Bonifait et al., Sous presse). Comme pour les légionelles, les MNT seront potentiellement trouvées dans l’air des usines de biométhanisation.
1.4.1.7 Les moisissures
Des moisissures, qui sont des champignons filamenteux, sont également retrouvées dans l’air des usines de compostage (Bunger et al., 2007). Ces microorganismes sont en partie responsables de la biodégradation des MOP. Il n’est donc pas surprenant de les retrouver en quantités importantes dans la matière en décomposition, dont le compost. La diversité fongique des bioaérosols issus du compost peut varier en fonction de la composition des MOP, des conditions météorologiques, de la saison et du type de traitement utilisé (Fischer et al., 2000). Les Ascomycètes, les Basidiomycètes, les Oomycètes et les Zygomycètes sont présents dans l’air de ces environnements. Toutefois, l’air extérieur peut contribuer à augmenter la diversité des moisissures retrouvées dans les usines de compostage (Bru-Adan et al., 2009) et de biométhanisation. Hryhorczuk et al. ont retrouvé trois genres importants de moisissures, soit Aspergillus, Penicillium et Cladosporium,
21
dans l’air des usines de compostage (Hryhorczuk et al., 2001). Les limites d’exposition aux moisissures proposées dans la littérature sont de 1000 UFC/m3.
Néanmoins, des concentrations de 104 UFC/m3 sont généralement retrouvées dans
les usines de compostage (Wheeler et al., 2001).
1.4.1.8 Aspergillus fumigatus
Aspergillus fumigatus est une moisissure de la famille des Ascomycètes qui
est également retrouvée en abondance dans les usines de compostage (Albrecht et
al., 2007; Epstein et al., 2001). Elle peut causer plusieurs problèmes de santé, dont
une variété de maladies inflammatoires, en particulier chez les individus immunosupprimés. (Douwes et al., 2003; Shen et al., 2004; Taha et al., 2006). 80% des aspergilloses humaines sont causées par A. fumigatus. Kiviranta et al. ont conseillé en 1999 l’utilisation d’équipement de protection individuelle pour les travailleurs de sites d’enfouissement et d’usines de manutention des déchets. Millner et al. ont retrouvé entre 3,9 x 101 et 1,39 x 103 spores d'A. fumigatus par m3
d’air (Millner et al., 1980). Puisque les concentrations d’A. fumigatus varient en fonction des saisons, cette moisissure ne peut être utilisée comme indicateur pour d’autres bioaérosols (Fischer et al., 1998; Harrison, 2007; Recer et al., 2001; Sanchez-Monedero, & Stentiford, 2003).
1.4.1.9 Les (1,3) β-D-glucanes
Des réponses immunitaires spécifiques et non spécifiques sont causées quant à elles par des (1,3) β-D-glucanes, des polymères de haut poids moléculaire présents dans les spores de moisissures. (Douwes et al., 2000; Flannigan, & Miller, 1994; Weber et al., 1993). Ces composés sont également retrouvés dans les parois des plantes et d’autres espèces fongiques. Mis à part leur capacité d’induire des modifications dans les lymphocytes et d’enclencher la formation de granulomes, en marqueur caractéristique des pneumopathies d’hypersensibilité, les symptômes chez l’humain ne sont pas bien définis (Rylander, 2002).
22
1.4.2 Les valeurs limites d’exposition
Habituellement, les risques causés par l’exposition aux bioaérosols sur la santé humaine sont contrôlés par des valeurs limites d’exposition (VLE). Le terme « VLE » est défini par une concentration limite d’un composé présent dans l’air à laquelle aucun effet néfaste sur la santé n’est observé chez les humains exposés tous les jours à cette concentration (ACGIH, 1999). Certaines limites quant à la quantité de microorganismes présents dans l’air ont été proposées par l’IRSST il y a plusieurs années. Des VLE de 10 000 UFC/m3 pour les bactéries totales et de
1 000 UFC/m3 pour les bactéries à Gram négatif ont été suggérées pour une période
de huit heures dans les usines de compostage (Marchand et al., 1995). Dutkiewicz propose des normes de 105 UFC/m3 pour les bactéries totales, 5 X 104 UFC/m3 pour
les moisissures et 2 X 104 UFC/m3 pour les bactéries à Gram négatif et les
actinomycètes thermophiles (Dutkiewicz, 1997; Schlosser et al., 2009). De son côté, l’Institute of Inspection, Cleaning and Restoration Certification (IICRC) des États-Unis recommande le port d’un appareil de protection respiratoire lorsque la concentration est d’au moins 10 000 spores de moisissures/m3 d’air (Lavoie et al.,
2007). Néanmoins, une mise à jour de ces limites serait intéressante puisque la biométhanisation est un traitement des MOP qui est relativement nouveau. La faible quantité de VLE disponible est principalement causée par le manque de méthodes d’échantillonnage, d’analyses standardisées et de valeurs dose-réponse pour certains microorganismes ou composants biologiques (Douwes et al., 2003; Pearson et al., 2015). La variabilité des effets chez les humains en contact avec les bioaérosols peut également expliquer l’absence de VLE. L’American Conference of Governmental Industrial Hygienists (ACGIH) indique qu’une comparaison des concentrations de bioaérosols et de leur composition entre l’environnement intérieur étudié et l’environnement extérieur peut servir de guide pour détecter un site de prolifération (ACGIH, 1999; Domingo, & Nadal, 2009).
1.4.3 Problèmes de santé chez les travailleurs
Les bioaérosols peuvent être la source de plusieurs problèmes de santé, comme des toxicoses (STEPO), des infections (haut du tractus respiratoire, peau)
23
et des allergies (asthme bronchique, alvéolite allergique extrinsèque) (Bunger et al., 2000; Douwes et al., 2003). Il est connu que certaines réactions allergiques ou toxiques puissent être causées par des composantes structurales ou métaboliques intactes, sans que le microorganisme soit vivant (Browne et al., 2001; Bunger et al., 2000; Burrell, 1995; Duchaine et al., 2001; Fischer et al., 2000; Liebers et al., 2008; Muller et al., 2004; Wouters et al., 2002). Néanmoins, il est souvent difficile d’établir un lien clair entre une exposition et un effet sur la santé (Domingo, & Nadal, 2009; Douwes et al., 2003; Schlosser et al., 2009).
Quelques auteurs ont déterminé qu’une sensibilité chez des travailleurs constamment exposés à certains bioaérosols peut se développer (Persoons et al., 2010; Schlosser et al., 2009; Wheeler et al., 2001; Wouters et al., 2006). Chez les travailleurs des usines de compostage, Bünger et al. ont constaté une forte association entre la fréquence de maladies respiratoires et cutanées et une exposition élevée aux bioaérosols (Bunger et al., 2000; Bunger et al., 2007). D’autres auteurs ont rapporté de nombreux effets sur la santé, la plupart étant des symptômes respiratoires (toux, asthme, bronchites chroniques, pneumopathies d’hypersensibilité, mycoses broncho-pulmonaires) (Bunger et al., 2007; Collins, & Kennedy, 1992; Douwes et al., 2000; Hansen et al., 1997; Lavoie et al., 2006; Schafer et al., 2013; Wouters et al., 2002). Des problèmes gastro-intestinaux (nausées, diarrhées) (Collins, & Kennedy, 1992; Ivens et al., 1999; Lavoie et al., 2006), cutanés (dermatites) (Bunger et al., 2000), d’irritation des muqueuses (Bunger et al., 2007), ou encore l’augmentation de la fréquence des conjonctivites (Bunger et al., 2007) et des mécanismes inflammatoires irritatifs et toxiques (allergies, syndrome de réponse inflammatoire systémique SRIS, cancer) (Bunger
et al., 2000; Douwes et al., 2003; Lavoie et al., 2006; Muller et al., 2006) ont été
observés chez les travailleurs des usines de compostage.
Selon l’Institut national de recherche et de sécurité (INRS), les sites de compostage et de biométhanisation s’inscrivent dans la catégorie de « situation d’exposition potentielle [où] les agents biologiques peuvent être présents soit du fait de l’activité elle-même (métiers de la santé, traitement de l’eau ou des déchets…),