Production de matière grasse laitière bovine
enrichie en acide α-linolénique
Thèse
Maxime Leduc
Doctorat en sciences animales
Philosophiæ Doctor (Ph. D.)
Québec, Canada
Production de matière grasse laitière bovine
enrichie en acide α-linolénique
Thèse
Maxime Leduc
Sous la direction de :
Yvan Chouinard, directeur de recherche
Rachel Gervais, codirectrice de recherche
Résumé
L’acide α-linolénique (18:3 c9c12c15; AAL) possède des effets potentiellement
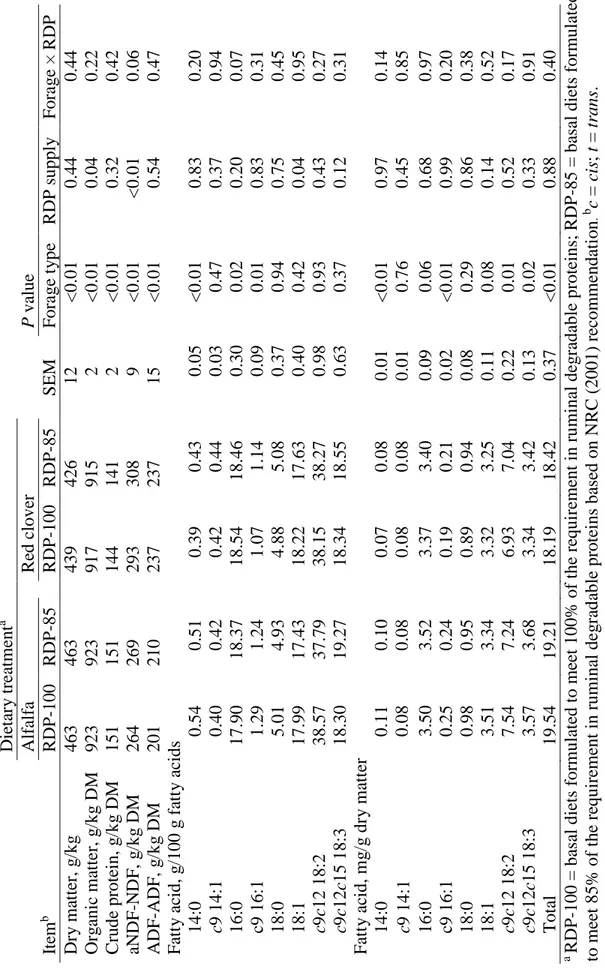
bénéfiques pour la santé humaine et un fort potentiel commercial pour le développement de produits enrichis. Par contre, la présence d’AAL dans le gras du lait des bovins laitiers est faible, soit moins de 1,0 g/100 g d’acides gras (AG) totaux, à cause d’un processus biochimique nommé biohydrogénation (BH), ce qui rend la production de lait enrichi en AAL difficile. La BH est effectuée par les bactéries du rumen et consiste en l’hydrogénation des doubles liaisons de l’AAL. Ce mécanisme biochimique entraine une faible concentration en AAL et une concentration élevée en AG saturé et en AG trans dans le gras du lait et de la viande des ruminants. Cette thèse a comme mandat d’évaluer différentes stratégies pour réduire la BH de l’AAL chez le bovin laitier et ainsi augmenter naturellement sa concentration dans le lait. Quatre stratégies ont été abordées, soit 1) l’utilisation de trèfle rouge (TR), source de polyphénol oxydase (PPO); 2) l’utilisation de différentes concentrations de protéines dégradables dans le rumen; 3) l’utilisation de sels de calcium (Ca) de différentes tailles riches en AAL; et 4) l’utilisation d’une méta-analyse sur le lin. La première phase animale a permis de vérifier l’effet du TR (source de PPO) lorsque comparé à la luzerne (LU) et l’effet d’une concentration en protéine dégradable dans le rumen comblant 100 % ou 85 % des recommandations (PDR-100; PDR-85). Huit vaches fistulées (72 ± 17 jours en lactation; JL) ont été utilisées dans un carré latin double 4 × 4 (21 j/période et 14 j d’adaptation) avec un arrangement factoriel des traitements : TR+PDR-100, TR+PDR-85, LU+PDR-100 et LU+PDR-85. Le traitement TR, en comparaison à la LU, a augmenté la concentration d’AAL (0,69 vs. 0,43 g/100 g gras;
P < 0,01). L’utilisation du TR a augmenté l’efficacité de transfert de l’AAL de la ration au
gras du lait (10,9 %) par rapport à la LU (5,9 %; P < 0,01). Aucune différence n’a été observée entre les traitements PDR-100 et PDR-85 pour la concentration et l’efficacité de transfert de l’AAL de la ration au gras du lait. La deuxième phase expérimentale a nécessité huit vaches Holsteins (115 ± 14 JL) dans un dispositif en carré latin double 4 × 4 où les traitements étaient un apport de 600 g/j d’un mélange d’AG, dont en moyenne 231 g
dans le rumen (SCF); 3) triacylglycerols dans le rumen (TEM-N); et 4) triacylglycerols dans l’abomasum (TEM-P). Des contrastes orthogonaux ont été utilisés pour comparer chaque traitement aux SCG. La concentration en AAL dans le gras du lait était de 2,52 g/100 g de gras pour SCG, soit supérieure aux traitements TEM-N (0,59 g/100 g de gras;
P<0,01) et SCF (1,31 g/100 g de gras; P = 0,06, tendance), et inférieure au TEM-P (8,06
g/100 g de gras; P<0,01). L’efficacité de transfert de l’AAL de la ration au gras du lait pour les SCG (8,4 %) a été supérieure aux SCF (4,2 %; P=0,03) et CTRL-N (1,7 %; P<0,01) et inférieure aux TEM-P (26,4 %; P<0,01). Finalement, une méta-analyse a été utilisée pour déterminer la valeur nutritionnelle d’une supplémentation en lin sous différentes formes (huile, graine entière, ou fraction de graine) sur les performances laitières, le profil en AG du lait et l’efficacité de transfert de l’AAL de la ration au gras du lait. La base de données était constituée de 78 articles scientifiques avec au moins un traitement supplémenté en lin. Lorsque les différentes formes de lin sont comparées, la graine protégée et les coques de lin démontrent la plus forte concentration d’AAL avec respectivement 1,67 et 1,62 g/100 g de gras. L’efficacité de transfert de l’AAL de la ration au gras du lait a été plus élevée pour les graines entières traitées mécaniquement (roulées ou broyées), les graines protégées et les coques de lin avec des valeurs respectives de 5,84, 6,50 et 4,79 % à comparer à l’huile et la graine entière intacte et extrudée. En conclusion, les différentes stratégies abordées lors de ces travaux n’ont pas permis d’obtenir une concentration assez élevée d’AAL dans le lait pour atteindre les normes de Santé Canada permettant d’attribuer le qualificatif d’enrichi en AAL à un breuvage, soit un apport de 300 mg d’AAL par portion ou une concentration de 4,1 g/100 g de gras pour un verre (250 mL) de lait entier à 3,25 % de gras.
Abstract
The alpha-linolenic acid (c9c12c15 18:3; ALA) has potential health benefits when consumed by humans and a strong marketing potential for enriched products. However, the concentration of ALA in dairy cow milk is low, less than 1.00 g/100 g of fatty acid (FA) due to a biochemical process called biohydrogenation (BH), which makes the production of milk enriched in ALA difficult. Biohydrogenation is done by ruminal bacteria and consists of the hydrogenation of the double bonds present in ALA. This mechanism leads to a low concentration of ALA and a high concentration of saturated FA and trans FA in ruminant milk and meat. The objective of this thesis is to evaluate different strategies for reducing BH of ALA in dairy cows in order to increase naturally ALA concentration in milk. Four different approches were evaluated in this thesis: 1) feeding red clover (RC), which is a source of polyphenol oxidase (PPO); 2) feeding different concentrations of rumen degradable protein; 3) feeding calcium (Ca) salts rich in ALA with two different particle sizes; and 4) using a meta-analysis on flaxseed. The first experiment tested the effect of feeding RC (source of PPO) compared to alfalfa (AL) and the effect of 100 or 85 % of recommendation in the supply of rumen degradable protein (RDP-100; RDP-85). Eight fistulated cows (72 ± 17 days in milk; DIM) were used in a double Latin 4 × 4 square design 4 × 4 (21 d period/14 d of adaptation) with the following factorial treatments: RC+RDP-100, RC+RDP-85, AL+RDP-100 and AL+RDP-85. Red clover increased ALA concentration in milk (0.69 vs 0.43 g/100g of fat; P<0.01). Transfer efficiency of ALA from diet to milk was higher for RC (10.9 %) compared to AL (5.9 %; P<0.01). No difference was observed between RDP-100 and RDP-85 for ALA milk concentration and transfer efficiency from diet to milk. For the second experiment, eight Holstein cows (115 ± 14 DIM) were used in a double Latin square (4 × 4) with treatments consisting of giving 600 g/day of a mix of FA providing 231 g ALA/day in the following forms: 1) coarse calcium salts (CCS); 2) fine Ca salts (FCS); 3) triacylglycerols (Negative control; N-CTRL) in the rumen; 4) triacylglycerols (Positive control; P-N-CTRL) in the abomasum. Orthogonal contrasts were used to compare each treatment to CCS. The concentration of
of fat; P<0.01) and FCS (1.31 g/100 g of fat; P=0.06, tendency) and was inferior when compared to P-CTRL (8.06 g/100 g of fat; P<0.01). Transfer efficiency of ALA from diet to milk for CCS (8.4%) was superior to FCS (4.2%; P=0.03) and N-CTRL (1.7%; P<0.01) and inferior to P-CTRL (26.4%; P<0.01).
Finally, a meta-analysis was used to evaluate the feeding value of different forms of flaxseed (oil, seed, or fractions of seed) on milk production, milk components, milk FA, and transfer efficiency of ALA from diet to milk in cows. The database consisted of 78 articles with a minimum of one treatment containing flaxseed. Higher concentrations of ALA were observed with protected flaxseed (1.67 g/100 g of fat) and flax hulls (1.62 mg/g of fat). The highest transfer efficiency of ALA from diet to milk was observed with mechanically processed whole seeds (rolled or ground), chemically protected flax seed and flax hulls with 5.84, 6.50, and 4.79 %, respectively compared to oil and whole seed intact and extruded. In conclusion, it was impossible, with our strategies, to achieve a concentration of ALA that meets Health Canada rules, i.e. a contribution of 300 mg of ALA per portion or concentration of 4.1 g/100 g of fat in a glass of whole milk (250 mL) at 3.25% of fat.
Table des matières
Résumé ... iii
Abstract ... v
Table des matières ... vii
Liste des tableaux ... xi
Liste des figures ... xiii
Liste des abréviations françaises ... xv
Liste des abréviations anglaise ... xvii
Abréviations utilisées pour désigner les acides gras ... xix
Remerciements ... xxi
Avant-Propos ... xxiii
Chapitre 1 Introduction ... 1
Chapitre 2 Revue de la documentation scientifique ... 7
2.0 Composition et structure des lipides du lait... 9
2.0.1 Les acides gras ... 9
2.0.1.1 Les acides gras saturés ... 10
2.0.1.2 Les acides gras insaturés cis ... 11
2.0.1.3 Les acides gras trans ... 11
2.1 Effets des acides gras sur la santé humaine ... 13
2.1.1 Les acides gras ω-3 ... 14
2.1.1.1 Effets des acides gras sur la santé des bovins laitiers ... 19
2.2 Biohydrogénation ... 20
2.2.1 Lipolyse ... 21
2.2.2 Voie métabolique de la biohydrogénation ... 22
2.3 Digestion et métabolisme des lipides ... 24
2.3.3 Métabolisme hépatique des acides gras ... 27
2.4 Facteur influençant la concentration en acide α-linolénique du lait ... 28
2.4.1 Génétique ... 28
2.4.2 Nutrition ... 28
2.4.2.1 Protection chimique des acides gras polyinsaturés ... 28
2.4.2.2 L’utilisation des plantes fourragères ... 29
2.4.2.2.1 Concentration en acide α-linolénique dans les plantes fourragères ... 31
2.4.2.2.2 Composés botaniques réduisant la biohydrogénation ... 33
2.4.2.3 Les facteurs alimentaires ... 34
2.4.2.4 L’utilisation d’oléagineux ... 34
2.5 Méta-analyse sur les suppléments lipidiques ... 35
2.6 Conclusion ... 36
Chapitre 3 Stratégies 1 et 2: Le trèfle rouge et différents apports en protéines dégradables dans le rumen ... 39
3.0 Résumé ... 43
3.1 Abstract ... 45
3.2 Introduction ... 47
3.3 Materials and methods ... 48
3.3.1 Feeding trial... 48
3.3.2 Laboratory Analysis ... 50
3.3.3 Statistical analysis ... 53
3.4 Results ... 54
3.4.1 Silage and diet composition ... 54
3.4.2 Animal performance ... 57
3.4.3 Ruminal fermentation ... 59
3.4.4 Milk fatty acid profile ... 62
3.4.5 Transfer efficiency and total tract digestibility ... 67
3.4.6 In sacco incubation kinetic ... 69
3.4.7 Nitrogen metabolites ... 69
3.5 Discussion ... 71
3.5.1 Diet composition ... 71
3.5.2 Lactation performance ... 72
3.5.4 Milk odd- and branched-chain fatty acids ... 73
3.5.5 Transfer efficiency from diet to milk of n- 6 and n-3 fatty acids ... 74
3.6 Conclusion ... 76
3.7 Statement of animal rights ... 77
3.8 Conflict of interest ... 77
3.9 Aknowledgements... 77
3.10 Reference ... 78
Chapitre 4 Stratégie 3 : Les sels de calcium de différentes granulométries ... 85
4.0 Résumé ... 89
4.1 Abstract ... 90
4.2 Introduction ... 91
4.3 Materials and methods ... 92
4.3.1 Animal trial ... 92 4.3.2 Laboratory analyses ... 94 4.3.3 Statistical analysis ... 97 4.4 Results ... 97 4.4.1 Treatment assessment ... 97 4.4.2 Animal performance ... 98 4.4.3 Ruminal fermentation ... 100
4.4.4 Milk fatty acids ... 100
4.4.5 Transfer efficiency from diet to milk of n-6 and n-3 fatty acids ... 107
4.5 Discusion ... 110
4.5.1 Lactation performance and ruminal metabolism ... 110
4.5.2 Transfer efficiency from diet to milk of n-6 and n-3 fatty acids ... 112
4.5.3 Additional effects on milk fatty acid profile ... 113
4.6 Conclusions ... 114
4.7 Statement of animal rights ... 115
4.8 Conflict of interest ... 115
4.9 Acknowledgments ... 115
4.10 References ... 116
Chapitre 5 Stratégie 4 : Méta-analyse sur le lin ...121
5.2 Introduction ... 129
5.3 Materials and methods ... 130
5.3.1 Data collection ... 130
5.3.2 Data investigation and statistical analysis ... 140
5.3.2.1 Experiment 1 – Flax-TRI vs. Unsupplemented Control ... 140
5.3.2.2 Experiment 2 – Flax-TRI vs. Varying Lipid Sources ... 141
5.3.2.3 Experiment 3 – Effects of Flax Forms ... 143
5.3.2.4 Experiment 4 - Multivariate Factor Analysis ... 143
5.4 Results ... 144
5.4.1 Experiment 1 - Flax-TRI vs. Unsupplemented Control ... 144
5.4.1.1 Flax-TRI vs. LOW-E Control. ... 144
5.4.1.2 Flax-TRI vs. ISO-E Control. ... 145
5.4.2 Experiment 2 - Flax-TRI vs. Varying Lipid Sources ... 145
5.4.2.1 Flax-TRI vs. SFA Supplements. ... 145
5.4.2.2 Flax-TRI vs. MONO Supplements. ... 151
5.4.2.3 Flax-TRI vs. DI Supplements. ... 151
5.4.3 Experiment 3 – Effects of Flax Forms ... 157
5.4.4 Experiment 4 - Multivariate Factor Analysis ... 160
5.5 Discussion ... 162
5.5.1 Experiments 1 and 2 – Flax-TRI vs. Unsupplemented Control or Varying Lipid Sources... 162
5.5.2 Experiment 3 – Effects of Flax Forms ... 166
5.5.3 Experiment 4 - Multivariate Factor Analysis ... 168
5.6 Conclusions ... 170
5.7 Acknowledgements ... 171
5.8 References ... 172
Chapitre 6 Discussion générale & conclusions ...187
Liste des tableaux
Tableau 2-1 Concentration en acide octadécénoïque- trans (18:1) dans le lait des bovins, adapté de Precht et
Molkentin (1997). ... 12
Tableau 2-2 Concentration en acides trans-octadécadiénoïques (18:2) dans le lait des bovins, adapté de MacGibbon et Taylor (2006). ... 12
Tableau 2-3 Différentes sources d’huile selon leur concentration en 18:3 c9c12c15. ... 16
Tableau 2-4 Résumé de différentes études sur les effets de l’acide α-linolénique (AAL) pour ses caractéristiques nutraceutiques, adapté de Kim et al. (2014). ... 18
Tableau 2-5 Résumé de différentes études sur les effets de l’acide α-linolénique (AAL) pour ses caractéristiques pharmacologiques, adapté de Kim et al. (2014). ... 19
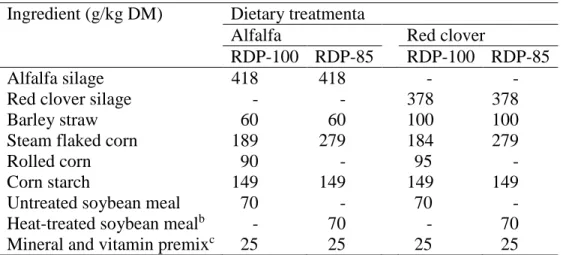
Table 3-1 Composition of the experimental diets. ... 49
Table 3-2 Fatty acid profile of alfalfa and red clover silages. ... 55
Table 3-3 Chemical composition of the experimental diets. ... 56
Table 3-4 Body weight, dry matter intake, milk production, feed efficiency, and milk fat concentration and yield in cows fed alfalfa- or red clover-silage based diets formulated to satisfy 100% (RDP-100) or 85% (RDP-85) of the requirement in ruminal degradable protein. ... 58
Table 3-5 Ruminal fermentation characteristics in lactating dairy cows fed alfalfa or red clover-silage based diets formulated to meet 100% (RDP-100) or 85% (RDP-85) of the requirement in ruminal degradable proteins. ... 60
Table 3-6 Counts (log10) of bacteria per gram of rumen fluid from dairy cows fed alfalfa- or red clover-silage based diets formulated to meet 100% (RDP-100) or 85% (RDP-85) of the requirement in ruminal degradable proteins. ... 61
Table 3-7 Milk fat composition (g/100 g of fat) in cows fed alfalfa- or red clover-silage based diets formulated to meet 100% (RDP-100) or 85% (RDP-85) of the requirement in ruminal degradable protein. ... 63
Table 3-8 Intake, milk secretion, and apparent transfer efficiency from diet to milk fat of polyunsaturated fatty acids in dairy cows fed alfalfa- or red clover-silage based diets formulated to meet 100% (RDP-100) or 85% (RDP-85) of the requirement in ruminal degradable protein. ... 68
Table 3-9 Apparent total tract digestibility (%) of fatty acids in dairy cows fed alfalfa- or red clover-silage based diets formulated to meet 100% (RDP-100) or 85% (RDP-85) of the requirement in ruminal degradable protein. ... 68
Table 3-10 In sacco disappearance kinetic parameters and effective disappearance of polyunsaturated fatty acids of alfalfa and red clover silages in the rumen of dairy cows consuming diets based on these forages and formulated to meet 100% (RDP-100) or 85% (RDP-85) of the requirement in ruminal degradable proteins. ... 70
Table 3-11 Nitrogen metabolites in dairy cows fed alfalfa- or red clover-silage based diets formulated to meet 100% (RDP-100) or 85% (RDP-85) of the requirement in ruminal degradable protein. ... 70
Table 4-1 Composition and administration rate of fatty acids in the form of Ca salts or triacylglycerols. ... 93
Table 4-2 Ingredient and chemical composition of basal diet. ... 96
Table 4-4 Dry matter intake, milk yield, and concentration and yield of milk constituents in cows receiving lipid supplements in the form of triacylglycerols or Ca salts at different sites of the gastric complex. ... 99 Table 4-5 Ruminal fermentation characteristics in cows receiving lipid supplements in the form of
triacylglycerols or Ca salts at different sites of the gastric complex. ... 101 Table 4-6 Milk fat composition in cows receiving lipid supplements in the form of triacylglycerols or Ca salts at different sites of the gastric complex. ... 103 Table 4-7 Intake, milk secretion, and apparent transfer efficiency, from diet to milk, of polyunsaturated fatty
acids in cows receiving lipid supplements in the form of triacylglycerols or Ca salts at different sites of the gastric complex. ... 108 Table 5-1 List of references used in statistical analyses including the type of comparisons reported and the
information available on diet composition ... 132 Table 5-2 Means ± standard deviations (number of observations) for diet composition in five different
comparisons involving flax seed and oil (Experiments 1 and 2) ... 135 Table 5-3 Means ± standard deviations (number of observations) for production performance, concentration
and yield of milk components, and milk fatty acid profile in five different comparisons
involving flax seed and oil ( Experiments 1 and 2) ... 137 Table 5-4 Means ± standard deviations (number of observations) of the composition of experimental rations
containing 6 different categories of flax forms (Experiment 3) ... 139 Table 5-5 Dietary lipid sources evaluated and number of treatments in each category of supplementation
(Experiments 1 and 2) ... 142 Table 5-6 Estimates ± standard errors of the models for production performance, concentration and yield of
milk components, and milk fatty acid profile when flax rich in trienoic fatty acids (flax-TRI,
c9c12c15 18:3) was compared with lipid supplements rich in SFA (mainly 16:0 or 18:0 or both;
Experiment 2) ... 149 Table 5-7 Estimates ± standard errors of the models for production performance, concentration and yield of
milk components, and milk fatty acid profile when flax rich in trienoic fatty acids (flax-TRI,
c9c12c15 18:3) was compared with lipid supplements rich in monoenoic fatty acids (MONO,
mainly c9 18:1; Experiment 2) ... 153 Table 5-8 Estimates ± standard errors of the models for production performance, concentration and yield of
milk components, and milk fatty acid profile when flax rich in trienoic fatty acids (flax-TRI,
c9c12c15 18:3) was compared with lipid supplements rich in dienoic fatty acids (DI, mainly c9c12 18:2; Experiment 2) ... 155
Table 5-9 Means ± standard deviations (number of observations) for production performance, concentration and yield of milk components, milk fatty acid profile, and transfer efficiency of dietary fatty acids to milk fat with 6 different categories of flax forms (Experiment 3). ... 159 Table 5-10 Common factor loading and communalities for milk yield and composition and milk fatty acid
Liste des figures
Figure 2-1 Biosynthèse de l’acide éicosapentaénoïque et de l’acide docosahexaénoïque à partir de l’acide α-linolénique, adaptée de Williams (2000) ; c = cis . ... 15 Figure 2-2 Schéma présentant le processus de transformation des lipides ingérés par le ruminant ainsi que les
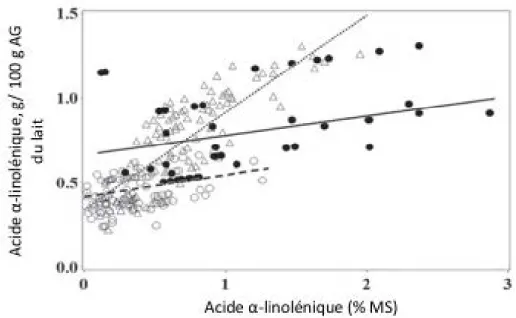
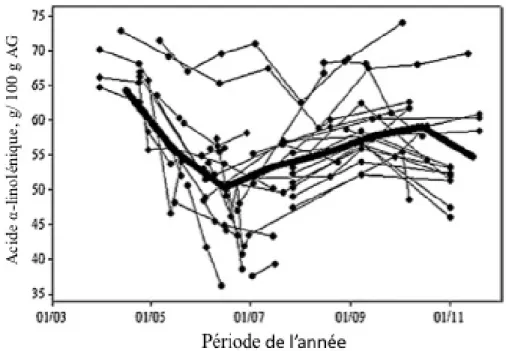
facteurs influençant la lipolyse et la biohydrogénation, adaptée de Doreau et al. (2011), avec la permission de CSIRO Publishing... 22 Figure 2-3 Voie métabolique de la biohydrogénation de l’acide α-linolénique (AAL), adaptée de Shingfield et Wallace (2014) avec la permission de The Royal Society of Chemistry ... 24 Figure 2-4 Concentration d’acide α-linolénique, en g/ 100 g d’acide gras, dans le lait en fonction de la
concentration d’acide α-linolénique (% MS) dans la ration. Ration composée
principalement de pâturage (•), de fourrage servi à l’intérieur (Δ) et de concentré servi à l’intérieur (0). La Figure 2-4 présente la moyenne ajustée et la pente de régression pour chaque type de ration [pâturage (—), fourrage servi à l’intérieur (· · ·) et ration riche en concentré servi à l’intérieur (– –)]. Adaptée de Khiaosa-Ard et al. (2015) avec la permission de Elsevier. ... 30 Figure 2-5 Concentration en 18:3 c9c12c15 du gras du lait de vache Tarentaises et Montbéliardes, en fonction de la ration de base, à partir des données de Ferlay et al. (2006). ... 30 Figure 2-6 Relations entre la concentration 18:3 c9c12c15 dans les fourrages et la période de l’année, adaptée de Glasser et al. (2013) avec la permission de Elsevier. ... 32 Figure 4-1 Milk urea N as a function of (A) ruminal ammonia-N (r = -0.21; P = 0.26), (B) milk total n-3 fatty acids (r = 0.71; P < 0.01), and (C) milk total t 18:1 (r = -0.53; P < 0.01) in cows receiving lipid supplements in the form of triacylglycerols or Ca salts at different sites of the gastric complex. = Coarse Ca salts in the rumen, = Fine Ca salts in the rumen, = Triacylglycerols in the rumen, = Triacylglycerols in the abomasum. ... 109 Figure 4-2 Variation of milk urea-N concentrations expressed as a proportion (mg/mg) of basal values in
cows receiving lipid supplements in the form of triacylglycerols or Ca salts at different sites of the gastric complex. Average (± standard deviation) basal values: Coarse Ca salts in the rumen = 18.4 (± 2.7) mg/100 mL, Fine Ca salts in the rumen = 18.9 (± 2.4) mg/100 mL;
Triacylglycerols in the rumen = 18.1 (± 1.6) mg/100 mL; Triacylglycerols in the abomasum = 19.5 (± 1.9) mg/100 mL. ... 110 Figure 5-1 Percent change in production performance and concentration and yield of milk components (A and
C) and individual milk fatty acid concentrations (B and D) when flax seed and oil rich intrienoic fatty acids was included in the diet, as compared with non-supplemented control treatments adjusted (ISO-E) or not (LOW-E) for dietary energy concentration. Percent change is represented as the mean ± 95% confidence intervals. Means represented by solid symbols are statistically different from 0 at P ≤ 0.05. ƩDNFA = total de novo synthesized fatty acids (4:0 + 6:0 + 8:0 + 10:0 + 12:0 + 14:0 + 14:1), Ʃc 18:1 = total cis octadecenoic acids, Ʃt 18:1 = total
trans octadecenoic acids, ƩCLA = total CLA, and ƩOCFA = total odd-chain fatty acids; c = cis;
t = trans. ... 147 Figure 5-2 Response ratios for (A) milk fat concentration and (B) milk fat yield in relation to the proportions
of corn silage in basal rations when flax seed and oil rich in trienoic fatty acids (c9c12c15 18:3) were included in the diet, as compared with nonsupplemented control diets used without adjustment for the extra energy provided by ether extract from flax seed and oil. *P < 0.05. RMSE = root mean squared error. ... 148
= ——) was compared with lipid supplements rich in SFA (data = ○, model = - - -;Experiment 2). ... 150 Figure 5-4 Feed efficiency (A; ECM/DMI), milk lactose concentration (B), and proportions of total trans
octadecenoic acids (C; Σt 18:1) and total CLA (D; ΣCLA) in milk fat in relation with the proportion of supplemental ether extract when flax rich in trienoic fatty acids (data = ●, model = ——) was compared with lipid supplements rich in monoenoic fatty acids (data = ○, model = - - -; Experiment 2). ... 154 Figure 5-5 Milk lactose concentration (A) and milk fat concentration 18:0 (B) in relation with the proportion
of supplemental ether extract when flax rich in trienoic fatty acids (data = ●, model = ——) was compared with lipid supplements rich in dienoic fatty acids (data = ○, model = - - -; Experiment 2). ... 156 Figure 5-6 Loading plot based on principal component (PC) 1 vs. PC 2 vs. PC 3 describing the relationships
among yield, composition, and fatty acid profile of milk in dairy cows. The explained variance of each PC is given in parentheses (experiment 4). ... 162
Liste des abréviations françaises
Abréviation Terme
AAL Acide gras α-linolénique
ADH Acide docosahexaénoïque
AEP Acide éicosapentaénoïque
AG Acide gras
AGL Acide gras libre
AGPI Acide gras polyinsaturé
AGS Acide gras saturé
AL Acide linoléique
ALC Acide linoléique conjugué
AO Acide oléique
AR Acide ruménique
AVT Acide vaccénique trans
BH Biohydrogénation Ca Calcium EC Esters de cholestérol ex. Exemple g Gramme GL Glycolipides h Heure
ISO-É Ration isoénergétique sans
supplément lipidique j Jour JL Jours en lactation kg Kilogramme LBD Lipoprotéine de basse densité
LDI Lipoprotéine de densité
intermédiaire
LHD Lipoprotéine de haute
densité BAS-É
Ration sans supplément lipidique non ajustée pour l’énergie LTBD Lipoprotéines de très basse densité Abréviation Terme m/m Masse/masse mg Milligramme MG Matière grasse MS Matière sèche N Azote n Nombre d'observations PB Protéine brute PDR-100 Ration comblant 100 % des besoins du NRC (2001) en protéine
dégradable dans le rumen
PDR-85
Ration comblant 85 % des besoins du NRC (2001) en protéine dégradable dans le rumen
PG Prostaglandine
PL Phospholipide
PPO Polyphénol oxydase
R2 Coefficient de
détermination
RMSE Erreur quadratique
moyenne
SCF Sels de calcium fin
SCG Sels de calcium grossier
TAG Triacylglycérols TEM-N Traitement mélange triacylglycérols perfusé dans le rumen TEM-P Traitement mélange triacylglycérols perfusé dans l’abomasum TR Trèfle rouge ω-3 Oméga-3
Liste des abréviations anglaise
Abréviation Terme % Percen °C Degree Celsius a Rapidly disappearing fraction (%)a.m. Ante meridiem
ADF-ADF Acid detergent fiber
including residual ash
AL Alfalfa
ALA Alpha-linolenic acid
aNDF-NDF
Neutral detergent fiber assayed with a heat stable amylase and expressed inclusive of residual ash AOAC
Association of official analytical chemists Communities
b Slowly disappearing fraction
BH Biohydrogenation
c cis
Ca Calcium
CCS Coarse calcium salts
Cl Chlorine
CLA Conjugated linoleic acids
cm Centimetre Co Cobalt CP Crude protein CS Calcium salts Cu Copper d Day DI Dienoic acids
DIM Days in milk
dL Decilitre
DM Dry matter
DMI Dry matter intake
DNA Deoxyribonucleic acid
ECM Energy corrected milk
Abréviation Terme
ERD Effective
ruminal disappearance
FA Fatty acids
FCS Fine calcium salts
Flax-TRI Flax rich in trienoic acids
g Gram
h Hour
ISO-E
Unsupplemented control diets adjusted for energy concentration IU International unit K Potassium kd Fractional rate of disappearance of the fraction b kg Kilogram
l Limit loading value
Level L
General linear effect of ether extract from lipid
supplements Level Q
General quadratic effect of ether extract from lipid supplements
ln Natural logarithm
log Logarithm
LOW-E
Unsupplemented control diets not adjusted for energy concentration
Mcal Mega calories
MFD Milk fat depression
mg Milligram
Mg Magnesium
min Minute
mL Milliter
Abréviation Terme n Number of observations N Nitrogen n − 3 Omega-3 n − 6 Omega-6 N-CRTL Triacylglycerols infused in rumen Na Sodium
NDF Neutral detergent fiber
NEL Net energy for lactation
nm Nanometre
OCFA Odd-chain fatty acids
P Phosphorus
P
Percentage of FA
disappearance from the bag at a specific time of incubation P-CTRL Triacylglycerols infused in abomasum PC Principal component PPM Parts-per-million
PPO Polyphenol oxidase
PUFA Polyunsaturated fatty acids
RC Red clover
RDP Ruminal degradable protein
RDP-100
Diets formulated to provide 85% of calculated rumen-degradable protein requirements RDP-85
Diets formulated to provide 100% of calculated rumen-degradable protein
requirements
RMSE Root mean-square error
RR Response ratio
S Sulfur
SEM Standard error of the mean
SFA Saturated fatty acids
t Time of incubation
t trans
tanh Hyperbolic tangent
TG Triacylglycerols
Abréviation Terme
VFA Volatile fatty acids
Zn Zinc
μm Micrometer
Σc 18:1 Total cis octadecenoic acids
ΣCLA Total CLA
ΣDNFA Total de novo synthesized
fatty acids
ΣOCFA Total odd-chain fatty acids
Σt 18:1 Total trans octadecenoic
Abréviations utilisées pour désigner les acides gras
Abréviation utilisée Nomenclature officielle Désignation usuelle
4:0 Butanoïque Butyrique 6:0 Hexanoïque Caproïque 8:0 Octanoïque Caprylique 10:0 Décanoïque Caprique 12:0 Dodécanoïque Laurique 14:0 Tétradécanoïque Myristique
14:1 c9 Tétradécénoïque cis-9 Myristoléique
15:0 Pentadécanoïque Pentadecylique
16:0 Hexadécanoïque Palmitique
16:1 c9 Hexadécénoïque cis-9 Palmitoléique
17:0 Heptadécanoïque Margarique
18:0 Octadécanoïque Stéarique
18:1 t5 Octadécénoïque trans-5 ‑
18:1 t6-8 Octadécénoïque trans-6-8 -
18:1 t9 Octadécénoïque trans-9 Élaïdique
18:1 t10 Octadécénoïque trans-10 -
18:1 t11 Octadécénoïque trans-11 Trans-vaccénique
18:1 t12 Octadécénoïque trans-12 -
18:1 t16 Octadécénoïque trans-16 -
18:1 c9 Octadécénoïque cis-9 Oléique
18:1 c11 Octadécénoïque cis-11 Cis-vaccénique
18:1 c12 Octadécénoïque cis-12 -
18:1 c13 Octadécénoïque cis-13 -
18:1 c15 Octadécénoïque cis-15 -
18:2 c9c12 Octadécadiénoïque cis-9, cis-12 Linoléique
18:2 t8c10 Octadécadiénoïque trans-8, cis-10 -
18:2 c9t11 Octadécadiénoïque cis-9, trans-11 Ruménique
18:2 t10c12 Octadécadiénoïque trans-10, cis-12 -
18:2 c11t13 Octadécadiénoïque cis-11, trans-13 -
18:3 c6c9c12 Octadecatriénoïque cis-6, cis-9, cis-12 γ-linolénique
18:3 c9c12c15 Octadecatriénoïque cis-9, cis-12, cis-15 α-Linolénique
Abréviation utilisée Nomenclature officielle Désignation usuelle
18:3 c9t13c15 Octadecatriénoïque cis-9, trans-13, cis-15 -
20:0 Eicosanoïque Arachidique
20:1 c8 Eicosanoïque cis-8 -
20:1 c11 Eicosanoïque cis-11 Gondoïque
20:2 c11c14 Eicosadiénoïque cis-11, cis-14 Homolinoléique
20:3 c8c11c14 Eicosatriénoïque cis-8, cis-11, cis-14
Di-Homo-γ-linolénique
20:4 c5c8c11c14 Eicosatétraénoïque cis-5, cis-8, cis-11,
cis-14
Arachidonique
20:5 c5c8c11c14c17 Eicosapentaénoïque cis-5, cis-8, cis-11,
cis-14, cis-17
Timnodonique
22:0 Docosanoïque Béhénique
22:4 c7c10c13c16 Docosatétraénoïque cis-7, cis-10, cis-13,
cis-16
Adrénique 22:5 c7c10c13c16c19 Docosapentaénoïque cis-7, cis-10, cis-13,
cis-16, cis-19
Clupanidonique 22:6
c4c7c10c13c16c19
Docosahéxaénoïque cis-4, cis-7, cis-10,
cis-13, cis-16, cis-19
Cervonique
Remerciements
Malgré une courbe d’apprentissage difficile à mes débuts aux études graduées, des méthodes de travail qui ne répondaient pas toujours aux exigences de l’emploi et de nombreuses «frasques», Yvan et Rachel ont continué à m'épauler, à me ramener à l’ordre et à répondre à mes nombreuses questions pour que je puisse mener à terme mon doctorat; merci à vous pour votre générosité. Je voudrais aussi remercier Yolaine de m’avoir aidé dans mes analyses et de m’avoir rendu plus méticuleux dans le laboratoire. Merci également à Nancy et à Micheline pour leur soutien lors de mes analyses en laboratoire.
À mon comité d’évaluation, Doris Pellerin et Gaëtan Tremblay, qui ont répondu à toutes mes questions : mille mercis.
J’aimerais souligner le travail exceptionnel des employés du CRSAD lors de mes phases animales et remercier plus particulièrement André Perreault qui s'est dévoué dans mes projets et avec qui j'ai eu de nombreuses discussions. Un immense merci aux nombreuses stagiaires qui nous ont assistés.
À mes parents, Sylvain et Ginette, qui m’ont permis de poursuivre mon rêve en continuant de s’occuper de la ferme en mon absence : rien de tout cela n’aurait été possible sans vous.
Finalement, j’aimerais remercier mes amis proches Daniel, René, Véronique, Liliana, Florence et Éric d'avoir été là dans les meilleurs moments comme dans les plus difficiles, me permettant ainsi de m’améliorer en tant qu’individu.
Avant-Propos
Cette thèse vise à étudier différentes stratégies pour augmenter la teneur en acide α-linolénique dans le gras du lait des bovins laitiers. Le document comprend une introduction (chapitre 1), une revue de la documentation scientifique (chapitre 2), trois articles scientifiques (chapitres 3 à 5) et une discussion/conclusion (chapitre 6). L’auteur de cette thèse est l’auteur principal de chacun des articles. Sa participation aux projets consistait en la collecte et l’analyse des échantillons lors des deux premières phases animales, la construction de la base de données pour la méta-analyse et la rédaction des articles. Il a aussi collaboré au processus d’élaboration des protocoles expérimentaux, à l’analyse statistique des données des phases animales, à l’analyse des données de la méta-analyse et à la soumission et à la révision des articles, sous la supervision de son directeur de thèse, M. Yvan Chouinard et de sa codirectrice, Mme Rachel Gervais.
Chapitre 3: Leduc, M., Gervais, R., Tremblay, G.F., Chiquette, J., Chouinard, P.Y., 2017. Milk fatty acid profile in cows fed red clover- or alfalfa-silage based diets differing in rumen-degradable protein supply. Animal Feed Science and Technology 223, 59-72. doi: 10.1016/j.anifeedsci.2016.11.001.
Chapitre 4: Leduc, M., Gervais, R., Chouinard, P.Y., 2017. Effect of calcium salts of polyunsaturated fatty acids with different particle sizes on lactation performance and milk fatty acid profile in dairy cows. Animal Feed Science and Technology 228, 102-114. doi: 10.1016/j.anifeedsci.2017.04.012.
Chapitre 5: Leduc, M., Létourneau-Montminy, M.-P., Gervais, R., Chouinard, P.Y., 2017. Effect of dietary flax seed and oil on milk yield, gross composition and fatty acid profile in dairy cows: A meta-analysis and meta-regression. Journal of Dairy Science, soumis le 24 janvier 2017.
Chapitre 1
Le gras provenant des produits laitiers n’a pas toujours eu bonne presse. Cette mauvaise image des aliments lactés est en grande partie due à leur concentration élevée en acides gras saturés (AGS; 65-70 % sur une base pondérale; Jensen, 2002). Dans les années 60, les AGS ont été associés à une augmentation du taux de cholestérol sanguin chez l’homme, ce qui aurait eu pour effet, selon les données disponibles à l’époque, d’augmenter l’athérosclérose dans les vaisseaux sanguins et les risques de maladies coronariennes (Hegsted et al., 1965; Keys et al., 1965). Cette affirmation a toutefois été réfutée dans les plus récentes méta-analyses (Siri-Tarino et al., 2010a; Chowdhury et al., 2014).
La ration de base des ruminants est composée majoritairement de fourrages et de concentrés qui sont riches en acide α-linolénique (18:3 c9c12c15; AAL) et en acide linoléique (18:2 c9c12; AL). Il aurait donc été possible de croire que le lait et la viande des ruminants contiennent des quantités élevées de ces acides gras (AG); or, c’est tout le contraire (Lock et Bauman, 2004). La cause de cette faible concentration en AG polyinsaturés (AGPI), de la concentration élevée en AGS et de la présence d’isomères de configuration trans dans les produits issus des ruminants est liée à un processus biochimique qui se produit à l’intérieur du rumen et que l’on nomme biohydrogénation (BH).
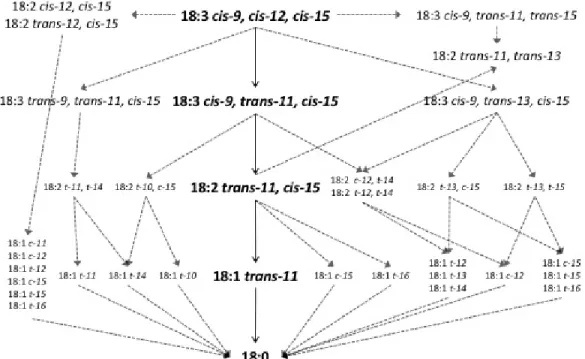
La BH des AGPI est un processus en deux étapes qui inclut l’hydrolyse des lipides qui libèrent les AG dans l’environnement ruminal (Lourenço et al., 2010). C’est à la suite de cette étape qu’il est possible pour la population bactérienne de biohydrogéner les AGPI pour les transformer en AGS. La BH des AGPI est effectuée en plusieurs étapes et l’accomplissement de l’ensemble du processus n’est pas complet. Cela explique la présence d’AG insaturés dans le lait ainsi que des intermédiaires de la BH comme l’acide vaccénique
trans (18:1 t11; AVT) et l’acide ruménique (18:2 c9t11, AR). Cette caractéristique
intrinsèque aux ruminants, et plus précisément aux bovins laitiers, rend difficile la commercialisation de produits laitiers enrichis en AAL dans le marché des aliments fonctionnels.
Selon Santé Canada (2002), « un aliment fonctionnel est semblable en apparence aux aliments conventionnels, il fait partie de l'alimentation normale et il procure des
des fonctions nutritionnelles de base ». Les composants bioactifs qui peuvent être présents dans les aliments sont nombreux et incluent le β-carotène, les fibres insolubles et les tannins, mais ce sont plus précisément les acides linoléiques conjugués (ALC) et les AG ω-3 qui sont présents naturellement dans le lait. Les ALC sont des intermédiaires de la BH et sont présents dans les matières grasses du lait. Il a été démontré, à la fois chez des modèles humains ou animaux, que les ALC ont des effets bénéfiques dans la prévention ou l’atténuation des symptômes de divers désordres ou maladies métaboliques tels le cancer, le diabète de type 2, l’athérosclérose ou le dépôt de masse adipeuse (Belury, 2002). La famille des AG ω-3 inclut l’AAL, l’acide éicosapentaénoïque (20:5 c5c8c11c14c17; AEP) et l’acide docosahéxaénoïque (22:6 c4c7c10c13c16c19; ADH). Tout comme pour les ALC, il
a été démontré que la famille des AG ω-3 a des effets bénéfiques tant pour la santé des
humains que pour celle des bovins laitiers (Anderson et Ma, 2009; Sordillo et al., 2009; Kim et al., 2014).
Le marché des AG ω-3 n’est pas qu’une mode passagère. Entre 2007 et 2012, les
ventes canadiennes de produits d’huiles de poisson et d’huiles dites « oméga » ont augmenté de 118 %, passant de 73 à 159 millions $. La croissance de ce secteur n’est pas terminée : les ventes estimées pour 2017 sont de 205 millions $ pour une croissance totale de 29 %, ou une croissance annuelle de 5 % par rapport à 2012 (Euromonitor International, 2013). Il est donc dans l’intérêt des producteurs de développer des moyens pour améliorer
l’absorption et le transfert des AG ω-3 dans le lait. Les objectifs de cette démarche, pour les
producteurs, sont d’entrer dans le marché lucratif des aliments fonctionnels, d’améliorer la rentabilité de leur entreprise et d’augmenter les parts de marchés des produits laitiers.
Les études sur le sujet sont déjà nombreuses et une variété de solutions ont été mises à l’essai : graines oléagineuses (e.g. lin, tournesol, canola, soya) traitées avec différents procédés (e.g. micronisation, torréfaction, extrusion), fourrages, produits marins, composés botaniques, traitements chimiques et probiotiques. L’objectif des travaux proposés ici est d’approfondir, d’explorer et de quantifier les différentes stratégies qui sont à la portée de l’industrie. Les deux premières stratégies consisteront à nourrir des bovins laitiers avec du trèfle rouge (Trifolium pratense L.; TR) en interaction avec une limitation de la disponibilité de l’azote dans le rumen. Il a été démontré que l’utilisation du TR dans l’alimentation des bovins laitiers augmentait la quantité de protéines non dégradables dans
le rumen et augmentait la concentration AAL dans le lait (Lee, 2014). De plus, Gerson et al. (1983) ont démontré qu’une diminution de la disponibilité de la protéine dans le liquide ruminal réduisait la lipolyse et la BH des AGPI. La troisième stratégie consistera à utiliser des sels de calcium (Ca) riche en AAL préalablement tamisés pour obtenir deux différentes tailles de particules. Block et al. (2008) ont démontré que des AG insaturés, présents dans des particules de sel de calcium de plus grandes tailles, étaient biohydrogénés moins rapidement comparativement à des sels fins en conditions in situ. L’essai réalisé visera donc à valider ce phénomène en condition in vivo. La quatrième stratégie consistera à procéder à une méta-analyse spécifique sur les effets du lin comparé à d’autres sources lipides et des procédés de traitement du lin sur la productivité des vaches et l’efficacité de
transfert des AG ω-3 de la ration à la matière grasse du lait. Une analyse du même type a
déjà été rédigée par Glasser et al. (2008a), mais plusieurs articles sur le lin sont parus depuis, de sorte qu’une nouvelle analyse des données de la litérature apparaît nécessaire.
Chapitre 2
La présente revue de littérature permettra d’appuyer, sur des bases solides, les recherches qui seront présentées dans ce document. Les sujets suivants seront traités : la composition et la structure des lipides du lait des bovins laitiers, les effets de l’acide α-linolénique (18:3 c9c12c15; AAL) sur le métabolisme des humains et des bovins, le processus de biohydrogénation (BH) ruminale de même que la digestion et le métabolisme des lipides chez la vache. Par la suite, différentes stratégies pour augmenter la concentration en AAL dans le lait seront abordées. Pour finir, un sommaire des différentes méta-analyses sur l’utilisation de la graine de lin en alimentation de la vache laitière sera faite.
2.0 Composition et structure des lipides du lait
La fonction première du lait était et est toujours de nourrir les nouveau-nés. Les lipides présents dans le lait jouent d’abord le rôle de source d’énergie. La concentration en matière grasse (MG) du lait des bovins et son profil en acides gras (AG) peuvent varier selon le stade de lactation (Palmquist et al., 1993). Or, les lipides ne servent pas seulement de source d’énergie, mais sont aussi responsables de la valeur nutritionnelle (source d’AG indispensables) et des propriétés physiques (Toral et al., 2013) des produits laitiers. Les lipides du lait sont constitués de triacylglycérols (TAG) à 98,3 %, de phospholipides (PL) à 0,8 %, et d’une concentration minime de diacylglycérols, de monoacylglycérols, d’AG libres (AGL) et de vitamines liposolubles (Walstra et Jenness, 1984). Puisque les lipides laitiers sont composés majoritairement de TAG, ceux-ci sont responsables des différentes caractéristiques physicochimiques comme l’hydrophobicité, la densité et le point de fusion. La seconde catégorie de lipides en importance dans le lait est celle des PL. Ces molécules, qui sont à la fois hydrophiles et lipophiles, jouent un rôle majeur dans la structure membranaire des globules de gras, ce qui permet de maintenir la MG dispersée dans une solution aqueuse telle que le lait (Deeth, 1997).
2.0.1 Les acides gras
0,01 % et on dénombre 14 AG dont la concentration est supérieure à 1 %. Leur analyse se fait par capillarité à l’aide d’un chromatographe en phase gazeuse. Les AG du lait proviennent de deux sources différentes, soit la synthèse de novo ou le prélèvement de la circulation sanguine. La synthèse de novo est effectuée directement par la glande mammaire pour les chaînes courtes et moyennes qui incluent les AG 4:0 à 14:0 et une partie du 16:0. Les chaînes synthétisées de novo représentent environ 45 % des AG totaux (Moore et Christie, 1979). La proportion restante est composée d’AG préformés qui proviennent de la ration ou de la mobilisation des réserves lipidiques corporelles. Les deux principaux AG polyinsaturés (AGPI) consommés par les bovins sont l’acide linoléique (18:2 c9c12; AL) et l’AAL. Une fois ces AG sont ingérés par l’animal, la flore microbienne du rumen s’active pour effectuer la BH (Jenkins, 1993). La BH est un processus qui permet aux micro-organismes du rumen de transformer les AGPI en AG saturés (AGS) et elle sera décrite ultérieurement dans cette revue de littérature. Ce processus biochimique conduit à la formation de nouveaux AG comme les acides linoléiques conjugués (ALC) ou encore l’acide vaccénique trans (18:1 t11; AVT). Ces intermédiaires de la BH se retrouvent par la suite dans le lait et certains ont des effets bénéfiques sur la santé humaine (Lock et Bauman, 2004).
2.0.1.1 Les acides gras saturés
Les acides gras à chaînes saturées sont les plus importants en termes de concentration dans les lipides du lait puisqu’ils représentent approximativement 70 à 75 % des AG. Les AGS sont composés d’une chaîne carbonée qui contient entre quatre et 18 molécules de carbone; les plus importants étant le 16:0 (22-35 %) suivi du 14:0 (8-14 %) et
du 18:0 (9-14 %) (Jensen, 2002). Outre ces trois principaux AGS, il est possible de
retrouver des chaînes carbonées de plus petite taille (12:0 à 4:0) qui permettent de réduire le point de fusion des TAG et ainsi conserver les lipides du lait liquides à la température corporelle de l’animal qui les produit (Toral et al., 2013).
2.0.1.2 Les acides gras insaturés cis
Les AG insaturés avec une isomérie cis représentent de 18 à 24 % des lipides du lait. Le plus important en concentration dans cette catégorie est l’acide oléique (18:1 c9;
AO) avec environ 85 % du total (Jensen, 2002). Quant aux autres AG mono-insaturés
comme le 14:1 et le 16:1 qui sont produits à partir du 14:0 et du 16:0 par l’action de
l’enzyme Δ9-désaturase, ils sont présents respectivement dans le lait avec des
concentrations de 1,0 et 1,5 %. Au contraire des AG mono-insaturés, les AGPI contenant seulement une isomérie cis sont présents en une plus faible concentration dans le lait, principalement à cause de la BH. Malgré la consommation élevée d’AL et d’AAL chez le ruminant, leurs concentrations respectives sont de 1 à 3 % et de 0,5 à 2 % dans le lait (MacGibbon et Taylor, 2006).
Pour ce qui est des autres AG de la famille des ω-3, l’acide éicosapentaénoïque
(20:5 c5c8c11c14c17; AEP) et l’acide docosahexaénoïque (22:6 c4c7c10c13c16c19; ADH) sont présents sous forme de trace puisque l’animal possède une très faible capacité de synthèse de ces AG (Bernal-Santos et al., 2010). Ainsi, le moyen le plus efficace pour obtenir un lait riche en AEP et en ADH serait de supplémenter la ration des bovins en produits marins préalablement protégés contre la BH ruminale. Comme les AG à courte chaîne, les AGPI cis permettent de réduire le point de fusion des TAG. Par contre, une concentration trop importante de ces AG pourrait engendrer des problèmes organoleptiques à la suite de leur oxydation (Bassette et al., 1986; Fauteux et al., 2016).
2.0.1.3 Les acides gras trans
La présence d’AG trans dans le lait est due à la biohydrogénation des AGPI dans le rumen. La méthode pour déterminer l’ensemble des AG 18:1 trans nécessite plusieurs
techniques analytiques qui ont permis d’identifier 13 différents AG de Δ4 à Δ16 (Precht et
Molkentin, 1996; Tableau 2-1). L’AVT est le plus important avec 30 à 60 % de l’ensemble des 18:1 trans pour une concentration en AVT totale entre 2 et 6 % des AG totaux (Precht et Molkentin, 2000).
Tableau 2-1 Concentration en acide octadécénoïque- trans (18:1) dans le lait des bovins, adapté de Precht et Molkentin (1997).
Isomères des acides trans-octadécénoïque
Composition (% m/m des acides gras totaux)
Δ4 Δ5 Δ6-8 Δ9 Δ10 Δ11 Δ12 Δ13/14 Δ15 Δ16 Total
Valeur moy. 0,05 0,05 0,17 0,24 0,17 1,75 0,21 0,48 0,28 0,34 3,74
Valeur max. 0,13 0,12 0,30 0,31 0,26 4,00 0,31 0,73 0,47 0,51 6,34
Valeur min. 0,02 0,02 0,03 0,16 0,00 0,52 0,11 0,25 0,10 0,16 1,91
Precht et Molkentin (1997) ont répertorié plusieurs acides trans-octadécadiénoïques qui contiennent une ou deux liaisons trans (Tableau 2-2). L’acide ruménique (18:2 c9t11; AR) est le plus important dans cette catégorie puisqu’il représente 80 à 90 % des acides
trans-octadécadiénoïques (Parodi, 1977). Le terme ALC est utilisé pour représenter un
mélange d’isomères positionnels et géométriques d’acide octadécadiénoïque. Les ALC du lait sont dérivés du processus de BH des AG dans le rumen. De plus, la glande mammaire a
la capacité de synthétiser du 18:2 c9t11 à partir du 18:1 t11 grâce à l’enzyme Δ9-désaturase.
La grande différence entre une structure cis et trans est la présence d’une courbure de la chaîne carbonée dans le cas d’une liaison cis, ce qui a pour effet de réduire le point de fusion des TAG. À température ambiante, les AGPI trans sont ainsi solides si on les compare aux AGPI cis qui sont sous forme liquide.
Tableau 2-2 Concentration en acides trans-octadécadiénoïques (18:2) dans le lait des bovins, adapté de MacGibbon et Taylor (2006).
Composition (% m/m des acides gras totaux)
Isomères trans-18:21 Moyenne Max. Min.
c9t11 0,85 1,95 0,25 c-9t12 0,10 0,16 0,05 t-9c12 0,07 0,48 0,02 c9t13
}
0,11 0,16 0,07 t8c12 t11c15 0,33 0,68 0,04 t9t12 0,09 0,12 0,06 1 c = cis ; t = trans2.1 Effets des acides gras sur la santé humaine
Selon l’Organisation mondiale de la Santé (2013), l’obésité a atteint des proportions épidémiques avec le décès d’au moins 2,8 millions de personnes par année attribuable à cet état métabolique. L’obésité n’est pas seulement une problématique reliée à l’apparence physique : le surplus de masse adipeuse entraîne de nombreuses pathologies, incluant le diabète de type 2, l’hypertension, l’hypertriglycéridémie ou encore l’hypercholestérolémie. Malgré la possibilité de traiter ces pathologies de façon pharmaceutique, le meilleur moyen reste d’avoir de meilleures habitudes de vie et une alimentation équilibrée. En dépit de la mauvaise presse faite par certains auteurs (Michaëlsson et al., 2014) sur les risques liés à la consommation de produits laitiers, ces aliments sont vus comme bénéfiques pour la santé. Le lait contient plusieurs composés bioactifs qui incluent le lactose, les immunoglobulines, les caséines, les protéines du lactosérum, les enzymes, les lactoferrines, les vitamines et les lipides (Park, 2009).
Le guide alimentaire canadien (Santé Canada, 2013) recommande la consommation de produits laitiers pour une alimentation saine puisqu’ils représentent une importante source de protéines, de calcium et de vitamines A et D. Par contre, le lait ne fait pas l’unanimité dans la population et la communauté scientifique, car sa concentration en lipides est vue comme une source d’énergie dense, de cholestérol et de gras saturés (Ulbricht et Southgate, 1991). Selon certains auteurs, la consommation de ce type de lipides serait reliée à des augmentations du cholestérol sanguin et du rapport entre les lipoprotéines de basse densité et le cholestérol des lipoprotéines de haute densité (Kratz, 2005; Siri-Tarino et al., 2010b; Siri-Siri-Tarino et al., 2010a). Jusqu’à tout récemment, ces changements au profil lipidique sanguin étaient considérés comme des facteurs de risque pour les maladies cardiovasculaires. Un autre facteur qui joue contre le lait est que la consommation d’une diète avec une densité énergétique élevée favorise une augmentation de la masse corporelle (Rolls, 2009).
Au contraire de la plupart des modèles animaux utilisés lors d’expérimentations sur l’athérosclérose, la consommation de cholestérol chez les humains ne semble pas augmenter les risques de maladies cardiovasculaires (Kratz et al., 2013). Une méta-analyse
que la consommation d’AGS n’était pas associée à une augmentation du risque de maladies cardiovasculaires. Siri-Tarino et al. (2010b) et Hooper et al. (2011) sont arrivés à la conclusion que le remplacement des AGS par des AGPI n’a qu’un faible impact sur le bilan lipidique sanguin. Finalement, à la suite d’une récente méta-analyse avec des études cliniques, Ramsden et al. (2010) suggèrent que les effets bénéfiques du remplacement des AGS par des AGPI sont observables seulement lors de la consommation d’AG ω-3.
2.1.1 Les acides gras ω-3
Les AG ω-3 sont considérés comme indispensables puisque les humains sont
incapables de synthétiser l’AAL et qu’ils possèdent une faible capacité de synthèse de l’AEP et de l’ADH à partir de l’AAL. Le potentiel de transformation de l’AAL en AEP ou
en ADH est limité par l’activité de l’enzyme Δ6-désaturase qui conduit à la production de
l’acide stéaridonique, une étape limitante à la production de l’AEP et de l’ADH (Figure 2-1; James et al., 2003). Ainsi, les humains doivent obtenir ces AG de l’alimentation par la consommation de produits marins pour ce qui est de l’AEP et de l’ADH, et la consommation de produits oléagineux comme le lin, le canola ou la caméline pour l’AAL (Tableau 2-3).
Les effets des AG ω-3 sur la santé des humains sont diversifiés. Tout d’abord,
l’apport d’ADH lors de l’allaitement des nourrissons a été associé à une amélioration de l’acuité visuelle et de divers indices de développement du cerveau (Innis et al., 2001). L’effet sur le cerveau n’est pas seulement restreint aux nouveau-nés : il a aussi été possible d’observer, chez des patients atteints de schizophrénie et de dépression, un faible taux sanguin d’ADH, ce qui laisse croire à l’importance de cet AG dans le bon fonctionnement du cerveau (Yao et al., 1994; Timonen et al., 2004). Un autre bienfait des AG ω-3 est leur capacité à modifier le profil des lipoprotéines. Une réduction de la concentration de TAG dans le plasma de 25 à 30 % a été possible chez des patients atteints d’hypertriglycéridémie avec l’apport de 2 à 4 g/j d’AEP et d’ADH (Kris-Etherton et al., 2002). Du côté des bovins laitiers, la consommation d’AEP et d’ADH a montré des effets positifs sur la reproduction en modifiant l’expression de plusieurs gènes tels que FOXD1, FOXD3, NFKB1, ESR1, PGR, FOXA2, NKX3-1 et PPARα (Waters et al., 2014).
Acide octadécatriénoïque (Acide α-linolénique) 18:3 c9c12c15 ↓Δ6-désaturase Acide octadécatétraénoïque (Acide stéaridonique) 18:4 c6c9c12c15 ↓Élongase Acide éicosatétraénoïque 20:4 c8c11c14c17 ↓Δ5-désaturase Acide éicosapentaénoïque 20:5 c5c8c1c14c17 ↓Élongase Acide docosapentaénoïque 22:5 c7c10c13c16c19 ↓Élongase Acide tétracosapentaénoïque 24:5 c9c12c15c18c21 ↓Δ6-désaturase Acide tétracosahexaénoïque 24:6c6c9c12c15c18c21 ↓β-oxydation Acide docosahexaénoïque 22:6 c4c7c10c13c16c19
Figure 2-1 Biosynthèse de l’acide éicosapentaénoïque et de l’acide docosahexaénoïque
Tableau 2-3 Différentes sources d’huile selon leur concentration en 18:3 c9c12c15.
Nom binomial Nom commun %1 Référence
Salvia hispanica Chia 64,0 Dubois et al. (2007)
Actinidia chinensis Graine de kiwi 62,0 Piombo et al. (2006)
Lallemantia 60,0 Zlatanov et al. (2012)
Linum usitatissimum Lin 58,0 Dubois et al. (2007)
Perilla frutescens Graine de perilla 55,0 Dubois et al. (2007)
Plukenetia volubilis L. Sacha peanut 50,8 Gutiérrez et al. (2011)
Vaccinium vitis-idaea Petite airelle 49,7 Johansson et al. (1997)
Arctostaphylos uva-ursi
Raisin d'ours
commun 46,4 Johansson et al. (1997)
Matthiola tricuspidata Giroflée 43,9 Dubois et al. (2007)
Empetrum nigrum Camarine noire 43,9 Johansson et al. (1997)
Fragaria vesca Fraise des bois 43,5 Johansson et al. (1997)
Empetrum hermaphroditum
Camarine
hermaphrodite 43,0 Johansson et al. (1997)
Vaccium uliginosum Myrtille des marais 38,4 Johansson et al. (1997)
Vaccium myrtillus Myrtille 36,5 Johansson et al. (1997)
Rubus Chamaemorus Chicouté 35,6 Johansson et al. (1997)
Oxycoccus
quadripetalus Canneberge 35,1 Johansson et al. (1997)
Sambucus racemosa Sureau de montagne 34,5 Johansson et al. (1997)
Carex elata 32,5 Bogucka-Kocka et Janyszek (2010)
Carex otrubae 31,9 Bogucka-Kocka et Janyszek (2010)
Portulaca oleracea Portulaca 31-43 Liu et al. (2000)
Rubus Idaeus Framboise 29,1 Dubois et al. (2007)
Aleurites moluccanus Kukui 28,1 Martín et al. (2010)
Salicornia euoipaea Salicorne 28 Dubois et al. (2007)
Camelina sativa Caméline 27-39 Karvonen et al. (2002b)
Carex Contigua 26,2 Bogucka-Kocka et Janyszek (2010)
Rosa dumalis Rosier 25,1 Johansson et al. (1997)
Hippophae rhamnoides
L Argousier 20-36 Yang et Kallio (2001)
Les effets nutraceutiques et pharmacologiques montrés à ce jour sont résumés aux Tableau 2-4 et Tableau 2-5. En résumé, il a été démontré que la consommation d’AAL par des humains permettait de réduire les risques de mort subite à la suite d’un malaise cardiaque (Albert et al., 2005), d’infarctus du myocarde (Campos et al., 2008) et de maladies coronariennes (Djoussé et al., 2001). L’AAL agirait par le biais de l’activation du récepteur farnésoïde X (Kim et al., 2014) ou par une augmentation des synthèses d’AEP et d’ADH qui ont aussi des effets positifs sur la santé cardiovasculaire. L’AAL a également montré des effets protecteurs sur le système nerveux en prévenant la mort neurologique et l’apparition de lésions de l’hippocampe (Lauritzen et al., 2000). La consommation d’AAL réduit aussi la production de facteur-α de nécrose tumorale et d’interleukin-6/8 qui sont impliqués dans les réactions inflammatoires (Xie et al., 2011). Finalement, la consommation d’huiles riches en AAL, contrairement aux huiles riches en AL (e.g. huile de maïs), s’est révélée utile pour le traitement de l’asthme bronchique (Okamoto et al., 2000).
Tableau 2-4 Résumé de différentes études sur les effets de l’acide α-linolénique (AAL) pour ses caractéristiques nutraceutiques, adapté de Kim et al. (2014).
Forme de AAL1 Effet nutraceutique Référence
Huile de lin (3 g d’AAL/j)
Aucun effet sur la composition du sang
en TAG2 et les lipoprotéines
Harper et al. (2006) Huile de lin
(598,3 mg d’AAL/ capsule, 2 capsules/j)
Augmente la concentration d’AAL dans les érythrocytes
Barcelo-Coblijn et al. (2008)
Capsule d'huile de lin
Augmente la concentration d’AAL sanguin après six semaines, mais n'a aucun effet sur la concentration totale de
cholestérol, LBD3, LHD4 et TAG
Kaul et al. (2008)
Graine de lin Augmente la concentration dans le sérum
d’AAL et d’Apo lipoprotéine A-1 et B. Diminue la taille des particules de LBD
Dodin et al. (2008)
Graine de lin moulue
Augmente la concentration en AAL dans le sérum et la sensibilité à l'insuline Diminue les LBD et LHD
Bloedon et al. (2008)
Margarine enrichie en AAL
Augmente le niveau de LBD contenant des AAL et diminue la concentration de triglycéride dans le sérum.
Egert et al. (2009)
Diète enrichie en AAL
Diminue la pression diastolique et augmente les LHD
Sioen et al. (2009) Graine de lin
moulue (50 g /j)
Inhibe la synthèse de PG5. Altère la
composition des lipides dans le plasma et les plaquettes. Augmente la
concentration d’AAL et d’acides gras oméga-3 dans le plasma et les
érythrocytes. Diminue le cholestérol total et LBD dans le sérum
Adam et al. (1986)
Huile de lin (52,8 % d’AAL)
Réduit significativement la rougeur et l'écaillage de la peau
De Spirt et al. (2009)
1 Acide α-linolénique
2 Triacylglycérols
3 Lipoprotéine de basse densité
4 Lipoprotéine de haute densité
Tableau 2-5 Résumé de différentes études sur les effets de l’acide α-linolénique (AAL) pour ses caractéristiques pharmacologiques, adapté de Kim et al. (2014).
Forme d’AAL1 Effet pharmacologique Référence
Huile de pérille Bénéfice significatif sur l’asthme
bronchique
Okamoto et al. (2000)
Huile de chanvre Améliore la dermatite atopique Callaway et al. (2005)
Huile de lin Réduit le cholestérol total, LBD2, le
ratio LBD/LHD3 et les TAG4 du sérum
Singer et al. (1990)
Graine de lin Diminue les épisodes de chaleur chez
les femmes ménopausées
Pruthi et al. (2007) Margarine et capsule
d’AAL
Aucun effet sur les lipides du plasma et le glucose
Finnegan et al. (2003)
Huile de caméline Réduit le cholestérol du sérum Karvonen et al. (2002a)
Diète riche en AAL1 Effets cardioprotecteurs Zhao et al. (2007)
Huile de lin Aucun effet sur le contrôle de la
glycémie sur des personnes diabétiques de type 2
Barre et al. (2008)
Huile de colza (3,5 g d’AAL/j)
Réduit la pression systolique, le cholestérol total, LBD et le niveau d’insuline
Baxheinrich et al. (2012)
Noix Modulation partielle de l'inflammation
et de l'activation endothéliale
Chiang et al. (2012)
1 Acide α-linolénique
2 Triacylglycérols
3 Lipoprotéine de basse densité
4 Lipoprotéine de haute densité
2.1.1.1 Effets des acides gras sur la santé des bovins laitiers
En début de lactation, avec un apport insuffisant en énergie alimentaire, la production laitière conduit à la mobilisation de réserves corporelles pour combler le déficit calorique. Dans ces conditions, les AG non estérifiés sont libérés des tissus adipeux et transportés vers le foie pour la production d’énergie via la β-oxydation. Par contre, lorsque l’apport en AG non estérifié est trop important et que le foie est dans l’incapacité de les métaboliser ou de les exporter (stéatose hépatique), cela entraîne une augmentation de la production de corps cétoniques. Mashek et al. (2005) ont montré que la perfusion intraveineuse d’huile de lin, par rapport à du suif, avait pour effet de diminuer les concentrations plasmiques d’AG non estérifiés et de β-hydroxybutyrate chez des vaches taries. Les résultats obtenus lors de cette expérience sur le métabolisme lipidique n’ont pas
l’effet de l’AAL sur le métabolisme lipidique soit mitigé, l’apport de ces AG sous forme de graines de lin chez les bovins laitiers a permis d’améliorer la fertilité par rapport au soya ou au sel de calcium d’huile de palme (Petit et Twagiramungu, 2006). Les raisons avancées par les auteurs de l’étude seraient que la consommation de lin tend à augmenter la concentration de progestérone dans le plasma et conduit à la formation de corps jaunes avec une taille moyenne supérieure (Petit et Twagiramungu, 2006).
2.2 Biohydrogénation
L’alimentation des bovins laitiers est diversifiée dans le but de tenir compte de l’âge de l’animal, de sa taille, de son stade physiologique, de sa production et du coût des ingrédients de la ration. La multitude d’aliments tels les fourrages, les céréales, les protéagineux, les oléagineux, les sous-produits de l’industrie alimentaire ou les huiles et graisses servis aux bovins laitiers créent une diversité en lipides et en AG dans leur alimentation. Il est possible de retrouver des TAG comme forme principale de lipide dans les céréales, les oléagineux, les huiles de sources végétales ou marine et les sous-produits, tandis que les PL et les glycolipides (GL) sont présents dans les plantes fourragères. Contrairement aux AG absorbés par les animaux monogastriques, ceux absorbés par les ruminants ne sont pas identiques à ceux ingérés. La raison derrière ce phénomène est la BH, un processus biochimique effectué par les micro-organismes du rumen qui débute par une lipolyse des lipides suivie d’une hydrogénation des doubles liaisons. Cela explique la
faible concentration en AG ω-3 dans la viande et le lait des ruminants, même si certains
aliments qu’ils ingèrent, comme les fourrages (Boufaïed et al., 2003) ou la graine de lin (Woods et Fearon, 2009), peuvent contenir des concentrations appréciables de ces AG (50 et 54 g d’AG ω-3/100 g d’AG totaux, respectivement).
Le rôle de la BH n’est pas encore bien défini. L’une des hypothèses est que le processus a pour objectif de produire des AG absents de l’alimentation des animaux pour l’incorporation dans la membrane de certaines bactéries (Hazlewood et al., 1979). Une autre hypothèse est que le microbiote du rumen utilise la BH pour contrôler la présence d’hydrogène dans l’environnement du rumen (Lennarz, 1966). L’hypothèse qui semble cependant la plus probable est que la BH soit utilisée pour détoxifier le rumen puisque les
AGPI semblent inhiber la croissance de certaines bactéries (Nieman, 1954). Les paragraphes suivants porteront sur ce processus qui est l’obstacle le plus important pour l’absorption et la sécrétion dans le lait des AG ω-3.
2.2.1 Lipolyse
Une fois les TAG, les PL et les GL ingérés par le ruminant, la première étape dans le processus de la BH est la lipolyse ou la désestérification des lipides. Bien que les plantes possèdent des lipases qui ont la capacité d’effectuer la désestérification (Van Ranst et al., 2009), Dawson et al. (1977) ont démontré, avec des fourrages stérilisés par autoclave, que les enzymes provenant des micro-organismes du rumen étaient prédominants dans ce processus. Les micro-organismes responsables de la majorité de l’hydrolyse des lipides sont des bactéries parmi lesquelles anaerovibrio lipolytica serait la plus active (Hobson et Mann, 1961). La famille des butyrivibrio spp posséderait, quant à elle, le matériel génétique pour hydrolyser les PL et les GL (Harfoot et Hazlewood, 1997). En ce qui concerne l’activité lipolytique des protozoaires, il a été possible d’observer une activité galactosidique (Wright, 1961), mais sans activité lipolytique (Bailey et Howard, 1963). La majorité des facteurs influençant la lipolyse sont basés sur des expériences in vitro.
Il a été permis de constater, lors de ces expériences, que l’augmentation de la concentration en azote (N) dans le milieu ruminal intensifiait l’activité lipolytique (Gerson et al., 1983) et que le taux de lipolyse était réduit lorsque la fibre était remplacée par de l’amidon (Gerson et al., 1985). De plus, une augmentation du temps d’incubation accroît la lipolyse (Beam et al., 2000) tandis qu’une baisse de pH la réduit (Latham et al., 1972). Finalement, une augmentation de la température de fusion des lipides à hydrolyser réduit l’activité lipolytique in vitro (Beam et al., 2000). La Figure 2-2 résume les différents facteurs qui influencent le taux de lipolyse, le taux d’isomérisation et le taux de BH.
En condition in vivo, il a été rapporté qu’entre 85 et 93 % des lipides sont hydrolysés dans le rumen d’une vache en lactation qui consomme une ration composée d’ensilage avec un rapport fourrages/concentrés de 60:40 (Halmemies-Beauchet-Filleau et al., 2013). Cette forte lipolyse dans le rumen entraine la présence de 80 % d’AG sous forme