AVERTISSEMENT
Cette thèse d’exercice est le fruit d’un travail approuvé par le jury de soutenance et réalisé dans le but d’obtenir le diplôme d’Etat de docteur en médecine. Ce document est mis à disposition de l’ensemble de la communauté universitaire élargie.
Il est soumis à la propriété intellectuelle de l’auteur. Ceci implique une obligation de citation et de référencement lors de l’utilisation de ce document.
D’autre part, toute contrefaçon, plagiat, reproduction illicite encourt toute poursuite pénale.
Code de la Propriété Intellectuelle. Articles L 122.4
UNIVERSITÉ PARIS DESCARTES
Faculté de Médecine PARIS DESCARTES
Année 2017
N° 127
THÈSE
POUR LE DIPLÔME D’ÉTAT
DE
DOCTEUR EN MÉDECINE
Évaluation de la performance diagnostique de l’imagerie hybride TEP-IRM
pour l’exploration des troubles cognitifs dans la pratique clinique
Présentée et soutenue publiquement
le 23 juin 2017
Par
Stéphanie BOURRELIER
Née le 19 juin 1988 à Paris (75)
Dirigée par Mme Le Docteur Anne Bertrand, PH
Jury :
M. Le Professeur Stéphane Lehéricy, PU-PH ……….. Président Mme Le Professeur Aurélie Kas, PU-PH
M. Le Professeur Bruno Dubois, PU-PH
2
Remerciements
À Monsieur le Pr Stéphane Lehéricy, merci d’avoir accepté de présider le jury de ma thèse. À Madame le Dr Anne Bertrand, merci d’avoir accepté de diriger cette thèse, de m’avoir appris à aimer l’imagerie neurologique et de m’avoir épaulée et soutenue tout au long de ce travail. Son soutien et sa patience m’ont permis d’arriver au bout de ce travail. Je lui en suis réellement reconnaissante.
À Monsieur le Pr Bruno Dubois, merci d’avoir accepté de juger ce travail de thèse. En tant que neurologue spécialisé dans la maladie d’Alzheimer. Votre présence dans ce jury est une réelle chance.
À Madame le Pr Aurélie Kas, merci d’avoir accepté de juger et d’avoir participé à ce travail de thèse.
À Madame le Dr Marie-Odile Habert, merci d’avoir accepté de juger ce travail de thèse. Votre participation à cette thèse en tant que relectrice et votre aide à sa rédaction m’ont beaucoup aidées.
À Monsieur le Dr Stéphane Epelbaum, merci d’avoir accepté de juger ce travail de thèse. Votre contribution dans ce projet de thèse m’a été d’une aide précieuse.
Au Professeur Didier Dormont, merci pour son accueil dans son service.
Aux chefs et PH, trop nombreux pour être cités, auprès desquels j’ai beaucoup appris tout au long de ma formation et qui m’ont guidé à différents moments de mon parcours.
À mes co-internes et amis, pour tous ces bons moments passés ensemble, en particulier Pierre-Adrien, Anna, Pauline, Neesmah, Axel, Atanas, Mélodie, Sarah, Boubekeur, Anne-Sophie, Valentine, Alexis, Gabriel. Vous avez contribué à rendre les stages mémorables. À mes amis Julie, Pauline, Lucile, Dacine, Fanny, Elsa, Alix, Marc, Louise merci pour ces incroyables moments passés ensemble et pour cette amitié.
À mon frère Arnaud et aux merveilleux moments passés ensemble.
À mes parents et grands-parents, merci de m’avoir amenée jusqu’ici. Merci pour votre soutien et votre amour.
3
- Table des matières
- REMERCIEMENTS ... 2
- TABLE DES MATIERES ... 3
- TABLE DES ILLUSTRATIONS ... 6
- I. Liste des tableaux ... 6
- II. Liste des figures ... 6
- LISTE DES ABREVIATIONS ... 7
- INTRODUCTION ... 9 - PARTIE 1 : RATIONNEL ... 11 - I.MALADIES NEURODEGENERATIVES ... 11 - 1. GENERALITES ... 11 - A. Définition ... 11 - B. Etiologie ... 11 - 2. MALADIE D'ALZHEIMER ... 12
- 3. DEMENCES LOBAIRES FRONTO TEMPORALES ... 18
- 4. APHASIES PRIMAIRES PROGRESSIVES ... 22
- A. APP sémantique (SV-PPA) ... 22
- B. L'APP non fluente (nf-PPA) ... 23
- C. Aphasie logopénique ... 24
- 5. DEMENCES VASCULAIRES ... 25
- II.LA NEUROIMAGERIE ... 27
4
- 2.LA TEP-FDG ... 33
- A. PRINCIPES DE LA TEP-FDG ... 33
- B. Le fluorodesoxyglucose marqué au fluor 18 (18F-FDG) ... 35
- 3.LA TEP -IRM... 36
- A. Principes ... 36
- B. Difficultés techniques poses par rapport à la TEP et l’IRM seules ... 38
- PARTIE 2 : MATERIELS ET METHODES ... 41
- I. Population ... 41
- II. Informations cliniques ... 41
- III. Biomarqueurs du LCR ... 41
- IV. Protocole d'acquisition des images ... 42
- V. Analyse Des Images ... 42
- VI. Volumétrie automatique des hippocampes ... 44
- VII. Analyses statistiques ... 45
- PARTIE 3: RESULTATS ... 46
- I. Caractéristiques de la population ... 46
- II. Concordance inter-observateur ... 47
- III. Performances diagnostiques de la TEP-IRM ... 48
- A. Identification des patients MA et non MA ... 48
- B. Erreurs diagnostiques : faux positifs et négatifs MA ... 50
- C. Erreurs diagnostiques : faux négatifs ... 50
5
- E Volumétrie hippocampique ... 53
- PARTIE 4: DISCUSSION ... 55
- I.Performance diagnostique globale de la TEP-IRM ... 55
- II. Faux positifs pour la MA en TEP-IRM ... 56
- III. Faux négatifs pour la MA en TEP-IRM ... 57
- IV. Diagnostics autre que la MA ... 59
- V. Volumétrie hippocampique ... 60
- VI. Limites de l'étude ... 60
6
Table des illustrations
I. Liste des tableaux
Tableau 1 : Critères de MA incorporant les biomarqueurs Tableau 2 : Caractéristiques des patients
Tableau 3 : Performances diagnostiques de la TEP-IRM (MA versus non MA)
II. Liste de figures
Figure 1 :Plaque amyloïde et dégénérescence neurofibrillaire
Figure 2 :Critères diagnostiques de la variante comportementale de démence frontotemporale Figure 3 : Critères résumés de démence vasculaire probable ou possible, NINDS-AIREN Figure 4 : Interaction entre l’onde de radiofréquence et les protons placés dans le champ B0 Figure 5 : Illustration du phénomène de l’écho de spin avec quatre spins
Figure 6 : Chronologie des événements au cours du phénomène de l’écho de spin Figure 7 : Chronologie des impulsions RF et paramètres de la séquence d’écho de spin Figure 8 : Détection des photons gamma par couplage : cristal/tube photomultiplicateur Figure 9 : TEP-IRM
Figure 10 :Echelle de Fazekas et Schmidt
Figure 11 : 2 patients faux positifs pour la maladie d’Alzheimer avec leucopathie Figure12 :Patient MA diagnostiqué comme démence sémantique en TEP-IRM
Figure 13 :Comparaison des volumes hippocampiques normalisés entre les patients MA et les
autres patients.
Figure 14 : Patients MA avec discret hypométabolisme du cortex pariétal
7
ACP : Atrophie Corticale Postérieure ARS : Agence Régionale de Santé AVC : Accident Vasculaire Cérébral BA : Balanced Accuracy
CADASIL : Artériopathie Cérébrale Autosomique Dominante DCB : Dégénerescence Cortico Basale
DLFT-bv: Dégénérescence Lobaire Fronto-Temporale à variante comportementale DNF: Dégénérescence neurofibrillaire
DSMV:Diagnostic and Statistical Manual of Mental Disorders V DV : Démence Vasculaire
FdRCV : Facteur de Risque Cardio-Vasculaire FN : Faux négatif
FP : Faux positif
IGW 2 : International Working Group 2 IRM: Imagerie par Résonnance Magnétique LCR: Liquide Céphalo Rachidien
MA: Maladie d’Alzheimer
MCI : Mild Cognitive Impairment MMSE : Mini Mental State Examination
Nf-PPA: Aphasie Progressive primaire Non Fluente
NIA-AA : National Institut on Aging-Alzheimer’s Assiociation RF : Radiofréquence
RMN : Résonnance Magnétique Nucléaire Se: Sensibilité
8
Sp: Spécificité
Sv-PPA: Démence sémantique TE : Temps d’Echo
TEP-FDG: Tomographie par Emission de Positons au Fluorodésoxyglucose TR : Temps de répétition
VP: Vrai positif VN : Vrai négatif
9
Introduction
Les troubles neurocognitifs, par leur fréquence, constituent un problème considérable de santé publique(1–3).Aujourd'hui, en France, plus d’un million de personnes sont concernées : environ 1 200 000 personnes seraient touchées par la maladie d’Alzheimer ou un autre trouble neurocognitif.Le facteur de risque essentiel est l’âge avec une incidence qui croit de façon quasi exponentielle avec ce facteur. La maladie d’Alzheimer explique à elle seule une proportion importante de ces chiffres (de 55 à 70 %, selon les séries). Avec le vieillissement croissant de la population, on s’attend à une augmentation de la prévalence dans les prochaines années (doublement d’ici les années 2020). L’amélioration des stratégies diagnostiques et thérapeutiques est donc une nécessité absolue.
La neuroimagerie comprenant à la fois l’IRM et la TEP, a joué un rôle central dans l’exploration des troubles neurocognitifs. Elle est maintenant intégrée dans lescritères diagnostiques decertainesmaladies neurodégénératives (4–7).La tomographie par émission de positons hybrides / imagerie par résonance magnétique (TEP- IRM) est une nouvelle modalité d'imagerie qui est devenue disponible récemment dans la pratique clinique. La TEP-IRM hybride offre plusieurs avantages :
-un gain de temps et une augmentation du confort du patient, en particulier pour les personnes âgées ayant de nombreuses comorbidités ;
-la suppression de l'erreur d'enregistrement entre les modalités, grâce à l'acquisition simultanée d’images TEP et IRM ;
-une possibilité unique d'effectuer des analyses anatomiques, métaboliques et fonctionnelles simultanées (8,9).
10
L'exploration hybride TEP-IRM de patients atteints de troubles cognitifs est intéressante car la TEP-FDG fournit un marqueur précoce de nombreux troubles neurodégénératifs (10–13), mais l'IRM fournit des informations sur les lésions vasculaires (séquelles d'accident vasculaire cérébral, microsaignements, leucopathie) qui ne peuvent pas être évaluées de manière fiable sur la TEP-FDG. Par ailleurs, l'appréciation du métabolisme, chez les sujets plus âgés, peut-être plus difficile en raison de l’atrophie liée à l'âge : ainsi la combinaison d'images TEP avec celles de l’IRM à la place du scanner facilite l'estimation précise du métabolisme cortical, en particulier dans les régions atrophiques (9,14).La TEP-IRM est, pour toutes les raisons suscitées, un outil prometteur mais son intérêt clinique n’est pas encore évalué.
L'objectif de notre étude était d'évaluer l'efficacité de l'imagerie hybride TEP-IRM pour le diagnostic des maladies neurodégénératives parmi les patients d’une cohorte mémoire, chez qui les biomarqueurs du LCR de la maladie d’Alzheimer avaient été réalisés. En effet, ils sont devenus un gold standard pour le diagnostic de la maladie d’Alzheimer et ils permettent de s’affranchir d’une partie du problème de circularité du diagnostic basé en partie sur l’imagerieIl s’agissait d’estimer la contribution respective de l'imagerie IRM et TEP-FDG dans le diagnostic final et son degré de confiance. Nous avons également étudié, dans la même population, la valeur diagnostique de la volumétrie automatique de l'hippocampe fournie par un fournisseur commercial, approuvé par la FDA Logiciel (Neuroquant, CorTechs Labs, San Diego, CA) (15).
11
Partie 1 : Rationnel
I. LES MALADIES NEURODEGENERATIVES
1. GENERALITES
A. Définition des troubles neurocognitifs (DSMV):
- Atteinte multiple des fonctions cognitives (atteinte de la mémoire et d’au moins une autre fonction comme le langage, les gnosies, les praxies, les fonctions exécutives…) - Cette atteinte doit constituer une baisse par rapport au niveau antérieur (témoignant de
son caractère acquis et non congénital). Elle doit avoir un retentissement significatif sur la vie sociale et/ou professionnelle.
- Les troubles cognitifs ne doivent pas survenir exclusivement au cours d’un épisode de confusion mentale. Les confusions se caractérisant par une atteinte cognitive
régressive.
- Ces troubles cognitifs ne doivent pas pouvoir être expliqués exclusivement par un trouble psychiatrique (psychose ou dépression…).
B.Etiologie
Il existe de nombreuses étiologies aux troubles neurocognitifs :
La principale est dégénérative, avec d’une part, la maladie d’Alzheimer se présentant le plus souvent comme un syndrome amnésique hippocampique, plus rarement par des troubles visuo-spatiaux ou praxiques, une APP logopénique, et exceptionnellement par un syndrome frontal ; et d’autre part, la dégénérescence lobaire fronto temporale se manifestant par une forme com-portementale, une nf-PPA ou une démence sémantique. Plus rarement, la DLFT peut se
12 présenter sous la forme d’un syndrome cortico basal ou d’une paralysie supra nucléaire pro-gressive. Enfin, on trouve la maladie de Parkinson et les syndromes parkinsoniens aty-piques(Démence à Corps de Lewy, Paralysie Supranucléaire Progressive, Dégénérescence Cor-tico Basale).
On observe de nombreuses autres causes comme vasculaire, toxiques, tumorale, infectieux (VIH, syphilis…), prions, inflammatoires (SEP, Sarcoïdose, Behçet, Sjögren…), séquellaires, métaboliques et nutritionnelles (thyroïde, carence vitaminique…), paranéoplasiques.
2. LA MALADIE D’ALZHEIMER Anomalies histologiques :
Les lésions cérébrales sont de deux types (Figure 1) : les dépôts extracellulaires de plaques amyloïdes (ou plaques séniles) et les dégénérescences neurofibrillaires (DNF) (16). C’est la concomitance de ces deux anomalies qui pose le diagnostic de certitude de la maladie d’Alzheimer en post mortem après l’étude anatomopathologique des coupes de cerveau (17– 19). Les plaques amyloïdes sont constituées d’agrégats extracellulaires oligomériques d’une protéine appelée peptide amyloïde ou peptide Aβ1-42. Ce peptide, connu pour être neurotoxique et à l’origine de dysfonctions synaptiques (20,21), est séquestré dans l’espace intercellulaire cérébral.
Par conséquent, la concentration d’Aβ1-42 circulant dans le LCR va diminuer. La DNF se définit comme la présence d’agrégats intra neuronaux, appelés neurofibrilles, constitués de l’accumulation d’une protéine sous sa forme hyper phosphorylée, la protéine Tau. Al’état physiologique, cette protéine participe à l’assemblage des microtubules quiconfèrent au neurone son intégrité et jouent un rôle important dans les transportsaxonaux antérogrades et rétrogrades (22).
13 Dans la maladie d’Alzheimer, la forme phosphorylée de cette protéine prédomine de façon anormale suite à un phénomène d’hyper phosphorylation. Ce phénomène aura pour conséquence de diminuer l’affinité de la protéine pour les microtubules, et de favoriser leur agrégation sous forme de neurofibrilles (17,23).
La perte de la stabilisation du neurone et la toxicité neuronale des neurofibrilles vont conduire au dysfonctionnement puis, à terme, à la destruction du neurone (24). Ainsi, le contenu du neurone sera relargué dans l’espace extracellulaire, augmentant, les concentrations en protéine Tau et P-Tau dans le LCR.
La plupart des MA est sporadique. Il existe de rare cas où la maladie se transmet selon un mode autosomique dominant.
Figure 1 : Plaque amyloïde et dégénérescence neurofibrillaire. Il s’agit d’unecoupe anatomopathologique de cerveau colorée par des techniquesimmunohistochimiques où coexistent les deux lésions cérébrales caractéristiquesde la maladie d’Alzheimer : une plaque amyloïde (Amyloid) en bas à gauche etune image de dégénérescence neurofibrillaire en haut à droite (NFT). D’après (37).
14 Clinique :
L’histoire naturelle de la maladie d’Alzheimer se décompose en trois grandes phases.
- Une phase silencieuse préclinique au cours de laquelle les lésions cérébrales vont apparaitre progressivement pendant une voire plusieurs dizaines d’années, sans plainte mnésique particulière de la part du patient(25–27).
- Au fur et à mesure de la propagation de ces lésions dans le cerveau, vont apparaître les premiers signes cliniques, c’est la phase prodromale, caractérisée par un trouble cognitif léger ou mild cognitive impairment(MCI), défini comme une atteinte d’au moins une des fonctions cognitives sans retentissement sur les activités quotidiennes, repérée par le patient lui-même ou par son entourage (28).
- Enfin, l’étendue des lésions va conduire à la démence. C’est à ce stade tardif d’évolution de la maladie que la plupart des diagnostics sont posés. En effet, les signes cliniques et neuropsychologiques antérieurs à laphase de démence peuvent être confondus avec le vieillissement normal du cerveau.
La forme typique de la maladie d’Alzheimer se présente par une amnésie hippocampique (atteinte de la mémoire épisodique avec un rappel déficient non normalisé par l’indiçage). Il existe des formes atypiques comprenant l’aphasie logopénique (atteinte langagière au premier plan), l’Atrophie Corticale Postérieure (ACP) (atteinte praxique) et la variante frontale de la maladie d’Alzheimer (atteinte exécutive).
Anomalies radiologiques et métaboliques -Anomalies morphologiques :
On met en évidence une atrophie des parties médiales des lobes temporaux (hippocampes, gyrus para-hippocampal et gyrus fusiforme), des lobes pariétaux (précunéus et jonction temporo-pariétale). L’atteinte est le plus fréquemment symétrique (29–31).
15 La progression topographique suit un schéma spécifique dans les cas typiques, qui commence dans la zone entorhinale, se propage à travers l'hippocampe, puis vers le néocortex temporal, les zones néocorticales temporo-pariétales associatives et enfin une implication majeure dans l'isocortex.
L'atrophie des régions temporales médiales (cortex entorhinal et hippocampe) est observée dans la maladie d'Alzheimer précoce. (32)
Une méta analyse, évaluant la performance diagnostique de l’IRM pour la MA parmi 26 études de la littérature (comparant des groupes MA versus sujets sains ou versus autres démences) retrouve une sensibilité de 83% (IC95: 79-87%) et une spécificité de 85% (IC95: 80-89%)(33) -Anomalies métaboliques :
La tomographie par émission de positons au Fluorodésoxyglucose (TEP-FDG) met en évidence une réduction du métabolisme dans les aires associatives néocorticales (cortex cingulaire postérieur, cortex temporo-pariétal et frontal multimodal) alors que les régions visuelles et sensorimotrices, les ganglions de la base et le cervelet sont relativement préservés.(34,35). Une méta analyse, évaluant la performance diagnostique de la TEP-FDG pour la MA parmi 27 études (comparant des groupes MA versus sujets sains ou versus autres démences) retrouve une sensibilité autour de 92 et 93% et des valeurs de spécificité allant de 89% (groupe MA versus sujets sains) à 70% (groupe MA versus autres maladies neurodégénératives)(11,33,36).
Marqueurs biologiques :
Trois marqueurs biologiques dans le LCR ont été identifiés comme aidant au diagnostic de Maladie d'Alzheimer. Ils sont en relation avec les lésions cérébrales caractéristiques de la maladie d’Alzheimer (37).La diminution de la concentration en peptide béta amyloïde de 42 acides aminés (AA) (Aβ1-42) associée à l’augmentation des concentrations de la protéine Tau totale (Tau) et de la protéine Tau phosphorylée 181P (P-Tau) sont caractéristiques d’un profil
16 biochimique de maladie d’Alzheimer.La sensibilité et la spécificité de ces marqueurs pour le diagnostic de la MA se situent respectivement entre 80 et 90 % et entre 90 et 95 % (38). La positivité des biomarqueurs est définie par un rapport P-Tau/Aβ1-42 > 0.11 (39,40).
Critères diagnostiques :
Il existe deux critères diagnostiques :lescritères IGW 2 (International Working Group 2) et les critères NIA-AA (National Institut on Aging-Alzheimer’s Assiociation) s’appuyant sur la cli-nique et la paraclicli-nique (imagerie et marqueurs biologiques) etpermettant un diagnostic de ma-ladie d’Alzheimer, même à un stade précocedit prodromal(6,7,28).Les marqueurs physiopatho-logiques signent la présence des lésions de la maladie ; il s’agit des biomarqueurs du LCR (Abeta et Tau) et de la TEP amyloïde. L’atrophie en IRM et l’hypométabolisme en TEP-FDG sont des marqueurs de dégénérescence ; ils témoignent de la sévérité et de la progression de la maladie mais n’en sont pas spécifiques. (Tableau 1)
17 Tableau 1. Critères de MA incorporant les biomarqueurs (41)
18 3. LES DEGENERESCENCES LOBAIRES FRONTO-TEMPORALES
C’est la troisième forme de démence dégénérative après la maladie d’Alzheimer et la démence à corps de Lewy (elle serait responsable de 10 à 15 % des démences)(42).
Les DLFT apparaissent habituellement lors de la cinquième décade, plus précoces que le début habituel d’une maladie d’Alzheimer (43). Elles touchent un peu plus souvent les hommes que les femmes (autre différence notable avec la maladie d’Alzheimer). Les DLFT comprennent les DLFT-bv (forme comportementale des DLFT), et les APP de type sémantique ou non fluente. Dans la majorité des cas, la DLFT est sporadique, mais 30 à 50% des cas sont des formes génétiques à transmission autosomique dominante avec 3 mutations principales (gènes C9ORF72, GRN, MAPT). Le dosage plasmatique de la progranuline est utile pour détecter la mutation GRN (44).
Anomalies histologiques :
Il existe une grande hétérogénéité des lésions neuropathologiques des DLFT en fonction de leur type de marquage (Tau, Ubiquitine, TDP-43, FUS (fused in sarcoma))(45).
Clinique :
Au début, la DLFT se manifeste essentiellement par des troubles du comportement:
- Des troubles du contrôle de soi, hyperoralité, conduites alcooliques, désinhibition verbale, désinhibition comportementale, irritabilité, colères, troubles du contrôle des émotions avec rires ou pleurs inappropriés, instabilité motrice ;
- Une incurie physique avec abolition de l’hygiène corporelle et des soins vestimentaires ; - Des troubles de l’humeur, en particulier l’indifférence affective ;
19 L’aggravation se fait sur un mode progressif : la réduction d’activité s’accentue, les stéréotypies diminuent, la perte de l’incitation verbale aboutit au mutisme. Le patient devient amimique, hypertonique et totalement apragmatique avec incontinence urinaire et fécale. La durée d’évolution est en moyenne de huit ans.
Anomalies radiologiques et métaboliques : -Anomalies morphologiques :
A l’imagerie morphologique, on met en évidence une atrophie lobaire, frontale et temporale antérieure bilatérale(mais pouvant être plus ou moins asymétrique) qui se majore progressivement en cours d’évolution (33,46,47). Néanmoins, l’imagerie morphologique peut être normale au stade initial.
-Anomalies métaboliques :
On visualise plus précocement à la TEP une hypoperfusion des lobes frontaux et des pôles temporaux(33,46) L’atteinte est le plus souvent bilatérale, mais elle peut être asymétrique, voire même unilatérale dans certaines formes débutantes.
20 Figure 2. Critères diagnostiques de la variante comportementale de démence frontotemporale (4).
22 4. LES APHASIES PROGRESSIVES PRIMAIRES
L’APP est caractérisée par des troubles du langage isolés ou largement prédominant d’évolution insidieuse (48).
Cette atteinte se traduit par des difficultés à s’exprimer ou à comprendre les propos d’autrui. Au cours de la maladie les troubles peuvent s’étendre à d’autres domaines cognitifs.
La classification de référence proposée par Gorno-Tempini et al. en 2011 (5) distingue et définit trois variantes : l’APP sémantique (sv-PPA), l’APP non fluente (nf- PPA) et l’aphasie logopénique.
A. APP sémantique (sv-PPA) Clinique :
Elle se caractérise par une perte progressive des connaissances des mots et des objets, avec préservation de la fluence verbale et de la grammaire (49). Le discours est fluide et le débit de parole normal, voire logorrhéique. Il existe un manque du mot dans le discours spontané ou en dénomination et des paraphasies sémantiques. La prosodie est normale.
Anomalies radiologiques et métaboliques : -Anomalies morphologiques :
La sv-PPA est associée à une atrophie bilatérale de la portion antérieure des lobes temporaux avec souvent une extension à l’insula, au noyau caudé et à la région inféro-médiale. Il existe souvent une atteinte asymétrique prédominant à gauche (50–52).
-Anomalies métaboliques :
La TEP-FDG montre un hypométabolisme des régions temporales antérieures. Cet hypométabolisme est plus étendu que la zone d’atrophie (53).
23 Anomalies histologiques :
Dans la sv-PPA, le diagnostic pathologique le plus fréquent est la Dégénérescence Lobaire Fronto-Temporale (DLFT). La DLFT avec des inclusions de protéine TDP43 est le profil pathologique le plus représenté, jusqu’à 68% des cas dans les séries autopsiques.
Dans les autres cas de sv-PPA, on peut trouver des lésions de type DLFT-tau ou des lésions de la maladie d’Alzheimer.
B. L’aphasie non fluente (nf-PPA) Clinique
Elle est caractérisée par un débit ralenti, haché, souvent dysprosodique et laborieux contenant de nombreuses paraphasies phonémiques. Des troubles articulatoires sont en rapport avec une apraxie de la parole et il existe une diminution des capacités syntaxiques. La compréhension des mots est préservée (42,54).
Anomalies radiologiques et métaboliques : -Anomalies morphologiques :
On met en évidence une atrophie frontale gauche incluant l’aire de Broca et s’étendant aux régions voisines de l’hémisphère gauche (gyrus pré central inférieur, gyrus frontal moyen, l’insula et le noyau caudé) (50,52).
-Anomalies métaboliques :
On observe en TEP-FDG, un hypométabolisme prédominant dans la région fronto-operculaire gauche et insulaire antérieure gauche pouvant s’étendre en péri sylvien (50,52).
Anomalies histologiques :
Dans la nf-PPA, le diagnostic le plus fréquent est la DLFT avec des inclusions de protéine tau (55). Les autres types pathologiques rencontrés sont la DLFT-TDP43, les lésions de la MA ou les corps de Lewy (45,56–58).
24 C. L’Aphasie logopénique :
Clinique :
Elle est caractérisée par des difficultés à trouver des mots et des pauses multiples lors du discours spontané (phénomène du mot sur le bout de la langue) (59). L’élocution est grammaticalement correcte. Il existe un déficit de la répétition des phrases par atteinte de la mémoire de travail, et parfois des paraphasies phonologiques (60).
Anomalies radiologiques et métaboliques : -Anomalies morphologiques :
L’atrophie prédomine au niveau de la jonction pariéto-temporale gauche. -Anomalies métaboliques :
On retrouve un hypo métabolisme asymétrique temporo-pariétal gauche, étendu au précunéus et parfois à la partie postérieure du gyrus frontal inférieur.
Anomalies histologiques :
Dans l’aphasie logopénique, les lésions de la MA sont le diagnostic pathologique le plus fréquemment retrouvé (56). Les autres types de pathologies sont la DLFT-TDP43 ou DLFT-tau (56,57,61).
25 5. LES DEMENCES VASCULAIRES
Clinique :
Elles sont définies par les syndromes d’altération cognitive et comportementale secondaires aux maladies vasculaires affectant le cerveau. Les DV pures semblent relativement rares (moins de 8 % des démences) se plaçant ainsi au quatrième rang des démences, après la maladie d’Alzheimer, la démence à corps de Lewy et les démences frontotemporales (62).
Le terme de démence vasculaire recouvre un cadre hétérogène (démences par infarctus corticaux multiples, démences lacunaires, CADASIL (artériopathie cérébrale autosomique dominante avec infarctus sous-corticaux et leucoencéphalopathie...), ce qui explique l’absence de consensus sur un outil diagnostique unique et des critères peu spécifiques (DSM V, NINDS-AIREN, ADDTC) (63). (Figure 3)
26 Figure 3. Critères résumés de démence vasculaire probable ou possible, NINDS-AIREN
27 Anomalies radiologiques et métaboliques :
-Anomalies morphologiques :
Il existe plusieurs patterns en IRM permettant d’orienter vers le diagnostic d’atteinte vasculaire : microsaignements profonds, infarctus superficiels ou profonds, leucopathie vasculaire (stade II ou III de la classification de Fazekas et Schmidt) (64).
-Anomalies métaboliques :
On observe des hypométabolismes focaux corticaux et sous corticaux touchant le cortex frontal moyen, le cortex temporopariétal, les noyaux gris centraux, le cervelet et le tronc cérébral. L’hypométabolisme est plus marqué dans le aires sous corticales et le cortex sensitivomoteur comparativement à la maladie d‘Alzheimer. Les aires associatives sont moins touchées (65). La TEP-FDG montre un hypométabolisme lié à la perte neuronale mais aussi liés aux effets fonctionnels à distance en rapport avec une désafférentation corticale(63).
II. LA NEUROIMAGERIE 1. L’IRM
L'IRM est une technique permettant d'obtenir des vues en deux ou en trois dimensions de l'intérieur du corps.
Elle repose sur le principe de la résonance magnétique nucléaire (RMN), consistant à étudier les modifications d'aimantation des noyaux d'une substance sous l'action conjointe de deux champs magnétiques: un champ magnétique statique fixe élevé (B0) et un champ électroma-gnétique tournant (B1) (onde de radiofréquence).
Le noyau d'hydrogène (principal composant du corps humain) est constitué d'une particule char-gée positivement, le proton, qui en tournant autour de lui- même induit un moment magnétique élémentaire microscopique. Lorsque les protons sont placés dans un champ magnétique externe
28 B0, ils vont avoir tendance à s'orienter dans la direction de ce dernier.
Contrairement aux aimants qui s'alignent parfaitement dans un champ magnétique externe,les protons vont se distribuer en deux populations tournant autour de B0 avec un certain angle (précession) : l'une orientée dans le sens de B0 (parallèle) et l'autre dans le sens contraire à B0 (antiparallèle). Lorsqu'un échantillon tissulaire est soumis à un champ magnétique B0, un état d'équilibre apparaît avec une composante longitudinale Mz0 de l'aimantation tissulaire. Un ap-port d'énergie (excitation) par une impulsion RF de 90°entraîne une disparition de la compo-sante longitudinale Mz et une apparition d'une compocompo-sante transversale Mxy de l'aimanta-tion.Cet état est instable et, dès la fin de l'excitation, il va y avoir retour à l'état d'équilibre (stable) au cours duquel les phénomènes inverses vont avoir lieu. D'une part, l'aimantation lon-gitudinale Mz repousse progressivement : phénomène de relaxation T1. D'autre part, lors du déphasage rapide des spins, l'aimantation transversale Mxy décroît rapidement : phénomène de relaxation T2. (Figure 4)
29 Le temps de relaxation T1 correspondant à la repousse de l'aimantation longitudinale se fait selon une exponentielle croissante où la constante de temps T1 (exprimée en millisecondes) est caractéristique d'un tissu donné: elle correspond à 63 % de repousse. L'ordre de grandeur pour le T1 des tissus biologiques est de 500ms à 1 000 ms. Le T1 varie avec la structure moléculaire ainsi que l'état solide ou liquide de la matière. Il est plus long dans les liquides par rap- port aux solides ; il est court dans les tissus graisseux.
Le temps de relaxation T2 correspond à la décroissance rapide et à la disparition de l'aimanta-tion transversale selon une exponentielle décroissante où la constante de temps T2 (exprimée en millisecondes) est caractéristique d'un tissu donné. Elle correspond à 63 % de décroissance (en d'autres termes, il persiste 37 % de l'aimantation transversale Mxy). L'ordre de grandeur pour le T2 des tissus biologiques est d'environ 50 ms a` 100 ms (beaucoup plus court – environ dix fois – que le T1). Le T2 varie avec la structure moléculaire ainsi qu'avec l'état solide ou liquide de la matière. Le signal de la décroissance de l'aimantation transversale Mxy est recueilli par une bobine ou antenne de réception qui le transforme en signal électrique mesurable.
30 L’obtention d’un signal mesurable repose sur une impulsion RF de 90°pour basculer l'aimanta-tion dans le plan transversal et une impulsion RF de 180°. Cette dernièrepermet de s'affranchir des déphasages constants induits par B0. L'impulsion RF de 180°est appliquée au temps TE/2. Au temps t 1⁄4 TE (2 TE/2), les spins sont de nouveau en phase (alignés) : MT est de nouveau maximal, induisant un signal dit d'écho de spin que l'on mesure. (TE= temps de mesure). (Figure 5 et 6
Figure 5. Illustration du phénomène de l’écho de spin avec quatre spins (66)
t=0, les quatre spins sont en phase, le vecteur Mt est maximal (Mtm). (b) Les spins se déphasent à cause des inhomogénéités de champ d’origine « moléculaire »(relaxation spin-spin irréver-sible) et à cause des inhomogénéités propre de B0 ; les spins les plus rapides (3 et 4)sont en avant et les plus lents (1 et 2) en arrière ;ils s’écartent en éventail et le vecteur Mt (résultant) diminue ainsi en T2*. (c) t=TE/2, une impulsion RF de 180° est appliquée, elle inverse les déphasages (image en miroir) sans modifier le sens de rotation. Les spins 3 et 4 qui précessaient le plus rapidement vont se retrouver à présent derrière les plus lents (1 et 2). (d) t=TE (2TE/2), les spins sont de nouveau en phase : Mt est de nouveau maximal, induisant un signal dit d’écho
31 de spin que l’on mesure.
Figure 6. Chronologie des événements au cours du phénomène de l’écho de spin(66)
-t=0, application de l’impulsion de 90° qui bascule Mlo dans le plan transversal. Les (4) spins sont en phase et l’aimantation transversale est maximale : Mtm. -t=TE/2, application de l’im-pulsion de 180°. Les spins se rephasent. -t=TE, les spins sont rephasés : le signal réapparait sous forme d’écho et il peut être mesuré.
Ce cycle élémentaire ne permet d'obtenir qu'une ligne de la matrice image; pour obtenir les lignes suivantes (un cycle complet « image » correspond à 128 ou 256 lignes), il va falloir répéter, pour chaque ligne, le cycle d'impulsions ou train d'onde RF de 90et 180. On appelle TR (Temps de Répétition) le temps auquel on doit répéter le cycle élémentaire d'impulsions RF de 90et 180pour réaliser la « deuxième ligne de la matrice image », et ainsi de suite : à chaque TR, les lignes de la matrice sont successivement réalisées une par une.(Figure 7)
32 Les paramètres TE et TR accessibles à l'opérateur vont tous deux moduler le signal : le TE détermine le moment où le signal est mesuré (sur la courbe de décroissance en T2); le TR dé-termine le niveau de repousse de l'aimantation longitudinale et donc du signal disponible. Cha-cun de ces deux paramètres va contrôler le contraste en T1 et T2. Le TR conditionne la pondé-ration en T1 d'une séquence (plus on raccourcit le TR, plus la séquence est pondérée en T1). Le TE conditionne la pondération en T2 (plus on allonge le TE, plus la séquence est pondérée en T2).
A partir de ces bases, de nombreuses séquences ont été créées pour caractériser au mieux les tissus.Pour réaliser des images en résonance magnétique, il est indispensable de pouvoir loca-liser précisément le signal de résonance magnétique nucléaire (RMN). La localisation spatiale du signal de l'image fait appel à l'utilisation d'un outil physique : les gradients de champs ma-gnétiques et à un outil mathématique : la transformée de Fourier. La technique de formation de
33 l'image en IRM se singularise par rapport aux autres techniques d'imagerie, en particulier de la tomodensitométrie. La méthode actuelle d'exploration (technique bidimensionnelle) sélec-tionne d'abord des plans de coupe successifs. Al'intérieur des plans de coupe, la reconstruction de l'image fait appel à une double transformée de Fourier (appelée méthode par 2DFT). Le codage spatial du signal est obtenu par codage de la phase dans une direction du plan et de la fréquence dans l'autre direction(66).
2. LA TEP-FDG A. Principe de la TEP-FDG
La TEP-FDG est une méthode d'imagerie médicale diagnostique qui permet la détection in vivo de la distribution spatiale et temporelle d’un radio pharmaceutique à l’échelle du corps entier, grâce aux émissions de positons.
Il s’agit d’injecter un traceur dont on connaît le comportement et les propriétés biologiques pour obtenir une image du fonctionnement d'un organe ou la présence d'une cible moléculaire. Ce traceur est marqué par un atome radioactif (ici le Fluor) qui émet des positons dont l'annihilation (rencontre avec un électron) produit deux photons.
Le Fluor radioactif, est un atome trop chargé en protons, il va donc subir une désintégration de type Beta+ (transformation d’un proton en neutron avec émission d’un photon). L’interaction du photon avec un électron (réarrangement de la matière), entraine une annihilation : leur masse respective disparait elles sont converties en énergie sous forme de rayonnement gamma (deux rayons gamma émis dans deux direction diamétralement opposées). L’objectif de la TEP est alors de détecter ce rayonnement gamma.
C'est la détection en coïncidence de ces photons qui permet la localisation du lieu de leur émission et donc la concentration du traceur en chaque point de l'organe. C'est cette information
34 quantitative que l'on représente sous la forme d'une image faisant apparaître en couleurs les zones de forte concentration du traceur.
La détection des rayonnements gamma est réalisée grâce à une couronne de caméras autour du patient, comprenant de multiples couples cristal/ tube photomultiplicateur.Les cristaux scintillants absorbent l’énergie du rayonnement gamma et émettent des photons lumineux basse énergie. Les tubes photomultiplicateurs détectent ces photons qui interagissent avec des électrons de la photocathode du tube qui amplifie ces électrons. On enregistre à la fin un courant électrique.
35 Figure 8. Détection des photons gamma par couplage : cristal/tube photomultiplicateur (DES Radiodiagnostic » Modules de base » Imagerie fonctionnelle - Imagerie hybride – 2016)
Ainsi, la TEP permet de visualiser les activités du métabolisme des cellules : on parle d'imagerie fonctionnelle par opposition aux techniques d'imagerie morphologiques comme l’IRM. Il s’agit d’un outil diagnostic permettant de déceler certaines pathologies qui se traduisent par une altération de la physiologie normale comme les cancers, mais aussi les démences par exemple.
B. Le Fluorodésoxyglucose marqué au fluor 18 (18F-FDG)
- Le 18F-FDG est un sucre semblable au glucose, rendu radioactif. C’est la radioactivité de cet
atome de fluor qui permet sa détection par la caméra TEP. Plus le métabolisme des cellules est important, plus leur consommation de glucose augmente.
Le 18F-FDG se comporte comme le glucose, mais contrairement à celui-ci, il n’est pas une
source d’énergie utilisable par la cellule. La molécule de 18F-FDG est phosphorylée par la
cellule après son entrée ce qui l'empêche de ressortir de la cellule. Ensuite le FDG phosphorylé s'accumule dans le cytoplasme de la cellule car il n'est pas reconnu par les enzymes du cycle de
36 dégradation du glucose normal. En devenant ainsi radioactive, la cellule émet des rayonnements qui peuvent être détectés par la caméra TEP. Les tissus hyper ou hypo métaboliques sont ainsi repérés grâce à l’accumulation ou la non accumulation du produit radioactif sous la forme d’une image d’hyperfixation ou d’hypofixation.
Dans le cadre des maladies neurodégénératives, la TEP permet une mesure de la consommation régionale de glucose qui est un reflet du métabolisme neuronal. Les régions cérébrales atrophiques consomment moins de glucose : on observera des réductions du métabolisme glucidique au niveau de régions spécifiques selon les pathologies en cause.
Toutes les informations recueillies par la caméra TEP reposent sur la radioactivité repérée dans les tissus après l'injection du 18F-FDG au patient. Le système informatique relié à la caméra
TEP produit des images en coupe et en trois dimensions des endroits du corps où le 18F-FDG
s'est accumulé.
3. LA TEP-IRM
A. Principes
L’imagerie hybride tomographie par émission de positons / imagerie par résonance magnétique (TEP- IRM) est une nouvelle modalité d'imagerie qui est devenue disponible récemment dans la pratique clinique.
Il s’agit d’une approche simultanée, c’est-à-dire, l’existence d’une caméra TEP IRM de GE (General Electric) capable de combiner une caméra TEP temps de vol et IRM 3T de manière simultanéeavecune fusion TEP-IRM immédiate.
37 Figure 9. TEP-IRM (DES Radiologie Imagerie fonctionnelle et hybride – 6/12/2016)
Un système TEP IRM simultanée est un anneau TEP nouvelle génération inséré dans une IRM peu ou pas modifiée.
La caméra TEP-IRM, grâce notamment à la technique de temps de vol, est plus sensible et a une meilleure résolution spatiale. La notion de temps de vol signifie simplement que, pour chaque événement d'annihilation, nous notons le moment précis où chaque photon est détecté et on calcule la différence. Étant donné que le photon le plus proche arrivera d'abord à son détecteur, la différence de temps d'arrivée aide à définir l'emplacement de l'événement
d'anni-38 hilation le long de la ligne entre les deux détecteurs.Cette technique de temps de vol, par ail-leurs, permet d’avoir des acquisitions plus courtes et d’injecter une moins grande quantité de radio pharmaceutique.
La TEP-IRM permet d’avoir une étude multiparamétrique optimale, avec des informations ana-tomiques, fonctionnelles et moléculaires en un seul examen ; deux examens diagnostics en une seule session ; une amélioration du confort du patient, de la quantification des images et de la visualisation des structures cérébrales de petites tailles.
B. Difficultés techniques posées par rapport à la TEP et l’IRM seules
Les technologies traditionnellement utilisées dans les détecteurs TEP n’étant pas compatibles avec le champ magnétique de l’IRM, une série de défis technologiques a dû être résolue pour mettre au point les systèmes TEP-IRM. Les évolutions techniques entre TEP-IRM et TEP ou IRM seules, portent essentiellement sur la TEP.
En effet, il a fallu modifier les caméras TEP pour pouvoir les rendre compatibles au champ magnétique de l’IRM, en raison du champ magnétique empêchant le fonctionnement des tubes photomultiplicateurs.
Les tubes photomultiplicateurs ont donc, été remplacés par des photodiodes (tubes à composerélectronique). Ces détecteurs ne sont pas sensibles au champ électromagnétique et ils ont une résolution de temps suffisamment rapide pour générer des informations TOF (Time Of Flight). Ils présentent l’avantage d’être plus compact mais sont très sensibles à la température. Un défi technique dans l'imagerie hybride TEP-IRM est la correction d’atténuation des images d'émission de la TEP basées sur l’IRM (correction d’atténuation des rayons gamma par les tissus biologiques), nécessaire pour une mesure quantitative précise de la concentration de l'activité du traceur.
39 Les principaux facteurs dégradant l’image TEP sont l’atténuation et la diffusion des photons à l’intérieur du champ de vue. Pour détecter une paire de photons en coïncidence, aucun des deux photons ne doit avoir subi d’atténuation, alors que la fraction atténuée des paires de gamma émises à partir du centre du corps d’un patient peut être supérieure à 90 %. Ainsi, la reconstruc-tion d’images quantitatives en TEP nécessite une correcreconstruc-tion précise de l’atténuareconstruc-tion. Grâce au scanner couplé des machines TEP/TDM, la génération d’une carte de coefficients d’atténuation pour des photons de 511 keV peut être obtenue rapidement, et permettre de corriger de l’atté-nuation les images d’émission.
En TEP-IRM, la correction d’atténuation des photons se heurte à plusieurs problèmes :
Les valeurs d’intensité de l’image IRM reflètent la densité des protons et les propriétés
de relaxation tissulaire, sans relation directe entre le signal mesuré en IRM et le coeffi-cient d’atténuation linéaire à 511 keV. Les méthodes de correction d’atténuation en TEP-IRM sont donc basées sur la segmentation des tissus en classes auxquelles sont attribués des coefficients d’atténuation prédéfinis pour chaque classe.
Les séquences d’IRM standard donnent un signal très faible dans les os (qui est le tissu
le plus atténuant dans l’organisme) et le poumon en raison de la faible densité de protons et du T2 très court de ces tissus. Par conséquent, ces différents tissus ne peuvent pas être différenciés sur la base du signal IRM à partir de séquences standard, alors que leurs coefficients d’atténuation gamma respectifs sont très différents.
Du matériel additionnel tel que les antennes de radiofréquence et les câbles sont présents dans le champ de vue du TEP et sont sources d’atténuation.
La correction d’atténuation en TEP-IRM est aujourd’hui le plus souvent réalisée grâce à des méthodes de segmentation à partir de séquences Dixon, qui donnent des images en pondération
40 eau et graisse(67). La segmentation permet de délimiter les tissus sans signal (air, tube digestif et poumon), et leur attribuer une valeur de coefficient d’atténuation. Ces méthodes n’intègrent cependant pas l’atténuation par l’os. Des méthodes basées sur des atlas, issues de bases de don-nées comparatives TDM/IRM, peuvent être utilisées au niveau cérébral, pour améliorer la pré-cision de la correction d’atténuation en prenant en compte l’os du crâne(68). Des travaux sont en cours pour intégrer l’atténuation par l’os dans les méthodes de correction grâce notamment aux séquences à temps d’écho ultra court (séquences UTE et ZTE).
En octobre 2015, la première TEP-IRM clinique de France a été installée à la Pitié Salpêtrière. L’achat de l’appareil a été financé par la Fondation pour la Recherche sur Alzheimer (FRA) et part des grands donateurs privés. L’activité TEP-IRM est mixte avec 50% de créneaux cliniques et 50% de créneaux recherche. L’activité TEP-IRM clinique fait l’objet d’une mission d’évaluation par l’ARS. En 2016, 1110 examens TEP-IRM cliniques ont été réalisés, dont 900 en neurologie.
L’objectif de cette étude était d’évaluer la performance diagnostique de la TEP-IRM clinique pour le diagnostic de maladie d’Alzheimer, selon les critères diagnostiques les plus récents intégrant la positivité des biomarqueurs du LCR.
41
Partie 2 : Matériels et Méthodes
I. Patients :
Nous avons inclus, dans cette étude rétrospective, tous les patients hospitalisés entre janvier et juin 2016 et ayant passé une TEP-IRM dans le cadre de l’exploration de troubles cognitifs, pour lequel on disposait derésultats debiomarqueurs du LCR, et d’un compte-rendu d’hospitalisation avec une conclusion diagnostique.
II. Informations Cliniques :
A partir des comptes rendus d’hospitalisation nous avons collectés les données cliniques sui-vantes des patients: le sexe, l’âge, les facteurs de risques cardiovasculaires(46,68), la durée d’évolution des troubles, le Mini Mental State Examination (MMSE) (69). Pour catégoriser les 48 patients, nous avons pris le diagnostic final mentionné dans le compte rendu d’hospitalisa-tion. Ce dernier s’appuyait sur les données cliniques, l’imagerie et les biomarqueurs du LCR. Les 34 patients ayant pour diagnostic final une maladie d’Alzheimer avaient tous des biomar-queurs dans le LCR positifs.
III. Biomarqueurs du LCR :
Le LCR était obtenu après ponction lombaire de 10mL de LCR collecté dans des tubes de polypropylène. Les échantillons étaient centrifugés et stockés à -80°C dans l’heure suivant la ponction.
La quantité des biomarqueurs Tau, P-Tau et Aβ42 était mesurée par méthode ELISA (Innoge-netics) selon les instructions du fabricant. La positivité des biomarqueurs était définie par un rapport P-Tau/Aβ1-42 > 0.11 (39,40).
42 IV. Protocole d’acquisition TEP-IRM
Pour tous les patients, on disposait d’une imagerie TEP-IRM réalisée sur une machine TEP/IRM SIGNA (GE Healthcare) qui combine une technologie TEP temps de vol avec des photomultiplicateurs au silicium, et une IRM 3T.
Après l’injection de 2MBq/kg de 18-Fluorodésoxyglucose (18-FDG), chaque patient restait dans le noir, au calme, pendant 20 minutes, en maintenant une température corporelle normale, avant que l’acquisition TEP-IRM soit réalisée.
Le protocole IRM comprenait des acquisitions 3DT1(TR/TE= 7,3/3,1ms; résolution spatiale 1x1x1mm); 3DFLAIR (TR/TE=10500/138ms ;résolution spatiale 1x1x1,6mm) ; 3DSWAN (TR/TE :56,9ms/23,1-53,4ms ;résolution spatiale 0,6x0,6x3,2mm), et axiales diffusion (TR/TE :9863ms/74,8ms ;résolution spatiale 1,9x1,5x3mm).
L’acquisition TEP-FDG (2 MBq/kg) centrée sur le cerveau a été réalisée simultanément aux séquences IRM avec un pas de lit de 16 minutes (champ de vue axial de 24,4 cm). Les reconstructions étaient réalisées avec l’algorithme Point Vue FX (8 itérations, 28 sous-ensembles, fréquence de coupure 3 mm). La correction de l’atténuation était basée sur un atlas TDM.
V. Analyse des images :
Nous avons comparé successivement 3 sessions de lectures successives.
La première lecture était une lecture IRM morphologique seule réalisée par deux neuroradiologues (S.B.&A.B.). La deuxième lecture était une lecture métabolique du TEP-FDG réalisée par deux médecins nucléaires (S.-R.T.&M.-O.H.). La troisième lecture incluait les deux modalités d’imagerie et était réalisée par un neuroradiologues et un nucléariste (A.B.&M.-O.H.).
43 Les lecteurs ont effectué toutes les lectures en aveugle du diagnostic clinique ; la seule infor-mation clinique disponible était l’âge du patient. Pour chaque session de lecture, chaque lecteur donnait indépendamment le diagnostic le plus probable parmi ceux-ci : Maladie d’Alzheimer (MA) ; Dégénérescence Lobaire Fronto-Temporale à variant comportemental (DLFT-bv) ; Aphasie Progressive Primaire Non Fluente (nf-PPA) ou sémantique (sv-PPA) ; Maladie Vas-culaire isolée (MV), normal et inclassable. Pour chaque patient, les lecteurs devaient choisir un seul diagnostic et devaient mettre un niveau subjectif de confiance diagnostique (1 : possible ; 2 : probable). Toutes les lectures ont été réalisées sur le PACS (Carestream, Rochester, NY). Sur les séquences FLAIR d’IRM, la présence d’hypersignaux FLAIR de la substance blanche était estimée selon le score de Fazekas et Schmidt à 3 grades (0 : absence d’anomalie de signal ; 1 : multiples hypersignaux FLAIR aspécifiques ; 2 : multiples hypersignaux FLAIR de la subs-tance blanche péri ventriculaire et sous corticale peu confluents ; 3 : plages en hypersignal FLAIR confluentes)(70). (Figure 10)
44 VI. Volumétrie automatique des hippocampes
Nous avons utilisé le logiciel NeuroQuant (San Diego, CA) pour évaluer quantitativement la moyenne normalisée du volume hippocampique (15).Le logicielNeuroQuantest un logiciel commercial (norme CE et FDA) qui effectue une segmentationautomatique des différentes structures du cerveau,et notamment des hippocampes. Neuroquant utilise des méthodes de seg-mentation similaires à celles du logiciel Freesurfer, maisà la différence de Freesurfer, il repose sur l’utilisation d’un atlas anatomique probabilistique, permettant de mieux prendre en compte les variations anatomiques inter-individuelles, notamment chez les patients âgés ; de plus, il
45 intègre des méthodes de correction d’intensité et d’artefact spécifiques à chaque type de ma-chine IRM.Les volumes hippocampiques étaient exprimés à la fois sous forme non ajustée et ajustée en pourcentage au volume intracrânien total(71,72).
VII. Analyses statistiques
Les analyses statistiques ont été effectuées en utilisant le logiciel GraphPad Prism 7.0 (San Diego, CA). Les volumes hippocampiques ont été comparé entre les groupes MA et non-MA en utilisant le test de Mann-Whitney. Les concordances inter observateurs ont été établies par le test du kappa pondéré de Cohen. La sensibilité, la spécificité et la Balanced Accuracy (moyenne de la sensibilité et de la spécificité) ont été calculées pour chaque session de lecture et pour chaque groupe diagnostique.
46
Partie 3 : Résultats
I. Caractéristiques de la population
Les caractéristiques des patients sont détaillées dans le tableau 2.
La majorité des patients avaient un diagnostic de MA (n=34 ; 70.8%). Au sein de ce groupe de patients atteints d’une MA, il y avait 23 présentations cliniques mnésiques, 10 langa-gières et 1 frontale. Parmi les 14 autres patients, il y avait 5 sv-PPA (10.4%), 3 DLFT-bv (6.3%), 3 considérés comme ayant des troubles fonctionnels (6.3%), 2 nf-PPA(4.2%), et 1 maladie vasculaire (2.1%).Les biomarqueurs étaient toujours positifs dans le groupe MA et toujours négatifs dans le groupe non MA, par définition.Une atteinte vasculaire (grade de Fazekas et Schmidtsupérieur ou égal à 2) était constatée chez 14 patients et 1 patient avait une séquelle d’AVC.
47
Tableau 2.Caractéristiques des patients
Ensemble des pa-tients
Patients MA Patients non MA
Nombre 48 34 14 Age (Moyenne, SD) 65,0 (9,0) 66.0 (9.0) 63.0(9.0) Sexe (F/H) 27/21 19/15 8/6 Durée d’évolution (moyenne, SD) 4,0 (3,0) 4.0 (3.0) 4.0(1.0) MMSE (Moyenne, SD) 20 (7) 19 (7) 22 (5) FdRCV (Médiane, nombre de patient dans chaque catégorie 0-3) 1 0 : 2 patients 1 : 23 patients 2 : 16 patients 3 : 5 patients NC : 2 patients 1 1 : 17 patients 2 : 12 patients 3 : 3 patients NC : 2 patients 1 0 : 2 patients 1 : 6 patients 2 : 4 patients 3 : 2patients Grade de leu-coaraiose (Fazekas et Schmidt) (Médiane, nombre de patients dans chaque catégorie 0-3 ) 1 0: 8 patients 1: 26 patients 2:12 patients 3:2 patients 1 0: 5 patients 1: 19 patients 2:9 patients 3:1 patient 1 0: 3 patients 1: 7 patients 2:3 patients 3:1 patient Nombre de pa-tients avec des
sé-quelles isché-miques
1 1
II. Concordance inter-observateur
La concordance observateur pour le diagnostic de MA était de k=0,432 pour les 2 lectures IRM, et de k=0,704 pour les 2 lectures TEP-FDG.
48 III. Performances diagnostiques de la TEP-IRM
A. Identification des patients MA et non MA
La lecture de la TEP-IRM a permis d’identifier les patients MA et non MA avec unemeilleure performance diagnostique en comparaison des lectures de l’IRM ou de la TEP-FDG seules La lecture de la TEP-IRM a correctement identifié 29patients MA (vrais positifs) sur 34, et a correctement identifié11 patients non MA (vrais négatifs) parmi les 14 patients ayant des biomarqueurs négatifs. La sensibilité de la lecture du TEP-IRM était supérieure à celle de la TEP-FDG ou de l’IRM seules, et sa spécificité était supérieure à celle de l’IRM seule et égale à celle de la TEP-FDG seule. (Tableau 3). La lecture de la TEP-IRM a permis, dans un plus grand nombre de cas,d’établir le bon diagnostic avec un haut niveau de confiance (33 cas en PET-IRM, contre 30 cas en TEP FDG et 20 cas en IRM).
Tableau 3. Performances diagnostiques de la TEP-IRM (MA versus non MA)
VP FN VN FP Se/Sp/BA IRM 22 12 10 4 64,7%/71,4%/68,1% NdC=2 (50,0%) 11 (58,3%) 7 (90,0%) 9 (75,0%) 3 TEP-FDG 27 7 11 3 79,4%/78,6%/79,0% NdC=2 (77,8%) 21 (71,4%) 5 (81,8%) 9 (66,7%) 2 TEP-IRM 29 5 11 3 85,3%/78,6%/82,0% NdC=2 23 (79,3%) 4 (80,0%) 10 (90,9%) 1 (33,3%)
NdC : Niveau de Confiance ; Se : sensibilité ; Sp ; spécificité ; BA : Balanced Accuracy. VP : vrais positifs ; FN : faux négatifs ; VN : vrais négatifs ; FP : faux positifs.
49 B. Erreurs diagnostiques : faux positifs
Il y avait 3 patients faux positifs ;identifiés à tort comme MAà la lecture de la TEP-IRM alors que les biomarqueurs étaient négatifs.
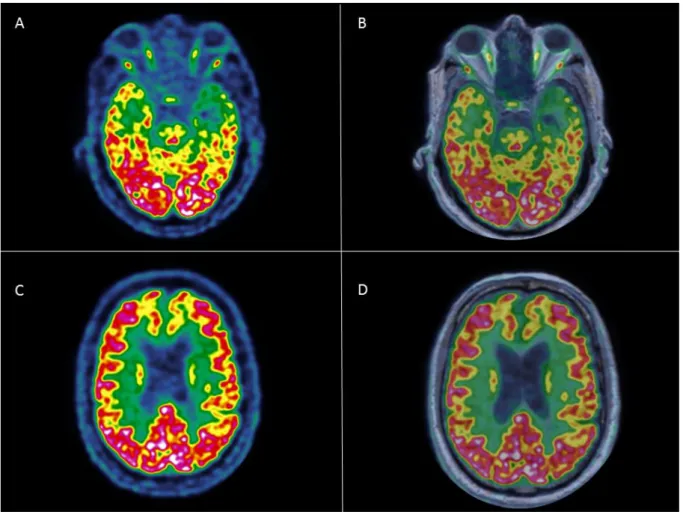
- Le premier patient avait un diagnostic clinique de maladie vasculaire isolée. Il était âgé de 57 ans, présentait une hypertension artérielle,un MMSE à 21et des troubles cognitifs évoluant depuis 3ans.La lecture de l’IRM avait conclu à une maladie vasculaire isolée en raison d’une importante leucopathie de grade 3 associée à une dilatation ventriculaire et de nombreux microsaignements superficiels et profonds,mais celle de la TEP-FDG avait concluà une maladie d’Alzheimeren raison d’un hypométabolisme modéré du cortex associatif, notamment en postérieur. La lecture consensuelle de l’imagerie TEP-IRM concluait à une maladie d’Alzheimer, associée à une atteinte vasculaire (Figure 10).
- Le deuxième patient faux positif avait un diagnostic clinique de DLFT-bv. Il était âgé de 69 ans, avait un MMSE à 18 et ses troubles évoluaient depuis 5 ans.Les lectures de l’IRM et de la TEP-FDG seules diagnostiquaientune maladie d’Alzheimer en raison d’une atrophie modérée temporale et pariétale bilatérale en IRM et d’un discret hypométabolisme du cortex associatif postérieur droit et gauche et frontal droit.Il existait aussi une leucopathie de grade 3 en IRM (Figure 11).
- Le troisième patient, âgé de 60ans, avait un diagnostic cliniquede trouble fonctionnel (trouble du langage sans substrat organique retenu) évoluant depuis 3 ans, avec un MMSE à26. L’IRM concluait à une imagerie normale et la TEP-FDG à une maladie d’Alzheimer en raison d’un hypométabolisme associatif postérieur. La lecture consensuelle retenait le diagnostic de maladie d’Alzheimer. Il n’y avait pas d’atteinte vasculaire en IRM.
50 Figure 11. Exemples de 2 patients identifiés à tort commeayant une maladie d’Alzheimer en PET IRM,et ayantune atteinte vasculaire marquée :
A (Fusion TEP-FDG et 3DT1), B (Séquence FLAIR), C (Séquence Swan) : Patient de 57 ans, ayant des biomarqueurs négatifset un diagnostic clinique de maladie vasculaire isolée, présentant une importante leucopathie de grade 2associée à une dilatation ventriculaire et de nombreux microsaignements superficiels et profonds en IRM, avec en TEP-FDG un hypométabolisme modéré du cortex associatif, notamment en postérieur.
D (Fusion TEP-FDG et 3DT1), E (Séquence FLAIR) : Patiente de 69 ans, ayant des biomarqueurs négatifset un diagnostic clinique de possible DLFT-bv débutante, présentant une leucopathie de grade 2 en IRM et un discret hypométabolisme du cortex associatif postérieur droit et gauche et frontal droit.
C. Erreurs diagnostiques : faux négatifs
Il y avait 5 patients faux négatifs ;identifiés à tort comme non MA à la lecture de la TEP-IRM alors que les biomarqueurs étaient positifs.
- Pour un patient, la lecture de la TEP IRM avait conclu à une sv-PPA. Ce patient était âgé de 77ans, et présentait des troubles de la mémoire épisodique peu évolutifs ayant débuté 20 ans auparavant (MMSE : 24).Les lectures IRM et FDG seules et lalecture consensuelle
TEP-51 IRM concluaient à une démence sémantique en raison d’une atrophie temporale antérieure prédominant à gauche sans atteinte vasculaire associée (grade 1 de Fazekas, absence de lacune, de microsaignement ou de séquelle d’AVC) et d’un hypométabolismedu cortex associatif postérieur en TEP-FDG (Figure12).
Figure 12. Patient MA diagnostiqué comme démence sémantique en TEP-IRM : TEP-FDG (A,C) et fusion TEP-FDG et 3DT1 (B, D).
Patient de 77ans, avec biomarqueurs positifs présentant des troubles de la mémoire épisodique associé à des troubles de la mémoire de travail et des troubles sémantiques. En TEP-IRM, atrophie et hypométabolisme des pôles temporaux prédominant à gauche, sans hypométabolisme du cortex associatif postérieur, interprété comme une démence sémantique.
Parmi les 4 autres patients diagnostiqués comme normaux en imagerie :
-Nous avions un patient de 66 ans, présentant une maladie d’Alzheimer de variante frontale des troubles cognitifs mnésiques inauguraux, évoluant depuis 3 ans, secondairement associés à des troubles du comportement avec un MMSE à22. Un autre patient de 56 ans, avec des troubles mnésiques depuis environ 6 ans et un MMSE à 23.Pour ces deux patients, les lectures IRM et
52 TEP-FDG seules n’observaient pas d’atrophie, d’atteinte vasculaire ou d’hypométabolisme et concluaient à une imagerie normale avec une lecture consensuelle TEP-IRM le confirmant. La troisième patiente était âgée de 83anset avait un syndrome amnésique associé à des troubles des fonctions exécutives et instrumentales depuis 4ans avec un MMSE bas à 12. La lecture IRM concluait à une maladie d’Alzheimer en raison d’une importante atrophie diffuse, y était associée une leucoaraiose de grade 2 et des microsaignements profonds ; mais la lecture de la TEP-FDG n’observait aucun hypométabolisme et était interprétée comme normale. La lecture consensuelle TEP-IRM concluait à une imagerie sans atteinte neurodégénérative.
La quatrième patiente était âgée de 79ans, elle présentait des troubles du langage de type aphasie logopénique d’installation insidieuse depuis 1 an. La lecture IRM concluait à une maladie d’Alzheimer sur une atrophie hippocampique, maisil n’y avait pas d’hypométabolisme à la lecture de la TEP-FDG seule, et la lecture consensuelle TEP-IRM était interprétée comme normale.
D. Diagnostics autres que la MA
14 patients avaient des biomarqueurs négatifs, et des diagnostics cliniques autre que la MA. Pour 8 patients, la lecture de la TEP-IRM était concordante avec le diagnostic clinique final, avec un niveau de confiance diagnostique élevé pour la totalité des cas. Parmi ces 8 patients, il y avait 5 démences sémantiques (100% des démences sémantiques), 2 troubles fonctionnels (66.7% des troubles fonctionnels) et 1 DLFT-bv (33.3% des DLFT-bv).
Pour 6 patients, la lecture de la TEP-IRM était discordante avec le diagnostic clinique final.Pour 3 patients, la lecture de la TEP-IRM avait conclu à une MA (voir ci-dessus, section B du paragraphe II des résultats), et pour les 3 autres patients, la TEP IRM était interprétée comme normale :
53 présentait des troubles du comportement avec un MMSE à 22. La lecture IRM concluait à une maladie d’Alzheimer et celle de la TEP-FDG seule à une imagerie normale. La lecture consensuelle TEP-IRM était interprétée comme normale.
Les 2 autres patients avaient pour diagnostic clinique une aphasie non fluente. Le premier était âgé de 70 ans, présentait des troubles de l’élocution évoluant insidieusement depuis 4ans, avec un MMSE à 14. Le mécanisme sous-jacent restait discuté (DCB ou DLFT). La lecture IRM s’orientait sur une maladie d’Alzheimer et celle de la TEP-FDG vers une imagerie normale. La lecture consensuelle concluait à une imagerie normale.
Le second était âgé de 49 ans et avait une nf-PPA lentement évolutive depuis 3ans, avec un MMSE à 27. La lecture IRM ne permettait de conclure à un diagnostic (inclassable) et la lecture de la TEP-FDG était considérée comme normale. Le consensus de la lecture TEP-IRM concluait à une imagerie normale.
E. Volumétrie hippocampique
Il n’y avait pas de différence significative pour la moyenne du volume hippocampique normalisé entre le groupe de patients MA et les autres patients (Mann-Whitney ; p= 0.057). (Figure 13)
54 Figure 13. Comparaison des volumes hippocampiques normalisés entre les patients MA et les autres patients.
55
Partie 4 : Discussion
La neuroimagerie, à la fois l’IRM et la TEP-FDG, occupe une place centrale dans le diagnostic des maladies neurodégénératives et est maintenant incluse dans les critères diagnostiques les plus récents de FTLD-bv (4)des aphasies progressives primaires (5)et de la maladie d’Alzheimer(critères NIAAA)(7).
Notre étude est la première à évaluer la performance diagnostique de la TEP-IRM hybride dans une cohorte de patients d'un centre de mémoire clinique.Tous nos patients avaient des biomarqueurs du LCR réalisés et tous les patients MA avaient des biomarqueurs positifsconformément aux critères diagnostiques les plus récents de la maladie d'Alzheimer(6)
I.Performance diagnostique globale de la TEP-IRM
Dans cette cohorte, la TEP-IRM a eu une performance diagnostique élevée pour départager les patients MA et les autres (sensibilité : 85.3% ; spécificité : 78,6%, balanced accuracy : 82,0%). Le niveau de confiance diagnostique en TEP-IRM était élevé pour79.3% des patients MA bien classés et 90,9% des patients non MA bien classés, ce qui était supérieur aux lectures TEP et IRM seules.
Les performances diagnostiques de l’IRM ou de la TEP-FDG seules que nous rapportonspourraient semblermoins bonnes que celles de la littératures(11,33,36) . En effet, une méta analyse récente a rapporté une balanced accuracy moyenne de 84% pour l’IRM et de 83,2% pour le TEP-FDG pour le diagnostic de MA, ce qui est supérieur à nos résultats (68,1% pour l’IRM et 79,0% pour le TEP-FDG). Cependant, beaucoup d’études estiment la performance diagnostique de l’IRM ou du TEP-FDG dans des groupes comprenant uniquement des sujets témoins et des patients atteints de MA, ce qui est une situation plus simple et qui ne correspond pas à la pratique clinique des centres mémoire. Si l’on considère uniquement les
56 études regroupant des patients atteints de MA et d’autres maladies neurodégénératives, les chiffres de balanced accuracy sont bien inférieurs : 48 à 68% pour l’IRM (10,33)et 68 à 79% pour le TEP-FDG(13,33).
Au total, nos résultats se situent donc parmi les chiffres les plus hauts de la littérature. De plus, nous avons choisi d'effectuer cette étude en aveugle des données cliniques, afin d'avoir une estimation fiable de la contribution diagnostique de l’imagerie. Dans la pratique courante, l’information clinique est normalement disponible pour le radiologue et le médecin nucléaire, et peut guider l’interprétation de l’imagerie. Ainsi, il est probable que les performances diagnostiques de la PET-IRM dans la pratique courante soient encore plus élevées.
II. Faux positifs pour la MA en TEP-IRM
3 patients ont été faussement identifiés commeMA à la lecture du TEP-IRM, en raison de la présence d’un hypométabolisme du cortex associatif notamment en dans les régions postérieures. Pour2 patients, il existait également des lésions vasculaires (leucopathie de grade 3 et 2 selon Fazekas et Schmidt, associée pour l’un d’entre eux à de multiples lacunes et microsaignements), qui pourraient être à l’origine d’un hypométabolisme cortical de désafférentation. Au cours de la démence vasculaire, il est en effet rapporté un hypométabolisme cortical, mais plus diffus que celui observé au cours de la maladie d’Alzheimer : outre le cortex associatif, il touche également le cortex primaire et les structures sous-corticales (73). Nos deuxobservations suggèrent que les hypométabolismes de
désafférentation des lésions vasculaires peuvent avoir des patterns assez similaires à ceux de la MA.