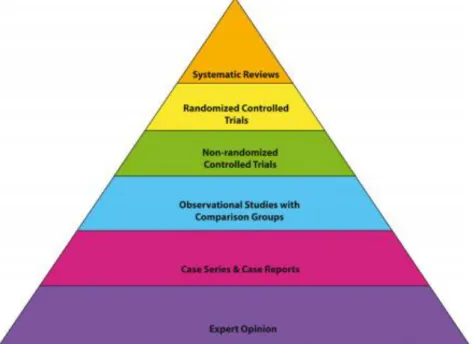
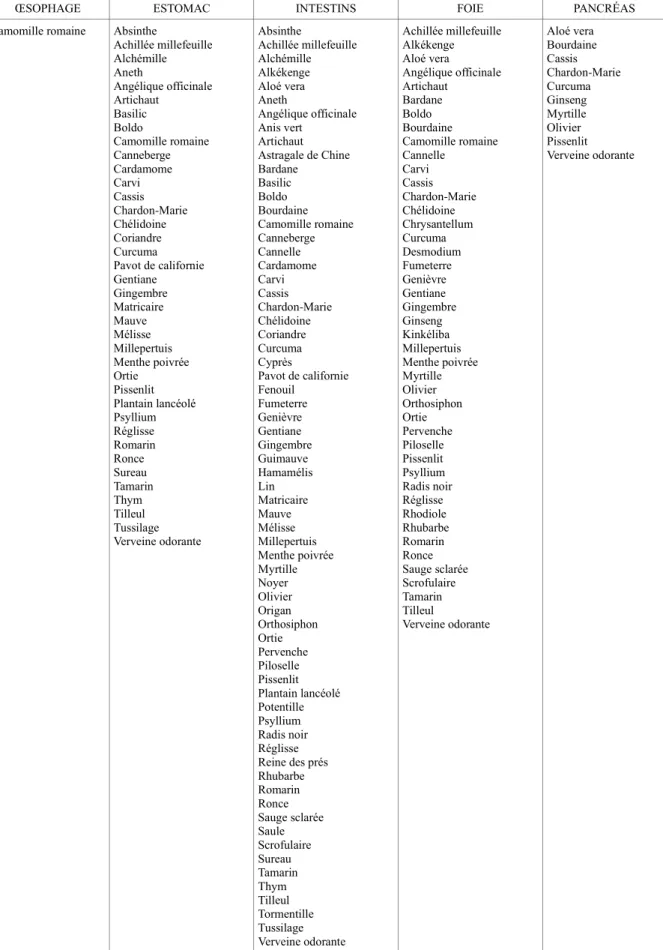
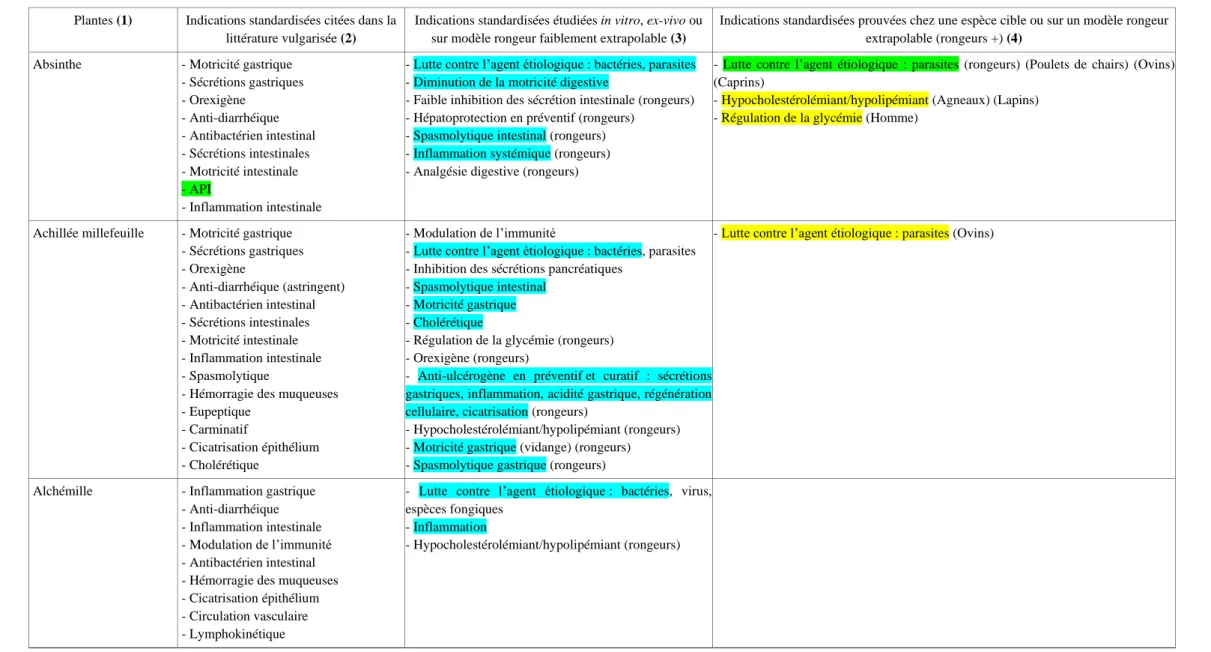
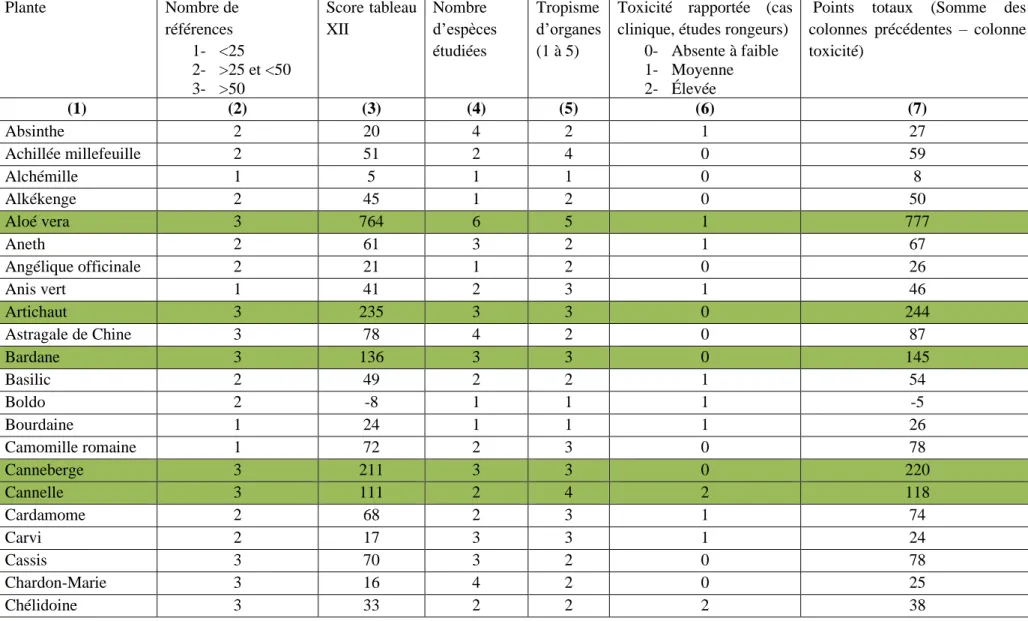
OATAO is an open access repository that collects the work of Toulouse
researchers and makes it freely available over the web where possible
Any correspondence concerning this service should be sent
to the repository administrator:
tech-oatao@listes-diff.inp-toulouse.fr
This is an author’s version published in:
https://oatao.univ-toulouse.fr/27353/
Veyssiere, Manon
. Analyse critique des traitements
phytothérapiques des troubles gastro-intestinaux selon les
critères de l'evidence-based medicine : préludes d'une revue
systématique. Thèse d'exercice, Médecine vétérinaire, Ecole
ANNEE 2020
THESE : 2020 – TOU 3 – 4060
ANALYSE CRITIQUE DES TRAITEMENTS
PHYTOTHERAPIQUES DES TROUBLES GASTRO-
INTESTINAUX SELON LES CRITERES DE L’EVIDENCE-
BASED-MEDICINE : PRELUDES D’UNE REVUE
SYSTEMATIQUE
THESE
pour obtenir le grade de
DOCTEUR VETERINAIRE
DIPLOME D’ETAT
présentée et soutenue publiquement
devant l’Université Paul-Sabatier de Toulouse
par
VEYSSIERE Manon
Née, le 05/09/1995 à SAINT-SAULVE (59)
Directeur de thèse : M. Jean-Philippe JAEG
JURY
PRESIDENT :
M. Nicolas FABRE Professeur à l’Université Paul-Sabatier de TOULOUSE
ASSESSEURS :
M. Jean-Philippe JAEG Maître de Conférences à l’Ecole Nationale Vétérinaire de TOULOUSE Mme Aude FERRAN Maître de Conférences à l’Ecole Nationale Vétérinaire de TOULOUSE
Mise à jour au 01/06/2020
3
PROFESSEURS CLASSE EXCEPTIONNELLEPROFESSEURS 1° CLASSE
PROFESSEURS 2° CLASSE
PROFESSEURS CERTIFIES DE L'ENSEIGNEMENT AGRICOLE
MAITRES DE CONFERENCES HORS CLASSE
Ministère de l'Agriculture et de l’Alimentation ECOLE
NATIONALE VETERINAIRE DE TOULOUSE
: Professeur Pierre SANS
M.
BERTAGNOLI Stéphane, Pathologie infectieuse
M.
BOUSQUET-MELOU Alain, Pharmacologie - Thérapeutique
Mme CHASTANT-MAILLARD Sylvie, Pathologie de la Reproduction
Mme CLAUW Martine, Pharmacie-Toxicologie
M.
CONCORDET Didier, Mathématiques, Statistiques, Modélisation
M
DELVERDIER Maxence, Anatomie Pathologique
M.
ENJALBERT Francis, Alimentation
Mme GAYRARD-TROY Véronique, Physiologie de la Reproduction, Endocrinologie
M.
PETIT Claude, (Emérite) - Pharmacie et Toxicologie
M.
SCHELCHER François, Pathologie médicale du Bétail et des Animaux de Basse-cour
M.
BAILLY Jean-Denis, Hygiène et Industrie des aliments
Mme BOURGES-ABELLA Nathalie, Histologie, Anatomie pathologique
M.
BRUGERE Hubert, Hygiène et Industrie des aliments d'Origine animale
Mme CADIERGUES Marie-Christine, Dermatologie Vétérinaire
M.
DUCOS Alain, Zootechnie
M.
FOUCRAS Gilles, Pathologie des ruminants
M
GUERIN Jean-Luc, Aviculture et pathologie aviaire
Mme HAGEN-PICARD, Nicole, Pathologie de la reproduction
M.
JACQUIET Philippe, Parasitologie et Maladies Parasitaires
M.
LEFEBVRE Hervé, Physiologie et Thérapeutique
M.
MEYER Gilles, Pathologie des ruminants
Mme TRUMEL Catherine, Biologie Médicale Animale et Comparée
Mme BOULLIER Séverine, Immunologie générale et médicale
Mme DIQUELOU Armelle, Pathologie médicale des Equidés et des Carnivores
M.
GUERRE Philippe, Pharmacie et Toxicologie
Mme LACROUX Caroline,
Anatomie Pathologique, animaux d’élevage
Mme LETRON-RAYMOND Isabelle, Anatomie pathologique
M.
MAILLARD Renaud, Pathologie des Ruminants
Mme MEYNADIER Annabelle, Alimentation animale
M.
MOGICATO Giovanni, Anatomie, Imagerie médicale
Mme PAUL Mathilde, Epidémiologie, gestion de la santé des élevages avicoles
M.
RABOISSON Didier, Médecine de population et Économie de la santé animale
Mme MICHAUD Françoise, Professeur d'Anglais
M
SEVERAC Benoît, Professeur d'Anglais
M.
BERGONIER Dominique, Pathologie de la Reproduction
Directeur
Mise à jour au 01/06/2020
4
MAITRES DE CONFERENCES (classe normale)CHARGES D’ENSEIGNEMENT CONTRACTUELS
ENSEIGNANT DE PREMIERE ANNEE COMMUNE AUX ETUDES VETERINAIRES
ASSISTANTS D'ENSEIGNEMENT ET DE RECHERCHE CONTRACTUELS