L’inhibition au tronc cérébral dans le système
sensoriel des vibrisses des rongeurs
Thèse Marie-Andrée Bellavance Doctorat en neurobiologie Philosophiæ doctor (Ph.D.) Québec, Canada © Marie-Andrée Bellavance, 2017
L’inhibition au tronc cérébral dans le système
sensoriel des vibrisses des rongeurs
Thèse
Marie-Andrée Bellavance
Sous la direction de:
Résumé
Les rongeurs utilisent leurs vibrisses afin de connaître leur environnement. L’information sen-sorielle captée par les vibrisses est envoyée à chacun des noyaux trigéminaux sensoriels du tronc cérébral, là où l’inhibition détermine les propriétés des réponses des cellules trigémino-thalamiques. Nous avons démontré qu’une inhibition rapide de type « feedforward » provenant des cellules GABAergiques et glycinergiques du noyau spinal interpolaire, détermine la préfé-rence angulaire des neurones du PrV. Nos résultats ont également montré que la direction de stimulation de la vibrisse influence systématiquement la latence du premier potentiel d’action, et que cette latence s’avère être un outil aussi robuste que le taux de décharge pour quantifier la préférence angulaire au PrV. Nous proposons que l’inhibition à la première station-relais du système des vibrisses contribue au filtrage des informations redondantes et à la mise en oeuvre d’un code basé sur la latence pour le transfert des informations sensorielles du thalamus jusqu’au cortex. Lors du second volet de cette étude, nous cherchions à comprendre comment une boucle sensorielle rétroactive peut affecter les motoneurones qui contrôlent le mouvement des vibrisses. Nous avons démontré que cette boucle n’est pas exclusivement excitatrice, tel que rapporté précédemment par Nguyen et Kleinfeld (2005) mais qu’elle peut aussi inhiber les motoneurones qui contrôlent la protraction des vibrisses. Nos résultats indiquent que la latence du réflexe dans cette boucle est de 11 à 13 ms, ce qui concorde avec la latence du réflexe estimé chez le rat en exploration libre lorsqu’il touche un objet. Des techniques de mar-quage rétrograde combinées avec de l’hybridation in situ ont révélé que les motoneurones des muscles intrinsèques des vibrisses reçoivent des informations des prémotoneurones glutamater-giques et GABAerglutamater-giques/glycinerglutamater-giques situés dans le noyau trigéminal oralis. Par contre, les motoneurones qui contrôlent la rétraction du coussinet facial reçoivent seulement les entrées excitatrices des cellules glutamatergiques du noyau spinal interpolaire qui projettent au Po. En somme, nos études montrent que l’inhibition d’origine trigéminale joue un grand rôle dans le tri des informations sensorielles et le mouvement des vibrisses.
Abstract
Rodents use their vibrissae to explore the environment. Sensory information gathered by the vibrissae is forwarded to each of the sensory trigeminal nuclei in the brainstem, where inhi-bition shapes response properties of trigeminothalamic cells. We found that fast feedforward inhibition of PrV cells by GABAergic and glycinergic interpolaris cells determines the angu-lar selectivity of PrV neurons. Our results also show that stimulus direction systematically influences the latency of the first action potential, and that first spike latency is as reliable as spike counts to quantify the angular tuning of PrV cells. We propose that inhibition at the first relay station of the vibrissa system contributes to filtering redundant information and to the implementation of a latency code for the transfer of sensory information to thalamus and cortex. In a second study, we examined how sensory feedback loops affect facial motoneurons that control vibrissa movements. We demonstrated that this loop is not exclusively excitatory, as previously reported by Nguyen and Kleinfeld (2005), but that it can inhibit motoneurons that drive vibrissa protraction. Reflex latency in this loop is of the order of 11 to 13 ms, which matches that estimated in freely exploring rats when they contact an object. Retrograde labeling combined with in situ hybridization revealed that motoneurons of the intrinsic vib-rissa muscles receive input from glutamatergic and GABAergic/glycinergic premotor neurons located in the trigeminal oralis nucleus. In contrast motoneurons that drive retraction of the mystacial pad only receive excitatory input from glutamatergic cells of the spinal interpolar nucleus that project to Po. In sum, our studies show that inhibition at the very first relay stations of the vibrissa system plays a key role in the selection of sensory information and in fine tuning the motion of the vibrissae.
Table des matières
Résumé iii
Abstract iv
Table des matières v
Liste des tableaux viii
Liste des figures ix
Liste des abréviations xvi
Remerciements xix
Avant-propos xx
1 Introduction 1
Introduction 1
1.1 Le modèle sensoriel des vibrisses chez les rongeurs. . . 1
1.1.1 Les avantages du modèle : la somatotopie . . . 2
1.2 Les vibrisses . . . 2
1.2.1 L’organisation des vibrisses . . . 4
1.3 La transmission de l’information sensorielle . . . 4
1.3.1 Les récepteurs sensoriels . . . 4
1.3.2 Les cellules de Merkel . . . 4
1.3.3 Les récepteurs lanciformes . . . 6
1.3.4 Le nerf trigéminal . . . 6
1.3.5 Le ganglion trigéminal . . . 6
1.3.6 La transduction mécanique . . . 6
1.4 Les noyaux du nerf trigéminal . . . 8
1.4.1 Le PrV . . . 9
1.4.2 Le SpVo . . . 9
1.4.3 Le SpVi . . . 9
1.4.4 Le SpVc . . . 11
1.5 Les voies somatosensorielles . . . 11
1.5.1 La voie lemniscale . . . 11
1.5.2 La voie lemniscale (2) . . . 13
1.5.4 La voie extralemniscale . . . 14
1.6 La sélection de l’information sensorielle : la préférence directionnelle . . . . 14
1.6.1 L’importance de l’inhibition dans les autres systèmes sensoriels . . . 15
1.6.2 Le PrV inhibé par les sous-noyaux trigéminaux . . . 17
1.7 La fonction motrice. . . 17
1.7.1 Le whisking . . . 17
1.7.2 Le vIRT responsable de la rythmicité du mouvement . . . 19
1.7.3 Le noyau 7N contient les motoneurones . . . 19
1.7.4 Muscles responsables du mouvement des vibrisses . . . 19
1.8 L’information sensorielle peut changer la stratégie de l’animal . . . 22
1.8.1 Une boucle trigéminale excitatrice . . . 22
1.8.2 Les prémotoneurones. . . 24
1.9 Problématiques, hypothèses et objectifs de l’étude. . . 27
1.9.1 La préférence directionnelle au PrV. . . 27
1.9.2 L’information sensorielle et la motricité des vibrisses . . . 28
2 Feedforward Inhibition Determines the Angular Tuning of Vibrissal Responses in the Principal Trigeminal Nucleus 30 2.1 Résumé . . . 30
2.2 Abstract . . . 31
2.3 Introduction. . . 31
2.4 Materials and Methods. . . 32
2.4.1 Recording of PrV cells . . . 32
2.4.2 Whisker stimulation . . . 33
2.4.3 Brainstem lesions . . . 33
2.4.4 Local injection of inhibitory receptor antagonists . . . 33
2.4.5 Data analysis . . . 33
2.5 Results. . . 35
2.5.1 Stimulus-evoked activity . . . 35
2.5.2 Directional tuning . . . 35
2.5.3 Inhibition shapes the angular tuning of PrV neurons . . . 37
2.5.4 Origin of inhibition—interpolaris lesion . . . 38
2.5.5 Origin of inhibition effect of GABAergic and glycinergic antagonists 40 2.5.6 Angular domain of inhibition . . . 41
2.5.7 Summary of results. . . 42
2.6 Discussion . . . 42
2.6.1 Rate code versus latency code. . . 43
2.6.2 Decoding spike latency : reference signals . . . 44
2.6.3 Fast feedforward inhibition and angular tuning . . . 44
2.6.4 Angular tuning and whisker torsion. . . 45
2.7 References . . . 45
2.8 Supplemental Data . . . 49
3 A fast inhibitory trigemino-facial feedback circuit for reflexive vibrissa movement 52 3.1 Résumé . . . 53
3.2 Abstract . . . 53
3.4 Methods . . . 54
3.5 Results. . . 56
3.5.1 Anatomical background . . . 56
3.5.2 Response of facial motoneurons to vibrissa deflection in anesthetized rats . . . 56
3.5.3 Assessment of reflex latency . . . 59
3.5.4 Anatomical substrate for reflex excitation and inhibition . . . 59
3.6 Discussion . . . 61
3.6.1 Context-dependence of the trigemino-facial reflex . . . 62
3.7 References . . . 63
4 Discussion 66 4.1 Une inhibition intertrigéminale détermine la directionalité angulaire des ré-ponses des vibrisses dans le PrV . . . 66
4.1.1 L’inhibition provenant du SpVic est nécessaire au maintien de la directionalité des réponses . . . 66
4.1.2 Cette inhibition contribue au filtrage des informations redondantes . 67 4.1.3 L’inhibition rend possible l’encodage des messages sur la base d’un code de latence . . . 68
4.2 Une boucle trigéminofaciale modifie la stratégie exploratoire de l’animal . . 69
4.2.1 La boucle trigéminofaciale . . . 69
4.2.2 Le réflexe trigéminofacial est conditionnel . . . 70
4.2.3 Les prémotoneurones du SpVir projettent aussi au Po . . . 70
4.2.4 La rétraction des vibrisses lors du réflexe de sursaut . . . 70
Liste des tableaux
Liste des figures
1.1 L’organisation des vibrisses et les circuits trigéminaux. Les macro- et les microvibrisses sont innervées par la branche infraorbitale du nerf maxillaire (ION). Les cinq rangées de vibrisses (A-E) et les quatre longues vibrisses cau-dales (α-δ) sont représentées par un code de couleur. Dans le tronc cérébral, les collatérales émergeant des axones des cellules du ganglion trigéminal, in-nervent le noyau trigéminal pincipal (PrV) et tous les sous-noyaux trigéminaux spinaux (SpV), où elles forment une organisation spécifique aux vibrisses (bar-relettes). Dans le PrV, la carte est inversée, les vibrisses ventrales du museau sont réprésentées dans la partie dorsale du noyau tandis que les poils dorsaux sont représentés ventralement. Les axones trigéminothalamiques du PrV (voie lemniscale) projettent à la partie dorsomédiane du noyau ventral postérieur mé-dian (VPM) dans le thalamus, où les cellules sont organisées (barillets) selon une représentation inversée. Les neurones du SpV projettent au noyau postéro-médian (voie paralemniscale) et dans la portion ventrolatérale du VPM (voie extralemniscale, non répresentée). Finalement, les axones thalamocorticaux du VPM projettent au cortex somatosensoriel primaire (S1) où ils forment les
ba-rils. Figure adaptée de Erzurumlu et al. (2010). . . 3
1.2 Représentation schématique de la structure et de l’innervation du complex follicule-sinus chez le chat et le rat.Les chiffres romains à gauche de l’illustration indiquent les zones d’innervation. I, Rete ridge collar (RRC) : l’épithélium forme un épais RRC à la partie superficielle du complex follicule-sinus (FSC) de la vibrisse, où le follicule est en continu avec l’épiderme. IV, Inner conical body (ICB) : la gaine mésenchymale s’étend pour former le ICB à l’apex du sinus sanguin. VI, Sinus caverneux : la moitié inférieure jusqu’au deux tiers du sinus sanguin vient s’attacher à un tissu conjonctif, appelé sinus caverneux. À la base du follicule, la capsule converge avec le bulbe de la vibrisse pour entourer le sinus. Les chiffres arabes à droite montrent des types spécifiques de terminaisons nerveuses. 2, Les terminaisons de Merkel sur les cellules de Merkel (ovales blancs) dans l’épiderme du RRC. 4, Petite et fine innervation couvrant la circonférence et des récepteurs lanciformes. 5, Terminaisons de Merkel sur les cellules de Merkel (ovales blancs). 6, Terminaisons lanciformes longitudinales.
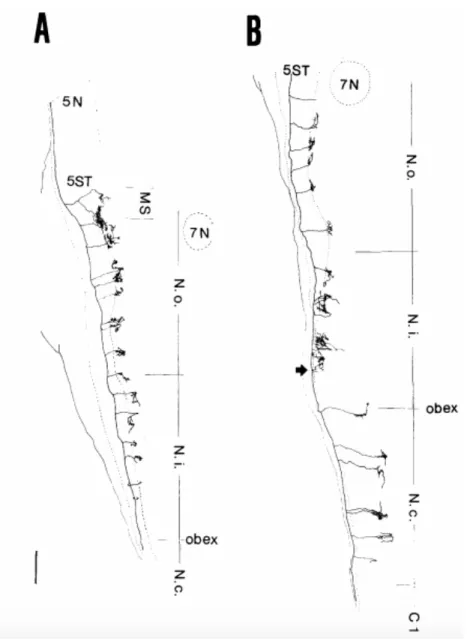
1.3 Reconstructions représentant deux fibres afférentes des vibrisses dans le tronc cérébral.A : Exemple d’une fibre injectée à la horseradish peroxydase (HRP) dont le site d’injection se situe près du noyau spinal oralis (SpVo). La reconstruction s’est faite avec 11 tranches horizontales d’une épaisseur de 150 µm. La branche rostrale s’étend de manière rostro-caudal vers le PrV tandis que les collatérales de la branche caudale s’étendent médialement. B : Exemple d’une fibre injectée près de l’obex. Cette fibre a été reconstruite à partir de 6 sections horizontales et dessiné du SpVo au noyau spinal caudalis (SpVc). La flèche représente une paire de collatérales qui se superposent. Les terminaisons axones de collatérales voisines montrées en A et en B, ne se superposent pas, excepté pour la paire montrée en B. 5N, nerf trigéminal ; 5ST, tractus spinal trigéminal ; 7N, noyau facial ; MS, noyau trigéminal principal (PrV) ; N.o., noyau trigéminal spinal oralis (SpVo) ; N.i., noyau trigéminal spinal interpolaris (SpVi) ; N.c., noyau trigéminal spinal caudalis (SpVc) ; C1, première vertèbre cervicale. La
barre verticale représente 0.5 mm. Figure adaptée de Hayashi, (1980). . . 7
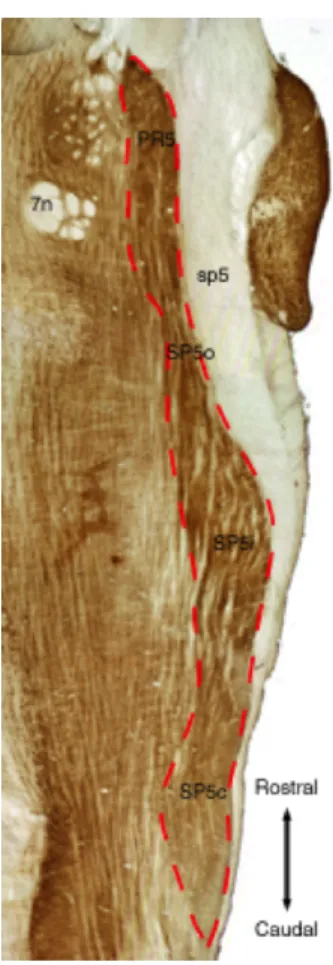
1.4 Noyaux de la colonne trigéminale. Une coloration à la cytochrome oxydase permet de visualiser la disposition du noyau principal et les sous-noyaux trigé-minaux dans le tronc cérébral. À noter que les barrelettes ne sont pas visibles sur une coupe horizontale étant donné leur orientation rostro-caudale. La ligne pointillée rouge délimite la colonne trigéminale. sp5, tractus trigéminal, 7n, nerf
facial. Figure adaptée de Henderson et Jacquin, (1995). . . 8
1.5 Barrelettes dans les noyaux trigéminaux. A : Les noyaux trigéminaux sen-soriels sont orientés selon un axe antéropostérieur. Le PrV est le noyau le plus antérieur et les noyaux trigéminaux spinaux (SpVo, SpVi et SpVc) s’étendent vers la portion caudale du tronc cérébral. Les vibrisses projettent à la partie ventrale des noyaux trigéminaux. Dans le PrV, le SpVc et la partie caudale du SpVi, chaque vibrisse a sa propre région de projection, c’est-à-dire une bar-relette. L’orientation des barrelettes des macrovibrisses est représentée sur le schéma. B : Section coronale d’un tronc cérébral d’une souris montrant la lo-calisation des barrelettes dans la partie ventrale du SpVic. Après une colora-tion à la cytochrome oxydase, les barrelettes apparaissent comme des taches foncées. À noter la somatotopie inversée : les vibrisses dorsales du museau de l’animal projettent aux barrelettes ventrales. Les petites taches foncées situées dorsalement aux barrelettes de la rangée E représentent le champ récepteur des
microvibrisses. Figure adaptée de Bosman et al. (2011). . . 10
1.6 Représentation schématique des voies trigémino-thalamo-corticales. Les flèches représentent les zones des terminaisons axonales. Dans le cortex cérébral, les cellules postsynaptiques pourraient avoir leur soma dans d’autres couches corticales. L’épaisseur des lignes indique l’importance relative des voies. Les barrillets du VPM ainsi que les barrelettes des noyaux trigéminaux sont représentés selon leur disposition sur des tranches coronales. D, dorsal ; L, la-téral ; R, rostral ; LD, noyau latérodorsal du thalamus ; VPMh, région dorsale du VPM ; VPMvl, partie ventrolatérale du VPM ; wM1, cortex moteur des vi-brisses ; wS1, partie des vivi-brisses du cortex primaire sensorimoteur ; wS2, partie des vibrisses du cortex sensorimoteur secondaire. Figure adaptée de Bosman et
1.7 Préférence directionnelle des cellules du PrV projettant au VPM (n=72) comparativement à celle des cellules ganglionnaires (n=64). Toutes les données montrées en A-C ont été recueillies avec la déflection de la vibrisse principale. A : Distribution des fréquences des ratios de préférence direc-tionnelle, défini comme étant [la moyenne des réponses ON (tous les angles)/la réponse ON du meilleur angle]. Les flèches indiquent les classes contenant les valeurs moyennes (ligne pleine = PrV ; ligne pointillée = ganglion). À noter la préférence directionnelle plus forte des cellules ganglionnaires indiquée par des ratios de préférence plus petits. B : Distribution des indices de préférence directionnelle des réponses ON. Un indice de 7 indique une réponse fortement préférentielle à une direction ; 0 indique une préférence de direction faible. C : Tracés polaires de population pivotés et normalisés qui illustrent une préférence directionnelle moins élevée des cellules du PrV projettant au VPM que celle des
cellules ganglionnaires. Figure adaptée de Minnery et Simons, (2003).. . . 16
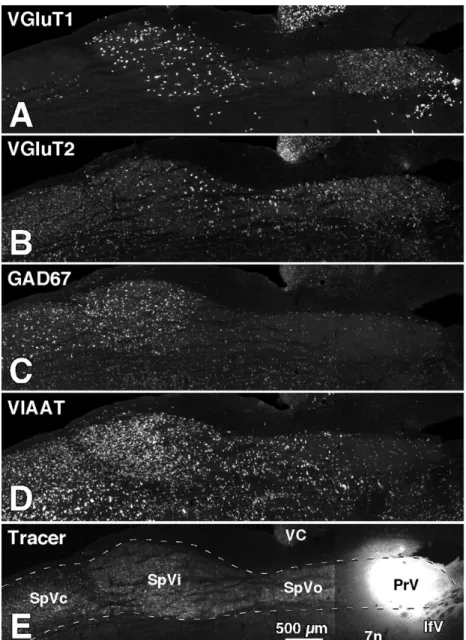
1.8 Distribution des cellules glutamatergiques et GABAergiques dans le tronc cérébral.A-D : In situ hybridation des facteurs de transcription VGluT1 (A), VGluT2 (B), GAD67 (C), et VIAAT dans des tranches horizontales du tronc cérébral. Les cellules positives au VGluT1 et VGluT2 sont glutamater-giques (excitatrices) ; les cellules positives au GAD67 sont GABAerglutamater-giques (inhi-bitrices) ; les cellules positives au VIAAT sont soit GABAergiques ou glyciner-giques (inhibitrices). E : Injection de la sous-unité B de la toxine du choléra dans le PrV permettant le marquage rétrograde des cellules de la colonne trigémi-nale, avec une concentration plus dense dans le SpVic et le SpVc. Le marquage dans le SpVo est plutôt au niveau des axones internucléaires de passage. Les sections horizontales du tronc cérébral sont alignées de la même façon, ce qui fait en sorte que le marquage dans les divisions nucléaires en E s’applique aussi aux autres tranches A-D. 7n, tractus du nerf facial ; ifV, noyau infratrigéminal ;
VC, noyau cochléaire ventrale. Figure adaptée de Furuta et al. (2008). . . 18
1.9 Disposition des muscles du noyau facial et leur représentation dans le noyau 7N. A : Les muscles intrinsèques (Int) s’enroulent autour de la base des follicules des vibrisses. Quand ces muscles contractent, on observe une pro-traction des vibrisses. B : Deux groupes de muscles extrinsèques existent : les muscles nasolabialis (NL) et maxillolabialis (ML) qui rétractent la région des vi-brisses et le muscle nasolabialis profundus (NLP) qui provoque une protraction. Les fibres des muscles extrinsèques (mf) se situent sous la peau entre les ran-gées des vibrisses. C : Les motoneurones qui innervent les muscles intrinsèquent des vibrisses sont localisés dans la partie latérale ventrale du 7N, les muscles extrinsèques rétracteurs sont représentés dorsolatéralement, et les muscles ex-trinsèques protracteurs sont représentés dans la portion la plus latérale du 7N. Les dessins A et B sont adaptés de la Figure 11 de Grant et al. (2013). La
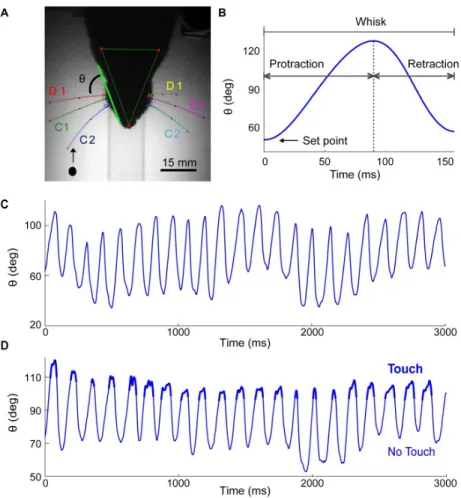
1.10 Trajectoire des vibrisses lors du whisking chez les rats. A : La trajectoire des vibrisses C1, C2 et D1 a été enregistrée chez des rats dont la tête était fixée. L’angle instantanée de la vibrisse, θ, était défini comme l’angle entre la base de la vibrisse et la ligne tracée du nez jusqu’à l’oeil. L’objet est représenté par un point à son endroit initial et la flèche indique la direction de mouvement de la vibrisse. B : Les phases de protraction et de rétraction d’une seule vibrisse sont représentées selon l’angle de la vibrisse et le temps du déclenchement de la protraction. L’angle de la vibrisse lors du point de commencement de la protraction est indiqué par une flèche. C : Exemple de trajectoire d’une vibrisse lors d’un whisking sans obstacle (filtré à 80 Hz). D : Exemple de trajectoire d’une vibrisse lors d’un contact avec un objet pendant une période de whisking (filtré à 80 Hz). Les moments de contact entre la vibrisse et l’objet sont indiqués en gras. Lors de ces contacts, on remarque une rétraction supplémentaire de la vibrisse comparativement à une trajectoire sans obstacle montrée en C. Dans cet exemple, le rat fait 21 whisks successifs où il y a eu un contact avec l’objet.
Figure adaptée de Deutsch et al. (2012). . . 23
1.11 Réponses d’électromyogrammes (EMG) obtenues après la stimulation du nerf infraorbital (IoN) chez des rats anesthésiés à la kétamine-xylazine.A : Montage expérimental. B : Latence des réponses représentées par ∆t1 et ∆t2 à chaque stimulation. C : Enregistrements simultanés des signaux des électromyogrammes des muscles des vibrisses intrinsèques et extrinsèques ipsilatéraux lors de trois répétitions. Le IoN était stimulé avec des stimulations de 5 mA de courant pendant 200 µs à toutes les 2 s. La moyenne des EMG enregistrés avant (gris pâle) et après (gris foncé) la transection de la branche buccolabialis montrée chez différents rats. Les traces sont une moyenne de 10 réponses consécutives suivant la stimulation du IoN à 10 Hz avec 8 mA de courant et des séquences de 100 µs. D : Distribution de la latences de réponses
chez 4 rats (50 répétitions par rat). Figure adaptée de Nguyen et Kleinfeld (2005). 25
1.12 Prémotoneurones innervant les muscles intrinsèques et extrinsèques du 7N.A : Gauche, stratégie utilisant un virus pour marquer sélectivement les neurones prémoteurs projettant aux cellules des vibrisses du 7N et reliées aux muscles intrinsèques. Droite, stratégie pour marquer sélectivement les neurones prémoteurs projettant aux cellules des vibrisses du 7N et reliées aux muscles extrinsèques. B : Motoneurones intrinsèques marqués par le virus dans les ré-gions latérale et ventrolatérale du 7N. C : Motoneurones extrinsèques marqués par le virus dans la région dorsolatérale du 7N. D-O : Comparaison des patrons de distribution entre les prémotoneurones intrinsèques et extrinsèques des diffé-rents noyaux du tronc cérébral. Marquage similaire observé dans les noyaux sui-vants : le noyau réticulaire médulaire (MdD ; D et E), le complexe pre-Bötzinger (preBötC ; H et I), le complexe Bötzinger (BötC ; données non montrées), SpVo (L et M) et KF (N et O). Une quantité significative de prémotoneurones intrin-sèques a été observée dans la formation réticulaire intermédiaire (IRt) adjacente au noyau ambigu (NA ; flèches en F et G) comparativement aux motoneurones extrinsèques. Dans le noyau spinal vestibulaire (Ve), les prémotoneurones sont seulement observés lors d’un traçage des motoneurones extrinsèques (H et flèche en I). Dans le SpVir, le nombre de prémotoneurones extrinsèques est significa-tivement plus élevé que celui des prémotoneurones intrinsèques (J et flèche en
2.1 Response of PrV cells to controlled whisker deflection. PSTHs and the polar plot in A show responses of a SA unit to directional deflection of whisker D3. Normalized number of spikes per deflection within a time window of 10 ms after stimulus onset was used to build the polar plot ; the arrow is the vector sum of angular responses. Traces and raster display in B show ON responses of a representative SA unit ; note the very high frequency of action potentials (∼1 kHz) ; dotted line, stimulus waveform. C, Distribution of tuning index across a population of 16 SA and 27 RA units. Scatter plots in D show correlation between tuning indices computed from normalized values of spike counts per stimulus (10 ms time window) and first-spike latency (regression lines : SA, y = 1.21x−0.22; RA, y = 1.02x−0.06 ; RA & SA, y = 1.02x−0.07). E, circular-circular correlograms between preferred deflection angle computed as the vector sum of normalized values of spike counts per stimulus (10 ms time window) and first-spike latency. The gray line is the curve of a perfect correlation. In these circular plots, the vector sum derived from first-spike latency is represented on the circular axis, and the vector sum derived from spike counts is represented
on the radial axis. . . 36
2.2 Absolute angular difference between preferred directions estimated by the normalized values of first-spike latency and spike counts versus the directional tuning index of PrV cells.Note the important difference for the least tuned cells (blue column). These three cells correspond to cells 39, 40 and 41 in figure S2.6 ; they were excluded from the circular-circular correlation
analysis (see Fig. 2.1E). . . 38
2.3 Inhibition shapes the angular tuning of PrV neurons. Single cell PSTH in A and population PSTH in B show the suppression of background discharges induced by current injection when whiskers were deflected in the least effective direction. Intracellular recordings in C show a cell that responded with a spike on the crest of an EPSP at a deflection angle of 135◦, and with an IPSP at
a deflection angle of 45◦ (5 superimposed traces ; note the opposite pattern of
excitation/inhibition at stimulus offset). . . 39
2.4 Blockade of inhibition reduces the angular tuning of PrV cells. Lesion of the inhibitory connections between the SpVi and the PrV significantly reduces the tuning index of PrV cells in comparison with normal rats (ρ < 0.0003 for the combined populations of SA and RA units ; compare histograms in A with histograms of figure 2.1C). A short-lasting suppression of background discharges induced by current injection was still present when whiskers were deflected in the least effective direction (arrow in B). This population PSTH was built from the responses of 8 cells where no excitation preceded inhibition. C, When inhibition was fully blocked by local injection of gabazine and strychnine, tuning indices were further reduced with respect to normal rats (ρ < 0.0001), and background discharges were no more suppressed when whiskers were deflected in the least effective direction (D). Note that in B and D, the magnitude of ON and OFF
responses was cropped. . . 40
2.5 Broadening of the angular tuning domain of PrV cells after blockade of inhibition by gabazine and strychnine. Graphs show the average atte-nuation of response magnitude as a function of the angular distance from the best direction for RA (A) and SA (B) units (gray line, control rats ; black line,
2.6 Comparison of angular preference of 41 PrV cells estimated from spike counts and first-spike latency. All units were recorded in normal rats, and red arrows are vector sums of polar plots. Normalized values of the mean number of spikes per deflection within a poststimulus time window of 10 ms were used to build the left-hand series of polar plots. Normalized values of the modal first-spike latency (latencyminimum/latency) were used to build the
right-hand series of polar plots. Cells are ranked according to their D value (i.e., degree of angular tuning estimated from normalized values of spike counts per
stimulus) as indicated between the associated polar plots. . . 50
2.7 Frontal section through the brainstem showing the extent of an elec-trolytic lesion that destroyed ascending projections from the SpVi to the PrV (cytochrome oxidase staining). Abbreviations : SpVo, oralis division
of the spinal trigeminal complex ; trV, spinal trigeminal tract. . . 51
3.1 Layout of facial muscles and their central representation in the facial motor nucleus.(A), The intrinsic muscles (Int) form a sling around the base of vibrissa follicles. When they contract, vibrissae protract. (B), Two groups of extrinsic muscles translate the mystacial pad : muscle nasolabialis (NL) and maxillolabialis (ML) retract the pad, while muscle nasolabialis profundus (NLP) protract the pad. Extrinsic muscle fibers (mf) run underneath the skin between vibrissa rows. (C), Motoneurons that innervate the intrinsic vibrissa muscles are located in the ventral lateral part of the facial nucleus, the extrinsic retractor muscles are represented dorsolaterally, and the extrinsic protractor muscles are represented at the lateral most edge of the nucleus. The drawings in A and B were adapted from Figure 11 of Grant et al. (2013). (D), Injection of ∆G-Rabies-mCherry in the tip of the snout leads to retrograde labeling in the lateral most part of the facial nucleus (E), and transsynaptic labeling in the parafacial region (F) and the preBötzinger complex (G). Note the absence of labeled cells in the SpVO and SpVIr. Abbreviations : Amb, ambiguous nucleus ; FN, facial nucleus ; PF, parafacial region ; preBötC, preBötzinger complex. Lower-case letters in D
3.2 Sensory feedback in facial motoneurons following air-puff deflection of the vibrissae. (A,B) In intrinsic motoneurons vibrissa deflection induces a short-latency hyperpolarization at an average latency of 3.5 ± 0.4 ms. In some intrinsic motoneurons, shown as overlaid traces in panel B, the early hyperpo-larization was interrupted or followed by depolarizing events that triggered an action potential (arrows ; action potentials are cropped). (C,D) The hyperpolari-zation reversed in sign at about – 70 mV, and became depolarizing shortly after cell impalement with a KCl-filled pipette. (E) In pad retractor motoneurons, passive vibrissa deflection induces a prompt excitation. The ten superimposed traces in this panel are from a motoneuron that drove retraction of vibrissae E1, E2, E3, D1, D2, and D3. Traces in panel F show the time course of sensory-evoked responses in an intrinsic motoneuron and a pad retractor motoneuron with that of the local field potential (LFP) recorded in the oralis nucleus. Each trace is the average of 35 responses. Note the very short delay (about 0.5 ms) between the onset of the LFP (dashed line) and the onset of intracellular events. Traces in panel G show how the latency of protraction after a motoneuronal spike was measured. In this example, spikes were triggered by current injection in a D1 motoneuron, and a piezoelectric film was used to monitor displacement of vibrissa D1 (red trace). (H), spike-triggered average protraction of vibrissa
D1 (34 events). . . 58
3.3 Anatomical substrate for the trigemino-facial reflex. (A), Fluorogold was injected in the ventral lateral facial nucleus, and in situ hybridization was used to label trigeminal neurons that express VGAT (B). Doubly labeled cells (arrowheads) are found in the oralis nucleus, as delineated by the dashed lines in A. (C-F), Interpolaris neurons that project to Po were selectively labeled by injecting RG-LV-hSyn-Cre in Po, and AAV.2/1.hSyn.ChR2.EYFP.WPRE in SpVIr. The framed area in panel C is enlarged in panel D. Anterograde labeling of interpolaris axons reveals terminal fields in Po and the ventral part of zona incerta (panel E), as well as in the dorsal lateral division of the facial nucleus (panel F). The dashed line indicates the dorsal border of the facial nucleus. The preferential distribution of SpVIr terminals in the dorsal lateral sector of the facial nucleus is illustrated in the 3D map in panel G (a, anterior ; d, dorsal). Sagittal sections (panels C-F) were counterstained for cytochrome oxidase. Ab-breviations : PrV, principal trigeminal nucleus ; SpVO, oralis subnucleus of the spinal trigeminal complex ; SpVIr, rostral division of the interpolaris subnucleus of the spinal trigeminal complex ; SpVIc, caudal division of the interpolaris sub-nucleus of the spinal trigeminal complex ; SpVM, muralis sector of the spinal trigeminal complex ; SpVC, caudal subnucleus of the spinal trigeminal complex ;
ZIv, ventral division of zona incerta. . . 60
3.4 Schematic diagram of first-order feedback loops involved in reflex motion of the vibrissae. Intrinsic motoneurons in the ventral lateral sector of the facial nucleus receive both excitatory and inhibitory inputs from SpVO, whereas nasolabialis and maxillolabialis motoneurons in the dorsal lateral sector
Liste des abréviations
7N Noyau facial
µm Micromètre
EPSP Potentiel postsynaptique excitateur
GABA Acide γ-aminobutyrique
Hz Hertz
MdD Noyau réticulaire médulaire
mm Millimètre
MRN Noyau réticulé mésencéphalique
ms Millisecondes
Po Groupe postérieur du thalamus
PrV Noyaux trigéminal pincipal
S1 Cortex somatosensoriel primaire
S2 Cortex somatosensoriel secondaire
SpV Noyaux trigéminaux spinaux
SpVc Noyau spinal caudalis
SpVi Noyau spinal interpolaris
SpVic Partie caudale parvocellulaire du noyau spinal interpolaris SpVir Partie rostrale magnocellulaire du noyau spinal interpolaris
SpVo Noyau spinal oralis
VIAAT Transporteur vésiculaire d’amino-acides inhibiteurs
vIRT Région des vibrisse de la formation réticulaire intermédiaire VPM Noyau ventral postérieur médian du thalamus
VPMdm Noyau dorso-médian du VPM
VPMvl Noyau ventral postérieur latéral
À mes parents. À Olivier.
Dans la vie, rien n’est à craindre, tout est à comprendre
Remerciements
Je voudrais tout d’abord remercier mon directeur de thèse Martin Deschênes, qui m’a accueilli dans son laboratoire au tout début de mes études graduées. Pendant huit années, j’ai eu le privilège de cotoyer un passionné des neurosciences. Il approche chaque problématique scientifique comme une énigme à résoudre et s’amuse avec les différentes stratégies pour y parvenir. J’ai appris énormément sur le système sensoriel à ses côtés et aussi sur la démarche scientifique. Je suis maintenant mieux outillée afin d’attaquer des problèmes de toutes sortes. Je le remercie également de m’avoir donné la chance d’assister à des congrès scientifiques internationaux sur la neuroscience, qui m’ont permis d’apprécier la diversité de la recherche scientifique.
Je veux dire un grand merci à Maxime Demers, professionnel de recherche dans le laboratoire de Martin, avec qui j’ai travaillé toutes ces années. En plus de m’avoir aidée à la réalisation de chacune des étapes de cette thèse, il a toujours apporté une touche d’humour à notre travail. Nos discussions sur la science et sur la vie en général ont toujours été très intéressantes et divertissantes.
Merci à tous les étudiants qui ont travaillé dans le laboratoire de Martin Deschênes et éga-lement ceux des autres laboratoires du centre de recherche qui m’ont aidée au cours de mon doctorat. Un merci particulier à Hana, Élise, Audrey, Sarah, avec qui j’ai eu beaucoup de plaisir et aussi beaucoup de fous rires.
Je dis un merci très particulier à mes parents qui m’ont supportée tout au long de mes études. Ils ont su m’encourager dans les bons moments comme dans les moments plus difficiles. Et finalement, un énorme merci à Olivier pour son soutien, ses encouragements et sa patience. Il ne faudra jamais oublier que c’est grâce à la science si nous nous sommes rencontrés.
Avant-propos
Cette thèse comporte tout d’abord une introduction sur le système sensoriel des vibrisses des rongeurs afin d’y décrire ses caractéristiques, son importance dans l’exploration de l’environ-nement proximal et son implication dans la fonction motrice. J’aborde également les raisons pour lesquelles les vibrisses sont utilisées comme modèle du système sensoriel. J’expose ensuite deux problématiques et j’émets mes hypothèses.
Les résultats de nos expériences sont présentés dans des chapitres distincts sous la forme de deux articles scientifiques. Le premier chapitre de cette section présente les résultats des expé-riences qui portent sur la première problématique. Comment la préférence directionnelle est-elle formée au PrV ?. Notre hypothèse était la suivante : la préférence directionnelle des cellules de la voie lemniscale du PrV est causée par une inhibition de type « feedforward » provenant du SpVi. Cette hypothèse a été validée par nos résultats.
Les résultats ont été soumis à la revue scientifique Journal of Neuroscience sous la forme d’un article intitulé « Feedforward Inhibition Determines the Angular Tuning of Vibrissal Responses in the Principal Trigeminal Nucleus » le 28 septembre 2009. Après une révision par un comité de lecture spécialisé, l’article a été accepté pour publication le 5 décembre 2009. Le contenu de l’article apparaît dans ce chapitre tel que publié par la revue scientifique.
Pour cet article, dont je suis le premier auteur, j’ai participé à la conception, l’élaboration et la réalisations des expériences. Lors de toutes ces étapes, j’ai travaillé en équipe avec Maxime Demers, professionnel de recherche et Martin Deschênes, directeur de thèse. Pour ce qui de l’analyse et de l’interprétation des résultats, Maxime Demers et moi avons travaillé conjointe-ment avec Martin Deschênes. Ensuite, nous avons tous travaillé à la présentation des résultats sous forme d’un article scientifique, dont l’écriture a été effectué par Martin Deschênes. Le deuxième chapitre de la section des résultats présente la démarche effectuée et les résultats obtenus lors de l’étude de la deuxième problématique. Comment l’information sensorielle change-t-elle la stratégie de l’animal ?Nous avons validé l’hypothèse suivante : une boucle rétroactive sensorimotrice crée la rétraction des vibrisses lors d’un contact et implique les noyaux SpVo et SpVi.
ces résultats à la revue scientifique Neuron. Je suis première auteure pour cet article puisque j’ai participé à la conception, l’élaboration et la réalisations des expériences d’électrophysiologie sur les motoneurones du noyau facial et aussi au marquage rétrograde de ces cellules. Maxime Demers, professionnel de recherche et Martin Deschênes, ont aussi travaillé au succès de ces étapes. Ils ont également réaliser les injections virales dans le SpVir et le Po. Jun Takatoh, qui travaille dans le laboratoire de Fan Wang, a effectué les expériences d’hybridation in situ sur le matériel injecté de Fluorogold dans la partie ventrale latérale du noyau facial. Les injections du virus de la rage ont été faites dans le laboratoire de David Kleinfeld. J’ai travaillé avec Maxime et Martin à la présentation des résultats sous la forme d’un article scientifique. L’écriture a été effectuée par Martin Deschênes et une révision du manuscrit a été effectuée par Fan Wang et David Kleinfeld.
Chapitre 1
Introduction
Pour explorer et découvrir son environnement, l’humain utilise son sens du toucher. Ses doigts munis de mécanorécepteurs tactiles lui permettent de détecter les objets qui l’entourent et de discriminer les formes et les textures. Les informations recueillies lui permettent également de situer son corps dans l’espace et d’engager des commandes motrices pour se déplacer aisément ou faire la préhension d’objets.
Mais comment ces données sensorielles sont-elles captées et décodées par les différentes régions du cerveau ? Chaque étape du processus, soit l’acquisition, l’intégration et le traitement des informations sensorielles, fait intervenir des mécanismes neuronaux encore mal compris à ce jour. L’étude du système sensoriel nécessite un modèle sur lequel une stimulation bien définie crée des effets facilement observables et mesurables. Le système sensoriel des vibrisses des rongeurs comporte des avantages qui en font un modèle tout à fait approprié pour l’étude de ces mécanismes neuronaux.
1.1
Le modèle sensoriel des vibrisses chez les rongeurs
Les souris et les rats sont des animaux nocturnes, actifs dans les environnements sombres et ne possédant pas une bonne vision. Les poils situés de chaque côté de leur museau, appelés vibrisses, sont le principal organe utilisé pour la collecte des informations sensorielles. La survie des rongeurs dépendrait, en majeure partie, de leur sens du toucher. Déjà en 1912, on démontrait que l’habilité d’un rat à circuler dans un labyrinthe dépend de l’utilisation des vibrisses (Vincent, 1912). En 2008, une étude de Diamond et al. confirme que les vibrisses permettent à l’animal de connaître la position des objets, des murs et des planchers. Le système des vibrisses des rongeurs est utilisé comme modèle pour étudier la perception tactile et le toucher actif depuis plus d’un siècle (Richardson, 1909 ; Vincent, 1912).
Le système sensoriel des vibrisses des rongeurs est un bon modèle puisque les vibrisses sont des organes tactiles munis de mécanorécepteurs, dont l’utilité se rapproche de celle des doigts chez
l’humain. Les humains utilisent des stratégies actives pour contrôler la position des surfaces sensorielles tactiles de leurs doigts (Chapman, 1994) et pour réguler la pression avec laquelle les contacts sont faits selon la tâche à effectuer (Smith et al., 2002). Les rongeurs utilisent des stratégies semblables avec leurs vibrisses pour faire la capture de l’information sensorielle. De plus, les rongeurs possèdent une région somatosensorielle de leur néocortex qui est homologue à celle d’un grand nombre de mammifères incluant l’humain (Kaas, 1983). Par conséquent, des comparaisons entre la circuiterie neuronale des rongeurs et des humains sont alors possibles pour comprendre l’intégration de l’information sensorielle. Toute découverte faite grâce au modèle des vibrisses est pertinente pour la compréhension du sens du toucher des mammifères.
1.1.1 Les avantages du modèle : la somatotopie
Le modèle des vibrisses se distingue par l’existence d’une somatotopie, c’est-à-dire d’une repré-sentation du corps, point par point, par des éléments nerveux discrets au sein d’une structure (Clarac et al., 2008). Cette disposition des cellules reflétant l’organisation des vibrisses est pré-sente du tronc cérébral (barrelettes) jusqu’au cortex somatosensoriel (barils) en passant par le thalamus (barillet) et facilite l’étude du système sensoriel chez les rongeurs (Fig.1.1). De plus, le modèle n’étant pas statique, la cinétique des vibrisses permet d’observer les stratégies utilisées par l’animal pour faire l’acquisition des informations sensorielles et aussi d’étudier les programmes moteurs en réponse à des stimuli environnementaux.
Pour mieux comprendre le système sensoriel des vibrisses, cette thèse débute par une introduc-tion portant sur le système des vibrisses, son organisaintroduc-tion, ses voies sensorielles, son système moteur. Ensuite, la première portion porte sur la sélection de l’information sensorielle faite au premier relais de la voie lemniscale. Elle portera davantage sur la perception sensorielle et le triage de l’information au tronc cérébral. On y discutera de la préférence de réponses selon la direction de stimulation des vibrisses. La deuxième partie sera davantage centrée sur le système moteur des vibrisses toujours au tronc cérébral et abordera le sujet de la modulation de l’activité motrice par l’information sensorielle. Les deux études sont étroitement liées par l’importance de l’inhibition autant du côté sensoriel que du côté moteur.
1.2
Les vibrisses
Tous les mammifères possèdent des vibrisses sauf les humains et les mammifères qui pondent des oeufs (monomères ; Chernova, 2006 ; Muchlinski, 2010). Elles sont situées normalement sur la face mais peuvent être sur n’importe quelle partie du corps (Sarko et al., 2011). Chez les rongeurs, ces poils minces et flexibles se retrouvent de chaque côté de leur museau et font entre 15 et 50 millimètres (mm) de long. Ils sont ancrés dans un follicule contenant un sinus veineux et plusieurs récepteurs (Prescott et al., 2011). Ce point d’attachement au niveau de la peau joue le rôle de pivot, ce qui permettra aux vibrisses de défléchir.
Figure 1.1 – L’organisation des vibrisses et les circuits trigéminaux. Les macro- et les microvibrisses sont innervées par la branche infraorbitale du nerf maxillaire (ION). Les cinq rangées de vibrisses (A-E) et les quatre longues vibrisses caudales (α-δ) sont représentées par un code de couleur. Dans le tronc cérébral, les collatérales émergeant des axones des cellules du ganglion trigéminal, innervent le noyau trigéminal pincipal (PrV) et tous les sous-noyaux trigé-minaux spinaux (SpV), où elles forment une organisation spécifique aux vibrisses (barrelettes). Dans le PrV, la carte est inversée, les vibrisses ventrales du museau sont réprésentées dans la partie dorsale du noyau tandis que les poils dorsaux sont représentés ventralement. Les axones trigéminothalamiques du PrV (voie lemniscale) projettent à la partie dorsomédiane du noyau ventral postérieur médian (VPM) dans le thalamus, où les cellules sont organisées (barillets) selon une représentation inversée. Les neurones du SpV projettent au noyau postéromédian (voie paralemniscale) et dans la portion ventrolatérale du VPM (voie extralemniscale, non répresentée). Finalement, les axones thalamocorticaux du VPM projettent au cortex somato-sensoriel primaire (S1) où ils forment les barils. Figure adaptée de Erzurumlu et al. (2010).
1.2.1 L’organisation des vibrisses
Les macrovibrisses sont des poils épais et mobiles qui sont utilisés comme senseurs lors de l’exploration de l’environnement. Elles sont arrangées en cinq rangées (A,B,C,D,E) et plusieurs arcs (1,2,3, etc.). Les rangées dorsales A et B sont composées de quatre vibrisses chacune, tandis que les rangées C à E plus ventrales en comptent sept. Quatre longues vibrisses nommées α, β, γ et δ se retrouvent dans la partie caudale du coussinet facial. Chaque vibrisse est donc identifiée par une combinaison lettre-nombre correspondant à la rangée et l’arc (ex : A3, C4 ; Fig.1). Les souris et les rats possèdent également des petits poils près du nez et aussi dans la région de la gueule que l’on nomme microvibrisses. Ces petits poils orientés vers le bas, sont immobiles et seraient davantage impliqués dans la discrimination fine des textures et des formes (Grant et al., 2012).
1.3
La transmission de l’information sensorielle
1.3.1 Les récepteurs sensorielsLes vibrisses se distinguent des autres poils de l’animal par la grande diversité des terminaisons nerveuses localisées dans un follicule plus large (Diamond, 2010 ; Ebara et al., 2002). Chaque complexe sinus-follicule est innervé par plusieurs nerfs superficiels, soit un seul nerf profond contenant de 150 à 200 fibres myélinisées (Rice et al., 1986 ; Welker et Van der Loos, 1986 ; Crissman et al., 1991) et un certain nombre de fibres non myélinisées à la base du complexe. Les nerfs superficiels et le nerf profond contiennent des fibres Aβ et Aδ principalement. Les fibres myélinisées Aδ regroupent une grande diversité de récepteurs dispersés sur tout l’épiderme du complexe sinus-follicule mais plus concentrés au sinus caverneux (Ebara et al., 2002 ; Sarko et al., 2007). Les fibres myélinisées Aβ plus épaisses se terminent par des cellules de Merkel et des récepteurs lanciformes (Fig.1.2). Chacune des fibres périphériques n’innerve qu’un seul type de récepteurs.
1.3.2 Les cellules de Merkel
On compte de 1500 à 1600 cellules de Merkel par follicule. Elles sont situées à deux endroits dans l’épiderme : au « rete ridge collar » et à la base du sinus (Ebara et al., 2002). Ces récep-teurs détecteraient la direction, l’amplitude et la durée des déflexions des vibrisses (Csillag, 2007). Chez le rat, les cellules de Merkel se retrouvent davantage dans la partie caudale du complexe au niveau du « rete ridge collar » (Fig.2), ce qui suggère que ces cellules transmettent préférentiellement les informations lors de déflexions vers l’arrière (Fundin et al., 1994 ; Ebara et al., 2002). Les cellules de Merkel ont un seuil bas et s’adaptent lentement en réponse à une compression soutenue (Iggo et Muir, 1969 ; Gottschaldt et al. 1973 ; Johansson et al., 1982 a,b ; Johansson et Valbo, 1983).
Figure 1.2 – Représentation schématique de la structure et de l’innervation du complex follicule-sinus chez le chat et le rat.Les chiffres romains à gauche de l’illustra-tion indiquent les zones d’innerval’illustra-tion. I, Rete ridge collar (RRC) : l’épithélium forme un épais RRC à la partie superficielle du complex follicule-sinus (FSC) de la vibrisse, où le follicule est en continu avec l’épiderme. IV, Inner conical body (ICB) : la gaine mésenchymale s’étend pour former le ICB à l’apex du sinus sanguin. VI, Sinus caverneux : la moitié inférieure jusqu’au deux tiers du sinus sanguin vient s’attacher à un tissu conjonctif, appelé sinus caverneux. À la base du follicule, la capsule converge avec le bulbe de la vibrisse pour entourer le sinus. Les chiffres arabes à droite montrent des types spécifiques de terminaisons nerveuses. 2, Les termi-naisons de Merkel sur les cellules de Merkel (ovales blancs) dans l’épiderme du RRC. 4, Petite et fine innervation couvrant la circonférence et des récepteurs lanciformes. 5, Terminaisons de Merkel sur les cellules de Merkel (ovales blancs). 6, Terminaisons lanciformes longitudinales. Figure adaptée de Ebara et al. (2002).
1.3.3 Les récepteurs lanciformes
Chaque follicule contient environ 300 à 350 récepteurs lanciformes localisés au « inner conical body » et à la base du sinus (Ebara et al., 2002 ; Fig.2). Ces récepteurs sont sensibles à la vitesse de déflexion et à la fréquence des vibrations (Csillag, 2007), et ils s’adaptent rapidement aux déplacements (Tuckett, 1978 ; Tuckett et al., 1978).
1.3.4 Le nerf trigéminal
Deux nerfs crâniens innervent les vibrisses, soit le nerf trigéminal et le nerf facial. Le nerf trigéminal constitue le cinquième nerf crânien et est composé à la fois de neurones ayant une fonction sensorielle et d’autres ayant une fonction motrice. Les faisceaux de fibres sensorielles innervant les vibrisses forment la branche infraorbitale du nerf trigéminal. Cette branche se dirige dorsalement pour passer sous la surface ventrale de l’orbite de l’oeil au foramen infraor-bital pour ensuite se fusionner avec les branches motrices et mandibulaires du nerf crânien trijumeau.
1.3.5 Le ganglion trigéminal
Le ganglion trigéminal constitue le lien entre la périphérie et le système nerveux central. Il est situé à la base du crâne et contient tous les corps cellulaires des afférences de la tête et de la face de l’animal. De tous ces neurones, un grand pourcentage représente les macrovibrisses (Gibson et Welker, 1983a, 1983b). Chacune de ces cellules ganglionnaires ne reçoit l’information senso-rielle que d’une seule vibrisse (Kerr et Lysak, 1964 ; Zucker et Welker, 1969 ; Lichtenstein et al., 1990). Le nerf infraorbital ne forme qu’une partie des projections des cellules ganglionnaires, dont l’axone est en forme de T. La seconde portion des axones quitte le nerf trijumeau à la sortie du ganglion et passe par le tractus trigéminal, pour ensuite aller innerver les noyaux du tronc cérébral (Fox, 2008). Les terminaisons axonales projettent dans chacun des noyaux en formant des petits groupes de boutons à l’image d’une échelle, à des intervalles de 150 à 200 microns (µm ; Hayashi, 1980 ; Henderson et Jacquin, 1995, Shortland et al., 1996). Cette disposition des collatérales permet d’envoyer la même information vibrissale à tous les noyaux de la colonne trigéminale (Fig.1.3).
1.3.6 La transduction mécanique
La transduction mécanique a lieu dans le complexe formé par le sinus, le follicule et la vibrisse. La déflexion de la vibrisse transfert de l’énergie mécanique au follicule puisque ce dernier su-bit une contraction ou un étirement (Birdwell et al., 2007). Les canaux ioniques sensibles au mouvement sont alors activés et l’énergie se transforme en dépolarisation par les récepteurs sensoriels. La constriction vasculaire du sinus veineux pourrait également modifier la sensibilité des récepteurs. Ces récepteurs sensoriels sont les terminaisons axonales des cellules ganglion-naires qui forment les afférences primaires. Si la vibrisse ne bouge pas ou n’est pas touchée, la
Figure 1.3 – Reconstructions représentant deux fibres afférentes des vibrisses dans le tronc cérébral.A : Exemple d’une fibre injectée à la horseradish peroxydase (HRP) dont le site d’injection se situe près du noyau spinal oralis (SpVo). La reconstruction s’est faite avec 11 tranches horizontales d’une épaisseur de 150 µm. La branche rostrale s’étend de manière rostro-caudal vers le PrV tandis que les collatérales de la branche rostro-caudale s’étendent médialement. B : Exemple d’une fibre injectée près de l’obex. Cette fibre a été reconstruite à partir de 6 sections horizontales et dessiné du SpVo au noyau spinal caudalis (SpVc). La flèche représente une paire de collatérales qui se superposent. Les terminaisons axones de collatérales voisines montrées en A et en B, ne se superposent pas, excepté pour la paire montrée en B. 5N, nerf trigéminal ; 5ST, tractus spinal trigéminal ; 7N, noyau facial ; MS, noyau trigéminal principal (PrV) ; N.o., noyau trigéminal spinal oralis (SpVo) ; N.i., noyau trigéminal spinal interpolaris (SpVi) ; N.c., noyau trigéminal spinal caudalis (SpVc) ; C1, première vertèbre cervicale. La barre verticale représente 0.5 mm. Figure adaptée de Hayashi, (1980).
Figure 1.4 – Noyaux de la colonne trigéminale. Une coloration à la cytochrome oxydase permet de visualiser la disposition du noyau principal et les sous-noyaux trigéminaux dans le tronc cérébral. À noter que les barrelettes ne sont pas visibles sur une coupe horizontale étant donné leur orientation rostro-caudale. La ligne pointillée rouge délimite la colonne trigéminale. sp5, tractus trigéminal, 7n, nerf facial. Figure adaptée de Henderson et Jacquin, (1995). cellule ganglionnaire est silencieuse (Gibson et Welker, 1983 ; Lichtenstein et al., 1990 ; Leiser et Moxon, 2007).
1.4
Les noyaux du nerf trigéminal
Les noyaux du nerf trigéminal sont divisés en trois parties : le noyau mésencéphalique, le noyau trigéminal pincipal (PrV) et les noyaux trigéminaux spinaux soit l’oralis (SpVo), l’interpolaire (SpVi) et le caudalis (SpVc). Ces noyaux forment le complexe trigéminal et sont disposés en une colonne orientée dans un plan rostrocaudal. Cette colonne est adjacente au lieu de passage des fibres sensorielles, le tractus trigéminal, également orienté selon un plan horizontal (Fig.1.4). Le complex trigéminal s’étend du mésencéphale à la médulla, en passant par le pons. Les noyaux du nerf trigéminal traitent les informations captées par les récepteurs de la tête et la face de l’animal.
Dans le tronc cérébral, on retrouve des agglomérats de cellules en forme de longs cylindres de 1 mm de long et de 60 µm de large, orientés de manière rostro-caudale dans la portion ventrale des noyaux. Ces structures que l’on appelle barrelettes, reflètent la disposition des vibrisses sur le museau de l’animal mais de manière inversée. Elles ne sont visibles que dans quelques noyaux du nerf trigéminal lors d’une coloration à la cytochrome oxydase en plan coronal (Fig.1.5).
1.4.1 Le PrV
Le PrV est localisé dans le pons, médian au tractus trigéminal et latéral au noyau moteur trigéminal (Paxinos, 2014). Il reçoit les entrées sensorielles primaires des mécanorécepteurs de la tête, la face, la gueule et les dents de l’animal et les envoie au thalamus (Paxinos, 2014). Les barrelettes sont discernables dans le PrV (Ma et Woolsey TA., 1984 ; Herderson et Jacquin, 1995) et sont orientés dans un plan dorsoventral (Fox, 2008). Les vibrisses dorsales projettent aux barrelettes ventraux et les vibrisses des arcs les plus caudaux sont représentées latéralement (Ma, 1991 ; Erzurumlu et al., 2010).
Le PrV contient des cellules dont le champ récepteur est restreint à une seule vibrisse et d’autres qui répondent à plusieurs vibrisses. Les premières projettent au noyau ventral pos-teromédian (VPM) du thalamus et forment la voie lemniscale. Les cellules multi-vibrisses projettent au groupe postérieur (Po) et au VPM du thalamus, au tectum, au prétectum, à la zona incerta (ZI), à la partie médiane du noyau genouillé médian, aux collicules supérieurs et au cervelet (Huerta et Frankfurter, 1983 ; Bruce et al., 1987 ; Bennett-Clarke et al., 1992 ; Arends et Jacquin, 1993 ; Veinante et Deschênes, 1999) et forment la deuxième voie lemniscale.
1.4.2 Le SpVo
Le SpVo constitue le premier sous-noyau sensoriel spinal. Le SpVo est le noyau le moins étudié de la colonne trigéminale. Il forme peu de connexions trigéminothalamiques mais les quelques cellules qui projettent au thalamus sont caractérisées par un large soma et un champ récepteur de plusieurs vibrisses (Jacquin et Rhoades, 1990 ; Veinante et al., 2000). Leurs projections se terminent dans la partie la plus postérieure du VPM et du Po (Jacquin et Rhoades, 1990 ; Veinante et al., 2000) devant le prétectum et aussi dans une région thalamique située entre le noyau prétectal et noyau géniculé médian (Deschênes et Urbain, 2009). Les barrelettes ne sont cependant pas discernables dans ce sous-noyau trigéminal.
1.4.3 Le SpVi
En 1989, Phelan et Falls ont remarqué des différences morphologiques entre les cellules de la partie rostrale et celles de la partie caudale du SpVi. Ils l’ont alors divisé en 2 parties : la partie rostrale magnocellulaire (SpVir) composée majoritairement de grosses cellules d’un diamètre
Figure 1.5 – Barrelettes dans les noyaux trigéminaux. A : Les noyaux trigéminaux sensoriels sont orientés selon un axe antéropostérieur. Le PrV est le noyau le plus antérieur et les noyaux trigéminaux spinaux (SpVo, SpVi et SpVc) s’étendent vers la portion caudale du tronc cérébral. Les vibrisses projettent à la partie ventrale des noyaux trigéminaux. Dans le PrV, le SpVc et la partie caudale du SpVi, chaque vibrisse a sa propre région de projection, c’est-à-dire une barrelette. L’orientation des barrelettes des macrovibrisses est représentée sur le schéma. B : Section coronale d’un tronc cérébral d’une souris montrant la localisation des barrelettes dans la partie ventrale du SpVic. Après une coloration à la cytochrome oxydase, les barrelettes apparaissent comme des taches foncées. À noter la somatotopie inversée : les vibrisses dorsales du museau de l’animal projettent aux barrelettes ventrales. Les petites taches foncées situées dorsalement aux barrelettes de la rangée E représentent le champ récepteur des microvibrisses. Figure adaptée de Bosman et al. (2011).
de plus de 20 µm et la partie caudale parvocellulaire (SpVic) avec des cellules d’un diamètre égal ou inférieur à 20 µm (Jacquin et al., 1989).
Le SpVir est composée majoritairement de cellules répondant à plusieurs vibrisses et peuvent avoir un champ récepteur allant jusqu’à quinze vibrisses (Woolston et al., 1982). Les barrelettes ne sont pas visibles dans le SpVir après une coloration à la cytochrome oxydase.
Le SpVic est composé de neurones du circuit local, c’est-à-dire de cellules projetant au sein même du SpVi ou dans la colonne trigéminale. Ces neurones n’ont qu’une seule vibrisse comme champ récepteur (Jacquin et al., 1989). Les barrelettes sont discernables après coloration à la cytochrome oxydase (Ma et Woolsey TA., 1984 ; Herderson et Jacquin, 1995).
1.4.4 Le SpVc
Le noyau SpVc contient des cellules ayant comme champ récepteur plusieurs vibrisses et d’autres cellules qui ne répondent qu’à une seule vibrisse. La représentation des vibrisses est plutôt une image miroir par rapport aux autres noyaux (Fox, 2008) et les barrelettes sont bien visibles dans le plan coronal (Ma et Woolsey TA., 1984 ; Herderson et Jacquin, 1995). Bien que le SpVc reçoive les informations sensorielles par les afférences primaires comme les autres sous-noyaux spinaux, il contient très peu de cellules trigéminothalamiques (Deschênes et Urbain, 2009). Le SpVc projette plutôt aux autres noyaux de la colonne trigéminale (Jacquin et al., 1990). Les informations qui se rendent au thalamus par les autres noyaux trigéminaux sont alors la synthèse des entrées sensorielles périphériques et des entrées du SpVc (Deschênes et Urbain, 2009).
1.5
Les voies somatosensorielles
L’information sensorielle encodée en périphérie est transmise des noyaux trigéminaux, jusqu’au thalamus et ensuite arrive au cortex cérébral pour l’intégration. Il existe au moins quatre voies pour transmettre l’information sensorielle des vibrisses des noyaux trigéminaux au cortex cérébral. Chaque voie concerne différents aspects de la sensation des vibrisses (Yu et al., 2006) lors d’un contact actif ou passif. Ces voies comptent trois neurones pour relayer l’influx nerveux de la périphérie jusqu’au cortex somatosensoriel, soit un neurone du ganglion trigéminal, une cellule trigéminothalamique et un neurone thalamocortical. La décussation de l’influx nerveux a lieu entre le tronc cérébral et le thalamus (Fig.1.6).
1.5.1 La voie lemniscale
La voie lemniscale est la seule voie qui transmet principalement les informations monovibrisse au thalamus et au cortex (Fig.1.6). Elle transmet les informations sensorielles autant lors du toucher que du whisking (Yu et al., 2006).
Figure 1.6 – Représentation schématique des voies trigémino-thalamo-corticales. Les flèches représentent les zones des terminaisons axonales. Dans le cortex cérébral, les cellules postsynaptiques pourraient avoir leur soma dans d’autres couches corticales. L’épaisseur des lignes indique l’importance relative des voies. Les barrillets du VPM ainsi que les barrelettes des noyaux trigéminaux sont représentés selon leur disposition sur des tranches coronales. D, dorsal ; L, latéral ; R, rostral ; LD, noyau latérodorsal du thalamus ; VPMh, région dorsale du VPM ; VPMvl, partie ventrolatérale du VPM ; wM1, cortex moteur des vibrisses ; wS1, partie des vibrisses du cortex primaire sensorimoteur ; wS2, partie des vibrisses du cortex sensorimoteur secondaire. Figure adaptée de Bosman et al. (2011).
La voie lemniscale débute par les cellules du PrV qui ont un petit soma étroit d’environ 20 µm et une arborisation dendritique restreinte à un seul barrelette (Henderson et Jacquin, 1995 ; Lo et al., 1999 ; Veinante et Deschênes, 1999). Ces cellules ne répondent qu’à une seule vibrisse lors d’une anesthésie profonde de l’animal (Friedberg et al., 1999 ; Aguilar et Castro-Alamancos, 2005). Sous anesthésie légère, le PrV et même toute la voie lemniscale est reconnue pour répondre fortement à une vibrisse principale mais aussi faiblement à la stimulation d’une à 5 vibrisses avoisinantes (Armstrong-James et Callahan, 1991 ; Chiaia et al., 1991 ; Diamond et al., 1992 ; Friedberg et al., 1999 ; Minnery et Simons, 2003 ; Minnery et al., 2003 ; Nicolelis et Chapin, 1994 ; Simons et Carvell, 1989). Suite à une déflection des vibrisses, la latence des réponses des cellules du PrV est de 3 à 5 millisecondes (ms). Ce type cellulaire forme la majorité des cellules du PrV (67% ; Veinante et Deschênes, 1999).
Au thalamus, les cellules qui reçoivent les informations de ces cellules trigéminales se situent dans le barillet (structure homologue au barrelette du tronc cérébral) de la vibrisse corres-pondante au niveau du noyau dorso-médian (VPMdm) du thalamus controlatéral (Veinante et Deschênes, 1999 ; Minnery et Simons, 2003). Bien que les axones des cellules trigéminotha-lamiques peuvent couvrir toute la surface d’un barillet, les cellules du VPMdm ne reçoivent l’information sensorielle que d’une ou deux cellules du PrV (Castro-Alamancos, 2002 ; Des-chênes et al., 2003 ; Arsenault et Zhang, 2006). al., 2001). Après la déflexion d’une seule vibrisse, ces cellules de relais du thalamus émettent des potentiels d’action à une courte la-tence d’environ 4 à 8 ms (Ito, 1988 ; Simons et Carvell, 1989 ; Armstrong-James et Callahan, 1991 ; Diamond et al., 1992 ; Brecht et Sakmann, 2002). Ces cellules des barillets projettent ensuite leur axone vers le cortex et aucun branchement local dans le VPM ne se fait, seulement certaines collatérales dans le noyau réticulaire thalamique (Harris, 1987).
Les cellules du thalamus projettent leurs axones au cortex somatosensoriel primaire (S1), qui est la première station corticale pour les informations des vibrisses de la voie lemniscale. Les synapses se font majoritairement dans les barils des couches 3 et 4 et aussi dans la couche 6 (Jensen et Killackey, 1987 ; Pierret et al., 2000 ; Arnold et al, 2001).
1.5.2 La voie lemniscale (2)
En plus des cellules monovibrisses, le PrV contient des cellules multivibrisses qui forment la deuxième voie lemniscale (Fig.1.6). Leur soma multipolaire de plus de 20 µm de diamètre se retrouve entre les barrelettes et leurs dendrites s’étendent sur une distance de 300 à 500 µm (Veinante et Deschênes, 1999). Leur projection axonale peut innerver ensuite le Po, le VPM, le tectum, le prétectum, la ZI, la partie médiane du noyau genouillé médian, les collicules supérieurs et le cervelet (Huerta et Frankfurter, 1983 ; Bruce et al., 1987 ; Bennett-Clarke et al., 1992 ; Arends et Jacquin, 1993 ; Veinante et Deschênes, 1999). Dans le VPM, cette voie implique les cellules multivibrisses situées au niveau de la tête des barillets. Les cellules du centre des barrilets étant monovibrisses sont plutôt reliées à la première voie lemniscale (Urbain
et Deschênes, 2007). Les cellules thalamiques de la deuxième voie lemniscale projettent leur axone dans la région des septa, c’est-à-dire entre les barils de S1 (Furuta et al., 2009).
1.5.3 La voie paralemniscale
La voie paralemniscale concerne la portion magnocellulaire du SpVir, constituée de grosses cellules qui projettent au Po (Fig.1.6). Par contre, avant d’arriver au Po, leurs axones peuvent faire synapse avec des cellules de l’olive inférieure, des noyaux pontins, de la région périrubrale, le collicule supérieur, le noyau prétectal antérieur et la zone incerta (Jacquin et al., 1989). Dans le Po, les terminaisons axonales se situent davantage dans la portion dorso-médiane couvrant le VPM (Lavallée et al., 2005). Les projections des cellules du Po vont ensuite dans plusieurs régions des cortex sensoriel et moteur comme les cortex S1, somatosensoriel secondaire (S2), périrhinal, insulaire et moteur (Deschênes et al., 1998). La grande majorité des terminaisons se retrouvent dans les couches corticales 5a et 1.
1.5.4 La voie extralemniscale
La voie extralemniscale débute dans la partie caudale et parvocellulaire du SpVi (Fig.1.6). Elle sert à transporter les informations sensorielles recueillies lorsque l’animal entre en contact avec des objets (Yu et al., 2006). Cette portion est formée de cellules qui répondent à plusieurs vibrisses et dont le soma fait entre 25 à 30 µm de diamètre (Veinante et al., 2000). Leur axone projette dans la partie ventrolatérale du VPM qui ne possède aucune organisation des cellules reflétant la disposition des vibrisses sur le museau de l’animal. Les ramifications des axones s’étendent dans un axe rostrocaudal sur une région d’environ 100 par 250 µm (Pierret et al., 2000 ; Veinante et al., 2000). La voie extralemniscale se termine au S2 et aussi par des collatérales dans la zone dysgranulaire de S1 (Pierret et al., 2000).
1.6
La sélection de l’information sensorielle : la préférence
directionnelle
Dans le système sensoriel des vibrisses, les neurones sont sensibles à la direction de déflexion de la vibrisse. Cette sensibilité angulaire se retrouve à tous les niveaux de la voie lemniscale. Les cellules du ganglion trigéminal montrent une préférence directionnelle (Lichtenstein et al., 1990) qui peut être expliquée par la disposition des récepteurs dans le follicule de la vibrisse (Ebara et al., 2002).
Au PrV, selon l’indice utilisé par Minnery et Simons (2003), 46% des cellules projettant au VPM présentent un indice de préférence directionnelle de 6 ou 7. Selon cet indice, 0 signifie qu’une cellule est peu sensible à la direction de stimulation de la vibrisse et 7 indique une grande préférence directionnelle. Un ratio, défini par la moyenne des réponses à tous les angles divisé par la réponse du meilleur angle, a également été utilisé pour illustrer la sensibilité des
cellules. Un ratio de 1 signifie que la réponse moyenne de tous les angles est semblable à la meilleure direction, donc qu’il n’y a pas de préférence directionnelle. Une valeur de 0 signifie que la cellule est très sensible à une direction de stimulation. Les neurones du PrV montrent un ratio de 0,58 ± 0,13 (Minnery et al., 2003 ; Fig.1.7), cependant les mécanismes causant cet préférence sont méconnus.
Au deuxième relais, les cellules thalamocorticales montrent une réponse à l’angle préférentiel du double de la valeur moyenne des réponses à tous les angles (Timofeeva et al., 2003). De plus, l’emplacement des cellules dans le VPM est relié à leur préférence angulaire. Les cellules qui répondent plus fortement à une déflexion vers l’avant ou vers le haut sont situées principa-lement dans la partie dorsale des barrilets. Les neurones qui sont plus sensibles à une déflexion vers le bas ou l’arrière, sont généralement localisés dans le centre ou dans la partie ventrale des barrilets.
Au cortex somatosensoriel, la préférence directionnelle est observée chez le rat (Simons, 1978 ; Simons et Carvell, 1989), dans les couches 4 (Bruno et al., 2003) et 2/3 (Andermann et Moore, 2006 ; Kremer et al., 2011). Cette convergence des axones des cellules thalamocorticales donne lieu à une organisation en micro-colonne (300 à 500 µm de diamètre ; Woolsey et Van Der Loos, 1970) dans les barils selon la préférence des angles de déflexion (Bruno et al., 2003). Les cellules répondant de manière préférentielle à une direction qui tend vers des vibrisses voisines, seront représentées dans la portion du baril la plus près du baril de ces vibrisses voisines (Tsytsarev et al., 2010).
1.6.1 L’importance de l’inhibition dans les autres systèmes sensoriels
Un tri des informations sensorielles s’effectue au PrV et cette sélection est préservée à tous les relais de la voie lemniscale. Ce procédé est important dans le système des vibrisses mais aussi dans les autres systèmes sensoriels et on sait que l’inhibition y joue un grand rôle. Dans le cortex auditif, les cellules sont préférentielles à l’intensité des sons et à des fréquences spécifiques. Lorsque l’inhibition est bloquée par la pharmacologie, la préférence des réponses s’élargit (Wehr et Zador, 2003). L’inhibition joue donc un rôle fonctionnel dans la formation du champ récepteur des cellules auditives. Dans le cortex visuel primaire du chat, des antagonistes des récepteurs A de l’acide γ-aminobutyrique (GABAA) peuvent modifier ou même éliminer l’orientation et la sélectivité directionnelle des réponses (Sillito, 1979 ; Sillito et al., 1980 ; Eysel et Shevelev, 1994). Des expériences de désinhibition ont également démontré l’importance de l’inhibition dans la formation de la sélectivité directionnelle au cortex strié (Eysel et al., 1990 ; Crook et al., 1997).
L’inhibition a un rôle fonctionnel en sculptant la structure du champ récepteur et la sélectivité de l’orientation pour qu’ils soient précis et constants dans le temps (Eysel et Shevelev, 1994). L’inhibition bloquerait les entrées excitatrices dans une séquence temporelle précise, ce qui
Figure 1.7 – Préférence directionnelle des cellules du PrV projettant au VPM (n=72) comparativement à celle des cellules ganglionnaires (n=64).Toutes les don-nées montrées en A-C ont été recueillies avec la déflection de la vibrisse principale. A : Distri-bution des fréquences des ratios de préférence directionnelle, défini comme étant [la moyenne des réponses ON (tous les angles)/la réponse ON du meilleur angle]. Les flèches indiquent les classes contenant les valeurs moyennes (ligne pleine = PrV ; ligne pointillée = ganglion). À noter la préférence directionnelle plus forte des cellules ganglionnaires indiquée par des ratios de préférence plus petits. B : Distribution des indices de préférence directionnelle des réponses ON. Un indice de 7 indique une réponse fortement préférentielle à une direction ; 0 indique une préférence de direction faible. C : Tracés polaires de population pivotés et normalisés qui illustrent une préférence directionnelle moins élevée des cellules du PrV projettant au VPM que celle des cellules ganglionnaires. Figure adaptée de Minnery et Simons, (2003).