HAL Id: dumas-01902651
https://dumas.ccsd.cnrs.fr/dumas-01902651
Submitted on 23 Oct 2018HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Distributed under a Creative Commons Attribution - NonCommercial - NoDerivatives| 4.0 International License
Activation du complément : un lien entre l’inflammation
et la régénération parodontale
Loïc Ducroux
To cite this version:
Loïc Ducroux. Activation du complément : un lien entre l’inflammation et la régénération parodontale. Chirurgie. 2018. �dumas-01902651�
ACADEMIE d’AIX-MARSEILLE
Activation du Complément :
un lien entre l’inflammation et la
régénération parodontale
THESE
Présentée et publiquement soutenue devant la
Faculté d’Odontologie de Marseille
(Doyen : Monsieur le Professeur Jacques D
EJOU)
Aix Marseille Université
(Président : Monsieur le Professeur Yvon B
ERLAND)
Le 25 septembre 2018
par
DUCROUX Loïc
né le 14 juin 1989
à MARSEILLE
Pour obtenir le Diplôme d’Etat de Docteur en Chirurgie Dentaire
E
XAMINATEURS DE LAT
HESE:
Président : Monsieur le Professeur
F. BUKIET
Assesseurs : Monsieur le Docteur
P. LAURENT
Monsieur le Docteur
T. GIRAUD
Monsieur le Professeur
I. ABOUT
Invité :
Madame le Docteur
C. JEANNEAU
A notre Président de Jury,
Monsieur le Professeur Frédéric BUKIET
Nous vous remercions de l’honneur que vous nous faites en acceptant de présider ce jury.
Veuillez trouver ici l’expression de notre profonde reconnaissance pour votre disponibilité, votre sérieux et vos conseils tout au long de notre cursus.
Recevez par ce travail le témoignage de notre profond respect et de toute notre estime.
A notre Directeur de Thèse,
Monsieur le Professeur Imad ABOUT
Nous vous remercions de nous avoir fait l’immense honneur d’accepter de diriger cette thèse.
Merci pour vos connaissances, votre bonne humeur et votre patience qui ont grandement contribué à l’élaboration de cette thèse.
Nous vous prions de trouver dans ce travail l’expression de notre profonde gratitude.
A notre Assesseur,
Monsieur le Docteur Patrick LAURENT
Vous nous avez fait l’honneur d’accepter très spontanément de faire partie de ce jury.
Merci pour votre sympathie, votre pédagogie et vos précieux conseils pendant ces années de clinique mais aussi au laboratoire.
Veuillez trouver ici le témoignage de notre sincère estime et de tout notre respect.
A notre Assesseur,
Monsieur le Docteur Thomas GIRAUD
Nous vous remercions de nous faire l’honneur d’avoir accepté de siéger au sein de ce jury malgré la demande tardive.
Merci pour votre disponibilité, votre gentillesse et votre aide lors de nos vacations cliniques qui nous auront été précieuses tout au long de nos études.
Veuillez trouver ici le témoignage de notre profonde gratitude et de tout notre respect.
A notre invité,
Madame le Docteur Charlotte JEANNEAU
Nous vous remercions de l’honneur que vous nous faites d’accepter de siéger au sein de ce jury.
Vous avez, par vos connaissances, votre gentillesse et votre patience, permis le bon déroulement de notre stage au laboratoire ainsi que l’élaboration de cette thèse. Nous vous en serons éternellement reconnaissants.
Merci pour tout ce que vous avez fait pour nous et veuillez trouver ici le témoignage de notre profond respect et de toute notre gratitude.
Table des matières
A.
Introduction
... 1A.I. Le Complément ... 2
A.I.1. Origines des protéines du complément ... 2
A.I.2. Les voies d’activation et mécanismes ... 3
A.I.2.a) Voie classique ... 3
A.I.2.b) Voie des lectines ... 5
A.I.2.c) Voie alterne ... 6
A.I.2.d) Mécanismes communs ... 7
A.I.3. Rôles physiologiques du complément ... 8
A.I.3.a) Médiation de l’inflammation par les anaphylatoxines ... 8
A.I.3.b) Induction de la phagocytose de pathogènes ... 9
A.I.3.c) Lyse directe du pathogène ... 10
A.II. Complément et régénération pulpo-dentinaire ... 12
A.II.1. Principe de la régénération pulpo-dentinaire ... 12
A.II.2. Les acteurs de la régénération pulpo-dentinaire ... 14
A.II.2.a) Signaux de régénération ... 14
A.II.2.b) Cellules souches ... 16
A.II.2.c) Fibroblastes ... 18
A.III. Les lésions parodontales ... 20
A.IV. Objectif : rôle du complément dans la régénération parodontale ... 25
B. Matériel et méthodes ... 25
B.I. Culture de cellules parodontales humaines ... 26
B.II. Tri cellulaire des cellules STRO1+ ... 26
B.III. Caractérisation des cellules par immunofluorescence ... 27
B.IV. Quantification du C5a par test ELISA ... 29
B.V. Statistiques ... 29
C. Résultats ... 30
C.I. Obtention des cellules parodontales humaines ... 30
C.II. Caractérisation des fibroblastes et des cellules souches parodontaux par immunofluorescence ... 30
C.III. Une stimulation au LPS induit la sécrétion du C5a par les fibroblastes parodontaux ... 33
D. Conclusion et discussion ... 34
E. Perspectives ...36
Bibliographie ... I
1
A. Introduction
Le système du complément, découvert au XIXème siècle par Jules Bordet, George
Nuttall et Paul Ehrlich (auquel il doit son nom) est un ensemble de protéines plasmatiques et transmembranaires qui constitue un mécanisme primordial de l’immunité innée. On parle de « cascade » du complément. En effet, la majorité des protéines se trouvent sous la forme de pro-enzymes inactives, l’activation locale d’un petit nombre d’entre elles va provoquer des réactions enzymatiques en chaîne durant lesquelles les pro-enzymes activées vont à leur tour cliver d’autres protéines inactives et les faire passer sous forme active. Ainsi, à partir d’un faible nombre de molécules activées initialement, on obtient rapidement une grande amplification, ce qui explique son efficacité pendant les réactions inflammatoires (1–5).
Le système du complément joue un rôle important dans la défense de l’organisme (4,6,7) :
- Il facilite l’opsonisation des pathogènes par les phagocytes. Il permet d’augmenter la perméabilité vasculaire et le recrutement des cellules immunitaires sur le site lésé.
- Il permet la lyse directe des pathogènes.
En plus d’avoir un rôle important dans l’inflammation, le système du complément est impliqué dans les processus de régénération tissulaire. D’abord mis en évidence au niveau hépatique, cardiaque et osseux (8–12), ce rôle a été démontré récemment dans le cadre de la régénération pulpo-dentinaire. A la suite d’une lésion le système du complément est activé et un gradient chimiotactique d’anaphylatoxine C5a se met en place. Les cellules progénitrices pulpaires, qui expriment le récepteur au C5a (C5aR), vont migrer selon ce gradient depuis leur niche périvasculaires jusqu’au site lésé (13). Nous nous sommes donc demandé si les mêmes mécanismes sont mis en jeu lors d’une lésion parodontale, et si de nouvelles stratégies thérapeutiques peuvent par conséquent être envisagées.
2
A.I. Le Complément
A.I.1. Origines des protéines du complément
La majorité des composants plasmatiques du système du complément est synthétisée par le foie : en effet, celui-ci est la source d’au moins 90% du C3 contenu dans le sérum (14). Cependant, les hépatocytes ne sont pas capables de synthétiser l’ensemble des molécules du complément : le C1q, le FD et la properdine ne sont pas produits par le foie, et le C7 l’est seulement dans de faibles proportions (15,16).
Il existe donc une production extra-hépatique des molécules du complément par des organes, tissus ou cellules de façon constitutive ou en réponse à une stimulation. C’est le cas dans les zones faiblement vascularisées où l’apport plasmatique en molécules du système du complément est insuffisant pour une action efficace, et dans les zones sujettes aux infections qui ont besoin d’activer très rapidement la cascade du complément, par exemple les cellules de la peau ou du tube intestinal (17).
Il a été envisagé que la pulpe dentaire pourrait produire certains éléments du système du complément car elle est très largement sujette aux infections. Une étude récente (18) a révélé que les cellules pulpaires expriment de façon constitutive une très grande partie des molécules du système du complément dont le C1q et le C7. Seuls le C3 et le C6 ne sont synthétisés par les cellules pulpaires qu’à la suite d’une stimulation au LTA (qui permet de mimer in vitro une lésion carieuse par des bactéries Gram +) ou au LPS (qui permet de mimer in vitro une lésion carieuse par des bactéries Gram -). Il est d’autant plus intéressant de noter que ces molécules sont exprimées en intégralité par un seul et unique type cellulaire : les fibroblastes pulpaires, ce qui représente une première. Ces derniers sont une source fonctionnelle de molécules du système du complément : ces molécules peuvent être activées pour aboutir à la formation du complexe d’attaque membranaire et à la production de l’anaphylatoxine C5a. Il existe donc un système d’activation du complément « indépendant » des molécules plasmatiques, qui peut s’expliquer par la situation enclavée de la pulpe dentaire.
3
A.I.2. Les voies d’activation et mécanismes
A.I.2.a) Voie classique
L’activation du complexe C1 du complément marque le point de départ de la voie classique d’activation. Le complexe C1 se compose de trois unités : C1q, C1r et C1s. L’unité C1q se compose de six queues collagéniques terminant par des têtes globulaires. Les unités C1r et C1s (formées chacune de deux molécules) sont attachées au complexe au niveau de ces queues (1,19).
Lors de l’interaction entre un antigène et des IgG1, IgG2, IgG3 ou IgM se forme ce que l’on appelle un complexe immun : le site de fixation pour les têtes globulaires de C1q initialement masqué va alors être révélé à la suite du changement de conformation de la fraction constante des anticorps (20). On assiste à un changement de conformation de C1 lorsqu’au moins deux têtes globulaires se retrouvent liées à un complexe immun : la pro-enzyme C1r va s’activer, puis à son tour cliver et activer l’unité C1s qui a une activité sérine protéase (1).
Le C4 va ensuite être clivé par la forme active du C1s pour donner le fragment C4a qui sera libéré dans l’environnement, et le fragment C4b qui va venir se fixer à la membrane du pathogène. Le C2 va être recruté au niveau de C1s et C4b pour être clivé par C1s en deux fragments : le C2b sera libéré dans l’environnement, et le C2a formera avec C4b la C3-convertase (également appelée C4b2a) (figure 1). Le site protéolytique de cette dernière se situe au niveau du C2a (2,3,7,19).
4
Figure 1 : Voie classique d'activation du système du complément (21)
La voie classique peut toutefois aussi être activée, en l’absence de complexe immuns, par :
- Une interaction directe du C1q aux PAMPS (Pathogen-Associated Molecular Patterns) situés sur des cibles pathogéniques comme les lipopolysaccharides (LPS), l’enveloppe protéique de certains rétrovirus, les porines de bactéries Gram- (22,23).
- Les membranes des cellules apoptotiques et nécrotiques via l’exposition des phosphatidylsérines (24–26).
- Des biomatériaux, le contact avec le sang entraînant une surface « modifiée » reconnue par le C1 (27–30).
5 A.I.2.b) Voie des lectines
A l’inverse de la voie classique, la présence d’anticorps n’est pas requise pour l’activation de la voie des lectines. Cette voie constitue l’une des premières réponses de l’immunité innée. Deux membres de la famille des collectines, semblables au C1q (1), vont permettre la reconnaissance des membranes des pathogènes : il s’agit de MBL (Mannan-Binding Lectin) et des ficolines (L, H ou M) (31).
Deux MBL-associated serine protease (MASP-1 et MASP-2), protéases homologues à C1r et C1s, vont se lier avec ces oligomères (32–36). La MBL et la ficoline vont venir se fixer au niveau des carbohydrates de de la paroi du pathogène respectivement sur le mannose ou les protéines glycosylées (pour MBL) et N-acétylglucosamine (GlcNAc) ou galactose (pour ficoline). MASP-1 et 2 vont ensuite cliver les molécules de C4 recrutées au niveau de la MBL et de la ficoline en C4a et C4b. C4a sera libéré dans l’environnement, et C4b va se fixer à la surface du pathogène. Enfin, les molécules de C2 recrutées vont subir un clivage enzymatique en C2a et C2b par les MASP-1 et 2. Le C2a va s’associer au C4b pour former la C3-convertase (C4b2a), alors que le C2b sera libéré dans l’environnement (3,31,33) (figure 2).
6
Figure 2 : Voie des lectines (21)
A.I.2.c) Voie alterne
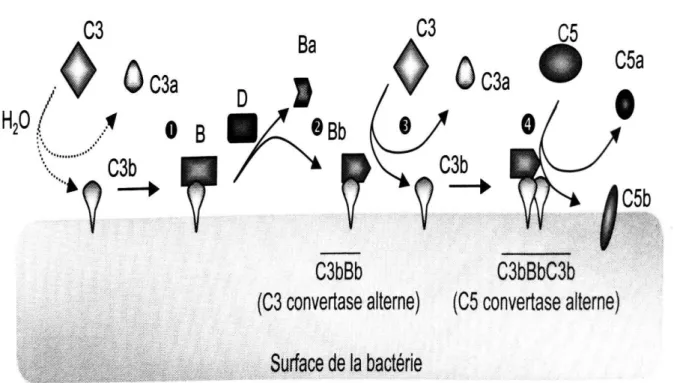
Deux protéines plasmatiques ayant une activité sérine protéase, le facteur B (FB) et le facteur D (FD), vont jouer un rôle important dans la troisième voie d’activation du système du complément, la voie alterne.
La voie alterne débute par l’hydrolyse spontanée du C3 en C3(H2O). La formation de la pro-convertase C3(H2O)B par liaison au FB va engendrer un changement de conformation et permettre la liaison avec le FD. Une fois lié au complexe C3(H2O)B, le FD va cliver le FB et libérer le fragment Ba (37) avant d’être lui-même libéré dans l’environnement. La C3-convertase C3(H2O)Bb ainsi obtenue (38) va, lorsqu’elle rencontre du C3, cliver ce dernier en deux fragments bioactifs C3a et C3b : le C3a est libéré dans l’environnement, et le C3b va se fixer aux membranes des pathogènes ou de l’hôte. Une fois fixé à ces surfaces, le C3b va suivre la même séquence que le
7 C3(H2O) : liaison au FB puis au FD afin de former la C3-convertase C3bBb. En l’absence de surfaces activatrices, les C3-convertases vont se dissocier et se dégrader rapidement en raison de leur demi-vie de courte durée. Cette voie constitue une boucle d’amplification de l’activation du complément en raison de la capacité du FB à se lier à la fois à C3(H2O) et au fragment actif C3b (2,3) (figure 3).
Figure 3 : Voie alterne (21)
A.I.2.d) Mécanismes communs
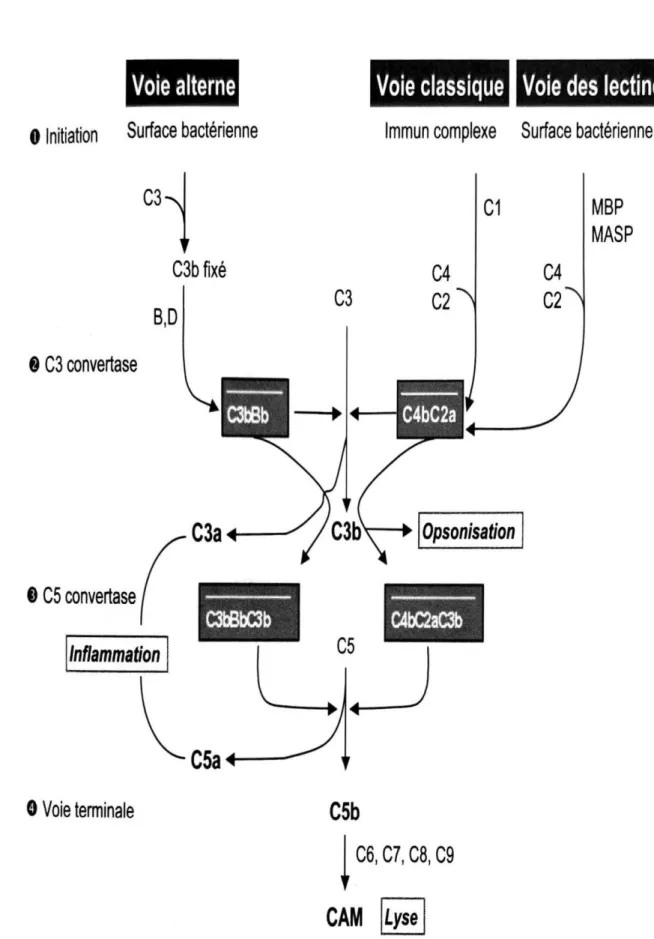
Les trois voies d’activation précédemment citées conduisent toutes au clivage du C3 par les C3-convertases : C4b2a pour la voie classique et des lectines et C3bBb pour la voie alterne. Celles-ci permettent le clivage du C3 en deux fragments bioactifs C3a et C3b : C3a est libéré dans le plasma et C3b va venir se fixer à la membrane des pathogènes pour ensuite s’associer aux C3-convertases membranaires (C4b2a ou C3bBb) pour former les C5-convertases C4b2a3b ou C3bBb3b (1).
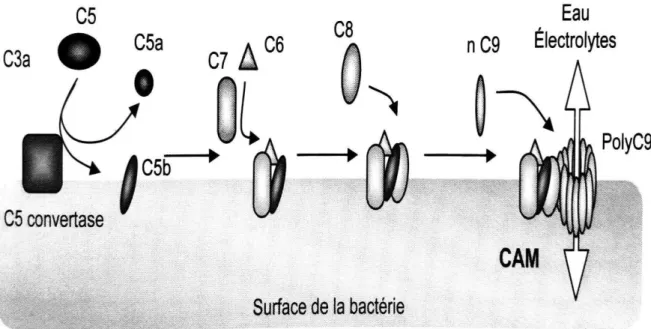
Les C5-convertases ainsi formées vont, de la même manière que les C3-convertases pour le C3, cliver le C5 en deux fragments bioactifs : C5a et C5b. Lors de ce clivage, le C5a est libéré dans le plasma alors que le C5b se fixe aux membranes des pathogènes. L’élément C6 va ensuite se fixer au C5b pour former un complexe hydrophile appelé
8 C5bC6. Un changement de conformation se produit ensuite après la fixation de la molécule C7 à ce complexe et au cours de cette modification, l’élément C8 (glycoprotéine composée d’un hétérodimère C8α-C8γ dont les sous-unités sont reliées entre elles par la chaîne C8β) va se fixer au complexe par la sous-unité C8β et l’hétérodimère C8α-C8γ va pénétrer dans la bicouche lipidique de la membrane du pathogène. Enfin, un pore transmembranaire de 100 angströms va être formé à la membrane des agents pathogènes à la suite du recrutement de 10 à 15 protéines C9 qui vont s’associer en cylindre au niveau du complexe (2,39). On appelle complexe d’attaque membranaire (CAM ou C5b-9) l’association de ces composants C5b, C6, C7, C8 et C9. L’activation d’une seule C3-convertase peut générer plus de 1000 CAM. Cependant, il existe une voie d’activation du système du complément indépendante du C3. En effet, des sérines protéases de la coagulation, telles que la thrombine, les facteurs FXa et FXIa, ou de la fibrinolyse comme la plasmine, peuvent cliver le C5 pour générer un C5a actif (19,40,41) et ainsi se substituer aux C5-convertases C4b2a3b et C3bBb3b. Ce C5a généré par le système de la coagulation a des propriétés biologiques identiques au C5a produit par les trois voies principales d’activation du complément. Les sérines protéases (ou facteurs de coagulation) issues de cette cascade de coagulation permettent donc d’activer le système du complément même en l’absence de C3 (19,40–42).
A.I.3. Rôles physiologiques du complément
A.I.3.a) Médiation de l’inflammation par les anaphylatoxines
Les fragments bioactifs C3a, C4a et C5a obtenus au cours de l’activation du système du complément sont appelés anaphylatoxines. Alors que le rôle du C4a est encore mal connu, le C3a et le C5a vont avoir un rôle prépondérant dans l’initiation locale du processus inflammatoire par l’interaction avec leurs récepteurs spécifiques (respectivement C3aR et C5aR) qui peut avoir lieu à plusieurs niveaux.
Ces anaphylatoxines vont entraîner une contraction des muscles lisses (43) et permettre d’augmenter la perméabilité vasculaire (44–46) de deux manières :
- Par la formation de fibres de stress au sein des cellules endothéliales à la suite de l’interaction de C3a et C5a avec leurs récepteurs spécifiques.
- En induisant une vasodilatation par le relargage d’histamine et de TNF-α par les mastocytes et les basophiles (47).
9 De plus, ces anaphylatoxines vont faciliter la migration des cellules immunitaires du compartiment sanguin au compartiment tissulaire :
- Le C3a va permettre l’induction du rolling des éosinophiles en réduisant l’expression des L-sélectines.
- Le C5a va induire l’extravasation des éosinophiles et des neutrophiles en plus de leur rolling (48,49) en réduisant l’expression des L-sélectines mais aussi en
augmentant l’expression des intégrines (αMβ2) (50).
Enfin, les anaphylatoxines possèdent un fort pouvoir chimioattractant : l’activation locale du système du complément va entraîner la formation d’un gradient d’anaphylatoxines qui va faire migrer les cellules exprimant leurs récepteurs en direction du site d’activation du complément (51). Parmi ces cellules, on retrouve de nombreuses cellules immunitaires dont les macrophages, les neutrophiles (52), les cellules B et T activées (53,54), les basophiles (55) et les mastocytes (56), mais aussi les cellules progénitrices de la pulpe dentaire (13).
A.I.3.b) Induction de la phagocytose de pathogènes
L’induction de l’élimination de pathogènes par les cellules phagocytaires est la première des fonctions du système du complément à avoir été découverte. Les opsonines C3b et C4b capables de se fixer à la surface des pathogènes vont être reconnues spécifiquement par les cellules phagocytaires qui présentent à leur surface des récepteurs du complément (CR) comme le CR1 (CD35). Il est important de noter que le C4b étant produit dans une moindre mesure, son rôle dans l’opsonisation est moins important que celui du C3b. D’autres médiateurs, comme le C5a et le C3a, doivent toutefois entrer en jeu en complément de cette interaction entre CR1 et C3b ou C4b afin d’entraîner l’activation des macrophages et ainsi la phagocytose des pathogènes liés aux récepteurs CR1 (57–60). La présence de récepteurs spécifiques au C5a (C5aR) et C3a (C3aR) à la surface des macrophages va permettre, une fois liés à leurs anaphylatoxines respectives, l’induction d’un signal de phagocytose.
Le déroulement de cette phagocytose peut être résumé ainsi :
- Le système du complément est activé par la présence de pathogènes dans l’organisme
10 - Les opsonines C3b et C4b vont venir s’insérer dans la membrane des pathogènes et la production locale de C3a et C5a va permettre le recrutement de cellules phagocytaires exprimant C3aR et C5aR sur le site infecté
- Les pathogènes vont être reconnus par les CR des cellules phagocytaires et dans le même temps les anaphylatoxines vont interagir avec leur récepteur, tout ceci entraînant l’endocytose de ces pathogènes
- À la suite de cette endocytose, des phagosomes se forment et leur fusion avec des lysosomes va former des phagolysosomes, entraînant ainsi la lyse des pathogènes
A.I.3.c) Lyse directe du pathogène
Le complexe d’attaque membranaire (C5b-9), produit final de la cascade d’activation du complément, va permettre la lyse directe des pathogènes. Les composants C9 des complexes d’attaque membranaires vont former des pores d’environ 100 angströms dans la membrane des pathogènes ciblés, et le nombre et le diamètre important de ces pores vont alors perturber les gradients d’eau, d’ions de solutés et de lysosomes entre les milieux intra et extracellulaires. Le déséquilibre osmotique ainsi créé entraîne la destruction du pathogène (1,61) (figures 4 et 5).
11
12
A.II. Complément et régénération pulpo-dentinaire
A.II.1. Principe de la régénération pulpo-dentinaire
La dent est constituée de l’émail, la dentine, la pulpe et le cément. La pulpe, tissu conjonctif hautement vascularisé et innervé est isolée du milieu extérieur par la dentine, tissu minéralisé sécrété par les odontoblastes pulpaires. Cependant, la dentine est perméable en raison de la présence de tubulis dentinaires en son sein qui permettent aux prolongements odontoblastiques de réagir aux stimuli externes (chimiques, physiques ou thermiques). En raison de la grande proximité entre dentine et pulpe, elles sont souvent réunies sous le terme de complexe pulpo-dentinaire. Ce complexe est recouvert par l’émail au niveau coronaire et par le cément au niveau radiculaire. Toutefois, la protection offerte par ces structures n’est pas parfaite, et certains évènements peuvent affaiblir cette barrière, entraîner le contact direct entre le complexe pulpo-dentinaire et la cavité buccale et activer le système du complément :
- Une lésion carieuse : la sécrétion d’acides et protéases va entraîner la destruction de la barrière protectrice par dissolution tout d’abord de l’émail puis de la dentine et ainsi faciliter le développement des bactéries. Cette déminéralisation de l’émail et de la dentine est nécessaire à toute invasion bactérienne au cours d’une lésion carieuse (62). L’adhésion aux tissus dentaires est facilitée par la présence d’adhésines à la surface des pathogènes, comme les antigènes I et II responsables de l’adhésion des streptocoques oraux au collagène de la dentine. La structure de la dentine organisée en milliers de tubuli de gros diamètres (au moins 0,9 µm) permet aux bactéries présentes dans la cavité buccale de migrer facilement à travers la dentine jusqu’à la pulpe (63). Les bactéries (majoritairement Gram+) va activer le système du complément au niveau des trois voies : classique, des lectines et alterne (64,65).
- Au cours d’un trauma mécanique : les cellules nécrotiques et apoptotiques formées vont voir leurs membranes modifiées via les phosphatidylsérines, permettant ainsi l’activation de la voie classique du système du complément (24–26,66,67)
13 - Lors d’une procédure de restauration : le praticien utilise des biomatériaux qui vont entraîner la formation d’une « surface modifiée », présentant des groupements libres OH, NH3, COOH mais aussi Ni+ et CO2, et activer ainsi la voie classique du système du complément (27–30,68)
Face à ces différents évènements, le complexe pulpo-dentinaire va mettre en œuvre plusieurs moyens de défense selon l’intensité et la profondeur de la lésion. Le début du processus de régénération pulpo-dentinaire ne sera possible que si la réponse inflammatoire est limitée, car si cette dernière est trop importante, le tissu affecté entrera dans une phase de nécrose : le contrôle de l’inflammation est un prérequis à la régénération. On va distinguer deux cas selon la sévérité de la lésion carieuse.
Dans le cas d’une lésion peu profonde (en l’absence d’atteinte pulpaire), une dentine réactionnelle fortement minéralisée va être sécrétée par les odontoblastes afin d’empêcher la progression des bactéries, bloquer leurs toxines et ainsi protéger la pulpe (69).
Cependant, dans le cas où la lésion n’est pas traitée et progresse, la pulpe sera atteinte. Les odontoblastes situés en première ligne vont être détruits, les fibroblastes, vaisseaux sanguins et nerfs pourront l’être également. En réponse à cette destruction, des odontoblastes de deuxième génération, appelés odontoblastes-like, vont venir remplacer les odontoblastes lésés. Ceux-ci vont synthétiser une dentine appelée dentine réparatrice capable de protéger à nouveau la pulpe par la formation d’un pont dentinaire (70–73). Ces odontoblastes-like proviennent du recrutement et de la différentiation des cellules souches pulpaires jusqu’au site lésé (74,75).
14
A.II.2. Les acteurs de la régénération pulpo-dentinaire
Différents acteurs jouent un rôle primordial dans le processus de régénération pulpo-dentinaire : les signaux de régénération, les cellules souches, et les fibroblastes.
A.II.2.a) Signaux de régénération
On connaît actuellement trois sources pour les signaux participant à la régénération pulpo-dentinaire :
- La dentine
- Les cellules pulpaires
- L’activation du système du complément
• La dentine est la première source identifiée de molécules capables d’induire le processus de régénération pulpo-dentinaire (76). La dentine renferme de nombreux facteurs de croissances tels que :
- Le TGFβ1 (77) et le FGF2. Le TGFβ1 est séquestré sous forme inactive au sein de la dentine puis passe sous forme active lors de sa libération après dissolution acide de cette dernière à la suite d’une lésion carieuse. C’est un inducteur de la migration et de la différenciation des cellules souches pulpaires en odontoblastes-like (78). Le FGF-2 (Fibroblast Growth Factor) peut être libéré de la dentine par des héparanases ou la plasmine (79). C’est un facteur pro-angiogénique et qui induit la prolifération des fibroblastes des tissus conjonctifs (80,81). Une étude récente, au cours de laquelle FGF-2 et TGFβ1 ont été encapsulés dans des billes de polymère biodégradables permettant leur libération contrôlée, TGFβ1 induit la migration des cellules progénitrices pulpaires STRO-1+, tandis que FGF-2 induit la prolifération des fibroblastes pulpaires (82).
- Le VEGF (Vascular Endothelial Growth Factor) est responsable de la prolifération et de la migration des cellules endothéliales (83,84).
15 - Les composants de la matrice extracellulaire (collagène-I, collagène-IV, laminine, fibronectine) ainsi que les facteurs de croissance Sphingosine 1-phosphate (S1P) et EGF induisent la migration des cellules souches de la pulpe dentaire (principalement grâce à S1P et la laminine) par chimiotactisme (85).
Il est important de noter que la solubilisation de la dentine n’est pas nécessairement due à une lésion carieuse : elle peut également être la conséquence de procédures de restauration réalisées par le praticien, ce qui aboutira de la même manière à une induction du processus de régénération pulpo-dentinaire (85).
Ainsi, la libération de facteurs de croissance de la dentine provoquée par une infection carieuse et la procédure de restauration qui en découle va constituer un véritable signal pour le recrutement spécifique et l’activation des cellules souches/progénitrices au niveau des niches pulpaires et leur migration jusqu’au site affecté.
• Une deuxième source de signaux de régénération a été établie après l’observation de formation de tissus minéralisés, en l’absence de dissolution dentinaire, à la suite d’une lésion traumatique. Il s’agit de la pulpe dentaire, principalement dû à l’activité sécrétoire des fibroblastes et des cellules endothéliales pulpaires :
- In vitro, la sécrétion du FGF-2, VEGF et PDGF par les fibroblastes pulpaires humains et la sécrétion de VEGF et FGF par les cellules endothéliales sont significativement augmentées plusieurs heures après une lésion (86,87). Cette modification du microenvironnement local par la sécrétion de facteurs de croissance a donc pour origine la lésion elle-même.
- In vivo, Le FGF-2 stimule la prolifération de cellules pulpaires de dent immature de rat et induit la production de calcium minéralisé dans un modèle de culture en trois dimensions (collagène de type 1) de cellules pulpaires, et l’implication de FGF, TGFβ1 et BMP dans le processus de régénération pulpo-dentinaire a été démontrée par leur application directe sur la pulpe dentaire (82,88–90).
16 • La source de signaux de régénération la plus récemment découverte est l’activation du système du complément. En effet, il est connu que le C5a induit, via le C5aR, le recrutement de cellules souches mésenchymateuses à travers une phosphorylation prolongée de ERK1/2 (91). De plus, les cellules souches pulpaires STRO-1+, capables de se différentier en odontoblast-like et de sécréter de la matrice dentinaire (92,93), expriment C5aR, le récepteur actif du C5a. Une étude a démontré que le C5aR exprimé par les cellules souches pulpaire interagit de façon spécifique avec le C5a, et que ces cellules vont migrer en direction du site lésé selon un gradient de C5a (13). La migration de cellules souches pulpaires est primordiale au processus de régénération pulpo-dentinaire (74,75,94). La mise en place de ce gradient par diffusion et interaction avec les molécules matricielles et membranaires (notamment les glycanes et protéoglycanes) est possible grâce à l’activation localisée extrêmement rapide et amplifiée du système du complément (1). Plus récemment, le rôle de l’anaphylatoxine C3a a été étudié, et il a été démontré qu’en tant que premier fragment libéré lors de l’activation du système du complément, le C3a va induire la prolifération des cellules souches et des fibroblastes pulpaires, ainsi que la migration de ces derniers suivant un gradient de C3a tandis que les cellules souches ne suivront pas ce gradient (95). Ainsi, lors d’une agression de la pulpe (que ce soit à la suite d’une carie, d’un traumatisme ou de la mise en place d’un biomatériau), le système du complément va être activé localement. Cette activation va tout d’abord libérer du C3a qui va entraîner la prolifération des fibroblastes et des cellules progénitrices pulpaires, puis va aboutir à la mise en place d’un gradient de C5a au niveau du tissu pulpaire, et les cellules progénitrices pulpaires STRO-1 exprimant le C5aR (récepteur spécifique du C5a) vont alors migrer depuis leur niche périvasculaire jusqu’au site lésé afin de régénérer le complexe pulpo-dentinaire. Il y a donc un lien fort entre inflammation et régénération, car l’activation du système du complément constitue un signal de régénération.
A.II.2.b) Cellules souches
Les cellules souches, découvertes en 1909 par Alexander Maximow, sont des cellules indifférenciées capables de proliférer et pouvant être à l’origine de lignées cellulaires différenciées. Il existe deux catégories de cellules souches : les cellules souches embryonnaires et les cellules souches adultes. Les cellules souches embryonnaires, issues de la masse cellulaire interne de l’embryon au stade blastocyste, sont
17 pluripotentes (elles sont capables de donner tous les types cellulaires sauf les annexes embryonnaires) tandis que les cellules souches adultes sont multipotentes (capables de donner différents types cellulaires spécifiques d’un lignage donné) (96). Il y a deux types de cellules souches adultes : les cellules souches parenchymateuses qui vont générer les tissus non-conjonctifs, et les cellules souches mésenchymateuses qui vont générer tous les tissus conjonctifs (97,98). Les cellules souches, qu’elles soient embryonnaires ou adultes, sont capables d’empêcher leur différenciation et de rester à l’état de cellules souches.
Il existe deux principales caractéristiques permettant ce maintien :
- L’expression de facteurs de transcription appelés facteurs de pluripotentialité, les trois principaux sont : SOX2, OCT4 et NANOG. Chacun des facteurs de pluripotentialité va également réguler l’expression des autres, ainsi c’est l’ensemble de ces fines régulations qui va maintenir les cellules dans leur état de cellules souches (99–102)
- La régulation des mécanismes épigénétiques et notamment la méthylation de la chromatine bloque l’expression de certains gènes : en effet, 60% de l’ADN des cellules différenciées est méthylé, contre 3% chez les cellules souches embryonnaires (103–106)
Les cellules souches dentaires ont plusieurs sources : la pulpe (107), la papille apicale (108), le ligament parodontal (109) ou les follicules dentaires (110). Les cellules souches pulpaires, situées au niveau de niches périvasculaires, vont participer à la régénération du tissu pulpaire après une lésion (74,75,111). Les cellules souches pulpaires vont exprimer des marqueurs de surface spécifiques de cellules souches mésenchymateuses : STRO-1 (74), CD146, CD105, CD44, 3G5, CD29, E2F2, PTTG1, TWIST-1, SSEA4, FIk1, EphB, Nestin, LANGFR (Low Affinity Nerve Growth Factor Receptor).
Des études réalisées in vitro ont montré la pluripotentialité des cellules souches pulpaires, indispensable au processus de régénération. Mais la dépendance à l’environnement de la différenciation des cellules souches a aussi été étudiée in vivo :
18 - Par transplantation dans un modèle de souris, les cellules progénitrices pulpaires conduisent à une régénération osseuse dans un contexte de défaut osseux (112)
- Dans un modèle d’ischémie des membres postérieurs de souris, l’injection de
cellules progénitrices CD34+/VEGFR2+/CD31-/CD146- aboutit au
rétablissement du flux sanguin et de la vascularisation en 7 jours (111)
- La transplantation de ces mêmes cellules, associées à un scaffold collagénique (type I et III) dans des dents ayant subi des pulpotomies permet la formation d’un tissu pulpaire contenant des capillaires en 14 jours (94)
- La transplantation d’un mélange de cellules souches STRO-1+ et de β-TCP en sous-cutané chez des souris immunodéprimées aboutit à la formation d’un tissu similaire à un complexe pulpo-dentinaire (92,93)
Ces données confirment bien la pluripotentialité des cellules souches pulpaires : le type cellulaire auquel aboutira leur différenciation dépendra des signaux reçus de l’environnement. Au niveau dentaire, les cellules souches pulpaires STRO1+ vont être capables de générer un tissu ressemblant à un complexe pulpo-dentinaire en se différenciant en odontoblastes, ce qui montre leur rôle clé dans le processus de régénération pulpo-dentinaire.
A.II.2.c) Fibroblastes
Les fibroblastes pulpaires sont des cellules de structure responsables de la synthèse
et du renouvellement continu de la matrice extracellulaire. Elles forment un réseau continu de cellules reliées entre elles par des jonctions intercellulaires et représentent la population cellulaire majoritaire dans le tissu pulpaire. Alors que l’on pensait leur rôle dans la régénération pulpo-dentinaire limité à la sécrétion de facteurs de croissance (FGF-2, VEGF et PDGF), les fibroblastes pulpaires ont été identifiés comme les premières cellules non-immunitaires à être capables de produire et d’activer efficacement leurs propres composants du système du complément, indépendamment du plasma. En effet, après stimulation au LTA (constituant des parois des bactéries Gram +) ou au LPS (constituant des parois des bactéries Gram -), les fibroblastes pulpaires vont sécréter l’ensemble des constituants du système du complément pour aboutir aux anaphylatoxines C3a et C5a et au complexe d’attaque membranaire C5b-9 (produit final de cette cascade de réactions enzymatiques) (13,18). Le fragment C3a va
19 entraîner la prolifération des fibroblastes et des cellules progénitrices pulpaires, mais également la migration de ces fibroblastes selon un gradient de C3a après interaction spécifique avec C3aR (récepteur spécifique du C3a exprimé par les fibroblastes) (95). Ainsi, l’activation du complément est impliquée simultanément dans l’initiation du processus de régénération (par la production d’anaphylatoxines) et le contrôle de l’inflammation (par la formation de complexe d’attaque membranaire). De plus, il a été démontré que les bactéries cariogènes Streptococcus mutans et Streptococcus sanguinis stimulent la synthèse locale de complément par les fibroblastes pulpaires, ce qui aboutit à la formation d’un complexe d’attaque membranaire fonctionnel et donc à la destruction de ces bactéries (113). Cette inhibition de la prolifération des bactéries cariogènes est un prérequis à la régénération pulpo-dentinaire : elle va entraîner une diminution de l’inflammation pulpaire, ce qui permettra au tissu pulpaire restant de synthétiser une dentine réparatrice. Ceci permet d’expliquer la présence d’une régénération dentinaire directement sous les lésions carieuses et donc l’existence de caries arrêtées. Les fibroblastes pulpaires ont donc un rôle de protection et de défense de la pulpe via l’activation du complément.
Plus récemment, le rôle des fibroblastes pulpaires dans la régénération nerveuse de la pulpe a été étudié. En effet, cette régénération est un prérequis indispensable à une régénération pulpo-dentinaire efficace (114). Lors d’une atteinte carieuse profonde, les fibroblastes situés à proximité du site lésé vont non seulement sécréter du C5a, mais également exprimer C5aR, et c’est l’interaction entre ces deux éléments qui va induire une croissance neuritique via la modulation du BDNF (Brain-Derived Neurotrophic Factor) (115). En effet, ce dernier est un inducteur majeur de cette croissance neuritique grâce à son récepteur TrkB (116,117). Le C5aR fonctionne comme un régulateur positif de la sécrétion de BDNF et cette modulation joue un rôle direct dans la croissance nerveuse régénérative en direction du site lésé. Il s’agit du premier mécanisme de régénération pulpo-dentinaire reliant les fibroblastes pulpaires au bourgeonnement neuronal. La sécrétion de NGF (Nerve Growth Factor) par les fibroblastes pulpaires sera elle, au contraire, régulée négativement par le C5aR. Mais malgré cela, le NGF est impliqué dans le contrôle de la longueur de la croissance neuritique en direction du site lésé (118). Ainsi, le C5a pourrait à la fois être l’un des premiers signaux dans le bourgeonnement nerveux dentaire à la suite d’une carie et contrôler la régénération nerveuse en induisant la production locale de neurotrophines.
20
A.III. Les lésions parodontales
On appelle parodonte l’ensemble des tissus de soutien de la dent, il comprend : - L’os alvéolaire
- Le ligament parodontal (ou desmodonte ou ligament desmodontal ou ligament alvéolo-dentaire) reliant les dents aux maxillaires par des fibres insérées dans le cément et l’os alvéolaire
- La gencive comprenant gencive libre, gencive attachée, muqueuse alvéolaire et papille gingivale
- Le cément
- Des éléments nerveux et sanguins
Selon l’ANAES, les maladies parodontales ou parodontopathies peuvent être définies comme des maladies infectieuses multifactorielles. Elles sont caractérisées par des symptômes et signes cliniques qui peuvent inclure une inflammation visible ou non, des saignements gingivaux spontanés ou provoqués d’importance variable, la formation de poches en rapport avec des pertes d'attache et d'os alvéolaire, une mobilité dentaire et peuvent conduire à des pertes de dents. Elles sont dues à un déséquilibre entre les défenses de l’hôte et les agressions bactériennes survenant lorsque plusieurs facteurs sont réunis : présence de bactéries parodontopathogènes, absence de bactéries protectrices, environnement buccal défavorable, système immunitaire passif (119,120).
On peut distinguer deux principaux types d’atteintes parodontales :
- Les gingivites : atteintes réversibles du parodonte superficiel, très souvent liées à l’accumulation de plaque dentaire, leur traitement simple permet un retour à l’état initial sans séquelle pour le parodonte
- Les parodontites : atteintes irréversibles du parodonte profond provoquant la destruction du cément, de l’os alvéolaire et du ligament parodontal et entraînant ainsi une perte d’attache de la dent, elles aboutissent à des mobilités dentaires et parfois la perte de la dent si elles ne sont pas traitées ; elles peuvent être agressives ou chroniques, localisées ou généralisées
21 L’objectif des traitements des atteintes parodontales est d’obtenir une cicatrisation parodontale, qui peut être de deux sortes :
- Réparation : elle est définie comme l’ensemble des processus biologiques et cellulaires qui aboutissent au rétablissement de la continuité d’un tissu sans toutefois reconstituer l’architecture et la fonction (120)
- Régénération : processus biologique entraînant la reformation ad integrum de tous les composants du tissu lésé, restaurant ainsi son architecture et sa fonction (121)
En fonction du type de cellules (cellules épithéliales, cellules provenant du tissu conjonctif gingival, cellules osseuses ou cellules du ligament alvéolo-dentaire) qui va migrer le plus rapidement au niveau du site de cicatrisation, différents types de nouvelles attaches peuvent se former (122) :
- L’épithélium jonctionnel long : les cellules épithéliales empêchent la régénération de l’attache car ces cellules n’ont pas la capacité de régénérer le parodonte ; il s’agit donc d’une cicatrisation de type réparation (122,123) ; c’est ce qui se produit après un surfaçage radiculaire ou un lambeau d’assainissement
- L’adhésion conjonctive : si les cellules conjonctives colonisent le site en premier, un manchon fibreux supracrestal se forme empêchant l’insertion perpendiculaire des fibres ; ces cellules ne peuvent donc pas régénérer le parodonte (124)
- L’ankylose : les cellules osseuses peuvent coloniser le site mais n’ont pas le potentiel de produire une nouvelle attache conjonctive selon Nyman ; elles sont donc incapables de régénérer le parodonte (125)
- La nouvelle attache de type « régénération » : les cellules du ligament alvéolo-dentaire sont les seules à pouvoir générer une nouvelle attache, c’est-à-dire du cément, de l’os et du ligament, ce qui veut dire qu’il y a une hétérogénéité de cette population cellulaire (126)
22 La régénération parodontale est un processus complexe qui nécessite l’intrication et la synchronisation à la fois des tissus mous (fibres de Sharpey et attache conjonctive) et des tissus durs (os alvéolaire et cément) (127) et qui va impliquer plusieurs types cellulaires : fibroblastes pour le ligament parodontal avec ses fibres, cémentoblastes pour reformer du cément, ostéoblastes pour recréer de l’os (126).
Au vu de la complexité du parodonte, six grands principes de base sont appliqués pour toutes les techniques de régénération parodontale :
- Histocompatibilité des surfaces : la surface radiculaire et la surface interne du lambeau doivent être saines ; il faut donc enlever les bactéries, la plaque et les endotoxines du cément pour obtenir une surface saine (128)
- Exclusion cellulaire : il faut limiter la progression apicale de l’épithélium et éviter le contact entre le tissu conjonctif du lambeau et la surface radiculaire (122)
- Stabilité précoce du caillot : le sang contient un grand nombre de médiateurs favorisant la régénération des tissus, il faut donc protéger et immobiliser le caillot sanguin afin qu’il ne soit pas perturbé lors des premières phases de la cicatrisation ;
- Maintien de l’espace cicatriciel : on doit éviter l’effondrement des tissus mous en maintenant un espace suffisamment large entre la surface radiculaire et le lambeau pour permettre la formation d’un nouveau desmodonte et d’un nouvel os (129)
- Adhésion du caillot : celui-ci doit adhérer à la fois à la surface radiculaire et à la face interne du lambeau
- Induction cellulaire : il faut optimiser la stimulation des cellules capables de régénérer le parodonte (cellules desmodontales et osseuses)
En application de ces principes, différentes thérapeutiques régénératrices peuvent être utilisées lors de lésions parodontales ayant provoqué des destructions tissulaires irréversibles (130) :
23 - La régénération tissulaire guidée (RTG)
- Les matériaux de comblement osseux - Le conditionnement de surface
- Les facteurs de croissance
- Le plasma riche en fibrine (PRF) et le plasma riche en plaquettes (PRP) - Les protéines issues de la matrice amélaire (Emdogain)
Les protocoles cliniques actuels permettant d’obtenir une régénération parodontale avec formation d’un nouveau cément, d’un nouveau ligament, d’une nouvelle attache conjonctive et une formation osseuse sont basés essentiellement sur la régénération tissulaire guidée (131) et l’Emdogain avec éventuellement une association de membranes résorbables, de matériaux de comblement osseux. Cependant, ces techniques ont leurs limites et leurs résultats sont difficilement prévisibles en raison des nombreux paramètres : configuration du défaut osseux, technique utilisée, compétence de l’opérateur.
Les récentes avancées en ingénierie tissulaire ont toutefois permis d’entrevoir de nouvelles perspectives. Cette discipline, qui consiste à renouveler des tissus ou des parties d’organes défectueux, applique les principes et méthodes d’ingénierie et de la science de la vie pour le développement de substituts biologiques afin qu’ils restaurent, maintiennent et améliorent le fonctionnement des tissus endommagés (132). L’ingénierie tissulaire a pour objectif de regrouper les cellules et les facteurs de régulation appropriés pour permettre des reconstructions tissulaires (121) et repose sur la présence de trois éléments : des cellules souches, des médiateurs, et un support matriciel servant d’échafaudage (« scaffold ») (133).
Les cellules souches du ligament parodontal ont des caractéristiques de cellules souches mésenchymateuses, elles expriment les marqueurs STRO-1 et CD146 à leur surface (134), sont multipotentes et peuvent se différencier en cémentoblastes, ostéoblastes, adipocytes, chondrocytes, fibroblastes (135), neurones et hépatocytes (136). Ces cellules sont présentes dans les ligaments parodontaux, même en présence d’une parodontite (137). Plusieurs études ont été menées sur ces cellules souches du ligament parodontal :
- Chez des souris et rats immunodéprimés, leur transplantation au niveau de défauts parodontaux in vitro va entraîner une nouvelle attache du ligament à la racine ainsi qu’une régénération de l’os alvéolaire (134)
24 - Chez des porcs miniatures, leur transplantation dans des défauts osseux montre leur supériorité en termes de régénération parodontale (os alvéolaire, cément, ligament) par rapport aux substituts osseux biphasiques (138)
- Chez l’Homme, la transplantation autologue d’un complexe cellules souches du ligament parodontal/substitut osseux cultivé in vitro dans les défauts osseux a permis un gain d’attache clinique et une néoformation osseuse visible radiologiquement sur 3 patients atteints de parodontite (139)
Les médiateurs sont des molécules de signalisation qui, sous l’effet de modifications de l’environnement (pH, dégradation enzymatique), vont être libérées sous forme active et modifier le comportement des cellules voisines (140). Lors d’une tentative de régénération parodontale, la lésion chirurgicale va nécessairement entraîner une réaction inflammatoire et donc la libération de médiateurs aboutissant à la formation d’un caillot puis d’un tissu de granulation. La régénération tissulaire va s’organiser sous l’influence de facteurs moléculaires comme TGF-β1, BMP, VEGF, FGF-1, FGF-2, PDGF. Ainsi, un apport exogène de ces médiateurs semble être une bonne solution afin d’optimiser la régénération parodontale, à condition d’être prudent au niveau des concentrations tissulaires pour éviter d’éventuels effets antagonistes.
Les scaffolds (ou échafaudages) sont des biomatériaux mis au point pour servir de support bidimensionnel ou tridimensionnel mainteneur d’espace sur lequel les cellules peuvent adhérer, proliférer, migrer et lui conférer une activité biologique. Ils jouent un rôle primordial dans la revascularisation du site cicatriciel. Dans le cadre de la régénération parodontale, les premiers scaffolds utilisés furent des membranes non résorbables pour la régénération tissulaire guidée qui protégeaient le caillot et le tissu de granulation d’un envahissement par les cellules épithéliales (131,141). Ces membranes furent remplacées par la suite par des membranes résorbables associées à un matériau de comblement. Plus récemment, l’encapsulation de molécules bioactives dans des microsphères à base de polymères d’acide polylactique/polyglycolique (PLGA) a permis de délivrer des doses précises de médiateurs sur une longue période sans perte d’activité biologique (142). L’encapsulation de médiateurs biologiques pourrait être utilisée afin d’améliorer la régénération parodontale : un produit commercialisé aux Etats-Unis (le GEM-21S : rhPDGF-BB conditionné en gel associé à du β-TCP) semble obtenir de bons résultats pour la régénération des défauts intra-osseux parodontaux (143).
25
A.IV. Objectif : rôle du complément dans la régénération parodontale
Comme nous l’avons vu précédemment, le système du complément fait le lien entre inflammation et régénération pulpo-dentinaire, notamment grâce à l’anaphylatoxine C5a : à la suite d’une stimulation des fibroblastes pulpaires par des bactéries (Gram+ ou Gram-), le C5a sécrété va permettre la migration des cellules souches pulpaires vers le site lésé selon son gradient de concentration.
Etant donné que les fibroblastes sont présents dans le ligament parodontal et qu’ils jouent un rôle important dans la régénération parodontale, nous avons cherché à savoir si, comme c’est le cas au cours de la régénération pulpo-dentinaire, les bactéries Gram- (responsables des parodontites) peuvent activer localement la cascade du complément et entraîner la sécrétion de C5a par les fibroblastes parodontaux.
L’objectif est donc de découvrir si le mécanisme impliquant le système du complément est le même pour la régénération pulpo-dentinaire que pour la régénération parodontale.
B. Matériel et méthodes
Tout le matériel utilisé pour la culture cellulaire (plastique, milieu, antibiotiques, trypsine et sérum) provient de chez Dutscher (Dutscher, BRUMATH, France).
Les anticorps dirigés contre STRO-1, C5aR, C5a, ainsi que les molécules recombinantes (C5a et CD59) et le kits ELISA proviennent de chez R&D Systems (Lille, France). Les anticorps contre le FSP proviennent de chez Abcam (Paris, France). Tous les anticorps secondaires proviennent de chez Invitrogen (Saint-Aubin, France). L’intégralité des produits chimiques vient de chez Carlo-Erba (Val-de-Reuil, France).
26
B.I. Culture de cellules parodontales humaines
Les cellules de ligament alvéolo-dentaire sont obtenues à partir de troisièmes molaires immatures saines extraites pour raisons orthodontiques chez des adolescents. Les dents sont prélevées dans des conditions optimales d’asepsie en bloc opératoire et rapidement transportées jusqu’au laboratoire, dans un milieu de culture enrichi en antibiotiques (MEM contenant 300 UI/ml de pénicilline, 300 µg/ml de streptomycine et 0,75 µg/ml d’amphotéricine B) à 4°C. Au laboratoire, les germes sont nettoyés avec du PBS.
Les explants sont placés dans des boîtes de Pétri de 10 cm de diamètre, et cultivés en MEM/10% SVF / 200UI/ml de pénicilline / 200µg/ml de streptomycine / 0,50 µg/ml d’amphotéricine B, dans un incubateur humide à 37°C, 5% de CO2. En changeant le milieu de culture tous les deux jours, les cellules de ligament alvéolo-dentaire prolifèrent à partir des explants au bout d’une semaine de culture environ. Ces cellules
de ligament alvéolo-dentaire sont alors cultivées jusqu’au 8ème passage dans un milieu
de culture classique (MEM/10% SVF / 10UI/ml de pénicilline / 100µg/ml de streptomycine / 0,25 µg/ml d’amphotéricine B) dans un incubateur Humide à 37°C et 5% de CO2.
Tous les passages cellulaires sont réalisés de la façon suivante : à confluence, les cellules de ligament alvéolo-dentaire sont incubées 5 minutes à 37°C avec 0,05% trypsine/EDTA (1ml/75cm2). Lorsque les cellules sont décollées, celles-ci sont reprises dans du milieu de culture classique (10ml/75cm2) et centrifugées 5 minutes à 900trs/min. Les surnageants sont alors retirés et les culots cellulaires suspendus dans du milieu de culture classique et équitablement répartis dans trois flasques de culture.
B.II. Tri cellulaire des cellules STRO1+
Les cellules progénitrices parodontales sont isolées à partir des cultures de cellules de ligament alvéolo-dentaire (passages 1 à 4) par tri magnétique selon les instructions du fabricant (Dynal, Oslo, Norway). Le tri magnétique est réalisé en trois étapes :
- Préparation des complexes anticorps primaires – anticorps secondaires
magnétiques : l’IgM de souris anti-STRO-1 humain est incubé pendant 30 minutes à 4°C avec l’anticorps magnétique de rat anti-IgM de souris (Dynal,
27 Oslo, Norway), à 1µg/25µl (soit 10 millions de billes magnétiques). Au terme de cette incubation, et afin de retirer les excès d’anticorps primaires non couplés aux anticorps secondaires magnétiques, trois lavages sont réalisés, puis les complexes anticorps primaires – anticorps secondaires magnétiques sont repris dans une solution d’isolation (PBS/0.1% BSA/2 mM EDTA, pH7.4) (25µl solution d’isolation/1µg d’IgM anti STRO-1)
- Préparation des cellules parodontales à trier : le marqueur de surface des cellules souches mésenchymateuses STRO-1 étant résistant à la trypsine, les cellules de ligament alvéolo-dentaire sont décollées avec une solution de trypsine/EDTA 0,25% pendant 5 min à 37°C, à 1ml/75 cm². Après 5 min de centrifugation à 800 tours/min, les cellules de ligament alvéolo-dentaire sont reprises dans du tampon d’isolation, à 10 millions de cellules/ml
- Isolation des cellules progénitrices parodontales : les cellules de ligament alvéolo-dentaire en suspension sont incubées avec les complexes anticorps primaires – anticorps secondaires magnétiques, à 10 millions de cellules de ligament alvéolo-dentaire/25µl de complexe. Après 20 minutes d’incubation à 4°C sous agitation, les cellules de ligament alvéolo-dentaire exprimant le marqueur de surface STRO-1 se retrouvent liées aux complexes anticorps primaires – anticorps secondaires magnétiques. Les cellules progénitrices parodontales STRO-1 sont alors séparées de l’ensemble des cellules de ligament alvéolo-dentaire par l’utilisation du support magnétique DynaMag™15. Après quatre étapes de lavage, les cellules progénitrices parodontales STRO-1 sont cultivées dans des flasques de culture.
B.III. Caractérisation des cellules par immunofluorescence
Des immunomarquages fluorescents ont été réalisés in vitro, sur les cellules de ligament alvéolo-dentaire non triées et sur les cellules progénitrices STRO-1 triées. Ces marquages ont été réalisés afin d’apprécier la présence de différents antigènes :
- Le marqueur de cellules souches mésenchymateuses STRO-1 - Le marqueur fibroblastique FSP (Fibroblast Surface Protein) - Le récepteur actif du C5a, le C5aR
28 Les anticorps primaires et secondaires ainsi que leur contrôle respectif utilisé pour ces marquages sont récapitulés dans le tableau ci-dessous :
Anticorps primaires Anticorps secondaires
(Alexa-Fluor)
Contrôles
Mouse anti-human STRO-1 IgM 488 goat anti-mouse IgM Omission de l’anticorps primaire Mouse anti-human FSP IgM 488 goat anti-mouse IgM Omission de l’anticorps primaire Mouse anti-human C3aR IgG 594 goat anti-mouse IgG MouseIgG2A Isotype Control Mouse anti-human C5aR IgG 594 goat anti-mouse IgG Mouse IgG2A Isotype Control
Les immunomarquages fluorescents seront détectés de façon qualitative sur lame en microscopie à fluorescence. Le protocole est le suivant :
• les cellules sont ensemencées dans des lames de culture 8 puits, et incubées 24 heures dans un incubateur humide à 37°C et 5% de CO2
• les cellules sont alors lavées trois fois 5 minutes avec du PBS, avant d’être fixées 15 minutes avec de la PFA 4% (paraformaldéhyde)
• ensuite, les puits sont saturés (BSA5%, 1h) et les cellules incubées avec l’anticorps primaire (5µg/ml) ou en condition contrôle
• après trois lavages réalisés en PBS, les cellules sont alors incubées, et ce quel que soit l’antigène ciblé, 45 minutes avec 5µg/ml d’anticorps secondaire et 1µg/ml de DAPI
• les cellules sont alors lavées trois fois 5 minutes, en PBS, puis montées entre lame et lamelle à l’aide d’un milieu de montage aqueux (Glycergel Mounting Medium, Dako, Carpinteria, USA)
Dans le cadre d’un double immunomarquage, les cellules sont incubées simultanément avec les deux anticorps primaires, puis simultanément avec les deux anticorps secondaires.
29
B.IV. Quantification du C5a par test ELISA
Les fibroblastes parodontaux sont cultivés dans des plaques de culture douze puits jusqu’à confluence. Pour enlever toutes traces de sérum, les cellules parodontales sont lavées trois fois avec du PBS, et incubées dans 500µl de MEM sans sérum +/- LPS (104 EU/ml).
Après 1h/12h/24h les surnageants cellulaires sont récupérés et la production de C5a, résultant de l’activation du système du complément, est immédiatement quantifiée par test ELISA. Pour cela, les puits de plaques immunologiques 96 puits (Dominique Dutscher, Brumath, France) sont incubés une nuit à température ambiante avec l’anticorps de capture du C5a à 1.0µg/ml de PBS. Le lendemain, chaque puits est saturé une heure avec 300µl de lait 4%. Au terme de la saturation, les puits sont incubés durant deux heures avec 100µl des échantillons à doser, puis incubés deux heures avec l’anticorps de détection du C5a à 2µg/ml de PBS. Enfin, après une incubation de vingt minutes dans 100µl de streptavidine-HRP (HorseRadish-Peroxydase), chaque puits est incubé vingt minutes dans une solution de révélation, qui est un mélange 1 : 1 de H2O2 et de tétraméthylbenzidine. Il est important de noter qu’entre chaque étape de ce protocole, tous les puits sont lavés trois fois avec 400µl de PBS/0.05% Tween20. Pour finir, la densité optique de chaque puits est déterminée avec un lecteur de plaque à 650 nm (Σ960, MeterTech). Au cours de chaque expérience et suivant le même protocole, une gamme de concentration de C5a allant de 0pg/ml à 2000pg/ml est établie. De cette façon, les densités optiques de chaque traitement correspondent à une concentration de C5a.
B.V. Statistiques
Toutes les expériences ont été réalisées au moins 3 fois de manière indépendante pour assurer leur reproductibilité. Les résultats sont exprimés en moyenne ± les écart-types des moyennes. Le test de Student (t-test) a été utilisé (p-value < 0.05).
30
C. Résultats
C.I. Obtention des cellules parodontales humaines
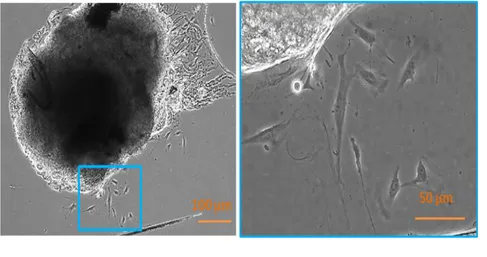
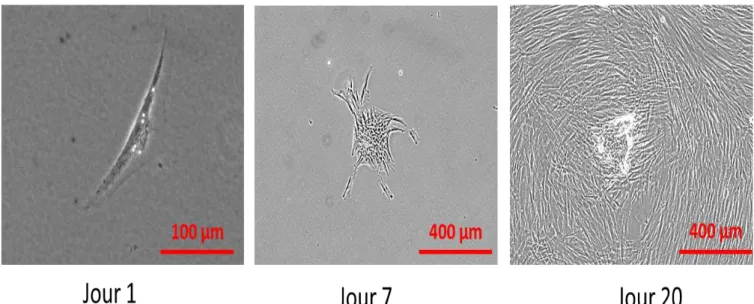
La culture d’explants de ligament parodontal a permis la récupération d’un mélange de populations de cellules. Après 3 jours, une croissance cellulaire commence à apparaître à la périphérie des explants (figure 6). Une croissance cellulaire rapide est observée autour de l’explant, pour obtenir une confluence à partir de 10 jours.
Figure 6 : Culture d'explants de ligament parodontal
C.II. Caractérisation des fibroblastes et des cellules souches parodontaux par immunofluorescence
Nous avons réalisé in vitro un tri des cellules souches STRO-1+ de l’ensemble des cellules du ligament parodontal obtenues précédemment. Les cellules souches parodontales ont été isolées, à partir de cellules de ligament parodontal humaines, par tri magnétique à l’aide d’un anticorps anti-STRO-1. Ainsi, le tri magnétique permet d’obtenir deux populations de cellules :
- Les cellules dites STRO1+ : immédiatement après le tri, les cellules encore en suspension sont associées à des billes magnétiques traduisant l’expression de STRO-1 à leur surface. Après 7 jours de culture, ces cellules forment de petites colonies (CFU) caractéristiques des cellules souches (figure 7). De plus, ces cellules expriment le STRO1, caractéristique des cellules souches (figure 8).
31 - Les cellules dites STRO1- : ce sont les cellules non associées aux billes magnétiques. Ces cellules expriment le FSP (figure 8), caractéristique des fibroblastes.
Un double marquage immunofluorescent est ensuite réalisé sur les deux populations (figure 8) dans lequel on étudie l’expression de C3aR et C5aR par les fibroblastes (cellules STRO-1-) et les cellules souches du ligament parodontal (STRO-1+). Les noyaux sont marqués au DAPI (bleu), FSP et STRO-1 ont été révélés avec un anticorps secondaire Alexa 488 (vert) et C3aR et C5aR ont été révélés avec un anticorps secondaire Alexa 594 (rouge).
Figure 7 : Tri magnétique STRO1
32
Figure 8 : Caractérisation des cellules STRO1+ et STRO1- par immunofluorescence
Les résultats confirment l’expression de STRO-1 par les cellules souches du ligament parodontal, ainsi que de FSP par les fibroblastes. Alors que peu de fibroblastes expriment le C5aR, il semble être exprimé en plus grande quantité par l’intégralité des cellules souches du ligament parodontal. A l’inverse, le C3aR semble être plus exprimé par les fibroblastes que par les cellules souches du ligament parodontal.
Cela confirme donc que les cellules souches du ligament parodontal expriment le C5aR à leur surface et C3aR dans une moindre mesure, et que les fibroblastes expriment C3aR à leur surface, et C5aR dans une moindre mesure.
33
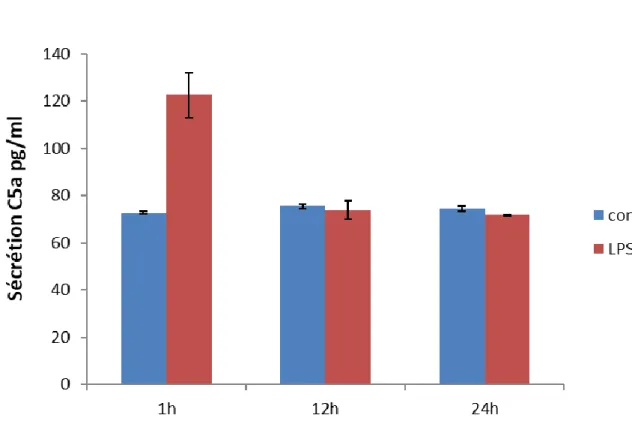
C.III. Une stimulation au LPS induit la sécrétion du C5a par les fibroblastes parodontaux
Des tests ELISA ont été réalisés sur des surnageants de fibroblastes parodontaux humains cultivés dans du milieu de culture sans sérum pendant 1h, 12h et 24h en l’absence (contrôle) ou en présence de 10⁴EU/ml de LPS. Cette stimulation au LPS, motif des parois des bactéries Gram négatif, a été utilisée pour mimer, in vitro, les bactéries présentes lors d’une lésion parodontale. En l’absence de stimulation, une quantité de C5a avoisinant les 70pg/ml est détectée dans le surnageant quel que soit le temps d’incubation des fibroblastes. La stimulation des fibroblastes avec du LPS induit rapidement (au bout d’1h) une augmentation significative de la quantité de C5a détectée dans le surnageant (environ 120 pg/ml). Au bout de 12h de stimulation, la quantité de C5a détectée est revenue à sa valeur de base (environ 70pg/ml) (figure 9). Cette expérience ayant été menée dans un milieu dépourvu de sérum, ces résultats démontrent que les fibroblastes parodontaux sont capables de produire du C5a et que cette production est fortement augmentée par une stimulation au LPS.
34
D. Conclusion et discussion
D’abord connu pour son rôle dans la réaction inflammatoire (production d’anaphylatoxines, induction de la phagocytose et lyse directe des pathogènes), le système du complément a récemment permis de faire le lien entre l’inflammation et la régénération pulpo-dentinaire. En effet, lors d’une lésion carieuse, la stimulation des fibroblastes pulpaires (identifiés comme les premières cellules non-immunes capables de sécréter l’ensemble des molécules de la cascade du complément) par les bactéries va permettre de réduire l’inflammation notamment grâce au complexe d’attaque membranaire produit, puis le C3a sécrété va entraîner la prolifération des fibroblastes et des cellules progénitrices pulpaires via son récepteur spécifique C3aR, et le C5a va permettre le recrutement et la migration suivant son gradient de ces cellules progénitrices pulpaires depuis leurs niches périvasculaires jusqu’au site lésé grâce à l’interaction avec son récepteur spécifique C5aR exprimé à la surface de ces cellules. Une fois cette relation entre inflammation et régénération via l’activation du complément mise en évidence dans la pulpe dentaire, nous avons cherché à déterminer si les mêmes mécanismes pouvaient être mis en jeu dans la régénération parodontale car les caractéristiques des cellules souches du ligament alvéolo-dentaire et la présence de fibroblastes nous ont poussé à envisager cette possibilité.
Les expériences menées ont démontré que les fibroblastes parodontaux exprimaient C3aR (majoritairement) et C5aR et que les cellules souches du ligament alvéolo-dentaire exprimaient C5aR (majoritairement) et C3aR. Ces cellules sont donc potentiellement sensibles à l’action de C3a et C5a qui peuvent être sécrétés au cours d’une réaction inflammatoire. Cette réaction inflammatoire est présente au cours d’une parodontite, nous avons donc cherché à mimer l’effet d’une stimulation des fibroblastes parodontaux par des bactéries Gram – (responsables des parodontites). La sécrétion de C5a par les fibroblastes parodontaux est nettement augmentée après stimulation au LPS en l’absence de sérum. Cela démontre que, à l’image de ce qui se produit dans la pulpe, les fibroblastes parodontaux permettent une production locale de C5a, indépendamment de l’apport plasmatique.
Ces innovations ont permis une meilleure compréhension des mécanismes régissant ces phénomènes d’inflammation et de régénération, et par conséquent une meilleure