HAL Id: tel-03210797
https://tel.archives-ouvertes.fr/tel-03210797
Submitted on 28 Apr 2021HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Intérêt et modalités d’utilisation de l’élastographie
ultrasonore impulsionnelle 2D en mode shear wave
elastography (2D-SWE) dans l’évaluation du
développement pulmonaire fœtal
Nicolas Mottet
To cite this version:
Nicolas Mottet. Intérêt et modalités d’utilisation de l’élastographie ultrasonore impulsionnelle 2D en mode shear wave elastography (2D-SWE) dans l’évaluation du développement pulmonaire fœ-tal. Gynécologie et obstétrique. Université Bourgogne Franche-Comté, 2020. Français. �NNT : 2020UBFCE005�. �tel-03210797�
THESE DE DOCTORAT DE L’ETABLISSEMENT UNIVERSITE BOURGOGNE
FRANCHE-COMTE
Ecole doctorale n°554
Ecole Doctorale Environnements – Santé Bourgogne/Franche Comté
Doctorat de Médecine, biophysique et imagerie médicale
Par
MOTTET Nicolas
Intérêt et modalités d’utilisation de l’élastographie ultrasonore
impulsionnelle 2D en mode Shear Wave Elastography (2D-SWE)
dans l’évaluation du développement pulmonaire fœtal
Thèse présentée et soutenue à Besançon le 13 mars 2020
Composition du Jury :
Monsieur Ramanah Rajeev Professeur des Universités, Praticien Hospitalier Directeur de thèse Université de Franche-Comté
Monsieur Aubry Sébastien Professeur des Universités, Praticien Hospitalier Président du Jury Université de Franche-Comté
Monsieur Morel Olivier Professeur des Universités, Praticien Hospitalier Rapporteur Université de Lorraine
Monsieur Perrotin Franck Professeur des Universités, Praticien Hospitalier Rapporteur Université de Tours
Monsieur Gorincour Guillaume Professeur des Universités, Praticien Hospitalier Examinateur Chercheur associé, Université Paris Descartes
Madame Jacquet Emmanuelle Maitre de conférence des universités Examinatrice Département de Mécanique Appliquée, FEMTO
Remerciements
A Emilie, merci pour ton soutien, ton accompagnement et tes encouragements durant ces dernières années. Merci de prendre soin de nous, je t’aime sincérement.
Monsieur le Pr Rajeev Ramanah
Vous nous avez fait l’honneur de diriger ce travail.
Malgré une période de grands bouleversements professionnels, vous êtes resté
présent et à l’écoute durant ce travail. Merci pour votre soutien et votre accompagnement
dans ce parcours universitaire.
Nous espérons être toujours à la hauteur de la confiance que vous nous avez
accordée.
Que cette thèse soit le reflet de notre profond respect et de notre gratitude.
Monsieur le Pr Guillaume Gorincour
Merci pour votre accompagnement et vos conseils durant ce travail de thèse.
Vous avez inititié ce travail avec Edwin Quarello chez le fœtus de singe lorsque je
terminais mon Master. Je vous ai appelé pour vous expliquer que je souhaitais poursuivre
votre réflexion chez le fœtus humain au cours de ma thèse, et vous m’avez immédiatement
soutenu dans ce projet.
Vous m’avez aidé à valoriser ce travail en me permettant de communiquer à deux
reprises durant les journées nationales de médecine fœtale de Marseille et vous avez su
trouver le temps de me conseiller pour mes publications.
Encore merci pour votre enthousiasme communicatif.
Nos échanges et votre venue sur Besançon ont été des moments précieux au cours de
cette thèse.
Que cette thèse soit le reflet de notre profond respect et de notre gratitude.
Monsieur le Pr Olivier Morel
Merci d’avoir accepté d’être rapporteur de ce travail de thèse.
Vous avez accepté de juger cette thèse, témoignant ainsi votre soutien et l’intérêt que
vous portez aux projets de vos jeunes collègues universitaires. Votre dynamisme et votre
disponibilité promettent de belles collaborations futures
Que cette thèse soit le reflet de notre profond respect et de notre gratitude.
Monsieur le Pr Frank Perrotin
Merci d’avoir accepté d’être rapporteur de ce travail de thèse.
Sans aucune hésitation, vous avez accepté de vous déplacer en Franche Comté pour juger ce
travail.
Votre équipe est une des premières à proposer l’exploration des organes du fœtus par
élastographie.
Nous vous remercions pour l’intérêt que vous avez bien voulu porter à notre travail. Que ce
Monsieur le Pr Aubry Sébastien
Vous nous avez fait l’honneur d’accepter de juger notre thèse. Nous vous remercions pour
l’intérêt que vous avez bien voulu porter à notre travail. Que ce travail soit le témoignage de
notre profond respect et de notre gratitude.
Madame Emmanuelle Jacquet
Vous nous avez fait l’honneur d’accepter de juger notre thèse.
Merci pour votre grande disponibilité et pour le temps consacré à nous rendre moins
mystérieux les principes fondamentaux de la mécanique appliquée aux tissus.
Nous vous remercions pour l’intérêt que vous avez bien voulu porter à notre travail. Que ce
travail soit le témoignage de notre profond respect et de notre gratitude
Je remercie le Pr Didier Riethmuller de m’avoir ouvert le chemin de la voie universitaire. Votre implication professionnelle et votre dynamisme pour partager votre conception de l’obstétrique m’ont convaincu de « maintenir le cap ». Merci sincérement de m’avoir fait confiance et de rester présent malgré l’éloignement.
Merci à Lauranne Mouraud et Marie Klufts. Vous avez été deux élèves ingénieurs impliquées et vos réflexions toujours pertinentes nous ont permis d’avoir de nouveaux regards sur le sujet.
Merci à l’équipe de l’Umeth et de la DRCI, en particulier Lionel Pazart, Chrystelle Vidal, Ingrid Tissot et Louis Benazet pour que les études ELASTOMAP et ELASTOPULM soient conduites dans de bonnes conditions.
Merci au laboratoire FEMTO et au département de mécanique appliquée pour avoir mis à diposition l’équipement nécessaire pour réaliser des tests de rhéométrie.
Merci au Pr Sananès et à l’équipe du centre de primatologie de Strasbourg de m’avoir accueilli pour participer aux expémrimentations sur le singe.
Merci aux constructeurs Samsung et General Electrics pour avoir mis à disposition leur machine durant la réalisation de nos études cliniques. Je remercie particulièrement les ingénieurs corréens de chez Samsung pour leur disponibilité et la mise à disposition de données constructeurs.
Merci à l’ensemble des patientes qui ont participé aux différents projets.
Merci à l’ensemble de mes collègues du service de gynécologie Obstétrique du CHU de Besançon. L’énergie de l’équipe est un véritable moteur pour avancer et construire ensemble de nouveaux projets.
Résumé
Le développement pulmonaire chez le fœtus s’accompagne d’une prolifération cellulaire, d’un renouvellement intense de la matrice extracellulaire et d’une augmentation des dépôts d'élastine responsables d’une évolution des caractéristiques tissulaires au cours de la gestation. L’élastographie ultrasonore impulsionnelle 2D en mode Shear Wave Elastography (2D-SWE) consiste à focaliser un faisceau ultrasonore à différentes profondeurs pour générer des ondes de cisaillement dont la vitesse de propagation dépend de l’élasticité du tissu étudié.
L’objectif de cette thèse est de proposer une nouvelle approche du développement pulmonaire fœtal humain à travers l’étude de son élasticité au cours de la gestation grâce à l’utilisation de l’élastographie ultrasonore impulsionnelle 2D-SWE. En tenant compte des différents paramètres acoustiques des sondes d’échographie utilisées, nous avons pu respecter les critères de sécurité acoustique réglementaires pour explorer la poumon fœtal humain in vivo. Nous avons d’abord recherché les facteurs limitant la mesure de l’élasticité d’un tissu mou par 2D-SWE selon une approche fondamentale avec l’utilisation de tests rhéométriques. Dans une première étude pilote nous avons évalué la faisabilité et la reproductibilité de la mesure de l’élasticité pulmonaire fœtale in vivo par 2D-SWE. Dans une deuxième étude, nous avons suivi l’évolution de l’élasticité du poumon fœtal entre 24 et 39 semaines d’aménorrhée et comparé les valeurs obtenues à celle du foie fœtal. Enfin, nous avons étudié les variations du coefficient d’élasticité dans un modèle d’occlusion trachéale chez le singe d’une part, et lors de l’exploration de pathologies pulmonaires congénitales d’autre part.
L’élastographie 2D-SWE permet d’apprécier l’élasticité moyenne d’un tissu mou mais ne semble pas appropriée pour en estimer sa valeur absolue. Il existe une variabilité du module d’élasticité, mais cette variabilité semble constante selon la profondeur d’exploration. L’utilisation de sondes convexes de basses fréquences parait plus adaptée à l’exploration de tissu profond en garantissant une meilleure stabilité du module de cisaillement. La première étude pilote chez 103 fœtus a permis de confirmer que les mesures de l’élasticité moyenne du poumon et du foie étaient faisables par 2D-SWE avec une reproductibilité acceptable. L’analyse intermédiaire des résultats de la deuxième étude pilote chez 63 fœtus montrait que l’évolution de l’élasticité moyenne selon l’âge gestationnel semblait différente pour le poumon et le foie. Alors que l’élasticité hépatique moyenne semblait augmenter avec l’âge gestationnel (3,76 kPa à 24 SA versus 4,52 à 39 SA, p<0,001) celle du poumon évoluait par pallier. De 24 SA à 32 SA, il existait une tendance à l’augmentation progressive de l’élasticité du poumon fœtal (3,82 kPa à 24 SA, 4,92 kPa à 28 SA, 5,15 kPa à 32 SA p<0,001). Après 32 SA, l’élasticité diminuait pour atteindre 4,42 kPa à 36 SA puis 4,09 kPa à 39 SA. Nous avons observé une dispersion plus importante des mesures pour le poumon par rapport à celle du foie pouvant témoigner d’une évolution tissulaire différente de ces deux organes au cours de la grossesse (p<0,001). Dans cette étude, les distances moyennes entre la sonde et le site de mesure au niveau du poumon et du foie étaient respectivement de 4,6 cm [2,5-8] et 5,8 cm [3-10]. On retrouvait une variation modérée de l’élasticité pulmonaire moyenne selon la profondeur d’exploration.
Dans un modèle de pathologies pulmonaires congénitales, nous avons remarqué que les variations des mesures de l’élasticité des lésions pulmonaires précédaient de 3 semaines les variations morphologiques objectivées en échographie standard. Enfin, nous avons constaté que l’évolution de l’élasticité pulmonaire fœtale dans un modèle d’occlusion trachéale pouvait refléter les variations de pression intra pulmonaire au cours de cette procédure foetoscopique.
Résumé en anglais
Fetal Lung development is accompanied by cell proliferation, intense renewal of the extracellular matrix and increased deposits of elastin responsible for changes in tissue characteristics during gestation. Two dimensional Shear Wave Elastography (2D-SWE) consists in focusing an ultrasonic beam at different depths to generate shear waves whose propagation speed depends on the elasticity of the tissue.
The objective of this thesis is to propose a new approach to human fetal lung development through the study of its elasticity during gestation with 2D-SWE. Considering the different acoustic parameters of the ultrasound probes used in this project, we were able to respect the regulatory acoustic safety criteria to explore the human fetal lung in vivo. We first investigated the factors limiting the measurement of the elasticity with 2D-SWE on soft tissue according to a fundamental approach through rheometric tests. In a first pilot study we evaluated the feasibility and the reproducibility of the measurement of the fetal lung elasticity in vivo by 2D-SWE. In a second study, we monitored the evolution of the elasticity of the fetal lung between 24 and 39 weeks of gestation (WG) and compared the values obtained with those of the fetal liver. Finally, we studied variations of lung elasticity during tracheal occlusion in monkeys and during the exploration of congenital pulmonary malformations.
It is possible to assess the average elasticity of a soft tissue with 2D-SWE but this technique does not seem appropriate to estimate its absolute value. The use of convex probes with low frequency seems more suitable for eploring deep tissue by ensuring better stability of the shear modulus.The first pilot study in 103 human fetuses confirmed that measurement of the average elasticity of the lung and liver was feasible by 2D-SWE with acceptable reproducibility. Intermediate analysis of the results of the second pilot study in 63 fetuses showed that the evolution of the average elasticity according to gestational age seems different for the lung and the liver. While the average hepatic elasticity seemeed to increase with gestational age (3.76 kPa at 24 WG versus 4.52 at 39 WG, p<0,001) that of the lungs progressed by stages. From 24 WG to 32 WG, fetal lung elasticty increased gradually (3.82 kPa at 24 WG, 4.92 kPa at 28 WG, 5.15 kPa at 32 WG, p<0,001). After 32 WG, the elasticity decreases to reach 4.42 kPa at 36 WG and then 4.09 kPa at 39 WG. We observed a greater dispersion of the measurements for the lung compared to the liver, which could be related to a different tissue evolution of both organs during pregnancy. In this study, the average distances between the probe and the measurement site in the lung and liver were 4.6 cm [2.5-8] and 5.8 respectively cm [3-10] There was a moderate variation for lung average elasticity according to the depth of exploration.
In a model of congenital pulmonary malformations, we noticed that variations in elasticity measurements of lung lesions preceded by 3 weeks the morphological variations objectified by ultrasounds. Finally, we found that the evolution of fetal lung elasticity in a tracheal occlusion model could reflect variations in intra pulmonary pressure during the fetoscopic procedure.
Tables des matieres
Remerciements ...2
Résumé ... 10
Résumé en anglais... 11
Tables des matieres ... 12
Liste des figures ... 15
Liste des tableaux ... 17
Liste des abréviations ... 18
Introduction générale ... 19
1.Développement pulmonaire fœtal humain et modifications des propriétés tissulaires au cours de la gestation ... 20
a. Organogenèse du poumon fœtal humain ... 20
b. Evolution des propriétés mécaniques tissulaires ... 22
oMatrice extracellulaire et production d’élastine ... 22
oLa pression intra luminale ... 23
oEvolution de la masse volumique ... 23
2.Justifications cliniques du projet de Thèse ... 26
a. Outils pour l’évaluation prénatale du développement pulmonaire fœtal ... 26
b. Détresse respiratoire néonatale et épidémiologie ... 28
c. Stratégies de prévention du risque de détresse respiratoire ... 30
3.Objectifs de la thèse ... 33
PREMIERE PARTIE ... 34
L’élastographie par ondes de cisaillement : état de l’art, applications en médecine fœtale
et néonatale ... 34
1.Bases fondamentales de l’élastographie ultrasonore ... 35
a.Propriétés physiques des ondes ultrasonores ... 35
oOndes de compression-dilatation ... 36
oOndes de cisaillement ... 36
oModule de cisaillement et module de Young ... 37
oConstructions de l’image d’élastographie ... 39
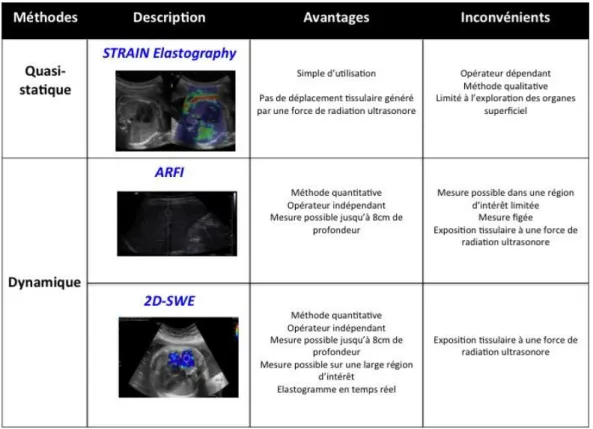
2.Les différentes techniques d’élastographie ultrasonore ... 41
3.Conditions réglementaires d’utilisation des ondes ultrasonore en cours de gestation ... 46
a.Effets biologiques des ondes ultrasonores ... 46
oEffet thermique ... 47
oEffet mécanique ... 47
b.Les normes réglementaires d’utilisation des ondes ultrasonores en cours de grossesse ... 48
c. Particularités de la force de radiation ultrasonore ... 49
oPublication Comments on the review: Shear wave elastography safety in fetus, a quantitative health risk assessment... 51
oPublication Feasibility of 2-D ultrasound shear wave elastography of fetal lungs in case of threatened preterm labor: a study protocol ... 53
4. Applications périnatales de l’élastographie ultrasonore : revue de la littérature ... 65
a.Etat de l’art en médecine néonatale ... 65
oElastographie ultrasonore et exploration hépatique ... 65
oElastographie ultrasonore et exploration cérébrale ... 65
b.Etat de l’art en médecine fœtale ... 66
oExploration chez l’animal ... 66
oExploration chez le fœtus humain ... 67
DEUXIEME PARTIE ... 73
Estimation de l’élasticité d’un tissu mou : confrontation des données obtenues par
rhéologie et par élastographie shear wave ... 73
1.Objectifs ... 74
2.Estimation du module de Young selon deux approches : rhéologie et élastographie shear wave ... 75
a.Publication en cours: Dynamic characterization using shear wave elastography compared to characterization using quasi-static compression and dynamic shear loading ... 75
oIntroduction ... 75
oMaterials and methods ... 76
oResults ... 81
oPrincipales conclusions ... 88
Impact de la non linéarité des tissus mous ... 88
Intérêt de l’utilisation des basses fréquences dans l’estimation du module de Young ... 89
Impact de la taille de région d’intérêt dans l’estimation du module de Young ... 90
b.Impact de la profondeur d’exploration sur l’interprétation des mesures ... 91
oExploration ex vivo de gels de polymère par 2D-SWE ... 91
oExploration ex vivo du placenta par 2D-SWE ... 94
TROISIEME PARTIE ... 96
Exploration du poumon fœtal humain par élastographie Shear Wave : études pilotes ... 96
1.1ère Etude ELASTOMAP : Etude de faisabilité et de reproductibilité ... 97
a.Les bases du projet ... 97
oPublication : Feasibility of two dimensional ultrasound shear wave elastography of human fetal lungs and liver : A pilot study ... 98
Abstract ... 98 Introduction ... 99 Methods ... 100 Results ... 104 Discussion ... 108 o Principales conclusions ... 111
Faisabilité et reproductiblité de la mesure d’élasticité par 2D-SWE ... 111
Corrélation avec l’âge gestationnel ... 111
Evolution de l’élasticité pulmonaire après corticothérapie ... 111
Les zones pulmonaires et hépatiques les plus reproductibles ... 112
Les principales limites ... 113
2.2ème Etude ELASTOPULM : Suivi individualisé de l’élasticité pulmonaire fœtale entre 24 et 39 SA ... 114
a.Méthodologie de l’étude ... 114
oDesign de l’étude ... 114
oTechniques de mesures ... 117
oDéfinition du nombre de mesures ... 119
c. Impact de la profondeur sur l’estimation de l’élasticité ... 124
QUATRIEME PARTIE ... 126
Variations de l’élasticité du poumon fœtal en cas de modifications des popriétés
tissulaires ... 126
1.Evaluation du coefficient d’élasticité pulmonaire en cas de pathologies pulmonaires .... 127
a.Publication : Evolution of fetal lung stiffness during gestation in two different congenital malformations. ... 129
oAbstract ... 129
oIntroduction ... 129
oMethods ... 130
Congenital Pulmonary Airway Malformation ... 130
Congenital Obstructive emphysema ... 132
Discussion ... 134
b.Principales conclusions ... 135
2.Evaluation du coefficient d’élasticité pulmonaire fœtal dans un modèle d’occlusion de la trachée fœtale chez le singe ... 136
a.Protocole expérimental ... 137
b. Résultats et interprétation ... 139
Conclusion ... 142
Valorisations de la thèse : publications et communications ... 145
Liste des figures
Figure 1 : Différents stades de développement du poumon fœtal chez l’humain... 20
Figure 2 : Représentation schématique d’un lobule de Miller. ... 22
Figure 3 : Evolution du volume pulmonaire fœtal au cours de la grossesse (cm3), estimé par échographie volumique, d’après Gérard et al... 24
Figure 4 : Poids (en gramme) des poumons droit et gauche en post mortem sur une série de 4000 fœtus, d’après Guihard et al ... 25
Figure 5 : Evolution (en Kg/m3) de la masse volumique des poumons droit et gauche au cours de la grossesse . 25 Figure 6 : Evolution (en Kg/m3) de la masse volumique du foie au cours de la grossesse ... 25
Figure 7 : Comparaison des niveaux de gris par histogramme du foie et du poumon fœtale sur une coupe sagitalle en échographie Bi-dimensionnelle. ... 26
Figure 8 : Evaluation du rapport signal Poumon/foie fœtal sur une coupe coronale par IRM, séquence T2. ... 27
Figure 9 : Risque de détresse respiratoire estimé par le logiciel « quantus FLM ». ... 28
Figure 10 : Onde longitudinale, axe de déplacement des particules parallèle à l’axe de propagation de l’onde ... 36
Figure 11 : Onde de cisaillement, polarisation perpendiculaire à la direction de propagation ... 37
Figure 12 : Modules élastiques de compressionK, cisaillement μ et Young E ... 38
Figure 13 : Variations des modules de cisaillement et de compression dans les tissus bilogiques. Les variations du module de compression sont limitées par rapport aux modules de cisaillement. ... 39
Figure 14 : Coupe du thorax fœtal à 28 SA exploré par Strain Elastography ... 42
Figure 15 : Génération d’une onde de cisaillement par pression de radiation ultrasonore ... 44
Figure 16 : Méthodes d’élastographie ultrasonore disponibles sur les principaux dispositifs médicaux commercialisés. ... Error! Bookmark not defined. Figure 17 : Recommandations de la Food and Drugs Admnistrations, normes 510K fixant les limites d’intensité acoustique (ISPTA3 et ISPPA3) autorisées lors de l’utlisation d’ultrasons à visée diagnostique ... 48
Figure 18 : Dimensions du faisceau ultrasonore émis par un transducteur de 2,32 mm de profondeur, sonde convexe CA-17 MhZ, Samsung RS 85 ... Error! Bookmark not defined. Figure 19: a) Transductors with the phantom in “H” configuration. b) Elastography probe on the surface of the phantom in water filled tank. ... 79
Figure 20: Area of interest with targets size from 3 mm to 11 mm in diameter ... 79
Figure 21: Ultrasound outputs in three configurations ... 82
Figure 22: Distribution of measurements superimposed to the Normal law ... 83
Figure 23: Observation by elastography of inclusion with AIXPLORER device. ... 83
Figure 24: Elastic modulus of heterogeneous phantom ... 84
Figure 25: Assessment of the depth influence on the elastography measurements. The figures above the points represent the number of measures used to calculate de elastic modulus for each depth. ... 85
Figure 26: Elastic modulus values obtained for different target sizes corresponding to the Figure 20 ... 85
Figure 27: top – Compression stress-strain values with interpolation curves (iminium, mean and maximum curves within the 21 samples of the 5 depths). Bottom – Compression elastic modulus mean values for each depth, standard deviation of mean value. ... 86
Figure 28: Shear modulus mean values for each depth, standard deviation of mean value ... 87
Figure 29 Evolution de la hauteur des échantillons en fonction de la force appliquée lors de l’essai de compression du fantôme 1 et 2. ... 92
Figure 30 : Détermination du module d'élasticité par essai de compression du fantôme 1 ... 92
Figure 31 : Détermination du module d'élasticité par essai de compression du fantôme 2 ... 92
Figure 32 : Mesures du module de Young E dans le fantôme 1 en focntion de la profondeur ... 93
Figure 33 : Mesures du module de Young E dans le fantôme 1 en focntion de la profondeur ... 93
Figure 34 : Exploration ex-vivo du placenta par 2D-SWE. La sonde d’échographie est maintenue dans la même position durant les acquitions.. ... 94
Figure 35 : Analyse de l’impact de la profondeur (courbe verte) et la taille de la ROI (courbe jaune) sur la vitesse de l’onde de cissaillement selon 3 conditions : 1 = 20 mm ; 2 = 40 mm, 3 = 60 mm pour la profondeur, 1 = 5 mm, 2 =10 mm et 3 = 15 mm pour la taille de la ROI... 95
Figure 36 : Diagramme en boite illustrant l’impact de la taille de la profondeur d’exploration sur l’estimation de la vitesse de l’onde de cisaillement ... 95
Figure 37 : Flow chart ... 100
Figure 38 : Measurement technique ... 102
Figure 39 : Analysis of the fetal LLE ratio variation and stiffness evolution (regions A3 and V) according to gestational age. ... 107
Figure 41 : Mesure de l’intensité du signal pulmonaire et hépatique sur une coupe coronale obtenue par IRM
Fœtale séquence T2. ... 112
Figure 42 : Valeur moyenne d’élasticité du poumon fœtal lors de la prmière visite chez les 10 premières patientes. ... 120
Figure 43 : Valeur moyenne d’élasticité du foie fœtal lors de la prmière visite chez les 10 premières patientes 121 Figure 44 : Coefficient de variation des mesures d’élasticité moyenne du poumon fœtal en fonction du nombre de mesures chez 10 patientes ... 121
Figure 45 : Coefficient de variation des mesures du poumon fœtal en fonction du nombre de mesures chez 10 patientes ... 122
Figure 46 : Evolution des valeurs d’élasticité moyenne, minimale et maximale du poumon et du foie fœtale entre 24 et 39 SA, selon les résultats de l’analyse intermédaire. ... 123
Figure 47 : Evolution de la dispersion des valeurs moyennes d’élasticité du poumon et du foie selon l’âge gestationnel ... 124
Figure 48 : Evolution de la distance moyenne Sonde-Poumon et Sonde-Foie au cours de la grossesse ... 124
Figure 49 : Evolution du coefficient de variation de l’élasticité pulmonaire moyenne selon la profondeur ... 125
Figure 50 : Evolution du coefficient de variation de l’élasticité moyenne du foie fœtal selon la profondeur ... 125
Figure 51 : 2D-Ultrasounds at 27 WG. Congenital pulmonary airway malformation type 2 with mediastinal deviation, left lung. ... 131
Figure 52 : Exploration of a congenital pulmonary airway malformation with 2D- Ultrasounds shear wave Elastography at 27 WG. ... 131
Figure 53 : Fetus A with a congenital pulmonary airway malformation. The CVR ratio was initially normal with a value of 0,6. ... 132
Figure 54 : 2D-Ultrasounds at 24WG. Congenital obstructive emphysema with mediastinal deviation, right lung. ... 132
Figure 55 : Exploration of a congenital obstructive emphysema with 2D- Ultrasounds shear wave Elastography at 24 WG. ... 133
Figure 56 : Fetus B with a congenital obstructive emphysema. The CVR ratio was initially abnormal and disturbing with a value of 1,64. While LLE ratio decreased since 27 WG, the CVR ratio remained abnormal until 32 WG... 133
Figure 57 : Mesure du LHR en échographie bidimensionnelle. Sur une coupe des 4 cavités cardiaques, l’opérateur mesure la plus grande longueur du poumon multipliée par la plus grande largeur et rapportée au périmètre céphalique. LHR : Lung over Head ratio ... 137
Figure 58 : Contrôle systématique du ballonet dans la trachée après la procédure d’occlusion trachéale par foetoscopie. ... 138
Figure 59 : Mesure de l’élasticité du poumon fœtale par 2D-Elastographie Shear Wave avant et après occlusion trachéale pour l’individu 2. ... 138
Figure 60 : Mesure de l’élasticité hépatique moyenne par 2D- Elastographie Shear Wave après 3 mesures consécutives sur le même site d’exploration. ... 138
Figure 61 : Courbes d’évolution du LHR et du LLE ratio au quatre temps de la procédure d’oclusion trachéale par foetoscopie (avant TO, après TO, avant unplug et après Unplug). TO : occlusion trachéale ... 140
Liste des tableaux
Tableau 1 : Valeurs d’élasticité de différents organes foetaux obtenues par élastographie dans des modèles animaux. ... 69 Tableau 2 : Valeurs d’élasticité de différents organes foetaux obtenues par élastographie chez le fœtus humain.70 Tableau 3 : Valeurs d’élasticité des différents organes explorés par élastographie en période néonatale. ... 71 Tableau 4 : Maternal and infant characteristics ... 104 Tableau 5 : Mean difference between pairs of elastographic measurements made by the three operators in
different region of interest (ROI). ... 105 Tableau 6 : Intraclass correlation coefficients (ICC) of elastographic measurements (average of pairs) in different region of interest (ROI) ... 106 Tableau 7 : Valeurs du LHR, surfacve pulmonaire, moyenne de l’élasticité pulmonaire et hépatique et LLE ratio
Liste des abréviations
ACOG : Collège américain de Gynécologie-Obstétrique ARFI : Acoustic Radiation Force Imaging
2D-SWE : Elastographie Shear Wave mode Bidimensionnel
c : célérité de l’onde ultrasonore
CNGOF : Collége national des gynécologues obstétriciens français CVR : Congenital pulmonary malformation Volume Ratio
DR : Détresse respiratoire E : Module de Young
ECMO : Oxygénation Extra corporelle sur Oxygénateur à Membrane FETO : Fetal Endoscopic Trachéale Occlusion
ICC : coefficient de corrélation intraclasse
ISATA : spatial average, temporal average Intensity
ISPPA : spatial peak, peak average Intensity ISPTA: spatial peak, temporal average Intensity
JdV : Jours de vie
K : module de compression LHR : Lung over Head Ratio
LLE ratio : Lung to Liver Elastography ratio.
MAKP : Malformation adénomatoïde kystique pulmonaire MMH : Maladie des membranes hyalines
PII : Intégrale d’intensité d’impulsion PD : Durée du pulse (microsseconde)
PRF : fréqunce de répétition des impulsions (Hz) SA : Semaines d’Aménorrhée
Se : Sensibilité Spé : Spécificité
SDR : Syndrome de Détresse Respiratoire SdV : Semaines de vie
TO : occlusion trachéale
VPP : Valeur prédicitive positive VPN : Valeur prédictive négative
: densité tissulaire
1. Développement pulmonaire fœtal humain et modifications des propriétés
tissulaires au cours de la gestation
a. Organogenèse du poumon fœtal humain
Les structures pulmonaires se développent à partir d’une ébauche épithéliale endodermique vers le 26ème jour de gestation, issue du tube digestif embryonnaire, et du mésenchyme splanchnique.
Le développement pulmonaire est classiquement divisé en 5 phases (Figure 1).
Figure 1 : Différents stades de développement du poumon fœtal chez l’humain. Le développement de l’arbre bronchique et de l’arbre vasculaire artériel sont représentés selon l’âge gestationnel.[1]
1) Durant la période embryonnaire, l’ébauche de l’appareil pulmonaire se développe à partir de la paroi antérieure du tube digestif primitif.
2) Le stade pseudoglandulaire est marqué par le développement des futures voies aériennes par ramifications successives du diverticule initial. L’aspect histologique est proche de celui d’une glande acineuse. Les tubes sont entourés d’un tissu conjonctif lâche, peu cellulaire dont l’abondance va décroitre avec l’âge.
3) Au cours du stade canaliculaire, les futures voies aériennes continuent à se diviser et à s'élargir en donnant naissance aux futures régions respiratoires qui seront capables d'effectuer les échanges gazeux respiratoires. Ce stade est marqué par l’apparition de deux types cellulaires, les pneumocytes I et II. On assiste aussi au réarrangement des capillaires du mésenchyme qui viennent au contact des pneumocytes I, permettant la formation d'une fine barrière air-sang. Sur le plan histologique, on constate l’apparition d’un revêtement respiratoire cilié avec une différenciation
musculaire lisse péri-bronchique. Le septum interlobulaire se développe pour donner de fins tractus conjonctivo veineux entourant les canaux bronchiques au sein d’un tissu cellulaire plus riche en vaisseaux. La sécrétion de surfactant synthétisé par les pneumocytes II débute également au cours de cette phase [2]. Le surfactant est un mélange de phospholipides (phosphatidylcholine, phosphatidylglycérol, phosphatidylinositol) et d’apoprotéines (SP-A, SP-B, SP-C et SP-D) sécrétés dès 23 semaines d’amnénorhée (SA). Cette substance est stockée dans la cellule sous forme de corps lamellaires. Les phospholipides sont d’abord synthétisés dans le réticulum endosplasmique puis transportés par des protéines spécifiques vers les précurseurs des inclusions lamellaires. Cette production de surfactant augmente au cours de la grossesse et permet d’éviter le collapsus des alvéoles à la naissance. Le surfactant est également une substance antioedémateuse et participe aux défenses broncho-alvéolaires [3].
4) Le stade sacculaire est marqué par un élargissement très important des espaces aériens périphériques, aboutissant à la constitution de saccules, formant le parenchyme pulmonaire primitif. Il correspond à l'état de maturation pulmonaire en cas de naissance prématurée. Les saccules sont séparés les uns des autres par des septa. L'interstitium est très cellulaire et son contenu en collagène et en élastine est faible. La population cellulaire interstitielle (fibroblastes) est responsable de la production de la matrice extracellulaire, de la différentiation des cellules épithéliales et contrôle la production de surfactant par l'intermédiaire de diverses cytokines. Avant le stade alvéolaire, les cellules interstitielles commencent à former des fibres d'élastine au niveau des septa qui vont jouer un rôle important lors de l'alvéolisation [2].
5) Le stade de formation alvéolaire débute peu avant la naissance à terme, vers la 38ème
semaine de gestation, mais la plus grande partie s'effectue principalement après la naissance. La formation alvéolaire est précédée d'une courte période d'expansion pulmonaire pendant laquelle les saccules augmentent de volume sans modification de la structure parenchymateuse. Puis, de multiples septa secondaires apparaissent le long des septa primaires pour diviser les espaces aériens primitifs en alvéoles. Plusieurs évènements accompagnent cette septation secondaire : prolifération cellulaire, renouvellement intense de la matrice extracellulaire, dépôts d'élastine au sommet des septa secondaires, et réduction du tissu interstitiel [2].
Durant la vie fœtale, le poumon est un viscère de consistance molle, élastique, comparable à une éponge gorgée de liquide pulmonaire et de sang. Contrairement à la vie extra utérine, il ne contient pas d’air et tous ces composants sont repliés sur eux mêmes, à l’image d’une atélectasie. La segmentation pulmonaire fait correspondre à chaque élément bronchique un territoire parenchymateux parfaitement défini, indépendant fonctionnellement des territoires voisins. Le poumon est fait de parenchyme (glandes, alvéoles, tissus conjonctifs), de bronches et de vaisseaux sanguins qui se divisent selon un mode dichotomique.
Le lobule de Miller est l’unité morphologique du poumon, (anatomopathologique et radiologique) de forme polyédrique de taille variable traversé à son sommet par un axe broncho vasculaire (Figure 2) [4]. La bronche lobulaire est une bronche de 15ème ordre, elle se ramifie en bronchioles terminales (16ème ordre, de 0,6 mm de diamètre) puis en bronches respiratoires (17, 18, 19ème ordre). Les artères lobulaires et acinaires (100 microns à 1 mm) suivent l’axe bronchique à la différence des veines et des lymphatiques pulmonaires. Ces derniers sont en effet distribués à la périphérie du lobule, dans le tissu péri lobulaire à partir duquel ils regagnent le hile pulmonaire. Les lobules de Miller au nombre de 5000 unités, sont entourés d’une enveloppe septale reliée à la plèvre. Un lobule est constitué de 3 à 5 unités acinaires qui se subdivisent elles mêmes en sacs alvéolaires puis en alvéoles.
Figure 2 : Représentation schématique d’un lobule de Miller.
b. Evolution des propriétés mécaniques tissulaires
Pendant la vie fœtale, le poumon se présente comme une masse compacte et non ventilée et l’évolution de sa structure peut générer des contraintes mécaniques différentes selon l’âge gestationnel. En effet, la prolifération cellulaire, le renouvellement intense de la matrice extracellulaire, l’augmentation des dépôts d'élastine, la ramification vasculo-bronchique et la synthèse de surfactant peuvent être responsables d’une évolution des propriétés élastiques du poumon au cours de la grossesse. [5]
o Matrice extracellulaire et production d’élastine
La matrice extracellulaire du poumon joue un rôle fondamental de soutien du parenchyme et participe à la différenciation cellulaire et dans la régulation de l’alvéolisation. Le rôle des fibres d'élastine dans la régulation de l'alvéolisation est suggéré par l'apparition de fibres immédiatement avant le développement alvéolaire et par la présence constante de tissu élastique au sommet des septa secondaires. L’élastine est élaborée par l’association d’un précurseur soluble, la tropo-élastine sous
l’action d’une enzyme, la lysyl-oxidase. La formation des fibres d’élastine commence par la synthèse et l’organisation dans l’espace extra-cellulaire de glycoprotéines de structure : fibrillines, fibulines, émilines et « micro-fibrillar-associated glycoprotein ». Ces glycoprotéines de structure constituent une charpente sur laquelle vont se déposer les molécules de tropoélastine [6]. Ces molécules sont produites par les myofibroblastes. L’elastine est normalement retrouvée dans la plèvre, les septa, les cartilages bronchiques, la paroi vasculaire. La grande concentration se retouve au niveau du parenchyme à hauteur de 20-30% [7]. L’importance de cette protéine a été démontrée chez des souris dépourvues d’élastine. Dans ces conditions, le développement pulmonaire s’arrêtait au stade sacculaire avec pour conséquences des sacs aériens dilatés et une diminution du tissu septal équivalent à des poumons emphysémateux [8][9].
o La pression intra luminale
Les cellules épithéliales sécretent du liquide pulmonaire qui permet de maintenir un certain niveau de pression dans la lumières des bronches les maintenant ouvertes tout au long de la gestation [10]. Cette pression est estimée entre 1 et 2 mmHg. Une augmentation de pression peut induire une accélération du développement alors que l’effondrement de la pression peut conduire à une hypoplasie pulmonaire[11]. L’occlusion trachéale réalisée par foetoscopie dans la prise en charge des hernies de coupoles diaphragmatiques cherche à augmenter la pression intrapulmonaire pour forcer son expansion. Même si cette augmentation peut favoriser la croissance pulmonaire, elle peut aussi perturber la différenciation des pneumocytes de type 2 à l’origine d’un défaut de production de surfactant.
Les mouvements respiratoires fœtaux qui apparaissent au cours du deuxième trimestre sont secondaires à des contractions diaphragmatiques. Ils induisent une réduction de la pression intra thoracique de l’ordre de 3 à 5 mmHg qui vient contrebalancer la pression endoluminale [12]. Ces contractions diaphragmatiques créent une dépression et induisent l’ouverture de la glotte fœtale favorisant les échanges entre liquide amniotique et pulmonaire. On comprend également que le volume de liquide amniotique peut influencer la pression intrapulmonaire et un oligomanios précoce peut conduire à une hypoplasie pulmonaire sévère.
o Evolution de la masse volumique
La masse volumique (ρ) d’un organe est une grandeur physique qui représente la masse de tissu (m) par unité de volume (V):
ρ = m/V m : en gramme (g) ; V : en cm3
Au cours de la gestation, l’arborisation dichotomique vasculo bronchique, le phénoméne de sacculation qui aboutit à un élargissement très important des espaces aériens périphériques et la
septation alvéolaire permettent de créer une surface d’échange importante dans un volume restreint. Ainsi, contrairement au foie, la masse volumique du poumon fœtal décroit au cours de la grossesse. Il est possible de calculer cette masse volumique en tenant compte du volume pulmonaire (mesuré in vivo par IRM ou échographie volumique) et de la masse des poumons déterminées sur des séries post mortem. L’évolution de la masse volumique est un paramètre intéressant lorsqu’on cherche à évaluer les propriétés viscoélastiques d’un tissu à travers le module de Young. En effet, nous verrons dans le chapitre suivant que le calcul du module de Young dépend de la masse volumique du tissu étudié.
Le volume des poumons évolue en fonction de l’âge gestationnel et différentes formules ont été proposées dans la littérature pour le calcul du volume global. Les volumes du poumon droit et gauche sont sensiblement différents et influencent l’évolution de la masse volumique (Figure 3). Le poids des poumons droit et gauche sont très proches jusqu’à 35 SA et la masse du poumon droit devient plus importante que celle du gauche à partir de 37 SA (Figure 4). Pour des raisons anatomiques, le cœur étant naturellement orienté à gauche, la masse volumique du poumon gauche est plus importante que celle du poumon droit (Figure 5).
Figure 3 : Evolution du volume pulmonaire fœtal au cours de la grossesse (cm3), estimé par échographie volumique, d’après Gérard et al[13]
Figure 4 : Poids (en gramme) des poumons droit et gauche en post mortem sur une série de 4000 fœtus, d’après Guihard et al [14].
Figure 5 : Evolution (en Kg/m3) de la masse volumique des poumons au cours de la grossesse
Figure 6 : Evolution (en Kg/m3) de la masse volumique du foie au cours de la grossesse[14,15]
450 500 550 600 650 700 750 800 850 23 25 27 29 31 33 35 37 39
masse volumique poumon gauche masse volumique poumon droit
2. Justifications cliniques du projet de Thèse
a. Outils pour l’évaluation prénatale du développement pulmonaire fœtal
La maturité pulmonaire fœtale est corrélée à la synthèse de surfactant par les pneumocytes de types 2. Initialement, c’est le dosage de certains marqueurs biologiques sur liquide amniotique qui était proposé comme méthode de référence pour prédire le risque de détresse respiratoire (DR) avec des performances variables : rapport lécithine/sphingomyéline avec une sensibilité (Se) de 74% et une spécificité (Spé) de 98%, compte des corps lamellaires (Se = 86% Spé= 86%), taux de phosphatidylglycérol (Se = 91% Spé = 72%) et le ratio surfactant/albumine (Se = 90% Spé = 76%). En 2008, une synthèse réalisée par les collège américain de Gynécologie-Obstétrique (ACOG) sur l’intérêt de ces dosages retouvait une valeur prédictive positive médiocre entre 20-50% et une valeur prédictive négative entre 95 et 100% [16]. Compte tenu de ces performances limitées, plusieurs sociétés savantes dont le collège national des gynécologues obstétriciens français ne recommandent pas de réaliser une amniocentèse dans le seul but d’évaluer la maturité pulmonaire fœtale. Ainsi, ces tests biologiques ont été progressivement abandonnés et le développement de méthodes non invasives encouragées [17][18].
Différentes techniques d’imagerie prénatale ont été proposées pour apprécier l’évolution de la maturité pulmonaire, en comparant l’évolution de certains paramètres entre le poumon et le foie foetal. L’évaluation de la maturité pulmonaire par imagerie a d’abord été proposée par échographie en quantifiant les niveaux gris de l’image. Ces études ont pu mettre en évidence des modifications de l’histogramme du poumon au cours de la gestation mais avec des performances limitées pour prédire le risque de détresse respiratoire [19–22] . L’étude la plus récente de Beck et al de 2015, rapporte les peformances suivantes pour la prédiction du risque de DR avec cette technique (Figure 7) : Se = 61,9%, Spé = 89,1%, VPP = 68,4% et une VPN = 86% [23].
Figure 7 : Comparaison des niveaux de gris par histogramme du foie et du poumon fœtale sur une coupe sagitalle en échographie Bi-dimensionnelle [23].
L’IRM a également été proposée comme outils d’évaluation de la maturité pulmonaire. Cette technique est principalement utilisée pour évaluer le développement et le volume des poumons du fœtus, en particulier en cas de hernie diaphragmatique congénitale. Plusieurs études ont mis en évidence une association significative entre le rapport du signal Poumon / Foie et l’âge gestationnel [24–26]. Dans une série de 110 fœtus ayant bénéficié d’une IRM (hernie de coupole diaphragmatique, trouble de la placentation, anomalies cérébrales fœtales, anomalies uro-digestives foetales), Oka et al retrouvaient un rapport du signal Poumon / Foie plus bas chez les enfants ayant présenté une DR à la naissance (2,15 ± 0.30 vs. 1.53 ± 0.40, p<0.001). Dix enfants ont présenté une DR sévère dont 5/22 porteurs d’une hernie de coupole diaphragmatique, 2/2 présentant un oligoanamnios, 1/3 présentant une coelosomie, ½ présentant un épanchement pleural et 1/16 dans un contexte d’anomalie de la placentation. En fixant un seuil du rapport à 2, la sensibilité et la spécificité de ce rapport pour identifier les enfants avec un risque de DR sévère étaient respectivement de 100% (IC 95% : 52-100%) et de 73% (IC 95% : 54-88%) (Figure 8) [25]. Cependant les performances de cet examen dans le seul but d’évalur la maturité pulmonaire fœtale reste discutables et son accès limité rend compliqué la diffusion de cette technique en routine.
Figure 8 : Evaluation du rapport signal Poumon/foie fœtal sur une coupe coronale par IRM, séquence T2[25].
Récemment, Palacio et al ont corrélé les données d’imagerie issues d’un logiciel de quantification de la texture pulmonaire par échographie « quantus FLM », au rapport surfactant/albumine sur liquide amniotique à partir d’une population de 103 femmes enceintes entre 24 et 41 SA (Figure 9) [27][28]. Ce logiciel était capable de prédire la maturité pulmonaire fœtale avec une sensibilité de 95,1% et une spécificité de 95%. Cette même équipe a étudié les performances de ce logiciel pour prédire le risque de morbidité respiratoire néonatale entre 25 et 39 SA. Pour cela, une analyse de la texture échographique du poumon fœtal était réalisée dans les 48h précédant la naissance. Sur un total de 730 cas, 101 enfants ont présenté des difficultés respiratoires à la naissance dont 66,3% de syndrome de détresse respiratoire et 33,7% de tachypnée transitoire.
« Quantus FLM » était capable de prédire le risque de morbidité respiratoire avec une sensibilité de 74,5%, une spécificité de 88,6%, une VPP de 51% et une VPN de 95,5% [29]. Toutefois cette technique requiert un logiciel spécifique de traitement de l’image ne permettant pas l’obtention d’un résultat en temps réel, et se base uniquement sur des données descriptives sans évaluation des propriétés biomécaniques intrinsèques du poumon fœtal.
Figure 9 : Risque de détresse respiratoire estimé par le logiciel « quantus FLM ». Après analyse de la texture pulmonaire obtenue sur un cliché du poumon sur une coupe des 4 cavités cardiaques, le logiciel estime le risque de morbidité respiratoire liée à l’âge gestationnel puis le risque ajusté après quantification
de la texture pulmonaire.
b. Détresse respiratoire néonatale et épidémiologie
L’évaluation prénatale de la fonction pulmonaire fœtale reste un défi pour les professionnels de la périnatalité et les examens d’imagerie à notre disposition ne permettent pas encore de déterminer précisément le niveau de maturité pulmonaire et le risque de détresse respiratoire à la naissance (DR). La DR est classiquement décrit comme un tableau clinique regroupant plusieurs symptomes respiratoires quelle que soit l’étiologie : tachypnée, signes de lutte respiratoire dont l’intensité est appréciée par le score de Silverman, ainsi qu’une cyanose pouvant être généralisée, intense ou modérée [30]. Elle peut être secondaire à une maladie des membranes hyalines, un retard de resorption du liquide pulmonaire, une inhalation méconiale ou une infection materno fœtale. La prématurité et les malformations pulmonaires congénitales sont deux grandes causes de DR chez le nouveau né.
La prématurité reste la première cause de détresse respiratoire et ce risque dépend de l’âge gestationnel de naissance. Le risque de syndrome de détresse respiratoire (SDR) est estimé entre 60 et
80% pour toutes naissances entre 26 et 28 SA, à 50 % avant 30 SA et entre 15-30% entre 32 et 36 SA [31–33]. Actuellement, les sociétés savantes s’accordent sur la persistance d’un risque de morbidité respiratoire (syndrome de détresse respiratoire et tachypnée transitoire secondaire à une retard de résorption du liquide alvéolaire) pour toute naissance survenant avant 39 semaines d’aménorrhée (SA). Cette zone grise comprend la période de prématurité tardive « late-preterm entre 34 0/7–36 6/7 semaines d’aménorhée (SA) et le terme précoce « early-term » entre 37 0/7–38 6/7 SA. Pour toute naissance survenant au cours de ces deux périodes, le risque de complications néonatales est largement décrit dans la littérature, en particulier concernant le risque de DR et d’hospitalisation prolongée en unité de soins intensifs [31–33]. Durant cette période, la morbidité respiratoire néonatale est estimée entre 5 à 20% et certaines situations peuvent augmenter le risque de DR alors que les poumons peuvent apparaître morphologiquement normaux : naissances par césarienne, diabète gestationnel déséquilibré, rupture prématurée des membranes [34,35]. Ainsi lorsque l’obstétricien et le pédiatre s’interrogent sur l’indication d’une naissance, ils comparent en permanence le risque qu’il existe à poursuivre la grossesse et celui de DR du nouveau-né.
Selon les données françaises de l’enquête nationale périnatale de 2016, 27% des enfants sont nés entre 34 et 39 SA. L’incidence de la prématurité tardive était de 5,3% et les enfants nés entre 34 et 37 SA représentaient 70 % de l’ensemble des prématurés [36]. La persistance du risque de DR durant cette période de prématurité tardive peut s’expliquer par une immaturité pulmonaire puisque les poumons sont encore au stade sacculaire pour toute naissance survenant avant 36 SA. Cette immaturité du tissu pulmonaire expose le nouveau-né à un risque de maladie des membranes hyalines et de DR transitoire. Durant cette période, l’incidence de la maladie des membranes hyaline est estimée à 10,5% chez les enfants nés à 34 SA versus 0,3% à 38 SA et s’explique principalement par un défaut de synthèse de surfactant [34]. La DR transitoire du nouveau-né est secondaire à un défaut de résorption du liquide pulmonaire s’accumulant dans les poumons à l’orgine d’une diminution de la compliance pulmonaire. L’incidence de cette DR transitoire est estimée à 6,4% à 34 SA versus 0,4% à 38 SA [37,38].
En 2018, nous avons étudié la prévalence de la DR chez les enfants nés entre 34 et 39 SA, dans notre maternité universitaire du CHU de Besançon au cours d’une étude rétrospective, cas témoin de janvier 2013 et Aout 2018. Les enfants présentant une pathologie pulmonaire ont été exclus. Un appariement a été réalisé sur le terme d’accouchement et l’année de naissance. Durant la période étudiée, nous avons relévé 15 522 naissances dont 4312 entre 34 et 39 SA (27,8%). L’incidence de la DR dans cette population était de 4,1% (n=176) avec une prédominance des MMH et de DR transitoire. Les prévalences de la DR était stable selon les années étudiées: 3,5 % en 2013 ; 3,02% en 2014, 3,8% en 2015 ; 5,5% en 2016 ; 4,7% en 2017 et 3,7 sur la période du premier janvier au 1 octobre 2018. Parmi les enfants ayant présenté une DR, 11,4% (n=20) ont nécéssité une intubation trachéale et 69,9% (n=123) une ventilation au masque. Comparé aux témoins, le diabète et la
naissance par césarienne avant travail représentaient deux facteurs de risque important de DR, respectivement OR = 2,2 [1,1-4,3], OR = 1,9 [1,1-3,1].
Certaines situations peuvent augmenter le risque de DR. En cas de rupture prématurée des membranes précoces, l’incidence de la DR à la naissnce varie entre 26,2 et 92,5% [39]. La hernie de coupole diaphragmatique est également à haut risque de DR à la naissance. Ce risque reste difficile à évaluer dans la littérature puisque beaucoup d’équipes intubent systématiquement les enfants à la naissance dans ces situations. L’analyse du registre des hernies de coupoles diaphragmatiques montre qu’environ 30% des enfants sont oxygénodépendant et ont besoin d’une Oxygénation Extra corporelle sur Oxygénateur à Membrane (ECMO) [40]. En cas malformations pulmonaires congénitales, l’incidence de la DR varie entre 13 et 49% selon les séries [41]. L’interpréatation de ces données est compliquée puisqu’il n’existe pas de définitions consensuelles sur les malformations pulmonaires congénitales dans la littérature. L’analyse de la cohorte RespiRare permet d’analyser des données en tenant compte des pratiques françaises [41] . Sur une cohorte de 90 enfants porteurs d’une malformations pulmonaires congénitales, 25% (n= 22) ont présenté une DR avec un support en oxygène nécessaire dans 13% des cas et une ventilation mécanique dans 11% des cas.
Actuellement, il reste difficile de réperer en période prénatale ces situations à risque de DR et plusieurs facteurs pronostiques sont décrits dans la littérature comme la compression médiastinale, l’échogénicité de la malformation ou son volume. Toutefois, l’identification des enfants les plus à risque permettrait de discuter l’injection maternelle d’une corticothérapie préventive et de définir le lieu de naissance le plus adapté.
c. Stratégies de prévention du risque de détresse respiratoire
Actuellement, l’injection maternelle de corticoïdes reste la principale stratégie pour réduire le risque de DR lors d’un accouchement prématuré. Le passage transplacentaire de certains corticoïdes (béthaméthasone, déxaméthasone) induit chez le foetus une augmentation de l’activité de la cytidylphophocholine estérase et une élévation de la concentration intracellulaire d’acides gras précurseurs. La stimulation du métabolisme phospholipidique et l’activation transcriptionnelle des gènes impliqués dans la synthèse des protéines SP-A, SP-B, SP-C et SP-D favorisent ainsi la production de surfactant [3]. Il est admis par l’ensemble des sociétés savantes que l’administration maternelle de corticoïdes réduit le risque de maladie des membranes hyalines (MMH) en cas d’accouchement prématuré entre 24 et 34 SA. Ces recommandations tiennent compte des résultats de la méta-analyse de Crowley qui retrouvait une réduction de l’incidence de la MMH d’environ 50% : 13,3 % (237/1780) pour le groupe traité par les corticoïdes versus 22,6 % (402/1780) dans le groupe contrôle, p <0,001. En ne considérant que les enfants nés dans l'intervalle compris entre les 24 heures et 7 jours suivant l'administration des glucocorticoïdes, la même différence significative était retrouvée : 10,2 % (87/855) dans le groupe traité contre 22,8 % (185/812) dans le groupe contrôle, p < 0,001 [42].
L'efficacité thérapeutique des corticoïdes est étroitement liée au délai entre l'injection et la naissance. La méta-analyse de Crowley dégage une efficacité maximale lorsque l'enfant naît entre 24 heures et 7 jours après le début de la cure [43]. Un délai physiologique est nécessaire pour permettre aux corticoïdes administrés de traverser la barrière placentaire (le pic sérique fœtal est obtenu 1 à 2 heures après l'administration maternelle). Ikegami et al. ont évalué la fonction pulmonaire d'agneaux prématurés après administration anténatale de bêtaméthasone. Les agneaux étaient sacrifiés à 126 jours de gestation (durée normale : 150 jours) après 8, 15, 24 ou 48 heures après la corticothérapie [44]. Les auteurs ont montré que la fonction pulmonaire des agneaux nés 8 heures après le début du traitement était comparable à celle des agneaux témoins alors que la fonction pulmonaire des agneaux nés 15 heures après était significativement améliorée, suggérant donc que l'efficacité des corticoïdes pourrait débuter entre 8 et 15 heures suivant la première injection. Cependant, l’efficacité semble limitée à 7 jours posant le problème de préserver ce bénéfice quand persiste un risque d’accouchement prématuré passéce délai. Cet épuisement thérapeutique est d’ailleurs d'autant plus marqué que l'âge gestationnel est bas [45].
Existe-t-il des effets secondaires lors de l’utilisation anténatale de corticoïdes ? Classiquement, on retrouve un effet freinateur de la corticothérapie sur l'axe hypophyso-surrénalien, étudié par Terrone et al [46], qui notent une baisse de 60 % de la cortisolémie à J1 chez les enfants ayant reçu de la betaméthasone en anténatal. La croissance et le développement cérébral peuvent aussi être altérés. Les études chez l’animal rapportent une diminution du poids du cerveau avec réduction neuronale irréversible après corticothérapie anténatale [47]. Les cures répétées de façon hebdomadaire sont abandonnées car le bénéfice néonatal est contre balancé par le risque de petit poids de naissance et de microcéphalie à long terme. L’étude prospective de French et al [48] sur 477 naissances prématurées met en évidence une réduction du poids de naissance et du périmètre crânien chez les enfants ayant reçu 3 cures ou plus. La réduction du poids de naissance est en moyenne de 9 % et celle du périmètre crânien de 4%. L’attitude adoptée par beaucoup d’équipes françaises, est donc de proscrire toute répétition systématique mais d’avoir éventuellement recours à une seconde cure uniquement en cas d’aggravation franche du risque d’accouchement prématuré si lapremière cure a été réalisée précocément durant la grossesse.
Comme nous l’avons expliqué précédement, il persiste encore une zone grise entre 34 et 39 SA. Il est actuellement démontré qu’il persiste un risque de DR pour toutes naissances avant 39 SA et certaines sociétés savantes s’interrogent sur l’utilité d’une cure de corticoide durant cette période. Les éventuels bénéfices sont contre balancés par le risque d’effets indésirables des corticoïdes. En tenant compte des résulats de l’essai randomisé « Antenatal Late Preterm Steroids Trial », l’American College of Obstetrician and Gynecologist recommande depuis 2017 l’utilisation des corticoïdes entre 34 et 36 SA+6 jours chez les patientes à risque d’accouchement dans les 7 jours suivant l’administration et n’ayant jamais reçu de corticoïdes. Cet essai retrouvait une réduction significative du risque d’assistance respiratoire dans les 3 jours suivant la naissance, 12,1% versus 8,1% (RR, 1.61;
95% CI, 1.38–1.88)[49]. Cette réduction concernait principalement le risque de tachypnée transitoire secondaire à un défaut de résorpbtion du liquide pulmonaire. Il n’existe pas encore de consencus en France sur l’utilisation des corticoïdes entre 34 et 39 SA.
L’injection systématique de corticoides entre 34 et 39 SA impliquerait d’exposer 95% d’enfants qui ne présenteront pas de détresse respiratoire à une thérapeutique responsable de certains effets secondaires. Il semble donc pertinent de développer des outils permettant de mieux sélectionnées les enfants à risque de DR chez qui une injection de corticoïdes serait bénéfique [50]. Actuellement, il n’existe pas d’essai évaluant l’intérêt d’une injection maternelle de corticoïde dans une population à risque sélectionnée par l’imagerie.
3. Objectifs de la thèse
L’objectif de cette thèse est de proposer une nouvelle approche du développement pulmonaire fœtal humain à travers l’étude de son élasticité au cours de la gestation grâce à l’utilisation de l’élastographie ultrasonore impulsionnelle 2D. Actuellement, l’échographie et l’IRM sont les principaux outils dédiés à l’exploration du poumon et l’élastographie n’a pas encore été proposée comme une méthode d’imagerie fonctionnelle prénatale. Différentes raisons peuvent être citées : systèmes d’imagerie par élastographie non construits pour la femme enceinte, absence de données de vigilance chez le fœtus humain exposés à cette technique, limites d’exploration supposées et absence de données précises sur les modalités d’utilisation chez le fœtus.
Dans la première partie de la thèse, nous décrivons les différentes techniques d’élastographie et précisons lesquelles paraissent les plus adaptées à l’exploration des organes du fœtus. Nous proposons ensuite une revue de la littérature concernant les applications de l’élastographie ultrasonore en médecine néonatale et en médecine fœtale.
La deuxième partie est consacrée à la description des facteurs susceptibles d’influencer la mesure de l’élasticité du poumon fœtal par 2D-SWE. Pour répondre à cette question, nous avons d’abord cherché à établir les facteurs limitant la mesure de l’élasticité d’un tissu mou par 2D-SWE selon une approche fondamentale avec l’utilisation de tests rhéométriques.
Dans une troisième partie, nous rapportons les résultats de deux études pilotes évaluant la faisabilité et la reproductibilité de la mesure de l’élasticité pulmonaire fœtale par Elastographie Shear Wave (2D-SWE). Nous précisons également pourquoi il semble pertinent de comparer l’évolution de l’élasticité pulmonaire à celle du foie via la modélisation d’un index d’élasticité : Lung to liver elastography ratio (LLE). Nous discutons de la technique de mesure, du nombre de mesures nécessaires pour estimer l’élasticité moyenne et de l’impact de la profondeur d’exploration sur le calcul de l’élasticité pulmonaire moyenne.
Dans une quatrième et dernière partie, nous étudions les variations du coefficient d’élasticité dans deux situations où sont attendues des modifications des propriétés tissulaires pulmonaires : dans un modèle d’occlusion trachéale chez le singe d’une part, et lors de l’exploration de pathologies pulmonaires congénitales d’autre part.
PREMIERE PARTIE
L’élastographie par ondes de cisaillement : état de l’art,
applications en médecine fœtale et néonatale
1. Bases fondamentales de l’élastographie ultrasonore
a. Propriétés physiques des ondes ultrasonores
Par définition, les ondes ultrasonores sont des ondes acoustiques mécaniques dont la fréquence d’émission est supérieure à la fréquence audible par l’oreille humaine soit environ 15 kHz. Au delà de 15 GHz, on parle d’hypersons. Les fréquences ultrasonores utilisées dans le milieu médical sont habituellement comprises entre 1 et 15 MHz. L’utilisation d’ultrasons avec une fréquence > à 1 MHz permet l’obtention d’un faisceau ultrasonore. Différents paramètres physiques sont nécessaires pour décrire une onde ultrasonore : l’axe de déplacement des particules, l’amplitude du mouvement particulaire, la célérité et l’énergie transportée.
Selon la nature du milieu traversé (fluide ou solide), une onde peut être décrite par une grandeur vectorielle par le déplacement particulaire qu’elle engendre. Dans ce cas, l’onde se comporte comme une onde élastique. Selon la nature du milieu traversé, différents types d’ondes élastiques peuvent se propager : onde de compression et onde de cisaillement.
Pour une amplitude A0 donnée, la vitesse de déplacement des particules autour de leur position de repos est proportionnelle à la fréquence de l’onde. Cette notion ne doit pas être confondue avec la célérité de l’onde ultrasonore, c. La propagation d'une onde dans un milieu non absorbant permet de relier la célérité, c, aux propriétés mécaniques du milieu que sont la densité ρ, et le module d’élasticité, E:
c = (E ρ -1)1/2
Ainsi, la célérité d’une onde ultrasonore ne dépend que de la nature du milieu traversé défini par sa compressibilité (c'est-à-dire l’aptitude à reprendre la forme originale après déformation) et sa masse volumique.
Une onde ultrasonore qui se propage transporte de l’énergie. L'énergie e d'une masse m qui oscille de part et d'autre d'une position d’équilibre, est à chaque instant la somme de son énergie cinétique et de son énergie potentielle. En l'absence de frottement, e est indépendant du temps. Lorsque la vitesse u est nulle, l'énergie cinétique, 1/2 mu2, est nulle aussi et l'énergie potentielle est maximum. Inversement, lorsque la vitesse passe par son maximum, u0, l'énergie cinétique est maximum et l’énergie potentielle est nulle. A chaque instant, l'énergie totale de la particule est donc :
![Figure 3 : Evolution du volume pulmonaire fœtal au cours de la grossesse (cm 3 ), estimé par échographie volumique, d’après Gérard et al[13]](https://thumb-eu.123doks.com/thumbv2/123doknet/7725556.248814/25.892.254.615.540.909/figure-evolution-pulmonaire-grossesse-estimé-échographie-volumique-gérard.webp)

![Figure 8 : Evaluation du rapport signal Poumon/foie fœtal sur une coupe coronale par IRM, séquence T2[25]](https://thumb-eu.123doks.com/thumbv2/123doknet/7725556.248814/28.892.256.594.510.806/figure-evaluation-rapport-signal-poumon-fœtal-coronale-séquence.webp)

![Figure 19 : Recommandations British Médical Ultrasound Society fixant la durée d’examen recommandée en fonction de l’index thermique [72]](https://thumb-eu.123doks.com/thumbv2/123doknet/7725556.248814/49.892.225.658.796.1019/recommandations-british-médical-ultrasound-society-recommandée-fonction-thermique.webp)



