Séquestration géologique du CO
2
par
carbonatation minérale dans les résidus
miniers
Thèse
Karl Dominique Lechat
Doctorat interuniversitaire en sciences de la Terre
Philosophiae doctor (Ph.D.)
Québec, Canada
Séquestration géologique du CO
2
par
carbonatation minérale dans les résidus
miniers
Thèse
Karl Dominique Lechat
Sous la direction de :
Jean-Michel Lemieux, directeur de recherche John Molson, codirecteur de recherche Réjean Hébert, codirecteur de recherche
iii
Résumé
La carbonatation minérale dans les résidus miniers est un moyen sûr et permanent de séquestrer le CO2 atmosphérique. C’est un processus naturel et passif qui ne nécessite
aucun traitement particulier et donc avantageux d’un point de vue économique. Bien que la quantité de CO2 qu’il soit possible de séquestrer selon ce processus est faible à l’échelle
globale, dans le cadre d’un marché du carbone, les entreprises minières pourraient obtenir des crédits et ainsi revaloriser leurs résidus. À l’heure actuelle, il y a peu d’informations pour quantifier le potentiel de séquestration du CO2 de façon naturelle et passive dans les piles
de résidus miniers. Il est donc nécessaire d’étudier le phénomène pour comprendre comment évolue la réaction à travers le temps et estimer la quantité de CO2 qui peut être
séquestrée naturellement dans les piles de résidus.
Plusieurs travaux de recherche se sont intéressés aux résidus miniers de Thetford Mines (Québec, Canada), avec une approche principalement expérimentale en laboratoire. Ces travaux ont permis d’améliorer la compréhension du processus de carbonatation, mais ils nécessitent une validation à plus grande échelle sous des conditions atmosphériques réelles.
L’objectif général de cette étude est de quantifier le processus de carbonatation minérale des résidus miniers sous des conditions naturelles, afin d’estimer la quantité de CO2 pouvant
être piégée par ce processus. La méthodologie utilisée repose sur la construction de deux parcelles expérimentales de résidus miniers situées dans l’enceinte de la mine Black Lake (Thetford Mines). Les résidus miniers sont principalement constitués de grains et de fibres de chrysotile et lizardite mal triés, avec de petites quantités d’antigorite, de brucite et de magnétite. Des observations spatiales et temporelles ont été effectuées dans les parcelles concernant la composition et la pression des gaz, la température des résidus, la teneur en eau volumique, la composition minérale des résidus ainsi que la chimie de l’eau des précipitations et des lixiviats provenant des parcelles. Ces travaux ont permis d’observer un appauvrissement notable du CO2 dans les gaz des parcelles (< 50 ppm) ainsi que la
précipitation d’hydromagnésite dans les résidus, ce qui suggère que la carbonatation minérale naturelle et passive est un processus potentiellement important dans les résidus miniers. Après 4 ans d’observations, le taux de séquestration du CO2 dans les parcelles
iv
Ces observations ont permis de développer un modèle conceptuel de la carbonatation minérale naturelle et passive dans les parcelles expérimentales. Dans ce modèle conceptuel, le CO2 atmosphérique (~ 400 ppm) se dissout dans l'eau hygroscopique
contenue dans les parcelles, où l'altération des silicates de magnésium forme des carbonates de magnésium. La saturation en eau dans les cellules est relativement stable dans le temps et varie entre 0,4 et 0,65, ce qui est plus élevé que les valeurs de saturation optimales proposées dans la littérature, réduisant ainsi le transport de CO2 dans la zone
non saturée. Les concentrations de CO2 en phase gazeuse, ainsi que des mesures de la
vitesse d'écoulement du gaz dans les cellules suggèrent que la réaction est plus active près de la surface et que la diffusion du CO2 est le mécanisme de transport dominant dans les
résidus.
Un modèle numérique a été utilisé pour simuler ces processus couplés et valider le modèle conceptuel avec les observations de terrain. Le modèle de transport réactif multiphase et multicomposant MIN3P a été utilisé pour réaliser des simulations en 1D qui comprennent l'infiltration d'eau à travers le milieu partiellement saturé, la diffusion du gaz, et le transport de masse réactif par advection et dispersion. Même si les écoulements et le contenu du lixivat simulés sont assez proches des observations de terrain, le taux de séquestration simulé est 22 fois plus faible que celui mesuré. Dans les simulations, les carbonates précipitent principalement dans la partie supérieure de la parcelle, près de la surface, alors qu’ils ont été observés dans toute la parcelle. Cette différence importante pourrait être expliquée par un apport insuffisant de CO2 dans la parcelle, qui serait le facteur limitant la
carbonatation. En effet, l’advection des gaz n’a pas été considérée dans les simulations et seule la diffusion moléculaire a été simulée. En effet, la mobilité des gaz engendrée par les fluctuations de pression barométrique et l’infiltration de l’eau, ainsi que l’effet du vent doivent jouer un rôle conséquent pour alimenter les parcelles en CO2.
v
Abstract
Mineral carbonation in ultramafic mining wastes is a safe and permanent way to sequester atmospheric CO2. This process can occur naturally and passively, and does not require
special treatment, which is interesting from an economical point of view. In the context of a carbon market, mining companies could obtain carbon credits and profit financially and environmentally from their residues. However, there is currently insufficient information to accurately assess the potential for natural and passive CO2 sequestration in mining waste
piles. It is therefore necessary to study the phenomenon to understand how the reaction evolves over time and estimate the amount of CO2 that can be naturally sequestered in
these structures.
Several research studies have focused on the ultramafic milling wastes at Thetford Mines (Quebec, Canada), and have particularly focused on laboratory experiments. The results have improved our understanding of the mineral carbonation process in milling waste, but they need to be tested at larger scales and under real atmospheric conditions.
The general objective of this study is to quantify the mineral carbonation process in mining waste under natural conditions, and to estimate the amount of CO2 that can be trapped by
this process. The methodology is based on the construction of two experimental cells of milling waste located at the Black Lake mine (Thetford Mines). The magnesium-rich milling wastes mainly consist of poorly sorted grains and fibers of lizardite and chrysotile, with smaller amounts of antigorite, brucite and magnetite. Spatial and temporal observations were made in the cells, including measurements of the composition and pressure of gas, soil temperature, volumetric water content, waste mineralogy as well as water chemistry of rain and of the cell leachate. The observations showed evidence of a significant depletion of CO2 gas concentrations (< 50 ppm) and precipitation of hydromagnesite in the milling
waste, suggesting that natural and passive mineral carbonation is a potentially important process in milling wastes. After four years of observations, the CO2 sequestration rates in
the experimental cells were estimated at between 3.5 and 4 kg/m3/year.
These observations have led to the development of a conceptual model of natural and passive mineral carbonation at the cell scale. In this conceptual model, atmospheric CO2 (~ 400 ppm) dissolves in the hygroscopic water contained in the cells where the weathering of magnesium silicates forms magnesium carbonates. Water saturation in the cells was
vi
relatively stable over time and varied between 0.4 and 0.65, which is higher than optimal saturation values proposed in the literature, reducing CO2 transport in the unsaturated zone. Gas-phase CO2 concentrations along with gas flow rate measurements in the cells suggest that the reaction is most active close to the surface and that diffusion of CO2 is the dominant transport mechanism in the wastes. Although the carbonation reaction is exothermic, no evidence of thermal convection has been observed in the experimental cells.
A numerical model was used to simulate the identified coupled processes and to validate the conceptual model with field observations. The numerical model MIN3P, for multiphase and multi-component reactive transport problems, was used to complete 1D simulations which included water infiltration through the partially-saturated column, gas diffusion, and advective-dispersive reactive mass transport. Although the calibrated moisture content and leachate composition were quite close to field observations, the simulated sequestration rate is 22 times lower than the measured rate. The simulation results also suggested that carbonates would precipitate mainly near the surface whereas field observations suggest that mineral carbonation had occurred throughout the vertical profile. This significant difference could be explained by an insufficient supply of CO2 in the simulated cells, which
is the limiting factor for mineral carbonation, suggesting that gas advection, which was not considered in the simulations, could have been important. It is concluded that gas mobility generated by barometric pressure fluctuations and water infiltration, as well as wind effects, likely played a significant role for CO2 supply within the cells and should be considered in
vii
Table des matières
Résumé _______________________________________________________________ iii Abstract ________________________________________________________________ v Table des matières ______________________________________________________ vii Liste des tableaux ________________________________________________________ x Liste des figures _________________________________________________________ xi Remerciements ________________________________________________________ xiv Avant-propos __________________________________________________________ xvi
CHAPITRE 1 Introduction, problématique et objectifs. _________________________ 1 1.1 Contexte général _________________________________________________ 2 1.2 La carbonatation minérale _________________________________________ 4 1.2.1 Définition ____________________________________________________________ 4 1.2.2 Dissolution minérale ___________________________________________________ 5 1.2.2.1 La structure cristalline ______________________________________________ 5 1.2.2.2 Le milieu réactionnel _______________________________________________ 6 1.2.3 Approvisionnement en CO2 ______________________________________________ 7 1.2.4 Précipitation des carbonates _____________________________________________ 9 1.2.5 Stabilité des carbonates ________________________________________________ 9 1.2.6 Différents types de carbonatation minérale _________________________________ 11
1.3 Différentes approches pour la carbonatation minérale _________________ 12
1.3.1 Carbonatation minérale d’origine biologique. _______________________________ 13 1.3.2 Carbonatation minérale in situ ___________________________________________ 13 1.3.3 Carbonatation minérale dans des réacteurs industriels _______________________ 14 1.3.4 Carbonatation minérale dans les résidus industriels et miniers. _________________ 16
1.4 Processus couplés et modélisation numérique _______________________ 17
1.4.1 Carbonatation minérale dans les résidus industriels et miniers. _________________ 17 1.4.2 Simulations numériques avec MIN3P _____________________________________ 19
1.5 La carbonatation minérale dans les résidus miniers ultramafiques de
Thetford Mines _______________________________________________________ 22
viii
1.5.2 État des connaissances et des recherches _________________________________ 26
1.6 Objectifs _______________________________________________________ 29 1.7 Méthodologie générale et organisation de la thèse ____________________ 30 CHAPITRE 2 Field evidence of CO2 sequestration by mineral carbonation in
ultramafic milling wastes, Thetford Mines, Canada _________________________ 32 Abstract _____________________________________________________________ 33 Résumé _____________________________________________________________ 34 2.1 Introduction ____________________________________________________ 35 2.2 Materials and methods ___________________________________________ 37 2.3 Results ________________________________________________________ 43 2.3.1 Material properties ____________________________________________________ 43 2.3.2 Field observations ____________________________________________________ 45 2.3.3 Mineralogical observations _____________________________________________ 53 2.4 Discussion _____________________________________________________ 56 2.5 Conclusions ____________________________________________________ 63 CHAPITRE 3 Mineral carbonation in ultramafic milling wastes at Thetford Mines,
Quebec, Canada : Aqueous chemistry and 1D numerical simulations ________ 64 Abstract _____________________________________________________________ 65 Résumé _____________________________________________________________ 66 3.1 Introduction ____________________________________________________ 67 3.2 Field cells and conceptual model __________________________________ 69 3.3 Aqueous chemistry and carbon content _____________________________ 71
3.3.1 Aqueous chemistry ___________________________________________________ 71 3.3.2 Carbon content ______________________________________________________ 74
3.4 Numerical model ________________________________________________ 76
3.4.2 Calibration __________________________________________________________ 83 3.4.3 Long-term simulation __________________________________________________ 88
ix
3.5 Discussion _____________________________________________________ 90 3.6 Conclusions ____________________________________________________ 93 Chapitre 4 Conclusion générale __________________________________________ 95
4.1 Principales contributions _________________________________________ 97 4.2 Recommandations et travaux futurs suggérés ______________________ 100 Bibliographie _________________________________________________________ 103 Annexes _____________________________________________________________ 118
Annexe 1 : Analyses minéralogiques ____________________________________ 119 Annexe 2 : Mesures chimiques des lixiviats et de la pluie __________________ 128 Annexe 3 : Fichier d’entrée dans MIN3P _________________________________ 140 Annexe 4 : Bilan de masse dans MIN3P _________________________________ 159 Annexe 5 : Données météorologiques ___________________________________ 161
x
Liste des tableaux
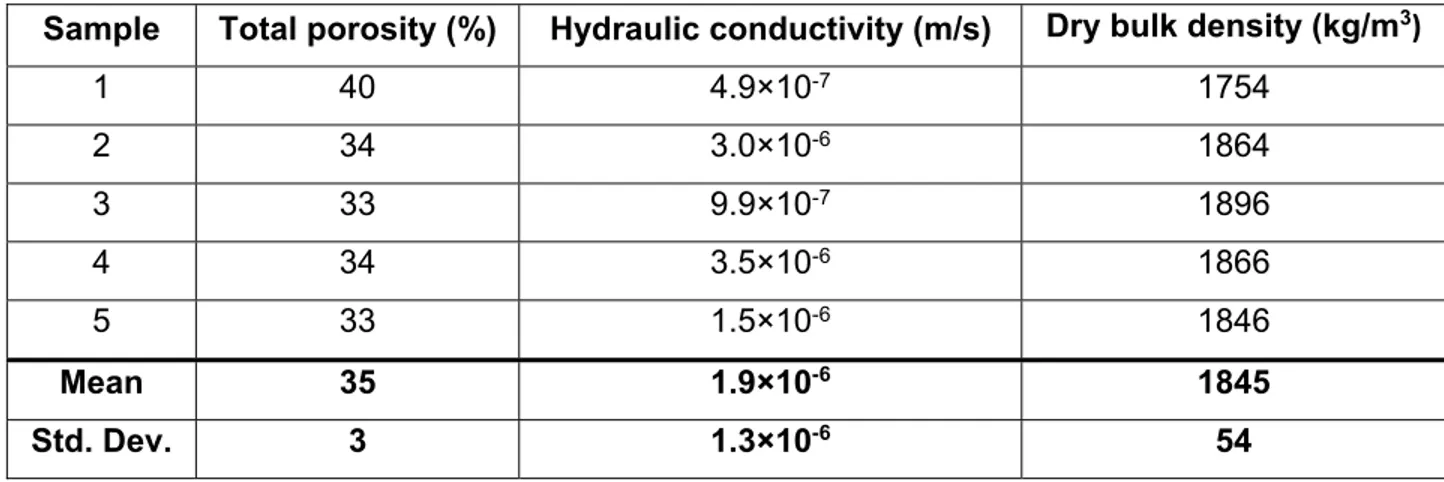
Table 2.1 : Porosity, saturated hydraulic conductivity and density for five samples of
mining waste from the LAB Chrysotile mine _________________________________ 44
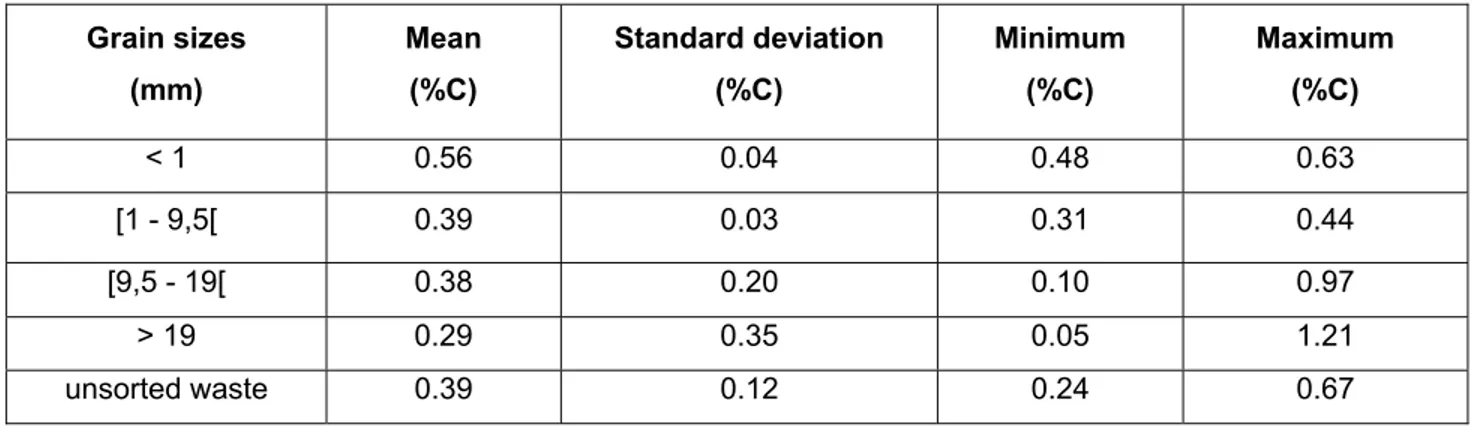
Table 2.2 : Summary of meteorological data collected in 2013 _____________________ 46 Table 2.3 : Carbon content of the milling wastes at Thetford Mines, grouped by grain size
distribution __________________________________________________________ 56
Table 3.1 : Parameter values considered in the MIN3P model _____________________ 79 Table 3.2 : Rain composition applied in the MIN3P model ________________________ 80 Table 3.3 : Equilibrium constants, effective rate constants and mass/volume fractions for
the mineral phases and gases considered in the simulations ___________________ 81
Tableau A1.1 : Récapitulatif des travaux réalisés en laboratoire (MEB, DRX et ELTRA 800
C-S) sur les échantillons prélevés lors de la destruction de la parcelle 1 _________ 120
Tableau A2.1 : Analyse de la chimie de la pluie collectée sur à la mine Black Lake
(Thetford Mines) _____________________________________________________ 128
Tableau A2.2 : Analyse de la chimie du lixiviat de la parcelle expérimentale 1 _______ 132 Tableau A2.3 : Analyse de la chimie du lixiviat de la parcelle expérimentale 2 _______ 136 Tableau A4.1 : Bilan de masse des principaux composants pris en compte lors de la
simulation sur 4 ans avec le logiciel MIN3P ________________________________ 159
Tableau A4.2 : Bilan de masse des phases minérales pris en compte lors de la simulation
xi
Liste des figures
Figure 1.1 : Distribution des espèces majeures de carbone inorganique dissout à 20°C
__________________________________________________________________ 8
Figure 1.2 : Inventaire des différents procédés de carbonatation minérale _________ 11 Figure 1.3 : Flux de matière et processus associés à la carbonatation industrielle de
matières premières minérales et les déchets industriels alcalins _______________ 15
Figure 1.4 : Localisation de Thetford Mines au Québec ________________________ 22 Figure 1.5 : Photographie aérienne de la mine et du parc à résidus de Black Lake à
Thetford Mines _____________________________________________________ 23
Figure 1.6 : Carte géologique des Appalaches au Québec _____________________ 25 Figure 2.1 : Experimental Cell 1 at the LAB Chrysotile mine (Thetford Mines, Quebec,
Canada) ___________________________________________________________ 40
Figure 2.2 : Vertical cross-section profiles of the experimental cells showing dimensions
and monitoring instrumentation ________________________________________ 40
Figure 2.3 : The water retention curve of sample 4, which was fitted using the Van
Genuchten (1980) model _____________________________________________ 45
Figure 2.4 : Data measured at Cell 1 between June 2012 and February 2014, showing
a) Atmospheric temperatures and CO2 concentrations, b) Rain and snowpack, c)
water saturations, and d) temperatures and CO2 concentrations in the vertical profile
in the center of the experimental cell ____________________________________ 46
Figure 2.5 : CO2 concentrations versus temperature in the vertical profile at the center of
the experimental cell ________________________________________________ 49
Figure 2.6 : Observed atmospheric CO2 concentrations versus cell CO2 concentrations
(gas sample port #17), measured at Thetford Mines (LAB Chrysotile mine) ______ 50
Figure 2.7 : Observed atmospheric CO2 concentrations versus atmospheric
xii
Figure 2.8 . 2D distributions of a) temperature, b) water saturation and c) CO2(g)
concentration in the half-cell of Cell 1 ___________________________________ 52
Figure 2.9 : SEM analyses showing different evolutionary stages of the carbonation
reaction at the surface of the milling wastes. a) Observation of the carbonates birth on the surface of magnesium silicates, b) the lamellar structures overlap increasingly the magnesium silicates, c) the carbonates completely cover the magnesium silicates, and d) general view of the sample with the locations of the zooms a) b) and c) ___ 54
Figure 2.10 : SEM analyses, thin section of magnesium silicate (milling waste) and new
carbonated mineral phase ____________________________________________ 55
Figure 2.11 : 2D spatial distribution of carbon content in milling wastes after 4 years _ 56 Figure 2.12 : Conceptual model of the physical processes assumed to occur during
mineral carbonation within the experimental cells containing ultramafic
mining residues _____________________________________________________ 61
Figure 3.1 : Conceptual model of the physical processes assumed to occur during
mineral carbonation within the experimental cells containing ultramafic mining
residues __________________________________________________________ 70
Figure 3.2 : Chemical evolution of the leachate composition over time in experimental
Cell 1 _____________________________________________________________ 72
Figure 3.3 : Chemical evolution of the leachate composition over time in experimental
Cell 2 ____________________________________________________________ 73
Figure 3.4 : Carbon content variations with depth within experimental Cell 1 and Cell 2
_________________________________________________________________ 76
Figure 3.5 : Conceptual model used for the MIN3P numerical simulations __________ 78 Figure 3.6 : Comparison of the water saturations measured in Cell 1 with the water
saturations calculated by MIN3P over 4 years _____________________________ 84
Figure 3.7 : Model calibration showing a) the simulated CO2(gas) (at 35 cm) and
b) simulated pH, c) Mg concentrations and d) alkalinity measured in the cell leachate (at 0 cm), compared to the observed data ________________________________ 86
Figure 3.8 : Simulated spatial distribution of selectedmineral phases and porosity, at t=0
and t=4 years ______________________________________________________ 87
Figure 3.9 : Simulated spatial distribution of mineral phases : initial condition (t0), and
after 10, 50 and 100 years ____________________________________________ 89
xiii
Figure A1.1 : Plan d’échantillonnage des résidus miniers de la parcelle expérimentale 1
réalisé lors de la destruction, au niveau du plan vertical instrumenté __________ 119
Figure A1.2 : Analyse DRX des résidus frais mis en place lors de la construction de la
parcelle expérimentale 1 ____________________________________________ 121
Figure A1.3 : Analyse DRX de la poudre prélevée à la surface des blocs des résidus de
l’échantillon n°2 ___________________________________________________ 122
Figure A1.4 : Analyse DRX de la poudre prélevée à la surface des blocs des résidus de
l’échantillon n°7 ___________________________________________________ 123
Figure A1.5 : Analyse DRX de la poudre prélevée à la surface des blocs des résidus de
l’échantillon n°20 __________________________________________________ 124
Figure A1.6 : Observation au MEB des carbonates précipités (structures lamellaires) à
la surface des résidus de l’échantillon n°7 _______________________________ 125
Figure A1.7 : Spectre obtenu par analyse EDS (analyse dispersive en énergie) des
carbonates observés lors de l’analyse au MEB de l’échantillon n°7 ___________ 125
Figure A1.8 : Observation au MEB des carbonates précipités (structures en nids
d’abeilles) à la surface des résidus de l’échantillon n°10 ____________________ 126
Figure A1.9 : Spectre obtenu par analyse EDS (analyse dispersive en énergie) des
carbonates observés lors de l’analyse au MEB de l’échantillon n°10 __________ 126
Figure A1.10 : Spectre obtenu par analyse EDS (analyse dispersive en énergie)
des serpentines (minéraux lisses) observés lors de l’analyse au MEB de
xiv
Remerciements
Je tiens d’abord à remercier mon directeur de thèse, le professeur Jean-Michel Lemieux, pour son encadrement et son soutien tout au long de cette expérience. Ses connaissances et ses conseils avisés m’ont permis d’évoluer, de progresser et de mener à bien ce projet. Je lui suis profondément reconnaissant de m’avoir fait bénéficier de son expérience, d’avoir investi du temps, et surtout, d’avoir cru en moi. Que ce soit pendant les recherches ou la rédaction, je le remercie de m’avoir conseillé et guidé jusqu’au bout de ce projet.
Je remercie également mes codirecteurs, les professeurs John Molson et Réjean Hébert, ainsi que le professeur Georges Beaudoin pour leur soutien moral et financier. Ils ont toujours été disponibles pour répondre à mes questions et m’orienter dans mes recherches. Leurs conseils pour l’analyse des données et leurs interprétations, ainsi que les recommandations concernant la rédaction des articles et des présentations orales m’ont permis d’améliorer la qualité du travail qui a été produit. Je remercie particulièrement John de m’avoir aidé pour la modélisation, une étape importante et compliquée, et aussi d’avoir fortement contribué à la correction de mes écrits en anglais. Je remercie les personnes qui composent le groupe de recherche CO2 : Josée Duchesne,
Marc Constantin, Faïçal Larachi, Antoine Gras, Gnouyaro Palla Assima et Joniel Tremblay. Les discussions, les commentaires et le partage des connaissances lors des réunions se sont avérés très utiles pour l’avancement du projet de recherche. Je remercie les stagiaires et assistants qui ont participés à ce projet, tout particulièrement Micha Horswill.
Je remercie aussi le personnel du département de géologie et de génie géologique de m’avoir accompagné et assisté durant ce projet de recherche. Sans tous les nommer, je remercie particulièrement Martin Plante, Pierre Thérrien, Edmond Rousseau et les personnes du secrétariat pour l’aide précieuse qu’ils m’ont apportée.
Je remercie les professeurs Josée Duchesne, Faïçal Larachi et Benoit Plante d’avoir accepté d’être membre du jury des examens que j’ai dû passer au cours de ce doctorat. Personnellement, je pense que faire une thèse est une vraie épreuve d’endurance. Au cours de cette expérience, j’ai fait la connaissance de nouvelles personnes avec qui j’ai
xv
partagé des moments forts et qui ont été indispensables pour pouvoir finir ce projet. Je dois remercier mes collègues et amis de m’avoir soutenu et d’avoir su apporter une belle ambiance au quotidien. Merci tout particulièrement à Antoine, Olivier, Arnaud, Nicolas, Nelly, Fabien, Elham, Tobias, Guillaume, Jalil et Ali (et leurs moitiés). J’espère qu’un jour, on se retrouvera autour d’une bonne pinte pour se remémorer nos souvenirs. Je remercie aussi Pierre et Lucie de m’avoir accompagné depuis le début de cette aventure. Merci aussi à ceux qui m’ont accueilli et aidé depuis mon arrivée. Je pense en autre à Dominique et Vincent ainsi qu’à Roger et Noëlla. J’ai une pensée aussi pour toutes les belles rencontres : Yan, Cathoune, Bernard et Estelle, Heythem, Sophie, Simon et plein d’autres. Merci pour tous les bons moments passés ensemble.
Je remercie mes amis de France qui m’accompagnent depuis l’âge de 3 ans pour certains. Ils ont su me faire oublier, le temps des visites, le quotidien d’un étudiant au doctorat. Je ne remercierai jamais assez mes parents, Dominique et Nathalie, mon frère Antoine et ma sœur Mathilde pour leur amour, leurs sacrifices, leurs encouragements, leur soutien et la confiance qu’ils me portent depuis toujours. Merci d’avoir cru en moi depuis le début et de m’avoir permis d’en arriver là.
Je remercie aussi Marcel et Denise de m’avoir accueilli dans leur famille et considéré comme l’un des leur. Les petits tours à Sainte-Luce-sur-Mer et les parties de pêches ont été des moments importants et remplis de bonheur pendant ces années de doctorat. Enfin, je remercie particulièrement « ma blonde » Stéphanie, que j’ai rencontrée au début de ce doctorat. Merci de m’avoir encouragé, soutenu et supporté tout au long de ce projet. Plus de 4 ans quand même! Merci d’avoir été si patiente et tolérante pour tous les moments où j’étais absent physiquement ou tout simplement perdu dans mes pensées. Je te remercie de m’avoir remonté le moral et d’avoir aiguayé mes journées quand c’était nécessaire. Finalement, j’ai une pensée particulière pour mon petit bébé Lili, qui ne m’a pas toujours facilité la tâche pour terminer ce doctorat, mais qui m’a apporté tellement de joie et de motivation. Merci d’avoir été mon rayon de soleil mes petites poulettes.
xvi
Avant-propos
Le présent mémoire de thèse comporte quatre chapitres. Le Chapitre 1 (Introduction) est une revue de la littérature portant sur la carbonatation minérale en général et sur les différentes approches qui ont été suivies pour utiliser cette réaction dans le but de piéger le CO2. Ensuite, les études concernant la carbonatation minérale dans les résidus miniers
de Thetford sont inventoriées, pour enfin décrire les objectifs de cette thèse et la méthodologie utilisée. Les chapitres 2 et 3 portent sur les travaux expérimentaux, l’analyse et l’interprétation des données, et les simulations numériques. Ces travaux ont donné lieu à deux publications scientifiques dont je suis l’auteur principal, et dont Jean-Michel Lemieux, John Molson, Georges Beaudoin et Réjean Hébert sont coauteurs. La première publication a été acceptée dans la revue scientifique internationale « International Journal of Greenhouse Gas Control », l’autre sera soumise à la revue « Greenhouse Gases: Science and Technology». Le chapitre 4 est une synthèse du travail et des conclusions de ce doctorat, où quelques suggestions sont proposées pour continuer les recherches sur le sujet.
En tant qu’auteur principal, j’ai moi-même élaboré les protocoles expérimentaux et j’ai participé à la construction des montages expérimentaux présentés dans les chapitres 2 et 3. J’ai réalisé ou supervisé toutes les expériences et les simulations numériques, et j’ai moi-même analysé et interprété les données. Je suis l’auteur de la majeure partie du texte, des figures et des tables. Jean-Michel Lemieux, John Molson, Georges Beaudoin et Réjean Hébert m’ont conseillé et supervisé tout au long du doctorat. Ils ont aussi révisé et contribué à améliorer les manuscrits produits pendant ce projet de recherche.
Lechat, K., Lemieux, J.-M., Molson, J., Beaudoin, G., Hébert, R., 2016. Field evidence of CO2 sequestration by mineral carbonation in ultramafic milling wastes, Thetford Mines,
Canada. Int. J. Greenh. Gas Control 47, 110–121. doi:10.1016/j.ijggc.2016.01.036 Lechat, K., Molson, J., Lemieux, J.-M., Beaudoin, G., Hébert, R., Mineral carbonation in ultramafic milling wastes at Thetford Mines, Quebec, Canada: Aqueous chemistry and 1D numerical simulations. À soumettre au journal Greenhouse Gases: Science and Technology.
xvii
Certains des résultats présentés dans cette thèse ont été présentés lors des conférences suivantes :
Lechat, K., Lemieux, J.-M., Molson, J., Beaudoin, G., Hébert, R., 2015. CO2 Sequestration
by Mineral Carbonation in Milling Wastes at Thetford Mines (Québec, Canada): Monitoring Experimental Cells under Atmospheric Conditions. 5th International Conference on Accelerated Carbonation for Environmental and Materials Engineering June 21-24, 2015 – Columbia University, New York City, USA
Lechat, K., Lemieux, J.-M., Molson, J., Beaudoin, G., Hébert, R. Monitoring CO2
Sequestration by Mineral Carbonation in Mine Tailings at Thetford Mines, Quebec, Canada. Présentation d’affiche au AGU FALL MEETING 2014 (The American Geophysical Union), 2014 – San Francisco, Californie, USA.
Lechat, K., Lemieux, J.-M., Molson, J., Beaudoin, G., Hébert, R. Observation de la carbonatation minérale naturelle dans les résidus miniers ultramafiques de Thetford Mines. Présentation d’affiche à la journée des Sciences de la Terre, 2014 – Université Laval, Québec, Canada.
Lechat, K., Lemieux, J.-M., Molson, J., Beaudoin, G., Hébert, R. Observation du piégeage du CO2 par carbonatation minérale dans les résidus miniers de Thetford Mines. 81e du
Congrès de l’Acfas Colloque 217 – La séquestration du carbone : solutions pour réduire et compenser nos émissions de CO2 dans l’atmosphère, 2013 – Québec, Canada.
Lechat, K., Lemieux, J.-M., Molson, J., Beaudoin, G., Hébert, R. Carbonatation minérale dans les résidus miniers. Présentation orale à la journée des Sciences de la Terre, 2012 – Université Laval, Québec, Canada.
1
CHAPITRE 1
2
1.1 Contexte général
Le réchauffement climatique est un problème environnemental majeur pour la planète. L’augmentation de l’activité industrielle et l’exploitation accrue des énergies fossiles ont pour conséquences le dérèglement de systèmes sensibles et fragiles tel que l’environnement. Des études menées par le Groupe d'experts intergouvernemental sur l'évolution du climat (GIEC) ont montré une augmentation des concentrations de gaz à effet de serre (GES) dont les principaux sont le méthane (CH4), le dioxyde de carbone (CO2), le protoxyde d’azote ou
oxyde nitreux (N2O), l’ozone (O3), les chlorofluocarbones (CFC), les hydrocarbures
halogènes (HFC, PCF), l’hexafluorure de soufre (SF6) et l’eau (H2O) (IPCC, 2007). Ces gaz
jouent un rôle essentiel dans la régulation de la température terrestre. Le CO2 à lui seul,
avec une durée de vie atmosphérique excédant 100 ans, contribuerait pour environ 55 % du réchauffement planétaire. Toujours selon le GIEC, les rejets annuels de CO2 ont
augmenté de 80 % de 1970 à 2004 et la teneur moyenne en CO2 dans l’atmosphère est
passée de 280 ppmv à 379 ppmv, soit une augmentation d’environ 30 % depuis l’époque préindustrielle (IPCC, 2007). D’après l’Agence internationale de l’énergie (AIE), les émissions de CO2 devraient atteindre 43 Gt par an d’ici 2030, soit une augmentation de
60 % (Gielen et al., 2008).
Au Québec, un rapport du ministère du Développement durable, de l'Environnement et des Parcs (MDDEP) (MDDEP, 2009) fait un bilan des émissions des GES de la province. En 2007, les émissions totales de GES au Québec se chiffraient à 88,3 Mt éq. CO2, soit
11,5 tonnes par habitant, et représentaient 11,8 % des émissions canadiennes, lesquelles atteignaient 747 Mt de CO2. Le CO2 constituait à lui seul 81,4 % de l’ensemble des
émissions québécoises. Depuis 1990, les émissions de GES ont augmenté de 5,6 % dans la province. Même si le Québec affiche le plus faible taux d’augmentation de ses émissions parmi les provinces canadiennes, deux options peuvent être envisagées pour limiter les effets indésirables qu’entraînent les GES : utiliser d’autres types d’énergies, ou piéger une partie des GES émis pour en limiter les effets.
Le présent projet de recherche s’intéresse exclusivement au piégeage et au stockage du CO2 atmosphérique. Actuellement, différentes techniques de piégeage existent et sont
toutes en phase de démonstration. Les différences majeures entre les techniques employées portent principalement sur les procédés, les risques, les coûts, et les bilans énergétiques. Toutes ces techniques sont détaillées dans les rapports produits par le GIEC
3
(IPCC, 2007). Par exemple, dans les centrales d’énergie à charbon ou au gaz, divers procédés comme la précombustion, la postcombustion ou l’oxycombustion sont utilisés afin de produire un flux concentré de CO2 à haute pression qui est ensuite acheminé vers un
lieu de stockage. La quantité d’énergie exigée par ces procédés demeure l’inconvénient majeur, auquel s’ajoutent le transport et le stockage.
Parmi les solutions de stockage, il existe le stockage du CO2 dans des couches géologiques
souterraines, dans les océans ou dans d’autres matériaux.
Le stockage du CO2 dans les océans est une solution toujours à l’étude. Il serait possible
d’injecter directement le CO2 dans les océans, à plus de 1000 m de profondeur. Le gaz
dissous et dispersé s’intégrerait ensuite au cycle global du carbone. Un des inconvénients liés à cette méthode est la modification du milieu comme la baisse du pH, et la mort des organismes vivants qui en résulte. Un autre inconvénient est issu du brassage des eaux au fil du temps, ce brassage va provoquer une réduction de l’isolement du CO2, qui va pouvoir
être libéré dans l’atmosphère.
Une autre méthode utilisée pour emprisonner le CO2 est le stockage géologique. Il consiste
à injecter du CO2 supercritique dans une couche souterraine. Certaines formations
géologiques ont fait l’objet d’études approfondies pour emprisonner du CO2, soit les
réservoirs de pétrole et de gaz naturel, et les formations salines profondes. Ces roches poreuses peuvent servir au stockage. Différentes formes de piégeage sont utilisées :
- le piégeage physique, où le CO2 en phase pure se trouve immobile dans un piège
géologique comme les dômes ou les biseaux stratigraphiques;
- le piégeage à saturation résiduelle, où le CO2 en phase pure demeure immobile dans
le domaine d’injection;
- le piégeage en solution, où le CO2 est dissout dans les eaux ou saumures du
domaine d’injection;
- le piégeage sous forme de carbonates, où le CO2 ou des solutions aqueuses
contenant du CO2 dissout sont injectés dans des formations géologiques fracturées
ou poreuses (péridotite, basalte ou serpentinite) pour former des carbonates.
Les inconvénients majeurs de cette méthode concernent les risques liés aux fuites des réservoirs de stockage géologique, donnant lieu à un retour du CO2 vers l’atmosphère ou à
4
la pollution des nappes phréatiques superficielles utilisées pour l’approvisionnement en eau potable. De plus, le coût que nécessite la surveillance de ces réservoirs n’est pas à négliger. Toutes ces formes de stockages présentent des bilans mitigés en termes de coûts, d’impacts environnementaux et de bilan énergétique. Une forme de stockage alternative et beaucoup moins énergivore consiste en la carbonatation minérale du CO2 dans les résidus
miniers sous des conditions environnementales naturelles. Cette dernière technique est celle qui est la moins connue, et pourtant, c’est probablement celle qui minimise le plus les risques de fuite. Le piégeage minéral est perçu comme le stockage le plus sûr et le plus durable dans le temps (Lackner, 2003; Lackner et al., 1995; Seifritz, 1990); on considère le stockage permanent. Il peut se produire naturellement dans les roches ultramafiques, n’entraînant pas de coûts supplémentaires. Cependant, c’est un processus lent qui demande beaucoup plus de temps et est beaucoup moins développé, mais il permet en contrepartie de revaloriser les résidus miniers. Par rapport aux autres techniques de séquestration du CO2, cette technologie n’a probablement pas une capacité importante de
stockage du CO2, mais pourrait avoir un rôle important à l’échelle d’une mine dans le
contexte d’une bourse du carbone.
Dans ce projet de recherche, on s’intéressera aux processus liés à la carbonatation minérale dans les résidus miniers de l’exploitation du chrysotile de Thetford Mines, à la mine Black Lake au Québec (Canada).
1.2 La carbonatation minérale
1.2.1 Définition
La carbonatation minérale (ou la séquestration minérale du CO2) consiste à fixer le CO2 au
moyen d’oxydes alcalins et alcalino-terreux, tels l’oxyde de magnésium (MgO) ou l’oxyde de calcium (CaO) qui sont des constituants majeurs des roches silicatées. Les réactions chimiques qui surviennent entre ces réactifs et le CO2 produisent des carbonates comme la
magnésite (MgCO3) et la calcite (CaCO3).
La carbonatation minérale peut se diviser en trois processus majeurs : la dissolution minérale des oxydes, l’alimentation en CO2 et la précipitation des carbonates. Ce sont sur
5
ces différents processus que sont axées les recherches pour améliorer et optimiser la réaction.
1.2.2 Dissolution minérale
L’aptitude d’un matériel à servir de matière première pour la carbonatation minérale dépend principalement de sa composition chimique, de sa réactivité et de sa disponibilité. Les roches ignées ou métamorphiques (par exemple, mafiques et ultramafiques) sont riches en métaux alcalino-terreux. Elles sont des sources idéales de cations métalliques divalents pour la séquestration minérale du CO2. Pour cette raison, les minéraux tels que l’olivine
(Giammar et al., 2005; O’Connor et al., 2005; Summer et al., 2005), la serpentine (Park et al., 2003; Park and Fan, 2004; Romão et al., 2015; Teir et al., 2009) et la brucite (Assima et al., 2013b; Harrison et al., 2013, 2015) ont été étudiés comme source potentielle de magnésium pour la carbonatation minérale. D’autres recherches ont porté sur des minéraux non-magnésiens comme le plagioclase (Munz et al., 2012), le verre volcanique naturel (Gislason and Oelkers, 2003; Stockmann et al., 2011) et la wallastonite (Daval et al., 2009). Les sources potentielles de magnésium et de calcium ne se limitent pas seulement aux roches naturelles, mais aussi aux déchets riches en magnésium ou calcium qui sont produits par l’industrie (Bobicki et al., 2012; Huijgen and Comans, 2005; Pan, 2012). Les minéraux étant tous différents, les taux de dissolution le sont tout autant. Puisque la disponibilité des oxydes métalliques peut s’avérer être le paramètre limitant de la réaction de carbonatation minérale, il est important de connaître les facteurs qui contrôlent leur dissolution.
1.2.2.1 La structure cristalline
La vitesse de dissolution du minéral est d’abord contrôlée par sa forme cristalline. Les liaisons entre les éléments chimiques sont plus ou moins fortes selon la structure du minéral, ce qui a un impact sur la vitesse de dissolution (Schott et al., 2009). Pour la brucite, qui est un oxyde simple, il y a seulement un type de liaison à briser. Par contre, les silicates et la majorité des minéraux peuvent nécessiter le bris de différents types de liaisons métal-oxygène. Ces liaisons peuvent être brisées sous conditions acides; pour les silicates la force de la liaison augmente souvent avec la valence de l’ion métallique (Oelkers, 2001). Les liaisons les plus difficiles à briser sont celles entre l’oxygène et le silicium. Ces liaisons étant plus fortes, la dissolution de la silice est plus lente, ce qui peut entraîner la formation de
6
couches de silice (polymérisation de la silice) et un phénomène de passivation à la surface des minéraux. Cette couche de silice agit comme une barrière et empêche le minéral d’être attaqué, ce qui peut ralentir considérablement la carbonatation minérale en limitant la libération du magnésium, par exemple (Assima et al., 2012; Béarat et al., 2006; Harrison et al., 2015).
1.2.2.2 Le milieu réactionnel
La forme cristalline n’est pas le seul paramètre modifiant le taux de dissolution. Le pH du milieu réactionnel l’est aussi. Selon Golubev et al. (2005), la dissolution des silicates est gouvernée principalement par le pH. En effet, plus le pH diminue et plus la lixiviation du magnésium est rapide (Chen et al., 2006; Park and Fan, 2004; Pokrovsky and Schott, 2000). De nombreuses études ont porté sur les méthodes d’acidification du milieu réactionnel pour augmenter la vitesse de dissolution du magnésium en ajoutant des acides minéraux ou organiques, par exemple (Teir et al., 2007b, 2009).
Un autre effet notable sur le taux de dissolution est celui de la température. La vitesse de dissolution augmente avec la chaleur et la dissolution des silicates est alors accélérée (Brady and Carroll, 1994; Gerdemann et al., 2007; White et al., 1999). Teir et al. (2007a) ont étudié l’ajout d’acides et l’effet de la température (de 30 à 70°C) pour faciliter l’extraction du magnésium des minéraux. Toutes ces expériences montrent un meilleur rendement de la dissolution lors de l’ajout des acides ou de l’augmentation de la température ou les deux. Pour une dissolution efficace du matériel primaire, il faut que les réactifs qui sont dans le milieu puissent entrer en contact avec le matériel pour le dégrader. La surface spécifique du matériel est donc un paramètre important à considérer. Plus la surface accessible aux réactifs est importante, plus le taux de dissolution augmente. Dans les procédés qui visent à accélérer la dissolution, le broyage est couramment employé pour accroître la surface de contact (Gerdemann et al., 2007;Park et al., 2003).
Au cours de la carbonatation minérale, en plus de la précipitation de minéraux carbonatés, d’autres phases secondaires sont produites. Par exemple, il est possible d’observer la formation de couches de silices (polymérisation de la silice) ou d’oxydes de fer (à cause de l’oxydation du Fer (II) en Fer (III)). Ces phases secondaires peuvent recouvrir la surface, rendre la surface potentiellement non réactive et empêcher la dissolution (Andreani et al., 2009; Assima et al., 2012; Béarat et al., 2006; Teir et al., 2007b).
7
Le taux de carbonatation est lié en partie à la disponibilité des oxydes métalliques (MgO et CaO) et dépend donc de la combinaison des paramètres qui contrôlent la vitesse de dissolution du matériel primaire : les phases minérales, le pH, la température et la surface spécifique.
1.2.3 Approvisionnement en CO2
Le CO2 est l’élément central de la carbonatation minérale. Un mauvais approvisionnement
de celui-ci limite la réaction. Dans ce projet de recherche, on va s’intéresser uniquement à la carbonatation minérale en milieu aqueux.
Le CO2 gazeux doit se dissoudre dans l’eau (CO2(aqueux)), être hydraté pour former de l’acide
carbonique (H2CO3) et se dissocier en ions bicarbonate (HCO3-) et carbonates (CO32-) pour
pouvoir réagir avec les cations alcalino-terreux (Ca2+ ou Mg2+) et précipiter en
carbonates (Équations 1-5). ↔ 1 ↔ 2 ↔ 3 ↔ 4 ↔ 5
D’après la loi de Henry, à température constante et à l’équilibre, le CO2 dissout est
proportionnel à la pression partielle qu’exerce le CO2(gazeux) sur la solution. Dans les
conditions atmosphériques, le CO2 se dissout naturellement dans l’eau. Selon le pH, le CO2
dissout dans l’eau peut se retrouver sous différentes formes, soit en H2CO3, HCO3- et CO3
8
Figure 1.1 : Distribution des espèces majeures de carbone inorganique dissout à 20°C (Fetter, 2001).
Avec l’augmentation du pH, l’acide carbonique va se dissocier (en HCO3- puis en CO32-) et,
pour retrouver un état d’équilibre entre le gaz et l’eau, le CO2 va de nouveau être hydraté.
Une augmentation du pH va alors permettre de dissoudre plus de CO2.
La température a un effet sur la solubilité du CO2 dans l’eau. Une baisse de température va
permettre d’augmenter la solubilité et donc la capacité de dissolution du CO2 dans l’eau.
Un dernier facteur important qui peut affecter la solubilité du CO2 dans l’eau est la salinité.
Wilson et al. (2010) ont montré, en observant l’évolution de la concentration en CO2 et celle
du δ13CDIC dans une solution très saline à pH élevé, que la vitesse de carbonatation était
plus rapide que la dissolution du CO2(gazeux).
Pour augmenter l’approvisionnement en CO2 au site de réaction et favoriser la carbonatation
minérale, les recherches se sont focalisées particulièrement sur ces paramètres : la température, la pression, le pH et la salinité.
9
1.2.4 Précipitation des carbonates
La précipitation des carbonates est la dernière étape de la carbonatation minérale. Le magnésium dissous du matériel primaire peut se combiner avec le CO2 dissout et présent
sous la forme CO32-. Comme pour les étapes précédentes, des conditions particulières pour
que le carbonate se forme sont nécessaires. La précipitation se fait en deux étapes distinctes : la nucléation d’une phase solide et la croissance du cristal. Giammar et al. (2005) montrent que la précipitation peut être limitée par le taux de nucléation, qui dépend du degré de saturation, de la température et de la présence du carbonate dans la solution. D’autre part, la croissance des cristaux est contrôlée par la surface réactive du précipité, de la chimie de la solution, du pH et de la température. Par exemple, la précipitation de la magnésite, qui est la forme la plus stable thermodynamiquement, n’est pas possible dans des conditions de surface (Case et al., 2011; Hänchen et al., 2008). En revanche, la précipitation des phases hydratées et métastables thermodynamiquement comme la nesquehonite, la dypingite et l’hydromagnésite est favorisée dans ces conditions; d’ailleurs, elles ont même été déjà observées (Beaudoin et al., 2008; Power et al., 2007, 2009; Pronost et al., 2011, 2012; Wilson, 2006; Wilson et al., 2009a). En effet, les minéraux produits lors de la précipitation sont différents en fonction de la température (Case et al., 2011; Pronost et al., 2011).
La précipitation des carbonates peut être l’étape limitante dans la carbonatation minérale si les conditions ne sont pas favorables (Hänchen et al., 2008; Saldi et al., 2010, 2012). Dans les conditions naturelles, la dissolution du magnésium, l’approvisionnement en dioxyde de carbone et la précipitation des carbonates sont des processus simultanés et concurrents. Dans les milieux aqueux, les conditions chimiques et physiques doivent promouvoir ces différents processus (Krevor and Lackner, 2011). Par exemple, pour le pH, un équilibre doit être trouvé entre la dissolution du magnésium et la précipitation des carbonates. Une solution acide est nécessaire pour la dissolution des minéraux contenant le magnésium, mais elle doit être suffisamment alcaline pour causer la précipitation et assurer la stabilité des carbonates.
1.2.5 Stabilité des carbonates
Comme énoncé ci-dessus, la précipitation et la différenciation des carbonates dépendent fortement de la température, un paramètre aussi déterminant pour leur stabilité. Parmi les
10
carbonates magnésien, la magnésite est la forme la plus stable dans une large gamme de température (Bénézeth et al., 2011; Königsberger et al., 1999). Cependant, la formation de magnésite à température ambiante est très limitée à cause de ses caractéristiques chimiques et thermodynamiques. En solution aqueuse, la magnésite se forme essentiellement à des températures supérieures à 60 – 80°C (Hänchen et al., 2008; Saldi et al., 2009, 2010, 2012). Lorsque les températures sont inférieures à 60 – 80°C, les carbonates précipitent sous différentes formes hydratées, selon la composition de la solution et de la température. Pour des températures supérieures à 15°C, l’hydromagnésite est la forme la plus stable, suivie par la nesquehonite (Königsberger et al., 1999; Marion, 2001). Ces deux formes peuvent précipiter à température ambiante (Hänchen et al., 2008; Hopkinson et al., 2012), mais la nesquehonite précipite plus facilement à 25°C et plus particulièrement à des pressions de CO2 élevées, alors que l’hydromagnésite précipite
davantage à des températures plus élevées (Cheng et al., 2009; Hänchen et al., 2008). La nesquehonite est connue pour se transformer en hydromagnésite à des températures plus hautes par l’intermédiaire de la dypingite (Hopkinson et al., 2008, 2012). Par contre, pour des températures inférieures à 15°C et des pressions de CO2 plus faibles, l’artinite est plus
stable que l’hydromagnésite (Königsberger et al., 1999). À température ambiante, la nesquehonite et l’hydromagnésite sont relativement stables et communément rencontrées dans les résidus miniers comme étant le produit d’altération des roches mafiques et ultramafiques (Beaudoin et al., 2008; Pronost et al., 2011, 2012; Wilson, 2006; Wilson et al., 2009a). On retrouve plus particulièrement l’hydromagnésite dans les milieux à forts pH et comportant un ratio Mg/Ca élevé (Gautier et al., 2014).
11
1.2.6 Différents types de carbonatation minérale
Fixer le dioxyde de carbone sous forme de carbonates de magnésium peut être possible en utilisant divers procédés naturels ou forcés. Les principaux procédés de capture de CO2
existant à ce jour sont schématisés sur la Figure 1.2 :
Figure 1.2 : Inventaire des différents procédés de carbonatation minérale (modifié d'après Sipilä et al., 2008).
12
La carbonatation directe est l’approche la plus simple pour la carbonatation minérale. Le procédé se résume au fait que les matières premières (ex. : olivine, serpentine, etc.) sont carbonatées en une seule étape. Il y a deux types distincts de carbonatation : la carbonatation gaz-solide dite « sèche » qui, par exemple, mélange directement ensemble des résidus alcalins et de l’air pollué (Baciocchi et al., 2006), et la carbonatation directe aqueuse dite « humide » qui est plus courante, et qu'on observe, par exemple, dans les résidus de Black Lake (Pronost et al., 2011).
La carbonatation indirecte se déroule en deux étapes. D’abord, la composante réactive (Mg ou Ca) est extraite de la matière première (comme oxyde ou hydroxyde); on parle souvent de prétraitement. Puis, elle est mise en réaction avec le CO2 pour former des carbonates.
Par exemple, une solution de sel d’acide faible et de base forte est ajoutée dans les déchets de ciment (Yogo et al., 2005) ou de l’acide acétique est ajouté dans des silicates de calcium pour optimiser l’extraction du calcium. Bon nombre de recherches sont menées sur la carbonatation indirecte, car elle permet souvent d’obtenir de meilleurs rendements de séquestration du carbone.
Outre les procédés cités plus haut, il existe d’autres procédés ressemblant à la carbonatation minérale :
‐ La précipitation des carbonates de calcium (PCC) (Teir et al., 2005);
‐ La carbonatation utilisant des saumures (Druckenmiller and Maroto-Valer, 2005); ‐ Le vieillissement accéléré du calcaire (VAC) (Huijgen and Comans, 2005);
‐ La carbonatation simple par épandage de poudre d’olivine sur les terres agricoles ou forestières (Schuiling and Krijgsman, 2006).
1.3 Différentes approches pour la carbonatation minérale
Il existe différentes approches pour la carbonatation minérale, soit la carbonatation d’origine biologique, in situ, dans des réacteurs industriels ainsi que dans les résidus industriels et miniers. Elles sont présentées en détail dans cette section.
13
1.3.1 Carbonatation minérale d’origine biologique.
Les bactéries peuvent accélérer la dissolution des minéraux. Leur petite taille leur permet de travailler à petite échelle (de la cellule individuelle aux colonies, pour parfois créer des biofilms) et créer des microenvironnements isolés. Elles peuvent sécréter des acides organiques autour d’elles, créant un milieu beaucoup plus acide que le milieu aqueux initial, entraînant une dissolution plus rapide des minéraux par rapport aux milieux abiotiques (Southam and Saunders, 2005). En laboratoire, Yao et al. (2013) ont mélangé de la poudre de serpentine avec Bacillus mucilaginosus et ont observé une baisse du pH, une accélération de la dissolution des minéraux, la présence de sécrétions contenant des acides organiques et une augmentation plus rapide de la concentration de magnésium dans le milieu.
Le rôle des bactéries ne se limite pas à seulement à la dissolution des minéraux, mais aussi à la précipitation. Power et al. (2007, 2009) ont étudié la formation des playas d’hydromagnésite d’Atlin en Colombie Britannique (Canada) et ont observé de la dypingite due à l’activité d’une cyanobactérie. Leurs expériences en colonne ont montré que seule la nesquehonite se forme sans ces biotes, les cyanobactéries ayant un rôle important dans la formation de ces playas.
Des expériences avec les résidus miniers ultramafiques de la Diavik Diamond Mine (Canada) et de la Mount Keith Nickel Mine (Australie) ont démontré l’intérêt d’utiliser les bactéries pour augmenter le taux de minéralisation du carbone en améliorant l’extraction du magnésium (McCutcheon et al., 2014; Power et al., 2010, 2011).
La carbonatation naturelle dans les résidus miniers est un processus lent. L’utilisation des bactéries est une alternative naturelle à faible coût qui pourrait permettre d’améliorer considérablement le taux de carbonatation.
1.3.2 Carbonatation minérale in situ
La carbonatation minérale in situ, une des stratégies utilisée pour séquestrer le CO2 sous
forme de carbonate, consiste à injecter du CO2 ou des solutions aqueuses contenant du
CO2 dissout dans des formations géologiques fracturées ou poreuses (péridotite, basalte ou
serpentinite; Matter and Kelemen, 2009). Par exemple, Kelemen and Matter (2008) ont observé une carbonatation minérale rapide et naturelle dans l’ophiolite de Samail (Oman),
14
composée de formations riches en silicates magnésiens. Ils décrivent également une méthode qui permettrait d’accélérer la réaction en faisant des forages et de la fracturation hydraulique pour faciliter la propagation de la chaleur qui serait produite par la carbonatation minérale et du CO2 très concentré. Dans un système contrôlé comme celui présenté
ci-dessus, l’injection d’un fluide très riche en CO2 pourrait permettre de séquestrer une tonne
de CO2/m3/an (Kelemen et al., 2011).
1.3.3 Carbonatation minérale dans des réacteurs industriels
La carbonatation minérale est un ensemble de processus nécessitant des conditions physico-chimiques particulières et souvent différentes. À l’état naturel, la carbonatation minérale se produit lentement en raison de l’équilibre qui doit être rencontré pour que les processus fonctionnent simultanément. Ainsi de nombreuses études s’intéressent à optimiser les processus tels que la capture du CO2 dans des réacteurs industriels, la
dissolution du magnésium ou la précipitation des carbonates pour améliorer le rendement de la carbonatation minérale et donc de la séquestration du CO2 par cette réaction.
Dans cette section, seulement un aperçu des procédés utilisés pour améliorer le rendement de la minéralisation du carbone est présenté, étant donné le grand nombre d’études qui traitent de ce sujet.
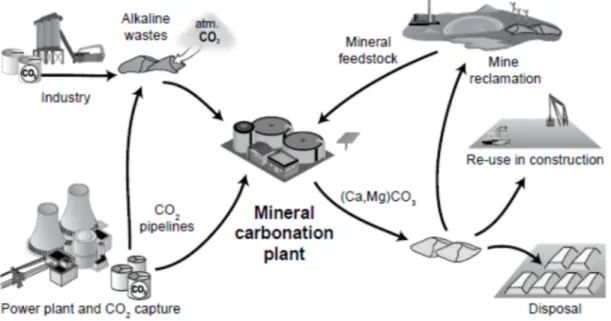
L’utilisation de réacteurs industriels permet d’améliorer considérablement le taux de carbonatation minérale des minéraux purs ou des résidus produits par l’industrie. Une des premières études portant sur la carbonatation minérale dans des réacteurs industriels consistait à augmenter la température pour la carbonatation directe gaz-solide ou à utiliser des processus chimiques pour extraire le calcium ou le magnésium puis le faire précipiter en carbonates (Lackner, 2003; Lackner et al., 1995). Cependant, comme le projet n’était pas viable sur le plan financier et beaucoup trop énergivore, de nombreuses recherches ont porté sur l’amélioration du procédé et la baisse des coûts. La Figure 1.3 montre les différentes étapes menant à la carbonatation minérale et le devenir des produits de la réaction.
15
Figure 1.3 : Flux de matière et processus associés à la carbonatation industrielle de matières premières minérales et les déchets industriels alcalins (Power et al., 2013).
Dans le cas de la carbonatation gaz-solide, les études s’intéressent principalement à trouver le bon équilibre entre la température et la pression des gaz pour améliorer le taux de réaction. Ces équilibres sont différents en fonction du matériel utilisé (olivine, forstérite, serpentine ou brucite). Plusieurs études traitent de ce procédé (Béarat et al., 2002; Larachi et al., 2010, 2012; Lackner et al., 1997; O’Connor et al., 2005; Zevenhoven et al., 2008). Le concept est simple, mais son utilisation à grande échelle est limitée en raison du faible taux de carbonatation des silicates magnésiens (Huijgen and Comans, 2005).
La carbonatation aqueuse offre d’autres perspectives. Dans le cas des réacteurs industriels, le gaz est chargé de CO2, souvent produit directement par l’industrie. La réaction est alors
limitée par la dissolution et la précipitation des minéraux. Des études portant sur la carbonatation aqueuse tentent d’optimiser l’extraction du calcium ou du magnésium. Comme énoncé précédemment, ce sont les conditions du milieu qui vont être modifiées pour améliorer le taux de réaction : pH, température, composition du fluide et salinité (Gerdemann et al., 2007; Hänchen et al., 2006; O’Connor et al., 2005; Prigiobbe et al., 2009).
16
1.3.4 Carbonatation minérale dans les résidus industriels et miniers.
L’exploitation industrielle ou minière produit beaucoup de déchets qui contiennent du calcium ou du magnésium. Ces ressources souvent inutiles ne sont pas revalorisées alors qu’elles peuvent servir de matière première nécessaire à la carbonatation minérale. Dans l’industrie, différents types de résidus font l’objet d’études poussées. Il y a les laitiers d’aciérie (Eloneva, 2009; Huijgen et al., 2007; Huijgen and Comans, 2005; Santos et al., 2012; Teir et al., 2007a), les cendres volantes (Montes-Hernandez et al., 2009), les cendres d’incinérateurs (Polettini and Pomi, 2004) et les saumures (Nyambura et al., 2011). Ces déchets industriels représentent une source de matériel très bon marché et déjà disponible qui, avec un minimum de traitement, peut compenser les émissions négatives de ces industries.
C’est aussi pour cette raison que l’utilisation des déchets de l’industrie minière (résidus, stériles) est une alternative intéressante pour la séquestration du CO2 par carbonatation
minérale et pour la revalorisation des déchets miniers. En effet, l’exploitation des roches mafiques et ultramafiques a produit et produit encore aujourd’hui beaucoup de déchets riches en magnésium (Power et al., 2014). Les exploitations du chrysotile (Bea et al., 2012; Beaudoin et al., 2008; Huot et al., 2003; Lechat et al., 2015; Pronost et al., 2011, 2012; Wilson, 2006; Wilson et al., 2009a), du diamant (Wilson et al., 2009b, 2011), du nickel (Gras et al., 2015; Pronost et al., 2011; Wilson et al., 2014), de la chromite (Beinlich and Austrheim, 2012) et des métaux du groupe du platine (MGP) (Meyer et al., 2014; Vogeli et al., 2011) génèrent des quantités considérables de déchets pouvant servir à la carbonatation. L’altération naturelle et passive des résidus miniers a été observée dans différentes mines (Beinlich and Austrheim, 2012; Beaudoin et al., 2008; Huot et al., 2003; Pronost et al., 2012; Wilson, 2006; Wilson et al., 2009b) et les résultats de simulation numérique ont permis d’estimer le taux de séquestration du CO2 entre 0,6 et 1 kg CO2/m2/an dans les résidus de
la mine de Mount Keith en Australie (Bea et al., 2012). Dans le sud du Québec, Pronost et al. (2011) ont estimé que 700 Mt de carbone pourraient être stockées dans les 2 Gt de résidus miniers produits lors de l’exploitation du chrysotile.
La carbonatation minérale dans les piles de déchets miniers est une alternative qui permet de revaloriser ces résidus tout en étant bénéfique pour l’environnement et l’industrie minière d’un point de vue financier (Hitch et al., 2010).
17
1.4 Processus couplés et modélisation numérique
Dans cette étude, on s’intéresse exclusivement à la carbonatation minérale dans les résidus miniers. Ces résidus sont rassemblés dans des parcs à résidus et disposés en piles pouvant atteindre plusieurs dizaines de mètres de hauteur. Ces piles de résidus plus ou moins homogènes, constituent des milieux poreux particuliers. La composition minéralogique et les propriétés hydrogéologiques des piles de résidus, ainsi que les conditions atmosphériques contrôlent les réactions chimiques et les écoulements à l’intérieur du milieu poreux que forment les résidus miniers. Dans le cas de la carbonatation naturelle et passive, les échanges entre l’atmosphère et les piles sont primordiaux. Le CO2 et l’eau, qui sont
essentiels pour que la réaction de carbonatation minérale dans les conditions ambiantes, sont fournis exclusivement par l’atmosphère.
1.4.1 Carbonatation minérale dans les résidus industriels et miniers.
Dans cette section, les processus liés à l’alimentation en CO2 des piles par les gaz sont
décrits.
Dans les résidus, le milieu poreux est généralement partiellement saturé, le CO2 est apporté
par l’intermédiaire du gaz et de l’eau de pluie dans laquelle le CO2 est dissout. En ce qui
concerne le gaz, selon Pronost et al. (2012), deux mécanismes de transport sont responsables de l’approvisionnement en CO2 dans les piles de résidus : la diffusion
moléculaire gazeuse et l’advection des gaz.
D’après la loi de Fick de la diffusion, le flux par diffusion d’un composé dans un fluide est directement proportionnel au gradient de concentration de ce composé dans le fluide. Si on considère un système en une dimension dans la direction l, le flux molaire diffusif Ji (mol/m2/s) est :
.
i i i odC
J
D
dl
(1)où Ci (mol/m3) est la concentration molaire du composé i dans le fluide et Do (m2/s) est le coefficient de diffusion du composé i dans un fluide. En général, dans un milieu poreux, on
18
utilise plutôt la diffusivité effective De (m2/s) qui est plus faible que le coefficient de diffusion,
car elle dépend entre autres, de la saturation en fluides, de la tortuosité du milieu poreux et de la porosité.
L’autre mécanisme, l’advection des gaz correspond à l’écoulement des gaz dans le milieu poreux. Dans ce cas, le mouvement du gaz est induit par l’infiltration de l’eau, des gradients de pression (ou de charge pneumatique) résultant par exemple des variations barométriques, de l’écoulement d’air causé par l’action du vent, et par la convection thermique. Comme le gradient du potentiel a la même forme pour les gaz que pour les liquides, la forme généralisée de la loi de Darcy peut être utilisée. Avec la charge pneumatique h (m), la forme de la loi de Darcy peut être dérivée comme suit pour l'écoulement en une dimension dans la direction l:
.
.
k g dh
k g d
p
q
z
dl
dl
g
(1)où q (m/s) est le flux volumétrique de gaz, k (m2) est la perméabilité du milieu, ρ (kg/m3) est
la densité du gaz, µ (Pa.s) est la viscosité du gaz, g (9.81m/s2) est l’accélération gravitationnelle, z (m) est l’élévation et p (Pa) est la pression du gaz. Lorsqu’on s’intéresse à un composé i du gaz en particulier, le flux molaire Ji (mol/m2/s) par advection peut s’écrire :
.
.
'
i i i ipx
J
q
q
M
RT
(1)où ρi est la densité du composé i ans le gaz, Mi (kg/mol) est la masse molaire de i, xi est la
fraction molaire du composé i, R (8.314 Pa.m3/mol/K) est la constante universelle des gaz et T’ (K) est la température absolue.
Puisque la carbonatation minérale est une réaction exothermique, la chaleur est un paramètre qu’il faut aussi considérer. Les transferts de chaleur peuvent se faire par conduction, et aussi par convection. Par exemple dans le cas du drainage minier acide (DMA), l’oxydation de la pyrite génère suffisamment de chaleur pour engendrer de la convection thermique au sein des piles de résidus (Lefebvre et al., 2001a, 2001b). En effet, les gradients de températures entre l’air froid de l’atmosphère et l’air chaud à l’intérieur des piles peuvent générer des mouvements thermiques. Les gradients de température engendrent des gradients de densité de gaz qui initient la convection, ce qui contribue à
19
augmenter la quantité d’oxygène qui entre dans les piles. La chaleur générée par la carbonatation minérale peut aussi engendrer de la convection, permettant ainsi de mieux alimenter la pile de résidus en CO2. Ce processus est d’ailleurs intégré dans le modèle
conceptuel décrit par Pronost et al. (2012).
Même s’ils ne sont pas détaillés ici, les processus de transport du CO2 dans la phase
aqueuse, comme la dispersion moléculaire et l’advection sont aussi à considérer et reposent sur les mêmes principes fondamentaux que pour la phase gazeuse. Ils contribuent aussi au transport du CO2 à travers les résidus.
La carbonatation minérale dans les piles de résidus miniers est un phénomène complexe, dans lequel les processus physico-chimiques sont couplés et sont les suivants : les écoulements multiphasiques, les transferts de masse dans la phase liquide et la phase gazeuse, les transferts de chaleur ainsi que les réactions de dissolution et précipitation. Ces processus évoluent simultanément au sein des piles de résidus et sont interdépendants.
1.4.2 Simulations numériques avec MIN3P
Dans les piles de résidus miniers, plusieurs modèles numériques ont été utilisés pour simuler des processus couplés comme pour le DMA. Lefebvre (1994) et Lefebvre et al. (2001b) ont utilisés le modèle numérique TOUGH/AMD (Pruess., 1991) pour simuler les écoulements multiphasiques, le transport de l’oxygène et l’oxydation de la pyrite dans les piles de résidus miniers. Plus tard, Molson et al. (2004) ont utilisés le model numérique MIN3P (Mayer et al, 2002) pour simuler le DMA dans des parcelles expérimentales mises en place pour étudier ce phénomène et trouver comment y remédier. Ce code numérique est capable de simuler le transport réactif, les écoulements multiphasiques et multicomposants dans des milieux à saturation variable, et permet de considérer le système géochimique complet incluant la spéciation géochimique et le pouvoir-tampon par les minéraux jouant un rôle sur la stabilité du pH. Ces simulations ont produit des résultats très proches des observations, et confirment l’intérêt porté à l’utilisation des modèles numériques capables de simuler des processus physico-chimiques couplés pour étudier les réactions au sein des piles de résidus miniers.
Concernant la carbonatation minérale dans les résidus miniers, seul le modèle MIN3P a été utilisé à ce jour. Bea et al. (2012) a réalisé des simulations 1D pour évaluer la quantité de