Hybridation entre Calanus finmarchicus et C. glacialis
(Copepoda)
Thèse
Geneviève Parent
Doctorat en biologie
Philosophiae Doctor (Ph. D.)
Québec, Canada
© Geneviève Parent, 2013
iii
Résumé
L’hybridation est un phénomène observé tant chez les plantes que chez les animaux, mais qui n’avait toutefois jamais été détecté chez le zooplancton marin. Cette thèse vise à caractériser l’hybridation entre Calanus glacialis et C. finmarchicus afin d’évaluer son impact sur la dynamique des populations dans l’ouest de l’Atlantique. De plus, les méthodes d’identification morphologique et génétique sont comparées et combinées afin de tester leur capacité à discriminer les espèces parentales et les hybrides. Dans le deuxième chapitre, une grande variabilité spatio-temporelle du chevauchement de la longueur de prosome entre les espèces C. glacialis et C. finmarchicus est montrée pour les copépodites de stade V. Ce chevauchement de taille entraine une identification erronée et donc, une sous-estimation considérable de l’abondance de C. glacialis dans l’estuaire du Saint-Laurent et sur la côte du Labrador. Au troisième chapitre, la présence d’hybrides est d’abord établie. Il existe une grande variabilité spatiale dans la fréquence des hybrides dans la zone hybride, soit de l’archipel canadien arctique au golfe du Maine, chez le stade copépodite V. De plus, la longueur de prosome des hybrides varie en fonction des génotypes dans l’aire d’étude. Dans le quatrième chapitre, il est mis en évidence que la phénologie reproductive des femelles adultes hybrides est intermédiaire à celles des espèces parentales dans l’estuaire du Saint-Laurent. En revanche, le succès reproducteur et le phénotype des femelles adultes hybrides sont similaires à ceux de leur ancêtre maternel. Les hybrides représentent une faible proportion de la production totale d’œufs de mars à juillet. Ainsi, malgré la présence de flux génique entre C. glacialis et C.
finmarchicus, les espèces parentales conservent leur intégrité et sont isolées temporellement dans la
zone hybride. Les effets sur la dynamique des populations des espèces parentales semblent minimes. Les recherches à vernir devraient tenter de révéler l’hybridation entre ces espèces dans d’autres zones et d’investiguer l’effet des variations de phénologie reproductive et d’advection sur l’abondance d’hybrides. L’hybridation entre d’autres espèces de zooplancton marin semble également plausible.
v
Abstract
Hybridization is a phenomenon observed in plants and animals which to date has never been detected in marine zooplankton. This thesis aims to characterise hybridization between Calanus
glacialis and C. finmarchicus in order to evaluate the impact on species population dynamics in the
West Atlantic. In addition, morphological and genetic identification were compared and combined to test their potential for discrimination of parental species and hybrids. In the second chapter, a great spatio-temporal variability in overlap in prosome length between C. glacialis and C.
finmarchicus is shown for stage V copepodites. This overlap in prosome length has the consequence
of misidentifying and thus, considerably underestimating C. glacialis’ abundance in the St. Lawrence Estuary and on the Labrador Coast. In the third chapter, it is shown that hybrids exist, and that there is substantial spatial variability in their frequency in the hybrid zone, from the Canadian Arctic Archipelago to the Gulf of Maine, for the copepodite stage V. Moreover, hybrid size varied as a function of genotypic composition. In the fourth chapter is shown that hybrid adult females have an intermediate reproductive phenology to that of their parental species in the St. Lawrence Estuary. Contrastingly, fitness and phenotypes of hybrid adult females are similar to those of their maternal ancestor. Hybrids represent a small proportion of total egg production from March to July. Thus, although gene flow occurs between these species, parental species are maintained and mainly isolated temporally within the hybrid zone. The effects of hybridization on species population dynamics are probably minor. Future studies should aim to study hybridization between these species in other zones and the effects of variation in their reproductive phenology and advection on hybrid abundance. Hybridization between other marine zooplankton species is also likely.
vii
Avant-propos
Remerciements
À mes directeurs, Julie et Stéphane, un énorme merci pour votre support durant ces cinq dernières années. C’est grâce à vous, et ce, pour différentes raisons qui vous sont propres, que cette thèse est complétée. Je vous en suis très reconnaissante.
Julie. Tu m’as offert un suivi exceptionnel. Tu m’as enseigné de nombreux concepts, corrigé ma vision « adaptationiste » de biochimiste, brassé de temps en temps pour m’assurer d’une progression optimale, encouragé quand mon moral était à plat, révisé rigoureusement et exceptionnellement rapidement mes versions d’articles et de thèse ainsi que proposé de nombreuses suggestions pour des impasses linguistiques. Grâce aux discussions épicées que nous avons eues au plan scientifique, artistique ou politique, j’ai aussi développé mon sens critique et une capacité à argumenter. Tu m’as même fait lire mon premier gros roman en m’incitant à lire J.-J. Pelletier. En plus de tout cela, tu m’as entourée d’une cuvée d’étudiants qui sont devenus des amis proches. Bref, tu as grandement aidé à mon émancipation non seulement en tant que candidate au doctorat, mais en tant que citoyenne. Je t’en remercie du fond du cœur.
Stéphane. Tes conseils, commentaires et suggestions en tant que zooplanctologue ont été plus qu’appréciés et éclairants durant tout mon parcours. J’avais parfois l’impression d’être perdue dans ces nombreuses références et tu as toujours pris le temps pour répondre à chacune de mes questions. Ton enthousiasme pour la recherche océanographique est contagieux. J’ai apprécié ces moments intenses au téléphone où je devais prévenir les gens de mon laboratoire que c’était normal et plaisant si je m’énervais. Merci aussi pour les fois où tu m’as fortement encouragée à continuer. Ton soutien au début du doctorat m’a définitivement empêchée d’abandonner ce projet dont je suis si fière maintenant.
À Pierre. ATTABOY! Quel homme j’avais dans mon équipe! As-tu vu tout ce que nous avons réussi à faire grâce à ton excellent travail et ta rigueur analytique? Aussi, un énorme merci pour ta supervision en bateau et toutes les réponses à mes questions (souvent très pressantes!).
Julian et Jean-Éric. Merci à vous deux pour des questions très pertinentes à chacune de nos rencontres de comité de thèse. Vous avez contribué à l’amélioration des articles de cette thèse et je vous en remercie.
viii
John Nelson. Thank you for evaluating my thesis. Your comments throughout the thesis were very useful and appreciated.
À mes collègues de laboratoire et du département : Merettesky, la p’tite, Marie-Claude Gagnon, Catherine Potvin, Élodie et Éric, merci pour vos commentaires, votre aide et votre support tout au long de mon parcours scientifique. Plus particulièrement pour certains d’entre vous, Nico-chat, Sam, Annick et Nico-mito, merci pour ces moments de détente hautement alcoolisés qui nous ont permis « d’échanger scientifiquement ».
À mes amis et ma famille. Plus particulièrement à Marie-Claude Fortin, Josée, Cat G. et Cat L., merci les filles pour vos encouragements. Votre dynamisme et votre moral d’acier sont contagieux. Votre amitié m’est très chère.
À Francis. Merci pour tout. Pour ta façon posée d’envisager les différentes situations, ton aide, ton sourire tous les matins pis plein d’autres choses que je ne peux écrire à la fin d’une thèse.
x
Organisation de la thèse
Cette thèse comporte cinq chapitres, dont l’introduction et la conclusion générales (chapitres 1 et 5). Les trois autres chapitres sont sous forme d’articles scientifiques dont deux sont publiés à ce jour :
Le chapitre 2 est publié sous la référence : Parent, G. J., S. Plourde et J. Turgeon. 2011. Overlapping size ranges of Calanus spp. off the Canadian Arctic and Atlantic Coasts: impact on species' abundances. Journal of Plankton Research. 33: 1654-1665.
Le chapitre 3 est publié sous la référence : Parent, G. J., S. Plourde et J. Turgeon. 2012. Natural hybridization between Calanus finmarchicus and C. glacialis (Copepoda) in the Arctic and Northwest Atlantic. Limnology and Oceanography. 57: 1057-1066.
Le chapitre 4 sera soumis sous peu pour publication dans une revue scientifique publiée en langue anglaise. Les coauteurs sont : Stéphane Plourde, Pierre Joly et Julie Turgeon.
Geneviève Parent a élaboré la problématique de recherche, analysé les résultats et rédigé chaque chapitre, sous la supervision de Julie Turgeon et Stéphane Plourde. Ces derniers ont commenté, révisé et fait plusieurs excellentes suggestions pour améliorer les manuscrits. Pierre Joly a fait l’énorme travail d’échantillonnage, d’incubation et de photographie sous-jacent au quatrième chapitre.
xii
xiv
Table des matières
Résumé ... iii
Abstract ... v
Avant-propos ... vii
Remerciements ... vii
Organisation de la thèse ... x
Table des matières ... xiv
Liste des tableaux ... xviii
Liste des figures ... xx
Chapitre 1. Introduction ... 1
1.1 Bref historique du concept d’espèce et de l’hybridation ... 2
1.2 Caractéristiques des hybrides ... 3
1.2.1 Morphologie ... 3
1.2.2 Génétique : identification et aptitude ... 4
1.2.3 Écologique : répartition ... 6
1.3 Description des espèces de Calanus à l’étude dans l’Arctique et le nord-ouest de l’Atlantique ... 8 1.3.1 Similitudes ontogéniques ... 8 1.3.2 Différences morphologiques ... 9 1.3.3 Divergence génétique ... 11 1.3.4 Différences écologiques... 11 1.4 Objectifs ... 14
Chapitre 2. Overlapping size ranges of Calanus spp. off the Canadian Arctic and Atlantic Coasts: impact on species’ abundances ... 17
2.1 Résumé ... 18 2.2 Abstract ... 19 2.3 Introduction ... 20 2.4 Methods ... 22 2.4.1 Sampling ... 22 2.4.2 Species identification ... 22 2.4.3 Data treatment ... 23 2.5 Results ... 24 2.6 Discussion ... 26
2.6.1 Species size overlap and identification ... 26
2.6.2 Impact of misidentification ... 28
2.7 Acknowledgements ... 30
2.8 Tables ... 32
2.9 Figures ... 37
Chapitre 3. Natural hybridization between Calanus finmarchicus and C. glacialis (Copepoda) in the Arctic and Northwest Atlantic ... 43
3.1 Résumé ... 44
3.2 Abstract ... 45
3.3 Introduction ... 46
3.4 Methods ... 47
xv
3.4.2 Genetic characterisation ... 48
3.4.3 Parental species and hybrid identification ... 48
3.4.4 Spatiotemporal variation in hybrid frequency ... 49
3.4.5 Phenotypic variation among composite genotypic classes ... 50
3.5 Results ... 50
3.5.1 mtDNA and nucDNA (microsatellites) genetic variation ... 50
3.5.2 Identification of parental species and hybrids ... 50
3.5.3 Spatiotemporal variability in hybrid frequency ... 52
3.5.4 Phenotypic variation among genotypic classes ... 52
3.6 Discussion ... 53
3.6.1 Effects of hybridization between C. glacialis and C. finmarchicus ... 55
3.6.2 Hybridization in marine zooplankton ... 56
3.7 Acknowledgements ... 56
3.8 Tables ... 58
3.9 Figures ... 62
Chapitre 4. Reproductive phenology, fitness, and morphological characteristics of hybrids between Calanus glacialis and C. finmarchicus in the St. Lawrence Estuary ... 67
4.1 Résumé ... 68 4.2 Abstract ... 69 4.3 Introduction ... 70 4.4 Methods... 71 4.4.1 Sampling procedure ... 71 4.4.2 Environmental conditions ... 72
4.4.3 Abundance and proportion of parental species and hybrids ... 72
4.4.4 Fitness components - Reproductive output ... 73
4.4.5 Morphological characteristics ... 74 4.4.6 Statistical analyses ... 74 4.5 Results ... 74 4.5.1 Environmental conditions ... 74 4.5.2 Reproductive phenology ... 75 4.5.3 Reproductive output ... 75 4.5.4 Morphological characteristics ... 76 4.6 Discussion ... 77
4.6.1 Reproductive phenology and reproductive output... 78
4.6.2 Morphological characteristics ... 79
4.6.3 Variability in hybrid frequency ... 79
4.6.4 Perspectives ... 80 4.7 Acknowledgements ... 81 4.8 Tables ... 82 4.9 Figures ... 84 4.10 Supplementary material ... 89 Chapitre 5. Conclusion ... 91
5.1 Chevauchement de taille chez les calanidés... 91
5.1.1 Résumé, impacts et limitations ... 91
5.1.2 Perspectives : caractères morphologiques distinctifs chez calanidés ... 93
5.2 Estimation erronée d’abondance ... 94
5.2.1 Résumé, impacts et limitations ... 94
5.2.2 Perspectives : impact des estimations erronées d’abondance au Canada et ailleurs ... 94
5.3 Hybridation chez le zooplancton marin ... 95
xvi
5.3.2 Perspectives : autres régions potentielles d’hybridation entre C. glacialis et C.
finmarchicus ... 96
5.3.3 Perspectives : zones d’hybridation potentielles chez d’autres espèces de zooplancton .. 97 5.3.4 Perspectives : hybridation et dynamique des populations des espèces de calanidés ... 98 5.4 Existe-t-il différentes populations de C. finmarchicus dans l’estuaire du Saint-Laurent? ... 99 Bibliographie ... 101
xviii
Liste des tableaux
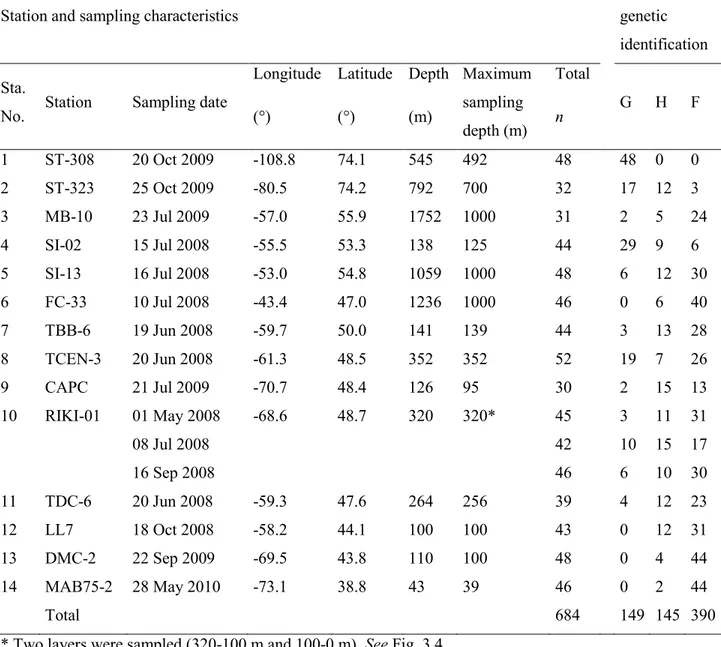
Table 2.1 Prosome length (PL) of stage V copepodite commonly used to discriminate three Calanus species along the Canadian Arctic and Atlantic Coasts. F, G, and H indicate respectively, C. finmarchicus, C. glacialis, and C. hyperboreus. ... 32 Table 2.2 Sampling specifications, species characteristics and prosome length (PL) overlap at each
station based on genetic species identification. For each pair of species, PL overlap is the ratio of PL overlap over the total PL range of both species. F, G, and H indicate respectively, Calanus
finmarchicus, C. glacialis, and C. hyperboreus. FG, GH, and FG indicate pairwise species PL
overlap. ... 33
Table 2.3 Analyses of variance for prosome length of three Calanus species sampled at four
stations (SI-02, RIKI-01, TCEN-2/3, and TDC-6) in two years ... 35
Table 2.4 Calanus species misidentification rate with optimized discriminant prosome length
(ODPL). Under species misidentification, the first column indicates the proportion of individuals of a species that were misidentified while the other columns (italics, if any) specify in which proportion there where incorrectly assigned to other species. For C. hyperboreus, all cases of misidentification involved C. glacialis. F, G, and H indicate respectively, Calanus finmarchicus, C.
glacialis, and C. hyperboreus. We omitted DMC-2 station since there was only one species. ... 36 Table 3.1 Description of sampling stations and genetic identification of parental species and
hybrids based on nucDNA markers. The number of genotypes classified as Calanus glacialis (G), hybrid (H), and C. finmarchicus (F) are given for each station... 58
Table 3.2 Information on four new microsatellite markers developed for this study, including
information on primers (GenBank accession No., primer sequence), repeat motif, allelic variability (total number of alleles (AN), PCR product size range across all samples) and PCR conditions
(annealing temperature (AT) and duration of denaturation (D), annealing (A), and extension (E)
steps)... 59
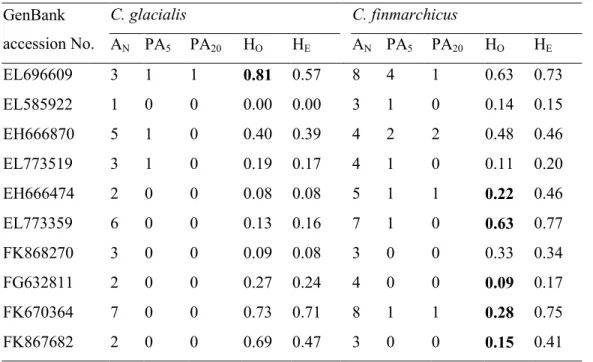
Table 3.3 Variability of nuclear markers for Calanus glacialis and C. finmarchicus at reference Sta.
1 and 14, respectively: number of alleles (AN), number of private alleles with frequency > 5% (PA5)
and > 20% (PA20), observed (HO) and expected (HE) heterozygosity. Bold characters indicate loci
displaying significant deviation from Hardy-Weinberg equilibrium. ... 60
Table 3.4 Comparison of reassignment performances with reference samples of Calanus glacialis
(G), in silico F1-hybrids (H) and C. finmarchicus (F) using approaches based on GeneClass2 and STRUCTURE (see text in Methods). ... 61
Table 4.1 Sampling dates, adult female genetic identification, and total abundance estimate at
Rimouski Station in 2010. The number of genotypes classified as C. glacialis (G), hybrid with C.
glacialis mtDNA (Hg), hybrid with C. finmarchicus mtDNA (Hf), and C. finmarchicus (F) are given
for each station. The asterisk indicates that one Fg individual was identified in this sample. ... 82
Table 4.2 Morphological characteristics of each genotype (G) sampled at the Rimouski Station in
2010. Genotypes are identified as in Table 4.1. Pigmentation levels are based on the number of colored body parts (0: none; 1: legs and digestive tract; 2: as for 1, plus antenna or pores; 3: as for 1, plus antenna and pores; 4: as for 3 and other parts) ... 83
Table 4.S1. Temporal variability of fitness components estimated for laying females at Rimouski
Station in 2010 (mean ± standard error). Different small letters indicate values that are significantly different across months (e.g., a,b) (Tukey-Kramer, p < 0.05). ... 89
xx
Liste des figures
Figure 2.1 Sampling stations for Calanus species on the Canadian Arctic and Atlantic Coasts ... 37 Figure 2.2 Prosome length overlap among three Calanus species along the Canadian Arctic and
Atlantic Coasts when all stations from both years are pooled (N = 1159). ... 38
Figure 2.3 Spatial variability in the extent of prosome length overlap among Calanus species.
Arrows indicate optimal discriminant prosome lengths (ODPL). For each station, the number of individuals (N) is given respectively for C. finmarchicus, C. glacialis, and C. hyperboreus. ... 39
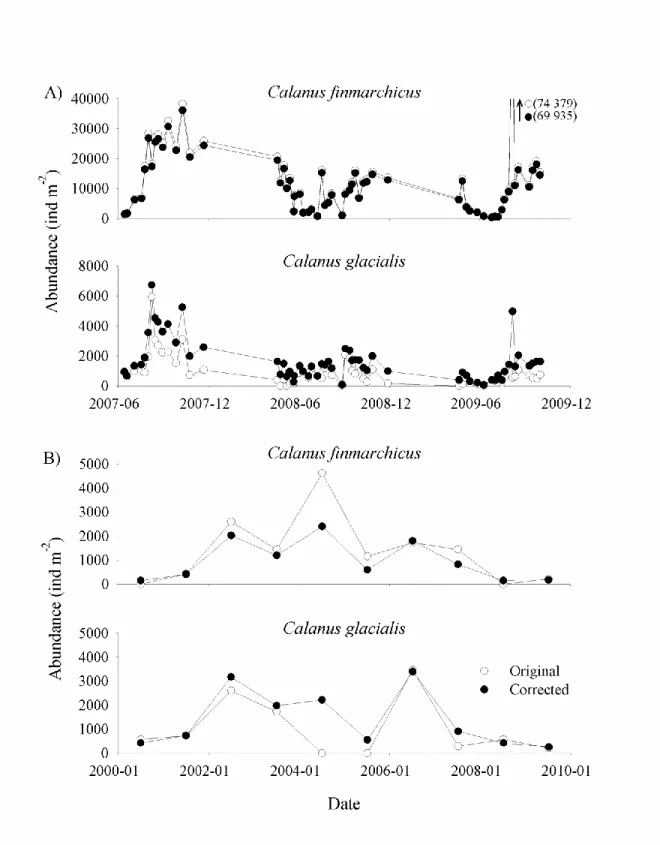
Figure 2.4 Comparison of original and corrected stage CV abundance estimates of Calanus finmarchicus and C. glacialis at RIKI-01 (A) and at SI-02 (B). ... 40 Figure 2.5 Relationship between average prosome length of Calanus finmarchicus and C. glacialis
and (A) estimated percentage of prosome length overlap between these species and (B) mean temperature during species-specific developmental period (late winter to spring in the Atlantic or spring to fall in the Arctic for C. glacialis; spring to fall: C. finmarchicus) at each station (years combined). PL overlap is the ratio of PL overlap over the total PL range of both species. Mean sea surface temperatures are from 1971 to 2000. Figure 2.5B contains only 14 stations, since sea surface temperatures were unavailable for CAPC. ... 41
Figure 3.1 Map of the Arctic and North Atlantic Oceans showing the frequency of parental species
and hybrids (as determined with mtDNA and nucDNA markers) at each station. ... 62
Figure 3.2 Factorial correspondence analysis of genetic variation at ten microsatellite loci for
individuals (A) from the two parental species at reference Sta. 1 and Sta. 14 and (B) from all stations. Colors and symbols represent classification based on mtDNA and nucDNA markers:
Calanus glacialis (white circle), C. finmarchicus (black circle), hybrids (grey circle), and highly
introgressed hybrids (grey triangle). ... 63
Figure 3.3 (A) Number of individuals and (B) prosome length for six classes of genotypes
combining mtDNA and nucDNA information when all stations are pooled. Bar color distinguishes parental species from hybrids. For each class of genotype, the capital letter specifies the nucDNA genotype (G, H, F) and the superscript the mtDNA haplotype (g or f) with G or g, H, and F or f indicating respectively Calanus glacialis, hybrid, and C. finmarchicus. Different letters above bars indicate classes of genotypes that are significantly different from one another. ... 64
Figure 3.4 Frequency distribution of parental and hybrid genotypes at Sta. 10 in samples taken in
May, July, and September 2008 from (A) the upper layer (0-100 m), (B) the bottom layer (320-100 m), and (C) for the entire water column (320-0 m). p-values on the upper right corner of each panel are for comparisons among sampling dates within layer. In (B), the asterisk indicates a significant difference in genotype frequency between the upper and lower layers (p < 0.001). ... 65
Figure 4.1 Variability of environmental characteristics from March to July at Rimouski Station in
2010. Filled and empty circles indicate temperature and chlorophyll a, respectively. ... 84
Figure 4.2 Temporal variability of genotypic abundance (A, B, C, D) and monthly relative
abundance (E) at Rimouski Station in 2010. Genotypes are identified as in Table 4.1. The single Fg
individual is not shown (Table 4.1). ... 85
Figure 4.3 Temporal variability of reproductive output and phenotype at Rimouski Station in 2010
(mean ± standard error). Genotypes are identified as in Table 4.1. Different small letters above bars indicate values that are significantly different from one another within a month (e.g., i, ii) or across months (e.g., a,b) (Tukey-Kramer, p < 0.05). Only samples with size ≥ 3 are shown. ... 86
xxi
Figure 4.4 Temporal variability of genotypic egg production rate (A, B, C, D) and monthly relative
egg production rate (E) at Rimouski Station in 2010. Genotypes are identified as in Table 4.1. Fg
was not represented as it did not lay eggs. ... 87
Figure 4.5 Egg pictures from A) Calanus glacialis, B) hybrids with C. glacialis mtDNA, C)
hybrids with C. finmarchicus mtDNA, and D) C. finmarchicus. Arrows are pointing at the external membrane. ... 88
1
Chapitre 1. Introduction
L’intérêt pour l’hybridation a crû rapidement depuis les vingt dernières années (Schwenk et al. 2008) et ceci a permis de caractériser l’ampleur de ce phénomène dans différents groupes taxonomiques. En 2005, une étude résumait que 25% des espèces de plantes vasculaires et 10% des espèces animales présentaient du flux génique interspécifique (Mallet 2005). D’ailleurs, il semble maintenant évident que la fréquence d’espèces s’hybridant varie au sein des taxons d’une même famille. Par exemple, chez les végétaux, aucune espèce ne semble s’hybrider chez le genre
Indiocarex tandis que 56% des espèces s’hybrident chez le genre Carex (Arnold 1997, p. 28). Bien
que ces taux variables d’hybridation interspécifique semblent indiquer que ce phénomène serait typique de certains groupes taxonomiques, il se pourrait aussi qu’ils reflètent la facilité à observer des formes hybrides ou le nombre d’études consacrées aux différents taxons.
Grâce à ces nombreux exemples, l’hybridation est d’un grand intérêt pour l’étude de la spéciation, mais est aussi problématique dans certains domaines tels que l’écologie et la taxonomie. En effet, l’hybridation est d’une part reconnue comme un phénomène créatif en évolution pouvant mener entre autres à la formation de nouvelles espèces (p. ex. Grant et Grant 1992 ; Rieseberg et Wendel 1993 ; Arnold et Hodges 1995). D’autre part, l’isolement reproducteur incomplet entre les espèces peut avoir un impact sur la démographie des espèces parentales. Ceci pose d’ailleurs certains problèmes quant à la conservation des espèces entre autres lorsqu’une espèce abondante s’hybride avec une espèce en voie d’extinction (p. ex. chien et loup dans Verardi et al. 2006 ; putois et vison dans Cabria et al. 2011). Par ailleurs, la présence d’hybrides peut parfois soulever aussi des débats quant à la reconnaissance et la classification des espèces au sein d’un même genre (p. ex. Veron 1996; Medina et al. 1999).
Cette thèse rapporte les premiers hybrides naturels entre des espèces marines de zooplancton. Au sens large, un hybride est un individu résultant d’un croisement fructueux entre des individus de deux populations qui se distinguent sur la base d’un ou plusieurs caractères héritables (Arnold 1997). Toutefois, dans la majorité des exemples utilisés dans cette thèse, un hybride est le résultat d’un croisement fructueux spécifiquement entre des espèces. C’est pour cette raison que le concept d’espèce utilisé sera d’abord présenté dans le premier chapitre afin de caractériser ces groupes d’individus. Ce premier chapitre sera présenté sous forme d’un bref historique dans le but de justifier le choix de ce concept, à ce jour la définition d’espèce est toujours controversée (Hausdorf 2011), et d’illustrer la perception de l’hybridation au courant des derniers siècles. Par la suite, les
2
caractéristiques des hybrides en milieu marin seront exposées. Les similitudes et les différences entre les espèces étudiées seront ensuite décrites. Finalement, j’aborderai les objectifs de cette thèse.
1.1 Bref historique du concept d’espèce et de l’hybridation
Bien avant que Darwin n’écrive « On the Origin of Species… » (De l’origine des espèces…), l’hybridation était connue et perçue comme un phénomène menant à l’inviabilité ou à la stérilité (Buffon 1749 dans Mallet 2008). Suite à la publication de son livre, Darwin fut d’ailleurs critiqué par des scientifiques de l’époque, du fait qu’il n’avait pas expliqué l’origine de ces « inaptitudes » chez les hybrides (Mallet 2008). Dans une revue récente de l’œuvre de Darwin, Mallet (2008) soutient cependant que Darwin n’a pas fondé son argumentation sur ces inaptitudes parce que selon lui l’inviabilité et la stérilité des hybrides, bien que présentes, ne sont pas nécessaires ou encore suffisantes pour expliquer l’origine et le maintien des espèces. De nombreux exemples de viabilité et de fécondité chez les hybrides empêchaient d’ailleurs Darwin de simplement fonder son argumentation sur l’universalité de ces inaptitudes (Mallet 2008). Suite à son décès, l’importance de ces inaptitudes s’est cependant accrue au sein de la communauté scientifique afin d’expliquer l’origine et le maintien des espèces.
En 1942, Ersnt Mayr proposa un premier concept clair d’espèce qui était basé sur l’isolement reproducteur et utilisait l’inviabilité ou la stérilité des hybrides pour expliquer l’existence des espèces. Ce concept biologique d’espèce (Mayr 1942 p. 120 ; 1995 p.5) est défini ainsi : « Les espèces sont des groupes de populations pouvant se reproduire entre elles et étant, isolées de groupes similaires.» (Traduction libre G. J. Parent)
À l’origine, Coyne et Orr (2004) indiquent que cette définition implique que les espèces existent sous deux conditions soit 1) que leurs différences génétiques les empêchent d’habiter une même région ou 2) qu’ils habitent dans la même région, mais que leurs différences génétiques les rendent incapables de produire des hybrides fertiles. Il y a ainsi absence de flux génique entre ces unités discrètes que sont les espèces.
Deux aspects sont cependant problématiques avec cette vision du concept biologique d’espèce. Ceux-ci concernent l’occurrence d’hybridation et l’applicabilité du concept. Premièrement, le flux génique doit être absent entre deux groupes afin que ceux-ci soient considérés comme des espèces d’après le concept biologique d’espèce de Mayr (1995). Or de nos jours, les évidences d’hybrides se reproduisant avec les espèces parentales sont nombreuses au sein de plusieurs taxons (p. ex. Arnold 1995 ; Seehausen 2004). De plus, les espèces parentales persistent dans un bon nombre de cas, et
3 ce, bien qu’il existe du flux génique entre ces dernières. Deuxièmement, le concept biologique n’est pas applicable à tous les taxons (Hey 2001). C’est entre autres le cas des organismes asexués tel que les bactéries pouvant absorber de l’ADN (transfert horizontal) provenant de taxons très divergents génétiquement (étant considérés comme des espèces différentes). Par exemple, il semble qu’Escherichia coli ait accumulé environ 18% de son génome par transfert horizontal en provenance de différentes lignées, et ce, pendant les derniers 200 millions d’années (Lawrence et Ochman 1998).
Il existe de nombreux autres concepts d’espèces permettant de définir les espèces au sein de différents groupes pour lesquels ces aspects sont problématiques (Mayden 1997 ; Coyne et Orr 2004 ; Hausdorf 2011). D’après Coyne et Orr (2004), le concept biologique d’espèce modifié de Mayr (1995) est cependant le plus adéquat en biologie évolutive afin d’expliquer les discontinuités entre les organismes sexués. Toutefois, puisqu’il existe de nombreuses évidences de fécondité entre les hybrides et les espèces parentales, de nombreux biologistes considèrent à présent une version moins stricte du concept biologique d’espèce permettant le flux génique interspécifique (Coyne et Orr 2004 ; Futuyma 2009). Une question demeure toujours quant à déterminer un seuil de flux génique afin que des groupes d’individus soient considérés comme des espèces.
1.2 Caractéristiques des hybrides
Dans cette section, la majorité des caractéristiques des hybrides proviennent du milieu marin. Ces exemples ont été choisis puisqu’ils présentent des caractéristiques démographiques similaires (p. ex. grande capacité de dispersion, grande taille de population) à celles des espèces étudiées. Toutefois, quelques exemples d’hybridation sont tirés des milieux terrestre et dulcicole afin de présenter des caractéristiques d’hybrides qui n’ont pas été révélées à ce jour en milieu marin.
1.2.1 Morphologie
Bien que les hybrides puissent avoir des phénotypes intermédiaires, identiques ou transgressifs par rapport aux espèces parentales, plus nombreux sont les exemples marins d’hybrides ayant des phénotypes intermédiaires. En effet, Gardner écrivait en 1997 que les trop peu nombreux exemples d’hybridation entre des espèces marines provenaient principalement d’études rapportant des individus dont la morphologie était intermédiaire. C’est le cas notamment des hybrides entre les espèces de palourdes Mercenaria mercenaria et M. campenchis qui présentent des caractéristiques morphologiques intermédiaires aux deux espèces parentales, telles l’épaisseur des crêtes et l’intensité de la coloration interne de la coquille (Dillon et Manzi 1989). Récemment, les concombres de mer avec des motifs intermédiaires de couleur ont aussi été identifiés comme des
4
hybrides entre les espèces Holothuria scabra et H. s. variété (var.) versicolor en Nouvelle-Calédonie (Uthicke et al. 2005).
Par ailleurs, les hybrides peuvent aussi exhiber le phénotype des espèces parentales. Le premier exemple de phénotype parental chez les hybrides concerne les deux espèces de sébastes dans l’Atlantique, Sebastes fasciatus et S. mentella (Roques et al. 2001) dont la morphologie est clairement distincte (Valentin et al. 2002). Les hybrides de sébastes ont principalement la forme du corps de l’espèce S. mentella (Valentin et al. 2002). Le deuxième exemple est le seul cas d’hybridation chez le plancton marin et ce, entre deux variétés de phytoplancton, Pseudo-nitzschia
pungens var. pungens et var. cingulata, qui se retrouvent dans le nord-est de l’océan Pacifique
(Casteleyn et al. 2009). Pour cette étude, la majorité des hybrides génotypés étaient de première génération et exhibaient les caractéristiques morphologiques de la variété pungens (Casteleyn et al. 2009).
Bien qu’aucun hybride en milieu marin n’ait été reconnu pour présenter des caractéristiques morphologiques transgressives (c.-à.-d. en dehors de la gamme observée chez les espèces parentales), quelques exemples existent dans d’autres environnements. Le cas le mieux documenté est celui des hybrides entre des espèces de tournesol Helianthus annuus et H. petiolaris qui présentent des caractères morphologiques transgressifs (41,5%), identiques (56,1%) et intermédiaires (2,4%) aux espèces parentales (Schwarzbach et al. 2001). Ainsi, les hybrides entre ces deux espèces présentent principalement des caractères identiques et transgressifs. Ce sont d’ailleurs ces caractères transgressifs qui permettraient aux hybrides de survivre à des conditions auxquelles les espèces parentales ne peuvent pas (exemple détaillé dans la prochaine section).
1.2.2 Génétique : identification et aptitude
Les hybrides ont une variété d’assortiments de caractéristiques génétiques (p. ex. chromosomes, allèles) des espèces parentales. D’ailleurs, les hybrides peuvent être classés dans différentes catégories en fonction de leur type d’assortiment. Par exemple, on nomme un hybride de première génération un individu qui a 50% des allèles nucléaires provenant de chacune des deux espèces parentales et est issu d’un croisement entre ces dernières. Alors qu’un hybride ayant plus 50% de ses allèles nucléaires de l’une des deux espèces parentales sera qualifié d’introgressé. Celui-ci peut provenir d’un croisement entre un hybride et une espèce parentale (alors nommé rétrocroisement), mais aussi de croisement entre des hybrides après une ou de multiples générations.
5 Afin d’identifier génétiquement les hybrides, des marqueurs génétiques sont généralement utilisés. Afin d’y parvenir, les génomes mitochondrial et nucléaire peuvent être caractérisés, mais ils ont cependant des propriétés différentes. Le génome mitochondrial est généralement haploïde, non recombinant et transmis maternellement. Quant au génome nucléaire, il est généralement diploïde, recombinant et transmis de manière biparentale. Ainsi, la caractérisation d’un seul locus nucléaire peut suffire à identifier des hybrides de première génération, tandis qu’un locus mitochondrial n’identifiera que l’ancêtre maternel des hybrides.
Différents marqueurs offrent la possibilité de caractériser ces génomes. Tout d’abord, une simple séquence nucléotidique peut caractériser une portion du génome et y identifier les sites variables d’un individu à l’autre. Il est aussi possible d’identifier dans de nombreux sites du génome cette variabilité ce qui augmente la capacité à détecter le flux génique entre les espèces. Par exemple, des marqueurs de polymorphisme nucléaire simple (SNP) peuvent être utilisés. Ces derniers se retrouvent à tous les 1900 nucléotides dans le génome humain (Sachidanandam et al. 2001) et sont donc fréquents. D’autres marqueurs, tels que les microsatellites sont aussi fréquemment utilisés afin de caractériser la variabilité du génome nucléaire. Il s’agit de répétitions di-, tri-, ou quadru-nucléotidiques dispersées dans le génome nucléaire ayant un haut taux de mutation (10-2 à 10-5 mutations/génération) (Amos et al. 1996). Cette grande possibilité de polymorphisme permet d’accroitre la capacité à mesurer l’ampleur du flux génique (Estoup et al. 1998). De plus, les microsatellites sont des marqueurs généralement retrouvés dans des régions non codantes du génome. Ils ont aussi les avantages d’être co-dominants, ce qui permet d’identifier des hétérozygotes, et d’être facilement amplifiables en cas de dégradation de l’ADN. Les inconvénients de ces marqueurs sont la complexité à les localiser (p. ex. nombreuses étapes) et le coût. Cependant, ces deux inconvénients sont moins importants depuis l’arrivée d’une nouvelle technique de séquençage de génomes (pyroséquençage).
L’interaction entre les allèles des deux espèces parentales chez les hybrides peut avoir des impacts différents sur leurs aptitudes (valeur adaptative ou « fitness »). Lorsqu’un hybride est plus apte que les espèces parentales, le phénomène est décrit comme de la vigueur hybride causée par un avantage de l’hétérozygotie ou des interactions épistatiques (entre deux ou plusieurs gènes) favorables (Demuth et Wade 2005). Cependant, lorsqu’un hybride est moins apte que les espèces parentales, le phénomène est décrit comme de la dépression hybride résultant d’interactions épistatiques négatives. Dans ce cas, la réduction d’aptitude des hybrides est causée par des interactions épistatiques délétères entre les gènes (Dobzhansky 1937 ; Demuth et Wade 2005). Ainsi, les hybrides peuvent avoir des aptitudes inférieure, intermédiaire, équivalente ou encore supérieure aux
6
espèces parentales (Arnold 1995 ; Seehausen 2004). Différentes aptitudes peuvent même être observées chez les rejetons provenant d’un seul rétrocroisement (Johansen-Morris et Latta 2006). Toutes ces aptitudes présentent un large spectre de possibilités évolutives. À une limite du spectre, les hybrides avec des aptitudes supérieures peuvent mener à une nouvelle source de variation génétique tandis qu’à l’autre limite, ceux avec des aptitudes inférieures peuvent mener en quelque sorte à un cul-de-sac évolutif.
Certains auteurs soutiennent que l’aptitude des hybrides est lié à la distance génétique entre les parents (p. ex. Coyne et Orr 1989 ; 1997 ; Mallet 2005). Coyne et Orr (1989 ; 1997) ont entre autres montré que l’isolement reproducteur entre différentes espèces de mouche du genre Drosophila était positivement corrélé avec la distance génétique (Coyne et Orr 1989 ; 1997). En fait, l’aptitude des mouches hybrides semble plus précisément réduite par un isolement prézygotique, c.-à-d. avant la fécondation (p. ex. fréquence réduite d’accouplements entre les espèces parentales). Des tests similaires à l’aide d’une espèce de copépode intertidal, Tigriopus californicus, dont la distance génétique varie grandement entre les populations provenant de différentes marelles (gène COI 0,2 à 22,3%) ont donné des résultats similaires (Edmans 1999). Dans cette dernière étude, la réduction d’aptitude est seulement détectée chez des hybrides rétrocroisés. Ce résultat semble indiquer que l’hybridation, et plus spécifiquement l’introgression, mène à des interactions épistatiques délétères. Toutefois, il ne faut pas généraliser ces résultats au sein d’un même genre (Drosophila) ou d’une même espèce (Tigriopus californicus) à l’ensemble des taxons confondus. En effet, Edmans (2002) a montré qu’une forte divergence entre deux populations ou espèces n’était synonyme de grand isolement reproducteur puisque le degré de divergence nécessaire semble varier en fonction du groupe taxonomique. Par exemple, les espèces d’oiseaux et de grenouilles peuvent s’hybrider à des niveaux de divergence beaucoup plus élevés que les mammifères (Edmans 2002).
1.2.3 Écologique : répartition
Deux répartitions sont typiques des hybrides et de leurs espèces parentales. Il y a premièrement la répartition en zone hybride. Dans ce cas, les hybrides se trouvent dans la zone de chevauchement des aires de répartition des espèces parentales. Deuxièmement, il y a aussi la répartition dans une nouvelle aire pour les génotypes hybrides. Il existe de nombreux exemples marins de zones hybrides chez les invertébrés tels que les palourdes (p. ex. Mercenaria, Dillon et Manzi 1989), les moules (p. ex. Mytilus, Bierne et al. 2002), le concombre de mer (Holothuria, Uthicke et al. 2005), le phytoplancton (Pseudo-nitzschia, Casteleyn et al. 2009) et chez les vertébrés tels que les poissons (p. ex. Sebastes, Roques et al. 2001). Cependant un seul exemple marin d’hybridation s’apparente à
7 une nouvelle aire de répartition pour les hybrides et il s’agit de palourdes (Macoma, Nikula et al. 2008).
L’exemple le mieux caractérisé de zone hybride en milieu marin est certainement celui des complexes de moules Mytilus. Sur la côte ouest européenne, Mytilus edulis et M. galloprovincialis sont deux espèces de moules qui montrent un isolement prézygotique par une différence d’habitat (Gosling et McGrath 1990) et par une asynchronie de ponte (Gardner et Skibinski 1990). Cependant, l’isolement prézygotique semble incomplet puisque ces deux espèces de moules forment une zone hybride de type mosaïque, c’est-à-dire où les aires de répartition des espèces parentales alternent et forment plusieurs zones hybrides intermédiaires (Bierne et al. 2003). De plus, il a été observé à l’aide de croisement en laboratoire qu’il y avait présence d’un isolement postzygotique (Bierne et al. 2006). En effet, des rétrocroisements, croisements contrôlés entre les hybrides de première génération et les espèces parentales, ont montré entre autres la présence d’interactions épistatiques dominantes favorables aux génotypes homozygotes, soit ceux des espèces parentales (Bierne et al. 2006). Dans cet exemple comme dans ceux des zones hybrides en général, le maintien de la zone hybride est expliqué par le modèle de zone de tension (Barton et Hewitt 1985). La largeur de la zone de tension est déterminée grâce à l’équilibre entre la dispersion des espèces parentales, qui accroit l’étendue de la zone, et à la sélection contre les hybrides, qui limite l’étendue de la zone (Barton et Hewitt 1985). La zone hybride sera donc très étroite dans les cas où il y a une forte sélection contre les hybrides ou une faible dispersion. Dans les aires de répartition des espèces parentales et la zone hybride, les hybrides ont une aptitude généralement inférieure à celles des espèces parentales.
Le seul exemple marin d’hybridation où l’aire de répartition des hybrides est différente de celles des espèces parentales est celui des variétés de palourdes Macoma balthica balthica, d’origine du Pacifique, et M. b. rubra, d’origine de l’Atlantique. En effet, dans la mer Baltique un mélange complet de ces deux lignées est retrouvé (« hybrid swarm ») alors que dans la mer du Nord seulement la variété M. b. rubra est retrouvée (Nikula et al. 2008). Cette répartition contemporaine résulterait du contact secondaire des deux variétés il y a au moins 2 millions d’années et des aptitudes supérieures des hybrides dans la mer Baltique (Nikula et al. 2008). Ainsi, la variété M. b.
rubra aurait été délogée dans toute son aire de répartition originale puisque seulement les hybrides
et l’espèce parentale M. b. balthica sont retrouvés dans l’Atlantique et les zones côtières (Nikula et al. 2007). C’est donc le modèle de supériorité hybride qui s’apparente le mieux à la répartition des hybrides dans ce cas. Toutefois, cet exemple n’est pas typique du modèle de supériorité hybride où les hybrides sont localisés dans un habitat différent de ceux des espèces parentales. Dans le cas le
8
mieux étudié de supériorité hybride, les hybrides de tournesols (Helianthus annuus et H. petiolaris) sont isolés géographiquement et évoluent indépendamment des espèces parentales. Dans le nouvel habitat, les hybrides ont d’ailleurs des aptitudes supérieures à celles des espèces parentales (Rieseberg 1991).
En milieu dulcicole, plusieurs complexes d’hybridation ont été rapportés et très bien caractérisés chez le genre Daphnia. En Amérique du Nord, les espèces D. pulex et D. pulicaria sont ubiquitaires dans les rivières et lacs (Taylor et Hebert 1993 ; Hebert et Finston 2001). Ces deux espèces ne se distinguent pas au plan morphologique, mais sont distinctes au plan écologique (Hebert et Finston 2001). D. pulex habite dans les étangs alors que D.pulicaria vit dans les lacs (Heier et Dudycha 2009) dans l'est de l'Amérique du Nord (Hebert et Finston 2001). Les hybrides de D. pulex et D.
pulicaria sont communs et associés aux environnements perturbés par l’homme (Crease et al. 1989
; Hebert et Finston 2001). En effet, de nombreuses études rapportent que les espèces parentales et leurs hybrides ont des niches écologiques distinctes (Hebert et Finston 2001 ; Dudycha 2004). Ainsi, les hybrides de D. pulex et D. pulicaria remplaceraient les espèces parentales grâce à leur aptitude supérieure dans certains environnements (Heier et Duchycha 2009).
1.3 Description des espèces de Calanus à l’étude dans l’Arctique et le
nord-ouest de l’Atlantique
Les caractéristiques des espèces parentales à l’étude seront décrites afin de pouvoir les comparer avec celles des hybrides dans les chapitres subséquents. Les trois espèces à l’étude sont Calanus
finmarchicus, C. glacialis et C. hyperboreus. Ces dernières présentent des caractéristiques
similaires et distinctes pour différents aspects. Les similitudes ontogéniques entre les espèces seront tout d’abord présentées. Par la suite, les différences entre les espèces aux plans morphologique, génétique et écologique seront décrites pour l’aire d’étude soit de l’Arctique au nord-ouest de l’Atlantique.
1.3.1 Similitudes ontogéniques
Tout d’abord, l’ontogenèse des espèces Calanus pélagiques comporte 13 stades dont un sous la forme d’œuf, six sous la forme larvaire nommés nauplius I à VI (NI à NVI), cinq sous la forme juvénile nommés copépodite I à V (CI à CV) et un sous la forme adulte nommé copépodite VI. C’est généralement durant la métamorphose en stade adulte qu’il y a différenciation sexuelle chez les Calanus.
9 Différentes phases actives et inactives caractérisent le cycle de vie de ces espèces. Elles sont d’abord actives suite à l’éclosion jusqu’à la forme copépodite. La durée de la phase active de développement varie principalement en fonction de l’espèce, de la température et de la biomasse phytoplanctonique (Huntley et Lopez, 1992 ; Campbell et al. 2001). Lorsqu’un certain stade de développement est atteint et que des conditions environnementales sont défavorables au développement, une migration saisonnière vers le fond peut avoir lieu (revu dans Hirche 1996). C’est suite à cette migration saisonnière que la phase inactive débute. Cette phase inactive, nommée diapause, se caractérise par un état léthargique, un métabolisme réduit (environ 15-30% de la période active) et un arrêt d’alimentation (Hirche 1983 ; Hirche 1989 ; Miller et al. 1991). Suite à la phase inactive, les copépodites retournent en surface afin de continuer leur développement. Certaines espèces, telles que C. glacialis et C. hyperboreus, alternent plusieurs fois entre une phase active et inactive afin de compléter leur cycle vital. De plus, le taux de développement (croissance et changement de stades) de C. finmarchicus est positivement lié à la concentration en nourriture et la température (Campbell et al. 2001) et ceci semble le cas chez les autres espèces de calanidés.
Suite à une diapause ou non, les stades CV se métamorphosent en adultes (CVI) afin de se reproduire. Chez les calanidés, les mâles sont généralement plus petits que les femelles. Pour plusieurs espèces de copépodes, il est estimé que cet accouplement se produit généralement en eau profonde (Hayward 1981). D’après Frost (1974), les femelles C. marshallae nouvellement métamorphosées déposent des phéromones sur leur passage, ce qui maximise les chances de rencontrer des mâles. Une fois que les partenaires se sont repérés s’en suit alors une danse nuptiale du mâle, un saut de la femelle au premier contact et une poursuite. Ensuite, le mâle attache un spermatophore à l’urosome de la femelle (Frost 1974), lequel se décharge dans la spermathèque de la femelle. Chez les espèces de Calanus, un seul spermatophore pourrait féconder les œufs d’une femelle pendant 2 à 2,5 mois (Marshall et Orr 1955).
1.3.2 Différences morphologiques
Les liens systématiques entre les espèces de Calanus sont confus à l’aide de la morphologie (Frost 1971 ; 1974 ; Bradford et Jillette 1974 ; Bradford 1988). Il est à noter que contrairement à plusieurs autres espèces de copépodes, le genre Calanus est particulier puisque la morphologie générale de la cinquième paire de pattes ne permet pas de différencier les espèces (Frost 1971 ; 1974).
Parmi les trois espèces à l’étude, il est possible de mieux distinguer certaines espèces sur la base de différents critères. En effet, la présence d’une pointe au cinquième segment thoracique à partir du stade CIV chez C. hyperboreus permet de la distinguer de C. finmarchicus et C. glacialis. Pour C.
10
glacialis et C. finmarchicus, il est possible d’observer des différences morphologiques entre ces
espèces aux stades copépodites (Jashnov 1955). À partir du stade CI, la longueur du prosome semble permettre de discriminer ces espèces (Unstad et Tande 1991 ; Hirche 1994). Au stade adulte (CVI), les traits sont le nombre de pores sur l’urosome ainsi que la courbe du basipode de la cinquième paire de pattes.
Ces critères d’identification ne font toutefois pas l’unanimité au sein de la communauté scientifique. En effet, quelques années après la caractérisation de l’espèce C. glacialis, des études ont montré qu’il existait des phénotypes intermédiaires pour les critères discriminants de C. finmarchicus et C.
glacialis (p. ex. Grainger 1961 ; Jashnov 1972). Frost (1971) montra à l’aide d’une analyse
morphométrique rigoureuse que les mâles de ces espèces avaient des gammes de tailles différentes pour des mesures du basipode de la cinquième paire de pattes. Cette publication, par ailleurs fortement influente, permettait alors de confirmer qu’il existait un isolement reproducteur entre ces deux espèces, et ce, basé sur des critères morphologiques. Frost (1974) publia aussi une deuxième étude montrant à l’aide de figures les différences morphologiques entre les femelles de C.
finmarchicus, C. glacialis et C. marshallae. De plus, des études ultérieures statuèrent à nouveau
qu’il existait une distribution bimodale des classes de taille pour les stades copépodites I à VI (p. ex. Unstad et Tande 1991 ; Hirche 1994). Ainsi, ces dernières études semblaient toutes s’accorder pour conclure qu’il existait bel et bien des différences morphologiques évidentes entre ces espèces. Cependant, lorsque Lindeque revisite le sujet en 2006, elle compare l’identification morphologique à celle génétique et découvre alors qu’il existe un grand chevauchement de la longueur de prosome entre C. finmarchicus et C. glacialis près de l’Angleterre. Elle conclut qu’il ne s’agit pas d’un bon indicateur pour identifier les espèces, et ce, jusqu’au stade CV. Malgré ces derniers résultats, nombreuses sont les études à ce jour utilisant le critère de la taille pour discriminer C. finmarchicus et C. glacialis (p. ex. Bergvik et al. 2012 ; Kwasniewski et al. 2013)
D’autres traits tels que le type de membrane externe des œufs et la couleur des copépodes sont couramment utilisés pour confirmer l’identification des espèces, mais ne sont généralement pas mentionnés dans les publications. Dans le cas de la membrane externe des œufs, il existe un espace entre les membranes externe et interne des œufs de C. glacialis contrairement à ceux de C.
finmarchicus (Knutsen et al. 2001). Cette membrane pourrait réduire la densité des œufs de C. glacialis et ceci permettrait d’éviter le fond pour cette espèce néritique tel qu’observé chez les
euphausiacés (cf. Lindley 1997). Quant au degré de coloration des individus, il est généralement reconnu que C. glacialis est plus rouge que C. finmarchicus. En fait, les antennes, l’appareil buccal et l’urosome sont généralement plus colorés chez C. glacialis (Arctic Ocean Diversity 2013).
11 Cependant, aucune étude quantitative n’a à ce jour évaluer si ce dernier critère est bel et bien discriminant.
La petite différenciation morphologique interspécifique au sein des calanidés est expliquée par une radiation récente (Frost 1974 ; Fleminger et Hulsemann 1977) soit pendant le Pléistocène (2,5 millions d’années). La spéciation au sein des calanidés est généralement expliquée par la présence d’un couvert de glace et le changement des courants qui auraient permis l’isolement géographique et reproducteur entre les espèces durant cette période (Frost 1974 ; Fleminger et Hulsemann 1977).
1.3.3 Divergence génétique
L’utilisation de marqueurs moléculaires a permis de préciser les liens évolutifs entre les différentes espèces de Calanus (Bucklin et al. 1995). En fait, il existe une grande divergence génétique interspécifique (7,3 à 20,4%) pour le gène 16S au sein de ce genre (Bucklin et al. 1995). Grâce à ce marqueur génétique, Bucklin et ses collaborateurs (1995) ont tout d’abord confirmé que l’espèce C.
hyperboreus est monophylétique tel que la morphologie l’indiquait (Frost 1974). Pour les espèces
de l’aire d’étude, la séquence 16S de C. hyperboreus diffère de 19,2% de celle de C. glacialis et de 17,3 à 18,1% de celle de C. finmarchicus. En revanche, celle de C. glacialis diffère de 17,2 à 18,3% de celle de C. finmarchicus (Bucklin et al. 1995). Ensuite, ils ont montré qu’il existe deux groupes d’espèces sœurs au sein des Calanus. Le premier groupe est composé de C. finmarchicus, C.
glacialis et C. marshallae tandis que le deuxième groupe est constitué de C. helgolandicus et C. sinicus.
Paradoxalement aux résultats obtenus par la différentiation morphologique, cette grande divergence génétique observée pour le gène 16S (ADNmt) indique que la divergence du genre Calanus a eu lieu bien avant le Pléistocène (Bucklin et al. 1995). Il semble que le genre Calanus ait divergé des autres calanidés il y a 80 millions d’années (fin du Crétacé supérieur) et les espèces sœurs sont apparues il y a 20 millions d’années (dont C. glacialis et C. finmarchicus).
1.3.4 Différences écologiques
Pour chacune des espèces de Calanus de l’aire d’étude, il sera présenté en premier lieu leur aire de répartition et leur structure de populations et en deuxième lieu la variabilité du cycle de vie dans les différentes régions de l’aire d’étude.
12
1.3.4.1 Calanus finmarchicus
L’aire de répartition de C. finmarchicus est limitée au nord par la baie de Baffin et la mer de Barents, et au sud par le cap Hatteras et la Manche (revu dans Shih 1984 ; Helaouët et Beaugrand 2007). Dans cette aire, une absence ou une faible structure génétique des populations a été détectée à l’échelle océanique avec l’aide de marqueurs microsatellites ou de quelques SNP (Provan et al. 2009 ; Unal et Bucklin 2010). Il est peu probable que l’espèce ait subi un accroissement très récent de l’aire de répartition ou de la taille de la population (Provan et al. 2009). Il existerait donc un grand flux génique entre les différentes régions de l’Atlantique.
Au nord de sa répartition, la durée du cycle de vie de C. finmarchicus est plus longue qu’au sud (Conover 1988). Des expériences en laboratoire ont d’ailleurs confirmé que la durée du développement de l’œuf au stade copépodite V est estimée à 56 jours à 4oC et à 22 jours à 12oC
(Campbell et al. 2001). En général, le cycle de vie habituel de C. finmarchicus implique un développement printanier ou estival de l’œuf au stade copépodite V, suivi d’une première migration saisonnière vers le fond afin d’hiverner en diapause et d’une seconde migration vers la surface des femelles pour pondre durant la saison printanière ou estivale suivante. Il s’agit alors d’un cycle de vie d’un an. Au nord de l’aire de répartition, il est possible d’observer une génération par année (Tande 1982 ; Gislason et Astthorsson 1998), tandis qu’à la limite méridionale, il est fréquent d’observer des générations multiples de C. finmarchicus au cours d’une année (p. ex. McLaren et al. 1989 ; Gislason et Astthorsson 1996 ; Michaud et Taggart 2007).
Bien que l’abondance de femelles de C. finmarchicus en surface soit généralement liée à l’abondance de phytoplancton dans l’ensemble de l’aire de répartition de cette espèce, il existe des anomalies dans différentes régions. Par exemple, bien qu’on retrouve cette espèce dans le nord de la mer de Barents et dans l’océan Arctique, aucun recrutement n’est observé (Hirche et Kosobokova 2007). Dans ces régions, C. finmarchicus proviendrait de régions limitrophes (p. ex. la mer du Groenland) où la phénologie du phytoplancton serait plus favorable au recrutement (Hirche et Kosobokova 2007). Dans l’estuaire du Saint-Laurent, la forte abondance de femelles en surface en avril/mai est aussi asynchrone avec la floraison phytoplanctonique. Le faible recrutement observé durant cette période est d’ailleurs expliqué par une faible survie des jeunes stades de vie (Plourde et al. 2009).
1.3.4.2 Calanus glacialis
L’aire de répartition de C. glacialis se trouve le long des milieux côtiers de l’Arctique, du nord du Pacifique et de l’Atlantique. Dans l’Atlantique, la limite méridionale se trouve sur le plateau
13 néoécossais à l’ouest et sur la côte de l’Angleterre à l’est (Jaschnov 1970). Contrairement à C.
finmarchicus, C. glacialis est caractérisé par une structure des populations dans l’ouest de son aire
de répartition. En effet, différents haplotypes mitochondriaux sont documentés dans différentes régions de la mer de Béring du Pacifique à l’Arctique (Nelson et al. 2009).
Dans son aire de répartition, C. glacialis a généralement un cycle de vie de deux ans. Il a ainsi deux périodes de diapause soit une au stade CIV et l’autre au stade CV. Dans certains endroits tels que dans l’ouest du Groenland et dans la mer Blanche, des cycles de respectivement un et trois ans ont été observés (Maclella 1967 ; Kosobokova 1999).
Contrairement à C. finmarchicus, C. glacialis amorce la ponte avant la floraison phytoplanctonique en utilisant principalement ses réserves lipidiques et en s’alimentant grâce aux algues de glace (Smith 1990 ; Hirche et Kattner 1993 ; Kosobokova et Hirche 2001). Cependant, une partie de la population de C. glacialis semble dépendre de la floraison phytoplanctonique pour pondre dans certaines régions (Hirche et Kosobokova 2003). De plus, il a même été noté que dans certains cas, le moment de ponte de C. glacialis varie en fonction de l’abondance de phytoplancton, soit d’avril à août (Hirche 1989 ; Plourde et al. 2005). Cette variation du moment de ponte coïncide généralement avec la fonte de la glace de surface et l’apparition de la floraison phytoplanctonique (revu dans Falk-Petersen et al. 2009). D’ailleurs, le moment de ponte de C. glacialis semble plus hâtif vers le sud de son aire de répartition alors que la glace fond plus tôt (revu dans Falk-Petersen et al. 2009).
1.3.4.3 Calanus hyperboreus
L’aire de répartition de C. hyperboreus est associée aux bassins profonds de l’Arctique, la baie de Baffin, l’est du talus du plateau néoécossais, le détroit de Fram et la mer de Norvège (Conover 1988 ; Sameoto et Herman 1990 ; Hirche et Mumm 1992). Malheureusement, aucune étude n’a caractérisé à ce jour la structure génétique des populations de C. hyperboreus.
La durée du cycle de vie de C. hyperboreus est entre un et cinq ans dans son aire de répartition (Conover 1988 ; Hirche 1997 ; Falk-Petersen et al. 1999 ; Plourde et al. 2003) et semble liée à la disponibilité en nourriture et à la température (Conover 1988 ; Hirche 1997 ; Plourde et al. 2003). Tout comme C. glacialis la durée du cycle de vie semble s’accroitre vers le nord. Ainsi, un cycle de vie d’un an est observé dans le golfe du Maine (Conover 1988) tandis qu’il est entre 3 et 5 ans dans la mer de Barents (Falk-Petersen et al. 1999).
C. hyperboreus pond en eau profonde (Vinogradov 1997) pendant l’hiver entre les mois d’octobre
14
2003). Les œufs et les nauplii se développent durant la remontée vers la surface en utilisant leur réserve lipidique. Les nauplii se nourrissent ensuite d’algues de glace ou de phytoplancton. Le stade CIII est le premier stade observé en diapause (Hirche 1997). Suite à la diapause, une seule métamorphose se produit généralement lors de l’été suivant (Hirche 1997 ; Falk-Petersen et al. 2009). Finalement, suite au développement en stade CV et à la migration ontogénique à l’automne, il peut y avoir métamorphose en eau profonde et accouplement de l’hiver au printemps (Hirche 1997). Les femelles C. hyperboreus peuvent retourner en diapause et pondre à nouveau l’année suivante (Plourde et al. 2003).
1.4 Objectifs
Cette thèse a pour objectif général de décrire l’hybridation entre les espèces de C. glacialis et C.
finmarchicus en explorant différentes échelles spatiales et temporelles. Bien que l’hybridation soit
connue entre plusieurs espèces, aucune étude avant cette thèse ne portait sur ce phénomène entre des espèces de zooplancton marin. Cette thèse présente trois chapitres avec des objectifs spécifiques (chapitres 2-4). Au moment du dépôt final, les chapitres 2 et 3 sont publiés.
Le chapitre 2 a pour objectif spécifique d’évaluer le chevauchement de taille entre les espèces C.
hyperboreus, C. glacialis et C. finmarchicus dans l’aire d’étude. De plus, cette étude évalue
l’impact des erreurs d’identification par la taille sur les estimés d’abondance dans deux régions de l’aire d’étude. Par le fait même, cette étude contribue à caractériser à nouveau la zone de sympatrie des deux espèces dans le nord-ouest de l’Atlantique et dans l’Arctique. La caractérisation antérieure remontait à plus de 40 ans (Jashnov 1970).
Le chapitre 3 vise d’une part à détecter la présence des hybrides entre les espèces C. glacialis et C.
finmarchicus et d’autre part à évaluer la variabilité spatiale et temporelle de la fréquence d’hybrides
dans l’aire d’étude. J’ai aussi caractérisé la taille de prosome des espèces parentales et des hybrides chez le stade copépodite V. De plus, différentes hypothèses seront exposées afin d’expliquer la variabilité spatiale et temporelle des fréquences hybrides.
Dans le chapitre 4, j’évalue et compare la phénologie reproductive, la valeur adaptative et le phénotype des femelles adultes de C. glacialis, C. finmarchicus et de leurs hybrides pendant la période de reproduction des espèces parentales dans l’estuaire du Saint-Laurent entre mars et juillet 2010. Ces comparaisons permettront de caractériser pour ces différents aspects les hybrides à une station dans la zone hybride.
15 Le chapitre 5 consiste en un résumé des résultats probants et des limitations de cette thèse ainsi que des perspectives qui en découlent.
17
Chapitre 2. Overlapping size ranges of Calanus spp. off the
Canadian Arctic and Atlantic Coasts: impact on
species’ abundances
Publié sous :
Parent, G. J., S. Plourde et J. Turgeon. 2011. Overlapping size ranges of Calanus spp. off the Canadian Arctic and Atlantic Coasts: impact on species' abundances. Journal of Plankton Research.
18
2.1 Résumé
Dans le nord de l’Atlantique, l’identification de Calanus finmarchicus, C. glacialis et C.
hyperboreus s’effectue sur la base de traits morphologiques subtiles, nécessitant un travail
méticuleux, ou encore sur la base de gammes de taille de prosome différentes. Nous réévaluons le critère discriminant de la taille de prosome pour le stade CV en couplant les identifications morphologique et moléculaire (ADNmt, gène 16S) de 1159 individus échantillonnés à 15 stations, dont certaines sur deux ans, le long des côtes canadiennes de l’Arctique à l’Atlantique. Nous avons observé de la variation spatiale, et non intra-annuelle, de la taille de prosome chez ces espèces. Aux stations côtières dans la zone de sympatrie, un chevauchement de la taille de prosome était fréquent entre C. finmarchicus et C. glacialis et restreint à l’estuaire et au golfe du Saint-Laurent entre C.
glacialis et C. hyperboreus. Nous avons utilisé des analyses discriminantes afin de redéfinir la taille
de prosome optimale pour minimiser les erreurs d’identification des espèces. Les estimés d’abondance ont été corrigés et ces corrections affectent principalement l’espèce C. glacialis. Dans l’estuaire Saint-Laurent et sur le plateau continental du Labrador, l’abondance de C. glacialis était sous-estimée respectivement de 19 et 35% depuis 2000. L’augmentation des estimés d’abondance de C. glacialis pourrait accroitre le rôle de cette espèce dans la chaine trophique et potentiellement modifier la perception des changements à long terme de proportions des espèces de Calanus le long de la côte est canadienne.
19
2.2 Abstract
In the North Atlantic, Calanus finmarchicus, C. glacialis, and C. hyperboreus are identified based on subtle morphological traits, which is fastidious, or based on their allegedly non-overlapping prosome length ranges. We reappraised the prosome length based diagnosis for the CV stage by coupling prosome length and molecular identifications (mtDNA, 16S gene) for 1159 individuals collected over two years from 15 stations off the Canadian coast from the Arctic to the Atlantic. We observed spatial but no intra-annual variation in species’ average prosome length. In sympatric coastal sites, prosome length overlap was frequent between C. finmarchicus and C. glacialis and restricted to the Estuary/Gulf of St. Lawrence between C. glacialis and C. hyperboreus. We used discriminant analyses to redefine prosome length criteria to minimize error in species identification. Species abundances were corrected and this affected mostly C. glacialis. In the St. Lawrence Estuary and on the Labrador shelf, C. glacialis abundance was underestimated by respectively 19% and 35%, with important interannual variations since 2000. This increase in abundance could enhance the role of C. glacialis in the food web and potentially alter our view of the long-term changes along eastern Canadian coast.