T
T
H
H
È
È
S
S
E
E
En vue de l'obtention du
D
D
O
O
C
C
T
T
O
O
R
R
A
A
T
T
D
D
E
E
L
L
’
’
U
U
N
N
I
I
V
V
E
E
R
R
S
S
I
I
T
T
É
É
D
D
E
E
T
T
O
O
U
U
L
L
O
O
U
U
S
S
E
E
Délivré par l'Université Toulouse III - Paul Sabatier Discipline ou spécialité : Sciences et génie des matériaux
Présentée et soutenue par Hélène AUTEFAGE Le 20 Juillet 2009
Titre : RÔLE OSTEOINDUCTEUR D’UN REVÊTEMENT D’APATITE CARBONATÉE NANOCRISTALLINE SUR DES CÉRAMIQUES DE PHOSPHATE DE CALCIUM
BIPHASIQUE JURY Dr. J. AMÉDÉE Rapporteur Pr. M. P. GINEBRA Rapporteur Pr. M. GOLDBERG Examinateur Pr. P. BONNEVIALLE Examinateur
Pr. C. REY Directeur de thèse Pr. P. SWIDER Co-directeur de thèse Dr. S. GONÇALVÈS Membre invité
Dr. F. BRIAND-MÉSANGE Membre invité
Ecole doctorale : Sciences de la Matière
Unité de recherche : CIRIMAT, INP-UPS-UMR CNRS 5085
Laboratoire de Biomécanique EA3697
Directeur(s) de Thèse : Pr. Christian Rey et Pr. Pascal Swider Rapporteurs : Dr. Joëlle Amédée et Pr. Maria Pau Ginebra
« L’esprit d’équipe ? C’est des mecs qui sont une équipe, ils ont un esprit ! Alors, ils partagent ! »
Michel Colucci, dit Coluche
A ma famille,
A mon amour,
Cette thèse est le fruit d’une collaboration entre cinq laboratoires académiques, membres du groupe de travail « Biomatériaux, os et dents » de l’Université Paul Sabatier créé en 2004 :
• Le laboratoire « Phosphates, Pharmacotechnie et Biomatériaux », anciennement « laboratoire de physico-chimie des phosphates », du Centre Interuniversitaire de Recherche et d’Ingénierie des Matériaux à l’Université de Toulouse, dirigé par le Pr Christian Rey puis le Dr Christèle Combes.
• Le laboratoire de Biomécanique, EA 3697, de l’Université de Toulouse, dirigé par le Pr Pascal Swider.
• L’équipe du Pr Jean-Pierre Salles et du Dr Patrick Raynal du département « Lipoprotéines et Médiateurs Lipidiques » de l’unité U563 de l’Institut National de la Santé Et de la Recherche Médicale (INSERM), au Centre de Physiopathologie de Toulouse Purpan, dirigé par le Pr Bertrand Perret.
• Le service de chirurgie des animaux de compagnie de l’Ecole Nationale Vétérinaire de Toulouse, dirigé par le Pr André Autefage.
• Le département d’anatomie et cytologie pathologique de l’hôpital de Rangueil à Toulouse, dirigé par le Pr Marie-Bernadette Delisle.
J’ai donc à cette occasion eu le plaisir de travailler aux côtés de nombreuses personnes. Mais avant de m’engager dans le vif du sujet et de vous remercier, vous qui m’avez aidée tout au long de ce projet, je voudrais commencer par exprimer ma reconnaissance aux membres de mon jury de thèse qui ont accepté d’évaluer mon travail :
- le Professeur Michel Goldberg, du laboratoire sur la réparation et les remodelages orofaciaux de l’Université René Descartes - Paris V, qui m’a fait l’honneur de présider mon jury de thèse.
- Mes deux rapporteurs : le Docteur Joëlle Amédée, directrice de l’unité 577 « Biomatériaux et réparation tissulaire » de l’INSERM de Bordeaux et le Professeur Maria-Pau Ginebra, du département « Materials Science and Metallurgical Engineering » de l’Universitat Politècnica de Catalunya de Barcelone, pour l’intérêt qu’elles ont porté à ce travail et les suggestions apportées.
- le Pr Paul Bonnevialle, du service de chirurgie orthopédique et traumatologique de l’hôpital Purpan à Toulouse, qui sait ponctuer ses questions d’une touche d’humour très agréable.
Vous avez rendu ma soutenance très intéressante par vos questions et remarques pertinentes et je suis ravie de vous avoir rencontrés à cette occasion.
Je tiens ensuite à exprimer ma gratitude à ceux qui ont fait que ce projet a pu voir le jour en s’engageant dans cette collaboration, c'est-à-dire les directeurs des équipes impliquées, le Pr Christian Rey, le Pr Pascal Swider, le Pr Jean-Pierre Salles, le Pr André Autefage et le Pr Marie-Bernadette Delisle. Je vous remercie pour votre accueil chaleureux dans vos
laboratoires et je souhaite que cette expérience vous ait été profitable et que cela vous encourage à entretenir de tels partenariats dans le futur.
J’adresse ensuite mes plus sincères compliments à ceux qui ont fait vivre ce projet et m’ont encadrée tout au long de ce travail : mes directeurs de thèse bien sûr, le Pr Christian Rey et le Pr Pascal Swider mais aussi le Dr Fabienne Briand-Mésange, le Dr Didier Mathon et le Dr Anne Gomez-Brouchet. Vous avez été au cœur de ce projet, travaillant ensemble à son développement et sa réalisation, vous investissant pleinement aussi bien dans les tâches administratives que scientifiques. Vous m’avez guidée, soutenue, transmis une part de vos connaissances et vous m’avez fait confiance pour mener ce projet à bien. Ce fût un réel plaisir de travailler à vos côtés et d’apprendre à votre contact. Pour tout cela, MERCI.
Plus spécifiquement,…
Christian, vous êtes un puits (sans fond) de connaissances, un grand « maître » des phosphates de calcium. Merci pour tout le temps que vous m’avez accordé, votre gentillesse et nos discussions toujours passionnantes.
Pascal, vous avez été un moteur dans la réalisation de ce projet. Vous m’avez aidé à avancer étape par étape, en gardant le cap pour atteindre les objectifs fixés. J’admire l’énergie et la détermination dont vous avez fait preuve pour que ce travail puisse aboutir et je souhaite qu’il s’agisse d’un investissement à long terme qui continuera à porter ses fruits.
Fabienne, tu as vraiment été là pour moi à tous les niveaux. Ton écoute et tes conseils ont été des atouts précieux. Je reste encore maintenant impressionnée par tes compétences scientifiques et tes qualités humaines. Je te souhaite beaucoup de bonheur et de réussite aussi bien dans tes projets professionnels que dans ta vie personnelle.
Anne, ton regard de lynx a été déterminant dans ce projet. Je te remercie d’avoir partagé avec moi ton expertise et ton temps souvent compté.
Didier, aux doigts de fée, aussi à l’aise avec une perceuse qu’avec du fil et une aiguille. J’ai vraiment apprécié de pouvoir participer (de loin) aux expérimentations et te voir à l’œuvre. Du grand art ! Merci pour ton implication.
Ce projet a, en outre, été réalisé en partenariat avec l’entreprise Teknimed S.A. à l’Union, dirigée par Mr Léonard. Je remercie donc Mr Léonard, le Dr Benoît Donazon et le Dr Stéphane Gonçalvès pour l’intérêt qu’ils ont porté à notre projet ainsi que pour les moyens financiers et techniques qu’ils ont mis à notre disposition. Merci en particulier à Stéphane qui a géré la collaboration avec entrain et réactivité et a accepté de participer à mon jury de thèse en tant qu’invité.
Je remercie, d’autre part, la présidence de l’Université Paul Sabatier pour nous avoir octroyé une bourse ministérielle et la région Midi-Pyrénées pour le financement qu’elle nous a accordé. C’est la combinaison de ces différents facteurs qui a permis la réalisation de ce projet ambitieux.
Mais comme même bien encadrée, on ne peut tout faire seul, il reste encore beaucoup de personnes qui ont joué un rôle majeur dans ce travail :
- Le Dr Christèle Combes, avec son rire sincère et chaleureux, le Dr Sophie Cazalbou, toujours pleine d’énergie, et le Dr Christophe Drouet et sa gourmandise légendaire. Merci d’avoir été présents à mes côtés tout au long de mon parcours et encore maintenant. - Sandrine Cavalié, pour accomplir tes missions parfois périlleuses (comme l’achat d’un
équipement commun, par exemple), tu as à ta disposition ta bonne humeur, ta vitalité et ta patience. Accompagnée de Mme Chamayou, tu as été mon fil d’Ariane dans ces méandres administratifs. Pour cela et pour le reste, nous te devons tous un GRAND MERCI.
- Cédric Charvillat et Olivier Marsan, qui m’ont si spontanément proposé leur aide. Cédric, merci pour ces moments passés dans et en dehors du labo, j’espère que nous pourrons continuer à mieux nous connaître, avec ou sans Mona… Olivier reste passionné et enthousiaste, c’est un vrai bonheur !
- Dominique Bonsirven, la resplendissante Domi. S’il te plaît, fais-nous partager ton secret. - Le Dr Jérôme Briot, le maître incontesté de MATLAB® et un allié de poids pour le labo. Merci pour ton aide, tes conseils et nos longues discussions politico-scientifiques ou scientifiques tout court.
- Le Pr Jean-Jacques Railhac et le Pr Nicolas Sans du service de radiologie et imagerie médicale de l’hôpital Purpan à Toulouse pour le prêt de la tablette graphique, qui fût fort utile, et les radiographies effectuées.
- Le Dr Nicolas Bonnevialle, parfois pressé mais toujours souriant. Ravie d’avoir pu collaborer un temps avec toi.
- Le Dr Jean-Michel Lafosse, Monsieur Efficacité. Ce fût bref mais tu m’as rendu un très grand service. Pour cela et pour tes encouragements, je te remercie.
- Le Dr Sophie Palièrne, avec son dynamisme hors-norme. Nul doute que nos petites brebis ont été bien chouchoutées grâce à toi.
- Joëlle Ribaut, qui répond toujours rapidement. Désolée pour les appels réguliers qui ne te sont pas destinés.
- Gisèle Viguier et Marie Cortèse. Un grand MERCI à vous, d’abord pour ne pas avoir fuit en me voyant arriver les bras chargés de « cadeaux » et ensuite bien sûr pour tout le travail que vous avez accompli en gardant le sourire.
Beaucoup d’autres personnes ont croisé ma route, partagé mon chemin. Je pense à mes amis et collègues qui ont été là pour moi et avec lesquels j’ai passé une multitude de bons moments :
Mona, mon amie, ton enthousiasme, ta générosité, ta « folie », nous rendent tous meilleurs. Tu me manques, Pup you et Te iubesc ! Solène, qui associe bonne humeur et prévenance avec un soupçon de coups de gueule pour l’obtention d’un mélange détonnant ; Jean-Phi, mon sauveur, toujours plein de bonnes idées ; Françoise, merci pour ta bienveillance, je te souhaite toute la réussite du monde dans tes projets, tu le mérites ; la Belle Imane et le très convivial Farid, plein de réussite et de bonheur à vous deux ; Amhed, no stress, tu gères ; Sabrina, toutes mes félicitation pour ta petite Annabelle ; David, le nouveau gourmand de l’équipe ; Gérard et son calme impressionnant ; Stéphanie, en temps partiel sur Toulouse ; Hélène et Sophie qui ont toujours le sourire ; Caroline, avec qui je peux parler « bio » ; Albert, avec ses idées parfois étonnantes ; Jean-Louis que l’on entend de loin et Michèle pleine de tendresse ; mais aussi, Patricia, Fabien, Audrey, Anne-Marie, Véronique, Fernand, Hakim, Ingrid, Fred, Amal, Laeticia, Christos, Jaime, Djar, Yann….
…. Mes copines du vaisseau U563. Et les filles, vous savez pas quoi ?... J’ai « adoooré » passer du temps en votre compagnie ! Anne, petite padawan, (petite mais solide). Merci pour ton écoute et ton soutien, qui m’ont très souvent été utiles. J’espère que nous pourrons continuer nos interminables discussions (en direct ou de loin) encore très longtemps. Marianne, avec ta fraicheur et ta joie communicative, tu es une personne exceptionnelle à connaître absolument. Armelle, scientifique, conseillère perso, bricoleuse, pro de la retouche de photos et des gâteaux, je me demande vraiment ce que tu ne sais pas faire. A toi aussi merci et bon courage. La douce et glamour Audrey, je te souhaite plein de larmes de joies pour cette année et toutes celles à venir. L’attachante et plutôt bavarde Marie, j’aurais vraiment aimé mieux te connaître ; Véro, si tu montes un club « gourmandise », j’adhère tout de suite ; Camille, ta joyeuse excentricité nous manque ; Pierre, tu n’es pas une fille, mais admets-le, sur un malentendu, on peut se tromper…Je pense aussi bien sûr à Dénis, avec qui on se comprend trop bien sur certains points, bon courage ; la « timide » Aurélie ; Claudia avec son rythme et son accent délicieux ; Sara et son emploi du temps millimétré ; l’avenante Alex ; la toujours superbe Stéphanie ; Thomas et sa bobo attitude ; Emmanuelle qui m’autorise à piquer des bonbons ; Françoise qui déborde d’énergie et de gaité ; Greg, le ventre sans fond ; Guillaume, le blagueur ; Jean-Philippe avec son maxi pot de Nutell…, (« chut chut pas de marque ») ; Clo et Christine P qui savent se faire entendre mais n’oublient jamais d’être attentives aux autres ; Nicole et son organisation hors-pair ; Yvette, toujours prête à rendre service, surtout entre midi et deux ; Christine C à qui je souhaite plein de bonnes choses pour la suite ; Isabelle, discrète et attentionnée ; sans oublier bien entendu, Patrick, Muriel, Valérie, Nathalia, Justine, Véro, Séverine, Sophie, Ronan, Coco, Xénia, Stéphane, Gérald, Bertrand, Xavier, Elvire, Emmanuel, Laurent, Michel, François, Jean-Luc, Michel… je vous souhaite à vous tous bonne chance pour le futur….
… Eric, Gaëtan, Georges, Fabien… qui sont toujours très accueillants bien qu’ils parlent une autre langue ( ( , ) .(D( ,r) (r,t)) t t rr φ r φ r φ =∇ ∇ ∂ ∂ )….
…Les vétos, dont notamment Eric avec son sens de l’humour et ses spécialités niçoises, Patricia qui m’a évité les points à vifs, Iban le spécialiste du plaquage de brebis…
Je voudrais, d’autre part, exprimer ma reconnaissance à mes anciens mentors qui m’ont encouragée dans cette voie, Claude, Thierry et Nathalie ; à mes yeux ce sont vos qualités humaines qui font la différence.
Je souhaite enfin faire de gros bisous à ceux que j’aime…
A ma maman et mon papa, qui m’ont tant soutenue tout au long de ces années. Pour les efforts que vous avez faits pour nous et l’amour que vous nous témoignez tous les jours, les mots que j’écrirai ne pourront pas suffire pour vous exprimer ma gratitude. Alors ma douce maman et mon gentil papa, que j’ai embêté plus d’une fois le we, je vous dis simplement, je vous aime !
A Julien, mon âme-sœur. Nul besoin de mots pour se comprendre et heureusement, car il n’en existe pas d’assez fort... T’aim.
A mon grand frère, Xavier, toujours là pour moi, plein de prévenance et d’humour. Je te souhaite un bel avenir avec Véro sur Toulouse (de préférence) ou ailleurs.
A Fabien et Ciloune, qui occupent depuis toujours une grande place dans mon cœur.
A Chantal, Josie, Jojo, Daniel, Francis, Martine, Francette, Christian, Christiane, Vaness, Philippe, Olive et Delphine, Mélanie, Patrice, Olivier et tous les petits bouts de choux qui vous ressemblent et font notre bonheur.
A Maïté, Michel, Billy, Seb, Adi et Lilou qui m’ont accueillie avec amour dès le début et qui continuent à m’encourager.
A celles et ceux qui ne sont plus là, mais que je garde très profondément dans mon cœur. Et pour finir à mes amis IRL, de longue date ou en devenir :
Marine, Sarah, Marina, ma Jojo, Alex, Micka, Yaya, Christophe, Constance, Stéphanie, Claudine, Hyo Young, Chach, Sandra, Audrey, Axel, Cindy, Agnes, Greg, Yoann, Trévor, Ailyc, Sylvain,…
…. Non, je vous le répète une dernière fois : « Je ne fais pas de schtroumpf-moutons » !
Je pense aussi à toi qui as lu mes remerciements dans leur ensemble. Tu me sembles être quelqu’un de courageux ; tu peux donc, dès à présent, t’attaquer à la lecture du reste de mon manuscrit….
RÔLE OSTEOINDUCTEUR D’UN REVÊTEMENT D’APATITE CARBONATÉE NANOCRISTALLINE SUR DES CÉRAMIQUES
DE PHOSPHATE DE CALCIUM BIPHASIQUE
Résumé
Les céramiques commerciales à base de phosphate de calcium frittées à haute température présentent une très faible surface spécifique et sont peu réactives. Bien qu'elles possèdent une excellente ostéoconductivité, leur capacité d'ostéoinduction est très limitée.
L'hypothèse centrale de ce travail a consisté à supposer qu'un revêtement d'apatite carbonatée nanocristalline pouvait améliorer les propriétés de surface et biologiques de ces céramiques. Les analyses physico-chimiques ont montré qu'un revêtement composé de nanocristaux présentant des caractéristiques proches de celles du minéral osseux conduisait à une augmentation sensible de la surface spécifique et à la formation de nanopores, à priori favorables à une amélioration de l'activité biologique. Cette amélioration a été établie par l’étude de l’adsorption d’un facteur de croissance ostéogénique, la rhBMP-2. La quantité de BMP-2 adsorbée a été sensiblement augmentée et le revêtement a de plus permis une libération temporellement soutenue. La biocompatibilité des échantillons revêtus a été ensuite évaluée in vitro par l’étude du comportement de deux types cellulaires. Une étude in vivo a été menée sur modèle animal ovin en site intramusculaire afin d'évaluer le potentiel ostéoinducteur des céramiques phosphocalciques. La proportion d’os néoformé dans ce site ectopique, est apparue significativement augmenté par l’association avec la BMP-2 pour des quantités de protéines réduites, mais également, plus étonnamment, par la seule présence du revêtement nanocristallin. Ce dernier résultat, particulièrement original, ouvre la voie à des applications cliniques à court terme dans le domaine des substituts osseux.
Mots clés
Ostéoinduction – Phosphate de calcium – Apatite nanocristalline – Activation de surface – Bone Morphogenetic Protein
OSTEOINDUCTIVE POTENTIAL OF NANOCRYSTALLINE CARBONATED APATITE - COATED BIPHASIC CALCIUM PHOSPHATE CERAMICS
Abstract
Commercial calcium phosphate ceramics sintered at high temperature exhibit a very low specific surface area and a poor surface reactivity. Although they are excellent osteoconductive materials, their osteoinductive properties appear rather weak. In this work, we hypothesised that a nanocrystalline carbonated apatite coating could improve the surface and biological properties of these ceramics. The physico-chemical analyses showed that a coating made of bone mineral-like nanocrystals increased the specific surface area of the ceramics and induced the formation of nanopores, which could favor the biological activity. The adsorption study of an osteogenic growth factor, the rhBMP-2, confirmed the improvement of surface reactivity. An increased amount of protein was adsorbed and its release was sustained. The biocompatibility of the coated ceramics was demonstrated in vitro. The in vivo osteoinductive property of the modified ceramic was studied in intramuscular sites of an ovine animal model. The modified ceramic, associated with BMP-2 promoted the formation of bone. Furthermore, interestingly, the nanocrystalline coating itself, without any addition of BMP-2, was found to be osteoinductive. This last result, particularly innovating, could lead to clinical applications in the field of bone substitutes.
Key words
Osteoinduction – Calcium phosphate – Nanocrystalline apatite – Surface activation – Bone Morphogenetic Protein
Abréviations
ALP Phosphatase alcaline
BCP Phosphate de calcium biphasique
BET Brunauer-Emmet-Teller
BMP Bone Morphogenetic Protein (rhBMP : BMP humaine recombinante)
BSA Albumine de sérum bovin
CKO Conditional Knock-out mouse
DBM Demineralized bone matrix
DCPA Phosphate dicalcique anhydre (CaHPO4)
DCPD Phosphate dicalcique dihydraté (CaHPO4, 2H2O) DMEM Dulbecco’s modified Eagle’s medium
DMSO Diméthylsulfoxide
DO Densité optique
DRX Diffraction des rayons X
FGF Fibroblast Growth Factor
FTIR Spectroscopie infrarouge à transformée de Fourier
HA Hydroxyapatite (Ca10(PO4)6(OH)2)
ICP-MS Inductively Coupled Plasma-Mass Spectrometer
JCPDS Fiche Joint committee on powder diffraction standard
KO Knock-out mouse
µCT Microcomputed tomography
MEB Microscopie Electronique à Balayage
MET Microscopie Electronique à Transmission
MSC Cellules Souches Mésenchymateuses (hMSC : MSC humaines)
MTT Bromure de 3-[4,5-diméthylthiazol-2-yl]-2,5(-diphényltétrazolium)
NanoAp Revêtement d’apatite nanocristalline 1
NanoAp-EtOH Revêtement d’apatite nanocristalline 2 (Etape additionnelle) OCP Phosphate octacalcique (Ca8(PO4)4(HPO4), 5H2O)
PBS Phosphate Buffer Saline
PDLLA Poly(D,L-lactide)
PGE2 Prostaglandine E2
PLGA Poly D,L(lactide-co-glycolide) pI Point Isoélectrique
qRT-PCR Quantitative Reverse Transcription-Polymerase Chain Reaction
RANK Receptor Activator of Nuclear factor κB
Rapport S/L Rapport Solide/Liquide
RMN Résonance magnétique nucléaire
SBF Simulated body fluid
SD Ecart-type à la moyenne
SEM Erreur standard à la moyenne
SVF Sérum de veau fœtal
TCP Phosphate tricalcique (Ca3(PO4)2) TGF-β Transforming growth Factor-β TRAP Tartrate-resistant acid phosphatase
Table des matières
Table des matières __________________________________________________________ 1 Chapitre 1
Introduction bibliographique générale __________________________________________ 5
1. L’os ________________________________________________________________________ 6
1.1.La matrice extracellulaire ____________________________________________________________ 6 1.1.1.La matrice organique ____________________________________________________________ 6 1.1.2.Le minéral osseux _______________________________________________________________ 7 1.2.Les cellules de l’os et le remodelage osseux ______________________________________________ 8
2. Les matériaux de comblement osseux ___________________________________________ 10
2.1. Les céramiques phosphocalciques_____________________________________________________ 11 2.1.1. L’hydroxyapatite (HA) __________________________________________________________ 11 2.1.2. Le phosphate tricalcique-β (β-TCP) ________________________________________________ 11 2.1.3. Les phosphates de calcium biphasiques (BCP)________________________________________ 12 2.1.4. Les apatites analogues au minéral osseux ____________________________________________ 12
3. Caractéristiques des substituts osseux ___________________________________________ 12
3.1.Biocompatibilité __________________________________________________________________ 12 3.2.Résistance mécanique ______________________________________________________________ 13 3.3.La porosité_______________________________________________________________________ 13 3.4.Biorésorbabilité ___________________________________________________________________ 15 3.5.Bioactivité _______________________________________________________________________ 15 3.6.Ostéoconduction __________________________________________________________________ 17 4. L’ostéoinduction_____________________________________________________________ 18
4.1.L’ostéoinduction par les BMPs _______________________________________________________ 19 4.1.1.Les BMPs ____________________________________________________________________ 20 4.1.1.1.Structure __________________________________________________________________ 20 4.1.1.2.Production par génie génétique ________________________________________________ 21 4.1.1.3.Rôle des BMPs dans l’ostéogenèse _____________________________________________ 21 4.1.2.Association BMPs-matériaux : Efficacité in vivo ______________________________________ 23 4.1.2.1.Influence de la quantité administrée sur la réponse _________________________________ 24 4.1.2.2.Influence du temps de libération _______________________________________________ 25 4.2.L’ostéoinduction induite par les matériaux ______________________________________________ 26 4.2.1.Caractéristiques des matériaux ostéoinducteurs _______________________________________ 26 4.2.2.L’ostéoinduction par les céramiques phosphocalciques _________________________________ 27 4.2.3.Les mécanismes d’action envisagés ________________________________________________ 28
5. Les interactions cellules/biomatériaux ___________________________________________ 29
5.1.Matériaux et ostéoprogéniteurs ou ostéoblastes __________________________________________ 30 5.1.1.Influence de la composition chimique ______________________________________________ 30 5.1.2.Influence de la topographie de surface ______________________________________________ 31 5.1.3.Influence de la taille des cristallites ________________________________________________ 32 5.1.4.Influence de l’énergie de surface __________________________________________________ 33 5.1.5.Les mécanismes d’action possibles ________________________________________________ 33 5.2.Matériaux et ostéoclastes ___________________________________________________________ 34 5.3.Matériaux et cellules immunitaires ____________________________________________________ 34
6.Objectifs de notre étude_______________________________________________________ 35
Chapitre 2
Etude d’un procédé de revêtement de céramiques poreuses par une apatite carbonatée nanocristalline ____________________________________________________________ 38
1.1.Les caractéristiques du minéral osseux _________________________________________________ 38 1.2.Les analogues de synthèse du minéral osseux____________________________________________ 41 1.2.1.Propriétés des apatites biologiques et de leurs analogues de synthèse : Influence de la couche hydratée ___________________________________________________________________________41 1.3.Exemples de procédés de revêtements d’apatites à faible température _________________________ 42
2. Objectifs ___________________________________________________________________ 45 3. Matériel et méthodes _________________________________________________________ 46
3.1.Matériaux _______________________________________________________________________ 46 3.2.Caractérisation des nanocristaux ______________________________________________________ 47 3.2.1.Diffraction des Rayons X ______________________________________________________ 47 3.2.2.La spectroscopie infrarouge à transformée de Fourier __________________________________ 47 3.2.3.Dosage du calcium, du phosphore et du sodium_______________________________________ 48 3.2.4.Dosage des carbonates __________________________________________________________ 49 3.2.5.Microscopie Electronique à Transmission ___________________________________________ 49 3.3.Caractérisation des granulés _________________________________________________________ 50 3.3.1.Microscopie Electronique à Balayage_______________________________________________ 50 3.3.2.Mesure de la surface spécifique ___________________________________________________ 50 3.3.3.Mesure de la porosité ___________________________________________________________ 51 3.3.4.Echange ionique : Strontium______________________________________________________ 51
4. Résultats ___________________________________________________________________ 51
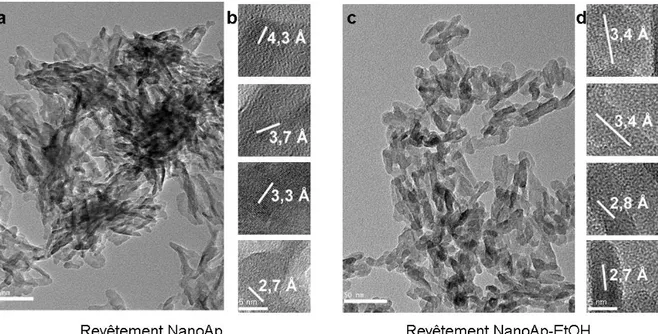
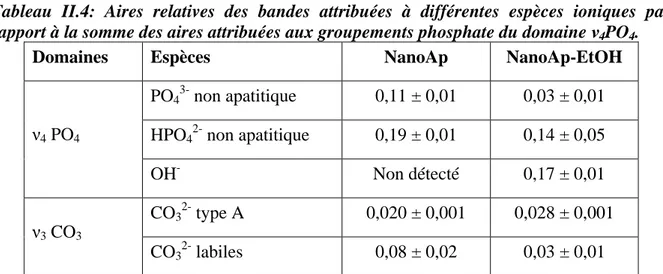
4.1.Caractérisation des nanocristaux ______________________________________________________ 52 4.2.Caractérisation des granulés _________________________________________________________ 56 4.2.1.Morphologie des granulés revêtus _________________________________________________ 56 4.2.2.Surface spécifique______________________________________________________________ 57 4.2.3.Porosité ______________________________________________________________________ 58 4.2.4.Echange ionique avec le strontium _________________________________________________ 59
5. Discussion __________________________________________________________________ 60
5.1.Procédé de revêtement _____________________________________________________________ 60 5.2.Morphologie du revêtement _________________________________________________________ 61 5.3.Caractéristiques des nanocristaux _____________________________________________________ 62 5.4.Comparaison des granulés revêtus ____________________________________________________ 63 5.4.1.Surface spécifique______________________________________________________________ 63 5.4.2.Porosité ______________________________________________________________________ 64 5.4.3.Echange avec le strontium _______________________________________________________ 65
6.Conclusion et perspectives_____________________________________________________ 66
Chapitre 3
Etude de l’adsorption et de la libération de la rhBMP-2 sur les céramiques de BCP revêtues d’un dépôt d’apatite carbonatée nanocristalline__________________________________ 68
1. Introduction bibliographique __________________________________________________ 68
1.1.Adsorption de protéines sur l’hydroxyapatite ____________________________________________ 68 1.2. Adsorption de protéines acides _______________________________________________________ 69 1.3. Adsorption de la BMP-2 ____________________________________________________________ 69 1.4. Paramètres influençant l’adsorption de protéines sur les Ca-P _______________________________ 70 1.4.1. Conditions d’adsorption _________________________________________________________ 71 1.4.2. Influence des caractéristiques de l’adsorbant _________________________________________ 72 1.5.La libération _____________________________________________________________________ 74 2. Objectifs de l’étude __________________________________________________________ 75 3. Matériel et méthodes _________________________________________________________ 76 3.1. Réactifs _________________________________________________________________________ 76 3.1.1. Adsorbant ____________________________________________________________________ 76 3.1.2. Adsorbat : La rhBMP-2 non-glycosylée _____________________________________________ 76 3.2.Adsorption de la rhBMP-2 __________________________________________________________ 76 3.2.1.Marquage de la BMP-2__________________________________________________________ 77
3.2.2.Protocoles d’adsorption de la BMP-2 par les granulés __________________________________ 77 3.3.Libération de la rhBMP-2 ___________________________________________________________ 79 3.3.1.Echantillons utilisés ____________________________________________________________ 79 3.3.2.Protocole de suivi de la libération__________________________________________________ 79
4. Résultats ___________________________________________________________________ 80
4.1.Comparaison de l’efficacité des différents revêtements ____________________________________ 80 4.2.Etude comparative entre les granulés témoins et NanoAp-EtOHx1 ___________________________ 82 4.2.1.Cinétiques d’adsorption de la rhBMP-2 _____________________________________________ 82 4.2.2.Isothermes d’adsorption de la rhBMP-2 _____________________________________________ 83 4.3.Suivi de la libération de la rhBMP-2___________________________________________________ 84
5. Discussion __________________________________________________________________ 86
5.1.Vitesse d’adsorption _______________________________________________________________ 87 5.2.Comparaison des capacités d’adsorption des différents échantillons __________________________ 88 5.2.1.Comparaison des granulés témoins et revêtus ________________________________________ 88 5.2.2.Comparaison des revêtements_____________________________________________________ 90 5.3.Libération de la rhBMP-2 ___________________________________________________________ 91
6.Conclusions et perspectives ____________________________________________________ 94
Chapitre 4
Etude du comportement cellulaire vis-à-vis des céramiques de BCP revêtues ou non avec le procédé NanoAp-EtOH _____________________________________________________ 95
1. Introduction bibliographique __________________________________________________ 95
1.1.Les modèles cellulaires pour l’étude de l’interaction matériaux/ostéoprogéniteurs ou ostéoblastes___ 95 1.2.Les modèles cellulaires pour l’étude de la différenciation ostéoblastique induite par la BMP-2 _____ 97
2. Objectifs ___________________________________________________________________ 98 3. Matériels et méthodes ________________________________________________________ 99
3.1.Modèles cellulaires ________________________________________________________________ 99 3.2.Culture cellulaire sur les granulés ____________________________________________________ 100 3.3.Etudes de l’adhésion et de la prolifération _____________________________________________ 101 3.3.1.Conditions de cultures _________________________________________________________ 101 3.3.2.Test au MTT _________________________________________________________________ 102 3.4.Morphologie des cellules __________________________________________________________ 102 3.4.1.Conditions de culture __________________________________________________________ 102 3.4.2.Microscopie Electronique à Balayage (MEB) _______________________________________ 103 3.5.Etude de la différenciation ostéoblastique______________________________________________ 103 3.5.1.Conditions de culture __________________________________________________________ 103 3.5.2.Récupération des cellules incubées sur les granulés ___________________________________ 103 3.5.3.Dosage de l’activité ALP _______________________________________________________ 104 3.5.4.Dosage de l’ADN _____________________________________________________________ 105
4. Résultats __________________________________________________________________ 105
4.1.Etude des réponses cellulaires vis-vis des matériaux _____________________________________ 105 4.1.1.Adhésion et prolifération _______________________________________________________ 105 4.1.1.1.C2C12___________________________________________________________________ 105 4.1.1.2.C3H10T1/2_______________________________________________________________ 107 4.1.2.Morphologie des cellules ensemencées sur les granulés________________________________ 108 4.1.3.Différenciation des cellules en contact avec les matériaux______________________________ 109 4.2.Différenciation en réponse à la BMP-2 adsorbée ________________________________________ 110
5. Discussion _________________________________________________________________ 112
5.1.Biocompatibilité générale des céramiques étudiées ______________________________________ 112 5.2.Adhésion et prolifération cellulaires __________________________________________________ 114 5.3.La différenciation intrinsèque _______________________________________________________ 116 5.4.Différenciation en réponse à la rhBMP-2 adsorbée ______________________________________ 117
Chapitre 5
Etude du potentiel ostéoinducteur des céramiques de BCP revêtues avec un dépôt d’apatite carbonatée nanocristalline avec ou sans rhBMP-2 chez l’animal___________________ 121
1. Introduction bibliographique _________________________________________________ 121
1.1.Les modèles animaux _____________________________________________________________ 121 1.1.1.Les modèles d’ostéoinduction par les BMPs ________________________________________ 121 1.1.2.Les modèles d’ostéoinduction par les matériaux _____________________________________ 122 1.2.Le site d’implantation _____________________________________________________________ 123 1.3.La taille de l’implant ______________________________________________________________ 124 1.4.Le temps d’implantation ___________________________________________________________ 124 2. Objectifs __________________________________________________________________ 125 3. Matériel et méthodes ________________________________________________________ 126 3.1.Implants________________________________________________________________________ 126 3.1.1.Les céramiques _______________________________________________________________ 126 3.1.2.Association avec la rhBMP-2 ____________________________________________________ 126 3.2.Implantations intramusculaires ______________________________________________________ 127 3.3.Etude histologique________________________________________________________________ 129 3.4.Etude statistique _________________________________________________________________ 134 4. Résultats __________________________________________________________________ 135 4.1.Observations générales ____________________________________________________________ 135 4.2.Inflammation et fibrose ____________________________________________________________ 135 4.3.Comparaison de l’efficacité des échantillons – quantification de l’os néoformé (ostéoinduction) ___ 135 4.3.1.Implants intramusculaires 1 mois _________________________________________________ 135 4.3.1.1.Echantillons avec rhBMP-2 déposée ___________________________________________ 135 4.3.1.2.Echantillons sans rhBMP-2 __________________________________________________ 137 4.3.1.3.Evaluation quantitative______________________________________________________ 137 4.3.2.Implants intramusculaires 3 mois _________________________________________________ 138 4.3.2.1.Echantillons avec rhBMP-2 déposée ou adsorbée_________________________________ 138 4.3.2.2.Echantillons sans rhBMP-2 __________________________________________________ 139 4.3.2.3.Evaluation quantitative______________________________________________________ 140
5. Discussion _________________________________________________________________ 141
5.1.Effet ostéoinducteur de la rhBMP-2 __________________________________________________ 142 5.2.Effet ostéoinducteur du revêtement___________________________________________________ 143
6. Conclusions et perspectives ___________________________________________________ 146
Conclusions et perspectives générales _________________________________________ 148
1. Evaluation de la capacité de reconstruction osseuse en site orthotopique _____________ 149 2. Transfert industriel _________________________________________________________ 151 3. Etude des mécanismes d’ostéoinduction ________________________________________ 151
3.1.Etudes chez l’animal ______________________________________________________________ 152 3.2.Etudes in vitro ___________________________________________________________________ 153
Liste des publications et communications issues de ce projet ______________________ 156 Références_______________________________________________________________ 158
Chapitre 1
L’os est une structure dynamique qui possède la propriété de se renouveler et de se reconstruire. Les capacités de régénération sont cependant limitées et il arrive dans certaines circonstances qu’un comblement osseux soit nécessaire pour obtenir une reconstruction complète de la zone lésée. C’est le cas notamment lorsque la taille de la zone à reconstruire est importante (pseudarthrose, résection de tumeurs ou de kystes osseux, forte perte de substance lors d’un traumatisme, …) ou lorsque la reconstruction est lente (union retardée, maladie, patient agé…).
Pour faciliter la réparation de grandes pertes de substances, une greffe osseuse peut être réalisée. L’autogreffe est considérée comme la référence du matériau de comblement. Sa réalisation comporte cependant plusieurs inconvénients : le prélèvement du greffon s’accompagne d’une augmentation de la douleur pour le patient, consécutive à l’opération, et d’un fort risque de morbidité du site de prélèvement. La quantité et la qualité du tissu osseux prélevé sont, d’autre part, variables et peuvent être insuffisantes chez les patients d’un âge avancé ou malades (Dawson et al. 2008).
Des allogreffes, c'est-à-dire des greffes osseuses provenant d’un donneur différent, sont aussi disponibles. Afin de limiter les problèmes d’histocompatiblité entre le donneur et le receveur et les risques de transmissions virales, ces greffons sont classiquement stérilisés par radiations gamma. Après stérilisation, les propriétés mécaniques et biologiques de ces greffons peuvent cependant être altérées et leur potentiel de reconstruction, plus limité que celui des autogreffes en raison de l’absence de cellules vivantes, ne permet pas en général un remplacement total du substitut par de l’os néoformé (Nguyen et al. 2007).
Avec le prolongement de la durée de vie notamment, la demande de substituts osseux est en constante augmentation et ce domaine représente donc un marché économique important. En raison des difficultés rencontrées par l’utilisation de greffes osseuses, les orthopédistes et dentistes se tournent de plus en plus vers l’utilisation de matériaux de comblement synthétiques ou d’origine naturelle contrôlée. Plusieurs types de matériaux sont, en effet, disponibles : éponges de collagène, polymères synthétiques ou naturels, bioverres, composés phosphocalciques, matériaux composites (Rezwan et al. 2006, Kokubo 2008).
Mais les matériaux commercialisés à l’heure actuelle présentent au mieux des propriétés
ostéoconductrices, c'est-à-dire qu’ils possèdent la capacité de favoriser la croissance osseuse
lorsqu'ils sont au contact d'un os (Jarcho 1981). Ces propriétés ostéoconductrices sont cependant insuffisantes pour soutenir la reconstruction complète de larges pertes de substance
Il apparaît donc essentiel d’élaborer de nouvelles catégories de matériaux possédant des capacités de reconstruction du tissu osseux sans contact direct avec l’os ; les matériaux
ostéoinducteurs ont ce potentiel. L’ostéoinduction, contrairement à l’ostéoconduction, est un
processus biologique qui induit une différenciation de cellules progénitrices en ostéoblastes. Dans ce cas, la croissance osseuse pourra avoir lieu dans l’ensemble du matériau, ce qui augmente l'efficacité de la reconstruction. Plusieurs stratégies envisagées s’inspirent des processus d'ossification et visent à les reproduire en partie (De Bruijn et al. 2008).
1. L’os
L’os est un tissu conjonctif dynamique soumis à un renouvellement régulier, appelé remodelage, et qui possède la capacité de se régénérer lorsqu’il est endommagé. Il est composé d’une matrice extracellulaire minéralisée et de cellules qui participent à son remodelage et à sa réparation.
1.1. La matrice extracellulaire
La matrice extracellulaire osseuse est composée d’une matrice organique, de minéral et d’eau qui représentent respectivement 30, 60 et 10% de la masse osseuse.
1.1.1. La matrice organique
La matrice organique est composée essentiellement de fibres de collagènes (90%) qui sont associées entre elles et constituent l’architecture du tissu osseux. Le collagène de type I est largement majoritaire mais d’autres types de collagènes ont été détectés (les collagènes de type V et III) et participent à l’organisation de cette matrice (Niyibizi et al. 1994). Cette structure collagénique assure la visco-élasticité de l’os alors que le minéral qui se dépose à la surface et entre les fibres de collagène (parallèlement à celles-ci) est responsable de la rigidité du tissu. L’orientation et la composition de ces fibres, qui régulent la quantité et l’orientation du minéral déposé, conditionnent donc la résistance mécanique du tissu osseux (Viguet-Carrin et al. 2006).
Des protéines non-collagéniques sont, par ailleurs, incluses dans la matrice et peuvent participer à la formation d’os et à sa régulation. Ces protéines sont nombreuses et assurent des fonctions variées. Plusieurs d’entre elles jouent un rôle sur l’organisation de la matrice et sa minéralisation (protéoglycanes, sialoprotéine osseuse, ostéocalcine, ostéopontine,
ostéonectine, phosphatase alcaline (ALP)…). D’autres peuvent avoir une action - directe ou indirecte - sur l’activité des ostéoblastes et/ou des ostéoclastes (protéoglycanes, Bone Morphogenetic Proteins (BMPs), osteoprotégérine…). Des protéines caractéristiques du remodelage osseux (Tartrate-resistant acid phosphatase : TRAP) et de la vascularisation (Vascular Endothelial Growth Factor : VEGF) sont aussi présentes (Schmidmaier et al. 2006, Lamoureux et al. 2007, Schreiweis et al. 2007).
1.1.2. Le minéral osseux
Comme nous l’avons indiqué, la matrice extracellulaire osseuse est minéralisée. Cette minéralisation assure la rigidité du tissu osseux et participe activement à l’homéostasie du calcium de l’organisme. Le minéral osseux sert en effet de réservoir d’ions.
Le minéral osseux est composé de fines plaquettes d’apatite de taille nanométrique qui se déposent parallèlement aux fibres de collagène (Kuhn et al. 2008). Longtemps considéré comme de l’hydroxyapatite substituée, le minéral osseux correspond en fait à une apatite carbonatée déficiente en ions calcium et hydroxyde. La composition moyenne du minéral osseux peut être représentée par la formule chimique suivante (Legros et al. 1986) :
Ca8,3 1,7(PO4)4,3(HPO4 et CO3)1,7(OH et/ou 1/2 CO3)0,3 1,7
Une caractéristique majeure des apatites biologique est la présence d'environnements ioniques qui n'existent pas dans les apatites bien cristallisées. Ces environnements ont été attribués à la présence en surface des cristaux d’une couche hydratée bien organisée, mais labile, contenant des ions minéraux (environnements des ions CO32-, HPO42- et PO43- notamment) (Rey et al.
1989, Eichert et al. 2002). Cette couche hydratée, qui évolue au cours du temps, serait responsable de la très grande réactivité de surface des apatites biologiques. Ces apatites présentent de très fortes capacités d’échanges ioniques et d’adsorption de protéines, ce qui leur permet d’interagir facilement avec les fluides biologiques. Ces propriétés pourraient être liées à la présence de cette couche hydratée, qui contient des espèces ioniques relativement mobiles et facilement échangeables (Figure I.1) (Ouizat et al. 1999, Cazalbou 2000). Une description plus complète des caractéristiques du minéral est faite dans la partie bibliographique du chapitre 2.
Figure I.1 : Schéma de la couche hydratée en surface des nanocristaux. Les ions présents
dans la couche hydratée peuvent être facilement échangés avec les ions présents en solution et participer à l’adsorption de protéines (Pr) à la surface des cristaux.
1.2. Les cellules de l’os et le remodelage osseux
Le maintien du capital osseux est assuré par deux types cellulaires, les ostéoblastes qui sont les cellules formatrices de l’os et les ostéoclastes qui le dégradent. Deux autres types cellulaires qui correspondent à des ostéoblastes différenciés, les ostéocytes et les cellules bordantes de l’os, sont présents dans l’os et ont un rôle majeur dans la régulation de ces phénomènes. Toutes ces cellules agissent de manière coordonnée lors du remodelage osseux (Matsuo et al. 2008).
• Les ostéoblastes
Les ostéoblastes sont issus de cellules souches mésenchymateuses, situées notamment dans la moelle osseuse, et sont responsables de la formation de l’os. Lors de leur différenciation, les pré-ostéoblastes, qui deviennent progressivement des ostéoblastes matures, expriment différents facteurs (phosphatase alcaline, collagène de type I, ostéopontine, ostéocalcine, sialoprotéine osseuse) qui participent à la formation du tissu ostéoïde (la matrice organique de l’os) puis à sa minéralisation. Les ostéoblastes matures peuvent se différencier en ostéocytes, en cellules bordantes de l’os ou être éliminés par apoptose (mort cellulaire programmée).
• Les ostéocytes
Les ostéocytes sont des ostéoblastes qui sont totalement différenciés et sont entourés de matrice minéralisée. Ils sont incapables de proliférer mais participent activement à l’initiation et à la régulation du remodelage osseux, notamment par leur action de mécanosenseurs.
• Les cellules bordantes de l’os
Les cellules borbantes de l’os sont des ostéoblastes différenciés, aplatis, qui recouvrent la surface de l’os. Leur fonction consiste à protéger la matrice osseuse contre l’action des ostéoclastes. Lors du remodelage osseux, ces cellules sécrètent des collagénases qui dégradent le tissu ostéoïde, découvrant donc la matrice minéralisée et participent à l’activation des ostéoclastes.
• Les ostéoclastes
Les ostéoclastes sont des cellules multinucléées issues de progéniteurs hématopoïétiques aussi présents dans la moelle osseuse. Les précurseurs hématopoïétiques expriment le récepteur RANK (Receptor Activator of Nuclear factor κB) à leur surface puis fusionnent sous l’activation du ligand (RANKL), ce qui conduit à la formation de cellules multinucléées actives. Les ostéoclastes matures sont des cellules polarisées capables de dégrader la matrice osseuse minéralisée par la libération d’enzymes (cathepsine K) et d’acide chlorhydrique.
Le remodelage osseux peut être divisé en trois phases : initiation, transition, terminaison (Figure I.2)
Figure I.2 : Le remodelage osseux. Les ostéoclastes sont en rouge et les ostéoblastes en bleu.
Lors de la phase d’initiation, les précurseurs hématopoïétiques sont recrutés au niveau du site à remodeler. La différenciation des ostéoclastes est induite par les cellules bordantes de l’os qui expriment des ligands des ostéoclastes tels que RANKL. Ceci entraine la fusion des précurseurs ostéoclastiques qui deviennent multinucléés et entament la résorption de l’os. La phase de transition correspond au passage de la résorption vers la formation osseuse. Celle– ci comprend le recrutement de cellules progénitrices et leur différenciation ostéoblastique alors que les ostéoclastes partent en apoptose. Ces évènements sont susceptibles d’être régulés par différents facteurs sécrétés, des liaisons directes entre ostéoclastes et ostéoblastes ou la libération de facteurs contenus dans la matrice lors de sa dégradation. Lors de la phase de terminaison, l’os est reformé, minéralisé puis protégé par les cellules bordantes de l’os
2. Les matériaux de comblement osseux
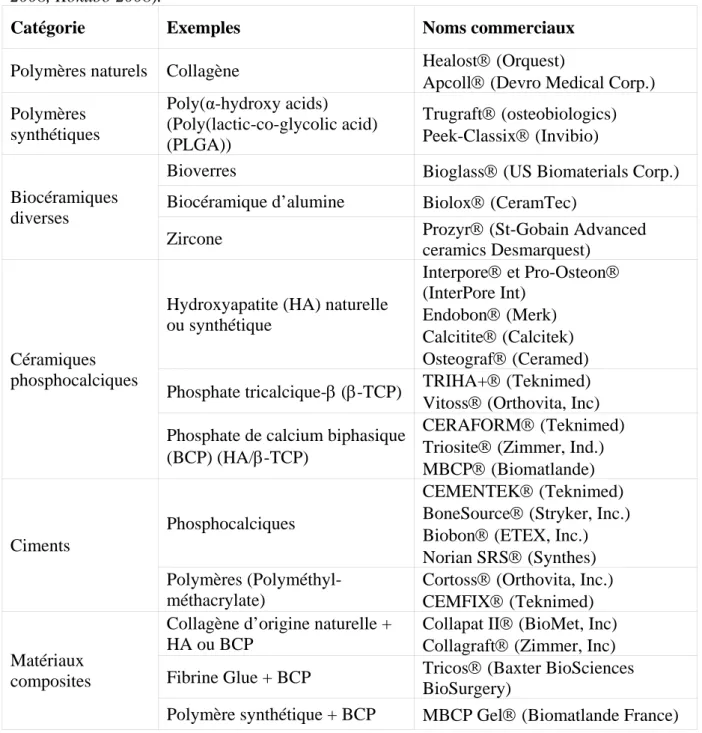
De nombreux types de matériaux peuvent être utilisés comme substituts osseux. Leur nature, leur composition, leur formulation et leurs propriétés sont diverses. Différents types de matériaux de comblement sont déjà commercialisés et utilisés en orthopédie ou chirurgie dentaire. Quelques exemples de substituts osseux commercialisés sont mentionnés dans le tableau I.1.
Tableau I.1 : Types de matériaux de comblement commercialisés (LeGeros 2002, Ge et al.
2008, Kokubo 2008).
Catégorie Exemples Noms commerciaux
Polymères naturels Collagène Healost® (Orquest)
Apcoll® (Devro Medical Corp.) Polymères synthétiques Poly(α-hydroxy acids) (Poly(lactic-co-glycolic acid) (PLGA)) Trugraft® (osteobiologics) Peek-Classix® (Invibio)
Bioverres Bioglass® (US Biomaterials Corp.) Biocéramique d’alumine Biolox® (CeramTec)
Biocéramiques diverses
Zircone Prozyr® (St-Gobain Advanced
ceramics Desmarquest) Hydroxyapatite (HA) naturelle
ou synthétique Interpore® et Pro-Osteon® (InterPore Int) Endobon® (Merk) Calcitite® (Calcitek) Osteograf® (Ceramed) Phosphate tricalcique-β (β-TCP) TRIHA+® (Teknimed) Vitoss® (Orthovita, Inc) Céramiques
phosphocalciques
Phosphate de calcium biphasique (BCP) (HA/β-TCP)
CERAFORM® (Teknimed) Triosite® (Zimmer, Ind.) MBCP® (Biomatlande)
Phosphocalciques
CEMENTEK® (Teknimed) BoneSource® (Stryker, Inc.) Biobon® (ETEX, Inc.) Norian SRS® (Synthes) Ciments
Polymères (Polyméthyl-méthacrylate)
Cortoss® (Orthovita, Inc.) CEMFIX® (Teknimed) Collagène d’origine naturelle +
HA ou BCP
Collapat II® (BioMet, Inc) Collagraft® (Zimmer, Inc) Fibrine Glue + BCP Tricos® (Baxter BioSciences
BioSurgery) Matériaux
composites
2.1. Les céramiques phosphocalciques
De par leur composition ionique proche de celle du minéral osseux et leurs bonnes propriétés ostéoconductrices, les céramiques phosphocalciques constituent une catégorie de matériaux très souvent utilisée pour le comblement de perte de substance osseuse. Ces céramiques sont en général à base d’hydroxyapatite et/ou de phosphate tricalcique-β. Ces céramiques peuvent comporter une phase unique de l’un de ces deux composés ou un mélange des deux (BCP) avec des rapports variables. Elles peuvent se présenter sous différentes formes (pastilles denses, blocs ou granulés poreux).
2.1.1. L’hydroxyapatite (HA)
L’hydroxyapatite (HA) fait partie de la famille des apatites qui sont des composés minéraux dont la principale caractéristique est leur capacité à admettre un grand nombre de substitutions et de lacunes ioniques. Les apatites stoechiométriques sont en général représentées par la formule chimique :
Me10(XO4)6Y2
Où Me est un métal bivalent, XO4 un anion trivalent et Y un anion monovalent.
L’hydroxyapatite stoechiométrique est donc représentée par la formule Ca10(PO4)6(OH)2.
La synthèse de l’hydroxyapatite est en général effectuée par précipitation en conditions basiques puis frittage à une température excédant les 1000°C.
L’HA stoechiométrique est caractérisée par son rapport Ca/P de 1,67. Son analyse par spectroscopie infrarouge montre des bandes caractéristiques attribuées aux ions OH- et au groupement phosphate ; et son diagramme de diffraction des rayons X correspond à une structure hexagonale (groupe P63/m) avec les paramètres de maille : a = 0,9422 nm et c =
0,688 nm (LeGeros 2002).
2.1.2. Le phosphate tricalcique-β (β-TCP)
Le phosphate tricalcique-β a pour formule chimique : Ca3(PO4)2. Il est caractérisé par un
rapport Ca/P de 1,5. Il est de structure rhomboédrique (groupe R3c) et a pour paramètres de
mailles : a = b = 1,0439 nm et c = 3,7375 (pour la maille multiple hexagonale).
Sa préparation se fait par frittage à haute température d’apatite déficiente en calcium de rapport Ca/P de 1,5 ou par réaction solide-solide à haute température. Les températures de
2.1.3. Les phosphates de calcium biphasiques (BCP)
Des céramiques biphasiques contenant un rapport HA/β-TCP variable sont également synthétisées. Pour cela, une apatite déficiente en calcium précipitée avec un rapport compris entre 1,5 et 1,67 est frittée à haute température. En fonction du rapport Ca/P du composé initial, la céramique obtenue aura un rapport HA/β-TCP défini. La deuxième technique de fabrication consiste à mélanger des poudres d’hydroxyapatite et de β-TCP dans le rapport souhaité avant frittage.
Les céramiques de BCP les plus couramment utilisées ont un rapport HA/β-TCP de l’ordre de 60/40 ou 80/20.
2.1.4. Les apatites analogues au minéral osseux
Ces céramiques frittées à haute température ne sont pas parfaitement comparables au minéral osseux, notamment en ce qui concerne leur réactivité de surface (Gautier et al. 1998). Il est cependant possible de synthétiser de vrais analogues du minéral osseux. Ces composés possèdent les caractéristiques des apatites biologiques au niveau de la taille des cristallites, de la composition et de la présence d’une couche hydratée à leur surface. Ces analogues du minéral osseux sont par conséquent très réactifs (Cazalbou 2000). Le développement de substituts osseux biomimétiques à partir de ces apatites est envisagé mais plusieurs problèmes techniques devraient d’abord être surmontés, notamment en ce qui concerne la mise en forme et la résistance mécanique de tels matériaux.
3. Caractéristiques des substituts osseux
En vue de leur utilisation en clinique, les substituts osseux doivent répondre à certains critères. Ces caractéristiques définissent l’efficacité du matériau de comblement.
3.1. Biocompatibilité
La biocompatibilité des substituts employés est primordiale. Ces matériaux ainsi que leurs produits de dégradation ne doivent pas, en effet, présenter de cytotoxicité ni s’accompagner d’une forte réaction inflammatoire.
De par leur nature, les matériaux phosphocalciques et leurs produits de dégradation (calcium, phosphate) sont parfaitement assimilables par l’organisme et participent même à la
régénération osseuse. Que ce soit in vitro ou in vivo, la majorité de ces matériaux présentent une très bonne biocompatibilité. L’implantation de céramiques d’HA, de β-TCP ou de BCP chez l’animal s’accompagne d’une bonne apposition d’os à la surface des matériaux, sans présence de réaction inflammatoire (Jarcho 1981). Dans de rares cas, une dissolution trop importante des matériaux s’accompagne d’une cytotoxicité et par suite, d’un manque d’efficacité. De telles observations ont pu être faites pour des céramiques d’α-TCP (Yuan et al. 2001a).
3.2. Résistance mécanique
Les substituts osseux peuvent être soumis à des efforts mécaniques importants similaires à ceux que l’os doit supporter. Il est donc important que ces matériaux présentent de bonnes propriétés mécaniques afin d’éviter leur effritement ou leur fracture lors de la mise en place durant l'opération chirurgicale ou au moment de la mise en charge.
La résistance mécanique des substituts osseux est dépendante principalement de leur composition, de leur mode de fabrication et de leur morphologie.
L’hydroxyapatite dense possède une forte résistance à la traction ou à la compression avec des valeurs supérieures ou comparables à celle de l’os cortical. Sa résistance à la traction est comprise entre 79 et 106 MPa contre 69 à 110 MPa pour l’os cortical (LeGeros 2002) et sa résistance à la compression peut atteindre 400 MPa contre 100 à 200 MPa pour l’os cortical (Rezwan et al. 2006).
Cependant, la présence nécessaire de pores interconnectés dans les matériaux employés diminue de manière drastique leurs propriétés mécaniques. Les valeurs obtenues, très variables en fonction du type de céramique phosphocalcique étudié, sont de l’ordre de 50 MPa pour la résistance à la traction et inférieures à 10 MPa pour la résistance à la compression (LeGeros 2002, Dellinger et al. 2006).
3.3. La porosité
La morphologie des substituts osseux est un paramètre majeur qui conditionne leur efficacité. Il est en effet nécessaire que le matériau contienne des pores interconnectés. Il a été montré que deux gammes de porosités doivent être présentes pour assurer une bonne reconstruction osseuse :
• Une macroporosité
La macroporosité correspond en général à des pores de diamètre supérieur à 100 µm, et classiquement compris entre 300 et 600 µm. La présence de ces macropores assure l’envahissement du matériau par les cellules ainsi que la mise en place de la vascularisation permettant un apport des fluides biologiques nécessaires à la survie et à la différenciation cellulaire. Une porosité minimale de 40-70 µm est indispensable pour l’envahissement de vaisseaux et la formation d’os. Klenke et al. ont montré que la taille des macropores était directement corrélée à la quantité d’os et au nombre de vaisseaux formés après implantation de céramiques de BCP sur des crânes de rats. Les valeurs obtenues sont significativement plus importantes pour des gammes de porosités supérieures à 140 µm et augmentent avec la taille des pores (Klenke et al. 2008).
• Une microporosité
La présence de mésopores de diamètre inférieur à 10 µm – communément appelées micropores dans le domaine des biomatériaux – joue par ailleurs un rôle important dans l’efficacité de reconstruction de ces matériaux, notamment sur leurs propriétés ostéoconductrices et/ou ostéoinductrices. Il a été évoqué que ces micropores étaient susceptibles de jouer un rôle à plusieurs niveaux : augmentation de la surface spécifique des matériaux, création d’un microenvironnement à l’intérieur de ces pores, augmentation de la rugosité, augmentation de la résorbabilité. Ces différents paramètres, associés à la réactivité du matériau, pourraient donc avoir une influence sur la bioactivité du matériau ou ses capacités d’adsorption (Habibovic et al. 2008, Zhu et al. 2008).
La porosité des matériaux est contrôlée par leur mode de fabrication. En général, la macroporosité et la microporosité peuvent être assurées par l’utilisation de moules poreux ou l’intégration d'agents porogènes qui vont être dégradés à haute température (frittage de céramiques par exemple). Les porosités peuvent aussi être obtenues simplement par le frittage de billes calibrées ou encore par dissolution de l'agent porogène ajouté (pour la préparation de polymères poreux par exemple). Dans le cas des céramiques phosphocalciques, la microporosité est aussi corrélée à la température de frittage : plus la température de frittage est faible, plus la microporosité sera importante (Wilson et al. 2006).
3.4. Biorésorbabilité
La biorésorbabilité est un facteur important : Elle va déterminer la vitesse à laquelle le matériau va être dégradé in vivo par les phénomènes de dissolution spontanés et par l’action des ostéoclastes. Celle-ci doit être contrôlée pour obtenir une dégradation directement corrélée dans le temps à la formation d’os : Le matériau doit, en effet, être en mesure de se dégrader pour permettre le remplacement progressif de la céramique par l’os néoformé mais une dégradation trop rapide peut être responsable de la perte de l’intégrité de la structure de la céramique qui ne pourra donc plus soutenir la croissance osseuse.
La biorésorbabilité est dépendante des caractéristiques physico-chimiques des matériaux. La composition chimique du matériau conditionne son degré de solubilité et donc sa vitesse de dégradation. Il est généralement considéré que la biodégradabilité est liée au produit de solubilité du matériau. L’HA stœchiométrique est définie par de nombreux auteurs comme un matériau non résorbable. Son produit de solubilité est, en effet, très faible. Au contraire, le β-TCP a un produit de solubilité beaucoup plus grand que celui de l’hydroxyapatite (si on le rapporte au même nombre d'ions phosphate dans de l’eau à 25°C) et peut être plus facilement dissout à pH acide. La combinaison d’HA et de β-TCP pour former les céramiques mixtes de BCP a pour objectif principal de contrôler leur vitesse de résorption. Ces céramiques mixtes ont une résorbabilité intermédiaire et sont capables d’être dégradées entièrement pour être remplacées par la matrice osseuse.
La vitesse de dissolution des céramiques peut être modifiée par différents facteurs dont la taille des cristallites et la porosité du matériau (LeGeros 2002). La présence de micropores permet d’augmenter la surface spécifique des matériaux et donc leur vitesse de dissolution et leur dégradation à composition chimique et produit de solubilité identiques (Dellinger et al. 2006, Wilson et al. 2006).
3.5. Bioactivité
Les matériaux bioactifs possèdent la propriété unique de créer un contact direct avec l’os sans formation de chape fibreuse augmentant de ce fait leur potentiel d’intégration. Cette capacité réside dans la possibilité pour ces biomatériaux de précipiter à leur surface une apatite nanocristalline, similaire au minéral osseux, au contact des fluides biologiques (Takadama et al. 2008).
La formation de cette phase apatitique se fait en plusieurs étapes : 1) existence d’un environnement sursaturé en ions calcium et phosphate ; 2) précipitation à la surface du matériau d’une apatite nanocristalline carbonatée ; 3) association puis incorporation de cette phase avec la matrice organique de l’os nouvellement formé. La première étape est réalisée naturellement et les fluides biologiques au contact d'un implant sont sursaturés par rapport aux apatites nanocrystallines susceptibles de se former. On considère que le produit ionique du sérum est proche du produit de solubilité du phosphate Octacalcique (OCP) (Eidelman et al. 1987). La deuxième étape dépend des propriétés de nucléation de la surface, elle est particulièrement importante pour l'hydroxyapatite et d'autres phosphates de calcium susceptibles de favoriser la croissance epitactique de cristaux d'apatite. Cependant, cette capacité d'une surface à favoriser la germination d'une phase apatitique peut être exaltée par la libération d'ions minéraux du biomatériau lui-même. Ainsi, la bioactivité des bioverres est attribuée à leur capacité à libérer du calcium dans leur environnement immédiat et favoriser ainsi localement la précipitation de phosphate de calcium. Deux autres ions peuvent contribuer à cet effet, les phosphates et les ions OH- par leur effet sur le pH local, et certains biomatériaux utilisent aussi ces propriétés. La troisième étape est plus complexe et elle implique de nombreux paramètres physico-chimiques et biologiques. Parmi les paramètres physico-chimiques, il faut mentionner la vitesse de croissance des cristaux, l’inhibition de la croissance et de la germination par des protéines ou des ions (Mg, carbonates, pyrophosphates, citrates ...), la diffusion de ces groupements vers le front de minéralisation. Les paramètres biologiques concernent, notamment l'adhésion, la prolifération, la différenciation et la minéralisation des ostéoblastes, qui dépendent fortement de la surface du biomatériau et de certains ions minéraux en solution (notamment calcium et phosphate) (cf. paragraphe I.5.1). Tout comme le minéral osseux, la phase apatitique nanocristalline néoformée est très réactive et elle possède des capacités importantes d’échange ionique et d’adsorption de protéines. Il a, par ailleurs, été suggéré que des protéines issues des fluides environnants pourraient être co-précipitées et donc incluses dans cette couche apatitique lors de sa formation.
La bioactivité de matériaux a été montrée pour la première fois par Hench et al. qui ont remarqué la formation de cette couche apatitique sur leur bioverre (Hench et al. 1972). Kokubo et al. ont ensuite montré que la bioactivité d’un matériau pouvait être évaluée in vitro par immersion à 37°C du matériau dans une solution de SBF (simulated body fluid) qui reproduit la composition ionique du plasma sanguin. Dans ces conditions, seuls les matériaux
bioactifs ont la capacité d’induire la nucléation-croissance de cette phase apatitique à leur surface (Kokubo 1991).
La présence de sites de nucléation et un accroissement de la sursaturation en ions calcium et/ou phosphate à la surface du matériau sont deux mécanismes permettant d'induire la formation de cette apatite similaire au minéral osseux (Duan et al. 2004).
La plupart des céramiques à base de phosphates de calcium sont bioactives à des degrés variables. La microporosité de ces matériaux semble jouer un rôle important dans ce phénomène : cette microporosité augmente la surface spécifique des échantillons et donc le nombre de sites de nucléation. Il a, d’autre part, été suggéré qu'elle pourrait permettre d’obtenir un micro-environnement favorable pour une sursaturation en ions calcium et phosphate (Duan et al. 2004).
3.6. Ostéoconduction
L’ostéoconduction est définie actuellement comme la capacité d’un matériau à permettre une croissance osseuse lorsqu'il est au contact ou à proximité d'un os (Jarcho 1981). Le matériau doit être en mesure d’accueillir les précurseurs ostéoblastiques qui migrent de la moelle osseuse et d’assurer leur prolifération puis leur différenciation en ostéoblastes. D’un point de vue pratique, l’ostéoconduction est mesurée après implantation d’un matériau dans un site osseux. Il s’agit, en général, d’études comparatives qui mettent en évidence le potentiel ostéoconducteur d’un matériau par rapport à un autre. Les évaluations effectuées peuvent être histologiques, avec la mesure de la formation d’os formé et de la vascularisation, ou mécaniques, avec des mesures de la force de la liaison os-matériau (Nakamura et al. 2008). La composition chimique et la topographie de surface des échantillons ont une forte influence sur l’ostéoconduction. Le contact os-implant et la résistance aux tests mécaniques d’implants en titane apparaissent, en effet, significativement accrues en présence d’un revêtement d’HA, bioactif, à leur surface ou d’une rugosité importante, susceptible de stimuler la différenciation et la minéralisation des ostéoblastes (Goldberg et al. 1995, Moroni et al. 2008). En outre, bien qu’elle n’apparaisse pas indispensable dans l’initiation du phénomène, la présence d’une macroporosité favorise l’ostéointégration des matériaux (Takemoto et al. 2005).
Les céramiques phosphocalciques présentent de très bonnes propriétés ostéoconductrices et leur capacité est déterminée par leurs caractéristiques et notamment leur composition chimique et leur microporosité. L’implantation dans des fémurs de chien de céramiques de BCP (HA/β-TCP : 62/38) montre une ostéointégration plus précoce et une quantité d’os