Panmixie et variabilité phénotypique :
Étude des déterminismes moléculaires impliqués dans la
variation phénotypique chez l’anguille d’Amérique
(ANGUILLA ROSTRATA, LESUEUR 1817)
Thèse
Caroline Côté
Doctorat en biologie
Philosophiae Doctor (Ph.D.)
Québec, Canada
© Caroline Côté, 2014
Résumé général
On observe le déclin progressif de l‘anguille d‘Amérique sur l‘ensemble de son aire de répartition depuis plus de quatre décennies, mais celui-ci semble plus soutenu dans la région du Haut-Saint-Laurent/Lac-Ontario (STLO). Plusieurs mesures de mitigation ont été mises en place, dont le transfert de civelles vers le STLO à partir de régions moins touchées. La translocation fut acceptée sur la base du caractère panmictique de l‘espèce. Cependant, certains aspects écologiques interrégionaux, comme la taille à maturité ou le recrutement, semblaient en contradiction avec l‘hypothèse de panmixie. Ce projet de thèse a pour but d‘aborder cette problématique en testant les hypothèses de panmixie et de plasticité phénotypique chez l‘anguille d‘Amérique. Au chapitre 2, nous décrivons l‘étude de génétique de population de l‘anguille d‘Amérique la plus complète effectuée à ce jour. L‘hypothèse de panmixie devrait désormais être acceptée. Ensuite, pour tester l‘hypothèse de la plasticité phénotypique comme mécanisme de la variance interrégionale, nous avons travaillé avec des civelles provenant Nouvelle Écosse (Mira River : MR) et du Québec (Grande rivière Blanche : GRB), en milieux contrôlé (eau douce ou saumâtre). Le chapitre 3 fait état des premiers sept mois d‘élevage. On y rapporte un taux de croissance supérieur en eau saumâtre pour tous les groupes. Les anguilles de la MR croissent plus rapidement, tous environnements confondus, que celles du GRB. Les MR présentent une réponse plastique marginalement supérieure aux GRB. Au chapitre 4 nous faisons état de la conclusion de l‘expérience de croissance. On y rapporte des sex-ratios identiques pour tous les groupes. Les femelles présentent une distribution bimodale avec deux modes de croissance/maturation : lente (L) ou rapide (R). La MR produit une majorité de R en eau saumâtre et de L en eau douce, alors que GRB produit une majorité de L dans les deux milieux. Le chapitre 5 teste l‘hypothèse nulle sous l‘angle de la transcriptomique. On y fait état de l‘effet de l‘environnement, de l‘origine et de leur interaction sur de nombreux gènes et groupes fonctionnels. À la lumière des résultats de ces quatre chapitres, nous proposons que la plasticité phénotypique n‘exclue pas une base génétique quantitative pour expliquer la variance interrégionale dans les traits phénotypiques et d‘histoire de vie. Finalement, dans ce contexte, nous avançons l‘hypothèse suivant : la différenciation génétique interrégionale serait le produit de la sélection spatiale variable.
Table des matières
Résumé général ... iii
Table des matières ... v
Liste des tableaux ... ix
Liste des figures ... xi
Remerciements ... xv
Avant-propos ... xix
Chapitre1. Introduction générale ... 1
1.1 Trait d‘histoire de vie ... 1
1.2 Structure génétique de population et variabilité adaptative ... 2
1.3 Panmixie, mortalité différentielle et dispersion non-aléatoire ... 4
1.4 Plasticité phénotypique adaptative et variabilité adaptative ... 5
1.5 Source de variabilité adaptative ... 6
1.6 État des connaissances sur l‘anguille d‘Amérique (Anguilla rostrata) ... 6
1.7 Cycle vital de l‘anguille ... 7
1.8 Structure génétique de population du genre Anguilla de l‘Atlantique ... 9
1.9 Précarité de l‘espèce ... 10
1.10 Objectifs ... 11
Résumé chapitre 2 : Fst = 0 ... 13
Chapitre 2. Population genetics of the American eel (Anguilla rostrata): FST=0 and NAO effects on demographic fluctuations of a panmictic species ... 15
2.1 Abstract ... 16
2.2 Introduction ... 16
2.3 Materials and Methods ... 19
2.3.1 Sampling ... 19
2.3.2 Age determination ... 23
2.3.3 DNA extraction, PCR and genotyping ... 25
2.3.4 Population genetics analyses ... 26
2.3.5 Effective number of breeders (Nb) and effective population size (Ne) ... 26
2.3.6 Year class strength index (YCSI) ... 27
2.3.7 NOA association with fluctuations in demographic indices ... 27
2.4 Results ... 28
2.4.1 Microsatellite variability and test of population structure ... 28
2.4.2 Effective number of breeders (Nb) and effective population size (Ne) ... 30
2.4.3 NOA index association with fluctuations in demographic indices ... 30
2.5 Discussion ... 33
2.5.1 Confirmed panmixia in the American eel ... 33
2.5.2 Effective number of breeders, population size, and Ne/N ratio ... 35
2.5.3 North Atlantic Oscillation and variation in number of breeders and recruits. ... 37
2.5.4 Conclusions ... 42
Résumé chapitre 3 : Croissance 1re partie ... 43
Chapitre 3. Differential effects of origin and salinity rearing conditions on growth of glass eels of the American eel Anguilla rostrata: implications for stocking programmes. ... 45
3.2 Introduction ... 46
3.3 Materials and methods ... 49
3.3.1 Glass eels capture and rearing ... 49
3.3.2 Measurements and statistical analysis ... 51
3.4 Results ... 53
3.4.1 Origin effects on growth ... 53
3.4.2 Treatment effects on growth ... 57
3.4.3 Correlation between survival, eel numbers, biomass density and growth ... 57
3.5 Discussion ... 58
3.5.1 Comparisons with previous studies ... 59
3.5.2 Link between early growth and sex differentiation ... 60
3.5.3 Possible explanations for a genetic basis for growth differences ... 60
3.5.4 Relevance for eel conservation and management ... 62
Résumé chapitre 4 : Croissance 2e partie et bimodalité femelle ... 63
Chapitre 4. Growth, female size bimodality, and sex ratio variability in American eels Anguilla rostrata (L.) of different origins reared under controlled conditions: Implications for stocking programs ... 65
4.1 Abstract ... 66
4.2 Introduction ... 66
4.3 Materials and methods ... 67
4.3.1 Capture, rearing, measurements, and sex determination ... 67
4.3.2 Statistical analysis of growth... 70
4.3.3 Statistical analysis of body size distribution ... 70
4.3.4 Asymptotic length estimation... 70
4.3.5 Head morphometric and analyses ... 72
4.4 Results ... 72
4.4.1 Growth ... 72
4.4.2 Determinants of body size distribution ... 76
4.4.3 Head morphology ... 78
4.5 Discussion ... 81
4.5.1 Differential growth trajectories between origins ... 81
4.5.2 Sex ratio and bimodality in female size distribution ... 82
4.5.3 Head morphology is influenced by environment, origin, and sex ... 84
4.5.4 Relevance for management and future avenues of research ... 85
Résumé chapitre 5 : Normes de réaction génomiques ... 87
5.1 Abstract ... 90
5.2 Introduction ... 91
5.3 Materials and methods ... 92
5.3.1 Sampling and rearing conditions ... 92
5.3.2 High quality RNA preparation ... 93
5.3.3 cDNA microarray description, hybridisation and analysis ... 94
5.3.4 Experimental design, data acquisition and analyses ... 94
5.3.5 Gene clustering ... 95
5.3.6 Annotation. ... 96
5.4 Results ... 96
5.4.1 Gene annotations and clustering ... 96
5.4.3 Differentiation between elvers from distinct origins reared in fresh and brackish
water ... 105
5.5 Discussion ... 113
5.5.1 Transcription divergence between at sampling sites ... 113
5.5.2 Transcription divergence after three months in controlled environments ... 115
5.5.3 Conclusions and perspectives ... 120
Chapitre 6. Conclusions générales et perspectives ... 121
6.1 Retour sur la thèse ... 121
6.2 Panmixie et taille effective de population ... 121
6.3 Croissance et maturation (chapitre 3 et 4) ... 125
6.4 Transcriptomique (chapitre 5) ... 126
6.5 Perspectives ... 127
6.6 Conclusion pour la gestion et la conservation ... 129
Bibliographie ... 131
Liste des tableaux
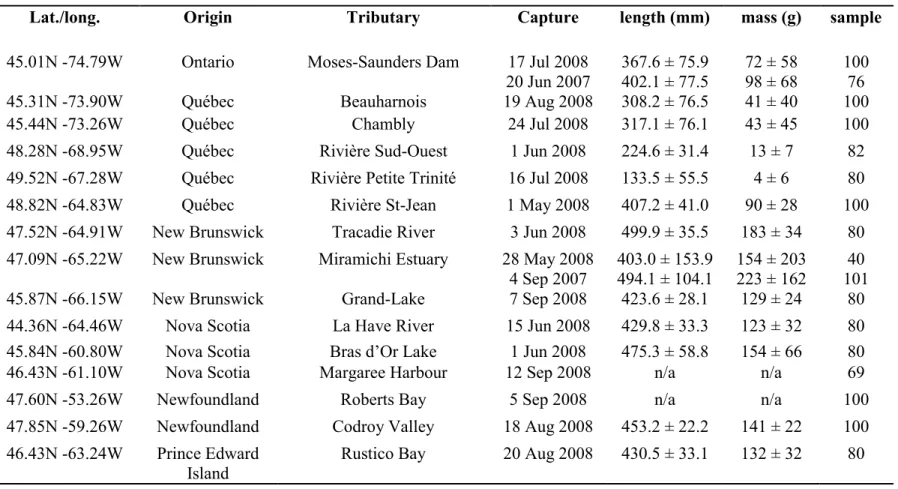
Table 2.1 Description of sampling locations (origin) and dates of capture, mean body
measurements, and sample sizes for glass eels. p.19
Table 2.2 Description of sampling locations and date of capture, mean body measurements,
and sample sizes for yellow eels. p.20
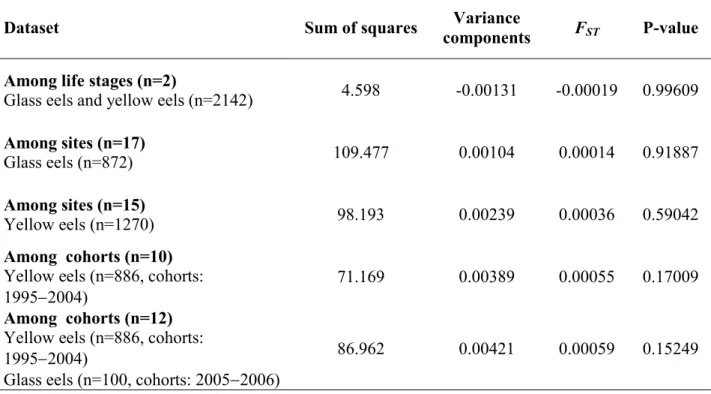
Table 2.3 Summary of five different AMOVAs to test for the amount and significance of
molecular variance imputable to differences between life stages, among sites within either glass eel or yellow eel stages, among annual cohorts within yellow eels, and among cohorts including both yellow and glass eels (n = 100 per year to balance with average sample size for yellow eel cohorts). No attempt was made to estimate genetic variance among sites within cohorts since sample sizes were too small and highly variable. p.27
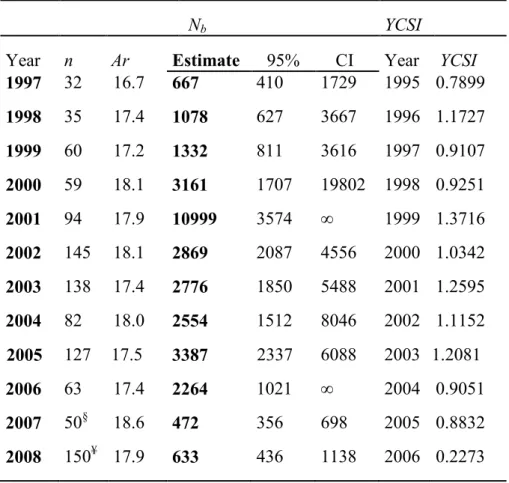
Table 2.4 Summary of sample size (n), allelic richness (Ar), effective number of breeders per
cohort (Nb), confidence interval (95% CI) in yellow eel samples, and the year class strength
index (YCSI) in the Sud-Ouest River, Québec. The column ‗‘Year‘‘ correspond to the year of arrival in the St.Lawrence R. estuary of yellow eels that were aged by otoliths. p.29
Table 2.5 Statistical analysis of the relationships between the North Atlantic Oscillation (NAO)
index and three indices of relative abundance and recruitment for American eel: effective number of breeders (Nb), allelic richness (Ar), and year class strength index (YCSI).
Explanatory variables considered were the NAO for every month and different time lags: current year (0), previous year (1), two years before (2). Means of NAO for the current year, the previous year, and two years before were also considered. Stepwise regressions of the four relative abundance variables on the explanatory variables were fitted in order to select important explanatory variables. The AIC was used as the variable selection criteria. Cross-validation R2 values were computed to determine the prediction strength of the selected model
and semi-partial R2 values were computed to assess the relative importance of each selected variable. p.31
Table 3.1 Mean weight and total length (± standard deviation) at the start of the growth
experiment (T1), after three months rearing and full pigmentation (T2), and after seven months of rearing (T3) for elvers from different origins reared in fresh water (FW, salinity 3) and brackish water (BW, salinity 22). N corresponds to the total number of individuals measured at a given time. p.49
Table 3.2 Results of the slice effect tests for the factorial (nested) ANOVA of factors
explaining weight variation, including main effects and interactions. * indicates significant effects (P<0.05). See Table I for definition of abbreviations. For each slice effect result, F and P values refer to the significance of a specific factor. For instance, the first two results reported indicate that both MR and RB significantly varied with time. Conversely, the next
three lines of results indicate that there is a significant difference between origins at T3 only.
p.51
Table 3.3 Summary of the factorial (nested) ANOVA of factors explaining weight variation,
including main effects and interactions. * indicates significant effects (P<0.05). p.52
Table 4.1 Mean total body weight and total length (± standard deviation) of eels caught as glass
eels at two sampling sites and initially reared in freshwater (FW; salinity=3) and brackish water (BW; salinity=22) for 9 months (aquaria) before being reared in freshwater for another 25 months (tanks). The experiment started in May 2007. N corresponds to the total number of individuals measured at a given time. p.66
Table 4.2 Mean total weight and length (mean ± SD) reached after 34 months of rearing for
eels from the Mira River (MR) and Grande-Rivière-Blanche (GRB) initially reared in either fresh water (FW) or brackish water (BW) for 9 months prior to transfer to freshwater for another 25 months. N refers to the number of males (M) and females (F) (and percent) in each group at the end of the experiment. The asymptotic length for each group (L∞) is estimated from the von Bertalanffy growth function. p.73
Table 4.3 Summary of the best model retained for each trait describing head morphology.
Models were selected by forward procedure based on AICc infinite criterion and adjusted R2
for multiple tests. p.77
Table 4.4 ANOVAS and Type 3 tests estimating the significance of parameters retained in the
best model for each morphometric trait. Only terms with significant effects are presented. p.78
Table 5.1 List of differentiated genes within general function categories and their
representation across different comparisons based on single gene analysis and in each cluster based for the hierarchical clustering analysis. p.97
Table 5.2 Distribution of gene families comprising annotated genes across the seven clusters. p.103
Table 5.3 Numbers of transcripts detected in all comparisons, numbers of differentially
expressed transcripts and their proportions. p.106
Table 5.4 Distribution of super gene families belonging to the different functional categories
Liste des figures
Figure 0.1 Acrylique de civelles groupées (CCote 2013) p.xiv Figure 1.1 Civelle ou glass eels p.9
Figure 1.2 Cycle de vie de l‘anguille d‘Amérique p.10
Figure 1.3. Dispersion et distribution de l‘anguille d‘Amérique p.11 Figure 2.1 Sampling map p.21
Figure 2.2 Otolith age reading, picture from Guy Verreault p.25
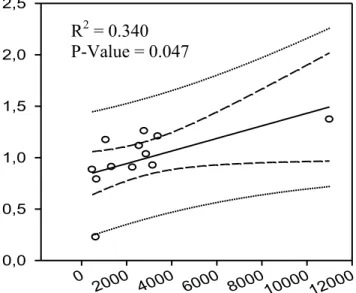
Figure 2.3 A) Top panel: Linear correlation between the effective number of breeders per
cohort (Nb +2 years) and the year class strength index (YCSI) estimated on the Sud-Ouest River, Québec. B) Bottom panel: Linear correlation between Nb 95% inferior intervals (as suggested in Waples 2006) and YCSI estimated in the Sud-Ouest River. The central line represents the model estimate, the inner dashed line and the outer dotted lines delimit the 95% and 99% confidence intervals, respectively. p.34
Figure 2.4 Putative effect of the NAO on eel‘ oceanic stage of life. p.42
Figure 3.1 Sampling sites: On the left: Grande Rivière Blanche, Saint-Ulrik, Québec, and on
the left Mira River, Cap Breton in Nova Scotia. p.52
Figure 3.2 Growth patterns observed between American glass eels and elvers from Mira River,
Cape Breton (MR) and Grande-Rivière-Blanche (RB) in fresh water (FW) and brackish water (BW) between the start of the experiment (T1) and after three months (T2) and after seven months (T3). Data points correspond to means ± SD for all treatments combined for a given origin at a given time (n = 4 for MR and n = 7 for CB). Points are slightly offset to make standard deviation bars easier to visualise. p.59
Figure 4.1 Gain in total length observed for eels from Mira River (MR) and
Grande-Rivière-Blanche (GRB) initially reared in fresh or brackish water aquaria for 9 months prior to being transferred to freshwater tanks for another 25 months. Mean total length of eels transferred from small aquaria to large tanks were measured from month 11 to month 34, that is from March 2008 to the end of the experiment in April 2010. Symbols correspond to the means of all individuals measured for each group. Symbols: diamonds=Mira River in freshwater; squares=Mira River in brackish water; circles=Grande-Rivière-Blanche in freshwater, and triangles=Grande-Rivière-Blanche in brackish water. p.77
Figure 4.2 Density distribution of score values for factor1 (size factor combining the loading
of total weight and length) obtained from the principal component analysis which explained 95% of the phenotypic variation among all eels in both females (left panel) and males (right panel) after 34 months of rearing in common environment. p.81
Figure 4.3 Eye diameter / total length ratios expressed in percent illustrating
origin*environment interactions. Symbols: squares = Mira River and circles = Grande-Rivière-Blanche. p.85
Figure. 5.1 Cluster mean fold change in Log-2 (and 95% confidence limits). From left to right:
(a) between glass eels at the river mouth (T0: MR/GRB), (b) between elvers of both origins after three months rearing in BW and (c) in FW, (d) between environments for elvers from MR, and (e) GRB. GLM procedure was done, followed by K-means analysis where clusters with the same letter are not significantly different. p.111
Figure 5.2 Clusters genomic reaction norm, where MR and GRB absolute fold changes are
illustrated on the same standardised scale. K-mean categories defined in Figure 5.1 are given for each cluster. p.112
Longue vie à l’accès à l’éducation supérieure pour tous et à notre sociale démocratie!
Remerciements
Ce travail n‘aurait pu être réalisable sans le support de mes directeurs de thèse, Martin Castonguay (MPO) et de Louis Bernatchez (U. Laval). Merci d‘avoir eu la générosité de partager votre passion et vos idées. Merci également pour tout le support financier, l‘infrastructure, technique et le réseautage.
‘’Encore plus que du talent, de l’intelligence, même du génie, l’excellence naît de l’effort.’’ Ceci est une citation de coupure de journal qui fut placée sur la porte du frigo, il y a 30 ans, par Louise, ma mère, qui avait de l‘ambition à revendre pour ses trois filles. Depuis, cette coupure a jauni, ses coins racornis, mais elle m‘accompagne toujours et prend actuellement tout son sens alors que je rédige cette thèse. Cette thèse, qui n‘aurait vu le jour si ce n‘était de l‘immense vague (train) de coopération et de réseautage que sont le laboratoire Bernatchez et l‘Institut de Biologie Intégrative et des Systèmes (IBIS). Voici donc une liste de remerciements : d‘abord, je remercierai les personnes qui ont participé à l‘élaboration de chaque chapitre, ensuite, je témoignerai ma reconnaissance à mon entourage.
Chapitre 2, Fst = 0. Je remercie tous les membres du laboratoire Bernatchez pour leur
assistance tant au niveau intellectuel, technique ou sur le terrain, tout particulièrement B. Bougas, N. Brodeur, G. Côté, M. Gauthier-Ouellet, E. Normandeau, L. Papillon, and J. Roy. Je suis également redevable à D. Talbot pour son assistance dans le processus d‘analyses statistiques. Merci aussi aux personnes suivantes pour nous avoir fourni les échantillons nécessaires au moment opportun: D. Cairns, G. Veinott (DFO), M. Campbell (SSTC), Y. & G. Carey (Atlantic Elver Inc.), R. Verdon (Hydro Québec), A. Mathers (OMNR), R. Threader (OPG), G. Wippelhauser (MDNR), C. McBane (NHFGD), B. C. Chase (MDMF), T. Wildman (PO), R. Horwitz (ANSP), H. Corbett (DFW), J. Clark (DDFW), W. Lowery (VIMS), K. West (DMF), B. Post (DNR), J. Page (DNR), et B. Johnson (MyFWC). Merci aussi à tous ceux qui m‘auront si généreusement offert leur temps/expertise dans la préparation et l‘analyse de lecture d‘âge sur les otolithes d‘anguilles : R. Tardif (MRNF), V. Tremblay (AECOM), J. Casselman (Queen‘s University) et D. Cairns (MPO). Nous sommes aussi redevables à T. D. Als pour nous avoir dirigés dans l‘optimisation de ses protocoles d‘analyses de microsatellite ainsi qu‘à G. Maes pour ses commentaires. Merci à L. Devine pour son aide sur le terrain et ses commentaires/révisions. Ses rétroactions ont grandement contribué à amélioration de la qualité du manuscrit préliminaire. Nous remercions aussi les éditeurs S. Palumbi, G. De Leo et les arbitres anonymes pour leurs commentaires pertinents et suggestions éclairantes.
Chapitre 3 et 4, Croissance et bimodalité. J‘adresse mes sincères remerciements à E.
Normandeau, H. Crépeau et D. Talbot pour leur assistance statistique. Le travail de terrain et celui de laboratoire n‘auraient pas pu être réalisés sans l‘aide de L. Papillon, L. Devine, N. Brodeur, S. Renault, I. Thibault et H. Tamdrari. Nous remercions également Y. & G. Carey de l‘Atlantic Elver Fishery pour nous avoir gratuitement fourni des épuisettes à civelles, M. Campbell et Mitch de la South Shore Trading Co. pour les échantillons de la Nouvelle Écosse, ainsi que leurs conseils pour le départ de nos élevages. Également, le maintien en bassin de nos anguilles au LARSA n‘aurait pas été possible sans l‘ouverture d‘esprit, l‘assistance et l‘assiduité de S. Higgins et J.C. Therrien. Nous remercions également B. Knights, (éditeur invité), ainsi que deux arbitres anonymes pour leurs commentaires constructifs au chapitre 3.
Chapitre 5, Normes de réaction génomiques. En plus de nos collaborateurs nommés ci-haut
pour les chapitres 3 et 4, nous sommes redevables à G. Verreault (MRNF) pour l‘ensemble de son œuvre sur le terrain, en laboratoire ainsi que ses commentaires constructifs. Nous remercions également E. Normandeau et B. Bougas pour leur aide en laboratoire et leurs commentaires sur le matériel, méthodes et statistiques. Enfin, merci à S. Kalujnaia et à G. Cramb pour m‘avoir gracieusement fourni des puces à ADNc.
Autres contributions scientifiques. Merci à Pierre-Alexandre Gagnaire et Simon Laflamme
pour avoir contribué de façon significative à l‘essor et le rayonnement de ce projet de recherche par leurs idées, leurs travaux et la publication de deux articles scientifiques en 2012 (Gagnaire
le flambeau pour la suite. Côté historique professionnel. Merci à Daniel Kneeshaw (UQAM), qui m‘a donné mon premier boulot comme biologiste en Abitibi. Ensuite, il est important, pour moi, de remercier Yves Prairie et Paul del Giorgio : ceux-ci m‘ont permis de gagner assez d‘expérience et de confiance pour plonger dans l‘aventure de la maîtrise. Merci à John MacKay de m‘avoir donné cette chance inestimable de faire partie de son excellente équipe (Arborea) à la maîtrise. L‘anguille m‘aura permis de travailler avec Guy Verreault (DEX-Rivière-du-Loup) et son équipe de coureurs des grèves. Je dois aussi souligner la contribution intellectuelle et professionnelle des membres de la CESWOG : Valérie Tremblay, David Cairns, Tom Pratt, Rob MacGregor, David Stanley, Yvonne & Genna Carey, Mike Cambell, Paul T. Jacobson, Marie Clement, Jean-Marc Nicolas, Rod Bradford, Wendy Epworth, Yves Mailhot, Pierre Dumont, Peter Hodson, Geoff Veinott, Alastair Mathers et Mélanie Dionne (pour ne nommer que ceux-ci). Je remercie mon comité d'encadrement et jury d‘examen doctoral qui étaient composés de Martin Castonguay, Nicolas Derôme, Julian Dodson, Connie Lovejoy et Alan Anderson. Merci, enfin, aux membres du département de biologie et de Québec Océan pour leur soutien moral ou administratif : Nadia Aubin-Horth, Christian Landry, Louise Lapointe, Julie Turgeon, Jocelyne Roy, Martine Boucher, Caroline Vallée, Lynn Bélanger et Brigitte Robineau. Côté personnel. Merci à mon père Gilles, à Mimilia, Geneviève, Catherine et Claudio pour leur indéfectible présence et soutien. Merci à Annie, ma meilleure amie, ainsi que Jeanne et Alex. Votre amitié m‘aura portée depuis les rayons du Eaton jusqu‘ici, et ce, pour longtemps encore. Julie F, Ève, Martin, Véro, Amélie et Fred : depuis nos années à l‘UQAM, vous en avez fait du chemin et m‘avez inspirée. Et merci à toute ma belle-famille, tout particulièrement à Andrée-Maude Jobin pour avoir révisé certains morceaux de ma thèse, et bien sûr à Madeleine pour la sollicitude soutenue.
Avant-propos
Soutiens financiers. Ce projet a été financé par le SARCEP, un programme sur les espèces en
péril du département de Pêches et Océans Canada (MC), par une subvention de la «Great Lakes Fishery Commission», ainsi que par la Chaire de recherche du Canada en génomique et conservation des ressources aquatiques et le programme de subvention à la Découverte du CRSNG (LB). Finalement, ce projet de recherche est aussi une contribution au programme de recherche de Québec Océan (Groupe interinstitutionnel de recherches océanographiques du Québec). Contributions des co-auteurs des chapitres publiés 2 et 3. CLC est étudiante au doctorat sous la co-supervision de LB et de MC. Son principal intérêt est d‘élucider les causes de la variabilité génétique et phénotypique chez l‘anguille d‘Amérique et leurs conséquences sur la gestion et la conservation de cette espèce. P-AG est un chercheur post-doctorant, il s‘intéresse à la génomique de population et à la spéciation des organismes marins, entre autres l‘anguille. VB est un étudiant au doctorat qui s‘intéresse à la base génomique de la divergence adaptative et à la mortalité en océan du saumon Atlantique (Salmo salar). Aussi sous la supervision de LB, GV est un écologiste des pêcheries travaillant sur la distribution, l‘abondance et la conservation des espèces halieutiques de l‘estuaire du Saint-Laurent, au Lac Ontario. MC est un écologiste des pêches travaillant sur l‘abondance, la distribution, la gestion et conservation des espèces marines et diadromes. Les recherches de LB portent sur la compréhension des patrons et les processus moléculaires et physiologiques évolutifs ainsi que leurs implications en gestion et conservation.
Chapitre1. Introduction générale
1.1 Trait d’histoire de vie
Au cours de leur existence, les organismes marins font face à une vaste gamme de facteurs intrinsèques et extrinsèques qui modèlent la dynamique et la structure génétique de leurs populations (Waples, 1998). D‘une part, ces organismes présentent souvent un stade larvaire planctonique, durant lequel les larves se déplacent passivement ou activement selon les courants au sein d‘environnements vastes et variables comportant peu de barrières physiques à la dispersion (Holt, Gaines, 1992; Lenormand, 2002). D‘autre part, ces espèces peuvent démontrer un comportement phylopatrique, c'est-à-dire que les individus matures retournent se reproduire là où ils ont vu le jour. L‘histoire de vie des espèces marines rappelle alors l‘un des paradigmes fondamentaux en écologie évolutive, celui de l‘interaction entre la sélection naturelle et la capacité de dispersion d‘une espèce à l‘intérieur d‘un habitat vaste et hétérogène (Svensson, Sinervo, 2004). Ce paradigme inclut, entre autres, deux champs de recherche analogues : l‘analyse du ‗’paysage génétique‘‘ (landscape genetics) et la ‗‘phénogéographie‘‘. Ceux-ci intègrent respectivement la variance génétique et phénotypique à la répartition géographique d‘une espèce (Conover et al., 2006; Holderegger et al., 2006; Holderegger, Wagner, 2008). Et un jour, peut-être, ‗‘l’épigéographie‘‘ ou ‗‘landscape épigénétique’’, domaine de recherche caractérisant la distribution des patrons épigénétiques d‘une espèce, pourra être reconnu comme un paramètre descriptif important de la variation populationnelle (Zhang, 2008a; Zhang, 2008b).
De ce paradigme, trois principaux scénarios permettent d‘expliquer la capacité d‘une espèce pour occuper et utiliser un vaste habitat hétérogène : (1) la mise en place et le maintien d‘une
structure génétique de populations, (2) le maintien d‘une seule population panmictique et (3)
l‘acquisition de plasticité phénotypique adaptative pour un ou plusieurs traits liés au développement ou à l‘histoire de vie (Pelletier et al., 2007; Via, Conner, 1995; Via et al., 1995).
1.2 Structure génétique de population et variabilité adaptative
Commençons par définir quelques de termes et concepts essentiels, auxquels nous ferons référence tout au long de cette thèse : D‘abord, la génétique est définie par l‘étude des différences entre individus (Sturtevant, Beadle, 1923). Si tous les individus d‘une espèce étaient identiques, il serait toujours possible d‘étudier leur morphologie, physiologie ou leur comportement, etc., cependant les généticiens seraient tous sans travail (Allendorf et al., 2010). Ensuite, l‘héritabilité (génétique quantitative) se base sur la comparaison des similitudes entre les parents et leur progéniture en relation avec les similitudes entre individus non apparentés à l‘intérieur d‘une population ou d‘une espèce (Mendel 1865). Et enfin, l‘étude de la génétique de populations consiste en l‘analyse de la distribution de fréquences d‘allèles, influencée par les quatre forces évolutives : la sélection naturelle, la dérive génétique, la mutation et la migration (Fisher, Wright et Haldane, 1918-32). Cette dernière analyse permet la caractérisation de la structure génétique de populations d‘une espèce sur son aire de répartition. En d‘autres termes, il s‘agit de quantifier statistiquement l‘ampleur de la divergence entre les populations d‘une même espèce sur une partie ou l‘ensemble de l‘aire de répartition. En combinant les données écologiques et la structure génétique de populations, il est possible de décrire certains phénomènes tels que l‘adaptation et la spéciation. Enfin, l‘approche multidisciplinaire (biologique moléculaire, développementale, physiologie, génétique de population) permet aussi de résoudre et de comprendre les processus menant du génotype au phénotype dans le contexte de populations naturelles (Lewontin, 2008).La structuration génétique découle souvent de l‘occupation d‘un habitat hétérogène : une population se forme à partir d‘un groupe (pool) ancestral de génotypes représentant un échantillon de l‘ensemble des génotypes disponibles. Sous des pressions sélectives locales, les individus présentant un succès reproducteur supérieur, donc une plus grande valeur sélective (fitness), voient la proportion de leurs génotypes augmenter relativement à l‘ensemble des génotypes de l‘espèce au fil des générations. La formation de populations génétiquement distinctes s‘effectue sous l‘influence de la sélection naturelle locale, de la dérive génétique, de l‘accumulation de mutations et est maintenue par le faible succès des migrants, dont la valeur sélective est plus faible que celle des résidents (Bolnick, Nosil, 2007; Nosil et al., 2005). Les populations tendent ainsi à se spécialiser et à développer des caractéristiques phénotypiques adaptées à un habitat en particulier. Cependant, si l‘environnement change, une population
localement adaptée risque de perdre cet avantage si elle ne possède pas la diversité génétique ou n‘a pas suffisamment de temps pour rétablir l‘équilibre adaptatif.
Le saumon atlantique anadrome (Salmo salar L.) représente un exemple typique d‘espèces structurées en plusieurs populations localement adaptées à différents environnements. Ainsi, cette espèce est caractérisée par une structure génétique de populations hiérarchique : où il est possible de discriminer de grands groupes régionaux et des populations distinctes à l‘intérieur de ces régions. La structure fine est associée à certains cours d‘eau et permet dans certains cas de distinguer des populations provenant de tributaires différents à l‘intérieur d‘une même rivière. On associe cette structuration à l‘isolement reproducteur en raison de la distance (isolation by distance : IBD), à la phylopatrie (fidélité au lieu de reproduction) et à plusieurs facteurs sélectifs telles la température, la diversité de pathogènes ou la pollution (Beacham et
al., 2006; Beacham et al., 2005; Dionne et al., 2008; Garcia de Leaniz et al., 2007).
La morue (Gadus morhua) représente, quant à elle, une espèce marine océanique structurée génétiquement et démontrant apparemment des évidences d‘adaptation locale. D‘une part, la caractérisation génétique à l‘aide de marqueurs neutres a révélé une structuration génétique caractérisée par le phénomène d‘IBD, soit un accroissement de la différenciation génétique en fonction de la distance géographique entre les populations (Jorde et al., 2007). D‘autre part, certaines populations de morues, présentant une différentiation très faible en ce qui concerne la fréquence des marqueurs neutres, sont caractérisées par des différences (nettes ou cryptiques) sur le plan de traits phénotypiques potentiellement adaptatifs. Ainsi, le suivi de traits, tels que la survie et la croissance de jeunes morues en milieu contrôlé, a révélé qu‘il existait des différences génétiques quantitatives entre différentes populations pour ces traits et a permis de définir de nouvelles populations. Cette dichotomie apparente entre les différentes méthodes d‘évaluation des différences inter-populations s‘explique par le fait que la sélection agit plus rapidement sur les traits adaptatifs (base mono ou polygénique) que la dérive génétique ne le fait sur les marqueurs neutres microsatellites. De plus, en raison du niveau relativement élevé de migrants maintenu à chaque génération, la mise en évidence d‘une structure génétique de telles populations marines à l‘aide de marqueurs microsatellites est souvent plus difficile sur une échelle spatiale fine (Hutchings et al., 2007; Marcil et al., 2006a; Marcil et al., 2006b).
1.3 Panmixie, mortalité différentielle et dispersion non-aléatoire
La panmixie consiste en un régime de reproduction où tous les génotypes composant une espèce se mélangent aléatoirement. Ainsi, à chaque génération, des individus provenant de l‘ensemble de l‘aire de répartition de l‘espèce se retrouvent dans une aire de reproduction unique et l‘agencement des gamètes s‘effectue aléatoirement. D‘un point de vue génétique de populations, la panmixie se traduit en une absence de différence de fréquences alléliques sur l‘ensemble de l‘aire de répartition d‘une espèce (hypothèse nulle de Hardy-Weinberg). Dans un tel contexte, l‘adaptation locale est impossible puisque les complexes d‘allèles potentiellement coadaptées disparaissent à chaque génération. Donc, une espèce phylopatrique panmictique, largement distribuée, avec un niveau de diversité génétique élevé permettant de maintenir une variabilité de génotypes, peut survivre dans une variété d‘habitats contrastés. Ainsi, sur l‘ensemble des génotypes retrouvés au sein d‘une population panmictique, ceux qui présenteront une valeur sélective plus élevée pour un habitat particulier pourront y croître et s‘y développer. Ceci implique, par contre, que beaucoup n‘accèderont pas au stade de développement suivant, à cause des pressions de sélection du milieu résultant en une survie différentielle. Passé le stade juvénile, auquel est associée une forte mortalité, la probabilité de survie devient alors plus forte puisque les individus survivants devraient posséder les caractéristiques génétiques, en principe, plus appropriées pour survivre dans l‘environnement colonisé (Pearl, 1928). Cette situation a notamment été mise en évidence grâce à l‘analyse de marqueurs de type isozymes chez des invertébrés marins tels que la moule bleue, MytilusEdulis (Koehn et al., 1980; Koehn et al., 1976) et la balane commune, Semibalanus balanoides
(Veliz et al., 2004; Veliz et al., 2006a; Veliz et al., 2006b). Chez ces deux espèces, la mortalité différentielle conduit à la mise en place d‘une ‗‘structure génétique apparente‘‘ des marqueurs génétiques soumis à la pression de sélection du milieu, soit de façon directe ou indirecte (hitchhiking).
Outre l‘effet de la survie différentielle entre génotypes distincts, il est théoriquement possible qu‘une dispersion non aléatoire spatio-temporelle ait lieu à la suite de l‘établissement des larves, pour les espèces non sessiles (Collins, Simberloff, 2007). La répartition des génotypes retrouvés au sein d‘une seule et même population peut alors résulter encore en une structuration génétique apparente, structure qui pourrait être mise en évidence soit par la caractérisation de régions du génome associées à une telle dispersion non aléatoire ou, encore, par l‘étude de la
variation phénotypique en environnement contrôlé. À ma connaissance, ce phénomène n‘a cependant pas été mis clairement en évidence chez aucune espèce à ce jour. Cependant, les travaux d‘Edeline et coll. (2004, 2006) portant sur l‘anguille européenne (Anguilla anguilla) ont mis en lumière une propension à la dispersion non aléatoire associée à l‘état physiologique des civelles. Par contre, ces auteurs n‘ont pas vérifié si les différences physiologiques observées entre individus s‘expliquaient en partie par des différences génétiques.
1.4 Plasticité phénotypique adaptative et variabilité adaptative
La plasticité phénotypique consiste en la capacité d‘un même génotype d‘exprimer plusieurs phénotypes en fonction des conditions environnementales auxquelles il est soumis (Bradshaw, 1973; Scheiner, 1993). Certains considèrent que la plasticité phénotypique peut jouer un rôle adaptatif en réponse à un environnement hétérogène (Via et al., 1995; Via, Lande, 1985). En effet, certaines expériences en laboratoire démontrent clairement que la plasticité phénotypique peut avoir une base génétique (Schmitt et al., 2003; Stinchcombe et al., 2004; Stinchcombe etal., 2002), qu‘elle peut aussi être soumise à la sélection naturelle (Scheiner, 1993) et s‘illustrer
par le biais de normes de réaction (Schlichting, Pigliucci, 1995; Schlichting, Pigliucci, 1998). On connait peu de choses à propos de ce phénomène en milieu naturel. Néanmoins, depuis peu, l‘utilisation de marqueurs moléculaires pour assister à la reconstruction de pedigree jumelée à la génétique quantitative permet d‘accéder à de nouvelles méthodes descriptives de l‘évolution de traits quantitatifs en milieu naturel (Kruuk, 2004). Une telle démarche peut également s‘appliquer à l‘étude de la plasticité phénotypique en utilisant des mesures répétées sur des individus faisant l‘expérience de conditions environnementales variées (Nussey et al., 2007). Ainsi, des bases de données ayant cumulé les pedigrees de mammifères et d‘oiseaux sur plusieurs générations ont récemment révélé de nouvelles informations sur la plasticité phénotypique. Entre autres, la variabilité interindividuelle serait la réponse plastique de certains traits aux fluctuations environnementales (Nussey et al., 2005a; Nussey et al., 2005c). De plus, cette plasticité individuelle peut être à la fois héritable (Nussey et al., 2005b) et sous sélection directionnelle (Brommer et al., 2005; Brommer et al., 2008). Le caractère adaptatif de la plasticité phénotypique au sein de populations naturelles n‘a, pour l‘instant, été suggéré que pour un nombre limité de traits phénotypiques ou d‘histoire de vie (Charmantier et al., 2008; Nussey et al., 2005a; Nussey et al., 2005b; Nussey et al., 2005c; Pelletier et al., 2007). Chez les poissons, les cas les plus probables de plasticité phénotypique adaptative ont été principalement
suggérés chez les salmonidés et plus particulièrement chez le saumon atlantique (Aubin-Horth
et al., 2006; Garant et al., 2001; Garcia de Leaniz et al., 2007; Paez et al., 2008). Bien qu‘étant
difficile à mettre en évidence, la plasticité phénotypique adaptative pourrait néanmoins représenter un mécanisme évolutif important par lequel une espèce panmictique pourrait coloniser et se maintenir dans une vaste aire de distribution hautement hétérogène.
1.5 Source de variabilité adaptative
On reconnaît généralement trois sources de la variation phénotypique adaptative, incluant celle associée à la plasticité phénotypique : (1) l‘héritabilité variable de traits phénotypiques ayant une
valeur adaptative, (2) la variabilité moléculaire de gènes sous sélection et (3) la fluctuation de
l‘expression des gènes selon l‘environnement produisant des phénotypes à plasticité variable (Garcia de Leaniz et al., 2007). Vue d‘un autre angle, la variation phénotypique adaptative pourrait s‘expliquer par l‘hérédité dite ‗‘multidimensionnelle‘‘, définie par Jablonka et Lamb (2005), et impliquant la transmission de l‘ADN, le contrôle épigénétique, l‘information non génétique contenue dans le cytoplasme de l‘ovule ou les ARNs non-codant des spermatozoïdes et la transmission comportementale ou ‗‘culturelle‘‘ (Jablonka, Lamb, 2005). Certains de ces mécanismes de contrôle de la variation phénotypique demeurent encore à peu près inexplorés chez les populations naturelles. Ceci est particulièrement le cas pour le contrôle épigénétique.
1.6 État des connaissances sur l’anguille d’Amérique (Anguilla
rostrata)
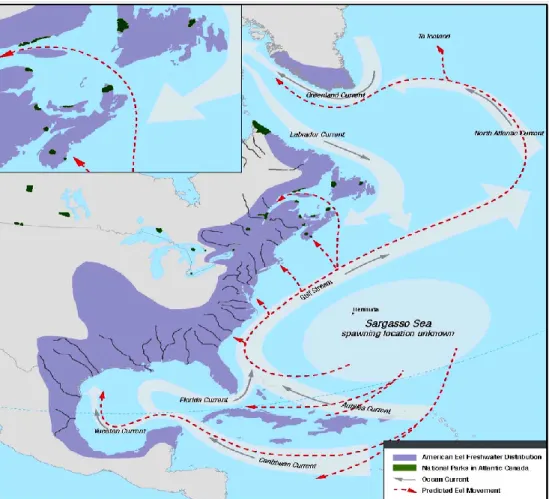
L‘anguille d‘Amérique fait partie du genre Anguilla qui regroupe toutes les « anguilles d‘eau douce », lesquelles posséderaient un ancêtre commun originaire de l‘océan Pacifique ouest. Le genre Anguilla comprend 18 autres espèces et sous-espèces réparties à travers le globe à l‘exception de l‘Atlantique sud. L‘habitat que l‘espèce occupe est vaste et très hétérogène dans le temps et l‘espace. Ainsi, l‘aire de répartition en eau douce de l‘anguille d‘Amérique s‘étend sur plus de 50 degrés de latitude, soit du 5o au 63o parallèle de la côte Nord-Ouest de l‘Atlantique au Venezuela en passant par le Groenland et l‘Islande (Helfman et al., 1987; Tesch, 1977). De même, durant sa phase migratoire océanique, l‘anguille d‘Amérique peut s‘accommoder d‘un large gradient de pression, de salinité et de température. Enfin, ayant longtemps considéré que la phase de vie en eau douce était obligatoire, il est maintenant bien
documenté qu‘une proportion importante de l‘espèce complète son cycle de vie entièrement en eau douce ou encore effectue des mouvements périodiques entre l‘eau douce et saumâtre (Jessop et al., 2008; Thibault et al., 2007a; Thibault et al., 2007b). C‘est donc dire que l‘espèce peut s‘accommoder à une vaste gamme de conditions thermiques et écologiques bien distinctes nonobstant son stade de développement.
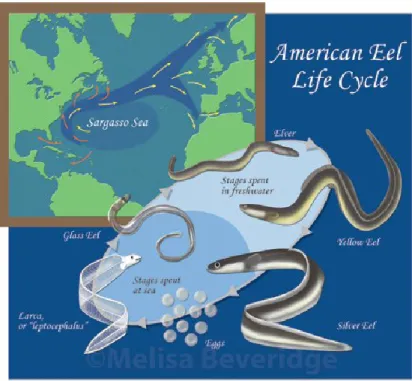
1.7 Cycle vital de l’anguille
Les anguilles d‘Amérique adultes migrent pour aller se reproduire dans la mer des Sargasses. Les larves, dites ‗‘leptocéphales‘‘, se dispersent de manière passive à l‘aide des courants marins vers les eaux continentales (Tesch, 1977). Elles effectuent alors une première métamorphose, de leptocéphale à civelle transparente (glass eel), puis la pigmentation apparait au moment d‘un arrêt de croissance momentanément et temporaire. Ce stade représenterait une seconde métamorphose mais, il n‘existe pas de consensus sur la nature exacte des changements physiologiques ayant lieu à ce moment. Le terme anglais « elver » désigne le stade entre la « glass eel » et « l‘anguille jaune ». Le stade de vie de l‘anguille jaune est le plus variable en ce qui concerne ses traits d‘histoire de vie. Ainsi, l‘anguille jaune se développe en eau douce ou estuarienne, de façon exclusive ou adopter un comportement alternatif en migrant de façons successives entre les deux environnements plus ou moins fréquemment au cours de son existence (Daverat, Tomas, 2006; Jessop, 2002; Lamson et al., 2006; Thibault et al., 2007a; Thibault et al., 2007b; Tsukamoto, Aoyama, 1998). L‘anguille jaune présente une coloration dorée qu‘elle perd au moment de l‘argenture, signe précurseur de la migration et de la pleine maturation sexuelle. Le moment et les facteurs déterminant l‘atteinte du stade argenté varient et les observations effectuées en aquacultures ne permettent pas de déterminer ce qui se passe réellement en nature (Jessop et al., 2004). Une autre caractéristique particulière chez l‘anguille d‘Amérique consiste en une variabilité très importante dans les proportions de mâles et de femelles selon les localités ou les habitats (Jessop et al., 2004). Il existe également une variabilité géographique très importante en ce qui a trait à la croissance et à la longueur maximale atteinte (Jessop, 1998; Tremblay, 2009).
Ainsi, c‘est dans la partie amont du bassin du fleuve Saint-Laurent où sont retrouvés les plus gros spécimens de l‘espèce. Cette région est de plus caractérisée par un sex-ratio fortement biaisé (99.9%) en faveur des femelles (Castonguay et al., 1994a). Selon Beullens et al. (1997) l‘anguille pourrait présenter trois options sexuelles : les grandes femelles à croissance lente (minoritaire et à fixation génétique?) et les indéterminés femelles ou mâles (détermination environnementale). Le sujet est loin de faire l‘unanimité et l‘on rapporte tout et son contraire (Davey, Jellyman, 2005; Krueger, Oliveira, 1999; Pratt, Threader, 2011; Verreault et al., 2010; Vladykov, Liew, 1982).
Figure 1.1 Civelle ou glass eels
Figure 1.2 Cycle de vie de l‘anguille d‘Amérique
Figure 1.3. Dispersion et distribution de l‘anguille d‘Amérique.
1.8 Structure génétique de population du genre Anguilla de
l’Atlantique
La majorité des études génétiques ont porté sur l‘anguille européenne (Anguilla anguilla). Certaines d‘entre elles (Daemen et al., 2001; Maes, Volckaert, 2002; Wirth, Bernatchez, 2001) ont démontré l‘existence d‘une mosaïque génétique indiquant qu‘il existe chez cette espèce une structure de population significative bien que, peu marquée. Dans l‘étude la plus récente et la plus complète à ce jour sur les anguilles européennes, Dannewitz et al. (2005) rapportent avoir observé une variation temporelle dans la composition génétique qui soit aussi importante que la structure génétique spatiale des populations. Cette structure a cependant été démentie de nouveau à la suite d‘une étude portant sur les leptocéphales capturées sur le lieu de reproduction dans la mer des Sargasses (Als et al., 2011). Ce résultat démontre l‘importance d‘établir le patron de structure génétique de plusieurs cohortes différentes afin d‘en arriver à des conclusions fiables dans les études génétiques portant sur les anguilles. Globalement, les données montrent que la population d‘anguilles européennes n‘est pas structurée au plan
géographique mais, que les fréquences alléliques fluctuent dans le temps (entre les vagues et les cohortes).
Beaucoup moins d‘efforts ont été consentis à l‘étude génétique de population de l‘anguille d‘Amérique (A. rostrata). Néanmoins, certains de ses résultats tranchent nettement avec ceux portant sur l‘anguille européenne. En effet, l‘hypothèse nulle de la panmixie n‘a pu être formellement rejetée et, aucun patron d‘isolement par la distance (IBD) n‘a été mis en évidence (Avise et al., 1986; Koehn, Williams, 1978; Wirth, Bernatchez, 2003). Toutefois, seulement un petit nombre de sites ont été échantillonnés dans les études précédentes et l‘aspect temporel de la structure génétique n‘a jamais été considéré. De plus, le pouvoir de résolution pourrait avoir été affecté par le nombre relativement faible de marqueurs microsatellites utilisés (moins de huit). Enfin, aucune étude génétique à ce jour n‘a porté sur les individus du fleuve Saint-Laurent, Lac Ontario et ses tributaires. En somme, aucune étude réalisée à ce jour n‘a permis d‘infirmer ou de confirmer de manière rigoureuse l‘hypothèse nulle de panmixie pour l‘aguille d‘Amérique.
1.9 Précarité de l’espèce
Outre l‘intérêt purement fondamental, le besoin d‘acquisition de nouvelles connaissances sur la biologie de l‘anguille se justifie également par l‘état démographique précaire de l‘espèce. Depuis 30 ans, les populations d‘anguilles ont décliné à travers le monde, et ce, de façon alarmante. La situation au Canada est particulièrement dramatique dans le haut Saint-Laurent au Québec et dans le Lac Ontario (STLO). La plus importante pêche à l‘anguille canadienne située dans le fleuve Saint-Laurent a diminué de 300 tonnes métriques en 1990 à moins de 72 tonnes métriques en 2000 (Verreault, Dumont, 2003). Le recrutement des civelles et anguillettes remontant vers le haut Saint-Laurent a aussi subi une baisse majeure alors qu‘en 1999, on observait un recrutement 1000 fois inférieur à celui observé quinze ans plus tôt (Dutil
et al., 2009). La baisse en abondance a également été rapportée au stade leptocéphale sur le site
de reproduction de la mer des Sargasses (Als et al., 2011). Les causes probables du déclin de l‘espèce sont apparemment multiples. Ceux-ci peuvent se classer en trois grands groupes, incluant les (1) entraves à la migration (barrages, turbinage, pêche), (2) la perte d‘habitat
climatiques sur l‘écosystème fragile de la mer des Sargasses et sur les courants océaniques (Bonhommeau et al., 2008a; Bonhommeau et al., 2008b; Castonguay et al., 1994a; Castonguay
et al., 1994b; Haro et al., 2000; Palstra et al., 2007; Richkus, Whalen, 2000; van Ginneken,
Maes, 2005).
1.10 Objectifs
L‘objectif général de ma thèse de doctorat est de documenter en quelle proportion la génétique et/ou la plasticité permettent à cette espèce d‘occuper un habitat vaste et hétérogène dans le temps et l‘espace. Dans le cadre d‘une approche multidisciplinaire, le premier objectif était d‘effectuer une analyse fine de la structure de population à l‘aide de marqueurs neutres sur l‘ensemble de l‘aire de répartition de l‘espèce. Les objectifs suivants sont de caractériser en environnement contrôlé la croissance, le sex-ratio et le transcriptome de civelles provenant de deux régions aux habitats et histoires de vie contrastés.
Résumé chapitre 2 : F
st= 0
Cette étude de génétique de population de l‘anguille d‘Amérique (Anguilla rostrata) vise trois principaux objectifs. D‘abord, nous présentons (i) l‘analyse de structure génétique neutre de population le plus complète à ce jour en revisitant l‘hypothèse nulle de la panmixie. Ensuite, nous utilisons les données de génotypage afin de produire (ii) le premier estimé de taille de population effective (Ne) et de (iii) documenter les variations temporelles de la taille effective
des reproducteurs (Nb) et des recrues (Ar). Dans ce chapitre, toutes les mesures de
différentiation rapportées sont essentiellement de zéro et aucune évidence de différentiation spatiale ou temporelle n‘a été détectée. L‘hypothèse de panmixie est donc définitivement acceptée. Les estimés de Nb varient par un facteur de 23 entre les 12 cohortes retenues (de 473 à
10 999). Le Ne a été estimé à 10 532 (95% CI: 9 312 - 11 752). Notre étude a aussi permis de
démontrer potentiel d‘indices démographiques génétiques comme substituts aux mesures d‘abondance classique de reproducteurs ou de recrutement. Les indices Nb et Ar sont
positivement corrélés à l‘indice climatique d‘Oscillation de l‘Atlantique Nord lorsque celui-ci est haut (positif). Ainsi, un suivi génétique sur le long terme de l‘anguille d‘Amérique pourrait représenter un complément avantageux afin de suivre les fluctuations démographiques et de mieux en comprendre les multiples causes.
Chapitre 2. Population genetics of the American eel (Anguilla
rostrata): F
ST=0 and NAO effects on demographic fluctuations of a
panmictic species
Publié sous:
Caroline Côté1, 2, Pierre-Alexandre Gagnaire1, Vincent Bourret1, Guy Verreault3,*, Martin
Castonguay4 and Louis Bernatchez1 (2013) Molecular Ecology 22, 1763-1776, doi:
10.1111/mec.12142
1. Département de Biologie, IBIS (Institut de Biologie Intégrative et des Systèmes), Université Laval, Québec, Qc, G1V 0A6, Canada
2. Corresponding author: caroline.cote.14@ulaval.ca, Département de Biologie, IBIS (Institut de Biologie Intégrative et des Systèmes), Université Laval, Québec, Qc, G1V 0A6, Canada. Phone: 1-418-656-3402 Fax: 1-418-656-7176
3. Direction de l'Expertise du Bas-Saint-Laurent, Ministère des Ressources Naturelles et de la Faune 186, rue Fraser, Rivière-du-Loup, Qc, G5R 1C8, Canada
4. Institut Maurice-Lamontagne, Ministère des Pêches et des Océans (DFO/MPO), 850 Route de la Mer, Mont-Joli, Qc, G5H 3ZH, Canada
2.1 Abstract
We performed population genetic analyses on the American eel (Anguilla rostrata) with three main objectives. First, we conducted the most comprehensive analysis of neutral genetic population structure to date in order to revisit the null hypothesis of panmixia in this species. Second, we used this data to provide the first estimates of contemporary effective population size (Ne) and to document temporal variation in effective number of breeders (Nb) in American
eel. Third, we tested for statistical associations between temporal variation in the North Atlantic Oscillation (NAO) index, the effective number of breeders and two indices of recruit abundance. A total of 2142 eels from 32 sampling locations were genotyped with 18 microsatellite loci. All measures of differentiation were essentially zero, and no evidence for significant spatial or temporal genetic differentiation was found. The panmixia hypothesis should thus be accepted for this species. Nb estimates varied by a factor of 23 among 12
cohorts, from 473 to 10 999. The effective population size Ne was estimated at 10 532 (95% CI:
9 312 - 11 752). This study also showed that genetically based demographic indices, namely Nb
and allelic richness (Ar), can be used as surrogates for the abundance of breeders and recruits, which were both shown to be positively influenced by variation during high (positive) NAO phases. Thus, long-term genetic monitoring of American glass eels at several sites along the North American Atlantic coast would represent a powerful and efficient complement to census monitoring to track demographic fluctuations and better understand their causes.
2.2 Introduction
The extent of population structure within a given species is ultimately determined by the interactions between mutation, migration, genetic drift, and selection (Wright, 1931). At the proximal level, the balance reached between these forces is determined by ecological factors, such as demography and potential for dispersal as well as the scale and temporal stability of the environment used by a given species to complete its life cycle (Waples, Gaggiotti, 2006). Population genetics likely reflects the balance between these counteracting ecological processes, and studies of highly mobile marine fishes have provided evidence for population structure associated with either geographic distance, heterogeneity of oceanographic features, or environmental gradients (Pelc et al., 2009; Roques et al., 2001).
Yet, the extent of observed structuring in marine species is typically very weak even over large geographic distances (DeWoody, Avise, 2000) and/or temporally and spatially unstable (Hogan
et al., 2010). Paradoxically, there is growing evidence for the occurrence of meaningful
adaptive differences within marine species over relatively short geographic distances, despite the lack of neutral genetic differentiation (Hutchings et al., 2007). Interpreting the biological significance of population structure revealed by molecular markers thus remains particularly challenging in marine fishes (Knutsen et al., 2011). Yet, knowledge of genetic population structure is crucial for improving the realism of neutral models used to examine adaptive genetic variation as well as for optimizing conservation and management strategies of exploited species.
In addition to understanding population structure, knowledge of the factors influencing demographic fluctuations is also essential for predicting recruitment and for sound management plans of exploited species. Among the many possible causal factors, changes in population abundance of marine species in the Atlantic Ocean have shown significant relationships with climatic and oceanographic variability (Stenseth et al., 2003). In particular, the North Atlantic Oscillation (NAO), a climatic phenomenon in the North Atlantic resulting from unpredictable temporal fluctuations in the local difference of atmospheric pressure at sea level between the Icelandic low and the Azores high (Hurrell, Deser, 2009), has been linked to changes in species assemblages and fluctuations in abundance of several North Atlantic species (Alheit, Hagen, 1997; Attrill, Power, 2002; Ottersen et al., 2001).While it may prove difficult to directly estimate population census size, especially in broadly distributed species, genetic methods can provide valuable information on fluctuations in population abundance (Luikart et al., 2010). Molecular markers can be used to estimate the effective population size (Ne), calculated over
the time frame of one generation and the effective number of breeders (Nb), which is the
effective number of breeders estimated over a unique reproductive event. Ne and Nb, in turn can
indirectly give information on fluctuations in census sizes under some circumstances (Antao et
al., 2011). Moreover, Ne itself is one of the most important parameters in both evolutionary
biology (Charlesworth, 2009) and conservation biology (Frankham, 2005). Ne or Nb estimates
using molecular methods are most efficient and precise for relatively small populations but may prove very difficult to obtain for large populations (Waples, Do, 2010). However, meaningful
estimates of Ne have previously been obtained for exploited marine species (Hauser, Carvalho,
2008).
Interpreting the biological meaning of weak genetic differentiation has been particularly contentious and yet most relevant in the two Atlantic eels of the genus Anguilla: the European (Anguilla anguilla) and the American (A. rostrata) eel. Based on the species‘ ecological characteristics, namely random larval dispersal and occurrence of a single spawning area, it has long been implicitly assumed that both Atlantic eels represent truly panmictic species (Tesch, 1977). Indeed, previous genetic studies revealed very weak signals of genetic differentiation (FST) in both species, with species-scale global FST values measured by microsatellites typically
being <0.005 (literature reviewed in the Discussion). Compared with the European eel, relatively modest effort has been devoted to the population genetics of American eel, and thus far the null hypothesis of panmixia has remained unchallenged (Avise et al., 1986; Wirth, Bernatchez, 2003). Arguably, however, the number of genetic markers used, the number of sampled individuals, and sampling coverage were all relatively modest in previous studies on the American eel. Moreover, samples typically comprised specimens of different life stages, which has cast some doubt on the potential of these studies to detect weak but meaningful genetic structure. Also, the temporal stability of genetic variation has never been tested in the American eel.
The global abundance of the American eel as well as European eel has been declining during the past 30 years. There are indications that abundance of all stages of eel (glass eel, yellow eel, and silver eel) remains at a historical low. Over the last 5 years, year‘s glass eel recruitment has averaged between less than 1% (continental North Sea) and 5% (elsewhere in Europe) of the 1960-1979 levels (ICES, 2011). Numerous factors are suspected to be responsible for the decline of Atlantic eels, among which global oceanic changes could be particularly important (Castonguay et al., 1994b; Friedland et al., 2007). Indeed, studies on the European eel have documented a negative correlation between glass eel recruitment and the North Atlantic Oscillation index (NAO) (Knights, 2003). For the American eel, the NAO has been
hypothesized to influence local recruitment and year-class strength structure (Sullivan et al., 2006). However, there has been no attempt to associate demographic fluctuations with changes in oceanic conditions reflected by the NAO.
In this context, this study had three main objectives. First, we conducted the most comprehensive analysis to date of neutral genetic population structure in American eel to revisit the null hypothesis of panmixia in this species. Second, we used this data to provide the first estimates of contemporary effective population size (Ne) and to document temporal variation in
the effective number of breeders (Nb) for the American eel. Third, we tested for statistical
associations between temporal variation in the NOA, effective number of breeders, and two indices of recruit abundance.
2.3 Materials and Methods
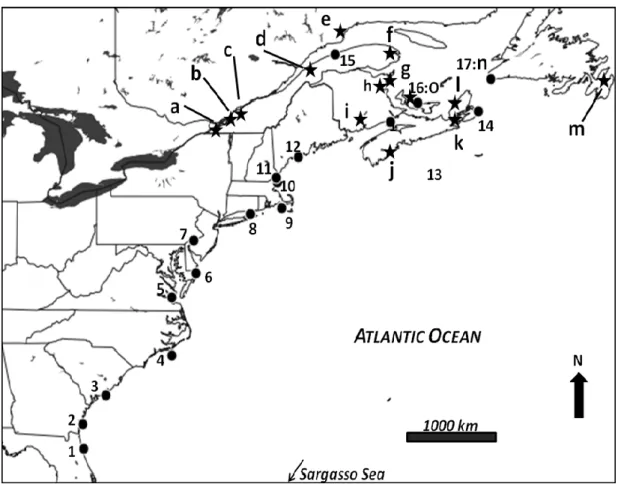
2.3.1 Sampling
American glass eels recruitment begins in Florida around December and progresses northward to Newfoundland–Labrador until JuneJuly (Helfman et al., 1987). The first waves of glass eels at each location were sampled in 2008 following this latitudinal trend at 17 sites evenly distributed along eastern North America up to the St. Lawrence estuary (Figure 2.1;Table 2.1). For each location, 50 individuals were measured and preserved in 95% ethanol. Yellow eels were also collected between May and September 2008 at 15 locations ranging from the upper St. Lawrence River to the Atlantic coast of Canada (Table 2.2). The emphasis on yellow eel sampling in this region was motivated by the occurrence of strikingly different recruitment trends reported between Atlantic Canada versus the upper St. Lawrence River and Lake Ontario (Cairns et al., 2008). Sample size varied from 69 to 100 yellow eels per location (Table 2.2, Suppl. Table 2.1). Fin clips were preserved in 95% ethanol for DNA extraction and genotyping, and heads were kept for otolith extraction.
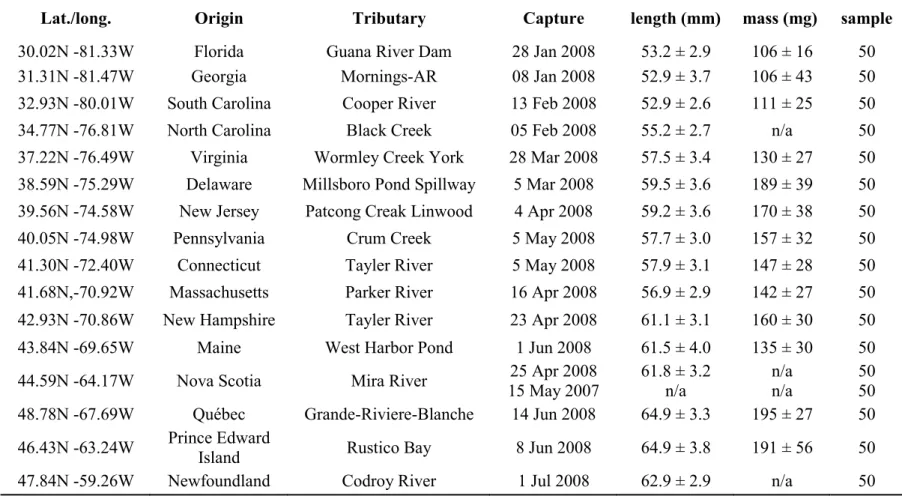
Table 2.1 Description of sampling locations (origin) and dates of capture, mean body measurements, and sample sizes for glass eels.
Lat./long. Origin Tributary Capture length (mm) mass (mg) sample
30.02N -81.33W Florida Guana River Dam 28 Jan 2008 53.2 ± 2.9 106 ± 16 50 31.31N -81.47W Georgia Mornings-AR 08 Jan 2008 52.9 ± 3.7 106 ± 43 50 32.93N -80.01W South Carolina Cooper River 13 Feb 2008 52.9 ± 2.6 111 ± 25 50 34.77N -76.81W North Carolina Black Creek 05 Feb 2008 55.2 ± 2.7 n/a 50 37.22N -76.49W Virginia Wormley Creek York 28 Mar 2008 57.5 ± 3.4 130 ± 27 50 38.59N -75.29W Delaware Millsboro Pond Spillway 5 Mar 2008 59.5 ± 3.6 189 ± 39 50 39.56N -74.58W New Jersey Patcong Creak Linwood 4 Apr 2008 59.2 ± 3.6 170 ± 38 50 40.05N -74.98W Pennsylvania Crum Creek 5 May 2008 57.7 ± 3.0 157 ± 32 50 41.30N -72.40W Connecticut Tayler River 5 May 2008 57.9 ± 3.1 147 ± 28 50 41.68N,-70.92W Massachusetts Parker River 16 Apr 2008 56.9 ± 2.9 142 ± 27 50 42.93N -70.86W New Hampshire Tayler River 23 Apr 2008 61.1 ± 3.1 160 ± 30 50 43.84N -69.65W Maine West Harbor Pond 1 Jun 2008 61.5 ± 4.0 135 ± 30 50 44.59N -64.17W Nova Scotia Mira River 15 May 2007 25 Apr 2008 61.8 ± 3.2 n/a n/a n/a 50 50 48.78N -67.69W Québec Grande-Riviere-Blanche 14 Jun 2008 64.9 ± 3.3 195 ± 27 50 46.43N -63.24W Prince Edward Island Rustico Bay 8 Jun 2008 64.9 ± 3.8 191 ± 56 50 47.84N -59.26W Newfoundland Codroy River 1 Jul 2008 62.9 ± 2.9 n/a 50
Table 2.2 Description of sampling locations and date of capture, mean body measurements, and sample sizes for yellow eels.
Lat./long. Origin Tributary Capture length (mm) mass (g) sample
45.01N -74.79W Ontario Moses-Saunders Dam 17 Jul 2008 20 Jun 2007 367.6 ± 75.9 402.1 ± 77.5 72 ± 58 98 ± 68 100 76 45.31N -73.90W Québec Beauharnois 19 Aug 2008 308.2 ± 76.5 41 ± 40 100 45.44N -73.26W Québec Chambly 24 Jul 2008 317.1 ± 76.1 43 ± 45 100 48.28N -68.95W Québec Rivière Sud-Ouest 1 Jun 2008 224.6 ± 31.4 13 ± 7 82 49.52N -67.28W Québec Rivière Petite Trinité 16 Jul 2008 133.5 ± 55.5 4 ± 6 80 48.82N -64.83W Québec Rivière St-Jean 1 May 2008 407.2 ± 41.0 90 ± 28 100 47.52N -64.91W New Brunswick Tracadie River 3 Jun 2008 499.9 ± 35.5 183 ± 34 80 47.09N -65.22W New Brunswick Miramichi Estuary 28 May 2008
4 Sep 2007 403.0 ± 153.9 494.1 ± 104.1 154 ± 203 223 ± 162 40 101 45.87N -66.15W New Brunswick Grand-Lake 7 Sep 2008 423.6 ± 28.1 129 ± 24 80 44.36N -64.46W Nova Scotia La Have River 15 Jun 2008 429.8 ± 33.3 123 ± 32 80 45.84N -60.80W Nova Scotia Bras d‘Or Lake 1 Jun 2008 475.3 ± 58.8 154 ± 66 80 46.43N -61.10W Nova Scotia Margaree Harbour 12 Sep 2008 n/a n/a 69 47.60N -53.26W Newfoundland Roberts Bay 5 Sep 2008 n/a n/a 100 47.85N -59.26W Newfoundland Codroy Valley 18 Aug 2008 453.2 ± 22.2 141 ± 22 100 46.43N -63.24W Prince Edward
Island
2.3.2 Age determination
From the 2146 samples, age through otolith reading was determined on 946 yellow eels (2008) other samples were either glass eels (850) or yellow eels samples (346) from previous sampling (2007) for which otoliths were not conserved, or were lost or degraded. Thus, nearly 75% of all yellow eels could be subdivides into annual cohorts. Sagittal otoliths were extracted, stored in glass vials in a 95% ethanol: glycerine solution (1:1 ratio), and cleaned with successive baths of bleach, water, and 95% ethanol. Once dried, otoliths were embedded in a mix of epoxy resin and hardener (4:1 ratio) inside gelatine capsules for 24 h, ground to the core on the sagittal plane, and polished with alumina powder on a polishing disc. Sections were etched, decalcified in 5% EDTA for annuli enhancing, stained in 0.01% toluidine blue solution, and digitally photographed (Tremblay, 2009). The first annulus after the dark central nucleus was considered as the elver check (metamorphosis from leptocephali larva to glass eel) and subsequent annuli as winter checks (ICES, 2011). Eels were considered by convention to be of age 0 + in their year of arrival in continental waters, and their ―cohort year‖ was thus defined as so. Each otolith was aged twice by two eel experts to confirm aging. A total of 946 yellow eel otoliths were readable, representing 17 different cohorts, each comprising 1 to 127 individuals.
Par Rémi Tardif en collaboration avec Guy Verreault Société de la faune et des parcs du Québec Direction de l’aménagement de la faune du
Bas-Saint-Laurent Elver Check en 2008 2008 2010 2011 2009 <2008
Anguille capturée au 1er juillet 2012