Pour l'obtention du grade de
DOCTEUR DE L'UNIVERSITÉ DE POITIERS UFR de médecine et de pharmacie
Laboratoire de chimie et microbiologie de l eau - LCME (Poitiers) (Diplôme National - Arrêté du 7 août 2006)
École doctorale : Biologie-santé - Bio-santé (Limoges)
Secteur de recherche : Physiologie, biologie des organismes, populations et interactions
Présentée par :
Vanessa Barbot
Implication des levures du genre Candida et des amibes libres
dans le risque infectieux lié à l'eau - contexte des soins dentaires
Directeur(s) de Thèse : Christine Imbert, Marie Deborde Soutenue le 30 octobre 2012 devant le jury Jury :
Président Thierry Bergès Professeur des Universités, Université de Poitiers Rapporteur Loïc Favennec Professeur des Universités, Université de Rouen Rapporteur Martine Bonnaure-Mallet Professeur des Universités, Université de Rennes 1 Membre Christine Imbert Professeur des Universités, Université de Poitiers Membre Marie Deborde Maître de conférences, Université de Poitiers Membre Raymond Robert Professeur des Universités, Université d'Angers
Pour citer cette thèse :
Vanessa Barbot. Implication des levures du genre Candida et des amibes libres dans le risque infectieux lié à l'eau contexte des soins dentaires [En ligne]. Thèse Physiologie, biologie des organismes, populations et interactions. Poitiers : Université de Poitiers, 2012. Disponible sur l'Intranet de l'Université de Poitiers
Pour
l’obtention du Grade de
DOCTEUR DE L’UNIVERSITE DE POITIERS
Faculté de Médecine et de Pharmacie
(Diplôme National - Arrêté du 7 août 2006)
Ecole Doctorale : «
Sciences pour l’environnement » Gay Lussac
Secteur de Recherche :
Physiologie, Biologie des organismes, populations et Interactions
Présentée par :
Vanessa BARBOT
************************
IMPLICATION DES LEVURES DU GENRE
CANDIDA
ET DES AMIBES LIBRES DANS LE
RISQUE INFECTIEUX LIE A L’EAU –
CONTEXTE DES SOINS DENTAIRES
************************
Directrices de Thèse : Christine IMBERT et Marie DEBORDE
Soutenue le 30 octobre 2012
devant la Commission d’Examen
************************
JURY
Président :
M. Thierry BERGES
Professeur, Université de Poitiers
Rapporteurs :
Mme Martine BONNAURE-MALLET
Professeur, Université de Rennes 1
M. Loïc FAVENNEC
Professeur, Université de Rouen
Examinateurs :
M. Raymond ROBERT
Professeur, Université d’Angers
Mme Christine IMBERT
Professeur, Université de Poitiers
Mme Marie DEBORDE
Maitre de Conférences, Université de
Thèse réalisée au Laboratoire d’Ecologie, Biologie des Interactions
EBI, UMR CNRS 7267
Equipe Microbiologie de l’Eau
Université de Poitiers, 6 Rue de la Milétrie, BP 199
86034 Poitiers cedex
Cofinancement
Ce projet a également bénéficié d’un soutien financier de l’IFRO (Institut Français de
Recherche en Odontologie) et des structures du CHU de Poitiers, nous les
« Le meilleur ami de ‘merci’ est ‘beaucoup’ » (M. Bouthot), et l’aboutissement de ce projet de recherche étant lié à de nombreuses personnes, j’ai beaucoup de ‘merci’ à distribuer.
En premier lieu, je remercie les professeurs Jacques Frère et Didier Bouchon, directeurs successifs du laboratoire LCME (Laboratoire de Chimie et de Microbiologie de l’Eau) devenu récemment EBI (Ecologie, Biologie des Interactions), pour m’avoir accueillie dans leur équipe et m’avoir permis de réaliser ce projet de recherche.
Je remercie également Yann Héchard, responsable de l’équipe Microbiologie de l’Eau, pour sa gestion dynamique de l’équipe et son aide, directe ou indirecte, mais indispensable.
Je tiens à remercier mes deux directrices de thèse, Christine Imbert et Marie
Deborde pour leur encadrement, leur présence, leur accompagnement continu, de près ou
de loin. Un merci particulier à Christine pour son écoute et son optimisme durant ces trois années de recherche.
J’aimerai remercier les autres membres du jury : Martine Bonnaure-Mallet, Loïc
Favennec, Raymond Robert et Thierry Bergès pour avoir accepté de lire et de corriger
mon travail.
Je remercie tous ceux qui m’ont apporté leur expérience, leurs connaissances et qui m’ont permis d’avancer dans ce projet de recherche : Jérôme Labanowsky (UMR CNRS 7285 Poitiers) pour les analyses de GC-MS, Nathalie Quellard et Béatrice Fernandez pour les observations en microscopie électronique (Unité de pathologie ultrastructurale et expérimentale ; Service d’anatomie et cytologie pathologique, CHU Poitiers), Virginie
Migeot pour les analyses statistiques (CHU Poitiers), Adriana Delwail (laboratoire LITEC,
plateforme ImageUp) pour les expériences de cytométrie en flux ainsi que le laboratoire
SR²B (Société de Recherche et de Réalisations Biotechnologiques) d’Angers dont fait partie
le Pr Raymond Robert, pour leurs conseils et leur participation aux marquages immunocytochimiques.
Un grand merci à Nathalie Ranger et Karine Demangeau pour leur gestion efficace de tout le côté logistique de l’équipe. Merci également à Alain, Christophe et Marie-Claude pour leur aide quotidienne et indispensable.
Sophie, ainsi que Nadine et Dominique au service de distribution. Merci également au Dr Jacques Berthonneau, alias Mimile pour sa décoration particulière du bureau et sa
convivialité permanente. Un grand merci à Marie-Hélène Rodier, chef du service de Parasitologie pour son accueil et surtout son aide précieuse. Merci à Anne Bousseau et
Amélie Robert pour leur participation au projet.
J’aimerai remercier les membres du CIMES (Cellule d’Initiation aux Métiers de l’Enseignement Supérieur) et surtout Anne Brouard pour l’organisation des formations de monitorat et Dominique Proudhon pour ses cours passionnants.
Merci à Charles Bodet et Nicolas Bellin pour m’avoir conseillée et encadrée durant les TP de Bactériologie, rendant mon premier contact avec le domaine de l’enseignement agréable et très motivant.
Merci également à mes stagiaires Armance et Jonathan, pour leur participation au projet et leur motivation.
Un grand merci à Marion Girardot et Damien Costa pour leur amitié et l’ambiance agréable qu’ils ont apporté dans le laboratoire du CHU.
Merci à Jean-Marc Berjeaud pour ses conseils et son optimisme, et merci à tous les autres membres de l’équipe pour leur présence, leurs conseils divers et variés, sans oublier leur participation volontaire pour les échantillonnages de salive. Un merci particulier à Aïcha
Gharbi pour m’avoir aiguillée et soutenue au début de ma thèse et à Julien Verdon pour
m’avoir initiée à la recherche et motivée à réaliser une thèse.
Enfin, un grand merci à mes parents Brigitte et Daniel, à toute ma famille pour leur soutien et leurs encouragements, merci à tous mes amis, et plus particulièrement à Julien et enfin Nicolas qui, en plus de son appui, m’a aidée à la réalisation de mon affiche de thèse.
SOMMAIRE
Liste des abréviations
1Liste des figures
2Liste des tableaux
6Introduction générale
7Etude bibliographique
10Chapitre 1 : Les micro-organismes étudiés
11I.
Les levures du genre Candida
111) Présentation
11a) Taxonomie 11
b) Morphologie 11
2) Pathogénicité
12a) Incidence et porteurs sains 12
b) Facteurs de pathogénicité 13
3) Adhérence et biofilm
14a) Définition d’un biofilm 14
b) Etapes de formation d’un biofilm 15
c) Architecture 17
d) Régulation et QS 18
e) Résistances 18
4) Infections orales à Candida
19a) Infections oropharyngées 19
b) Prévention 20
II.
Les amibes libres
211) Présentation
21a) Taxonomie 21
b) Morphologie 21
c) Environnement et prédation 23
d) ARB et endosymbiotes 24
2) Principaux genres amphizoïques
25a) Acanthamoeba 26
b) Balamuthia 26
c) Naegleria 27
e) Vahlkampfia – Hartmannella 28
3) Infections amibiennes
29a) Principales infections amibiennes 29
b) Modes de contamination 30 c) Traitements et prévention 31
Chapitre 2 : La salive
32I.
Généralités
321) Origine et formation
322) Caractéristiques et composition
33 a) Composants inorganiques 33 b) Composants organiques 333) Fonctions et applications
34 a) Goût 35 b) Protection et lubrification 35 c) Dilution et nettoyage 35 d) Barrière 36 e) Digestion 36f) Réparation des tissus 36
g) Activité antimicrobienne 36
h) Diagnostic 36
4) Facteurs influents
36a) L’hydratation 37
b) Le cycle circadien et rythme annuel 37
c) L’âge 37
d) Le sexe 37
e) Les stimuli 37
f) Les médicaments 37
g) Les infections 38
II.
Micro-organismes et interactions
381) Flore commensale buccale
38a) Flore bactérienne 38
b) Flore fongique 39
c) Interactions entre micro-organismes 39
2) Interactions des micro-organismes avec la salive
41a) La salive favorise l’adhérence 42
Chapitre 3 : Les units de soins dentaires
45I.
Définition et structure du circuit d’eau
451)
Définition de l’unit de soins dentaires
452)
Circuit d’eau de l’USD
46II.
Revues de la littérature
471) Revue nationale : Le Chirurgien Dentiste de France (2011)
482) Revue internationale : FEMS Immunology and Medical Microbiology
(2012)
57Matériel et méthodes
67Chapitre 1 : Milieux et réactifs
68I.
Le milieu de culture
68II.
Les micro-organismes
681) Souches utilisées
68a) Souches de levures 68
b) Souches d’amibes libres 68
2) Culture et entretien
68a) Culture des levures 68
b) Culture des amibes libres 68
3) Préparation des micro-organismes
71a) Préparation des levures 71
b) Préparation des amibes libres 71
c) Préparation des surnageants de culture d’amibes libres 72
III.
La salive
721) Obtention des échantillons
722) Préparation des salives
72a) Salive centrifugée 72
b) Salive filtrée 72
c) Salive filtrée et traitée au DTT 73
d) Salive filtrée et chauffée 73
e) Salive filtrée et fractionnée 73
Chapitre 2
: Survie dans l’eau – Influence de la salive
74I.
L’analyse de la salive
741) Préparation de la salive
742) Analyse par chromatographie
741) Survie des levures
75a) Gamme de concentrations en salive 75
b) Préparation des suspensions 75
c) Suivi de la survie 75
d) Analyse de la viabilité 75
2) Survie des amibes libres
76a) Gamme de concentrations en salive 76
b) Préparation des suspensions 76
c) Suivi de la survie 76
d) Analyse de la viabilité 76
Chapitre 3 : Les cocultures amibes libres-levures
78I.
Préparation des micro-organismes
78II.
Analyse de la viabilité
78III.
Observations microscopiques
791) Microscopie électronique à transmission
79a) Préparation des cocultures 79
b) Fixation 1 79 c) Pré-enrobage 79 d) Fixation 2 79 e) Déshydratation 79 f) Inclusion en résine 80 g) Coupes et observations 80
2) Marquage immunocytochimique
81 a) Oxydation 81 b) Saturation 82 c) Anticorps primaire 82 d) Anticorps secondaire 82 e) Contraste 823) Microscopie électronique à balayage
82a) Stérilisation des coupons 82
b) Préparation des cocultures 83
c) Fixation 83
d) Déshydratation 83
e) Dessiccation par méthode Point Critique 83
f) Métallisation et observations 84
1) Cytométrie en flux : principe
842) Cytométrie en flux : application
85a) Préparation des cocultures 85
b) Marquage par des fluorochromes 85
c) Analyse en cytométrie en flux 85
Chapitre 4 : Les traitements chimiques
86I.
Produits chimiques utilisés
86II.
Traitements des micro-organismes
871) Préparation des suspensions
87a) Préparation des levures 87
b) Préparation des amibes libres 87 c) Préparation des cocultures 87
2) Traitements chimiques
873) Analyse de la viabilité
88a) Analyse de la survie des levures 88
b) Analyse de la survie des amibes libres 88
Résultats et discussion
89 Chapitre 1 : Analyse de la salive 90I.
Objectif de l’étude
90II.
Chromatogramme obtenu par GC-MS
90Chapitre 2
: Survie dans l’eau – Influence de la salive
92I.
Survie des levures
921)
Objectif de l’étude
922) Article : FEMS Microbiology Letters (2011)
– Influence de la présence de
salive
923)
Influence du type d’eau utilisée
974) Influence de la composition de la salive utilisée
98a) Salive centrifugée VS salive filtrée 98
b) Salive filtrée VS salive DTT 100
c) Salive filtrée VS salive chauffée 102
d) Salive filtrée VS salives fractionnées 104
5) Influence de la température utilisée
106II.
Survie des amibes libres
1101)
Objectif de l’étude
110a) Sur la survie d’A. castellanii 110
b) Sur la survie de H. vermiformis 111
3) Influence de la température utilisée
112Chapitre 3 : Les cocultures amibes libres-levures
114I.
Cocultures A. castellanii-Candida
114II.
Cocultures H. vermiformis-Candida
1161) Article : Water Research (2012)
– Interactions entre H. vermiformis et
Candida spp
. 1162) Influence de la température utilisée
1253)
Influence de la présence d’un surnageant d’amibes libres
126III.
Observations microscopiques
1271) Microscopie électronique à transmission
128a) Observations des cocultures en suspension 128
b) Marquage immunocytochimique 129
2) Microscopie électronique à balayage
131IV.
Cytométrie en flux
1331) Analyse des suspensions de levures
1342)
Analyse des suspensions d’amibes libres
1353) Analyse des cocultures
137Chapitre 4 : Les traitements chimiques
139I.
Survie des microorganismes en mono-culture
– Article en
cours de soumission (2012)
139II.
Survie des microorganismes en cocultures
1571) Viabilité des levures
1572) Viabilité des amibes libres
159Conclusion et perspectives
1611
Liste des abréviations
Ag : Antigène
ARB : Amoeba-Resistant Bacteria
ATCC : American Type Culture Collection DMSO : DiméthylSulfoxyde
DTT : DiThiolThréitol
ES : Elastomère de Silicone
FEMS : Federation of European Microbiological Societies FSC : Forward Scatter
GC-MS : Gaz Chromatography – Mass Spectrometry H2O2: Peroxyde d’hydrogène
Ig : Immunoglobuline
IHEM : BCCM-IHEM, Belgian Co-ordinated Collections of Micro-organisms IP : Iodure de Propidium
MEB : Microscopie Electronique à Balayage MEC : Matrice Extracellulaire
MET : Microscopie Electronique à Transmission MOI : Multiplicity Of Infection
NaOCl : Hypochlorite de sodium NNA : Non-Nutrient Agar
NPP : Nombre le Plus Probable PIR : Porte-Instruments Rotatifs PMA : Polymétacrylate
Ppm : parties par million
PRP : Protéines Riches en Proline PVC : PolyChlorure de Vinyle
PYG : Peptone - Yeast extract - Glucose PYNFH : milieu ATCC 1034 modifié QS : Quorum-Sensing
SSC : Side Scatter
SVF : Sérum de Veau Fœtal UFC : Unité Formant Colonie USD : Unit de Soins Dentaires
2
Liste des figures
(Hors articles)
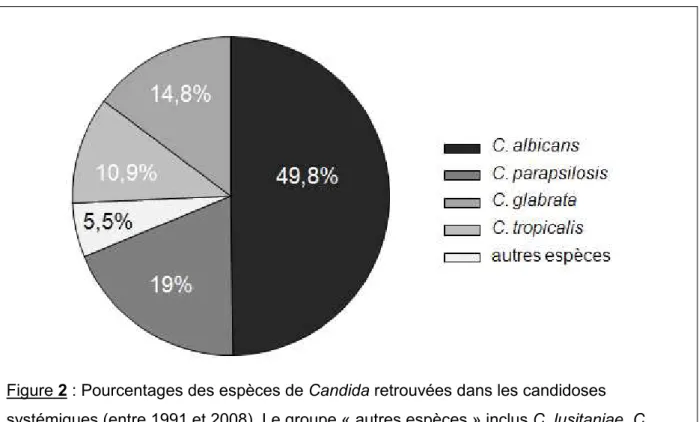
Figure 1 : Observations en microscopie électronique à balayage (MEB) des différentes morphologies de C. albicans (Hawser and Douglas, 1994). 12 Figure 2 : Pourcentages des espèces de Candida retrouvées dans les candidoses
systémiques (entre 1991 et 2008). Le groupe « autres espèces » inclus C. lusitaniae, C.
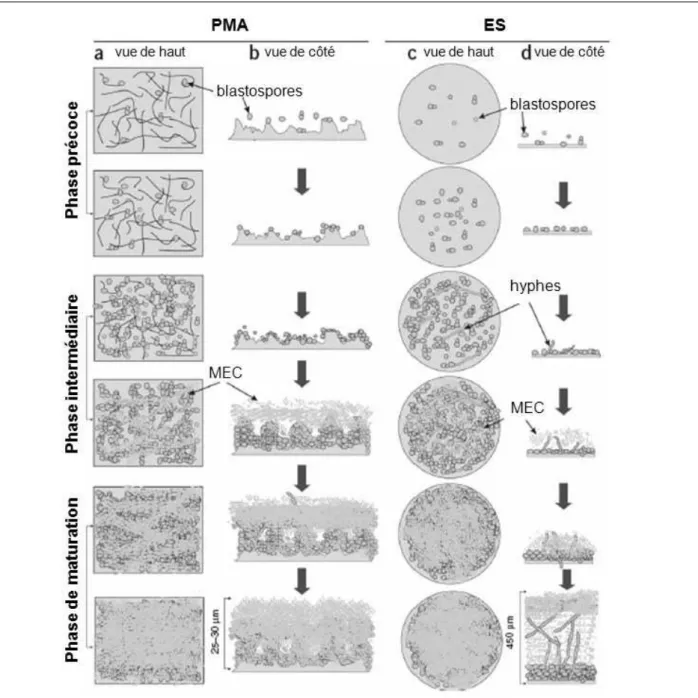
krusei, C. guilliermondii, C. dubliniensis, et C. rugosa (Trofa et al., 2008). 13 Figure 3 : Représentation schématique des trois phases de développement d’un biofilm de Candida spp. sur différents supports : PMA (polyméthacrylate) (a, b) et ES (élastomère de silicone) (c, d). MEC : matrice extracellulaire (Chandra et al., 2001). 15 Figure 4 : Observations en MEB des différentes étapes de formation d’un biofilm de C.
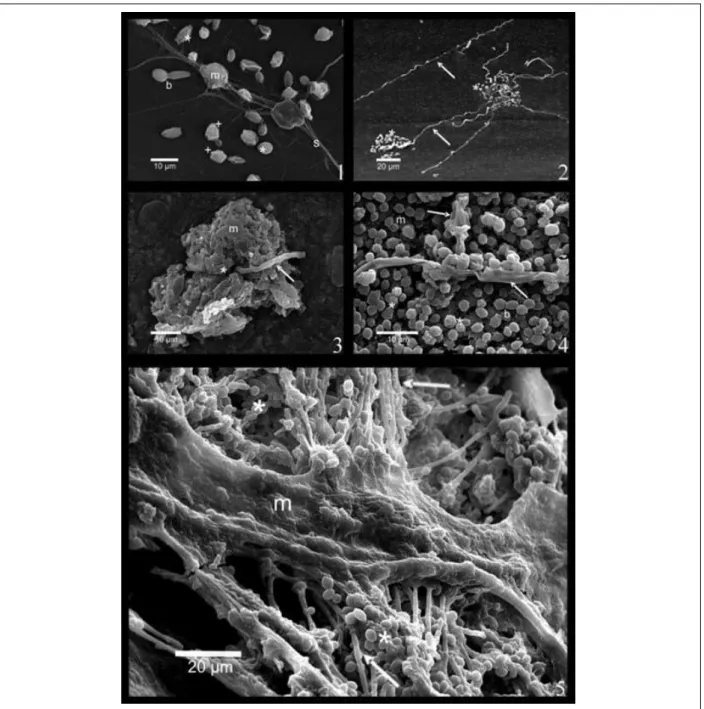
albicans (1-5). * : blastospores, b : cellule en bourgeonnement, m : MEC, : hyphes
(Paulitsch et al., 2009). 16 Figure 5 : Images de microscopie confocale illustrant l’architecture en 3D d’un biofilm
mature de C. albicans (a, b). : hyphes (Chandra et al., 2001). 17 Figure 6 : Observations en MEB d’un biofilm de Candida spp. retrouvé sur la prothèse dentaire d’un patient atteint de stomatite (A-C) (Ramage et al., 2004). 20 Figure 7 : Observations en microscopie optique de différents genres d’amibes libres :
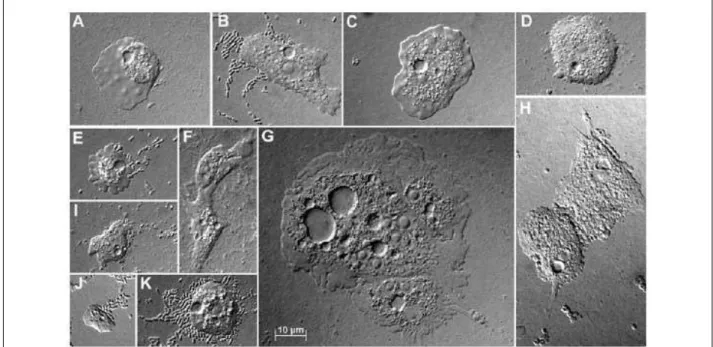
Playtamoeba (A), Acanthamoeba (B, D et K), Vanella (C), Glaeseria (E), Hartmannella (F
et I), Naegleria (G et H) et Echinamoeba (J) (Thomas et al., 2008). 22 Figure 8 : Observations en microscopie optique d’un trophozoïte (a) et de kystes (b)
d’Acanthamoeba castellanii (x1000). n : noyau, cv : vacuole. (Visvesvara et al., 2007). 22 Figure 9 : Observations en microscopie électronique à transmission (MET) de la
phagocytose de Legionella pneumophila par Hartmannella vermiformis (A-D) et de sa
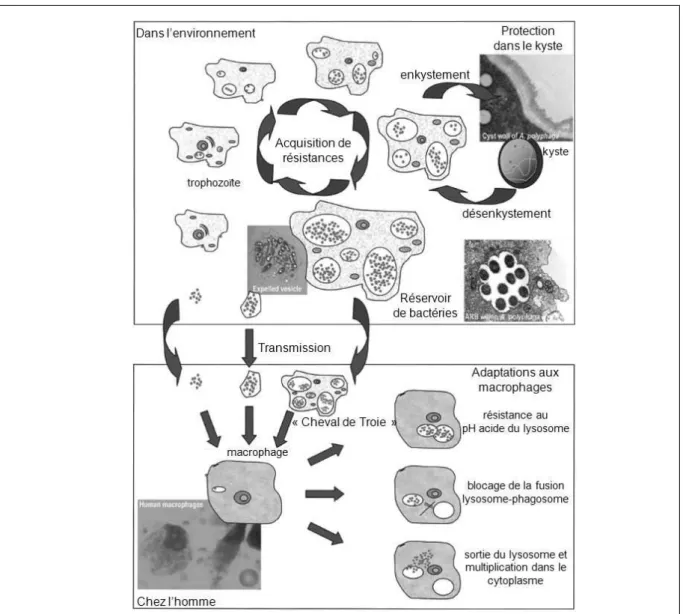
réplication à l’intérieur de l’amibe (E-F) (Greub and Raoult, 2003). 23 Figure 10 : Schéma du rôle des amibes libres en tant que réservoir et vecteur de
transmission de bactéries (Greub and Raoult, 2004). 25 Figure 11 : Observations en microscopie optique d’un trophozoïte (a) et d’un kyste (b) de
Balamuthia mandrillaris (x850) (Visvesvara et al., 2007). 26 Figure 12 : Observations en microscopie optique d’un trophozoïte (a), d’un flagellé (b) et d’un kyste (c) de Naegleria fowleri (x1000). n : noyau et u : partie postérieure (Visvesvara
et al., 2007). 27
Figure 13 : Observations en microscopie optique d’un trophozoïte (b), et de kystes (c) de
3
Figure 14 : Observations en microscopie optique d’un trophozoïte (1), et d’un kyste (4) de
Hartmannella vermiformis. cv : vacuole (Smirnov and Michel, 1999). 28 Figure 15 : Kératite amibienne à Acanthamoeba (Scat et al., 1995). 29 Figure 16 : Encéphalite amibienne à Balamuthia (Schuster and Visvesvara, 2004). 30 Figure 17 : Schéma de la localisation des glandes salivaires majeures. 1 : glande parotide,
2 : glande sous-mandibulaire, 3 : glande sublinguale
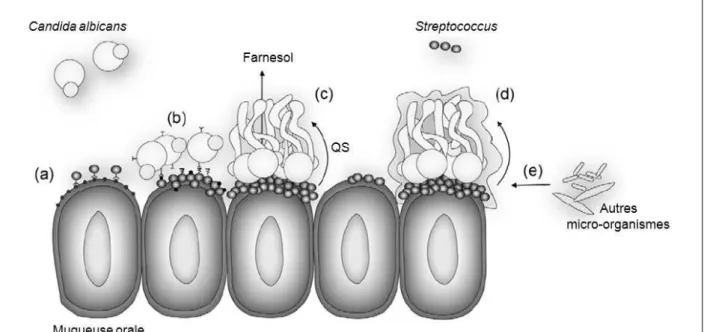
(http://coproweb.free.fr/pagphy/physioan/ch5s1.htm; 04/08/2012). 32 Figure 18 : Les différentes fonctions de la salive (Crielaard, 2011). 34 Figure 19 : Schéma des interactions mutualistes entre C. albicans et Streptococcus
gordonii dans la cavité orale (a-e). QS : Quorum Sensing (Morales and Hogan, 2010). 41 Figure 20 : Schéma des différentes interactions entre la salive et les micro-organismes oraux (A-D). K+ : potassium, exemple d’ions intracellulaires (Scannapieco, 1994). 42 Figure 21 : Adhérence de différentes souches de C. albicans sur un support de PMA, en absence (A) ou en présence (B) de salive (Elguezabal et al., 2008). 43 Figure 22 : Effet de différentes salives sur la transition blastospores-hyphes de C. albicans (Leito et al., 2009). 44 Figure 23 : Photographies de différentes parties de l’USD. (a) vue d’ensemble, (b) vue intérieure du circuit d’arrivée d’eau (ici un réservoir interne), (c) le plateau supportant les PIR, (e) le crachoir et le circuit d’évacuation d’eau (O'Donnell et al., 2006). 45 Figure 24 : Photographie de tubulures d’USD. (a) tubulure entière, (b) section de tubulure (Porteous, 2010). 46 Figure 25 : Vue intérieure de l’USD : un réseau complexe de circulation d’eau (Wirthlin et
al., 2003). 46
Figure 26 : Section longitudinale d’une tubulure d’USD, recouverte de biofilm (Coleman et
al., 2007). 47
Figure 27 : Aérosols visibles, produits par une turbine d’USD lors d’un acte de soins
dentaires (Harrel and Molinari, 2004). 48 Figure 28 : Protocole de tyndallisation de bactéries. 71 Figure 29 : Inclusion des échantillons dans une résine époxy (A, B) (Unité de pathologie ultrastructurale et expérimentale ; Service d’anatomie et cytologie pathologique, CHU
Poitiers). 80 Figure 30 : Coupes ultra-fines déposées sur des grilles de cuivre (A) et porte-échantillon permettant l’insertion des grilles dans le MET (B) (Unité de pathologie ultrastructurale et expérimentale ; Service d’anatomie et cytologie pathologique, CHU Poitiers). 81 Figure 31 : Schéma du principe de la cytométrie en flux (http://bentleyinstruments.com/ wp-content/uploads/2010/12/Somacount_FCM-300x254.jpg, 4/08/2012). 84
4
Figure 32 : Chromatogramme de la salive filtrée, analysée par GC-MS (n=2). 91 Figure 33 : Survie de C. albicans dans l’eau distillée (A) et dans l’eau filtrée (B), en
présence de différentes concentrations de salive centrifugée (0, 2, 5 et 10% v/v) à 27°C (n=2). 97 Figure 34 : Survie de C. albicans (A), C. glabrata (B), et C. parapsilosis (C), dans l’eau filtrée en présence de 5% (v/v) de salive centrifugée ou filtrée à 27°C (n=2). 99 Figure 35 : Survie de C. albicans (A), C. glabrata (B), et C. parapsilosis (C), dans l’eau filtrée en présence de 5% (v/v) de salive filtrée ou de salive DTT à 27°C (n=2). 101 Figure 36 : Survie de C. albicans (A), C. glabrata (B), et C. parapsilosis (C), dans l’eau filtrée en présence de 5% (v/v) de salive filtrée (n=2) ou chauffée à 27°C (n=1). 103 Figure 37 : Survie de C. albicans (A), C. glabrata (B), et C. parapsilosis (C), dans l’eau filtrée en présence de 5% (v/v) de salive filtrée, de salive <5 K ou <30 K à 27°C (n=2). 105 Figure 38 : Survie de C. albicans à 27°C (A), 20°C (B), et 10°C (C), dans l’eau filtrée en présence de 2% (v/v) de salive filtrée (n=2). 107 Figure 39 : Survie de C. glabrata à 27°C (A), 20°C (B), et 10°C (C), dans l’eau filtrée en présence de 2% (v/v) de salive filtrée (n=2). 108 Figure 40 : Survie de C. parapsilosis à 27°C (A), 20°C (B), et 10°C (C), dans l’eau filtrée en présence de 2% (v/v) de salive filtrée (n=2). 109 Figure 41 : Survie d’A. castellanii dans l’eau filtrée en présence de 2, 5 ou 10% (v/v) de salive filtrée à 20°C (n=1). 111 Figure 42 : Survie de H. vermiformis dans l’eau filtrée en présence de 2, 5 ou 10% (v/v) de salive filtrée à 20°C (n=2). 111 Figure 43 : Survie de H. vermiformis à 27°C (A), 20°C (B), et 10°C (C), dans l’eau filtrée en présence de 2% (v/v) de salive filtrée (n=2). 113 Figure 44 : Survie d’A. castellanii (A) (n=1) et de C. albicans (B) (n=2), en coculture dans l’eau filtrée en présence de 2% (v/v) de salive filtrée, à 20°C. 115 Figure 45 : Survie de C. albicans (A), C. glabrata (B) et C. parapsilosis (C), en coculture avec H. vermiformis, dans l’eau filtrée avec 2% (v/v) de salive filtrée, à 20, 27 et 10°C (n=2). 125 Figure 46 : Survie de C. albicans (A), C. glabrata (B) et C. parapsilosis (C), en présence de surnageant de culture amibienne ou de H. vermiformis, dans l’eau filtrée, à 20°C (n=2). 127 Figure 47 : Observations en MET de C. albicans (A) et de H. vermiformis (B) en coculture dans de l’eau filtrée avec 2% de salive filtrée (v/v) après 24 h (C-D) et 168 h (E-F)
5
Figure 48 : Observations en MET de C. albicans et de H. vermiformis en coculture dans de l’eau filtrée avec 2% de salive filtrée (v/v) après 72 h d’incubation à 20°C et marquage immunocytochimique (A-D) (n=2). 130 Figure 49 : Observations en MEB de coupons de PVC incubés dans de l’eau filtrée, après 72 h d’incubation à 20°C (A-B) (n=1). 131 Figure 50 : Observations en MEB de C. albicans et de H. vermiformis en coculture sur coupons de PVC, dans de l’eau filtrée avec 2% de salive filtrée (v/v) après 3 jours (A-B), 15 jours (C-D) et 42 jours (E-F) d’incubation à 20°C (n=1). 132 Figure 51 : Résultats de cytométrie en flux (A-B) d’une suspension de C. albicans après 72 h d’incubation dans de l’eau filtrée avec 5% de salive filtrée (v/v) à 20°C (n=2). 135 Figure 52 : Résultats de cytométrie en flux (A-B) d’une suspension de H. vermiformis après 72 h d’incubation dans de l’eau filtrée avec 5% de salive filtrée (v/v) à 20°C (n=1). 137 Figure 53 : Résultats de cytométrie en flux (A-B) d’une suspension de C. albicans et de
H. vermiformis en coculture, après 72 h d’incubation dans de l’eau filtrée avec 5% de
salive filtrée (v/v) à 20°C (n=1). 138 Figure 54 : Survie de C. albicans en coculture avec H. vermiformis, dans l’eau filtrée, à 20°C et après 15 min de mise en présence de chlore (A), d’H2O2 (B) ou d’Oxygenal 6©
(C) (n=1). 158 Figure 55 : Survie de H. vermiformis en coculture avec C. albicans, dans l’eau filtrée, à 20°C et après 15 min de mise en présence de chlore (A), d’H2O2 (B) ou d’Oxygenal 6©
6
Liste des tableaux
(Hors articles)
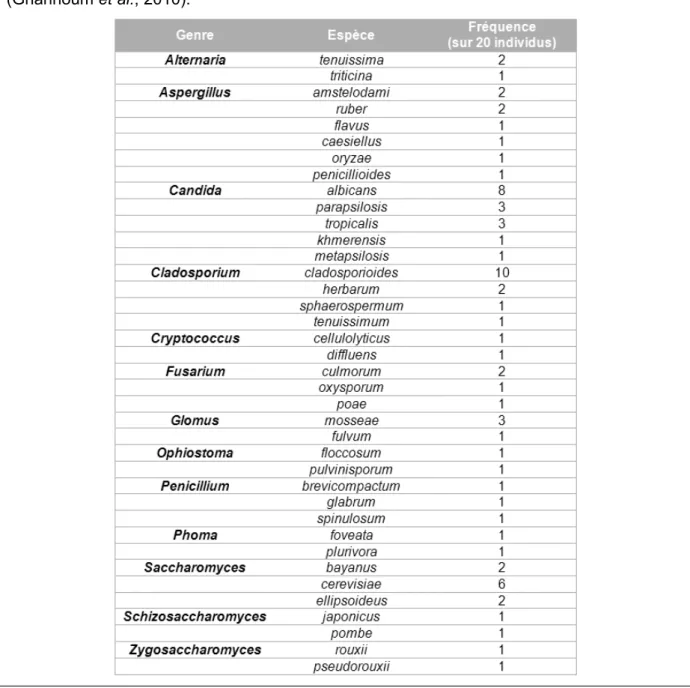
Tableau 1 : Les trois principales fonctions des protéines de la salive (Rudney, 2000). 35 Tableau 2 : Espèces fongiques retrouvées dans la cavité orale de 20 individus sains
(Ghannoum et al., 2010). 40 Tableau 3 : Préparation du milieu PYG. 69 Tableau 4 : Préparation du milieu PYNFH (ATCC 1034). 70 Tableau 5 : Tableau statistique pour la méthode du NPP à 3 géloses par dilution
(http://www.fda.gov/Food/ScienceResearch/LaboratoryMethods/BacteriologicalAnalytical ManualBAM/ucm109656.htm, 4/08/2012). 77
7
Introduction
générale
8
La contamination microbienne des units de soins dentaires (USD) est connue et étudiée depuis les années 1960. De nombreux travaux ont été menés depuis sans aboutir à des solutions satisfaisantes. L’origine de cette contamination est multiple.
D’une part l’eau arrivant au sein de l’USD, provenant du réseau d’eau potable ou d’un réservoir indépendant, peut transporter des micro-organismes qui vont coloniser le circuit d’eau de l’USD, se déposer sur les parois des tubulures et y former un biofilm. Ce biofilm pourra par la suite se décrocher, et ainsi contaminer l’eau délivrée aux patients par le biais des porte-instruments rotatifs (PIR).
D’autre part, la contamination du circuit d’eau de l’USD peut être le résultat d’un reflux de micro-organismes provenant de la bouche d’un patient. Durant un soin dentaire, les PIR en contact avec la muqueuse buccale du patient peuvent être en effet contaminés par contact direct ou par le biais des aérosols contenant des micro-organismes oraux. Ces derniers se retrouvent donc dans le circuit d’eau de l’USD et peuvent s’intégrer au biofilm formé sur les parois des tubulures, dans le cas d’un dysfonctionnement ou de l’absence de valves anti-reflux au niveau des PIR.
De nombreux micro-organismes ont été isolés dans l’eau des USD, et parmi eux certains peuvent être impliqués de façon directe et/ou indirecte en pathologie humaine. Suivant les recommandations en vigueur en France, l’eau qui entre dans l’USD doit respecter les critères de potabilité de l’eau destinée à la consommation humaine. Cependant, il n’existe pas de législation concernant l’eau en sortie de l’USD, et le passage à l’intérieur des tubulures potentiellement recouvertes de biofilm augmente la charge microbienne de l’eau, exposant ainsi les patients et les praticiens à une eau pouvant être contaminée. Pas ou peu de cas d’infections sont recensés. Toutefois quelques cas de pathologies respiratoires ou encore de kératites amibiennes sont rapportés dans la littérature ; un lien direct avec un acte de soin dentaire a dans ces cas plus ou moins été mis en évidence. Ce risque infectieux ne représente peut-être pas un problème de santé publique, mais il existe et concerne plus particulièrement les personnes fragiles ou immunodéprimées, de plus en plus nombreuses (ex. : personnes âgées, fumeurs, diabétiques, VIH+, …). Fournir un environnement exempt de micro-organismes pathogènes durant un soin dentaire reste donc un objectif à atteindre.
Par ailleurs, de nombreux moyens de lutte contre cette contamination peuvent être mis en œuvre tels que la filtration de l’eau, l’utilisation de désinfectants, la présence et l’entretien des valves anti-reflux, ou encore la purge des flexibles. Malheureusement, ces recommandations sont souvent mal connues et de ce fait insuffisamment suivies par les praticiens. Ce manque d’information conduit à une prise de conscience insuffisante du risque infectieux. C’est dans une démarche de prévention et de sensibilisation au risque infectieux que ce projet de recherche a été initié.
9
Les principaux objectifs de ce travail ont été de mieux connaitre le comportement de micro-organismes d’intérêt pouvant être présents dans l’eau des USD, étudier les interactions mises en jeu entre ces micro-organismes potentiellement pathogènes pour l’Homme et ainsi mieux évaluer le risque infectieux lié à leur présence dans l’eau circulant au sein de l’USD.
Les micro-organismes qui ont été choisis pour cette étude sont, d’une part, trois espèces de levures appartenant au genre Candida, commensales et pathogènes opportunistes de l’Homme, très fréquemment impliquées dans des infections nosocomiales. Suite à une défaillance ou à l’absence de valves anti-reflux au niveau des PIR, elles peuvent se retrouver à l’intérieur des tubulures de l’unit, accompagnées par un reflux de salive provenant du patient, durant un soin dentaire.
D’autre part, des micro-organismes environnementaux issus du réseau d’eau potable ont été étudiés : les amibes libres Acanthamoeba castellanii et Hartmannella vermiformis. Ces protozoaires sont ubiquitaires dans l’environnement, peuvent être à l’origine d’infections chez l’Homme et ont la capacité de servir d’hôte pour le développement intracellulaire de certains micro-organismes potentiellement pathogènes (ex : Legionella pneumophila).
Enfin, dans un but de prévention et de lutte contre le risque infectieux que ces micro-organismes peuvent représenter, l’efficacité de différents traitements chimiques communément utilisés a été étudiée sur les différentes espèces de Candida et d’amibes libres. De nombreux produits chimiques ont été développés pour la désinfection des USD, ainsi que différentes méthodes de traitement. Selon le type d’USD et le fournisseur associé, le traitement peut être réalisé avec l’utilisation de désinfectants de façon périodique ou continue, ou encore en combinant plusieurs désinfectants. Les produits disponibles ne sont que peu ou pas étudiés en termes d’efficacité contre des micro-organismes adhérés à des surfaces ou de toxicité pour les patients. De plus, leur effet corrosif sur les matériaux n’est pas toujours évalué. Dans cette étude, l’activité antimicrobienne de trois produits a été analysée : le chlore (NaOCl), le peroxyde d’hydrogène (H2O2) et l’Oxygenal 6© (peroxyde
10
Etude
11
Chapitre 1 : Les micro-organismes étudiés
I.
Les levures du genre
Candida
1) Présentation
Les levures du genre Candida sont des organismes eucaryotes, d’une taille de 4 à 10 µm et qui se multiplient par bourgeonnement (Odds, 1988). Ce sont des micro-organismes commensaux et pathogènes opportunistes pour l’Homme (Akpan and Morgan, 2002; Hube, 2004). Le commensalisme est une association entre deux organismes dont seul un organisme (le commensal) tire profit sans pour autant nuire au deuxième (l’hôte). Candida est principalement isolé dans les muqueuses telles que la cavité orale, le tractus gastro-intestinal, le tractus uro-génital ou la peau (Ghannoum et al., 2010; Odds, 1988). Candida a pour la première fois été isolé en 1884 dans l’expectoration d’un patient atteint de tuberculose (Akpan and Morgan, 2002). Sous certaines conditions, par exemple un système immunitaire fragilisé (VIH+, âge, chimiothérapie, …) ou une flore commensale réduite suite à un traitement antibiotique, Candida peut devenir pathogène pour son hôte : on parle donc de pathogène opportuniste.
a) Taxonomie
Les levures du genre Candida appartiennent au règne fongique, plus précisément au phylum des Ascomycètes, à la classe des Saccharomycètes, à l’ordre des Saccharomycétales et à la famille des Saccharomycétacées. Le genre Candida dénombre plus de 300 espèces parmi lesquelles seule une minorité, dont C. albicans, C. tropicalis, C.
glabrata, C. krusei, C. parapsilosis et C. dubliniensis, se retrouve impliquée en pathologie
humaine (Akpan and Morgan, 2002). L’espèce la plus fréquente et de ce fait la plus étudiée est C. albicans.
b) Morphologie
Candida est une levure dimorphique (Douglas, 2003), qui peut exister sous une forme
ovoïde unicellulaire, la blastospore (Figure 1) appelée encore « type levure » et sous une forme filamenteuse pluricellulaire, l’hyphe, caractéristique des champignons (Figure 1). Une troisième forme intermédiaire est retrouvée, le pseudo-hyphe. Les pseudo-hyphes ressemblent à des blastospores allongées, restant attachées entre elles (Figure 1). Ces formes cellulaires possèdent des propriétés différentes, notamment en terme de fonction ; les blastospores seraient plus adaptées pour la dissémination et la survie commensale, alors
12
que les hyphes favoriseraient l’invasion et la pénétration des tissus (Cannon et al., 1995a). La transition morphologique se fait en réponse à différents stimuli environnementaux (Cannon et al., 1995a; Leito et al., 2009), tels que le pH, la température ou encore la présence de nutriments.
Figure 1 : Observations en microscopie électronique à balayage (MEB) des différentes morphologies de C. albicans (Hawser and Douglas, 1994).
2) Pathogénicité
a) Incidence et porteurs sains
Les levures du genre Candida sont isolées de la cavité orale de 20 à 75% de la population générale, sans symptômes associés. En cas de dysfonctionnement du système immunitaire de l’hôte, ces levures sont capables de développer leur caractère pathogène et de causer une grande variété d’infections, nommées candidoses. Ces infections peuvent être superficielles au niveau de la peau et des muqueuses, systémiques au niveau des organes profonds (comme le foie ou les reins), ou encore septicémiques (Douglas, 2003; Trofa et al., 2008). L’incidence des infections fongiques a fortement augmenté depuis les années 1980, notamment dans le milieu hospitalier : les candidoses sont considérées comme la quatrième cause d’infections nosocomiales (Trofa et al., 2008). Avec une mortalité
13
associée de plus de 45%, les infections à Candida spp. sont devenues un réel problème de santé publique (Hawser and Douglas, 1994; Trofa et al., 2008).
C. albicans, C. parapsilosis et C. glabrata représentent plus de 80% des espèces
isolées en cas de candidoses nosocomiales ; C. albicans étant impliquée à elle seule dans 50% des cas (Figure 2) (Akpan and Morgan, 2002; Trofa et al., 2008).
Figure 2 : Pourcentages des espèces de Candida retrouvées dans les candidoses systémiques (entre 1991 et 2008). Le groupe « autres espèces » inclus C. lusitaniae, C.
krusei, C. guilliermondii, C. dubliniensis, et C. rugosa (Trofa et al., 2008).
b) Facteurs de pathogénicité
L’ampleur de l’infection fongique dépend d’une part de facteurs liés à l’hôte dont : -des facteurs intrinsèques tels que l’âge, le sexe ou un affaiblissement général de l’immunité dû à certaines maladies comme le diabète, le VIH ou les cancers (Akpan and Morgan, 2002; Daniluk et al., 2006).
-des facteurs extrinsèques tels que des traitements médicamenteux ou chirurgicaux. Une antibiothérapie à long terme altère la flore microbienne commensale et favorise le développement des candidoses, alors que les procédures invasives comme la pause de cathéters ou de sondes offrent aux levures une porte d’entrée vers la circulation sanguine (Akpan and Morgan, 2002; Daniluk et al., 2006; Trofa et al., 2008).
D’autre part, les levures du genre Candida possèdent un arsenal de facteurs de pathogénicité ; leur combinaison conduira au développement d’une infection chez un hôte affaibli. Les facteurs les plus importants sont :
14
-le dimorphisme,
-la sécrétion d’enzymes lytiques (ex : protéases, phospholipases), qui faciliteront le passage des levures au niveau des tissus,
-l’adhérence, qui représente l’étape initiale de la colonisation des surfaces (vivantes ou inertes).
3) Adhérence et biofilm
Les levures du genre Candida sont capables de se fixer aussi bien à des surfaces vivantes, telles que les cellules épithéliales (buccales ou vaginales), les kératinocytes ou les composants tissulaires (fibronectine, fibrinogène, …), qu’à des surfaces synthétiques comme les plastiques (silicone, chlorure de polyvinyle (PVC), acrylique, …). L’étape d’adhérence, initiatrice de la colonisation fongique, contribue à la formation d’un biofilm.
a) Définition d’un biofilm
La définition d’un biofilm a beaucoup évolué depuis ces 30 dernières années. Actuellement, il est défini comme étant une communauté de micro-organismes attachés de manière irréversible à un substrat (micro-organismes dits sessiles), ancrés dans une matrice de substances polymériques extracellulaires (MEC) qu’ils ont sécrétées, et présentant un phénotype modifié par rapport à leur équivalent planctonique (libres, en suspension) notamment en termes de taux de croissance ou de transcription génique (Donlan and Costerton, 2002). Le biofilm est un système biologique complexe, structuré et dynamique, et représente la forme d’existence microbienne la plus répandue dans la nature (Baillie and Douglas, 1999; Douglas, 2003). Le premier exemple reconnu de biofilm naturel est la plaque dentaire (Douglas, 2003). Il a depuis été démontré qu’un nombre important d’infections humaines étaient liées au développement d’un biofilm microbien (Douglas, 2003).
Les recherches sur les biofilms, après s’être longtemps focalisées sur les exemples bactériens (Baillie and Douglas, 1999), commencent à se concentrer de plus en plus sur les biofilms fongiques, et différents modèles d’étude in vitro commencent à se développer. C.
albicans, espèce la plus impliquée dans les infections, est souvent choisie comme modèle
15
b) Etapes de formation d’un biofilm
La formation d’un biofilm fongique est un processus complexe se déroulant en plusieurs phases dont 3 principales peuvent être distinguées : la phase précoce, la phase intermédiaire et la phase de maturation (Figure 3) (Chandra et al., 2001).
Figure 3 : Représentation schématique des trois phases de développement d’un biofilm de
Candida spp. sur différents supports : PMA (polymétacrylate) (a, b) et ES (élastomère de
silicone) (c, d). MEC : matrice extracellulaire (Chandra et al., 2001).
-phase précoce : les levures, sous forme de blastospores, arrivent à proximité de la surface et vont s’y associer (Figure 3) par l’intermédiaire de facteurs non-spécifiques (forces électrostatiques, hydrophobicité de surface) et spécifiques (reconnaissance
ligands-16
récepteurs de surface). Cette étape, d’environ 11 h, est rapidement suivie par des divisions cellulaires aboutissant à la formation de micro-colonies à la surface du support (Figure 4-1) (Chandra et al., 2001; Paulitsch et al., 2009; Ramage et al., 2005).
-phase intermédiaire : lors de cette phase, les formes hyphes commencent à apparaitre, et la matrice extracellulaire (MEC) est sécrétée (Figure 3). Cette étape se déroule entre 12 et 30 h après l’adhérence initiale des blastospores (Figure 4-2 ; 4-3).
Figure 4 : Observations en MEB des différentes étapes de formation d’un biofilm de C.
albicans (1-5). * : blastospores, b : cellule en bourgeonnement, m : MEC, : hyphes
17
-phase de maturation : au cours de cette phase tardive (31 à 72 h), la matrice polysaccharidique s’épaissit et englobe un réseau fongique (Figure 3) composé de blastospores, d’hyphes et de pseudo-hyphes (Figure 4-4 ; 4-5). Au-delà de 72 h, une quatrième phase débute, avec le détachement de levures seules ou en amas, se retrouvant à l’état planctonique.
c) Architecture
Le biofilm fongique est décrit comme une structure bi-phasique tridimensionnelle composée d’une couche basale de blastospores recouverte d’une couche plus ou moins épaisse constituée de formes filamenteuses et de MEC (Figure 5) (Baillie and Douglas, 1999; Chandra et al., 2001; Paulitsch et al., 2009). La couche basale, peu épaisse (10-12 µm ; environ ¼ de l’épaisseur du biofilm) joue un rôle primordial dans la solidité de l’ancrage du biofilm à la surface (Baillie and Douglas, 1999; Douglas, 2003). La couche plus externe, composée d’hyphes et de MEC est beaucoup plus volumineuse (environ ¾ de l’épaisseur du biofilm) et peut atteindre 450 µm d’épaisseur (Baillie and Douglas, 1999; Chandra et al., 2001).
Figure 5 : Images de microscopie confocale illustrant l’architecture en 3D d’un biofilm mature de C. albicans (a, b). : hyphes (Chandra et al., 2001).
Lors de la maturation du biofilm, des canaux aqueux se forment, permettant de faire circuler les nutriments jusqu’aux couches profondes du biofilm et d’évacuer les déchets métaboliques (Baillie and Douglas, 1999).
18
d) Régulation et QS
La formation d’un biofilm dépend de plusieurs facteurs dont d’une part des facteurs environnementaux tels que la nature de la surface (rugosité, hydrophobicité). En effet les surfaces lisses comme le silicone favorisent beaucoup moins le développement de biofilms que des surfaces plus rugueuses telles que le PVC (chlorure de polyvinyle) (Douglas, 2003; Hawser and Douglas, 1994). Les surfaces peuvent également être recouvertes d’un film de conditionnement protéique qui favorisera l’adhérence des micro-organismes en apportant des ligands supplémentaires et en modifiant les caractéristiques physiques et chimiques de la surface (charge, hydrophobicité, …) (Donlan, 2002; Douglas, 2003). Dans l’exemple de la formation de la plaque dentaire, les dents ou encore les surfaces acryliques des prothèses dentaires sont rapidement recouvertes d’une fine couche de salive appelée pellicule exogène acquise, et qui favorise l’adhérence des micro-organismes (Scannapieco et al., 1995; Zijnge et al., 2010). Le pH du milieu environnant, ainsi que les nutriments et l’oxygène disponibles vont également influer sur la formation du biofilm (Mukherjee et al., 2005).
D’autre part, de nombreuses études ont montré que les micro-organismes à l’intérieur des biofilms présentaient un profil transcriptionnel très différent de celui de cultures planctoniques (Chandra et al., 2001; Donlan, 2002). La voie de régulation génétique de la formation des biofilms de C. albicans, complexe et récemment élucidée, ne sera pas développée dans cette étude bibliographique.
Enfin, la communication intercellulaire, appelée « quorum-sensing » (QS), joue un rôle important dans la formation et le maintien du biofilm (Podbielski and Kreikemeyer, 2004). Les cellules sont capables de communiquer par le biais de molécules qu’elles sécrètent en fonction de la densité cellulaire de la population. Une réponse physiologique et génétique est initiée une fois que la concentration seuil en ces molécules est atteinte (Podbielski and Kreikemeyer, 2004). Deux molécules ont été identifiées pour C. albicans : le tyrosol, qui favorise la formation d’hyphes et de biofilm, et le farnesol qui exerce l’effet inverse (Mukherjee et al., 2005; Ramage et al., 2005).
e) Résistances
Comparé à la croissance planctonique, le développement des micro-organismes au sein d’un biofilm leur procure une meilleure survie. Englobés dans ce micro-environnement, ils se retrouvent protégés contre de nombreuses agressions extérieures telles que les variations de pH, de concentration en nutriments, la dessiccation ou encore la prédation (Donlan, 2002). La croissance sous forme de biofilm permet une proximité entre micro-organismes favorisant les échanges plasmidiques et les coopérations, aboutissant à une forte augmentation de la résistance aux traitements antimicrobiens ou encore aux défenses immunitaires de l’hôte (El-Azizi et al., 2004; Ghigo, 2001).
19
Les micro-organismes sessiles peuvent être mille fois moins sensibles à un traitement antimicrobien que les cellules planctoniques (Chandra et al., 2001). Plusieurs mécanismes de résistance ont été identifiés chez C. albicans (Douglas, 2003; Ramage et al., 2005), par exemple :
-la présence de la MEC constitue une barrière diffusive et permet de ralentir l’accès des molécules antifongiques aux couches profondes du biofilm,
-un état de croissance ralentie, dû à un accès parfois limité en nutriments, surtout dans les couches les plus internes du biofilm, engendre des changements du métabolisme, et notamment dans la composition de la membrane fongique,
-l’expression modifiée de certains gènes durant la formation du biofilm, telles que des gènes codant pour des pompes à efflux qui se retrouvent alors surexprimées à la surface des levures.
4) Infections orales à Candida
a) Infections oropharyngées
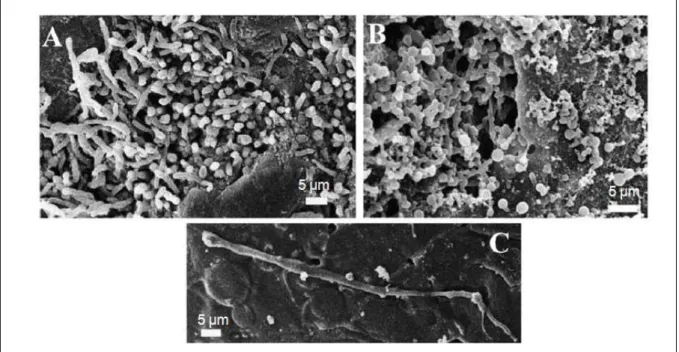
Une grande proportion de la population générale est colonisée par C. albicans au niveau de la cavité buccale (Cannon and Chaffin, 1999), mais seulement une partie de ces individus développeront une candidose orale. Le développement de l’infection est lié à divers facteurs tels que l’âge de l’individu ou encore un état affaibli du système immunitaire ; ainsi dans la population générale, 30-45% des adultes sont des porteurs sains, contre 75% en ne considérant que les personnes ayant une prothèse dentaire (Daniluk et al., 2006), ou 95% en ne considérant que les personnes atteintes du VIH (Akpan and Morgan, 2002). La prothèse dentaire représente un support propice à l’adhérence de micro-organismes oraux tels que les levures du genre Candida, sur lequel ils pourront plus facilement former un biofilm (Figure 6), augmentant ainsi la possibilité de développement d’une infection orale.
Il existe de nombreuses formes cliniques de candidoses oropharyngées, dont les principales sont (Akpan and Morgan, 2002; Bichot, 2012):
-la forme pseudomembraneuse ou « muguet » ; forme la plus commune, retrouvée surtout chez des individus au système immunitaire fragile (nouveau-nés et personnes âgées), des patients atteints de diabètes ou du VIH, sous chimiothérapie ou radiothérapie. Elle se caractérise par l’apparition d’efflorescences blanchâtres, composées de cellules épithéliales desquamées et de cellules fongiques, retrouvées au niveau des muqueuses buccales et labiales, de la langue et du palais,
20
-la forme hyperplasique chronique, caractérisée par des lésions cutanées de la muqueuse buccale et de la langue et fréquemment retrouvée chez les fumeurs,
-la forme atrophique chronique, ou « stomatite » ; retrouvée chez plus de 60% des individus porteurs de prothèses dentaires (O'Sullivan et al., 2000), et caractérisée par des érythèmes localisés au niveau de la prothèse,
-la glossite losangique médiane ; érythème en losange sur la langue atrophiant les papilles, souvent associé au diabète et au tabac,
-la chéilite angulaire ou « perlèche » ; inflammation des commissures des lèvres, souvent bilatérale et récidivante et associée à une carence en fer, en vitamine B12 ou une anémie. Toutes ces infections entraînent un inconfort permanent au niveau buccal, des brûlures, une altération de la sensation de goût et une nutrition compromise (Coco et al., 2008).
Figure 6 : Observations en MEB d’un biofilm de Candida spp. retrouvé sur la prothèse dentaire d’un patient atteint de stomatite (A-C) (Ramage et al., 2004).
b) Prévention
Dés son introduction dans la cavité buccale, la prothèse dentaire se retrouve recouverte de salive et représente un support idéal pour la formation inévitable de biofilms. La prévention des candidoses orales commence par une bonne hygiène de la cavité buccale ; un nettoyage quotidien des dents, de la langue et des prothèses dentaires est fortement recommandé (Akpan and Morgan, 2002). De plus, certains facteurs favorisant le développement de micro-organismes à la surface des prothèses comme le port prolongé des prothèses ou encore pendant la nuit, peuvent être évités (Daniluk et al., 2006).
21
II.
Les amibes libres
1) Présentation
Les amibes libres sont des protozoaires mobiles, organismes unicellulaires eucaryotes se nourrissant par phagocytose, c’est-à-dire par ingestion d’autres micro-organismes. Les amibes libres sont distinguées des amibes dites parasitaires ; la survie de ces dernières dépend de la présence d’un hôte (Schuster and Visvesvara, 2004). Les amibes libres sont capables de se développer et de se disséminer de façon autonome dans l’environnement.
a) Taxonomie
Les amibes libres sont classées dans l’embranchement des Amoebozoa des protozoaires (Thomas et al., 2008). Le groupe des amibes regroupe une grande diversité d’unicellulaires ayant des caractéristiques morphologiques et comportementales communes (Loret and Greub, 2010). Plus de 11000 espèces ont été recensées, dont seule une minorité est responsable d’infections chez l’Homme.
b) Morphologie
Les amibes libres ont une taille variable allant de quelques dizaines de micromètres à plusieurs centaines (Figure 7).
Elles existent sous deux formes principales : le trophozoïte, forme végétative métaboliquement active, qui est capable de se nourrir de micro-organismes, de se déplacer et de se multiplier, (Figure 8-a) et le kyste, forme de résistance (Figure 8-b) (Greub and Raoult, 2004; Thomas et al., 2008). Le kyste est de forme arrondie et est composé de deux parois, l’endokyste et l’ectokyste (Greub and Raoult, 2004; Smirnov and Michel, 1999). Cette structure explique la résistance élevée des kystes à de nombreuses agressions, telles que les traitements chimiques ou les changements de température.
22
Figure 7 : Observations en microscopie optique de différents genres d’amibes libres :
Playtamoeba (A), Acanthamoeba (B, D et K), Vanella (C), Glaeseria (E), Hartmannella (F et
I), Naegleria (G et H) et Echinamoeba (J) (Thomas et al., 2008).
Lorsque les conditions de culture deviennent défavorables (manque de nutriments, température ou pH non optimaux), les trophozoïtes sont capables de s’enkyster. Ce processus est réversible ; le kyste pourra redonner un trophozoïte après désenkystement, lorsque l’environnement redeviendra plus clément (Greub and Raoult, 2004).
Figure 8 : Observations en microscopie optique d’un trophozoïte (a) et de kystes (b) d’Acanthamoeba castellanii (x1000). n : noyau, cv : vacuole. (Visvesvara et al., 2007).
23
c) Environnement et prédation
Les amibes libres sont des protozoaires ubiquitaires de l’environnement. Elles sont retrouvées dans l’air, les sols, les eaux naturelles (lacs, rivières, mers) et les eaux artificielles (systèmes de distribution, tours aéro-réfrigérantes, piscines, …) (Greub and Raoult, 2004; Horn et al., 2000; Rohr et al., 1998; Wadowsky et al., 1991). Ces prédateurs ont un rôle important au sein des écosystèmes qu’ils colonisent ; en se nourrissant de micro-organismes, ils participent au maintien et au contrôle des populations microbiennes (Hoffmann and Michel, 2001; Weekers et al., 1993). Les amibes libres sont capables de se nourrir de bactéries, de champignons, de levures (Steenbergen et al., 2001), d’algues et même d’autres protozoaires (Horn et al., 2000) par phagocytose (Figure 9A-D). Les trophozoïtes ont tendance à mieux se déplacer sur les surfaces plutôt qu’en suspension, et vont donc préférer les micro-organismes sessiles (Pickup et al., 2007) ; les biofilms représentent une source idéale pour le grignotage des amibes (Huws et al., 2005; Pickup et
al., 2007). Par exemple, A. castellanii est capable de digérer 90 bactéries
sessiles/amibe/heure (Huws et al., 2005).
Figure 9 : Observations en microscopie électronique à transmission (MET) de la phagocytose de Legionella pneumophila par Hartmannella vermiformis (A-D) et de sa réplication à l’intérieur de l’amibe (E-F) (Greub and Raoult, 2003).
24
d) ARB et endosymbiotes
Certains micro-organismes ont développé la capacité de résister d’une part à la prédation, en adoptant une forme morphologique plus indigeste (micro-colonies ou filaments de grande taille), ou en augmentant leur mobilité pour échapper aux protozoaires (Matz and Jürgens, 2005).
D’autre part certains micro-organismes sont capables de résister à la phagocytose, et de se multiplier à l’intérieur des amibes (Figure 9E-F) (Brown and Barker, 1999; Greub and Raoult, 2003; Molmeret et al., 2005) : ils sont appelés ARB (amoeba-resistant bacteria) (Greub and Raoult, 2004). Certains ARB sont des bactéries intracellulaires obligatoires, d’autres facultatives et beaucoup d’entre eux sont pathogènes pour l’Homme (Greub and Raoult, 2004; Horn et al., 2000; Molmeret et al., 2005).
Les amibes libres sont considérées comme de véritables « Chevaux de Troie » du monde microbien (Figure 10) (Brown and Barker, 1999; Molmeret et al., 2005) car elles peuvent héberger dans leur cytoplasme, et surtout protéger des traitements et des conditions défavorables de croissance, de nombreux micro-organismes potentiellement pathogènes pour l’Homme (Kuchta et al., 1993; Rohr et al., 1998).
Les ARB se multiplient à l’intérieur de l’amibe et finissent par lyser la cellule hôte afin de se disséminer dans l’environnement (Figure 10) (Greub and Raoult, 2004); l’exemple le plus étudié jusqu’à présent est le cas de Legionella pneumophila, bactérie pathogène qui est capable de se multiplier à l’intérieur de différentes espèces d’amibes libres (Figure 9E-F) (Kuchta et al., 1993; Molmeret et al., 2005). Le développement intra-amibien de levures est beaucoup moins étudié, cependant un exemple d’interaction levures-amibes a été démontré avec le cas de Cryptococcus neoformans, capable de se multiplier dans le cytoplasme d’Acanthamoeba castellanii (Steenbergen et al., 2001).
L’amibe joue le rôle de réservoir à bactéries mais également de terrain d’entrainement (Molmeret et al., 2005) : capables de résister à la phagocytose des amibes, les bactéries seront plus facilement capables de résister aux macrophages humains par exemple (Figure
25
Figure 10 : Schéma du rôle des amibes libres en tant que réservoir et vecteur de transmission de bactéries (Greub and Raoult, 2004).
D’autres ARB sont considérés comme étant des endosymbiotes ; l’endosymbiose est définie comme une cohabitation harmonieuse de deux micro-organismes dans laquelle l’un des partenaire se multiplie à l’intérieur de l’autre (Greub and Raoult, 2004). Environ 20% des souches d’Acanthamoeba isolées de l’environnement abritent des endosymbiotes bactériens (Molmeret et al., 2005).
2) Principaux genres amphizoïques
Les amibes libres amphizoïques sont des protozoaires ubiquitaires dans l’environnement qui peuvent également vivre occasionnellement dans les tissus humains et animaux en tant que parasites (Visvesvara et al., 2007). Ces amibes peuvent alors être
26
responsables d’infections. Quatre genres principaux ont été décrits (Schuster and Visvesvara, 2004; Visvesvara et al., 2007).
a) Acanthamoeba
Isolé pour la première fois dans un échantillon de poussière, le genre Acanthamoeba dénombre aujourd’hui plus de 24 espèces différentes réparties en trois groupes selon des critères morphologiques des kystes (Gravel, 2009; Visvesvara et al., 2007). La principale caractéristique du genre est la présence d’acanthopodes à la surface du trophozoïte (Figure
8-a) ; ces prolongements cytoplasmiques en forme d’épines permettent à l’amibe de
phagocyter ses proies. Le trophozoïte mesure entre 15 et 50 µm et le kyste entre 10 et 25 µm (Visvesvara et al., 2007). Les amibes du genre Acanthamoeba sont isolées dans une grande variété d’habitats tels que les sols, les eaux de mer, les réseaux d’eau, les systèmes de ventilation ou encore les appareils de dialyse (Hoffmann and Michel, 2001; Schuster and Visvesvara, 2004). La double paroi du kyste leur permet de résister à des températures extrêmes et même aux traitements de décontamination de l’eau (chloration ou filtration) ; elles peuvent ainsi être retrouvées dans l’eau de distribution à une concentration de 1000 à 10000 amibes/L (Scat et al., 1995).
Ce genre amibien est particulièrement étudié car il est connu pour être capable d’héberger dans son cytoplasme des bactéries pathogènes telles que L. pneumophila ou encore Vibrio
cholerae (Axelsson-Olsson et al., 2010; Kuchta et al., 1993; Laskowski-Arce and Orth, 2008;
Schuster and Visvesvara, 2004).
b) Balamuthia
Ce genre amibien, assez proche d’Acanthamoeba, a été isolé pour la première fois dans les années 1980, chez un mandrill (babouin) ; d’où l’appellation de la principale espèce de ce genre, B. mandrillaris (Visvesvara et al., 2007). Le trophozoïte est pléomorphique et mesure entre 12 et 60 µm, alors que le kyste arrondi possède une paroi externe ondulée et mesure environ 15 µm (Figure 11). Cette amibe est beaucoup moins étudiée et difficilement isolée ; elle est principalement retrouvée dans les sols (Schuster and Visvesvara, 2004).
Figure 11 : Observations en microscopie optique d’un trophozoïte (a) et d’un kyste (b) de
27
c) Naegleria
Cette amibe a la particularité de posséder, en plus des formes trophozoïte (10-25 µm) et kyste (10 µm), une troisième forme flagellée d’environ 10-16 µm et très mobile (Figure
12). Le kyste possède une paroi assez fine et percée de pores, ce qui le rend beaucoup plus
fragile que d’autres genres amibiens.
Ce genre compte plus de 30 espèces mais la seule espèce pathogène est N. fowleri (Schuster and Visvesvara, 2004; Visvesvara et al., 2007). Beaucoup moins ubiquitaire qu’Acanthamoeba, Naegleria est isolée dans les sols et les eaux et peut survivre jusqu’à une température de plus de 45°C (Gravel, 2009; Hoffmann and Michel, 2001; Visvesvara et al., 2007).
Figure 12 : Observations en microscopie optique d’un trophozoïte (a), d’un flagellé (b) et d’un kyste (c) de Naegleria fowleri (x1000). n : noyau et u : partie postérieure (Visvesvara et
al., 2007).
d) Sappinia
Ce genre amibien, dont la principale espèce est S. diploidea, a été isolé des sols, des eaux douces et de matières fécales animales. Le trophozoïte (40-80 µm) ainsi que le kyste (15-30 µm) ont la particularité d’être diploïdes, c’est-à-dire d’avoir deux noyaux (Figure 13). Un seul cas d’infection impliquant cette amibe a été recensé chez l’Homme (Schuster and Visvesvara, 2004; Visvesvara et al., 2007).
Figure 13 : Observations en microscopie optique d’un trophozoïte (b), et de kystes (c) de
28
e) Vahlkampfia – Hartmannella
D’autres genres amibiens ont été isolés chez l’Homme et l’animal (cavité nasale, muqueuses intestinale et vaginale, …), toutefois leur adaptation à la température du corps humain ne signifie pas que ces amibes soient pathogènes (Mat Amin et al., 2004; Schuster and Visvesvara, 2004). Parmi ces genres, certains tels que Vahlkampfia et Hartmannella ont été isolés dans des cas de co-infections (Aimard et al., 1998; Aitken et al., 1996; Inoue et
al., 1998; Kinnear, 2003). Leur caractère de pathogènes opportunistes est depuis très
controversé (De jonckheere and Brown, 1998).
Le genre Hartmannella, dont la principale espèce est H. vermiformis, a été décrit pour la première fois en 1967 (Page, 1967). Le trophozoïte est pléomorphique et mesure 20-30 µm (Figure 14), alors que le kyste, très arrondi et ayant une double paroi, mesure 10-15 µm (Figure 14) (Smirnov and Michel, 1999). Ce protozoaire thermotolérant est principalement retrouvé dans les milieux aquatiques, et peut survivre jusqu’à une température de 55°C (Kuiper et al., 2006; Rohr et al., 1998). 71% des amibes retrouvées dans l’eau de réseau ou des tours aéro-réfrigérantes appartiennent à l’espère H. vermiformis (Breiman et al., 1990; Cateau et al., 2008). Cette amibe a même été retrouvée dans des circuits de décontamination des eaux, après avoir résisté à différents traitements physiques et chimiques (Hoffmann and Michel, 2001; Thomas et al., 2008). H. vermiformis, tout comme
Acanthamoeba, est capable de permettre à de nombreuses bactéries, dont certaines
pathogènes, de se développer à l’intérieur de son cytoplasme (Figure 9) (Axelsson-Olsson et
al., 2010; Cateau et al., 2008; Horn et al., 2000; Santic et al., 2011; Wadowsky et al., 1991).
Figure 14 : Observations en microscopie optique d’un trophozoïte (1), et d’un kyste (4) de