Modulation de l’expression de gènes reliés à la
virulence et au stress chez Porphyromonas gingivalis
par les polyphénols du thé vert
Mémoire
Jade Fournier Larente
Maîtrise en microbiologie
Maître ès science (M.Sc.)
Québec, Canada
RÉSUMÉ
Dans ce projet, la capacité des polyphénols du thé vert à moduler l’expression de certains gènes chez Porphyromonas gingivalis, le principal agent étiologique de la parodontite chronique, a été évaluée. Une analyse par PCR quantitative a démontré qu’à des concentrations sous-inhibitrices, l’extrait de thé vert ainsi que l’épigallocatéchine-3-gallate (EGCG) réduisent à différents degrés le niveau d’expression de gènes codant pour d’importants facteurs de virulence chez P. gingivalis. Ces facteurs participent notamment à la colonisation, l’acquisition des nutriments et la destruction tissulaire. De plus, les deux composés ont augmenté le niveau d’expression du gène codant pour la protéine de résistance au stress HtrA chez P. gingivalis. Les résultats de cette étude suggèrent que le thé vert et l’EGCG pourraient contribuer à réduire la virulence de P. gingivalis, supportant ainsi une potentielle utilisation pour la prévention et le traitement de la parodontite.
TABLE DES MATIÈRES
RÉSUMÉ ... III TABLE DES MATIÈRES ... V LISTE DES FIGURES ... VII LISTE DES TABLEAUX ... IX LISTE DES ABRÉVIATIONS ... XI REMERCIEMENTS ... XV 1 INTRODUCTION ... 1 1.1 Structure du parodonte ... 1 1.2 Maladies parodontales ... 2 1.2.1 Généralités ... 2 1.2.1.1 Gingivite ... 2 1.2.1.2 Parodontite ... 2
1.3 Étiologie des maladies parodontales ... 5
1.3.1 Composante bactérienne ... 5
1.3.1.1 Parodontopathogènes ... 5
1.3.1.2 Porphyromonas gingivalis ... 6
1.3.1.2.1 Facteurs de virulence ... 7
1.3.1.2.2 Mécanismes de réponse aux stress ... 10
1.3.2 Composante inflammatoire ... 11 1.4 Polyphénols ... 12 1.4.1 Généralités ... 12 1.4.2 Classification ... 12 1.4.3 Thé ... 14 1.4.4 Thé vert ... 15 1.4.4.1 Composition ... 16
1.4.4.2 Effets bénéfiques sur la santé générale ... 17
1.4.4.3 Effets bénéfiques sur la santé buccale ... 17
1.4.4.3.1 Halitose ... 17 1.4.4.3.2 Carie dentaire ... 18 1.4.4.3.3 Parodontite ... 19 2 PROBLÉMATIQUE ... 21 2.1 Hypothèse de recherche ... 21 2.2 Objectifs ... 21 3 MATÉRIEL ET MÉTHODES ... 23 3.1 Composantes à l’étude ... 23
3.2 Souche bactérienne et conditions de croissance ... 23
3.3 Détermination des concentrations minimales inhibitrices ... 24
3.4 Traitements de Porphyromonas gingivalis ... 24
3.4.1 Évaluation de l’expression de gènes ... 25
3.4.1.2 Évaluation de la pureté et de la concentration des ARN ... 25
3.4.1.3 Préparation des ADN complémentaires par transcriptase inverse ... 26
3.5 Préparation des amorces ... 26
3.6 PCR quantitative ... 27
3.7 Analyse statistique ... 29
4 RÉSULTATS ... 31
4.1 Concentrations minimales inhibitrices ... 31
4.2 Expression des gènes codant pour les facteurs de virulence ... 31
4.2.1 Effet de l’extrait de thé vert ... 31
4.2.2 Effet de l’EGCG ... 35
4.1 Expression du gène codant pour la protéine de stress HtrA ... 39
4.1.1 Effet de l’extrait de thé vert ... 40
4.1.2 Effet de l’EGCG ... 41
5 DISCUSSION ... 43
6 ANNEXE ... 53
LISTE DES FIGURES
Figure 1 : Représentation schématique des tissus de soutien de la dent (figure traduite et adaptée de Encyclopædia Britannica, Inc. 2013). ... 1 Figure 2 : Représentation des complexes bactériens selon Socransky et collaborateurs (28). ... 6 Figure 3 : Modes de production et composition en polyphénols des divers thés (figure adaptée de Cooper et collaborateurs (80)). ... 15 Figure 4 : Structure moléculaire de l’épigallocatéchine-3-gallate. ... 16 Figure 5 : Effets de concentrations croissantes d’extrait de thé vert sur l’expression des gènes codant pour les facteurs de colonisation HagA, HagB et FimA chez P. gingivalis ATCC 33277. ... 33 Figure 6 : Effets de concentrations croissantes d’extrait de thé vert sur l’expression des gènes codant pour les facteurs impliqués dans la destruction tissulaire et l’inactivation des mécanismes de défense de l’hôte soit les protéases RgpA et Kgp chez P. gingivalis ATCC 33277. ... 34 Figure 7 : Effets de concentrations croissantes d’extrait de thé vert sur l’expression du gène codant pour l’hémolysine chez P. gingivalis ATCC 33277. ... 35 Figure 8 : Effets de concentrations croissantes d’EGCG sur l’expression des gènes codant pour les facteurs de colonisation HagA, HagB et FimA chez P. gingivalis ATCC 33277. ... ... 37 Figure 9 : Effets de concentrations croissantes d’EGCG sur l’expression des gènes codant pour les facteurs impliqués dans la destruction tissulaire et l’inactivation des mécanismes de défense de l’hôte soit les protéases RgpA et Kgp chez P. gingivalis ATCC 33277. ... 38 Figure 10 : Effets de concentrations croissantes d’EGCG sur l’expression du gène codant pour l’hémolysine chez P. gingivalis ATCC 33277. ... 39 Figure 11 : Effets de concentrations croissantes d’extrait de thé vert sur l’expression du gène codant pour la protéine de stress HtrA chez P. gingivalis ATCC 33277. ... 40 Figure 12 : Effets de concentrations croissantes d’EGCG sur l’expression du gène codant pour la protéine de stress HtrA chez P. gingivalis ATCC 33277. ... 41
LISTE DES TABLEAUX
Tableau 1 : Classification des polyphénols. ... 14 Tableau 2 : Composition de l’extrait de thé vert GT#9. ... 23 Tableau 3 : Amorces utilisées pour la quantification de l’expression des gènes chez P.
LISTE DES ABRÉVIATIONS
C g l ADN ADNc ARN ATCC CD CH3SH CMI CO2 DL-C DNase DO EC ECG EGC EGCG EMMPRIN g GAPDH GCG GT9 h H2 H2S ICAM IL L LPS MAPK METase ml mM MMP MOI Degré Celsius Microgramme Microlitre Acide désoxyribonucléique ADN complémentaire Acide ribonucléiqueAmerican Type Culture Collection Cluster of differentiation
Méthyl mercaptan
Concentration minimale inhibitrice Dioxyde de carbone DL-Catéchines Désoxyribonucléase Densité optique Épicatéchine Épicatéchine gallate Épigallocatéchine Épigallocatéchine-3-gallate
Extracellular matrix metalloproteinase inducer
Gramme
Glycéraldéhyde-3-phosphate déshydrogénase
Gallate catéchine gallate
Green tea #9
Heure Dihydrogène
Sulfure d’hydrogène
Intercellular adhesion molecule Interleukine
Litre
Lipopolysaccharide
Mitogen-activated Protein Kinase
L-méthionine-α-deamino-γ-mercaptomethane-lyase Millilitre
Millimolaire
Métalloprotéinase matricielle
MTS MTT MUC-1 N2 NF-B nm pb PCR % qPCR THB-HK TNF- TREM-1 Unité 3-[4,5-dimethylthiazol-2-yl]-5-(3-carboxymethoxyphenyl)-2-(4-sulfophenyl)-2H-tetrazolium
3-[4, 5-dimethylthiazol-2-yl]-2, 5-diphenyltetrazolium bromide Mucine-1
Diazote
Facteur nucléaire kappa B Nanomètre
Paires de bases
Polymerase chain reaction
Pourcentage
Quantitative polymerase chain reaction
Todd Hewitt broth-hémine-vitamine K
Facteur de nécrose tumorale alpha
Triggering receptor expressed on myeloid cells-1
There are some bacteria that cause a disease, but there are some diseases that bring about a condition that is ideal for the growth of some bacteria.
REMERCIEMENTS
J’adresse mes remerciements sincères à ceux et celles qui ont participé de près ou de loin à la réalisation de ce projet.
Tout d’abord, à mon directeur de recherche Dr Daniel Grenier pour avoir été aussi présent, pour son aide précieuse et pour le temps qu’il a bien voulu consacrer à répondre à toutes mes questions et inquiétudes, sans lui, ce mémoire n'aurait jamais vu le jour.
Je voudrais également remercier les membres de mon comité aviseur, Dr Michel Frenette et Dre Fatiha Chandad, pour leurs conseils qui ont été des atouts à l’élaboration et à la réussite de ce projet.
Je voudrais exprimer ma reconnaissance envers mes collègues qui m’ont transmis leur expertise et aider dans les moments d’incertitude. Je veux aussi vous dire merci de rendre le laboratoire aussi vivant et chaque journée aussi agréable!
Un merci particulier à Laetitia Bonifait, qui a été mon mentor de microbiologie. Merci pour les gants roses qui m’attendaient à mon arrivée au labo; j’avais les plus beaux pour faire mes qPCR!
Merci à ma mère et ma sœur qui ont toujours été là pour moi, qui m’ont soutenue et encouragée tout au long de mes études. Je tiens également à remercier mon copain pour sa compréhension, son écoute et ses encouragements. J’y suis arrivée grâce à vous!
Enfin, je désire remercier mes amis pour leur présence et leur compagnie tant bien lors des cours que dans les heures interminables d’étude et de travail!
1 INTRODUCTION
1.1 Structure du parodonteLe parodonte représente l’ensemble des tissus entourant et servant au soutien des dents. Il comprend différentes structures dont la gencive, l’os alvéolaire, le cément et le ligament parodontal (1) (Figure 1). La gencive fait partie de la muqueuse buccale et représente la structure visible entourant la dent. L’os alvéolaire sert au maintien de la dent dans l’arcade maxillaire et forme l’alvéole dentaire (1). Le cément est une structure avasculaire et non innervée qui tapisse la surface externe de la dentine au niveau de la racine et qui assure l’attache des fibres du ligament parodontal. Ce dernier, aussi appelé desmodonte, se situe entre les racines et l’os alvéolaire et assure l’ancrage de la dent dans l’alvéole dentaire (2).
Figure 1 : Représentation schématique des tissus de soutien de la dent (figure traduite et adaptée de Encyclopædia Britannica, Inc. 2013).
1.2 Maladies parodontales
1.2.1 Généralités
Les maladies parodontales sont des maladies inflammatoires d’origine bactérienne affectant les tissus entourant et supportant les dents. Elles représentent les principales affections de la cavité buccale avec la carie dentaire. Les maladies parodontales constituent un problème de santé important dans la population (3). Il en existe 2 principales, soit la gingivite et la parodontite.
1.2.1.1 Gingivite
La gingivite est la maladie parodontale la plus répandue. Elle a une grande prévalence chez les adultes et est ubiquitaire chez les enfants (4, 5). Environ 50% de la population nord-américaine souffre de cette maladie et des proportions similaires ont été observées pour d’autres pays (4). La gingivite correspond à une inflammation des gencives engendrant de la rougeur, un gonflement et le saignement des gencives, le tout, ne menant pas à une perte d’attache de la dent (6-8). Cette maladie est réversible, et ce, par une meilleure hygiène buccale et dans certains cas un traitement dentaire. Cependant, lorsque non traitée, la gingivite peut mener à une maladie parodontale beaucoup plus sévère, soit la parodontite (6, 9).
1.2.1.2 Parodontite
La parodontite se définit comme une maladie inflammatoire sévère et progressive affectant l’ensemble des structures de soutien de la dent. La prévalence varie selon le sexe, la race et la région géographique. En Amérique du Nord, environ 40% de la population présente des symptômes de parodontite et au niveau mondial entre 5 et 15% de la population est atteinte d’une forme sévère de parodontite (4, 10). La parodontite progresse par phases cycliques de recrudescence, de rémission et de latence qui sont en étroite relation avec l’efficacité de la
réponse immunitaire de l’hôte. Il existe différentes formes de parodontite, dont la parodontite chronique et la parodontite agressive. La parodontite chronique affecte principalement les adultes et les personnes âgées, et correspond à la forme la plus commune de parodontites chez ces groupes d’âge (11). Elle peut être subdivisée en parodontite généralisée ou localisée, selon son étendue. Le principal agent étiologique responsable de cette forme est Porphyromonas gingivalis (9, 12). La parodontite agressive, quant à elle, diffère de la parodontite chronique par sa prévalence très faible et son évolution très rapide. Même si cette forme débute vers l’adolescence, elle n’est souvent cliniquement diagnostiquée que vers les 20-30 ans (13, 14).
Plusieurs facteurs peuvent prédisposer un individu au développement d’une parodontite. Comme déjà mentionné, les adultes et les personnes âgées sont principalement atteints, et un homme s’avère plus propice qu’une femme au développement d’une parodontite (3, 15). Également, une personne souffrant de diabète verra ses chances de développer la maladie tripler comparativement à un non-diabétique (16, 17). D’autres problèmes de santé comme l’obésité et le SIDA peuvent aussi être considérés comme étant des facteurs de risques pour la parodontite (18-20). De plus, les fumeurs ont un risque plus élevé puisque la cigarette a un effet immunosuppresseur, diminuant ainsi l’efficacité d’élimination des microorganismes pathogènes, en plus d’augmenter l’adhésion des bactéries aux cellules épithéliales (19).
Tel que mentionné précédemment, certaines maladies peuvent mener au développement de la parodontite, toutefois, la parodontite peut elle aussi prédisposer au développement de maladies. Par exemple, le diabète peut être à la fois une cause et une conséquence de la maladie (21). De plus, la parodontite peut être responsable du développement de maladies cardiovasculaires et de problèmes respiratoires, telle la pneumonie. Elle peut également augmenter les risques de naissance prématurée et de bébés prématurés de petits poids (19).
La parodontite chronique découle souvent d’une gingivite non traitée. En effet, la plaque dentaire, également connue sous le nom de biofilm dentaire (22), présente dans les sites supragingivaux, ainsi que le tartre vont progresser sous la gencive provoquant ainsi la
destruction du ligament parodontal. Ce ligament étant attaché au cément, un détachement de la gencive se produira, créant du fait même une poche parodontale (9). Lors de la progression de la maladie, les populations bactériennes colonisant les sites sous-gingivaux vont gagner en importance et intensifier la réaction inflammatoire. L’évolution de la maladie va se faire progressivement et sur une longue période de temps au cours de laquelle les populations bactériennes se modifieront. La microflore buccale, habituellement constituée de bactéries anaérobies facultatives à Gram-positif, deviendra majoritairement composée de bactéries anaérobies strictes à Gram-négatif, ce qui caractérise le passage vers un état pathologique (23, 24). À plus long terme, s’il y a absence de traitement, l’os alvéolaire pourra être affecté et se dégrader de telle sorte qu’il y aura perte de la dent.
Il est possible de traiter la parodontite, mais les dommages causés s’avèrent permanents. Le traitement de la maladie doit être adapté selon l’individu, mais est réalisé suivant deux étapes essentielles. La première étape consiste en un détartrage qui permet d’enlever la plaque et le tartre s’étant formés dans la poche parodontale. La deuxième étape implique un surfaçage radiculaire. Un polissage de la racine de la dent est réalisé afin de favoriser le rattachement de l’épithélium à la dent et la guérison (12). Advenant que certains sites ne répondent pas au traitement, une chimiothérapie peut être ajoutée pour l’élimination des parodontopathogènes (12, 25). Par exemple, la doxycycline pourra être administrée localement ou par voie systémique, alors que la chlorhexidine sera administrée localement (26). De plus, avoir recours à la chirurgie pourra corriger les défauts et permettre une régénération osseuse (3). Le détartrage et le surfaçage radiculaire combinés avec des mesures personnelles d’élimination de la plaque, comme le brossage et l’utilisation de la soie dentaire, ont été prouvés comme permettant à eux seuls un retour vers une flore normale, soit exempte de P. gingivalis (12). Une réduction de la quantité de P. gingivalis des sites parodontaux est souvent indicatrice d’une résolution de la maladie (27).
1.3 Étiologie des maladies parodontales
1.3.1 Composante bactérienne
1.3.1.1 Parodontopathogènes
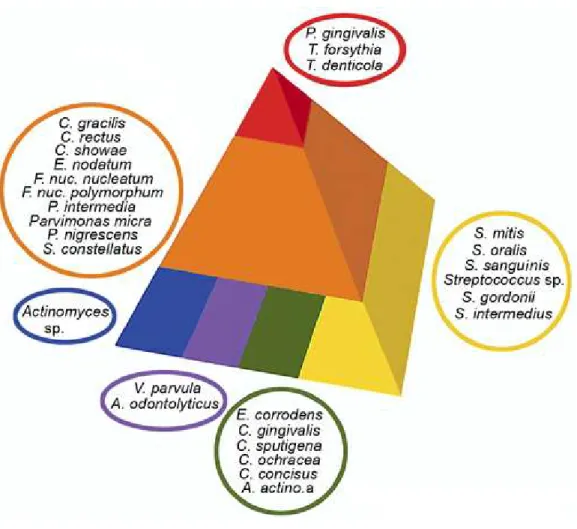
Les maladies parodontales sont des maladies d’origine polymicrobienne causées par un groupe de bactéries appelées parodontopathogènes. Il a été découvert, grâce aux travaux réalisés par Socransky et collaborateurs, que les parodontopathogènes présents dans les sites sous-gingivaux se présentent sous forme de complexes bactériens (28) (Figure 2). Ce groupe de chercheurs a décrit six complexes représentant la séquence de colonisation et marquant le début de la maladie. À l’état sain, le complexe jaune regroupant les bactéries du genre Streptococcus, le complexe mauve constitué des espèces Actinomyces
odontolyticus et Veillonella parvula, en plus du complexe vert comportant les bactéries du
genre Capnocytophaga ainsi que les espèces Eikenella corrodens et Aggregatibacter
actinomycetemcomitans (sérotype a), colonisent la surface de la dent avec les Actinomyces
(complexe bleu). Ces quatre complexes représentent les colonisateurs primaires. Le début de l’état pathologique est marqué par l’apparition du complexe orange, comportant les bactéries des genres Campylobacter, Fusobacterium, Eubacterium, Prevotella,
Peptostreptococcus et Streptococcus. Le complexe rouge représente les colonisateurs
tardifs et est associé, avec le complexe orange, aux stades avancés des parodontites. Le complexe rouge est plus spécifiquement associé à la forme chronique et est composé de trois bactéries soit P. gingivalis, le principal agent étiologique de la parodontite chronique,
Figure 2 : Représentation des complexes bactériens selon Socransky et collaborateurs (28).
1.3.1.2 Porphyromonas gingivalis
P. gingivalis est une bactérie asaccharolytique à Gram négatif, anaérobie stricte, qui
morphologiquement se présente sous forme de coccobacille, d’environ 2 µm de longueur et 1 µm de diamètre, isolé ou en courte chaîne. Cette bactérie est souvent retrouvée dans les sites sous-gingivaux de par la faible teneur en oxygène qui y est retrouvée. Comme mentionné précédemment, P. gingivalis est l’un des principaux agents étiologiques responsables de la parodontite, plus spécifiquement de la forme chronique. Sur gélose sang, cette bactérie a la particularité de former des colonies à pigmentation noire résultant de l’accumulation dans ses membranes de protoporphyrine dérivée de l’hémine contenue dans le milieu (27). Ce sont les différents mécanismes de pathogénicité de cette bactérie qui lui
permettent de coloniser la cavité buccale, de contourner le système immunitaire et d’engendrer la destruction tissulaire.
1.3.1.2.1 Facteurs de virulence
Les facteurs de virulence ont d’abord été décrits comme étant des composantes bactériennes ayant un effet néfaste sur les cellules hôtes. La bactérie P. gingivalis possède plusieurs facteurs contribuant à sa virulence lui permettant entre autres de : coloniser les sites sous-gingivaux, provoquer la destruction tissulaire et contourner les systèmes de défense.
Différents fimbriae (0.3 à 3 µm de longueur par 5 nm de largeur) se présentent de façon péritriche à la surface de P. gingivalis. Les fimbriae majeurs de type I (FimA) se trouvant à la surface de P. gingivalis permettent la colonisation des sites sous-gingivaux. Ils sont responsables de l’adhérence initiale de la bactérie à l’intérieur de la poche parodontale, c’est-à-dire à la surface de la dent ou au biofilm déjà présent. Le gène de FimA n’est présent qu’en une seule copie sur le chromosome de la bactérie et la séquence protéique ne présente pas d’homologie avec d’autres protéines fimbriales (29). Chez P. gingivalis, on compte 6 génotypes de fimbriae appelés type I à V et Ib. À cause de leur longueur, les fimbriae majeurs ont été proposés comme étant la première structure de la bactérie à entrer en contact avec les surfaces et les colonisateurs primaires (29). En effet, FimA est responsable de la coadhésion à différentes bactéries par l’entremise de différents récepteurs, dont la glycéraldéhyde-3-phosphate (GAPDH) déshydrogénase chez certains streptocoques. En plus des fimbriae majeurs, on retrouve également à la surface de la bactérie des fimbriae mineurs qui permettent eux aussi la coadhésion aux bactéries déjà présentes (29-32). Ces fimbriae proviennent du gène mfa1 codant pour la sous-unité protéique Mfa. Par ailleurs, les fimbriae majeurs stimulent les cellules de l’hôte et déclenchent une réponse inflammatoire. En réponse au fimbriae, les cellules épithéliales et les monocytes vont sécréter des cytokines pro-inflammatoires via l’activation du CD14 et de la voie NF-B (29). Il a été démontré que la production de cytokines par les cellules dendritiques est grandement diminuée lorsque P. gingivalis n’exprime pas de fimbriae majeur (33).
Des protéines membranaires, comme les hémagglutinines (HagA à E) contribuent également à l’établissement de la bactérie dans les sites sous-gingivaux (34). Ces protéines permettent la liaison de la bactérie à des récepteurs, comme les oligosaccharides présents sur les cellules humaines. Elles permettent l’adhésion de la bactérie à la surface des érythrocytes pour faciliter l’acquisition de nutriments. En effet, l’inactivation des gènes
hagA, hagB et hagC a démontré une diminution de l’activité d’hémagglutination de la
bactérie (35).
P. gingivalis possède également des facteurs contribuant à l’inactivation des mécanismes
de défense de l’hôte et à la destruction tissulaire, soit les protéinases. Ces dernières appartiennent à la famille des cystéines protéinases et se retrouvent à la surface de la membrane de P. gingivalis ou sont sécrétées sous forme soluble (36). P. gingivalis possède trois protéinases majeures, aussi connues sous le nom de gingipaïnes, possédant une activité amidolytique pour des acides aminés spécifiques. L’Arg-gingipaïne A et B (RgpA, RgpB) clivent la région carboxy-terminale des résidus arginine alors que la Lys-gingipaïne (Kgp) clive la région carboxy-terminale des résidus lysine (37). RgpA ainsi que Kgp possèdent des domaines hémagglutinines qui contribuent à la colonisation de la cavité buccale par P. gingivalis (38). Les adhésines des Rgp permettent l’adhésion de P.
gingivalis aux cellules épithéliales alors que leurs domaines catalytiques permettent la
désorption des bactéries (39). Une étude a démontré que des mutants n’exprimant pas certaines protéinases montraient une capacité atténuée à former des biofilms (40, 41).
De plus, les protéinases ont la capacité de dégrader des protéines structurales comme le collagène de type I, III, IV et V, la fibronectine et les laminines (42). En effet, les Arg-gingipaïnes sont des collagénases responsables de la dégradation du collagène de type I. Des essais réalisés ont démontré que leur inactivation entraînait une perte de la capacité de
P. gingivalis à dégrader le collagène de type I. C’est la forme associée à la membrane de
ces protéases qui est responsable de la dégradation la plus efficace de ces fibres de collagène (43). La destruction tissulaire qui marque la progression de la parodontite résulte de la dégradation de la protéine constituant majoritairement les tissus parodontaux par les protéases, soit le collagène de type I. Les protéases contribuent également au saignement
lors du sondage par la dégradation du fibrinogène (38). La dégradation de la fibronectine par les protéases de P. gingivalis permet aussi d’exposer des récepteurs présents à la surface des cellules, soit les cryptitopes. Ces récepteurs n’étant habituellement pas disponibles vont permettre l’attachement de la bactérie et ainsi contribuer à la capacité d’adhérence de P. gingivalis (44).
Certaines immunoglobulines, en plus des cytokines et du CD14 à la surface des monocytes, peuvent être dégradés par les protéinases, contribuant ainsi à la progression et au maintien de P. gingivalis à l’intérieur de la poche parodontale (45-50). La cascade du complément est un mécanisme de défense déclenché par les cellules de l’hôte en réponse à la présence de microorganismes dans le but de les éliminer. Cependant, les protéases de P. gingivalis protègent la bactérie contre cette cascade en dégradant les facteurs du complément comme le facteur C3 (38, 51). Le complément, bien que son activation permette d’éliminer les organismes pathogènes, peut moduler une destruction tissulaire s’il n’est pas régulé correctement. Le CD46, un cofacteur membranaire, permet entre autres la régulation du complément en inactivant les facteurs d’activation. Or, les protéases de P. gingivalis peuvent cliver le CD46 de la surface des cellules provoquant ainsi son relâchement et prévenant l’inactivation des molécules du complément favorisant ainsi la progression de la maladie (52). Les protéases de P. gingivalis interviennent, également, dans l’acquisition de nutriments. Elles peuvent dégrader la transferrine, une protéine riche en fer et présente en grande quantité dans le liquide créviculaire, afin de fournir une source de fer à la bactérie (53). En effet, des mutants de P. gingivalis pour les Arg- et Lys-gingipaïnes n’étaient plus en mesure de dégrader la transferrine (53). Les protéases de P. gingivalis engendrent également la sécrétion de cytokines proinflammatoires par les macrophages. En effet, la stimulation de ces cellules avec les Arg-gingipaïnes active la voie de transduction de signal de la MAPK p38 (Mitogen-activated Protein Kinase) entraînant la sécrétion de TNF- et d’IL-8 (54).
Finalement, l’hémolysine est responsable de l’acquisition d’une source de fer. Elle permet à
P. gingivalis de lyser les érythrocytes, libérant ainsi l’hémoglobine ce qui fournit l’hémine
Les bactéries à Gram-négatif, dont P. gingivalis, possèdent à leur surface du lipopolysaccharide (LPS), une composante qui fait partie intégrale de leur enveloppe externe. La structure du LPS est divisée en trois parties soit le lipide A, l’antigène O et le polysaccharide central. Le LPS joue un rôle majeur dans le développement des maladies parodontales et le lipide A est la partie principalement responsable de la stimulation du système immunitaire. Le LPS de P. gingivalis induit notamment la sécrétion de diverses cytokines et peut activer la voie RANK/RANKL contribuant ainsi à la progression de la maladie (55, 56).
1.3.1.2.2 Mécanismes de réponse aux stress
Les bactéries possèdent différents mécanismes leur permettant de survivre à des situations de stress. Selon le stimulus, une réponse différente peut être déclenchée. Par exemple, OxyR, une protéine tétramérique se liant à l’ADN, présente entre autres chez Escherichia
coli et P. gingivalis, est activée en présence d’H2O2 (57). Cette protéine induit la transcription de différents gènes nécessaires à la bactérie pour la résistance au stress oxydatif (57, 58). De plus, cette même protéine est activée chez P. gingivalis lorsque la bactérie est cultivée dans un milieu limité en hémine (59). Lorsque mise en présence d’oxyde nitrique, la protéine HcpR (hybrid cluster protein), une enzyme redox, est exprimée par P. gingivalis. Elle permet de réduire l’hydroxylamine produite à partir de l’oxyde nitrique ou du nitrite en eau et en ammoniaque (60).
Également, la protéine HtrA (high temperature requirement A) possède 2 fonctions lui permettant de jouer un rôle lors de stress. À température élevée, HtrA joue le rôle de sérine protéase alors qu’à basse température elle est une protéine chaperonne (61). En situation de stress, il devient essentiel pour la survie des bactéries de dégrader les protéines endommagées qui s’accumulent. HtrA est responsable de la dégradation de ces protéines. Chez les bactéries à Gram-négatif, HtrA est une protéine périplasmique (62). Elle est présente chez plusieurs espèces bactériennes et possède différentes fonctions. Par exemple, chez Bordetella pertussis, elle sert de chaperonne à son adhésine principal lors de sa sécrétion alors que chez Listeria monocytogenes elle permet de résister aux changements de
pH (63). Également, HtrA confère à Legionella pneumophila une résistance à la phagocytose par les macrophages et une protection contre les antibiotiques à
Staphyloccocus aureus (63). Chez P. gingivalis, HtrA est responsable de la résistance au
stress oxydatif et n’intervient pas dans la protection lors des changements de pH et de l’augmentation de température (62, 63).
1.3.2 Composante inflammatoire
Bien que la présence d’un biofilm bactérien dans les sites sous-gingivaux soit un facteur essentiel pour le développement de la maladie, il ne peut, à lui seul, provoquer la destruction tissulaire caractéristique de la parodontite. En effet, une réaction inflammatoire destructrice induite par l’agression bactérienne est déclenchée et contribue au développement de la maladie.
Chez un individu sain, une réponse immunitaire et inflammatoire basale est toujours présente puisque les cellules sont constamment stimulées par la présence de la microflore buccale (64, 65). Une proportion de bactéries sera éliminée par la salive et par le mouvement ascendant du fluide créviculaire, mais bon nombre de celles-ci demeurent en contact avec l’épithélium de la gencive (66). Ce dernier représente la première ligne de défense rencontrée par les bactéries et est responsable de la sécrétion de β-défensines reconnues pour leurs propriétés antimicrobiennes. Les β-défensines sont retrouvées en grande quantité dans la région de la gencive en contact direct avec les parodontopathogènes (67). De plus, le système immunitaire de l’hôte reconnaît des motifs moléculaires des microorganismes menant à la production de diverses molécules, dont les E-sélectines, la molécule d’adhésion intracellulaire (ICAM) et l’interleukine (IL-8) afin de recruter des neutrophiles au site d’infection où se retrouvent les bactéries parodontopathogènes (68). Le système de défense est donc en mesure de contrôler la prolifération bactérienne et d’empêcher l’invasion tissulaire par les bactéries. Cependant, lors d’un débalancement, par exemple une déficience momentanée du système immunitaire, les mécanismes de défense de base ne suffisent plus et les bactéries sont en mesure de proliférer et d’envahir les tissus sous-jacents. Le système immunitaire se retrouve alors stimulé de façon trop importante,
entraînant ainsi une réponse immunitaire anormale. Ce phénomène engendre la libération d’une grande quantité de molécules pro-inflammatoires au site d’infection qui s’accumulent, provoquant alors une réponse inflammatoire destructive par l’hôte.
Plus spécifiquement, les cytokines, incluant l’IL-1β, l'IL-6, l’IL-8 et le facteur de nécrose tumorale (TNF)-α, ont grandement été associées à la progression de la maladie (66). Elles sont retrouvées en quantité importante dans les sites sous-gingivaux en phase active de la maladie et leur sécrétion est entre autres responsable du recrutement des cellules immunitaires, au site de l'inflammation (56). De plus, la sécrétion des cytokines et des médiateurs de l'inflammation favorise la production excessive de certaines
métalloprotéinases matricielles (MMP-2, MMP-3, MMP-8, MMP-9), provoquant par le fait même la dégradation du collagène, de la fibronectine et de la laminine, et une destruction osseuse caractéristique de la maladie parodontale (8, 22, 56, 69-73).
1.4 Polyphénols
1.4.1 Généralités
Les polyphénols sont des composés naturellement retrouvés dans le règne végétal ; ils sont en grande partie responsables des propriétés organoleptiques en plus d’assurer une protection contre les rayons ultraviolets, les microorganismes pathogènes, et les prédateurs (74, 75). Les polyphénols, reconnus pour leur fort potentiel antioxydant, sont consommés dans l’alimentation courante et apportent de grands bienfaits pour la santé humaine. Les proportions ainsi que la nature des polyphénols varient grandement d’un végétal à l’autre (76).
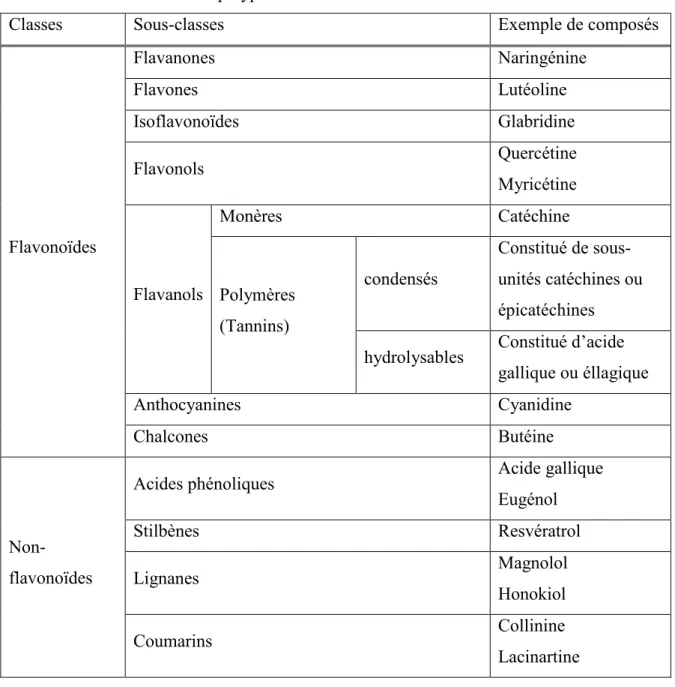
1.4.2 Classification
La structure moléculaire des polyphénols comprend plusieurs groupements aromatiques, des phénols, auxquels sont attachés des groupements hydroxyles. Jusqu’à présent, la
structure et les caractéristiques de plus de 8 000 polyphénols ont été répertoriées (77, 78). La classification de ceux-ci est basée sur divers critères tels leur provenance, leur fonction biologique ainsi que leur squelette de carbone (79). Plus spécifiquement, les polyphénols sont d’abord classés selon leur appartenance à la classe des flavonoïdes ou des non-flavonoïdes, puis divisés en sous-classes (Tableau 1) (79).
Tableau 1 : Classification des polyphénols.
Classes Sous-classes Exemple de composés
Flavonoïdes Flavanones Naringénine Flavones Lutéoline Isoflavonoïdes Glabridine Flavonols Quercétine Myricétine Flavanols Monères Catéchine Polymères (Tannins) condensés Constitué de sous-unités catéchines ou épicatéchines hydrolysables Constitué d’acide
gallique ou éllagique
Anthocyanines Cyanidine
Chalcones Butéine
Non-flavonoïdes
Acides phénoliques Acide gallique
Eugénol Stilbènes Resvératrol Lignanes Magnolol Honokiol Coumarins Collinine Lacinartine 1.4.3 Thé
Le thé, Camellia sinensis, est le breuvage le plus consommé dans le monde après l’eau. C’est un composé naturel dans lequel de grandes quantités de polyphénols sont présentes. Les polyphénols retrouvés dans le thé ainsi que leurs proportions varient entre les différents types de thés. Ces différences sont principalement reliées à leur mode de préparation. Les thés peuvent être fermentés, partiellement fermentés ou non-fermentés (80). Les méthodes
de production de thés ainsi que les types de polyphénols qu’ils renferment sont présentés dans la Figure 3.
Figure 3 : Modes de production et composition en polyphénols des divers thés (figure adaptée de Cooper et collaborateurs (80)).
1.4.4 Thé vert
Le thé vert est un thé non-fermenté provenant de feuilles matures qui, une fois récoltées, sont traitées à la vapeur afin de prévenir la fermentation, puis séchées (80, 81). Chaque année, environ 2.5 millions de tonnes de thé sont produites et le thé vert en constitue environ 20% (82). Le Japon, la Chine, l’Inde et certains pays du Moyen-Orient représentent les plus grands consommateurs de thé vert (80).
1.4.4.1 Composition
Plusieurs facteurs influencent la composition du thé, notamment le climat, les saisons et le degré de maturation des feuilles (83). Le thé contient de la théanine, un acide aminé dérivé de la glutamine et propre au thé. Une faible quantité de caféine, environ 3%, est également présente en plus de différents composés incluant des polyphénols, des protéines, des lipides et de la chlorophylle (83). Les polyphénols qui composent principalement le thé vert font partie de la classe des flavonoïdes, plus précisément des catéchines. Les catéchines sont des composés hydro-solubles, incolores qui confèrent l’astringence au thé (83). Il existe 6 catéchines différentes parmi lesquelles 4 sont plus abondantes dans le thé vert; l’épicatéchine (EC), l’épicatéchine gallate (ECG), l’épigallocatéchine (EGC), et l’épigallocatéchine-3-gallate (EGCG) (Figure 4) (84, 85). L’EGCG est considéré comme le composé le plus bioactif du thé vert (86) et constitue la catéchine retrouvée en plus grande proportion. Les catéchines sont des isomères avec une configuration trans alors que l’épicatéchine est un isomère de configuration cis (79).
1.4.4.2 Effets bénéfiques sur la santé générale
Au cours des dernières années, plusieurs études ont été réalisées, démontrant les effets bénéfiques du thé vert et de ses composantes sur la santé générale. En effet, plusieurs études ont apporté des preuves appuyant un effet anti-cancer de ces composés, notamment en regard du développement du cancer du poumon, du foie, du sein et de la prostate
(87-91). Une étude réalisée chez le rat a aussi démontré des effets anti-thrombotiques associés
aux catéchines du thé vert (92). Ce dernier, de par son potentiel antioxydant, peut également prévenir le développement de certaines maladies induites par le stress oxydatif comme les maladies cardio-vasculaires, en plus d’avoir un effet sur les fonctions plaquettaires (93-97). De plus, les polyphénols du thé vert offrent un potentiel pour la prévention et le traitement de certaines maladies inflammatoires comme l’arthrite, en diminuant la production de cyclooxygénase-2 et de TNF- dans les articulations arthritiques (98, 99). Ces polyphénols peuvent également contrôler l’obésité en inhibant la prolifération des adipocytes et leur différentiation en cellule 3T3-L1, en plus d’augmenter l’oxydation des graisses et le niveau d’adiponectine (100-102).
1.4.4.3 Effets bénéfiques sur la santé buccale
1.4.4.3.1 Halitose
L’halitose, communément appelée mauvaise haleine, est principalement causée par la présence de composés sulfurés volatils (CSV) générés par la transformation d’acides aminés contenant du soufre par certaines espèces bactériennes se trouvant à l’intérieur de la cavité buccale (103). Les deux principaux composés responsables de l’halitose sont le sulfure d’hydrogène (H2S) et le méthyl mercaptan (CH3SH) (6, 104). L’élimination des bactéries par le brossage quotidien des dents et de la langue permet de diminuer la sévérité de l’halitose, tout comme l’utilisation de produits antimicrobiens ou de produits capables de convertir les CSV en composés non-odorants (105). Le thé vert fait partie des produits capables de tels effets (106, 107). L’utilisation du thé vert sous forme de rince-bouche a été démontrée comme ayant un impact sur la quantité de CSV présent (103). De plus, l’ajout de
catéchines à des gommes à mâcher réduit la quantité de méthanethiol, un composé contribuant également à l’halitose (6, 108). Des essais in vitro ont également démontré la capacité d’un extrait de thé vert à diminuer la quantité de H2S et de CH3SH au niveau de la cavité buccale (109). De plus, l’expression du gène mgl et l’enzyme L-méthionine-α-deamino-γ-mercaptomethane-lyase (METase), impliqués dans la production de CH3SH par
P. gingivalis, ont pu être inhibé en présence de concentrations sous-inhibitrices d’EGCG
(110).
1.4.4.3.2 Carie dentaire
La carie dentaire est une maladie multifactorielle qui se développe par la présence de bactéries cariogènes, notamment Streptococcus mutans et Streptococcus sobrinus. C’est la maladie la plus répandue des tissus calcifiés des dents (111). L’alimentation joue un rôle important dans le développement de cette maladie et certains aliments peuvent contribuer ou encore prévenir son développement (112). Une étude utilisant un rince-bouche à base de thé vert a pu établir un lien entre la diminution du nombre de pathogène causant la carie dans l’environnement buccal et l’utilisation de ce rince-bouche (113). Plusieurs équipes de chercheurs ont aussi démontré un effet antibactérien du thé vert sur la principale bactérie responsable de la carie dentaire, S. mutans (114-116). S. mutans ainsi que d’autres microorganismes ont la capacité de produire des acides comme sous-produits de la fermentation des sucres, plus spécifiquement le saccharose. Par la production d’acides, une déminéralisation de l’émail de la dent peut se produire et entraîner le développement de la carie dentaire. Or, par le rinçage de la cavité buccale avec l’EGCG, il a été démontré qu’il est possible de réduire la quantité d’acide produite par les bactéries (117). De plus, l’EGCG, à des concentrations sous-inhibitrices, a engendré une inhibition chez S. mutans de l’expression du gène gtf codant pour la glucosyl transférase qui est impliquée dans la formation du biofilm (118). L’ajout de polyphénols du thé dans des sucreries et dans des gommes à mâcher a démontré un effet inhibiteur sur la formation de plaque dentaire ainsi que sur le développement de la carie dentaire (6).
1.4.4.3.3 Parodontite
Comme décrite précédemment, la parodontite est une maladie inflammatoire destructrice qui s’attaque aux structures de soutien de la dent. Les deux composantes étiologiques de la maladie se doivent d’être contrôlées pour prévenir efficacement la maladie. D’une part, il est primordial de limiter la colonisation de la cavité buccale par les bactéries parodontopathogènes. D’autre part, la présence de bactéries parodontopathogènes engendre une réponse inflammatoire menant à la production de cytokines et de MMPs qui contribuent au développement de la maladie (8). L’EGCG peut avoir un effet direct ou indirect sur la voie NF-B et ainsi réduire, voire inhiber la production de certaines cytokines. Cela a pour effet de diminuer la réponse inflammatoire, entre autres par l’inhibition de la production de l’IL-1 responsable de la production des MMPs qui engendrent la destruction de la matrice extracellulaire (116). Plusieurs études ont déjà évalué la capacité de l’EGCG à réduire la destruction osseuse médiée par les MMPs (119). Plus spécifiquement, l’étude a montré qu’en plus d’inhiber l’expression de l’ARNm de la MMP-9, l’EGCG permet aussi d’inhiber la formation d’ostéoclastes (119). D’autres études viennent appuyer les effets de l’EGCG sur les MMPs et les ostéoclastes (120, 121). Une étude sur le thé vert a démontré qu’il est possible, par l’utilisation locale de bandelettes saturées de thé, de réduire la profondeur des poches parodontales ainsi que le nombre de bactéries anaérobies à pigmentation noire (122). Lombardo Bedran et collaborateurs ont démontré que le thé vert et l’EGCG augmentent l’expression des gènes codant pour les -défensines ainsi que la production de celles-ci par les cellules épithéliales buccales (123). Ils ont aussi démontré que le thé vert et l’EGCG prévenaient la dégradation des -défensines par les protéases de P. gingivalis. Une autre étude a également rapporté les effets anti-protéases du thé vert, en plus de propriétés antibactérienne, anti-adhérence et anti-inflammatoire sur la bactérie P. gingivalis (124).
2 PROBLÉMATIQUE
Les maladies parodontales telle la parodontite représentent un problème de santé important dans la population. Leur développement est multifactoriel et fait intervenir des facteurs de l’hôte, microbiologiques et environnementaux. Malgré les connaissances déjà acquises sur ces maladies, beaucoup reste à découvrir. En effet, les mécanismes de pathogénicité ainsi que la réponse de l’hôte face aux microorganismes demeurent encore peu connus. Une réponse inflammatoire initiée par les cellules épithéliales et les macrophages au niveau du parodonte engendre une destruction importante du tissu de soutien de la dent et cette réponse est amplifiée par un contact prolongé avec les bactéries parodontopathogènes, incluant P. gingivalis. Cette bactérie joue un rôle majeur dans l’initiation et la progression de la parodontite, c’est pourquoi un contrôle efficace de celle-ci est associé à une amélioration des conditions de la pathologie. Les traitements aux antibiotiques actuellement utilisés pour éliminer les bactéries parodontopathogènes amènent de bons résultats, mais contribuent cependant à l’apparition de résistances bactériennes aux antibiotiques. L’identification de nouveaux composés capables d’agir sur la prolifération ou sur l’expression des facteurs de virulence de P. gingivalis s’avère donc d’intérêt.
2.1 Hypothèse de recherche
Les polyphénols du thé vert ont la capacité de moduler l’expression de gènes reliés à la virulence et au stress chez la bactérie parodontopathogène P. gingivalis.
2.2 Objectifs
- Vérifier l’effet des polyphénols du thé vert sur l’expression des gènes codant pour certains facteurs de virulence chez P. gingivalis;
- Vérifier l’effet des polyphénols du thé vert sur l’expression du gène codant pour la protéine de stress HtrA chez P. gingivalis.
3 MATÉRIEL ET MÉTHODES
3.1 Composantes à l’étudeL’EGCG a été acheté de la compagnie Sigma-Aldrich Canada Co. (Oakville, ON, Canada) et l’extrait de thé vert GT#9 (BCY-CT002) a été acheté de la compagnie Gosun Biotechnologies Co., Ltd. (Hangzhou Zhejiang, Chine). La composition de l’extrait de thé selon les analyses de la compagnie est présentée dans le Tableau 2.
Tableau 2 : Composition de l’extrait de thé vert GT#9.
Composé Pourcentage Polyphénols totaux 98.42 % Catéchines totaux 82.60 % EGCG 47.92 % EGC 7.56 % DL-C 2.16 % EC 6.19 % GCG 4.54 % ECG 14.23 % Caféine Max 1.0 %
Les solutions concentrées de l’extrait de thé vert et de l’EGCG ont été préparées à 10 mg/ml dans de l’eau distillée puis stérilisées par filtration (0.2 µm). La solution d’EGCG a été entreposée à -20C et la solution d’extrait de thé vert a été préparée chaque semaine et conservée à 4C.
3.2 Souche bactérienne et conditions de croissance
La souche bactérienne utilisée dans cette étude a été P. gingivalis ATCC 33277 (American Type Culture Collection, Manassas, VA, Etats-Unis). Cette souche a été cultivée dans un
milieu Todd Hewitt broth (BBL Microbiology Systems, Cockeysville, MD, USA) supplémenté d’hémine (10 µg/ml) et de vitamine K (1 µg/ml) (THB-HK) à 37°C durant 18 h ou 24 h en anaérobiose (75% N2 ; 10% H2 ; 15% CO2).
3.3 Détermination des concentrations minimales inhibitrices
La densité optique à 660 nm (DO660) d’une culture fraîche de P. gingivalis (24 h) a été mesurée, puis la culture a été centrifugée à 10 000 x g pendant 15 minutes. Par la suite, le culot bactérien a été resuspendu dans du milieu THB-HK frais à une DO660 de 0.2. Dans une microplaque 96 puits (Sarstedt Inc., Newton, NC, USA) ont été déposés 100 µl de la suspension bactérienne et 100 µl de dilutions sérielles (1:2) (2 mg/ml à 3.9 µg/ml) de l’extrait de thé vert et d’EGCG préparé dans le milieu THB-HK. La plaque a été incubée pendant 24 h à 37°C dans une chambre anaérobie. La DO660 finale a été mesurée et la concentration minimale inhibitrice (CMI) correspondait à la plus faible concentration capable d’inhiber totalement la croissance bactérienne.
3.4 Traitements de Porphyromonas gingivalis
Des milieux THB-HK (40 ml) ont été ensemencés avec différents volumes d’inoculum (1 à 100 µl) d’une culture fraîche de P. gingivalis. Après 18 h, la DO660 de chaque culture a été mesurée. Pour le traitement, une culture de P. gingivalis en début de phase exponentielle montrant une DO660 autour de 0.2 a été utilisée. Un millilitre de cette culture a été déposé dans des microtubes stériles de 1.5 ml en présence de concentrations croissantes d’extrait de thé vert et d’EGCG, 0 à 125 µg/ml et 0 à 62.5 µg/ml, respectivement. Les cultures ont été incubées en anaérobiose à 37°C durant 8 h, après quoi les étapes pré-congélation de la trousse RNAprotect (Qiagen Inc., Mississauga, ON, Canada) ont été réalisées et les échantillons ont été congelés à -20°C jusqu’à l’extraction-purification de l’ARN.
3.4.1 Évaluation de l’expression de gènes
3.4.1.1 Extraction de l’ARN
L’extraction-purification de l’ARN bactérien a été réalisée suivant les protocoles #4 (lyse enzymatique et digestion à la protéinase K) et #7 (purification de l’ARN par le RNeasy mini kit) fournis avec la trousse RNAprotect (Qiagen Inc., Mississauga, ON, Canada).
À la suite du traitement de P. gingivalis aux polyphénols, les échantillons ont été traités avec la solution RNAprotect permettant la protection de l’ARN. Après cette étape, les échantillons ont pu être conservés à -20°C jusqu’à l’extraction-purification de l’ARN. Après la décongélation des échantillons, une lyse bactérienne par lysozyme (15 mg/ml) et une digestion des protéines par la protéinase K (2 mg/ml) ont été réalisées simultanément durant une période de 10 minutes à la température de la pièce (volume final 900 µl). Par la suite, 500 µl d’éthanol 100% ont été ajoutés au 900 µl d’échantillon pour permettre la précipitation des protéines. Les échantillons ont été déposés sur une colonne (incluse dans la trousse) puis lavés. La DNase I (0.34 unité Kunitz/µl) a été ajoutée à la colonne pour permettre la digestion de l’ADN. Finalement des lavages ont été effectués puis l’ARN a été élué avec de l’eau ne contenant pas de nucléases. Les étapes suivant l’extraction ont été effectuées dans la même journée afin d’éviter les pertes d’ARN par la congélation-décongélation. Les ARN ont été conservés à -80°C.
3.4.1.2 Évaluation de la pureté et de la concentration des ARN
Avant la synthèse des ADN complémentaires (ADNc), la qualité, la pureté et la concentration des ARN ont été établies. Les ratios 260/280 et 260/230 déterminés à l’aide du Nanodrop (Themo Fisher Scientific, Wilmington, DE, USA) ont permis d’évaluer la pureté des ARN. Suivant les normes, les échantillons d’ARN ayant des ratios situés entre 1.8 et 2.0 ont pu être considérés purs. L’appareil Experion™ Automated Electrophoresis System (Bio-Rad Laboratories, Mississauga, ON, Canada) avec la trousse RNA stdSens
analysis (Bio-Rad Laboratories) ont été utilisés suivant le protocole du manufacturier pour déterminer la qualité des ARN grâce au gel virtuel obtenu après le traitement des échantillons. La concentration en ARN des échantillons a aussi été déterminée par Experion™ Automated Electrophoresis System.
3.4.1.3 Préparation des ADN complémentaires par transcriptase inverse
La préparation des ADNc a nécessité 1 µg d’ARN dans un volume total de 10 µl. À l’ARN ont été ajoutés 1 µl d’hexamères aléatoires (50 µM) (Roche Diagnostics, Indianapolis, IN, USA) ainsi que 1 µl de dNTPs (10 mM) (Life Technologies Inc., Burlington, ON Canada). Cette préparation a été incubée pendant 5 minutes à 70°C, puis mise sur glace pour un autre 5 minutes avant l’ajout des réactifs suivants : 4 µl du tampon RT 5X (Life Technologies Inc.), 2 µl de dTT (0.1 M) (Life Technologies Inc.), 1 µl de RNase out (200 U/µl) (Roche Diagnostics) et 1 µl de transcriptase inverse M-MLV (200 U/µl) (Life technologies Inc.). Les échantillons ont ensuite été placés dans un thermocycleur pendant 10 minutes à 25°C, 50 minutes à 37°C et 15 minutes à 70°C, pour terminer à 4°C. Les ADNc ont été conservés à -20°C et dilués d’un facteur 5 avant leur utilisation.
3.5 Préparation des amorces
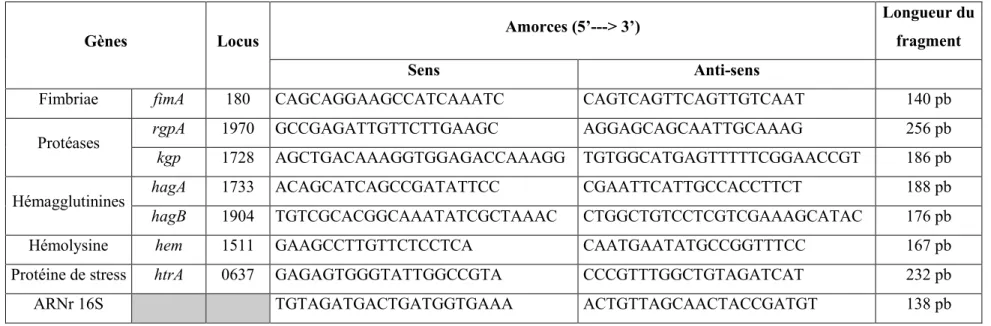
Dans la présente étude, les gènes codant pour les protéases (RgpA, Kgp), les hémagglutinines (HagA, HagB), le fimbriae (FimA), l’hémolysine (Hem) et la protéine de stress (HtrA) ont été étudiés. Le gène codant pour l’ARN ribosomal 16S a servi de contrôle. Les amorces utilisées sont décrites dans le Tableau 3. À la réception, les amorces ont été réhydratées dans de l’eau sans nucléases (Sigma-Aldrich Canada Co.) à une concentration finale de 50 µM et conservées à -80°C. Les amorces ont été combinées (sens et anti-sens) et amenées à une concentration de 10 µM. Avant l’utilisation des amorces, un gradient de température a été réalisé pour déterminer la température d’hybridation optimale de chaque paire d’amorces et pour s’assurer de l’absence d’auto-hybridation.
3.6 PCR quantitative
Le CFX96™ Real-Time System C1000™ thermal cycler (Bio-Rad Laboratories) a servi pour l’analyse qPCR. Un volume de 25 µl par réaction a été utilisé. Chaque réaction a été préparée avec 5 µl d’ADNc, 1 µl d’amorces (sens/anti-sens), 6.5 µl d’eau sans nucléases (Sigma-Aldrich Canada Co.) et 12.5 µl du supermix IQ SYBR Green (Bio-Rad Laboratories).
Le cycle qPCR utilisé a consisté en une première étape de 5 minutes à 95°C, suivie d’une dénaturation de 1 minute à 95°C, d’une hybridation de 1 minute à 60°C et d’une élongation de 30 secondes à 72°C. Les résultats obtenus ont été normalisés en fonction du gène de référence soit l’ARNr 16S.
Tableau 3 : Amorces utilisées pour la quantification de l’expression des gènes chez P. gingivalis par PCR quantitative.
Gènes Locus Amorces (5’---> 3’)
Longueur du fragment
Sens Anti-sens
Fimbriae fimA 180 CAGCAGGAAGCCATCAAATC CAGTCAGTTCAGTTGTCAAT 140 pb
Protéases rgpA 1970 GCCGAGATTGTTCTTGAAGC AGGAGCAGCAATTGCAAAG 256 pb
kgp 1728 AGCTGACAAAGGTGGAGACCAAAGG TGTGGCATGAGTTTTTCGGAACCGT 186 pb
Hémagglutinines hagA 1733 ACAGCATCAGCCGATATTCC CGAATTCATTGCCACCTTCT 188 pb
hagB 1904 TGTCGCACGGCAAATATCGCTAAAC CTGGCTGTCCTCGTCGAAAGCATAC 176 pb
Hémolysine hem 1511 GAAGCCTTGTTCTCCTCA CAATGAATATGCCGGTTTCC 167 pb
Protéine de stress htrA 0637 GAGAGTGGGTATTGGCCGTA CCCGTTTGGCTGTAGATCAT 232 pb
3.7 Analyse statistique
La moyenne l’écart-type des trois réplicas a été calculée et le test t de Student a été utilisé pour les analyses statistiques avec une valeur de p 0.05 considérée comme statistiquement significative.
4 RÉSULTATS
4.1 Concentrations minimales inhibitrices
Pour la détermination des concentrations minimales inhibitrices, P. gingivalis a été mis en culture en présence de concentrations croissantes d’extrait de thé vert et d’EGCG. La densité optique de la culture a été mesurée après 24 h d’incubation et les valeurs ont été comparées aux contrôles (absence de composés), ce qui a permis d’évaluer l’inhibition. Pour l’extrait de thé vert, la plus petite concentration capable d’inhiber totalement la croissance (CMI) a été de 125 µg/ml et pour l’EGCG de 62.5 µg/ml.
4.2 Expression des gènes codant pour les facteurs de virulence
4.2.1 Effet de l’extrait de thé vert
Dans un premier temps, l’effet de l’extrait de thé vert sur l’expression de gènes codant pour les facteurs de virulence de P. gingivalis a été évalué. Pour réaliser cette expérience, une culture de P. gingivalis en début de phase exponentielle a été mise en présence de concentrations croissantes d’extrait de thé vert se situant entre 0 et 125 µg/ml pour une période de 8 h en anaérobiose. La durée de l’incubation a été sélectionnée à la suite d’essais préliminaires ayant évalué des temps entre 15 minutes et 24 h. L’ARN a ensuite été purifié et quantifié afin de synthétiser les ADNc en vue de réaliser des qPCR.
Les résultats présentés ont été regroupés selon le rôle des différents facteurs de virulence de
P. gingivalis dans le processus pathogénique de la maladie parodontale, soit les facteurs de
colonisation qui regroupent les gènes codant pour le fimbriae (FimA) et les hémagglutinines (HagA et HagB), les facteurs contribuant à l’inactivation des mécanismes de défense de l’hôte et à la destruction tissulaire qui incluent les protéases Arg-gingipaïne (RgpA) et Lys-gingipaïne (Kgp), et les facteurs permettant l’acquisition d’une source de fer soit l’hémolysine.
D’une part, pour les facteurs de colonisation, une diminution significative et dose-dépendante de l’expression des gènes a été observée pour l’ensemble des concentrations d’extrait de thé vert testées (Figure 5). En effet, à la concentration la plus faible, une baisse de 20% de l’expression des hémagglutinines a été observée alors que pour le fimbriae, la diminution de l’expression était de 60%. À la plus forte concentration, soit 125 µg/ml, une diminution de 53% a été observée pour le fimbriae et de 60% pour les hémagglutinines.
D’autre part, en ce qui a trait aux deux protéases, une tendance similaire a été notée, soit une diminution dose-dépendante de l’expression des gènes allant jusqu’à un maximum d’environ 70-75% à une concentration de 125 µg/ml (Figure 6). À la concentration la plus faible, une diminution se situant entre 35-40% a été obtenue pour les deux protéases. De plus, pour l’Arg-gingipaïne (RgpA), la diminution obtenue s’est avérée significative à toutes les concentrations testées alors que pour la Lys-gingipaïne (Kgp), seules les concentrations de 75 µg/ml et 125 µg/ml ont engendré une diminution significative de l’expression.
Enfin, en ce qui concerne l’hémolysine, une inhibition dose-dépendante de l’expression du gène a, tout comme pour les autres facteurs, été observée (Figure 7). Également, une baisse significative de l’expression du gène, soit d’environ 70%, a été notée à la concentration la plus élevée soit 125 µg/ml.
Figure 5 : Effets de concentrations croissantes d’extrait de thé vert sur l’expression des gènes codant pour les facteurs de colonisation HagA, HagB et FimA chez P. gingivalis ATCC 33277. Les résultats ont été normalisés avec le gène de l’ARNr 16S et sont exprimés selon la moyenne l’écart-type. L’analyse statistique a été effectuée avec le test t de Student (* : p < 0.05 par rapport au contrôle de 0 µg/ml ;
†
: p < 0.05 par rapport aux concentrations 75 et 100 µg/ml).Figure 6 : Effets de concentrations croissantes d’extrait de thé vert sur l’expression des gènes codant pour les facteurs impliqués dans la destruction tissulaire et l’inactivation des mécanismes de défense de l’hôte soit les protéases RgpA et Kgp chez P. gingivalis ATCC 33277. Les résultats ont été normalisés avec le gène de l’ARNr 16S et sont exprimés selon la moyenne l’écart-type. L’analyse statistique a été effectuée avec le test t de Student (* : p < 0.05).
Figure 7 : Effets de concentrations croissantes d’extrait de thé vert sur l’expression du gène codant pour l’hémolysine chez P. gingivalis ATCC 33277. Les résultats ont été normalisés avec le gène de l’ARNr 16S et sont exprimés selon la moyenne l’écart-type. L’analyse statistique a été effectuée avec le test t de Student (* : p < 0.05).
4.2.2 Effet de l’EGCG
Les traitements avec l’EGCG ont été réalisés avec des concentrations allant de 0 à 62.5 µg/ml et selon les mêmes conditions que pour l’extrait de thé vert. Les résultats sont de nouveau regroupés selon la fonction des gènes à l’étude.
Tout comme l’extrait de thé vert, l’EGCG a engendré une diminution dose-dépendante de l’expression des gènes codant pour les facteurs de colonisation (Figure 8). Cependant, la diminution observée s’est avérée inférieure à celle obtenue pour le thé vert et l’effet dose-dépendant était moins important. Une diminution significative d’environ 60% a été observée pour le fimbriae à 50 µg/ml et pour l’hémagglutinine A à 62.5 µg/ml.
D’autre part, pour l’expression des gènes codant pour les protéases, la même tendance a été obtenue (Figure 9). Pour le gène rgpA, la diminution observée a été significative à toutes les concentrations testées et a atteint un maximum de 60% avec l’EGCG à 62.5 µg/ml. Un effet dose-dépendant a été obtenu pour le gène kgp et une diminution significative de 50% a été atteinte à 62.5 µg/ml.
Finalement, l’EGCG a engendré une diminution dose-dépendante pour le gène codant pour l’hémolysine (Figure 10). Aucune diminution significative n’a été observée et le niveau d’expression le plus bas a été noté à 50 µg/ml qui correspond à une diminution de 40% de l’expression.
Figure 8 : Effets de concentrations croissantes d’EGCG sur l’expression des gènes codant pour les facteurs de colonisation HagA, HagB et FimA chez P. gingivalis ATCC 33277. Les résultats ont été normalisés avec le gène de l’ARNr 16S et sont exprimés selon la moyenne l’écart-type. L’analyse statistique a été effectuée avec le test t de Student (* : p < 0.05 par rapport au contrôle de 0 µg/ml ;
†
: p < 0.05 par rapport à la concentration de 50 µg/ml).Figure 9 : Effets de concentrations croissantes d’EGCG sur l’expression des gènes codant pour les facteurs impliqués dans la destruction tissulaire et l’inactivation des mécanismes de défense de l’hôte soit les protéases RgpA et Kgp chez P. gingivalis ATCC 33277. Les résultats ont été normalisés avec le gène de l’ARNr 16S et sont exprimés selon la moyenne l’écart-type. L’analyse statistique a été effectuée avec le test t de Student (* : p < 0.05).
Figure 10 : Effets de concentrations croissantes d’EGCG sur l’expression du gène codant pour l’hémolysine chez P. gingivalis ATCC 33277. Les résultats ont été normalisés avec le gène de l’ARNr 16S et sont exprimés selon la moyenne l’écart-type. L’analyse statistique a été effectuée avec le test t de Student à p < 0.05.
4.1 Expression du gène codant pour la protéine de stress HtrA
Pour faire suite à l’évaluation de l’effet de l’extrait de thé vert et de l’EGCG sur l’expression des facteurs de virulence, des traitements de P. gingivalis ont également été réalisés afin d’évaluer la réponse de la bactérie au stress. Ceci a été possible en mesurant l’expression du gène codant pour la protéine HtrA après une exposition de P. gingivalis aux composés pour une période de 2 h. La procédure des traitements tout comme les concentrations des composés ont été les mêmes que celles décrites précédemment. L’ARN a ensuite été purifié, quantifié et les ADNc synthétisés pour la réalisation des qPCR.
4.1.1 Effet de l’extrait de thé vert
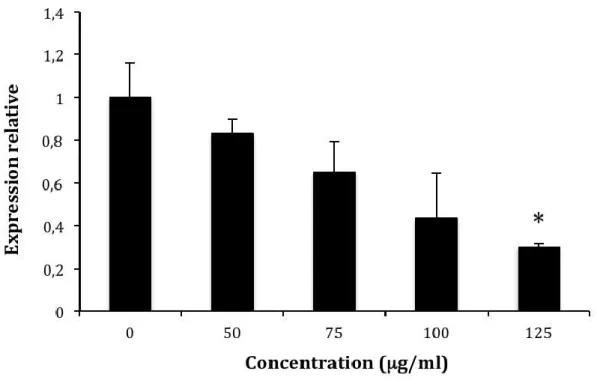
Suivant l’exposition de P. gingivalis aux concentrations croissantes d’extrait de thé vert, une augmentation dose-dépendante de l’expression du gène codant pour la protéine de stress HtrA a été observée (Figure 11). Cette augmentation s’est avérée significative à partir d’une concentration 75 µg/ml. À la CMI soit 125 µg/ml, une expression relative 6 fois plus élevée que celle du contrôle a été notée.
Figure 11 : Effets de concentrations croissantes d’extrait de thé vert sur l’expression du gène codant pour la protéine de stress HtrA chez P. gingivalis ATCC 33277. Les résultats ont été normalisés avec le gène de l’ARNr 16S et sont exprimés selon la moyenne l’écart-type. L’analyse statistique a été effectuée avec le test t de Student (* : p < 0.05).
4.1.2 Effet de l’EGCG
Tout comme l’extrait de thé vert, l’EGCG a augmenté l’expression du gène codant pour la protéine de stress HtrA (Figure 12). Cette augmentation est significative à 50 et 62.5 µg/ml et est dose-dépendante. À ces concentrations, l’expression du gène a été augmentée environ 2.5 fois par rapport au contrôle. L’EGCG a démontré un effet moindre comparativement à l’extrait de thé vert, mais induit tout de même une condition de stress chez P. gingivalis. De plus, dans le cas des 2 composés, les concentrations se rapprochant de la CMI ont causé les plus fortes augmentations d’expression.
Figure 12 : Effets de concentrations croissantes d’EGCG sur l’expression du gène codant pour la protéine de stress HtrA chez P. gingivalis ATCC 33277. Les résultats ont été normalisés avec le gène de l’ARNr 16S et sont exprimés selon la moyenne l’écart-type. L’analyse statistique a été effectuée avec le test t de Student (* : p < 0.05).