HAL Id: dumas-01708927
https://dumas.ccsd.cnrs.fr/dumas-01708927
Submitted on 14 Feb 2018HAL is a multi-disciplinary open access
archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Connaissance de deux Infections Sexuellement
Transmissibles : syphilis et infection à chlamydia, des
patients consultant au CDAG/CIDDIST de Bordeaux
Émilie Lasserre
To cite this version:
Émilie Lasserre. Connaissance de deux Infections Sexuellement Transmissibles : syphilis et infec-tion à chlamydia, des patients consultant au CDAG/CIDDIST de Bordeaux . Médecine humaine et pathologie. 2017. �dumas-01708927�
1
Université de Bordeaux
U.F.R. DES SCIENCES MEDICALES
Année 2017
N° 35
Thèse pour l’obtention du
DIPLOME d’ETAT de DOCTEUR EN MEDECINE
Présentée et soutenue publiquement
Par Emilie LASSERRE
Née le 11 Avril 1990 à Bordeaux
Le 21 Mars 2017
Titre de la thèse
Connaissance de deux Infections Sexuellement
Transmissibles, syphilis et infection à chlamydia, des patients
consultant au CDAG/CIDDIST de Bordeaux
Directeur de thèse
Professeur Charles CAZANAVE
Rapporteur de thèse
Docteur Hervé DUTRONC
Jury
Monsieur le Pr Didier NEAU
Président
Monsieur le Pr William DURIEUX
Juge
Madame le Dr Bertille de BARBEYRAC
Juge
Madame le Dr Isabelle LE HEN
Juge
Monsieur le Pr Charles CAZANAVE Juge
Monsieur le Dr Odon MONTALBETTI
Juge
2
Remerciements
A mon Président du Jury, Monsieur le Professeur Didier NEAU Professeur des Universités
Praticien Hospitalier
Chef de service de Maladies Infectieuses et Tropicales, CHU de Bordeaux
Je suis honorée que vous ayez accepté la Présidence de ce jury. Je vous remercie de m’avoir accueillie dans votre service lorsque j’étais externe, pour votre gentillesse et votre bienveillance.
Soyez assuré de ma reconnaissance et de mon profond respect.
A mon Rapporteur, Monsieur le Docteur Hervé DUTRONC Praticien Hospitalier
Service de Maladies Infectieuses et Tropicales, CHU de Bordeaux
Je vous remercie d’avoir accepté d’évaluer ce travail, pour votre disponibilité, votre rapidité et votre efficacité.
Soyez assuré de ma gratitude et de mon profond respect.
A mon Juge, Monsieur le Professeur William DURIEUX Professeur des Universités
Médecin Généraliste
Membre du Département de Médecine Générale
Je vous remercie de vous être rendu disponible et d’avoir accepté de juger ce travail. Soyez assuré de ma gratitude et de mon profond respect.
A mon Juge, Madame le Docteur Bertille de BARBEYRAC Maître de Conférences des Universités
Praticien Hospitalier
Responsable du Centre National de Référence des infections à chlamydiae
Vous m’avez fait l’honneur de juger ce travail, en tant que responsable du Centre National de Référence des infections à chlamydiae. Je vous remercie chaleureusement de votre disponibilité. Recevez par cette présentation l’expression de ma profonde reconnaissance et de mon profond respect.
3 A mon Juge, Madame le Docteur Isabelle LE HEN
Médecin coordinateur du CeGIDD de Bordeaux
Merci pour l’aide que vous nous avez apportée dans l’élaboration de cette thèse, autant sur la rédaction du questionnaire que lors de leur distribution au sein du CDAG/CIDDIST. Merci d’avoir accepté de juger aujourd’hui de ce travail.
A mon Juge, Monsieur le Docteur Odon MONTALBETTI Médecin Généraliste
Cabinet de Médecine Générale, Sainte Alvère
Merci pour tout ce que vous m’avez appris, aussi bien techniquement qu’humainement. Vous m’avez montré l’étendue des possibilités que permettait notre métier, les joies, les peines, les moments de rire mais aussi de tristesse et de réflexion. Je prendrai toujours à cœur de garder mon esprit critique et indépendant. Merci d’avoir accepté de partager avec moi votre savoir et votre passion, et merci d’avoir accepté de juger aujourd’hui ce travail, qui a débuté grâce à vous…
A mon Directeur, Monsieur le Professeur Charles CAZANAVE Professeur des Universités
Praticien Hospitalier
Service de Maladies Infectieuses et Tropicales, CHU de Bordeaux
Je vous remercie de tout cœur de m’avoir accompagné tout au long de ce travail, de votre confiance et de vos conseils avisés. Merci de m’avoir guidé tout en me laissant mon libre arbitre, et de vous être rendu disponible dans votre emploi du temps déjà bien chargé.
Recevez dans ces quelques mots le témoignage de ma très grande reconnaissance et de mon profond respect.
4
A l’ensemble des médecins, et de tout le personnel médical et paramédical que
j’ai été amenée à rencontrer tout au long de mon cursus, me permettant de
construire pas à pas le médecin que je suis aujourd’hui.
Au Docteur Marie-Quitterie PICAT, médecin épidémiologiste à l’AP-HP
Merci de vos conseils avisés quant à la préparation de cette thèse, aussi bien sur les statistiques que sur la méthodologie. Merci de votre gentillesse et de votre disponibilité, qui m’ont grandement éclairée.
Au Docteur Sandrine ELIAH, médecin épidémiologiste au CeGIDD de Bordeaux
Merci de votre aide et de votre disponibilité, notamment lors de la rédaction du questionnaire.
A l’ensemble de l’équipe médicale et para-médicale de mon premier semestre en Médecine
Interne à l’HIARP. J’y ai appris l’autonomie, comme aime le dire Lucas, et j’y ai trouvé un
immense soutien moral auprès de Marianne et Paméla.
A l’ensemble de l’équipe médicale et para-médicale de mon deuxième semestre aux
urgences adultes du CHU de PELLEGRIN. J’y ai appris la gestion de l’urgence et la
polyvalence. Merci à tous les médecins pour m’avoir donné envie d’en apprendre toujours plus. Merci à Céline pour sa gentillesse et son dévouement aux patients, duquel nous avons tous à apprendre.
A tous ceux qui m’ont accueillie lors de mon troisième semestre chez le praticien, Dr Odon MONTALBETTI, Dr Vincent BONNELLE et son épouse Emmanuelle, aux infirmières libérales, notamment Joëlle et Céline, qui nous ont été indispensables dans les situations d’urgence. A Chantal, toujours disponible, qui fait un travail exceptionnel…
A l’équipe médicale et para-médicale de mon quatrième semestre en Médecine et Maladies
Infectieuses du Centre Hospitalier d’Arcachon. Carine, Martha et Aude pour leur
encadrement bienveillant. Laetitia pour son écoute. Toute l’équipe des urgences pour leur accueil et leur bonne humeur.
A l’équipe médicale et para-médicale de mon cinquième semestre en Pédiatrie au Centre
Hospitalier de Périgueux, pour la confiance qu’ils m’on apporté, et leur aide précieuse dans
5 A ma fabuleuse sous-colleuse, Céline. Ensemble nous avons brillamment surmonté tous les obstacles de la D4 et montré à ceux qui pouvaient encore en douter que la médecine générale a de quoi rivaliser avec toutes les autres spécialités…
A mes fidèles amies, Mathilde, Marion et Bérangère. Qui m’ont toujours soutenue dans mon parcours, tout en poursuivant le leur. Je suis fière de chacune de vous et de l’amitié qui nous lie depuis le lycée.
A Laura, avec qui j’ai pleuré (entre autre) le jour des résultats du concours de P1. Parce qu’on a toujours été là l’une pour l’autre, et que ça sera toujours le cas, quoi qu’il arrive.
A mes cousins, Aurélien, Mathieu et Thibaut, qui ont toujours été comme des frères pour moi, prêts à m’aider et me protéger.
A ma cousine Laetitia, son mari Didier et leur fille Athénaïs, pour leur présence à mes côtés et leur soutien constant.
A mes tantes et oncles, Eliane, Didier, Mireille et Serge, prêts à m’accueillir à bras ouverts en toutes circonstances.
A mon Papi et ma Mamie, qui comptent tellement pour moi, et avec qui j’ai passé et je passe encore des moments inoubliables.
A mon Pépé et ma Mémé, que j’aurais aimé avoir près de moi en cette occasion. Je pense à vous à chaque instant important de ma vie. Je suis fière d’être la petite fille d’un forgeron, et fière d’apporter le titre de « Docteur » au nom de « LASSERRE »…
A mon Papa et ma Maman, parce que vous avez su vous adapter à chacune de vos filles et voir le potentiel en chacune de nous. Parce que vous nous avez apporté la stabilité et l’amour dont chaque enfant a besoin pour se construire en tant que personne et en tant que professionnel. Merci d’avoir contribué à faire de moi celle que je suis devenue. Je vous aime fort.
A ma sœur, Manon. Merci pour les « smiley » et les mots d’encouragement. Je suis extrêmement fièvre de tout le chemin que tu as parcouru et de la jeune femme que tu es aujourd’hui. Ne change rien…
Et enfin, à Alexis. Mon Alexis. Toi qui me supporte en toutes circonstances, qui me pousse à avancer et à donner le meilleur de moi-même. Tu es mon phare, dans la tempête passionnante mais oh combien envahissante de ma vie professionnelle. Tu es la pièce complémentaire au puzzle de ma vie. Je t’aime, vivement le 10 juin !!!
6
Serment d’Hippocrate
Au moment d’être admise à exercer la médecine, je promets et je jure d’être
fidèle aux lois de l’honneur et de la probité.
Mon premier souci sera de rétablir, de préserver ou de promouvoir la santé dans
tous ses éléments, physiques et mentaux, individuels et sociaux.
Je respecterai toutes les personnes, leur autonomie et leur volonté, sans aucune
discrimination selon leur état ou leurs convictions. J’interviendrai pour les
protéger si elles sont affaiblies, vulnérables ou menacées dans leur intégrité ou
leur dignité. Même sous la contrainte, je ne ferai pas usage de mes
connaissances contre les lois de l’humanité.
J’informerai les patients des décisions envisagées, de leurs raisons et de leurs
conséquences. Je ne tromperai jamais leur confiance et n’exploiterai pas le
pouvoir hérité des circonstances pour forcer les consciences.
Je donnerai mes soins à l’indigent et à quiconque me les demandera.
Je ne me laisserai pas influencer par la soif du gain ou la recherche de la gloire.
Admise dans l’intimité des personnes, je tairai les secrets qui me seront confiés.
Reçu(e) à l’intérieur des maisons, je respecterai les secrets des foyers et ma
conduite ne servira pas à corrompre les mœurs.
Je ferai tout pour soulager les souffrances. Je ne prolongerai pas abusivement les
agonies. Je ne provoquerai jamais la mort délibérément.
Je préserverai l’indépendance nécessaire à l’accomplissement de ma mission. Je
n’entreprendrai rien qui dépasse mes compétences. Je les entretiendrai et les
perfectionnerai pour assurer au mieux les services qui me seront demandés.
J’apporterai mon aide à mes confrères ainsi qu’à leurs familles dans l’adversité.
Que les hommes et mes confrères m’accordent leur estime si je suis fidèle à mes
promesses ; que je sois déshonorée et méprisée si j’y manque.
7
Liste des abréviations
ARS : agence régionale de la santé
BEH : bulletin épidémiologique hebdomadaire
CDAG : centre de dépistage anonyme et gratuit
CDC : center for disease control and prevention
CE : corps élémentaire
CeGIDD : centre gratuit d’information, de dépistage et de diagnostic des
infections sexuellement transmissibles
CH : centre hospitalier
CIDDIST : centre d’information, de dépistage et de diagnostic des infections
sexuellement transmissibles
CR : corps réticulé
ECDC : european center for disease prevention and control
ET : écart type
FIV : fécondation in vitro
FSF : femmes ayant des relations sexuelles avec des femmes
FSH : femmes ayant des relations sexuelles avec des hommes
HAS : haute autorisé de santé
HPV : human papilloma virus
HSF : hommes ayant des relations sexuelles avec des femmes
HSH : hommes ayant des relations sexuelles avec des hommes
IC : intervalle de confiance
IM : intra-musculaire
InVS : institut national de veille sanitaire
IST : infection sexuelle transmissible
IV : intra veineux
LGV : lymphogranulomatose vénérienne
MST : maladie sexuellement transmissible
NAAT : nucleid acid amplification tests
OMS : organisation mondiale de la santé
PCR : polymerase chain reaction
PID : pelvic inflammatory disease
QCM : question (ou questionnaire) à choix multiple
RPR : rapid plasma reagin test
SA : semaines d’aménorrhée
TPHA : Treponema pallidum haemagglutination test
TRUST : toluidine red unheated seru test
TT : test tréponémique
TNT : test non tréponémique
TTPA : Treponema pallidum passive particules agglutination test
VDRL : veneral diseases research laboratory test
8
Table des matières
Résumé………...11
Table des Figures………...…12
Table des Tableaux……...……….13
INTRODUCTION……….14
I.
Chlamydia trachomatis...15
1.1 Données épidémiologiques………15
a) En France………..15
b) A l’internationale…...………...17
c) Population et facteurs de risque………19
1.2 Physiopathologie………20
a) Microbiologie des Chlamydiae...20
b) Pathogénicité des Chlamydiae...20
1.3 Histoire clinique et évolution……….23
a) Chez les hommes………..23
b) Chez les femmes...24
c) Chez les nouveaux-nés………..26
1.4 Méthodes diagnostiques……….26
a) Tests recommandés………...26
b) Auto-prélèvements………27
1.5 Traitement………..28
1.6 Synthèse : un enjeu de santé publique………...29
II.
Treponema pallidum ...31
2.1 Données épidémiologiques………..…..31
a) Syphilis : pathologie du passé ?...31
b) Ou du futur ?...32
c) Population et facteurs de risque………36
2.2 Physiopathologie………37
a) Microbiologie des tréponèmes………..37
b) Pathogénicité de Treponema pallidum...39
2.3 Clinique, stadification et classification………..40
a) Syphilis précoce………40
b) Syphilis tardive……….41
c) Neurosyphilis………42
d) Syphilis congénitale………..42
e) Co-infection VIH………..42
2.4 Méthodes diagnostiques……….43
2.5 Traitement………..44
a) Syphilis précoce………44
b) Syphilis tardive……….45
c) Neurosyphilis………45
9
d) Prise en charge des partenaires……….46
e) Difficultés actuelles et alternatives………...46
2.6 Synthèse : un enjeu de santé publique………46
III.
Présentation du CDAG/CIDDIST………48
IV.
Hypothèses de la recherche………..50
PATIENTS et METHODES……….51
I.
Critères d’inclusion et d’exclusion………..51
II.
Matériel et Méthode……….51
2.1 Auto-questionnaire et données recueillies………..51
a) Profil………..54
b) Partie syphilis………54
c) Partie Chlamydia...55
d) Partie IST………..56
e) Caractéristiques du questionnaire……….56
2.2 Déroulement le l’étude………...58
2.3 Recueil de données……….59
a) Partie syphilis………59
b) Partie Chlamydia...60
c) Partie IST………..62
d) Objectifs secondaires………63
2.4 Analyses statistiques………..63
RESULTATS……….65
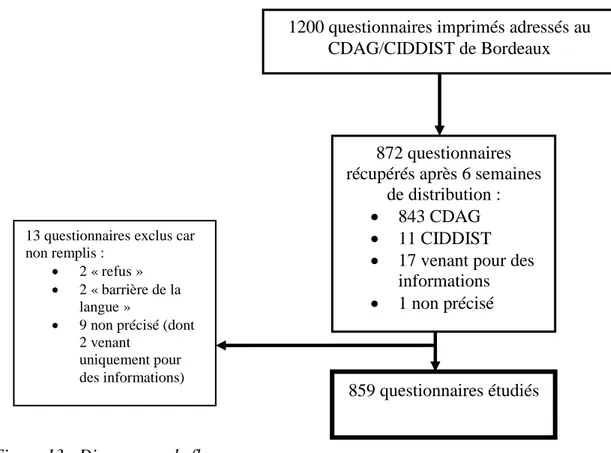
I.
Diagramme de flux………..65
II.
Caractéristiques de la population……….67
2.1 Proportion hommes/femmes………..67
2.2 Orientations sexuelles………68
2.3 Age……….69
2.4 Niveaux scolaires………...70
2.5 Nombre de partenaires sexuels………...70
2.6 Utilisation du préservatif………71
2.7 Antécédent d’IST………...74
2.8 Informations reçues sur les IST………..74
2.9 Conclusion………..74
III.
Réponses à l’auto-questionnaire………..76
3.1 Partie syphilis……….77
3.2 Partie Chlamydia...84
3.3 Partie IST………92
IV.
Moyennes des réponses au questionnaire………95
4.1 Résultats bruts………95
4.2 Comparaisons……….96
DISCUSSION………...97
I.
Principaux résultats………..97
10
B. Profil………...97
C. Syphilis………...98
D. Chlamydia………..…….98
E. IST………...99
F. Analyses statistiques……….100
II.
Etat des lieux par rapport à la littérature actuelle………...100
a. Chlamydia……….……100
b. Syphilis……….102
c. Profil des participants et comportements sexuels……….103
III.
Forces et faiblesses de l’étude………104
IV.
Généralisation des résultats et perspectives………...106
CONCLUSION………108
BIBLIOGRAPHIE………..109
ANNEXES………118
Annexe 1 : Fiche d’information destinée aux participants………..118
Annexe 2 : Fiche réponse donnée aux participants lors de la remise des
résultats par le médecin………...119
Annexe 3 : Fiche explicative du déroulement de l’étude donnée au
personnel du CDAG/CIDDIST………...120
11
RESUME
L’infection uro-génitale à Chlamydia trachomatis est l’IST bactérienne la plus fréquente en France, tandis que la syphilis émerge depuis les années 2000.
L’OBJECTIF PRINCIPAL de notre étude était d’évaluer les connaissances de ces deux
IST des personnes consultant au CDAG/CIDDIST de Bordeaux. Les objectifs secondaires étaient de comparer les réponses justes de la partie « chlamydia » des personnes ayant un antécédent d’infection à C. trachomatis à celles des participants n’ayant pas cet antécédent ; et de comparer les réponses justes à l’ensemble du questionnaire des personnes ayant déjà abordé le sujet des IST avec un médecin généraliste à celles des participants ne l’ayant pas fait.
PATIENTS et METHODE : Nous avons élaboré puis distribué du 2 Novembre au 12
Décembre 2015 un auto-questionnaire aux personnes consultant au CDAG/CIDDIST de Bordeaux. Il comprenait les parties suivantes : « profil consultant », « syphilis », « chlamydia » et « connaissances générales des IST ». Les données ont été recueillies sur tableur Excel. Le nombre de réponses « juste » a été décompté. Un test de Student a été utilisé.
RESULTATS : De nombreux participants ont reconnu ne pas connaître la réponse aux
questions posées notamment concernant les symptômes de ces IST, cependant le pourcentage de réponses fausses était faible. Leurs moyens de prévention sont connus, mais le fait qu’elles facilitent la transmission de l’infection VIH l’est moins. La moyenne des réponses justes pour la partie « chlamydia » était significativement plus élevée chez les participants ayant un antécédent de cette infection, et la moyenne des réponses à l’ensemble du questionnaire était significativement plus élevée chez les participants ayant déjà abordé le sujet des IST avec un médecin généraliste.
CONCLUSION : Il reste des progrès à faire sur l’information concernant les IST des
populations les plus à risque, pour faciliter leur dépistage et endiguer leur ré-émergence ou leur progression.
12
Table des Figures
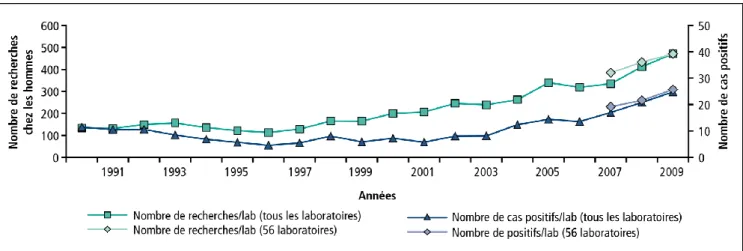
Figure 1 : Evolution du nombre annuel moyen d’hommes testés et de diagnostics
d’infection à C. trachomatis par laboratoire, Rénachla, France 1990-2009Figure 2 : Evolution du nombre annuel moyen de femmes testées et de diagnostics
d’infection à C. trachomatis par laboratoire, Rénachla, France 1990-2009Figure 3 : Nombre d’infections uro-génitales à C. trachomatis selon le sexe. Réseau
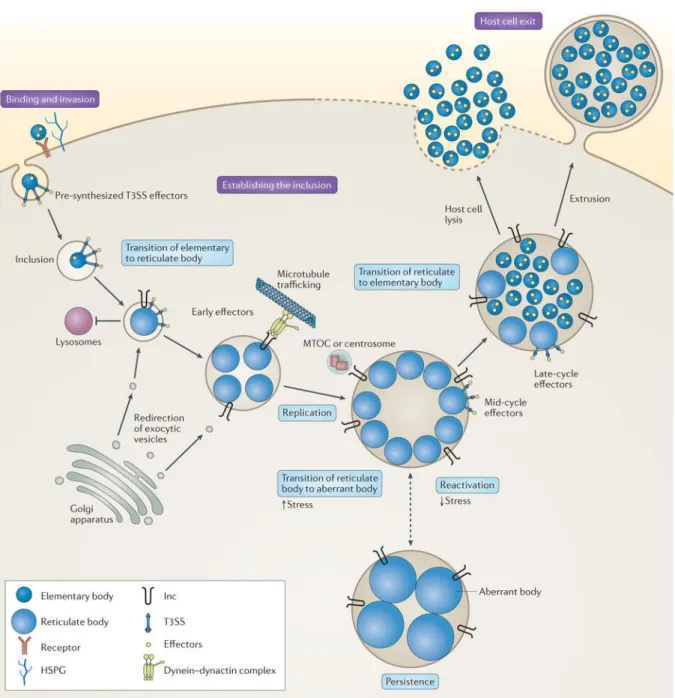
Rénachla, France, 2000-2015Figure 4 : Cycle de réplication des Chlamydiae
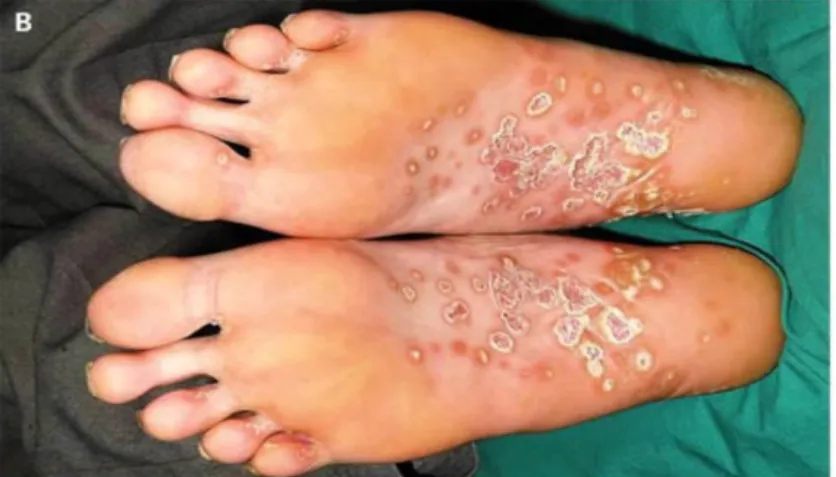
Figure 5 : Keratoderma Blenorrhagica
Figure 6 : Incidence de la syphilis aux Etats-Unis de 1941 à 2002
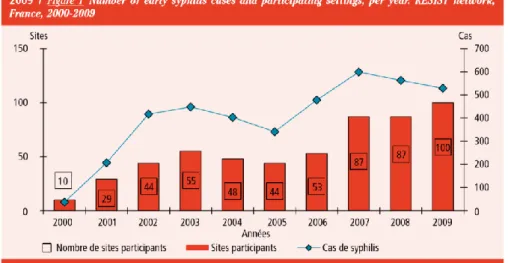
Figure 7 : Nombre de syphilis précoce en France de 2000 à 2009, données du réseau
RésISTFigure 8 : Nombre de cas de syphilis récente selon l’orientation sexuelle. Réseau RésIST,
France, 2000-2015Figure 9 : Evolution du nombre de cas de syphilis dans les différents pays européens entre
2008 et 2012Figure 10 : Nombre de cas de syphilis en Europe par sexe et pas classe d’âge
Figure 11 : Nomenclature des tréponèmes
Figure 12 : Auto-questionnaire
Figure 13 : Flow chart
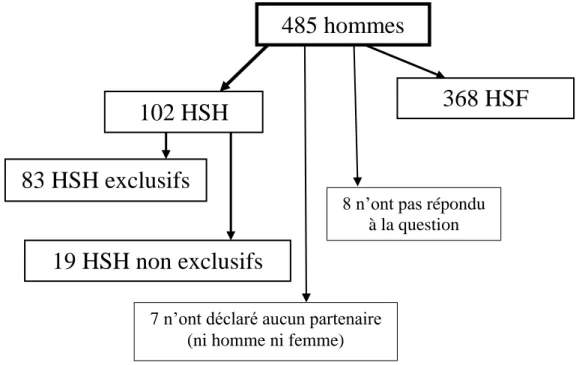
Figure 14 : Orientations sexuelles des hommes ayant répondu au questionnaire
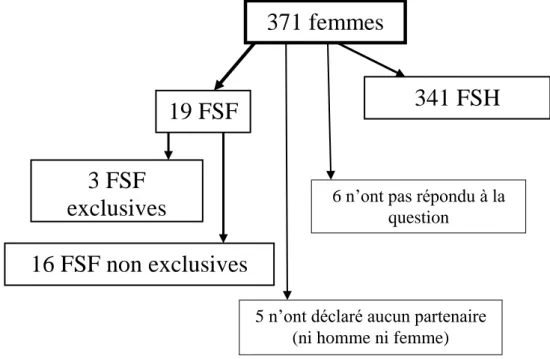
Figure 15 : Orientations sexuelles des femmes ayant répondu au questionnaire
Figure 16 : Nombre de participants par âge
Figure 17 : Nombre de réponses recueillies pour chaque partie du questionnaire
Figure 18 : Nombre de réponses par symptômes de la syphilis
Figure 19 : Nombre de réponses par symptômes des infections à C. trachomatis
Figure 20 : Réponses concernant les méthodes de détection en route des infections à
C. trachomatis
Figure 21 : Réponses à la question « les IST facilitent la transmission du VIH »
Figure 22 : Réponses à la question « Les rapports oro-génitaux peuvent transmettre des
IST »Figure 23 : Moyens utiles dans la prévention des infections à C. trachomatis et de la
syphilis13
Table des Tableaux
Tableau 1 : Nombre de réponses par question et données manquantes
Tableau 2 : Nombre de partenaires sexuels en fonction du sexe et de l’orientation sexuelle
Tableau 3 : Utilisation du préservatif des femmes en fonction de leurs pratiques et de leur
orientation sexuelleTableau 4 : Utilisation du préservatif des hommes en fonction de leurs pratiques et de leur
orientation sexuelleTableau 5 : Réponses à la question sur la population à risque de contracter la syphilis
Tableau 6 : Récapitulatif des réponses à la question ouverte sur le traitement de la syphilis
Tableau 7 : Résumé des réponses de la partie syphilis du questionnaire
Tableau 8 : Réponses à la question sur la population à risque de contracter une infection à
C. trachomatis
Tableau 9 : Récapitulatif des réponses à la question ouverte sur le traitement des infections
à C. trachomatisTableau 10 : Résumé des réponses à la partie « chlamydia » du questionnaire
Tableau 11 : Moyennes et écart-type des réponses au questionnaire
14
INTRODUCTION
L’infection uro-génitale à Chlamydia trachomatis est l’infection sexuellement transmissible (IST) bactérienne la plus fréquente en France et en Europe (1). Elle concerne le plus souvent les femmes de moins de 25 ans et les hommes de moins de 30 ans (2–4). La fréquence des formes asymptomatiques facilite sa diffusion (5–10). Le dépistage, par prélèvement vaginal chez la femme et premier jet d’urines chez l’homme est indispensable pour limiter la transmission de cette infection (11,12), dont le traitement est aisé, la plupart du temps par une seule prise d’azithromycine (13,14).
La syphilis, pathologie vénérienne emblématique des 19ème et 20ème siècles, réapparaît en France et en Europe depuis le début des années 2000, après avoir quasiment disparu au moment de l’avènement des antibiotiques (15). Elle touche principalement en France les hommes ayant des relations sexuelles avec des hommes (HSH) (16,17), dont une grande partie présente une co-infection VIH (18). Elle se divise en syphilis précoce et tardive, aux symptômes très variés (la « grande simulatrice »), souvent séparés par des phases asymptomatiques. Son diagnostic se fait par prélèvement sanguin et son traitement par injection de pénicilline G retard (14,19,20). Son diagnostic est recommandé pour toute personne ayant des rapports sexuels non protégés (et en particulier les HSH), les personnes ayant un antécédent d’IST, les travailleurs du sexe ou encore les migrants en provenance de pays d’endémie (21).
Une bonne connaissance de ces deux infections de la population la plus à risque de les contracter est ainsi nécessaire pour faciliter leur détection et leur dépistage. C’est dans ce cadre que nous avons réalisé une étude visant à évaluer les connaissances des infections à
15
I.
Chlamydia trachomatis
1.1 Données épidémiologiques
a) En France
L’infection urogénitale à Chlamydia trachomatis est l’IST bactérienne la plus fréquente en France et en Europe (1).
Sur le plan national, l’étude de Goulet et al. (22), réalisée en 2006 sur 4957 volontaires sexuellement actifs, met en évidence une prévalence de 1,4 % (Intervalle de confiance (IC) [0,8-2,6]) pour les hommes et 1,6 % (IC [1-2,5]) pour les femmes. La prévalence est plus importante pour les 18-29 ans : 2,5 % (IC [1,2-5]) pour les hommes et 3,2 % (IC [2-5,3]) pour les femmes.
L’institut national de veille sanitaire (InVS) rapporte dans son bulletin des réseaux de surveillance des IST (données au 31 décembre 2009 du réseau Rénachla) (23) une augmentation des diagnostics de C. trachomatis depuis les années 2000, avec une certaine accélération depuis 2005 (Figures 1 et 2), en partie due à la progression du dépistage des formes asymptomatiques. Il est donc difficile de conclure à une simple diffusion de l’infection, mais plutôt à une plus grande reconnaissance de celle-ci.
Figure 1 : Evolution du nombre annuel moyen d’hommes testés et de diagnostics d’infection à C. trachomatis par laboratoire, Rénachla, France 1990-2009 (23).
16
Figure 2 : Evolution du nombre annuel moyen de femmes testées et de diagnostics d’infection à C. trachomatis par laboratoire, Rénachla, France 1990-2009 (23).
Une étude réalisée en 2012 par la Ruche et al. (24) dans deux bases de laboratoires sentinelles en France met en évidence une incidence de l’infection à C. trachomatis de 257 pour 100 000 personnes testées sur les 15-49 ans (95 % IC [156-358]).
En effet après 2009, l’augmentation des infections à C. trachomatis s’est confirmée en France, comme le montre les données du réseau Rénachla au 31 Décembre 2015, avec une augmentation de 10 % entre 2013 et 2015, plus importante chez les hommes (19 % versus 8 % chez les femmes) (16) (Figure 3).
17
Figure 3 : Nombre d’infections uro-génitales à C. trachomatis selon le sexe. Réseau Rénachla, France, 2000-2015 (16).
b) A l’internationale
Sur le plan international, l’organisation mondiale de la santé (OMS) a réalisé une estimation des incidences de plusieurs IST dans le monde, dont l’infection uro-génitale à
C. trachomatis, en 1995, 1999 et 2005.
Pour les estimations de 1995 (25), l’incidence des infections à C. trachomatis était de 5,5 millions en Europe de l’Ouest, 3,99 millions en Amérique du Nord, 10,13 millions en Amérique latine et les caraïbes, 15,4 millions en Afrique Sub-saharienne, 40,48 millions en Asie du Sud et du Sud-Est, 5,07 millions en Europe de l’Est et l’Asie Centrale, 5,33 millions
18 en Asie de l’Est et dans le pacifique et 2,95 millions en Afrique du Nord et au Moyen Orient. L’incidence totale mondiale était de 89,15 millions.
Les estimations de 2005 (26) font part d’une incidence mondiale en augmentation (101,52 millions de nouveaux cas) dont 15,2 millions en Europe, 22,41 millions en Amérique, 10,02 millions en Afrique et 41,6 millions dans le Pacifique Ouest. Sur l’ensemble des territoires, il existe une prédominance de cas féminins, un peu plus marquée en Europe, avec 9,03 millions de femmes atteintes contre 6,17 millions d’hommes.
A noter que les méthodes d’estimations étaient similaires entre 1995 et celles de 2005, mais ont compris en 2005 plus de variables d’ajustement. De plus, les régions prises en compte ne sont pas les mêmes en 1995 et en 2005 (ex : différentiation « Europe de l’est/Asie Centrale »/« Europe de l’ouest » en 1995, et « Europe»/« Asie du Sud Est » en 2005). Il faut donc être prudent sur les comparaisons des résultats de ces deux périodes.
Les études de Wilson et al. (27) et de Fenton et al. (28) publiées respectivement en 2002 et 2004, font état d’une prévalence de l’infection à C. trachomatis variant de 2 à 17% à partir de prélèvements réalisés sur des femmes asymptomatiques. Les variations sont liées à la population à laquelle appartiennent ces femmes, à leur pays d’origine, ainsi qu’aux tests utilisés pour le dépistage.
L’étude de Franceschi et al. (2) réalisée sur 5328 femmes non enceintes par PCR sur prélèvement vaginal dans dix centres sur quatre continents différents (Nigéria, Colombie, Argentine, Vietnam, Chine, Thaïlande, Corée et Espagne) met en évidence une prévalence variant de 0,2 % en Espagne (IC [0,0-0,7]) à 5,6 % au Nigéria (IC [3,4-7,8]).
Aux Etats-Unis, il a été rapporté en 2012 au CDC (« Center for Disease Control and Prevention ») 1 422 976 infections à C. trachomatis soit 456,7 cas pour 100 000 habitants. Si ce nombre de cas n’a augmenté que de 0,7 % entre 2011 et 2012 (453,4/100 000 habitants en 2011), le taux d’infections à C. trachomatis est passé de 182,3 en 1992 à 456,7 pour 100 000 habitants en 2012 soit une augmentation d’environ 150 % (29).
19 Une méta-analyse publiée en janvier 2015, réalisée par Redmond et al. (30), regroupant 25 études (11 provenant d’Europe et 14 provenant de cinq autres pays à « revenus élevés ») conduites entre 1990 et 2012, trouve chez les adultes sexuellement actifs âgés de 18 à 26 ans :
- Une prévalence estimée qui varie de 3 et 5,3 % chez les femmes, avec une moyenne de 3,6 % (IC [2,4-4,8]).
- Chez les hommes, elle varie entre 2,4 et 7,3 % avec une moyenne à 3,5 % (IC [1,9-5,2]).
Dans cette étude, les prévalences des pays européens n’étaient pas différentes de celles des pays « à revenus élevés hors Europe » inclus dans l’étude.
c) Population et facteurs de risque
Selon les études du CDC (29), le taux d’infection à C. trachomatis est plus élevé chez les adolescents et les jeunes adultes âgés de 15 à 24 ans, aussi bien pour les femmes (3290 cas pour 100 000 femmes parmi les 15-19 ans et 3695 cas pour 100 000 femmes parmi les 20-24 ans) que pour les hommes, bien que ce taux soit plus faible chez ces derniers (774 cas pour 100 000 hommes parmi les 15-19 ans et 1350 cas pour 100 000 hommes parmi les 20-24 ans).
En Angleterre, les études montrent que les prévalences les plus élevées se trouvent parmi les hommes de 20 à 24 ans et les femmes de 16 à 19 ans (3).
Dans l’étude de Franceschi et al. (2) , la prévalence est plus importante parmi les femmes de 15 à 24 ans à 4,5 % (IC [3,4-5,8]) contre 2,6% (IC [2,1-3,1]) parmi les 25-44 ans. Les facteurs de risque mis en évidence sont la co-existence d’une infection à Neisseria gonorrhoeae ou d’une infection à un sérotype de haut risque de Human Papilloma Virus (HPV).
Les facteurs de risque d’une infection à C. trachomatis principalement mis en évidence au niveau international (4) sont un âge inférieur à 25 ans, un antécédent d’infection sexuellement transmissible (y compris à C. trachomatis), un nouveau partenaire sexuel ou des partenaires sexuels multiples, l’utilisation irrégulière du préservatif, le fait d’être un travailleur du sexe, ou le fait de ne pas être marié (3).
20 En France, l’étude de Goulet et al. (22) trouve comme facteurs de risque pour les deux sexes une dernière relation sexuelle avec un partenaire occasionnel, pour les hommes un dernier rapport sexuel avec un nouveau partenaire et le fait d’habiter en région parisienne, pour les femmes : des partenaires sexuels multiples dans l’année précédente, des partenaires du même sexe et un bas niveau d’éducation.
1.2 Physiopathologie
a) Microbiologie des chlamydiae
Les Chlamydiae sont de petits bacilles à Gram négatif (environ 0,3µm) cocoïdes non mobiles, intracellulaires (qui ne se multiplient que dans des vacuoles cytoplasmiques des cellules hôtes eucaryotes), présentant de façon simultanée de l’ADN et de l’ARN, et qui se divisent de façon binaire.
D’un point de vue génétique, et bien que possédant les gènes nécessaires au transport d’ATP de la cellule hôte, la bactérie contient de quoi fabriquer au moins un peu d’ATP par elle-même (et n’est donc pas entièrement dépendante, « parasite » de la cellule hôte). Cependant elle contient quand même au moins 20 gènes qui proviennent des cellules eucaryotes hôtes (contre 3 ou 4 de ces gènes pour la plupart des bactéries), certains sont même d’origine végétale, ce qui pourrait s’expliquer par le fait que les Chlamydiae aient dans un premier temps infecté un hôte végétal avant d’avoir migré vers les animaux (31).
Les Chlamydiae existent sous deux formes principales :
- Le corps élémentaire : correspondant à la forme mature, infectieuse, extracellulaire, ne pouvant pas se multiplier.
- Le corps réticulé : correspondant à la forme métaboliquement active, non infectieuse, intracellulaire, qui permet la division et la multiplication de la bactérie.
Une troisième forme peut être identifiée : le « corps aberrant ». Forme latente intracellulaire, il s’agit d’une bactérie viable dans la cellule, mais non capable de se diviser (et donc non cultivable, plus difficile à mettre en évidence et moins accessible aux antibiotiques…) (32).
21 Le cycle de réplication des Chlamydiae est particulièrement long (de 48 à 72h) et comporte 5 étapes majeures (Figure 4) :
- L’attachement et l’entrée du corps élémentaire (CE) dans la cellule hôte - La différentiation du CE en corps réticulé (CR)
- La multiplication des CR dans une inclusion cytoplasmique (caractéristique de cette infection)
- La différentiation des CR en CE
- La sortie des CE par lyse de la cellule hôte
22 La durée relativement longue de ce cycle explique :
- Le caractère subaigu, presque latent de ces infections, avec progression insidieuse du pathogène
- La présence de nombreuses formes asymptomatiques avec complications fréquentes - La nécessité d’une antibiothérapie active de façon prolongée, avec activité
intra-cellulaire.
b) Pathogénicité des chlamydiae
L’ancienne taxonomie divisant les Chlamydia en deux genres (Chlamydia et
Chlamydophila) est désormais obsolète. Seul le genre Chlamydia, comprenant neuf espèces,
est maintenant reconnu (34,35).
C. trachomatis a un pouvoir pathogène strictement humain. L’espèce se compose de 19
sérovars (en fonction des antigènes de sa Major Outer Membrane Protein), qui sont responsables distinctement de trois types de pathologies différentes (32) :
- Le trachome (sérovars A, B, Ba et C). Il s’agit d’une kératoconjonctivite chronique, facilitée par le manque d’hygiène, atteignant plusieurs centaines de millions de personnes, représentant la principale cause de cécité évitable dans le monde.
- Les IST, principalement uro-génitales (sérovars D, Da, E, F, G, H, I, Ia, J et K), et qui font l’objet de cette thèse.
- La lymphogranulomatose vénérienne (LGV) (sérovars L1, L2, L2a et L3) ou maladie de Nicolas-Favre.
Les sérovars responsables du trachome et ceux responsables des IST sont regroupés dans le
même biovar, alors que ceux responsables de la LGV forment le second biovar de l’espèce (34).
Chlamydia pneumoniae est responsable de pneumopathies atypiques communautaires (à début
souvent insidieux).
Chlamydia psittaci a plutôt un tropisme animal, mais peut « accidentellement » causer des
23 Seules les trois espèces décrites précédemment sont potentiellement pathogène pour l’homme. Les six dernières espèces (Chlamydia muridarum, Chlamydia pecorum, Chlamydia abortus,
Chlamydia felis et Chlamydia caviae) ne sont pathogènes que pour les animaux (34).
1.3 Histoire clinique et évolution
L’infection uro-génitale à C. trachomatis est le plus souvent asymptomatique. L’étude de van de Laar et al. (5) trouve qu’en Europe, 70 % des femmes et 50 % des hommes atteints de cette infection sont asymptomatiques. Aux Etats-Unis, les études de Stamm et al. (6) et de Cecil et al. (7) publiées respectivement en 1999 et 2001 font état de 85 à 90 % de formes asymptomatiques, en sachant que la seconde étude n’a été réalisée que sur des hommes. Une troisième étude, publiée en 2002 par Korenromp et al. (8) et réalisée en Ouganda rural met en évidence que seuls 11 % des hommes et 6 % des femmes de l’étude atteints d’infection à
C. trachomatis sont symptomatiques, soit respectivement 89 et 94 % de formes
asymptomatiques. Ce caractère paucisymptomatique facilite la diffusion à bas bruit de l’infection dans la population (9).
De plus, comme la plupart des IST, l’infection uro-génitale à C. trachomatis peut faciliter la transmission du VIH (10), ce qui représente un risque « invisible » supplémentaire pour les personnes atteintes.
a) Chez les hommes
La symptomatologie masculine comprend essentiellement les urétrites, puisque
C. trachomatis est responsable de la majorité (30 à 50 %) des urétrites non-gonococciques
chez l’homme (36). Le délai d’incubation est relativement long (de 7 à 10 jours (36) et les symptômes sont souvent moins bruyants que lors d’une urétrite gonococcique. Ils comportent un écoulement urétral le plus souvent clair ou blanchâtre, rarement muco-purulent, une dysurie ou un prurit urétral (36). Celles-ci peuvent se compliquer d’orchi-épididymites et
24 plus rarement de prostatites. Des rectites aigües sont possibles avec les génotypes D à K de
C. trachomatis responsables d’infections génitales, mais elles sont souvent moins bruyantes
que celles dues aux génotypes L des LGV (11). Le syndrome de Fiessinger-Leroy-Reiter, plus fréquemment décrit chez les hommes (37), associe urétrite, conjonctivite, arthrites et lésions cutanéo-muqueuses (balanite circinée et kératodermie palmo-plantaire aussi appelée
Keratoderma Blennorrhagica (Figure 5)) (38). Le tableau, incomplet dans un tiers des cas, est
favorisé par une susceptibilité génétique (individus porteurs de l’allèle HLA B27) (38).
Figure 5 : Keratoderma Blennorrhagica (38)
Une étude réalisée par de Barbeyrac et al. (39) au centre hospitalier universitaire (CHU) de Bordeaux sur des couples consultant pour réalisation d’une fécondation in vitro (FIV) dans le cadre d’une infertilité ne trouve pas d’impact d’une infection à C. trachomatis (actuelle ou ancienne) sur les caractéristiques du sperme des hommes inclus dans l’étude.
Chez les hommes comme chez les femmes, un portage oro-pharyngé de C. trachomatis est possible, permettant sa transmission lors de relations sexuelles oro-génitales.
b) Chez les femmes
Bien que la plupart des femmes soient asymptomatiques, un tiers de celles présentant une infection uro-génitale à C. trachomatis présentent des signes locaux à l’examen gynécologique (6) tels qu’un écoulement au niveau du col utérin ou un col ectopique et hypertrophique (36).
25 Les symptômes sont plus variés chez la femme que chez l’homme. On distingue les infections génitales basses (urétrite, bartholinite, cervicite pouvant être responsables de dysurie, leucorrhées et saignements post-coïtaux) et les infections génitales hautes (ou « Pelvic Inflammatory Disease ») comprenant endométrite, salpingite, abcès tubo-ovarien, péri-hépatite – syndrome de Fitz-Hugh-Curtis - (6,36). Ces dernières sont pourvoyeuses de nombreuses complications : métrorragies, douleurs abdominales ou pelviennes, mais surtout dans leur forme chronique d’infertilité (responsables de 2/3 des infertilités tubaires) et de grossesses extra-utérines (1/3 des cas de GEU) (40).
Malgré sa responsabilité dans l’infertilité tubaire, l’infection à C. trachomatis ne semble pas être un facteur d’échec de fécondation in vitro. Dans l’étude de de Barbeyrac et al. (39) une grossesse était obtenue chez 23,1 % des couples dont au moins l’un présentait un antécédent ou une infection actuelle à C. trachomatis, contre 20,2 % chez les couples n’ayant pas été en contact avec cette infection, sans que la différence soit significative.
Pendant la grossesse, l’infection à C. trachomatis peut être responsable de menace d’accouchement prématuré, voire de prématurité. L’étude d’Andrew et al. (41) réalisée sur
des femmes enceintes trouve que les femmes ayant un prélèvement positif pour
C. trachomatis à 24 semaines d’aménorrhée (SA) avaient deux fois plus de risque
d’accoucher avant 37 SA (Odds Ratio (OR) = 2,2 ; IC [1,03-4,78]) et trois fois plus de risque d’accoucher avant 35 semaines d’aménorrhée (OR = 3,2 ; IC [1,08-9,57]). L’infection est aussi associée à une mortalité néonatale plus importante et un plus grand nombre d’endométrites du post-partum (41,42). Ces données sont d’autant plus inquiétantes qu’une étude récente réalisée par Peuchant et al. (43) avec prélèvements vaginaux sur plus de 1000 femmes enceintes asymptomatiques trouve une prévalence importante (2,5 % ; IC [1,6-3,7]) des infections à C. trachomatis, dont 7,9 % parmi les 18-24 ans.
Une étude réalisée par Rours et al. (44) à Rotterdam entre 2003 et 2005 sur plus de 3900 femmes et nouveau-nés trouve que la présence d’une infection à C. trachomatis chez les femmes enceintes est associée à une plus grande proportion d’accouchement prématuré avant 32 SA (OR = 4,35 ; IC [1,3-15,2]) et 35 SA (OR = 2,66 ; IC [1,1-6,5]). Sur les naissances survenues avant 32 et 35 SA, respectivement 14,9 % (IC [3,5-39,5]) et 7,4 % (IC [2,5-20,1])
26 de ces accouchements pouvaient être attribués à une infection à C. trachomatis. Il n’y avait pas contre pas de lien entre la présence de l’infection et un petit poids à la naissance.
c) Chez les nouveaux nés
Dans le cas où la mère présente une infection à C. trachomatis, une transmission de l’infection à son enfant est possible pendant l’accouchement. Ainsi, 30 à 50 % des nouveau-nés dont la mère est atteinte développent une conjonctivite à C. trachomatis. Parmi ces enfants, 50 % présentent une infection naso-pharyngée associée dont 30 % développeront une pneumopathie (6). Une étude chinoise réalisée sur 1400 nouveau-nés de moins de six mois hospitalisés pour pneumopathie met en évidence un taux élevé de pneumopathies dues à
C. trachomatis (7,2 %) (45). Ces infections pulmonaires peuvent être responsables de
séquelles au long cours avec persistance d’un syndrome obstructif pulmonaire (42). Il n’existe cependant pas de preuve formelle d’une augmentation du risque de mort subite du nourrisson (42).
1.4 Méthodes diagnostiques
a) Tests recommandés
L’ancien « gold standard » du diagnostic des infections à C. trachomatis reposait sur (36) : - La culture cellulaire d’un échantillon d’endocol utérin chez la femme
- La culture cellulaire d’un échantillon de prélèvement endo-urétral chez l’homme Il s’agit de la technique de référence, les Chlamydiae étant des bactéries à développement intra-cellulaire, mais qui reste longue et peu sensible bien que très spécifique (46).
Les nouvelles techniques d’amplification génique (maintenant de deuxième génération) (TAAN pour « Tests d’Amplification des Acides Nucléiques »), comme les techniques de PCR (« Polymerase chain reaction ») permettent un diagnostic rapide, sensible
27 et spécifique. Ces tests diagnostics réalisables sur de nombreux prélèvements (écoulement urétral, prélèvement vaginal en fonction de la symptomatologie) sont maintenant recommandés notamment par le CDC (47). La culture cellulaire reste réservée à certaines situations médico-légales (46).
La sérologie n’est quant à elle pas recommandée en pratique courante sur des patients asymptomatiques. Elle reste cependant utile dans le diagnostic des infections génitales hautes, des pneumopathies néonatales, des lymphogranulomatoses vénériennes et des bilans d’infertilité tubaire (11).
En pratique, chez l’homme il est recommandé de réaliser un test d’amplification génique sur le premier jet d’urine (car non invasif par rapport au prélèvement endo-urétral). Chez la femme, l’auto-prélèvement vaginal, peu invasif et plus sensible que le premier jet d’urine, est privilégié (11,12,48).
b) Auto-prélèvements
Ces dernières années, dans l’optique de faciliter le dépistage chez les jeunes femmes asymptomatiques, de nombreuses études se sont penchées sur la possibilité que ce soient les femmes elles mêmes qui réalisent leur propre prélèvement vaginal (auto-prélèvement). En effet, les auto-prélèvements vaginaux réalisés par les patientes elles-mêmes ont une aussi bonne sensibilité et spécificité que ceux réalisés par des cliniciens (49). De plus, l’étude de Chernesky et al. (50) réalisée aux Etats-Unis montre que plus de 90 % des femmes trouvent facile la réalisation de l’auto-prélèvement vaginal, sans influence de l’âge, de l’éducation ou du niveau scolaire. Effectivement, 76 % préfèreraient un auto-prélèvement vaginal à un examen gynécologique et 94 % des femmes rapportent qu’elles seraient plus enclines à se faire dépister si des auto-prélèvements vaginaux étaient disponibles.
Les auto-prélèvements vaginaux sont ainsi devenus ces dernières années un outil de choix du dépistage des infections uro-génitales à C. trachomatis.
28 A noter que chez les hommes, la possibilité d’auto-prélèvement au niveau du gland a été étudiée, mais cette pratique ne permet pas de remplacer l’analyse du premier jet d’urines, par manque de sensibilité (51). Les auto-prélèvements de premier jet d’urine et rectaux restent possibles, y compris à domicile, avec une bonne acceptabilité et faisabilité (52).
1.5 Traitement
Le traitement recommandé pour les formes asymptomatiques comme pour les urétrites ou cervicites est :
- Soit 1g d’azithromycine per os en une seule fois
- Soit 200 mg de doxycycline par jour en deux fois pendant 7 jours (13,14)
Les deux ont en théorie une efficacité comparable (53), mais le traitement « monodose » ou « minute » par azithromycine facilite l’observance (14).
Les cyclines n’étant pas indiquées chez la femme enceinte, le traitement de première intention se compose d’azithromycine 1g en dose unique et en seconde intention d’amoxicilline 500 mg trois fois par jour pendant 7 jours voire d’érythromycine 500 mg quatre fois par jour pendant 7 jours (13).
Concernant les infections génitales hautes à C. trachomatis, les recommandations françaises prônent l’ajout d’une céphalosporine de 3ème
génération (ceftriaxone) à la doxycycline 100 mg deux fois par jour pour permettre une action plus rapide sur les symptômes et traiter une éventuelle infection à Neisseria gonorrhoeae associée (54).
Les partenaires sexuels (sur les 60 jours précédents le diagnostic) des personnes infectées doivent être identifiés, examinés par un médecin et traités (azithromycine dose unique ou doxycycline 7 jours). Il est recommandé de ne pas avoir de rapports sexuels durant les sept jours suivant le début du traitement (soit jusqu’à la fin du traitement par doxycycline ou une semaine après la prise d’azithromycine) pour diminuer le risque de transmission et éviter les ré-infections (14).
29 Pour les rectites à C. trachomatis n’entrant pas dans le cadre des LGV, le traitement par doxycycline 100 mg per os deux fois par jour est préféré à l’azythromycine en dose unique car celui-ci permet une meilleure éradication microbiologique, avec peu de différence concernant les effets secondaires. (55,56)
Concernant les conjonctivites néonatales, celles-ci peuvent être traitées par azithromycine 20 mg/kg/j en solution orale en une seule prise pendant 3 jours ou en deuxième intention par érythromycine 50 mg/kg/j en solution orale en quatre fois pendant 7 jours (13).
1.6 Synthèse : un enjeu de santé publique
Le dépistage de C. trachomatis est un moyen utile pour pouvoir traiter et endiguer la transmission de l’infection ainsi que ses complications, comme le montrent plusieurs études :
Un essai contrôlé randomisé publié en 1996 (57) réalisé dans des établissements de soins primaire trouve une réduction de 60 % des infections génitales hautes grâce au dépistage.
Une étude publiée en 2014 par Folger et al. (58) sur 3354 femmes enceintes dans l’Ohio montre que les patientes de moins de 19 ans traitées avant 20 SA avaient moins de risque d’accoucher prématurément (entre 32 et 36 SA) (OR = 0,54 IC [0,37-0,80]) que celles n’étant pas traitées ni dépistées après 20 SA. Ils démontrent ainsi l’importance du dépistage et traitement anténatal précoce des infections à C. trachomatis.
D’autres études ont montré que le dépistage de C. trachomatis était bien accepté par la population (52,59,60), mais qu’un dépistage systématique trouve une faible prévalence de l’infection (59). Il est donc utile de cibler ce dépistage sur une population prédéfinie (61,62). De ce fait, le CDC recommande un dépistage de C. trachomatis chez les jeunes femmes sexuellement actives de moins de 25 ans (14).
30 Il existe peu d’études sur le dépistage des hommes (36), il n’y a donc pas de preuve suffisante pour recommander le dépistage systématique des jeunes hommes sexuellement actifs. Celui-ci doit cependant être considéré dans certaines populations à risque (hommes ayant des relations sexuelles avec les hommes = HSH, antécédent d’IST, conduites à risque…) (14).
Dans la plupart des programmes de dépistage français (ainsi qu’en Angleterre et aux Etats-Unis), celui-ci est proposé aux femmes sexuellement actives âgées de moins de 25 ans (11), ainsi qu’aux jeunes hommes présentant des facteurs de risque d’infection (âges de moins de 30 ans).
Au CDAG/CIDDIST de Bordeaux, le dépistage est systématiquement proposé aux femmes de moins de 25 ans et aux hommes de moins de 30 ans.
31
II. Treponema pallidum
2.1 Données épidémiologiques
a) Syphilis : pathologie du passé ?
« J’ai la vérole : Enfin, la vraie, pas la misérable chaude-pisse, pas l’ecclésiastique cristalline, pas les bourgeoises crêtes de coq, les légumineux choux-fleurs, non, non, la grande vérole, celle dont est mort François Ier. » tels étaient les mots de Guy de Maupassant à Robert Pinchon en 1887. Maladie vénérienne emblématique, la syphilis, soupçonnée d’avoir atteint bon nombre de personnages célèbres (Charles Beaudelaire, Napoléon Bonaparte, Al Capone, Léon Tolstoï, Adolf Hitler…), touchait au début du 20ème siècle entre 8 et 14 % des adultes des grandes villes occidentales (Londres, Berlin, Paris, New York…) (63,64).
Longtemps décrite comme ayant été ramenée en Europe du Nouveau Monde par Christophe Colomb en 1493, cette théorie ne fait plus l’unanimité, des cas de tréponématoses datant d’avant le 15ème
siècle ayant été découverts ces dernières années en Europe (65,66). Le caractère « vénérien » de ces cas anciens, signature du T. pallidum (vecteur de la syphilis) reste cependant difficile à prouver.
Au 20ème siècle, l’avènement des antibiotiques (dont la pénicilline) associé aux campagnes de dépistage et de prévention (notamment port du préservatif), a permis un large recul de la syphilis en occident (figure 6) (15).
32
Figure 6 : Incidence de la syphilis aux Etats-Unis de 1941 à 2002 (15)
Malgré ce recul occidental, l’incidence de la syphilis est restée élevée dans les pays en voie de développement (67).
Alors que la pathologie semblait en « voie d’extinction » dans les pays développés et que sa déclaration obligatoire prenait fin en France en 2000, celle-ci réapparait progressivement en occident, notamment parmi les hommes ayant des relations sexuelles avec les hommes (HSH) au début du 21ème siècle. Cette réémergence semble être liée à une modification des normes sociales et sexuelles, à une interaction avec l’infection au virus de l’immunodéficience humaine (VIH), à un usage de drogues, à l’augmentation de la mobilité internationale des populations et de l’immigration, ainsi qu’à un sous-investissement financier des services de santé-publique (15).
b) Ou du futur ?
Ainsi en France ont été mis en place à la fin de l’année 2000 des réseaux de surveillance (centres de dépistage et cliniciens volontaires) appelés RésIST, pour permettre d’analyser cette résurgence.
Les premiers résultats trouvaient en 2005 notamment dans le Nord-Pas de Calais (68) une importante augmentation des cas de syphilis (167 cas entre 2000 et 2005), qui s’expliquait en partie par un relâchement de la protection lors des rapports sexuels, ce qui reste dommageable
33 car la syphilis facilite la transmission du VIH (69,70) et que 56 % des cas de ce réseau présentaient une co-infection syphilis-VIH (68). L’infection touchait principalement les hommes pour la plupart HSH, avec partenaires sexuels multiples (en moyenne plus de 10 partenaires sur les 12 derniers mois) (68).
L’augmentation de 56 % des ventes d’Extencilline®
prouve qu’il s’agit bien d’une augmentation des cas de syphilis et pas seulement d’une augmentation de cas rapportés au réseau par développement de celui-ci (68).
Les résultats nationaux publiés en 2011 dans le Bulletin Epidémiologique Hebdomadaire (BEH) (18) mettent en évidence un accroissement des cas de syphilis en
France aboutissant à une relative stabilité autour de 500 cas par ans sur la période 2007-2009
(Figure 7).
Figure 7 : Nombre de syphilis précoce en France de 2000 à 2009, données du réseau RésIST
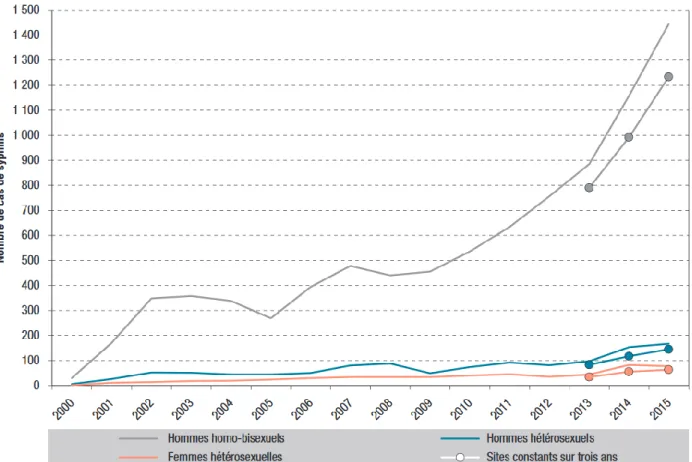
34 Cependant depuis 2009 il existe une nouvelle augmentation des cas de syphilis, toujours prédominante chez les hommes, avec en 2015 plus de 1500 cas recensés soit le triple par rapport à 2009 (Figure 8). Le nombre de syphilis précoce a effectivement augmenté de 56 % chez les HSH entre 2013 et 2015, mais aussi de 85 % chez les FSH et 75 % chez les HSF, même si ces taux restent bien plus faibles dans ces deux dernières populations (16).
Figure 8 : Nombre de cas de syphilis récente selon l’orientation sexuelle. Réseau RésIST, France, 2000-2015. (16)
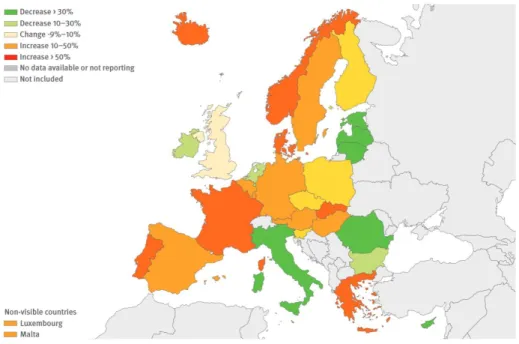
35 En Europe, l’ECDC (European Center for Disease Prevention and Control) rapportait en 2012 20802 cas de syphilis dans 30 pays européens soit 5,1 cas pour 100 000 habitants. De plus, 63 % de l’ensemble des cas diagnostiqués en Europe l’étaient dans 4 pays : l’Allemagne, la Roumanie, l’Espagne et le Royaume Uni (17) (Figure 9).
Figure 9 : Evolution du nombre de cas de syphilis dans les différents pays européens entre 2008 et 2012 (17)
Aux Etats-Unis, le CDC a rapporté en 2012 15 667 cas de syphilis précoce, soit une augmentation de 11,1 % (de 4,5 à 5 cas pour 100 000 habitants) entre 2011 et 2012 (29).
36
c) Population et facteurs de risque
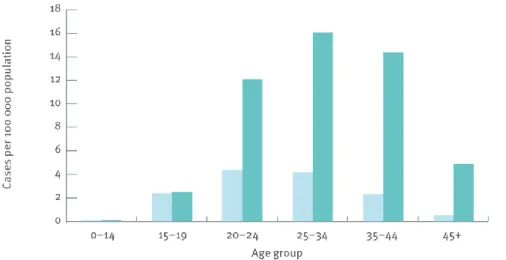
L’épidémie de syphilis qui sévit actuellement dans les pays occidentaux touche principalement les HSH, et pour la plupart âgés de plus de 25 ans (17) (Figure 10).
Figure 10 : Nombre de cas de syphilis en Europe par sexe et classe d’âge (17)
En effet en France, 95 % des cas déclarés au réseau RésIST sont des hommes, en majorité âgés de 20 à 49 ans (78 % quelle que soit l’orientation sexuelle). Il y a 84 % d’HSH et 5 % de femmes (dont 53 % âgées de moins de 29 ans) (16).
Les données américaines et européennes sont concordantes, bien que les chiffres difèrent entre les pays. Ainsi le CDC rapporte que 75 % des cas de syphilis précoce déclarés concernent des HSH. L’incidence chez les hommes était de 9,3 pour 100 000 habitants en 2012, contre 0,9 pour 100 000 habitants chez les femmes soit dix fois moins (29).
En Europe, l’ECDC montre que la majorité des cas déclarés concernent des HSH, à hauteur de 48 %. Les hommes atteints étaient quatre fois plus nombreux que les femmes (17).
D’après le réseau RésIST, l’âge médian des HSH atteints était de 36 ans, comparable à celui des hétérosexuels masculins (37 ans), mais légèrement plus élevé que celui des femmes (29 ans) (16).
Parmi les patients atteints de syphilis, 43 % présentaient une co-infection par le VIH (38 % connaissaient déjà leur séropositivité) (18), 55 % des personnes présentaient des signes cliniques évocateurs d’une IST au moment du diagnostic et 6 % présentaient des signes cliniques « autres ». Plus de 40 % étaient donc asymptomatiques (18).
37 Du point de vue des comportements sexuels, en 2014 les HSH avaient un plus grand nombre médian de partenaires sexuels sur les 12 derniers mois (6 partenaires), contre 2 partenaires pour les hommes hétérosexuels et un partenaire pour les femmes (16).
L’utilisation systématique du préservatif reste faible en 2014, avec 35,1 % lors des pénétrations anales (HSH), 23,5 % lors des pénétrations vaginales (hétéro-sexuels masculins) et 2,6 % lors des pénétrations vaginales pour les femmes hétérosexuelles (mais avec un seul partenaire en moyenne sur les douze derniers mois). 7,9 % des hommes hétérosexuels utilisaient de façon systématique le préservatif pour les fellations, contre 3,1 % des femmes et seulement 1,2 % des HSH (16), alors que la syphilis peut se transmettre lors de rapports oro-génitaux.
En effet, une étude réalisée par le CDC à Chicago rapporte que 13,7 % des cas de syphilis précoce inclus dans l’étude pourraient être dus à une transmission génito-orale de la maladie (71).
2.2 Physiopathologie
a) Microbiologie des tréponèmes
Les tréponèmes font partie de la famille des spirochètes. Ce sont des bactéries à Gram négatif, héliciformes et très motiles, qui se déplacent grâce à un filament axial qui leur permet de tourner quasiment constamment autour de leur axe longitudinal.
Ces bactéries se reproduisent par scission transversale, avec un temps de division long (environ 30 h). Longtemps considérés comme anaérobies, les tréponèmes sont en fait microaérophiles et ont donc besoin de petites quantités d’oxygène pour survivre. Ce sont par ailleurs des organismes extra-cellulaires.
La culture artificielle des tréponèmes pathogènes n’étant pour l’instant pas possible, aucune étude n’a pu être réalisée sur sa physiologie. L’étude de formes saprophytes cultivables de tréponèmes montre qu’il pourrait exister un « cycle de vie » comprenant des stades granulaires et corpusculaires sphériques (type « kystes ») en plus de la forme spirochétienne (72,73).
38 Les tréponèmes comprennent quatre genres pathogènes pour l’Homme (Figure 11) :
o Le Treponema pallidum variété S, responsable de la syphilis, est le seul de transmission vénérienne.
On lui oppose trois tréponématoses non vénériennes, responsables de lésions cutanées (complications viscérales et neurologiques rares) (19) :
o Le béjel du à Treponema pallidum variété M (endémique au Maghreb, touche principalement les enfants)
o Le pian du à Treponema pertenue (touche les enfants de pays tropicaux humides et chauds, responsable principalement de cicatrices cutanées et lésions osseuses)
o La pinta du à Treponema carateum (endémique en Amérique du sud et centrale et dans certaines zones du pacifique, responsable d’une hyperpigmentation suivie d’une dépigmentation de la peau avec hyperkératose, transmission possible par l’intermédiaire d’une mouche).
Figure 11 : Nomenclature des tréponèmes (19) Tréponématacées
(Famille des spirochètes, ordre des Spirochaetales)
Genres pathogènes pour l’Homme
Tréponèmes
Borrelia spp.
(Borréliose)
Leptospira spp.
(Leptospirose)
Treponema pallidum variété S
(syphilis)
Treponema pallidum variété M
(béjel)
Treponema pertenue
(pian)
Treponema carateum
39
b) Pathogénicité de Treponema pallidum
T. pallidum se transmet par contact direct (transmission vénérienne) ou par voie
transplacentaire. La syphilis est une pathologie spécifiquement humaine. Lors du contage, les tréponèmes vont infecter les muqueuses ou la peau (via des microlésions) puis se multiplier localement, avant d’aller infiltrer les ganglions lymphatiques et les vaisseaux sanguins.
Les lésions syphilitiques sont contagieuses (car riches en tréponèmes) généralement uniquement lors des cinq premières années de la maladie.
Il est possible de mettre en évidence les tréponèmes dans les tissus grâce à une coloration argentique, car ces bactéries réduisent le nitrate d’argent en argent métallique qui se dépose alors à leur surface. Ils peuvent aussi être mis en évidence à l’aide d’un microscope à fond noir (72,73) ou d’un microscope électronique, même si ces techniques ne sont plus utilisées en pratique courante.
Bien que leurs antigènes soient inconnus, on sait que les tréponèmes (indépendamment de leur genre) stimulent la sécrétion par le corps humain d’anticorps (73) :
o Spécifiques, détectés notamment lors des sérologies type TPHA
o Non spécifiques de type réagine, correspondant à des anticorps anti-cardiolipine (détectés lors des sérologies VDRL)
Les tréponèmes sont très sensibles à la sécheresse et à la chaleur, mais sont aussi immobilisés et tués par l’arsenic, le mercure ou le bismuth (qui ont pu être utilisés comme traitement avant la découverte des antibiotiques).
Ils sont très sensibles à la pénicilline, qui est tréponémicide à de faibles concentrations, mais avec un taux de destruction qui reste lent (du fait de leur temps de division lent) et qui oblige l’utilisation de pénicillines retard dans le traitement de la syphilis (73).
40
2.3 Clinique, stadification et classification
La syphilis peut être divisée en plusieurs stades cliniques :
a) Syphilis précoce
Elle correspond à une syphilis datant de moins de un an à partir du premier jour du chancre. Elle est le plus souvent contagieuse, et regroupe les anciennes « syphilis primaire », « syphilis secondaire précoce » et « syphilis latente précoce » (74).
Un chancre apparaît 2 à 6 semaines après le contage (15) (ou entre 10 et 90 jours selon les études(20)). Ulcéré, il est généralement indolore, unique, induré et à bords bien définis au niveau du point de contage. Ce chancre peut être difficilement mis en évidence, notamment chez les femmes ou les HSH où, indolores et intra-vaginaux ou intra-rectaux, ils peuvent passer inaperçus (20). Les lésions peuvent aussi être atypiques, parfois multiples et douloureuses, mimant des lésions herpétiques. Il convient donc d’être vigilant pour toute lésion ulcérée au niveau génital ou rectal (voire de la cavité buccale) et ne pas hésiter à renouveler les sérologies en cas de doute (75).
Le chancre disparaît en quelques jours à semaines grâce à l’immunité cellulaire immédiate de la personne infectée (phagocytose par les macrophages) (15).
Une éruption cutanée, secondaire à la dissémination bactériémique des tréponèmes, apparaît souvent 6 semaines après la disparition du chancre, mais peut survenir jusqu’à 6 mois après le contage. Les manifestations précoces sont à type roséole, composée de macules rose pâle, prédominant sur le tronc et disparaissant généralement sans séquelles en un ou deux mois
Lors d’un rapport sexuel avec une personne porteuse d’une syphilis précoce, il y a transmission de la pathologie au partenaire dans environ 50 % des cas (76).