FACULTÉ DES SCIENCES
Rabat
Faculté des Sciences, 4 Avenue Ibn Battouta B.P. 1014 RP, Rabat – Maroc
N° d’ordre : 2670
THÈSE DE DOCTORAT
Présentée par
Meriame BRICHA
Discipline : Science chimie
Spécialité : Physico-chimie des matériaux, céramiques, nanocomposites.
Synthèse et caractérisation des biocéramiques nanocomposites à base
d’hydroxyapatite substituée en magnésium /
nanotubes de carbone multiparois
Soutenue le :
21 Septembre 2013.Devant le jury
Président :
- Professeur El Mokhtar ESSASSI.
Examinateurs:
- Lahcen EL AMMARI: Professeur à l’université Mohammed V- Agdal.
- Fouad OUAZZANI CHAHDI: Professeur à la Faculté des Sciences et Techniques - Fès. - José. Maria da Fonte FERREIRA: Professeur à l’université d’Aveiro- Portugal.
- Khalil EL MABROUK : Directeur du centre biomatériaux céramiques à Mascir - Nanotech à Rabat.
FACULTÉ DES SCIENCES
Rabat
Faculté des Sciences, 4 Avenue Ibn Battouta B.P. 1014 RP, Rabat – Maroc
N° d’ordre : 2670
THÈSE DE DOCTORAT
Présentée par
Meriame BRICHA
Discipline : Science chimie
Spécialité : Physico-chimie des matériaux, céramiques, nanocomposites.
Synthèse et caractérisation des biocéramiques nanocomposites à base
d’hydroxyapatite substituée en magnésium /
nanotubes de carbone multiparois
Soutenue le :
21 Septembre 2013.Devant le jury
Président :
- Professeur El Mokhtar ESSASSI.
Examinateurs:
- Lahcen EL AMMARI: Professeur à l’université Mohammed V- Agdal.
- Fouad OUAZZANI CHAHDI: Professeur à la Faculté des Sciences et Techniques - Fès. - José. Maria da Fonte FERREIRA: Professeur à l’université d’Aveiro- Portugal.
- Khalil EL MABROUK : Directeur du centre biomatériaux céramiques à Mascir - Nanotech à Rabat.
FACULTÉ DES SCIENCES
Rabat
Faculté des Sciences, 4 Avenue Ibn Battouta B.P. 1014 RP, Rabat – Maroc
N° d’ordre : 2670
THÈSE DE DOCTORAT
Présentée par
Meriame BRICHA
Discipline : Science chimie
Spécialité : Physico-chimie des matériaux, céramiques, nanocomposites.
Synthèse et caractérisation des biocéramiques nanocomposites à base
d’hydroxyapatite substituée en magnésium /
nanotubes de carbone multiparois
Soutenue le :
21 Septembre 2013.Devant le jury
Président :
- Professeur El Mokhtar ESSASSI.
Examinateurs:
- Lahcen EL AMMARI: Professeur à l’université Mohammed V- Agdal.
- Fouad OUAZZANI CHAHDI: Professeur à la Faculté des Sciences et Techniques - Fès. - José. Maria da Fonte FERREIRA: Professeur à l’université d’Aveiro- Portugal.
- Khalil EL MABROUK : Directeur du centre biomatériaux céramiques à Mascir - Nanotech à Rabat.
immutable truths and eternal dogmas: its aim is to approach the truth by successive approximations, without claiming that at any stage final and complete accuracy has been achieved. »
Bertrand Arthur William RUSSELL Prix Nobel de littérature en 1950
A la personne que j’ai tant souhaité qu’elle assiste à ma soutenance : mon très regretté papa, qui m’a donné un magnifique modèle de persévérance et de courage. Cette thèse représente l’aboutissement des encouragements qu’il m’a prodigué tout au long de ma scolarité. A ma très chère maman, mes frères pour leur soutien et leurs sacrifices le long de ma formation. A mon cher mari Youssef et ma petite nounou Bayane, pour sa compréhension, son support et son encouragement au quotidien. J’espère qu’ils trouveront dans ce travail toute ma reconnaissance et tout mon amour.
AVANT PROPOS
Les travaux de cette thèse ont été réalisés dans le cadre de la convention liant l’Université
Mohammed V-Agdal de Rabat et la Fondation MAScIR. Lesdits travaux ont été effectués au Laboratoire de Chimie Organique Hétérocyclique, Pôle de Compétences Pharmacochimie, Université Mohammed V-Agdal, Rabat, MAROC sous la direction de Monsieur le Professeur El Mokhtar ESSASSI et la co-direction de Monsieur le Docteur Khalil EL MABROUK, directeur du centre biomatériaux céramiques à Mascir - Nanotech à Rabat, qui m’a introduit aux biomatériaux.
Je tiens à exprimer tout d’abord mes remerciements à mon directeur de thèse, le Professeur El
Mokhtar ESSASSI, pour m’avoir donné cette opportunité et pour m’avoir transmis une partie de leurs connaissances et leur savoir-faire. Je serais toujours admiratif de votre rigueur scientifique, de votre créativité, de votre efficacité et de votre amour pour la précision. Je tiens également à vous
remercier pour la disponibilité, la patience et les conseils savants qui m’ont permis d’avancer dans
les moments difficiles, dans la chimie et dans la vie, MERCI !
Aussi à mon co-directeur, Monsieur le Docteur Khalil El MABROUK, directeur du centre biomatériaux céramiques à Mascir - Nanotech à Rabat, qui m’a introduit aux biomatériaux, Au
cours de ma thèse, il a su me passionner pour les substituts osseux et m’a encouragé à poursuivre mon parcours de recherche. Je le remercie d’avoir toujours trouvé le temps pour discuter, son
expérience et son intérêt pour le sujet ont permis un avancement significatif de la thèse. Merci Said pour ta qualité scientifique et humaine, tu as été comme mon grand frère.
J’adresse un grand merci aux membres du jury, qui ont accepté d’évaluer mon travail de thèse.
Je souhaite remercier le Professeur Fouad OUAZZANI CHAHDI et le Professeur José. Maria da Fonte FERREIRA d’avoir accepté d’être les rapporteurs de ce manuscrit. Merci également au Professeur Lahcen EL AMMARI d’avoir bien voulu participer au jury.
Je tiens à remercier Mascir-Nanotech (Morrocan association of scientific and innovation research- nanotechnologie), pour m’avoir accueilli au sein de son laboratoire Nanotech, les chercheurs Abdelkrim EL KADIB et Nadia KATIR, ainsi que tout le personnel de la plate-forme pour avoir toujours cherché (et trouvé !) de bonnes solutions pour la caractérisation et l’étude biologique et mécaniques des céramiques et les céramiques nanocomposites, notamment Soumia MAZZI, Tarik MAHFOUD, Mohamed EL KHADRI et Abdelkrim ELIRAOUI. Je les remercie de
m’avoir accueilli dans cette unité et de m’avoir permis d’effectuer ma thèse dans de très bonnes
conditions matérielles et humaines.
Mes remerciements s’adressent également à Monsieur Professeur José. Maria da Fonte
FERREIRA de l’Université d’Aveiro de Portugal pour son apport essentiel et pour sa contribution scientifique à distance.
Tous mes remerciements à mes collègues et amis du laboratoire !!! Younes, Monsieur aux
innombrables talents, avec lequel j’ai partagé les sommets et les creux de la thèse. Et mes autres
co-bureaux : Walid, Mounir, Hassan…
Mes plus grands remerciements vont aux gens que j’ai pu avoir oublié ! Bonne chance aux nouveaux thésards et thésards à Mascir-Nanotech.
Liste des abréviations
HA Hydroxyapatite
n-HA Hydroxyapatite nanopoudre
MEB Microscope électronique à balayage
DRX Diffraction des rayons X
MET Microscope électronique à transmission
FTIR Spectroscopie infrarouge à transformée de Fourrier
UV-Vis Spectroscopie Ultraviolet visible
BET Théorie Brunauer, Emett et Teller
ATG Analyse thermogravimétrique
ICP-AES Spectrométrie par torche à plasma- spectrmétrie atomique d’émission
Ca Calcium
P Phosphore
Mg Magnésium
CTAB Bromure d'hexadécyltriméthylammonium
SDS Sodium dodécyl sulfate
Triton X-100 4 - (1, 1, 3,3 – tétraméthylbutyl) phényl- Polyéthylènglycol, t –
octylph énoxypolyéthoxyéthanol, Polyéthylènglycol tert -octylphényléther
Span 60 Monostéarate de sorbitane
Pluronic 127 Poly (éthylène glycol) - bloc -poly (propylène glycol) - bloc -poly (éthylène glycol)
Tpm Tours par minute
NTCs Nanotube de carbone
MWNTs Nanotubes de carbone multifeuillets
SWNTs Nanotubes de carbone monofeuillets
Table des matières
Introduction générale 2
Chapitre I 7
I. Tissu osseux 8
I.1. Fonctions et architecture des os 8
I.1.1. Composition du tissu osseux 11
I.1.2. L’os naturel 11
I.2. Matrice extracellulaire osseuse 12
I.2.1. La phase organique de la matrice extracellulaire 12
I.2.2. La phase minérale de la matrice extracellulaire 12
I.3. Cellules osseuses 13
I.3.1. Les cellules ostéoblastique 13
I.3.2. La différenciation ostéoblastique 14
I.3.3. Les cellules ostéoclastiques 14
I.4. Remodelage osseux 15
I.4.1. Phase d’activation 15
I.4.2. Phase de résorption 16
I.4.3. Phase de réversion ou d’inversion 16
I.4.4. Phase de formation 16
I.4.5. Les facteurs de croissances impliqués lors du remodelage osseux 17
II. Biomatériaux céramiques 18
II.1. Définition des biomatériaux 18
II.2. Biomatériaux naturels : greffe osseuse 18
II.2. 1. Autogreffe 19
II.2. 2. Allogreffe 19
II.2. 3. Xénogreffe 19
II.3. Biomatériaux synthétiques 19
II.3. 1. Céramiques phosphocalciques 20
II.3. 2. Phosphates de calcium apatitique : hydroxyapatite 21
II.3. 3. Apatites biologiques 21
III. Hydroxyapatite nanopoudres 22
III.1. Méthodes de synthèse de l’hydroxyapatite nanopoudre 22
III.1.1. Synthèse à l’état solide 23
III.1.2. Synthèse à l’état humide 23
III.1.2.a. Précipitation chimique 23
III.1.2.b. Voie hydrothermale 24
III.1.2.c. Voie Sol gel 24
III.1.2.d. Technique de la microémulsion 25
III.2. Propriétés de l’hydroxyapatite 26
III.3. Applications de l’hydroxyapatite 26
III.4. Substitutions dans l’hydroxyapatite 27
III.4.1. Structure cristallographique de l’hydroxyapatite 27
III.4.2. L’hydroxyapatite substituée en magnésium 28
III.4.3. Procédés d’élaboration de l’MgHA 28
III.4.4. Intérêt biologique de la substitution en magnésium 29
IV. Nanotubes de carbone (NTCs) 30
IV.1. Structure et propriétés 31
IV.2. Différentes méthodes de synthèse 34
IV.2.1. Décharge d'un arc électrique 34
IV.2.2. Ablation laser 34
IV.2.3. Dépôt chimique en phase vapeur (CCVD – CVD) 35
IV.3. Fonctionnalisation des NTCs 35
IV.3.1. Fonctionnalisation covalente 36
IV.3.2. Fonctionnalisation non covalente 37
IV.3.2. 1. Dispersion par les tensioactifs 37
IV.3.2. 2. Dispersion par les polymères ou les copolymères à blocs 39
IV.4. Propriétés biologiques 42
V. Biocompatibilité des nanocomposites HA/ NTCs 43
VI. Problématique de l’étude 45
VI.1. La mise en œuvre des NTCs : un défi ! 45
VI.2. Objectifs de la thèse 46
Chapitre II 59
A. Synthèse et caractérisation de l’hydroxyapatite nanopoudre 61
A.I. Introduction 61
A.II. Choix de la méthode de synthèse 61
A.III. Objectifs 62
A.IV. Synthèse de l’hydroxyapatite 62
A.IV. 1. Présentation de la méthode de synthèse 62
A.IV. 2. Protocole expérimental 63
A.V. Caractérisation de l’hydroxyapatite nanopoudre 64
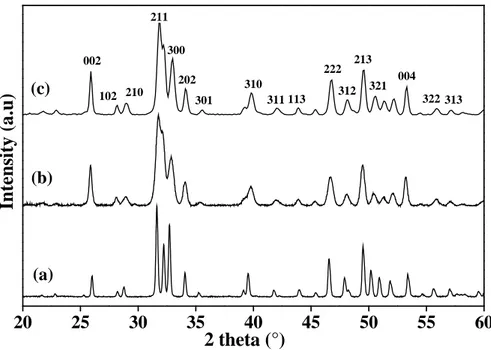
A.V. 1. Etude Structurale Diffraction des rayons X 64
A.V.1.1. Techniques de caractérisation 64
A.V.1.2. Analyse qualitative par diffraction des rayons X 65
A.V.1.3. Affinement de paramètres de maille sur diffractogramme de rayons X 66
A.V.1.4. Résultats 66
A.V. 2. Etude par spectroscopie Infrarouge à Transformée de Fourier 68
A.V.2.1. Techniques de caractérisation 68
A.V.2.2. Résultats 69
A.V.3. Etude morphologique – Microscope électronique à transmission 71
A.V.3.1. Techniques de caractérisation 71
A.V.3.2. Résultats 71
A.VI. Discussion 73
A.VII. Conclusion 79
B. Synthèse hydrothermale de l’hydroxyapatite dopée au magnésium 80
B.I. Introduction 80
B.II. Choix de la méthode de synthèse des nanopoudres 81
B.III. Objectifs 82
B.IV. Synthèse des nanopoudres d’hydroxyapatite dopée au magnésium 82
B.IV.1. Méthode et protocole de synthèse des poudres 82
B.IV.2. Paramètres de synthèse 83
B.V. Caractérisation des poudres brutes synthétisées 86
B.V.1. Analyse structurale par diffraction des rayons X des poudres 86
B.V.1.2. Affinement des paramètres cristallins des poudres 89
B.V.2. Etude spectroscopique infrarouge des nanopoudres 90
B.V.3. Comportement thermique des nanopoudres 92
B.V.3.1. Technique de caractérisation 92
B.V.3.2. Résultats 93
B.V.4. Caractérisation physique des poudres : mesure de surface spécifique 95
B.V.4.1. Technique de caractérisation 95
B.V.4.2. Résultats 98
B.VI. Caractérisation des nanopoudres calcinées 102
B.VI.1. Analyse structurale par DRX 102
B.VI.1.1. Analyse qualitative 102
B.VI.1.2. Affinement des paramètres 107
B.VI.2. Analyse spectroscopique 108
VI.3. Microscopie électronique par transmission des nanopoudres 111
B.VI. Discussion 113
B.VII. Conclusions 115
Chapitre III 122
-I. Etude in vitro de la bioactivité des céramiques en Mg0,0-HA et MgxHA nanopoudre 124
I.1. Introduction 124
I.2. Objectifs 124
I.3.Choix du milieu utilisé 125
I.3.1. Intérêts des tests in vitro 125
I.3.2. Préparation du milieu SBF 125
I.4. Protocole expérimental 127
I.4.1. Préparation des échantillons 127
1.4.2. Immersion des échantillons 127
I.5. Caractérisation physicochimiques de la surface des céramiques après immersion 128
I.5.1. Analyse des surfaces par DRX 128
I.5.2. Analyse de la couche formée en surface par FTIR 130
I.5.3. Morphologie des échantillons et analyse des surfaces après immersion 131
I.5.3.1. Technique de caractérisation 131
I.5.3.2. Résultats 132
I.5.4. Analyse des solutions SBF après immersion 137
I.5.4.1. Technique de caractérisation 137
I.5.4.2. Résultats 138
I.6. Conclusion partielle 142
II. Evaluation des propriétés mécaniques des céramiques 142
II.1. Introduction 142
II.2. Objectifs 142
II.3. Etude expérimentale 143
II.3.1. Préparation des échantillons 143
II.3.2. Géométrie des éprouvettes 143
II.4. Analyse mécanique : test en flexion 143
II.4.1. Principe 144
II.4.2. Dispositif expérimental 145
II.4.3. Analyse ou réalisation des essais 145
II.5. Densification des pastilles frittées 146
II.5.1. Technique de caractérisation 146
II.6. Comportement mécanique 149
II.7. Conclusion 151
Chapitre IV 155
I. Introduction 157
II. Objectifs 158
III. Purification des nanotubes de carbone Multifeuillets (MWNTs) 159
III.1. Protocole expérimental 160
III.2. Caractérisation des MWNTs purifiés 160
III.2.1. Comportement thermique des nanopoudres (ATG) 160
III.2.2. Etude morphologique – Microscope électronique à transmission 161
III.3. Conclusion 162
IV. Fonctionnalisation par oxydation à l’acide nitrique 163
IV. 1. Protocole 163
IV.2. Caractérisation des MWNTs oxydés 164
IV.2.1. Spectrométrie Infrarouge (FTIR) 164
IV.2.2. Analyse thermogravimétrie (ATG) 164
IV.2.3. Microscopie électronique à transmission (MET) 165
IV.3. Conclusion 166
V. Dispersion et fonctionnalisation des NTCs 166
V.1. Utilisation des ultrasons 167
V.2. Fonctionnalisation non covalente 168
V.2.1. Protocol expérimental 168
V.2.2. Caractérisation des MWNTs fonctionnalisés 168
V.2.2.1. Spectrophotométrie UVvisible 168
V.2.2.2. Potentiel zêta 176
V.2.2.3. Microscopie électronique à transmission 180
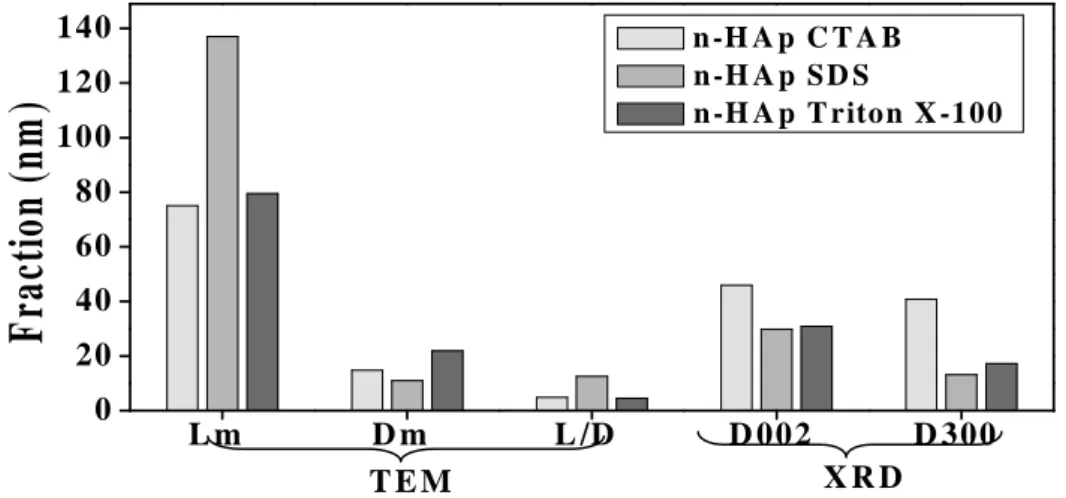
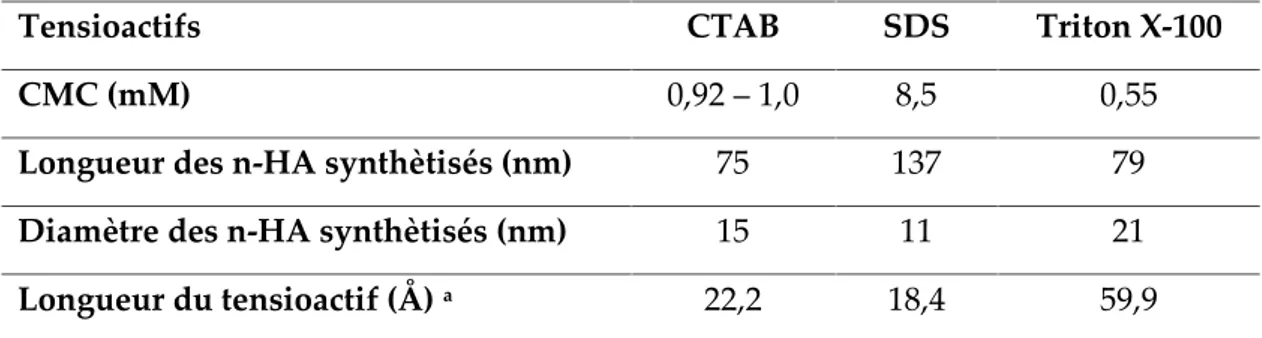
V.3. Comparaison de l’efficacité des différents tensioactifs 182
VI. Conclusion 183
Chapitre V 188
I. Propriétés mécaniques des céramiques composites MgHA/MWNTs 190
I.1. Introduction 190
I.2. Objectifs 190
I.3. Protocol expérimental 191
I.4. Caractérisation structurale des matériaux denses nanocomposites 192
I.5. Propriétés physiques et mécaniques 193
I.5.1. Taux de densification 193
I.5.2. Résistance en flexion à trois points 195
I.6. Conclusion 198
II. Etude de la bioactivité des céramiques composites MgHA/MWNTs 198
II.1. Introduction 198
II.2. Objectifs 199
II.3. Protocole expérimental d’immersion 199
-II.4. Caractérisation physico-chimique de la surface des céramiques nanocomposites après immersion dans le SBF 199
II.4.1. Analyse des surfaces par DRX 199
II.5. Analyse des solutions après immersion dans le SBF 204
II.6. Résumé des observations pour les céramiques nanocomposites (MgHA/MWNTs) 207
II.7. Conclusion 208
Conclusion générale & perspectives 213
-Glossaire--- 219
Résumé--- 221
Introduction générale
Le squelette osseux qui représente la charpente du corps humain, peut être sujet à des fractures ou des blessures induisant la perte de la substance osseuse. Cette perte, peut être conséquence d’un accident, d’un traumatisme ou des pathologies, qui peuvent altérer les fonctions
du tissu osseux. Le système osseux intervient pour réparer l’endommagement de l’os par un
phénomène de remodelage osseux, ou parfois suite à des facteurs de l’âge, des déficiences fonctionnaires et le régime alimentaire, ce mécanisme de remodelage osseux reste insuffisant d’où un apport de la matière extérieure est donc nécessaire. Les chirurgiens tentent à remédier à ces problèmes par le remplacement du site osseux endommagé ou par sa reconstruction. C’est dans
cette bordure, que ce confirme l’utilisation des biomatériaux. Ils sont sollicités de plus en plus, parce qu’ils présentent une sécurité clinique que les greffes osseuses naturelles ne peuvent offrir.
Les biomatériaux trouvent leurs applications en orthopédie, en ophtalmologie, en odontologie et dans le système cardiovasculaire. Ils peuvent être regroupés en des matériaux artificiels (métaux et alliages métallique, céramique au sens large, polymère et la matière molle) et
des matériaux d’origine naturelle (allogreffes, autogreffes, hétérogreffes, xénogreffes, cellulose)…
Le développement et l'amélioration des matériaux synthétiques, pour des applications biologiques
L’hydroxyapatite (HA) a été largement étudiée en tant que matériau de substitution osseuse, due à
ses caractéristiques biologiquement actives, issues de sa similarité chimique avec le composant minéral de l'os. Outre, la structure chimique de l’HA Ca10(PO4)6(OH)2peut accepter une variété de
substitution. En considérant, la substitution cationique, le magnésium est quantitativement le plus
important des ions bivalent associé à l’apatite biologique. Tandis que l’HA et Mg-HA ont la
capacité de favoriser la croissance osseuse le long de sa surface, leurs propriétés mécaniques, en particulier, la résistance et la ténacité, sont insuffisantes pour des applications principales porteuses de charges. Renforcer l’hydroxyapatite substituée en magnésium avec une seconde phase, offre une possibilité pour surmonter ces limitations.
Un matériau idéal renforçant serait d'assurer l'intégrité mécanique du composite sans impact négatif sur ses propriétés biologiques. Les nanotubes de carbone (NTCs), considérés comme l'un des matériaux les plus solides et les plus rigides, disponibles, ont un excellent potentiel d’accomplir cette tâche. Ayant un rapport d'aspect très haut, des fibres de diamètres nanométriques (1-100 nm) et des longueurs (0,001 à 6 mm), les NTCs ont une grande surface spécifique sur laquelle peuvent
interagir d’autres matériaux de la matrice. En outre, la surface des nanotubes de carbone peut être fonctionnalisée afin d’améliorer cette interaction.
Il est à noter que, les NTCs ont montré précédemment un potentiel de renforcement de polymères et de certains métaux et céramiques. Plusieurs publications ont abordé les composites HA-NTCs spécifiquement, mais aucun travail à notre connaissance n’est parvenu à étudier les nanocomposites Mg-HA/NTCs. Cependant, les études réalisées n’ont pas montré une vision cohérente de tous les aspects des nanocomposites, englobant la fabrication, le traitement des techniques de densification, le comportement mécanique et le comportement biologique. De même les recherches actuelles se contredisent quant à savoir si les NTCs peuvent induire une réponse cytotoxique, ou, peut-être même, améliorer les processus cellulaires. Ainsi, une attention particulière doit être accordée à l'impact biologique de la présence des NTCs.
Le présent travail porte sur l’élaboration, l’étude physicochimique, d’une hydroxyapatite
nanopoudre synthétique substituée en magnésium, tout en respectant une approche biomimétique avec un rendement très satisfaisant, un coût et un temps de réaction réduits, pour qu’elle soit un bon candidat pour la réalisation des céramiques nanocomposites, en utilisant les nanotubes de carbone multiparois fonctionnalisés comme renfort.
Cette étude visait à examiner les nanocomposites Mg-HA / nanotube de carbone multiparois dans six domaines principaux, avec les objectifs suivants:
1) Production et caractérisation des nanopoudres HA et Mgx-HA :
a. Synthèse des nanopoudres d’HA par la méthode hydrothermale en utilisant trois
b. Caractérisation des poudres HA produites ;
c. Etude de l’effet de chaque tensioactif sur la taille et la forme des nanopoudres.
d. Exploitation de la méthode hydrothermale pour la synthèse d’une phase pure et
bien cristallisée des nanopoudres d’hydroxyapatite substituée en magnésium avec des teneurs croissantes en magnésium ;
e. Caractérisations physico-chimiques des nanopoudres Mgx-HA.
2) Enquêtes sur les propriétés mécaniques et biologiques des céramiques Mgx-HA:
a. Caractérisation des matériaux frittés en atmosphères différentes, y compris la pureté de phase et la densité.
b. Effet du taux de magnésium sur la résistance en flexion et l’activité biologique en
milieu acellulaire (SBF).
c. Choix de la poudre d’hydroxyapatite substituée en magnésium ayant de meilleures propriétés biologiques acellulaires et des résistances en flexion modeste, afin de justifier
l’usage des nanotubes de carbone.
3) Fonctionnalisation des nanotubes de carbone multiparois :
a. Réaliser la fonctionnalisation organique des NTCs via une oxydation de surface en
vue de leur dispersion et de l’amélioration de leur réactivité de surface,
b. Effectuer la fonctionnalisation non-covalente des NTCs via un revêtement contrôlé de tensioactif ou de copolymères à blocs à leur surface.
c. Choisir deux tensioactifs produisant une bonne dispersion des nanotubes de
carbone pour la suite de l’étude.
4) Production et caractérisation des matériaux nanocomposites : a. Techniques pour combiner Mg-HA et les NTCs ;
b. Effet de fonctionnalisation des NTCs sur l'homogénéité des composites et
l’interaction des NTCs avec la matrice Mg-HA ;
c. Caractérisation des pastilles préparées par pression uniaxiale, y compris l'apparence et la densité.
5) Evaluation des propriétés mécaniques :
a. Optimisation du profil de frittage pour obtenir des matériaux censés donner des propriétés mécaniques optimales.
b. Caractérisation des matériaux frittés contenant à la fois la matrice Mg-HA et les NTCs fonctionnalisés avec une gamme de charge, notamment la pureté de la phase, et la densité.
c. Essai de la résistance en flexion des nanocomposites Mg-HA/ f-MWNTs.
6) Enquête préliminaire de la réponse biologique in vitro en milieu acellulaire :
a. Effet des nanotubes de carbone fonctionnalisés sur la dissolution et la précipitation de la nouvelle phase apatitique.
b. Influence des caractéristiques de chaque type de nanotubes de carbone fonctionnalisé sur la croissance de l’apatite.
Cette thèse s’articule autour de cinq chapitres. Elle commence par un survol (Chapitre I) sur les matériaux du remplacement osseux, en particulier l’HA, l’Mg-HA ainsi que des NTCs, avant
d'examiner, plus en profondeur, les céramiques nanocomposites Mg-HA/MWNTs, ainsi que le contexte de cette étude. Dans le deuxième chapitre de ce manuscrit, une étude approfondie sur la synthèse et la caractérisation physico-chimiques des nanopoudres d’hydroxyapatite et
d’hydroxyapatite substituée en magnésium. Les propriétés biologiques et mécaniques des
céramiques à base des nanopoudres d’hydroxyapatite et d’hydroxyapatite substituée en magnésium,
ont fait l’objectif du troisième chapitre.
La fonctionnalisation organique des NTCs via une oxydation de leur surface, suivie d’un
revêtement contrôlé de tensioactifs ou de copolymères à blocs en surface des NTCs, sera abordée dans le chapitre quatre. Nous avons procédé aux caractérisations par la spectroscopie UV-vis et le suivi du potentiel zêta (stabilité de la dispersion) et structurale des systèmes SDS-NTCs et Span-60-NTCs.
Enfin, dans le dernier chapitre, l’élaboration de matériaux nanocomposites Mg-HA/NTCs est présentée. Ces composites ont été obtenus par frittage sous gaz inerte, avec une composition en NTCs, variant entre 0 et 5 % en masse. Les propriétés biologiques et mécaniques de ces nanocomposites ont été largement étudiées pour des applications ultérieures comme biomatériaux orthopédiques ou pour la substitution osseuse. Une conclusion générale fournit des suggestions pour l'étude future des céramiques nanocomposites Mg-HA/NTCs.
Chapitre I
Revue bibliographique
Chapitre I
Revue bibliographique
Le but de cette revue bibliographique est de donner un « background » détaillé sur les
matériaux de la substitution osseuse et plus particulièrement l’hydroxyapatite (HA) et l’hydroxyapatite substituée en magnésium (Mg-HA), les nanotubes de carbone (NTCs) et les
céramiques composites avec un examin très profond des publications récentes sur les composites à
base d’HA/NTCs.
La synthèse bibliographique, de ce manuscrit, s’articule en cinq parties. Les principaux constituants du tissu osseux, ainsi que son processus de renouvellement, seront détaillés, dans un premier temps avant de présenter les matériaux à base de phosphates de calcium, utilisés en
chirurgie réparatrice, et plus spécifiquement ceux à base d’hydroxyapatite, ainsi que les nombreuses
substitutions ioniques rencontrées dans les phosphates de calcium. Elle aborde, plus particulièrement, l’intérêt biologique de l’incorporation du magnésium dans ces matériaux.
Dans le but d’améliorer les propriétés biologiques et mécaniques des biocéramiques, la quatrième partie de ce chapitre, expose les NTCs, le matériau de renfort choisi pour renforcer
l’hydroxyapatite afin de produire un matériau composite dans cette étude. Ensuite, les propriétés
des céramiques composites sont discutées, avec un intérêt particulier sur leurs propriétés biologiques et mécaniques. Enfin, la cinquième partie donne une étude approfondie sur les récents travaux réalisés sur la biocompatibilité des nanocomposites à base HA/NTCs.
I. Tissu osseux
Le tissu osseux est un tissu conjonctif spécialisé, constitué de cellules dispersées dans une matrice osseuse : la matrice extracellulaire. La première partie de ce paragraphe est destinée à décrire
l’architecture des os, ainsi que leurs fonctions. Dans un second temps, les principaux constituants de la
matrice extracellulaire seront présentés avant de préciser les différentes cellules coexistantes dans le tissu osseux. Ces cellules participent au remodelage osseux, phénomène qui sera détaillé dans une quatrième partie.
I.1. Fonctions et architecture des os
L’os humain, avec les dents, constitue le tissu le plus dur de l’organisme. De taille et de
forme diverses, les os, dont le nombre se situe entre 208 et 214, forment ensemble le squelette humain. Les os ont essentiellement une fonction de soutien corporel et de protection des organes,
l’os crânien par exemple protège le cerveau. En contact entre eux par les articulations, les os constituent les points d’attache des muscles et des tendons impliqués dans la locomotion. Les os ont
également une fonction métabolique. Le tissu osseux est un tissu vivant constamment remodelé, ce qui entraine la libération ou le stockage de sels minéraux. Ainsi, le tissu osseux d’un adulte
renferme 1100 g de calcium, soit 99 % du calcium total de l’organisme et environ 600 g de phosphore, soit 85% du phosphate total de l’organisme. En outre, en abritant la moelle osseuse
rouge, ou se forment les cellules sanguines, et la moelle osseuse jaune, qui renferme un tissu adipeux de réserve, les os possèdent une fonction hématopoïétique.
La forme des os est très variée, elle dépend de leur fonction et de leur situation dans le
corps. C’est ainsi qu’ils sont classés selon cinq catégories (Figure I.1.) :
Figure I. 1. Classification des os[1].
Les os longs, tels que le fémur, le radius ou le tibia, sont composés d’un corps (la diaphyse)
zone qui est le siège de la croissance osseuse, la métaphyse. La diaphyse est bordée d’os cortical délimitant une cavité centrale, appelée le canal médullaire, remplie de la moelle
osseuse jaune lipidique. Les épiphyses sont constituées d’une couche d’os compact contenant de l’os spongieux empli de la moelle osseuse rouge.
Les os plats, tels que l’os pariétal ou le sternum, sont composés de deux couches d’os
compact enfermant une couche de tissu spongieux.
Les os courts, comme la rotule ou les os du poignet, sont composés d’un noyau d’os spongieux entouré d’une fine couche d’os compact. La forme des os courts peut être
arrondie, pyramidale, ovoïde ou cubique.
Les os irréguliers, par exemple le sphénoïde ou le bassin, n’appartiennent à aucune des
catégories citées ci-dessus à cause de leurs formes très irrégulières. Ils comportent des quantités variables de tissu spongieux et compact.
Les os sésamoïdes, apparaissent dans certains tendons soumis à des contraintes physiques
considérables, tels ceux de la paume des mains et de la plante des pieds. Ils ne sont pas toujours ossifiés.
Figure I. 2. Coupe partielle d’un os long [1].
La figure I. 3. présente une coupe partielle d’un os long. Excepté au niveau des surfaces
articulaires, où se trouvent les cartilages, les os sont entourés par le périoste, constitué d’une couche externe de tissu conjonctif et d’une couche interne contenant les cellules ostéoprogénitrices assurant la croissance des os en épaisseur. Le canal médullaire des os longs est bordé par l’endoste, constituée d’une petite quantité de tissu conjonctif et d’une couche unique de cellules
ostéoprogénitrices. L’os est donc un ensemble de tissus conjonctifs spécialisés, constitué de cellules
dispersées dans une matrice osseuse.
De nombreux espaces séparent la matrice osseuse des cellules. Certains de ces espaces fournissent un accès aux vaisseaux sanguins qui approvisionnent les cellules en nutriments.
D’autres servent de stockage de la moelle rouge. La taille et la répartition de ces espaces
déterminent les régions composées de tissu osseux compact et celle composées de tissu osseux spongieux (Figure I.3.). Le tissu osseux compact ou cortical est situé en périphérie des os. Il est
composé d’unités appelées ostéons ou systèmes de Havers.
Figure I. 3. Histologie du tissu osseux compact et spongieux [1].
Chaque unité est formée de plusieurs couches de lamelles osseuses disposées concentriquement autour du canal de Havers qui contient les vaisseaux sanguins et les nerfs. Cette
disposition confère à l’os compact un maximum de résistance. Le tissu osseux spongieux ou trabéculaire constitue la partie interne de l’os situé sous le tissu cortical.
Beaucoup moins dense que le tissu cortical, il est constitué d’un réseau tridimensionnel de lamelles osseuses, ou trabécules osseuses. L’orientation de ces trabécules suit les lignes de forces auxquelles l’os est soumis car les cellules qui les fabriquent ont la capacité de percevoir ces forces. Cette architecture particulière délimite un système d’espaces inter-communicants, site de stockage
I.1.1. Composition du tissu osseux
Le tissu osseux naturel est comparable à un matériau composite, constitué d’une trame
organo-minérale et de cellules osseuses. La phase minérale est constituée de l’hydroxyapatite carbonatée mal cristallisée, alors que la phase organique est formée de 95 % de collagène, une glycoprotéine fibreuse, joue le rôle de la trame osseuse (Figure I.4.).
Les cellules osseuses sont présentées par deux composants, à savoir l’ostéoblaste qui construit la masse osseuse et l’ostéoclaste la dégrade, l’activité de ces deux types cellulaires est en
action synergique perpétuelle pour assurer le maintien du squelette osseux, et assurer ainsi le remodelage osseux [2].
L’os, charpente de l’appareil locomoteur, offre au corps une protection et un soutien des
parties molles et renferme la moelle rouge qui assure la formation des érythrocytes (globules rouges
et d’énergie) [3]. En outre, les os ont la capacité de détoxifier le corps en éliminant tous ce qui est
toxique et les métaux lourds tels que le plomb et l’arsenic.
Figure I.4. Graphique de la composition du tissu osseux.
I.1.2. L’os naturel
La composition moyenne de l’os naturel est de 70 % de la phase minérale, 10 % d’eau et 20 %
de la matière organique [5]. Le tissu osseux qui peut être divisé en deux catégories :
- Os compact ou cortical : un tissu dur et massif, formé des ostéons entre lesquelles
s’interposent les lamelles osseuses.
- Os spongieux : Moins dur, il est formé des lamelles osseuses délimitant de petites cavités.
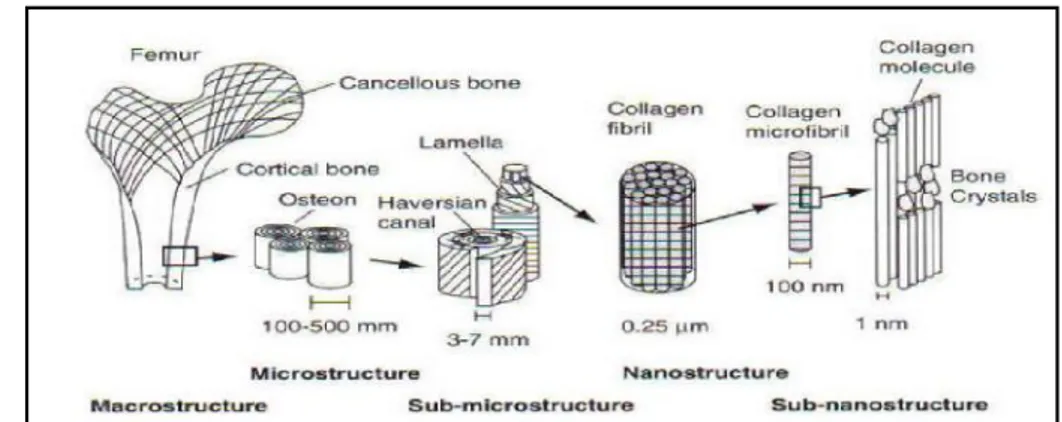
Figure I.5. Figure présentant la macrostructure, la sub-microstructure et la nanostructure
I.2. Matrice extracellulaire osseuse
I.2.1. La phase organique de la matrice extracellulaire
La matrice organique, quasi exclusivement composée de fibres de collagène de type I,
constitue la substance protéinique de l’os. Représentant environ 90 % du poids de la matrice organique de l’os sec, le collagène est une glycoprotéine fibreuse, rigide, en forme de tresse à trois brins, qui confère à l’os sa flexibilité. La partie organique du tissu osseux contient par ailleurs de
nombreuses protéines non collagéniques tels que les glycoprotéines (ostéonectine, ostéopontine, sialoprotéine, fibronectine), les protéines contenant des résidus d’acide glutamique carboxylé (ostéocalcine), les phosphoprotéines, les phospholipides, les protéoglycanes et les facteurs de
croissance. Beaucoup de ces protéines (l’ostéopontine, la sialoprotéine, la fibronectine…) possèdent
une séquence peptidique Arginine (ARG) – Glycine (GLY) – Acide aspartique (ASP), communément appelée « RGD ». Cette séquence RGD se lie spécifiquement à des récepteurs membranaires appelés intégrines [7]. Ainsi, l’adhésion des cellules osseuses à la matrice est facilitée [8]. En plus de promouvoir l’adhésion cellulaire, ces protéines favorisent également la migration des cellules [9].
I.2.2. La phase minérale de la matrice extracellulaire
La partie minérale de l’os est essentiellement constituée de phosphate de calcium dont la composition chimique est proche de l’hydroxyapatite phosphocalcique Ca10(PO4)6(OH)2. Le tissu
calcifié peut se définir comme une apatite mal cristallisée, déficitaire en calcium et partiellement substituée par des ions hydrogénophosphates (HPO42-) et carbonate (CO32-). L’os naturel contient,
de plus, de nombreux ions en substitution, tels les ions sodium, potassium, fluorure, magnésium, strontium et chlorure [10]. La composition chimique de l’os dépend du type d’os et de son âge : par
exemple, la teneur en ions carbonate augmente avec l’âge [10]. Une des formules chimiques de la partie minérale de l’os proposée dans la littérature est la suivante [12]:
Ca8,3(PO4)4,7(HPO4, CO3)1,3(CO3,OH)0,3
D’un point de vue morphologique, les cristaux d’apatite osseuse se présentent sous forme d’aiguilles d’une centaine d’angströms de longueur [13] et se sont situés de façon périodique dans
la matrice collagéniques [14]. L’axe le plus long de ces aiguilles d’apatite est aligné parallèlement
aux fibres de collagène, ce qui confère à l’os sa solidité. Du fait de cette architecture, l’interface
entre les composants minéraux et organiques est très étendue : chez un adulte, elle est de l’ordre de 400 000 à 500 000 m2. Une telle particularité explique la rapidité des échanges calciques dans le
I.3. Cellules osseuses
Dans le tissu osseux, deux lignées cellulaires coexistent (Figure I.6.) :
La lignée hématopoïétique qui conduit à la formation des cellules sanguines et des
ostéoclastes ;
La lignée mésenchymateuse qui génère, entre autre, la formation des ostéoblastes.
Tandis que les ostéoclastes contribuent à la résorption du tissu osseux ancien, les ostéoblastes assurent la synthèse de la nouvelle matrice osseuse. Ces cellules agissent de manière coordonnée lors du remodelage osseux. La source principale des cellules ostéoprogénitrices est la moelle osseuse.
Figure I. 6. Les différentes cellules osseuses [1].
I.3.1. Les cellules ostéoblastique
Les cellules de la lignée ostéoblastique sont issues de cellules souches non spécialisées dérivées du mésenchyme. Ces cellules se multiplient par mitose et conduisent à la formation des préostéoblastes, cellules allongées situées au contact des ostéoblastes matures. Elles peuvent se
différencier en ostéoblastes dont la fonction est, d’une part, de synthétiser les constituants
organiques de la matrice extracellulaire (MEC) et, d’autres part, d’initier la calcification.
L’ostéoblaste mature est une cellule mononuclée de 20 à 50 µm de diamètre, alignée perpendiculairement le long de la matrice osseuse qu’elle synthétise. Après déposition de la MEC
par les ostéoblastes, trois possibilités sont envisageables :
A mesure que les ostéoblastes s’entourent de MEC, ils restent prisonniers de leurs sécrétions
et se transforment en ostéocytes. Ces cellules fusiformes sont les principales cellules du tissu osseux constitué. Elles sont reliées, entre elles et avec les cellules de la surface osseuse, par des extensions de la membrane cytoplasmique. Elles maintiennent les activités cellulaires quotidiennes du tissu osseux, par exemple ses échanges de nutriments et de déchets avec le sang.
D’autres ostéoblastes deviennent progressivement aplatis et forment une couche de cellules
Enfin, les ostéoblastes peuvent mourir par mort cellulaire programmée ou « apoptose ».
I.3.2. La différenciation ostéoblastique
Les cellules souches mésenchymateuses peuvent se différencier en chondroblastes,
ostéoblastes ou adipocytes. La différenciation vers l’une ou l’autre voie implique l’expression de
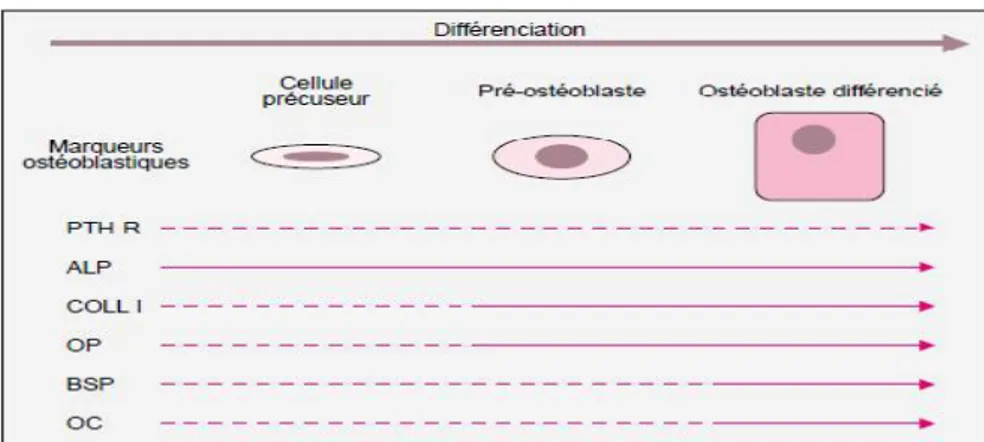
facteur de transcription. Pour la différenciation ostéoblastique, il s’agit de l’expression de Cbfa1/ Runx2. La différenciation ostéoblastique se caractérise, in vitro, par une succession d’étapes au cours desquelles, différents marqueurs phénotypiques sont exprimés (Figure I.7.).
Figure I.7. Principaux marqueurs exprimés au cours de la différenciation de l’ostéoblaste (- - - -) : faible expression,
_____: forte expression [15].
Les cellules de la lignée ostéoblastique se caractérisent par une activité en phosphatase alcaline (ALP pour alkaline phosphatase) élevée. Cette glycoprotéine, exprimée au cours du développement osseux, est impliquée dans le processus de minéralisation. Elle constitue le premier
marqueur de la différenciation ostéoblastique. Il s’en suit alors une phase de maturation cellulaire
durant laquelle sont exprimés des gènes associés à la production de la matrice extracellulaire : ALP, collagène de type I (COLL I), ostéopontine (OP), fibronectine (AUB 01).
L’ostéopontine est une phosphoglycoprotéine comportant une séquence adhésive RGD. Elle intervient dans la phase d’ancrage des ostéoblastes à la matrice osseuse minéralisée. Lorsque les
ostéoblastes sont différenciés, ils expriment des marqueurs associés à la minéralisation de la matrice osseuse : sialoprotéine osseuse (BSP) et ostéocalcine (OC).
I.3.3. Les cellules ostéoclastiques
Les précurseurs des ostéoclastes sont les cellules hématopoïétiques de la lignée monocyte/ macrophage avec le CFU-GM (Granulocyte and Macrophages Colony Forming Cells) comme premier précurseur identifié. Les ostéoclastes matures sont des cellules géantes (20 à 100 µm de diamètre), plurinucléées (Figure I. 6.). La morphologie des ostéoclastes se caractérise par une bordure en brosse formée par des extensions « en doigts » de la membrance cytoplasmique. La
fonction de la bordure en brosse est la destruction de l’os. Ils sècrétent des enzymes lysosomiales et
des acides qui digèrent les protéines et les minéraux de la matière osseuse sous-jacente, formant ainsi des « lacunes de Howship ». Les ostéoclastes sont très mobiles; ils se déplacent sur les travées
osseuses et à l’intérieur des lacunes de résorption qu’ils créent.
I.4. Remodelage osseux
Les os commencent à se former avant la naissance. La masse globale osseuse augmente
jusqu’à la vie adulte et les os continuent de se renouveler par la suite. Le remodelage est un processus continu par lequel du nouveau tissu osseux remplace l’ancien, assurant ainsi un maintien
de la masse osseuse au cours de la vie adulte. En tout temps, 3 à 5 % de la masse osseuse totale du corps est en cours de remaniement [16]. Le taux de renouvellement du tissu compact est d’environ 4% par an, et celui du tissu osseux spongieux est d’environ 20 %. Le processus de remodelage
osseux s’effectue grâce à des unités fonctionnelles de remodelage gouvernées par l’action couplée des ostéoclastes et des ostéoblastes. L’os est ainsi formé de millions d’unités fonctionnelles de
remodelage mobiles progressant dans le tissu osseux. Un cycle de remodelage dure environ quatre
mois chez l’adulte, la phase de formation étant plus longue que celle de la résorption. Ce cycle de
remodelage, illustré à la figure I.8. a, est divisé en quatre étapes distinctes et fait intervenir de nombreux facteurs de croissance.
Figure I. 8. (a) Illustration du cycle de remodelage osseux [15] et (b) rôle des ostéoblastes
et ostéoclastes durant le remodelage osseux [17].
I.4.1. Phase d’activation
Lors de la phase d’activation, des préostéoclastes fusionnent pour former les ostéoclastes. La surface osseuse est normalement recouverte de cellules bordantes qui empêchent l’accès des ostéoclastes à la MEC. Sous l’action d’une simulation hormonale, ces cellules bordantes se rétractent et libèrent l’accès aux ostéoclastes néoformés qui peuvent ainsi adhérer à la matrice
Les ostéoblastes sont indispensables au processus de différenciation des ostéoclastes (Figure I. 8. b). En effet, les cellules stromales ostéoblastiques expriment la protéine RANK-L (Receptor Activator of nuclear factor kB Ligand) qui stimule l’ostéoclasogenèse en se liant à son récepteur, la
protéine RANK, situé à la surface des précurseurs ostéoclastiques. A l’inverse, l’ostéoprotégérine
(OPG), facteur soluble également produit par les ostéoblastes, agit comme un antagoniste de RANK-L, et empêche la différenciation ostéoclastique [18], [19]. La production de RANK-L et
d’OPG par les cellules stromales ostéoblastiques est sous la dépendance des hormones et des
cytokines qui contrôlent la résorption osseuse.
I.4.2. Phase de résorption
Chaque ostéoclaste devenu actif se fixe aux protéines de la matrice osseuse (fibronectine, ostéopontine, collagène I, sialoprotéine) par des intégrines, initiant alors la phase de résorption. Cet ancrage à la surface osseuse délimite un compartiment de résorption. La partie minérale de l’os est dissoute par des ions H+sécrétés par des pompes à protons situées au niveau de la bordure en brosse
des ostéoclastes. Cette acidité favorise la dissolution du cristal d’apatite qui libère de sels minéraux (calcium, phosphore), permettant la mise à nue de la matrice organique, et provoque l’activation enzymatique. C’est également au niveau de la bordure en brosse que le contenu enzymatique des
ostéoclastes est déversé. Ces enzymes (phosphatases acides, métalloprotéinases et cathepsines) sont destinées à diriger les constituants de la MEC.
I.4.3. Phase de réversion ou d’inversion
Lorsque les ostéoclastes ont achevé la formation d’une lacune de résorption, ils meurent par
apoptose et sont remplacés par des macrophages qui lissent le fond de la lacune. La surface osseuse libérée par les ostéoclastes, qui correspond au fond de la lacune de Howship, est appelée ligne
cémentante. Elle est riche en éléments tels que l’ostéopontine qui activerait les ostéoblastes. Au bout d’une à deux semaines, cette phase aboutit au recrutement des cellules ostéoprogénitrices dans
la moelle osseuse.
I.4.4. Phase de formation
A l’issue de la résorption osseuse, les cellules ostéoprogénitrices viennent tapisser le fond de
la lacune de Howship, au niveau de la ligne cémentante puis se divisent et se différencient en
ostéoblastes. Ces ostéoblastes sécrètent d’abord une nouvelle matrice collagénique, non
minéralisée, appelée tissu ostéoïde, qui vient combler la lacune de résorption. Cette matrice est structurée par les fibres de collagène où les protéines non collagéniques sont intriquées. La vitesse
croissance, sécrétés par les ostéoblastes et stockés dans la matrice osseuse, sont relargués sous forme active pour stimuler la production de cette matrice. Leur nom et leur rôle sont précisés dans le paragraphe suivant.
Dans un second temps, les ostéoblastes matures contrôlent la minéralisation du tissu
néoformé par dépôt de cristaux d’apatite phosphocalcique, en régulant les concentrations locales en
ions calcium Ca2+et phosphate PO43-. Le calcium et le phosphate du milieu extracellulaire se lient
au niveau du cytoplasme de la cellule ostéoblastique et sont transférés sur le site de minéralisation via les ostéoblastes. Le produit de la réaction est un complexe phosphocalcique éliminé vers la
matrice osseuse sous forme de cristaux d’apatite biologique dans les espaces interfibrillaires du
collagène. L’expression de phosphatase alcaline (ALP), enzyme synthétisée par les ostéoblastes,
est, à ce stade de la formation osseuse, un marqueur important puisqu’elle hydrolyse les esters
phosphoriques inhibiteurs de la minéralisation.
A l’issue de la minéralisation, une partie des ostéoblastes meurt par apoptose, l’autre partie
devient des ostéocytes inclus dans la matrice osseuse et des cellules bordantes qui recouvrent la
surface de l’os à l’état quiescent (cf. paragraphe I.3.1.).
I.4.5. Les facteurs de croissances impliqués lors du remodelage osseux
Les facteurs de croissance sont des protéines sécrétées par des cellules, qui agissent de manière spécifique sur une ou plusieurs cellules cibles. Reconnus par des récepteurs membranaires spécifiques, ils agissent sur la division cellulaire, la synthèse de la matrice, la différenciation des
tissus… Présents en petites quantités dans le MEC, les facteurs de croissance jouent un rôle
important dans le processus de reconstruction osseuse et sont parfois indispensables à la différenciation et à la survie des cellules osseuses (Figure I. 8. b).
Le facteur de croissance TGF β (Transforming Growth Factor β),localisé dans plusieurs tissus et notamment dans l’os, influence de nombreuses activités cellulaires (croissance,
différenciation, synthèse de MEC …etc.) [20]. Fortement impliqué au cours du processus de repousse osseuse, il stimule la formation des ostéoblastes et inhibe celle des ostéoclastes [21]. Les BMPs (Bone Morphogenic Proteins), de la famille des polypeptides TGF β, sont impliquées lors de la croissance cellulaire et de la formation osseuse. In vitro, des propriètés ostéoinductrices leur ont été attribuées [22]. Les BMPs, en particulier BMP-2, 4 et 7, sont connues pour stimuler la différenciation des cellules mésenchymateuses [23]. Dans l’os, l’une des plus importantes BMPs est la BMP-2 qui active le facteur de transcription spécifique des ostéoblastes, le Cbfa 1 [24]. D’autres facteurs de croissance, tels que les IGF (Insulin Growth Factor) ou les PDGF ( Platelet Derived Growth Factor) stimulent également la différenciation et la proliférenciation et la prolifération des ostéoblastes.
L’angiogenèse correspond au mécanisme de croissance de nouveaux vaisseaux sanguins à
partir de vaisseaux préexistants. Il a été démontré, ces dernières années, l’importance de ce procesus
pour assurer le maintien du tissu osseux et garantir la guérison d’une fracture [25], [26]. Le FGF (
Fibroblast Growth Factor) est un faceur de croissance induisant le processus d’angiogenèse. Il possède, de plus, un effet mitogénique sur les cellules mésenchymateuses et les ostéoblastes [27]. Le facteur de croissance angiogénique VEFG (Vascular Endothelial Growth Factor), qui assure la survie, la migration et la prolifération de cellules endothéliales, semble également étre impliqué dans le processus de la repousse osseuse [28].
II. Biomatériaux céramiques
II.1. Définition des biomatériaux
Un biomatériau est un matériau non vivant utilisé dans un dispositif médical destiné à interagir avec les systèmes biologiques [29].
Plusieurs recherches se sont orientées, vers la synthèse et le développement de nouveaux matériaux,
afin d’assurer le bon fonctionnement de quelques charges, que le corps n’est plus capable d’assurer, suite au vieillissement. L’intégration de ces biomatériaux, dans le corps humain nécessite la
présence des critères de bioactivité, biocompatibilité et biotolérance. Ils trouvent de multiples utilisations, que ce soit en chirurgie orthopédique, en ophtalmologie, ou en chirurgie cardiaque. Les biomatériaux peuvent être groupés en quatre familles :
Matériaux d’origine naturelle [30] Métaux et alliages métalliques. Céramiques en sens large. Polymères et la matière molle.
Les biocéramiques synthétiques, du comblement osseux, doivent être bien tolérés par
l’organisme et capables de créer des liaisons fortes et intimes avec le tissu osseux environnant, ainsi que la propriété d’être résorbé progressivement, afin de permettre la recolonisation du site d’implantation par l’os néoformé [31].
II.2. Biomatériaux naturels : greffe osseuse
L’os constitue le meilleur substitut pour la réalisation d’une greffe osseuse réussie, puisqu’il
possède toutes les caractéristiques essentielles pour un parfait comblement osseux. Allogreffe,
autogreffe, xénogreffe sont les principaux types de la substitution osseuse, suivant l’origine du
II.2. 1. Autogreffe
Les greffes autologues sont le matériel de choix pour la chirurgie restructive. Bien entendu, afin de concrétiser une autogreffe, le meilleur matériel prélevé est celui du patient lui même, ayant
les mêmes critères présentés. Dans ce cas, le donneur et l’accepteur ont le même complexe majeur d’histocompatibilité (CMH), donc le taux de réussite de cette intervention est très notable. Parfois, lorsque l’âge du patient, ou la localisation de la partie à remplacer, ne le permet pas, la
reconstitution par autogreffe devient impossible [30].
II.2. 2. Allogreffe
L’allogreffe provient d’un donneur et d’un récepteur différents, mais de la même espèce
biologique, possédant des CMH distincts. Les allogreffes sont les greffes les plus facilement disponibles. Dans ces cas, elles sont souvent accompagnées par des risques de transmission de maladies infectieuses, d’où un traitement immunosuppresseur, qui vise à prévenir le rejet de la
greffe, est toujours obligatoire. Une difficulté supplémentaire est liée à la faculté d’adaptation de la structure, outre que le retard du remodelage osseux par l’os. Dans le cas, de défaut osseux très important, l’allogreffe pourrait devenir un site d’infection et de fractures, suite à sa présence
régulière durant la vie entière du patient [32].
II.2. 3. Xénogreffe
Autrement nommée hétérogreffe, elle désigne la transplantation d’un greffon (cellule, tissu, organe vivant), où le donneur et l’accepteur appartiennent à deux espèces biologiques différentes. Dans ce cas, le greffon subit une série de traitements préalables, afin d’éliminer toute trace d’agents infectieux [29].
Le développement de nouveau biomatériau synthétique de comblement osseux, est un secteur en plein essor, afin de permettre un meilleur contrôle de la résorption et de la substitution des
biomatériaux par de l’os.
Il est vrai que l’os reste le matériel du premier choix, pour la substitution osseuse, vu la
présence de beaucoup de points de similitude, il présente quand même des limites d’utilisation, en
tant qu’un greffon osseux, liées à la possibilité de la transmission des agents infectieux, ainsi que du
coût non négligeable, en comparaison avec les substituts osseux synthétiques.
II.3. Biomatériaux synthétiques
Les substituts osseux sont une alternative aux greffes osseuses naturelles pour la réparation
osseuse, la substitution et l’augmentation du volume. Particulièrement ces biomatériaux
II.3. 1. Céramiques phosphocalciques
De nombreux travaux fondamentaux ont été portés sur les biocéramiques phosphocalciques, en tant que substitut du tissu osseux en chirurgie odentologique, cardiaque et orthopédique. Les
céramiques sont des matériaux à l’état solide moyennement utilisés, contenant des phases amorphes. Les céramiques phosphocalciques, regroupent l’hydroxyapatite HA, tricalcium
phosphate sous ses deux formes : α-TCP, ß-TCP, phosphate octocalcique triclinique (OCP t).
L’appel des céramiques de phosphates de calcium repose en grande partie sur leur biocompatibilité, ainsi qu’aucune réponse immunologique ni une toxicité systémique n’ont été
reportées suite à leur utilisation in vitro et in vivo. Ces céramiques de phosphate de calcium
possèdent une remarquable capacité d’ostéoconduction, c'est-à-dire ils sont capables de se lier à l’os
directement, et de servir comme un support à la formation d’un os néoformé grâce à leur porosité, et peuvent aussi être résorbable (dégradation par un mécanisme chimique avantagé par les micropores [33].
En effet, ces biocéramiques phosphocalciques ont une composition chimique proche de celle du tissu dur osseux et des dents. Leurs caractéristiques de biocompatibilité, bioactivité et
biorésorbabilité, font de ces matériaux une bonne alternative de comblement lors d’un défaut osseux
important, et un vecteur de relarguage de principes actifs [5].
Ces phosphates de calcium ont une forte capacité de dissolution dans les milieux biologiques tels que le « Simulated body fluid » (SBF), qui dépend fortement des caractéristiques physico-chimiques, et plus particulièrement le rapport molaire Ca/P, la surface spécifique et la structure cristallographique [5]. Suivant le rapport molaire Ca/P, on distingue différents types de phosphates de calcium, classés dans le tableau ci-dessous :
Tableau I. 1. Les différents phosphates de calcium usuels [34].
Formule Ca/P Nom (abréviation)
Ca (H2PO4)2
Ca (H2PO4), H2O
0,5 0,5
Phosphate monocalcique anhydre (MCPA) Phosphate monocalcique monohydraté (MCPM) CaHPO4, 2H2O CaHPO4 Ca2P2O7 1 1 1
Phosphate dicalcique dihydraté ou brushite (DCPD) Phosphate dicalcique anhydre ou monétite (DCPA) Pyrophosphate de calcium (PPC)
Ca8H2(PO4)6, 5H2O
Ca8(HPO4)2.5(PO4)3.5(OH)0.5
Ca8(PO4)4(HPO4)2, nH2O
1,33 1,33 1,33
Phosphate octocalcique triclinique (OCPt) Phosphate octocalcique apatitique (OCPa) Phosphate octocalcique amorphe (OCPam)
Ca3(PO4)2 Ca9(HPO4)(PO4)5OH Ca9(PO4)6, n H2O 1,5 1,5 1,5 Phosphate tricalcique (TCP)
Phosphate tricalcique apatitique (TCPa) Phosphate tricalcique amorphe
Ca10(PO4)6(OH)2 Ca4O (PO4)2 1,67 2 Hydroxyapatite (HA) Phosphate tétracalcique (TTCP)
II.3. 2. Phosphates de calcium apatitique : hydroxyapatite
Parmi les céramiques de phosphates de calcium, l’hydroxyapatite est le matériau qui possède
une composition chimique et une structure cristallographique similaire à celle de la phase
inorganique minérale de l’os. L’hydroxyapatite est biocompatible, ayant un profil biologique très
attractif. Sa structure chimique et cristalline est la même que la phase majoritaire de la partie
minéral de l’os. Il est établi actuellement, que l’hydroxyapatite est un matériau sûr, non toxique et
stable [35], [36].
Durant les trente dernières années, un large intérêt a été focalisé sur la synthèse des phosphates de calcium hydroxyapatitique, en raison de la variété de ses applications médicales, spécialement en orthopédie, et en odontologie. L’hydroxyapatite peut être d’origine biologique, à
partir des os des mammifères ou du corail, comme elle peut être d’origine synthétique. Cependant,
il existe des paramètres qui doivent être pris en considération tels que : la taille, la morphologie, la
stœchiométrie, la composition des phases et la cristallinité des nanoparticules [37], [38].
Différentes méthodes ont été développées au laboratoire, permettant la synthèse de
l’hydroxyapatite, comme la précipitation chimique [39], [40], [41], [42], [43], le processus sol gel
[16] , [44] , [45] , [46], [47] la méthode hydrothermale [48], [49], [50], la microémulsion [51], [52], [35] , et par la voie de la pyrolyse [53], [54].
II.3. 3. Apatites biologiques
Les apatites sont des minéraux phosphatés, qui existent abondamment sur terre, sous la forme carbonatée ou de fluoroapatite. Toute la famille des phosphates de calcium progresse naturellement vers la forme apatitique la plus stable.
Les apatites biologiques, étant définies comme des apatites phosphocalciques carbonatées. Leurs cristaux constituent les os et les dents, ces apatites osseuses contiennent 99 % des réserves de
calcium de l’organisme et de 85 % de celle du phosphore. Elles appartiennent à la grande famille
des phosphates de calcium, constituant capital, des tissus durs des vertébrés. Elles sont représentées par la formule chimique générale M10(XO4)6Y2
Avec : M : un cation bivalent (Ca, Sr, Pb, Cd…) XO4: un anion trivalent (PO4, AsO4, VO4…)
Y: un anion monovalent (OH, F, Cl, Br, I…)
Les apatites cristallisent dans la plupart des cas dans le système hexagonal. En effet, ils ont
la capacité de faire diverses substitutions, et d’immobiliser les ions une fois en solution aqueuse : le calcium de l’os peut être remplacé par des ions bivalents (Pb 2+, Cd2+…). XO4peut être substitué
par des anions tels que AsO43-, VO43-, …etc.
III. Hydroxyapatite nanopoudres
L’hydroxyapatite est largement utilisée comme céramique bioactive en chirurgie osseuse.
Les premières identifications structurelles des biominéraux, en utilisant la diffraction des rayons X, ont été obtenues par Jong en 1926. Il a établi que les biominéraux phosphocalciques des vertébrés
correspondaient à une structure d’apatite, et depuis ce temps, la partie osseuse minérale a été
fréquemment identifiée comme l’hydroxyapatite (HA), de formule chimique générale de Ca10(PO4)6(OH)2[55].
L’hydroxyapatite est similaire chimiquement à la fraction minérale des tissus osseux durs,
elle est constituée des mêmes ions qui constituent la partie minérale des dents et des os. Elle montre une excellente biocompatibilité non seulement avec les tissus durs, mais aussi avec les tissus mous,
tels que la peau et le muscle. En outre, elle est bioactive, et favorise l’ostéo-intégration lorsqu’elle
est directement implantée dans l’os [6].
III.1. Méthodes de synthèse de l’hydroxyapatite nanopoudre
Ces dernières années, l’hydroxyapatite synthétique (HA), un intérêt substantiel, lui est
attribué, et une grande importance en raison de sa similitude chimique avec le calcium phosphate naturel minéral, présent dans un tissu biologique dur [56].
En considération de ses propriétés de bioactivité et de biocompatibilité, l’hydroxyapatite a
de multiples applications que ce soit dans le domaine médical et dentaire [57], [58], ou dans le domaine environnemental comme adsorbant des métaux toxiques, plusieurs méthodes de synthèse
ont été mises en œuvre, tout en utilisant une gamme de réactifs différents et des conditions de
traitements divers.
Les synthèses de l’hydroxyapatite s’effectuent par deux voies distinctes : la voie sèche
« réactions en phase solide », où les précurseurs sont à l’état solide, elle résulte souvent à des
produits caractérisés par un degré de cristallinité et une stœchiométrie très élevés, et la méthode
humide en utilisant des réactifs en solution, elle englobe la technique de la précipitation chimique,
une stœchiométrie et un degré de cristallinité bien contrôlables peuvent être obtenues, en fonction de la technique mise en œuvre [59].
III.1.1. Synthèse à l’état solide
La synthèse à l’état solide entre le calcium et le phosphore, met en jeu des poudres de
réactifs, tels que (CaHPO4. 2H2O)s et (Ca(OH)2)s. La réaction est portée à une température de
300-1200 °C, sous les pressions de 20 – 670 MPa, pour 10 minutes.
Comparativement à la préparation par voie humide, la synthèse par voie sèche a le grand avantage
de fournir des poudres d’hydroxyapatite stœchiométrique. Cette synthèse peut être effectuée selon
les réactions suivantes :
6CaHPO4+ 4 Ca(OH)2 Ca10(PO4)6(OH)2+ 6 H2O
3 Ca3(PO4)2+ Ca(OH)2 Ca10(PO4)6(OH)2 + H2O
Cependant, cette voie exige un niveau relativement élevé de la température et la durée de
traitement. En outre, la tendance de frittage d’une telle nanopoudre est généralement faible [5].
III.1.2. Synthèse à l’état humide
III.1.2.a. Précipitation chimique
La technique la plus couramment utilisée pour la formation d’HA est la technique de
précipitation, impliquant des réactions chimiques par voie humide entre les précurseurs de calcium et de phosphate en vertu des températures et des conditions de pH bien contrôlés. Cette méthode apparaît plus favorable en raison de sa simplicité, sa rentabilité et de son caractère non polluant (c'est-à-dire son seul sous-produit est l'eau) [60].
La méthode de précipitation améliore la réactivité des composés, mais la précipitation incomplète
conduit à une alternance entre la stoechiométrie et l’homogénéité chimique qui ne peuvent être
aisément obtenues grâce à des différences de solubilité ou de complexation entre les diverses espèces chimiques [61].
Généralement, la synthèse par précipitation chimique, permet d’obtenir des nanopoudres
d’hydroxyapatite avec une large surface spécifique. Néanmoins, cette méthode a des inconvénients
inhérents, principalement la difficulté de contrôler la valeur du pH au dessus de 9, pour éviter la
formation d’une HA déficiente en calcium, qui subit la décomposition facile lors du frittage,
formant ainsi les phosphates tricalciques [63], [64]. Outre que les nanopoudres d’HA obtenues ne sont pas toujours stoechiométriques et possèdent une basse cristallinité dont le degré dépend de plusieurs facteurs de la synthèse, comme le pH, la température, la nature et la concentration des réactifs ainsi que le temps de la maturation [64].