HAL Id: dumas-01305543
https://dumas.ccsd.cnrs.fr/dumas-01305543
Submitted on 21 Apr 2016HAL is a multi-disciplinary open access
archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires
Évaluation de l’Élastance Artérielle Dynamique (Eadyn)
comme marqueur prédictif d’augmentation de la
Pression Artérielle Moyenne en réponse à une épreuve
de remplissage vasculaire au bloc opératoire
Romain Lanchon
To cite this version:
Romain Lanchon. Évaluation de l’Élastance Artérielle Dynamique (Eadyn) comme marqueur prédictif d’augmentation de la Pression Artérielle Moyenne en réponse à une épreuve de remplissage vasculaire au bloc opératoire. Médecine humaine et pathologie. 2016. �dumas-01305543�
UNIVERSITE DE BORDEAUX
U.F.R DES SCIENCES MEDICALES
Année 2016 Thèse n° 3016
Thèse pour l’obtention du
DIPLOME D’ETAT DE DOCTEUR EN MEDECINE
Spécialité Anesthésie-Réanimation Présentée et soutenue publiquement
Le 05 Avril 2016 par
Romain LANCHON
Né le 30 Janvier 1987 à NOISY-LE-GRAND (93)
Evaluation de l’Elastance Artérielle Dynamique (Eadyn) comme marqueur prédictif
d’augmentation de la Pression Artérielle Moyenne en réponse à une épreuve de remplissage vasculaire au bloc opératoire.
Directeur de thèse :
Monsieur le Docteur Matthieu BIAIS
Jury
Madame le Professeur Karine NOUETTE-GAULAIN Présidente
Monsieur le Professeur Bruno FONTAINE Juge
Monsieur le Professeur Didier GRUSON Juge
A notre présidente de jury de thèse,
Madame le Professeur Karine NOUETTE-GAULAIN
Professeur des Universités en Anesthésie-Réanimation
Praticien Hospitalier
Chef de service
Je te remercie pour la confiance que tu me portes.
Je te remercie également pour ta disponibilité et ton indéfectible soutien qui m’ont permis de réaliser de beaux projets. En espérant qu’ils soient encore nombreux.
Tes qualités humaines et ton leadership me guident au quotidien.
Un jour tu m’as dit : « que les petites choses devaient rester des choses petites »…. Tu avais raison…
A notre jury de thèse,
Monsieur le Professeur Bruno FONTAINE
Professeur agrégé de l’Ecole du Val-de-Grâce
Spécialiste des Hôpitaux des Armées
Chef de service
Chef du Pôle Anesthésie-Réanimation-Urgences, HIA Robert Picqué
Nous sommes très honorés de votre présence dans ce jury.
Mon semestre passé dans votre service a été très enrichissant professionnellement et humainement. La bienveillance que vous m’avez témoignée m’a beaucoup touché. Soyez assuré de mon plus profond respect.
Monsieur le Professeur Didier GRUSON
Professeur des Universités en Réanimation Médicale
Praticien Hospitalier
Chef de service - Adjoint
Vous nous faites l’honneur de juger cette thèse.
Vos compétences et vos connaissances sont reconnues de tous. Soyez assuré de notre reconnaissance la plus sincère.
A notre rapporteur de thèse,
Monsieur le Docteur Laurent STECKEN
Praticien Hospitalier
Je te remercie pour ta relecture attentive et tes remarques pertinentes. Sois assuré de mes sincères remerciements et de ma profonde reconnaissance.
A notre directeur de thèse,
Monsieur le Docteur Matthieu BIAIS
Maître de Conférences des Universités en Anesthésie-Réanimation
Praticien Hospitalier
Responsable d’unité
Il est difficile d’exprimer en quelques lignes le profond respect que j’ai pour ton travail au quotidien et ton investissement dans notre formation. C’est un privilège de pouvoir bénéficier de ton enseignement. Merci de me permettre de travailler à tes côtés.
Merci de ta disponibilité et cela malgré toutes tes obligations.
Merci également d’avoir su au quotidien canaliser mon obstination frôlant parfois l’entêtement…
A mes proches,
A mes parents,
Pour leur soutien et leur amour,
Pour la fierté que je lis dans leurs yeux,
Et tout ce qu’ils m’ont apporté mais dont ils n’ont qu’une toute petite idée.
A ma sœur, Hélène, et mon frère, Benjamin,
Pour avoir supporté le petit-frère « terrible », Pour m’avoir montré la bonne voie,
Et au final, pour être toujours présents malgré la distance.
A Anne-Fabienne et à Yannick,
Pour m’avoir accepté et me considérer comme votre fils, Pour tous ces bons moments passés ensemble,
Et pour m’avoir toujours encouragé.
A Jean-Louis,
Pour la joie et le bonheur que tu as su apporter à ma mère,
Pour être mon plus fidèle traducteur, correcteur et expert médical.
A Nicole,
Pour rendre heureux mon père,
A mes amis, co-internes et autres rencontres,
A mes amis, d’hier à aujourd’hui : Paul et Maud, compagnons de la première heure, devenu
des amis proches et des témoins de vie. Quand on y pense, on ne s’en est pas si mal sorti… Paul, ton amitié m’est toujours aussi précieuse. Aux Angevins pour ces années passées ensemble. Nos barbecues au lac du Maine et nos soirées vins/fromages me manquent. Merci à vous de m’avoir accueilli en cours de route : Charlotte (sans oublier Arnaud), Nadia et Jérôme, Thomas et Elsa, Marine et Adrien. Merci à vous Natalya et Matthieu, c’est un privilège de pouvoir vous compter parmi nos amis (et je suis d’accord avec toi Matthieu, cela valait le coup, c’était le meilleur coiffeur de Guyane…). Merci à toi aussi Sarah (sans oublier Jérôme). Merci à Florian et Clémentine pour ces soirées et ces longues discussions. On portera haut les couleurs de Bordeaux à votre départ de Tahiti. Florian, je te renvoie le compliment, tu es toi aussi un des meilleurs conseillers fiscalo-conjugo-anesthésique du marché. Merci à vous : Henri-Louis, Jean-Claude, Arnaud et Pierre-André, co-internes de la première heure, devenus au fil du temps de véritables amis. Merci également à vous, compagnons d’infortunes grâce auxquels ces cinq années ont été merveilleuses : Antoine, Thomas, Lucie, Sébastien, Simon P et M, Nadia, Elsa, Alexandre, Hélène, Julien, Elodie, Eva, Florent, Hugues, Grégoire, Joris, Elie, Kevin, Guillaume, Jonathan, Yassine. Merci aussi à Guillaume B-N, Benjamin R et Benoît B (vous étiez internes à l’époque…). Merci à Léo mi-temps pour ce semestre inoubliable. Merci aussi à toi Julien, bien plus qu’un voisin, et ne t’inquiètes pas le PSG va gagner…
A tous ces chefs que j’ai croisé et qui ont marqué ma formation: Barbara K et Delphine P;
Ariane G, David T-V et Philippe L (merci d’avoir guidé mes premiers pas en réanimation); Joachim C, Cédrik Z (tes plats de pâtes méritent d’être au guide Michelin); Samuel S, Maude A, Stan R, Abdel H (car il y a un savoir-faire mais aussi un savoir-être); Marie-Christine K (alias maman), Frédérique B (j’espère que la prochaine fois on fera ensemble les vignobles californiens) et Amélie L; les deux Christophe, Wilfried P et Tahar S; Cécile D, Gérard M et Didier M (j’essayerais moi aussi d’avoir ta patience et ta pédagogie quand viendra mon tour d’encadrer de jeunes internes au BURG). Un grand merci aussi à toute l’équipe de neurochirurgie que je suis impatient de rejoindre.
A Anne-Claire, ma femme,
Je réserve mes derniers et plus profonds remerciements à ma femme, sans qui je n’en serais pas là aujourd’hui. Merci de m’avoir patiemment accompagné durant ces nombreuses années.
Merci de me faire partager ton goût des défis et ton ouverture aux autres. Je sais que, grâce à toi, d’innombrables autres aventures nous attendent.
Merci d’avoir donné naissance à notre merveilleuse fille, elle nous apporte bonheur et nombreux fous rires.
Sans ton aide précieuse et ton soutien, tout ceci n’aurait pas vu le jour. Je t’aime.
Anne-Claire,
Je te dédie ce manuscrit,
TABLE DES MATIERES
TABLE DES MATIERES ... 10
LISTE DES FIGURES ... 12
LISTE DES ABREVIATIONS ... 14
MANUSCRIT ... 16
I. Naissance du concept d’optimisation hémodynamique périopératoire ... 16
II. Stratégie actuelle d’optimisation hémodynamique : tout pour le débit cardiaque . 18 A. Notion de précharge et précharge dépendance ... 18
B. Principales techniques de monitorage utilisées au bloc opératoire ... 19
1. Thermodilution pulmonaire et transpulmonaire ... 19
2. Vélocimétrie doppler et ultrasonographie cardiaque ... 21
3. Analyse invasive de l’onde de pouls ... 22
C. Principaux indices monitorés... 24
1. Interactions cardio-pulmonaires en ventilation mécanique ... 24
2. Variations respiratoires du volume d’éjection systolique et de la pression pulsée ... 29
3. Autres indices fréquemment utilisés (Δdown, ΔITV, ΔVPeak, veine cave, pause télé-expiratoire) 31 D. Stratégie d’optimisation hémodynamique ... 33
1. Algorithme de prise en charge ... 33
2. Limites d’utilisation de ces marqueurs ... 36
III. La Pression Artérielle Moyenne (PAM) : la grande oubliée du concept d’optimisation hémodynamique ... 39
A. Autorégulation des débits régionaux, l’exemple du débit sanguin cérébral ... 39
B. Mécanismes de régulation de la pression artérielle ... 41
C. Conséquences de l’hypotension artérielle ... 44
IV. L’élastance artérielle dynamique, un nouvel indice en cours d’évaluation ... 47
A. Notion de couplage ventriculo-artériel ... 47
1. Elaboration d’un modèle ventriculaire ... 47
2. Elaboration d’un modèle vasculaire ... 52
3. Interaction ventriculo-artérielle ... 56
C. Evaluation de l’élastance artérielle dynamique en réanimation comme marqueur prédictif
d’augmentation de la PAM suite à une épreuve de remplissage ... 61
V. Evaluation de l’élastance artérielle dynamique au bloc opératoire ... 64
A. Introduction ... 64
B. Matériels et Méthodes ... 65
1. Objectifs principal et secondaires : ... 65
2. Population étudiée ... 66
3. Prise en charge anesthésique ... 66
4. Monitorage Hémodynamique ... 67
5. Protocole ... 69
6. Analyse statistique ... 69
C. Résultats ... 70
1. Analyse globale de la population ... 70
2. Variations des paramètres hémodynamiques en réponse à l’expansion volumique ... 72
3. Variations des paramètres de tonicité artérielle en réponse à l’expansion volumique ... 73
4. Prédiction de l’augmentation de la PAM en réponse à l’expansion volumique ... 75
D. Discussion ... 80 VI. Conclusion ... 84 VII. Bibliographie ... 85 VIII. Annexes ... 97 SERMENT D’HIPPOCRATE ... 104 RESUME ... 105
LISTE DES FIGURES
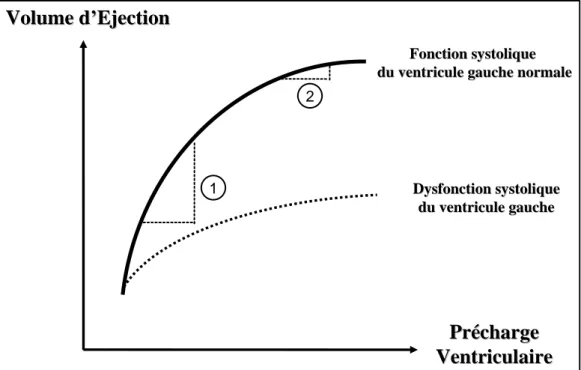
Figure 1: Représentation de la relation de Frank-Starling reliant le volume d’éjection et la précharge ventriculaire en cas de fonction systolique du ventricule gauche normale ou altérée.
... 19
Figure 2: Principe de la thermodilution pulmonaire avec cathéter de Swan-Ganz ... 20
Figure 3: Exemple de système de thermodilution transpulmonaire, le système PiCCO ... 21
Figure 4: Exemple de doppler œsophagien, système CardioQ ... 22
Figure 5: Analyse de la courbe de la pression artérielle ... 23
Figure 6: Modification des pressions en fonction du régime de pression ... 26
Figure 7: Effet du volume pulmonaire sur la résistance vasculaire pulmonaire 39 ... 27
Figure 8: Variations respiratoires de la pression artérielle. ... 30
Figure 9: Mesure de la variation du volume d’éjection systolique (VVE) ... 30
Figure 10: oscillation respiratoire de la veine cave inférieure en ventilation mécanique à pression positive ... 32
Figure 11: algorithme proposé par la Société Française d’Anesthésie et de Réanimation pour l’optimisation peropératoire du volume d’éjection systolique. ... 34
Figure 12: Courbe d’autorégulation du débit sanguin cérébral en fonction de la Pression artérielle moyenne. ... 40
Figure 13: Déterminants de la pression artérielle et du débit cardiaque et principaux effets de l’anesthésie générale ... 42
Figure 14: Courbe caractéristique de pompe ... 48
Figure 15: Diagramme Pression ventriculaire (Pv) / Volume ventriculaire (Vv) ... 49
Figure 16: Elastance télésystolique ventriculaire gauche (Ees) ... 50
Figure 17: Détermination de la courbe d’élastance point par point à partir des boucles PV à différents niveaux de précharge. ... 51
Figure 18: Relation volume-pression. ... 53
Figure 19: Propriétés d’amortissement des artères de gros calibres ... 54
Figure 20: Modèle de Windkessel à deux éléments ... 55
Figure 21: Couplage ventriculo-artériel de Sunagawa. ... 57
Figure 23: Effets du remplissage vasculaire sur le tonus artériel des patients « répondeurs » et « non-répondeurs » ; Monge Garcia et al., Critical Care 2011, 15 :R15 ... 61 Figure 24: Relation entre l’Eadyn avant remplissage et l’augmentation de la PAM après
remplissage vasculaire ; Monge Garcia et al., Critical Care 2011, 15 :R15 ... 62 Figure 25: Courbe ROC ; Monge Garcia et al., Critical Care 2011, 15 :R15 ... 63 Figure 26: Résumé des données démographiques des patients de l’étude ... 70 Figure 27: Comparaison des données démographiques des patients répondeurs et des non-répondeurs. ... 71 Figure 28: Comparaison des données hémodynamiques, avant remplissage des patients répondeurs et des non-répondeurs. ... 72 Figure 29: Effets du remplissage vasculaire sur les variables hémodynamiques chez les patients répondeurs et non-répondeurs a ... 73
Figure 30: Effets du remplissage vasculaire sur les indices de tonicité artérielle chez les patients répondeurs et non-répondeurs... 74 Figure 31: Evolution de l’élastance artérielle dynamique en réponse à l’épreuve de remplissage vasculaire chez les patients répondeurs et on-répondeurs ... 74 Figure 32: Relation entre l’Eadyn « pré-remplissage » et le pourcentage d’augmentation de la
pression artérielle moyenne ... 75 Figure 33: Courbe ROC des performances diagnostiques de l’Eadyn pour discriminer les patients
répondeurs et non-répondeurs après remplissage vasculaire ... 76 Figure 34: Courbe ROC des performances diagnostiques des résistances vasculaires systémiques pour discriminer les patients répondeurs et non-répondeurs après remplissage vasculaire ... 77 Figure 35: Courbe ROC des performances diagnostiques d’une PAM ≤ 65 mmHg avant remplissage vasculaire pour discriminer les patients répondeurs et non-répondeurs après remplissage vasculaire ... 78 Figure 36: Courbe ROC des performances diagnostiques de l’Eadyn avant remplissage vasculaire
pour discriminer dans un sous-groupe de patients, les patients répondeurs et non-répondeurs. ... 79
LISTE DES ABREVIATIONS
C : Compliance
Ca : Compliance artérielle
DC : Débit cardiaque
dP/Dt : Dérivée première maximale de pression Ea : Elastance artérielle effective
Eadyn : Elastance artérielle dynamique
Ees : Elastance télésystolique ventriculaire gauche Emax : Elastance ventriculaire maximale
ETO : Echographie transœsophagienne ETT : Echographie transthoracique
FC : Fréquence cardiaque
FR : Fréquence respiratoire
HEA : Hydroxyéthylamidon
HTAP : Hypertension artérielle pulmonaire
IC : Index cardiaque
LVSW : Travail ventriculaire systolique gauche PAD : Pression artérielle diastolique
PAM : Pression artérielle moyenne PAP : Pression artérielle pulmonaire
PAPO : Pression artérielle pulmonaire d’occlusion PAS : Pression artérielle systolique
Pcap : Pression pulmonaire capillaire PEP : Pression expiratorie positive Pes : Pression télésystolique
PP : Pression pulsée
RVS : Résistances vasculaires systémiques
RVSI : Résistances vasculaires systémiques indexées RVSW :Travail ventriculaire systolique droit
SFAR : Société Française d’Anesthésie-Réanimation SvO2 : Saturation en oxygène du sang veineux mêlé
TaO2 : Transport artériel en oxygène
V° : Volume mort
VD : Ventricule droit
Ved : Volume en fin de diastole VES ou SV : Volume d’éjection systolique Ves : Volume en fin de systole
VG : Ventricule gauche
VO2 : Consommation en oxygène
Vpeak : Vélocité maximale aortique
Vt : Volume courant pulmonaire
Vv : Volume ventriculaire
ΔPP : Variations respiratoires de la pression pulsée
MANUSCRIT
I. Naissance du concept d’optimisation hémodynamique périopératoire
Le concept d’optimisation hémodynamique est né des réflexions et des travaux de WC Shoemaker et de son équipe 1. Dès les années quatre-vingt, ils s’intéressèrent aux paramètres
cardiorespiratoires susceptibles d’influencer la morbidité et la mortalité postopératoires des patients subissant une chirurgie « à haut risque ». Le monitorage hémodynamique était alors réalisé par un cathéter artériel pulmonaire et les principales thérapeutiques utilisées étaient le remplissage vasculaire, les inotropes, les vasopresseurs et la transfusion. Ils montrèrent que le groupe de patients « survivants » présentait pendant les 24 premières heures des valeurs d’index cardiaque (IC), de transport artériel en O2 (TaO2) et de consommation d’O2 (VO2)
« supra-normales ». En suivant, ils démontrèrent dans un essai randomisé 2 que la
maximalisation de ces indices durant la période périopératoire était associée à une diminution des complications postopératoires et de la mortalité. Au même moment, Schultz et al. 3
publièrent un essai contrôlé randomisé en chirurgie orthopédique (fracture de hanche) avec également un monitorage hémodynamique par cathéter artériel pulmonaire. Cette étude montra une nette diminution de mortalité dans le groupe intervention (2,9%) comparativement au groupe contrôle (29%). L’hypothèse était que les patients non survivants étaient incapables, en raison de leurs faibles réserves physiologiques, de faire face à une demande métabolique accrue responsable d’une dette en oxygène aboutissant au développement de défaillances d’organes, voire de décès. Cette hypothèse, d’incapacité d’adaptation du statut hémodynamique aux besoins périopératoire, a été confirmée par la suite dans de nombreuses études 4, 5. Durant cette période, trois grands axes différents
d'optimisation hémodynamique ont été étudiés : maximalisation du transport en oxygène, maximisation du volume d'éjection systolique et cibles d'extraction d'oxygène.
A partir de la fin des années quatre-vingt-dix, le concept d’optimisation hémodynamique a évolué vers une simplification des outils de monitorage avec l’abandon progressif du cathéter artériel pulmonaire. Ainsi, Mythen 6 proposa dès 1995 une optimisation du volume d’éjection
de monitorages de moins en moins invasifs s’est accompagnée également d’une simplification des algorithmes de prise en charge comme par exemple l’utilisation des interactions cardiorespiratoires (variations respiratoires de la pression pulsée ou du volume d’éjection systolique) pour maximaliser le débit cardiaque 7, 8, 9.
Les années 2000 renforcent la validité externe de cette approche avec la publication de nombreuses méta-analyses confirmant qu’une stratégie d’optimisation hémodynamique permettait de diminuer la morbi-mortalité périopératoire. Dès 2002 et la première méta-analyse de Shoemaker et al 10, il a été montré une diminution significative de la mortalité chez
les patients les plus à risque. De multiples méta-analyses ont été publiées en suivant, confirmant ainsi l’impact de cette stratégie sur la morbi-mortalité périopératoire. Brienza et al., en 2009 11 puis en 2011 12 ont montré une diminution significative des complications
postopératoires : diminution de l’incidence de l’insuffisance rénale aigue, du recours à une technique de suppléance rénale, des complications gastro-intestinales mais également diminution du taux d’infections postopératoires 13. Là encore, ces résultats sont plus probants
chez les patients à haut risque. L’emploi de la formule « Earlier is better » dans le titre de la méta-analyse de Dalfino et al 13, rappelle que la précocité de cette prise en charge est garante
du succès de celle-ci. La même année, Hamilton et al. 14, dans une méta-analyse regroupant
plus de 4805 patients constatent d’importantes diminutions de mortalité et de morbidité postopératoires, et ce quel que soit le type de risque lié au patient. Ces résultats ont été réaffirmés par Marik 15 en 2014 avec la publication d’une revue analysant toutes les dernières
méta-analyses et qui concluait « qu’une optimisation hémodynamique initiée en peropératoire et poursuivie en postopératoire réduit les complications postopératoires et la mortalité à court et long terme ».
II. Stratégie actuelle d’optimisation hémodynamique : tout pour le débit cardiaque
A. Notion de précharge et précharge dépendance
La volémie, qui correspond au volume sanguin total circulant, est un élément essentiel de l'hémodynamique systémique. Elle est un des déterminants majeurs du débit cardiaque. La survenue d’épisodes d’hypovolémie, en déclenchant une cascade d’événements délétères menant à l’hypoxie tissulaire, augmente la morbidité et la mortalité des patients chirurgicaux. En pratique quotidienne, l’évaluation de la volémie est le plus souvent assimilée à celle de la précharge ventriculaire.
D’un point de vue physiologique, la précharge d’un ventricule correspond à la tension pariétale télédiastolique, et dépend en particulier du remplissage ventriculaire et donc du retour veineux. Selon la loi de Frank-Starling appliquée au ventricule gauche, pour un niveau donné de postcharge et de contractilité, une augmentation de la précharge ventriculaire (par remplissage vasculaire par exemple) peut entraîner ou non une augmentation du volume d’éjection systolique (VES) (Figure 1). La courbe reliant le VES et la précharge cardiaque est curvilinéaire et comprend schématiquement deux parties : (1) une portion ascendante de précharge dépendance, où une faible augmentation de précharge sera responsable d’une augmentation significative de VES et (2) une portion horizontale ou plateau, état de précharge indépendance, où une augmentation de précharge n’entraînera pas d’augmentation significative du VES. Dans le cas de précharge indépendance, le remplissage vasculaire n’aura aucun effet sur le débit cardiaque et sera susceptible d’entrainer des effets indésirables. La fonction ventriculaire systolique influence fortement la réponse au remplissage vasculaire. Lorsque la fonction ventriculaire gauche est altérée, la « zone » de précharge dépendance est significativement réduite, voire inexistante. La fenêtre thérapeutique du remplissage vasculaire est alors très étroite.
Figure 1: Représentation de la relation de Frank-Starling reliant le volume d’éjection et la précharge ventriculaire en cas de fonction systolique du ventricule gauche normale ou altérée.
1 : précharge-dépendance = une augmentation de précharge ventriculaire entrainera une augmentation du volume d’éjection, 2 : précharge indépendance = une augmentation de précharge ventriculaire n’entrainera pas d’augmentation du volume d’éjection
B. Principales techniques de monitorage utilisées au bloc opératoire
1. Thermodilution pulmonaire et transpulmonaire
a) Thermodilution pulmonaire : cathéter artériel pulmonaire
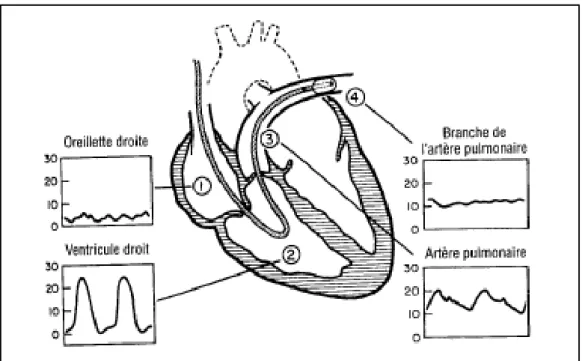
La thermodilution pulmonaire consiste en l’injection d’une solution saline froide dans l’oreillette droite qui sera ensuite détectée par une thermistance située à l’extrémité du cathéter artériel pulmonaire (Figure 2). Le débit cardiaque est calculé selon le principe de Stewart-Hamilton (l’aire sous la courbe de thermodilution est inversement proportionnelle au débit circulant). Le cathéter artériel pulmonaire fait partie intégrante des outils de monitorage hémodynamique depuis plus de trente ans 16,17. Avec l’arrivée de techniques moins invasives
ces dernières années, son usage s’est progressivement restreint au périopératoire de chirurgie cardiaque et à la transplantation hépatique 18,19. Cependant, le cathéter artériel pulmonaire
Volume d
Volume d
’Ejection
’
Ejection
Pr
Pré
écharge
charge
Ventriculaire
Ventriculaire
Fonction systolique Fonction systoliquedu ventricule gauche normale
du ventricule gauche normale
1 2 Dysfonction systolique Dysfonction systolique du ventricule gauche du ventricule gauche
nombreux paramètres : pression artérielle pulmonaire (PAP), pression artérielle pulmonaire d’occlusion (PAPO), pression pulmonaire capillaire (Pcap), volume systolique (VES), saturation en oxygène du sang veineux mêlé (SvO2), résistances artérielles pulmonaires (RAP), résistances artérielles systémiques (RAS), travail ventriculaire systolique droit et gauche (RVSW, LVSW), fraction d’éjection du ventricule droit, et le volume télédiastolique du VD.
Figure 2: Principe de la thermodilution pulmonaire avec cathéter de Swan-Ganz
Visualisation des différentes courbes de pressions obtenues avec le cathéter artériel pulmonaire
b) Thermodilution transpulmonaire
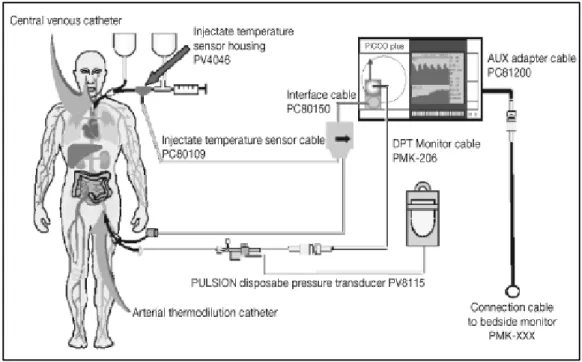
De nos jours, les techniques de thermodilution transpulmonaire sont privilégiées (PiCCO,
Pulsion Médical System ; Volume View Set, Edwards LifeSciences) (Figure 3). Ce système est
composé d’un cathéter artériel spécifique disposant d’une thermistance à son extrémité
(Pulsiocath ou capteur Volume View). L’extrémité de ce cathéter doit se situer au plus proche
de l’aorte. La mise en place d’une voie veineuse centrale permet de disposer une autre thermistance non spécifique au site d’injection. L’injection d’une solution saline froide (bolus de 20 ml) permet une mesure ponctuelle du VES 20, toujours selon le principe de
Stewart-transpulmonaire permet la calibration de la technique complémentaire par analyse du contour de l’onde de pouls et la détermination de paramètres volumétriques et de paramètres de contractilité comme la dérivée première maximale de pression (dP/Dtmax). La détermination du débit cardiaque par thermodilution pulmonaire ou transpulmonaire est comparable 21,22 .
Figure 3: Exemple de système de thermodilution transpulmonaire, le système PiCCO
2. Vélocimétrie doppler et ultrasonographie cardiaque
a) Doppler œsophagien
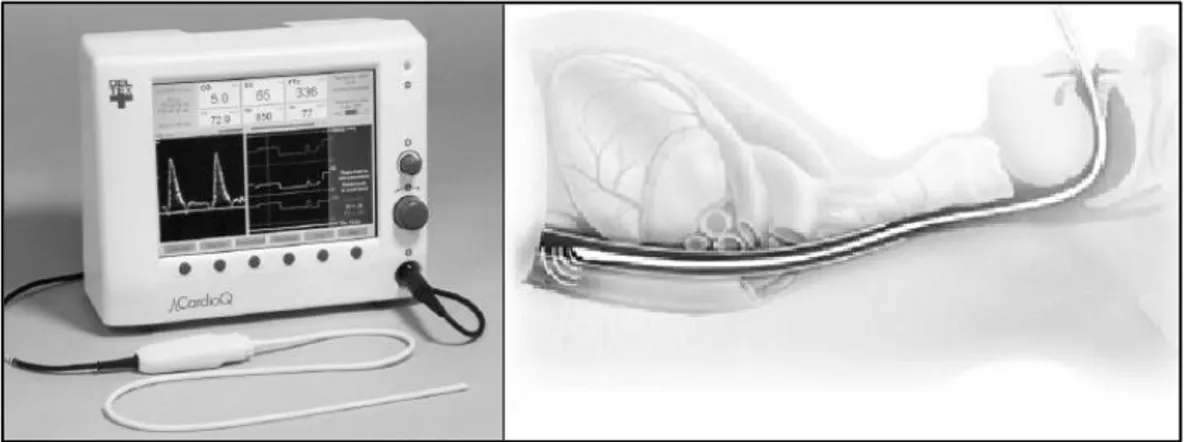
La technique du doppler œsophagien est basée sur la mesure de la vélocité des érythocytes par effet doppler au niveau de l’aorte ascendante grâce à une sonde flexible introduite dans l’œsophage (CardioQ-ODM, Deltex Medical) 23 (Figure 4). La multiplication de l’intégrale
temps-vitesse (ITV) par la surface de section de l’aorte (issue d’abaques du constructeur, ou mesurée par la sonde) permet d’obtenir le VES 24. La principale limite d’utilisation est le
mauvais alignement du faisceau doppler dans l’axe du vaisseau. De nombreuses études ont validé son utilisation peropératoire pour l’optimisation du remplissage vasculaire25, 26. Une
doppler œsophagien pour maximaliser le débit cardiaque par remplissage vasculaire, a confirmé ces résultats et mis en évidence un effet bénéfique en terme de morbidité post-opératoire 27.
Figure 4: Exemple de doppler œsophagien, système CardioQ
b) Echographie transœsophagienne
L’échographie transœsophagienne (ETO) permet à la fois une analyse des flux par vélocimétrie transvalvulaire mais également la visualisation et la quantification de nombreux paramètres contractiles, des pressions de remplissage et de l’appareil valvulaire. Les indications reconnues de l’ETO sont la chirurgie cardiaque et la chirurgie majeure non cardiaque chez un patient présentant une pathologie cardiaque sévère 28. En 2010, des recommandations
américaines 29 décrivent précisément l’impact thérapeutique de la réalisation d’une ETO lors
de la survenue d’une instabilité hémodynamique et/ou d’une hypoxémie brutale résistantes au traitement en chirurgie lourde. La connaissance des conditions de précharge, des performances globales ventriculaires, des pressions intracavitaires améliorent la gestion des situations hémodynamiques difficiles. Mais d’une manière générale, on ne peut pas considérer l’échocardiographie comme une technique de monitorage continue.
3. Analyse invasive de l’onde de pouls
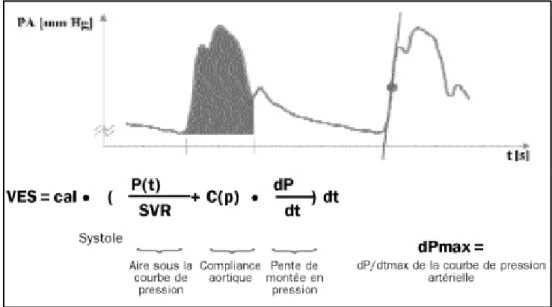
basé sur la relation entre la pression pulsée, le VES, la compliance artérielle et les résistances vasculaires systémiques. En analysant en continu la courbe de pression artérielle et en connaissant la compliance et les résistances vasculaires systémiques on peut obtenir le VES (cf. équation du débit cardiaque continu).
Figure 5: Analyse de la courbe de la pression artérielle
Principe de calcul du VES par l’intégration de la courbe de pression artérielle et de l’indice de contractilité ventriculaire gauche (dPmax)
Equation du débit cardiaque (DC) continu : 𝐷𝐶 = 𝑘. 𝐹𝐶. ∫ ( 𝑃𝑡
𝑅𝐴𝑆+ 𝐶𝑎 . 𝑑𝑃
𝑑𝑡) 𝑑𝑡 RAS : résistance artérielle statique (RAS = (PAM-PVC)/DC)
K : facteur de calibration calculé lors de la calibration par thermodilution ou par un algorithme Ca : compliance artériel globale
Il existe trois méthodes d’étalonnage :
- Courbe de thermodilution transpulmonaire 30 (cf. paragraphe précédent)
Certains de ces moniteurs de débit cardiaque continu ne nécessitent pas de calibration externe et peuvent être adaptés à la ligne artérielle préexistante. C’est le cas du système FloTrac (Edwards LifeSciences LLC, Irvine, CA) et du système ProAQT (Pulsion Medical Systems, Germany). La concordance de mesure du débit cardiaque entre ces moniteurs et la thermodilution pulmonaire ou transpulmonaire est parfois mise en défaut 32,33, par contre ils
sont capables d’identifier des variations de débits cardiaques (induites par un remplissage vasculaire par exemple), et permettent de prédire la réponse au remplissage à partir d’indices dynamiques 34.
La principale limite de ces moniteurs est la nécessité d’être re-calibrés lorsque l’impédance et les résistances artérielles se modifient de manière significative, sans quoi l’interprétation du rapport entre la surface sous la courbe et le volume systolique serait incorrecte. Toute variation importante des résistances artérielles diminue la précision de la mesure du débit cardiaque. Par exemple, le biais entre la mesure par analyse du contour de la courbe artérielle et la mesure par thermodilution (Swan-Ganz), qui est de 0.16 L/min en situation basale, passe à 3.25 L/min après une injection de phényléphrine qui augmente les résistances artérielles systémiques de 60% 35.
C. Principaux indices monitorés
1. Interactions cardio-pulmonaires en ventilation mécanique
Les conséquences hémodynamiques des interactions cardiorespiratoires résultent du fait que, dans l’espace clos qu’est le thorax, le système cardiovasculaire d’une part et le système respiratoire d’autre part sont soumis à des régimes de pression différents. En respiration spontanée et dans des circonstances physiologiques, ces interactions n’entrainent pas de conséquences hémodynamiques significatives. Toute modification des caractéristiques physiques et physiologiques pulmonaires va affecter le cœur et vice versa.
- La pression alvéolaire est la pression qui règne dans le poumon. Elle dépend de la compliance du système respiratoire. En ventilation spontanée, elle est nulle en fin d’expiration à condition que le patient atteigne sa capacité résiduelle fonctionnelle.
mécanique, elle devient positive tout au long du cycle respiratoire et s’oppose à la circulation capillaire pulmonaire.
- La pression intrathoracique dépend de la compliance de la paroi thoracique. Elle est négative tout au long du cycle respiratoire en ventilation spontanée pour favoriser l’entrée d’air dans l’arbre aérien, associée à une augmentation du retour veineux systémique. Sous ventilation mécanique, elle devient positive, d’autant plus que la pression motrice de ventilation (« Driving Pressure ») est importante.
- La pression transpulmonaire correspond à la pression de distension du poumon et dépend de la compliance de ce poumon. Elle est représentée par la différence de la pression alvéolaire moins la pression intrathoracique (assimilée à la pression pleurale). La compliance pulmonaire est représentée par le rapport entre variation de volume et variation de pression transpulmonaire.
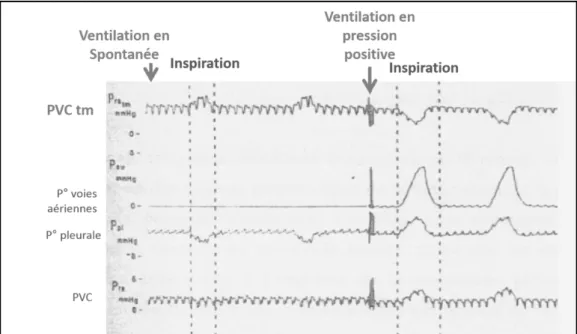
Lors d’une respiration spontanée, une pression inspiratoire pleurale et intrathoracique négative génère le volume courant. C’est en revanche une élévation périodique de la pression intra-pulmonaire qui produit ce volume courant lors de la ventilation mécanique en pression positive (Figure 6).
Figure 6: Modification des pressions en fonction du régime de pression
Enregistrement simultané de la pression veineuse centrale (PVC), de la pression veineuse centrale transmurale (PVCtm), de la pression des voies aériennes et de la pression pleurale durant une ventilation spontanée (à gauche) et une ventilation à pression positive (à droite).
a) Effet de la ventilation mécanique sur le cœur droit
Diminution de la conductance veineuse :
En ventilation mécanique, l’augmentation de la pression intrathoracique, secondaire à l’augmentation de pression dans les voies aériennes lors de l’insufflation, entraîne une diminution du retour veineux systémique. Cette diminution est d’autant plus marquée que la pression intra-thoracique générée est importante et que la volémie du patient est basse. Selon le concept de Guyton, la diminution du retour veineux a longtemps été attribuée à une diminution du gradient de pression moteur du retour veineux, défini comme la différence entre la pression systémique moyenne et la pression auriculaire droite 36. En réalité, la
ventilation en pression positive ne modifie pas ce gradient 37, et la baisse du retour veineux
est secondaire à une diminution de la conductance veineuse par l’interposition de veines collabables entre la circulation veineuse périphérique et l’oreillette droite. Cette hypothèse a été démontrée chez l’homme en ventilation spontanée et en ventilation mécanique 38.
Augmentation de l’impédance à l’éjection du ventricule droit :
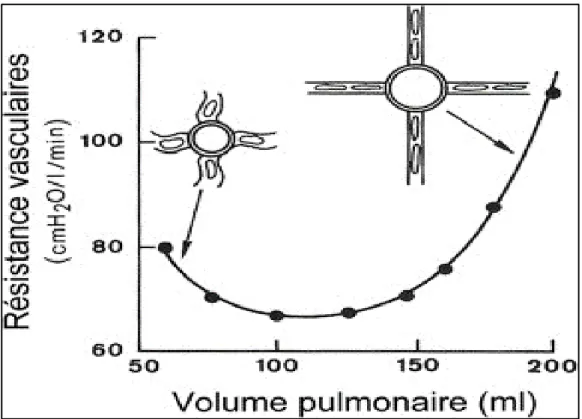
L’écoulement du sang dans la circulation pulmonaire est sous la dépendance d’un gradient de pression entre la pression motrice d’amont, c’est à dire la pression artérielle pulmonaire, et la pression d’aval, c’est à dire la pression veineuse pulmonaire. L’anatomie vasculaire pulmonaire varie cycliquement avec la respiration. L’état d’inflation des poumons est un déterminant important de la résistance qu’oppose l’arbre vasculaire pulmonaire à l’éjection du ventricule droit d’une part et la capacitance du lit vasculaire d’autre part. Une relation en « U » caractérise la relation entre le volume d’inflation des poumons et la résistance vasculaire pulmonaire 39. Cette résistance est déterminée par l’anatomie vasculaire instantanée 40. La
circulation pulmonaire peut être divisée en vaisseaux extra-alvéolaires et alvéolaires (gros calibre) qui sont exposés à la pression interstitielle pulmonaire. Lorsque le volume pulmonaire est petit, ces vaisseaux ont tendance à se collaber, ce qui augmente la résistance vasculaire pulmonaire (Figure 7) 39.
A l’inverse, lors d’une grande insufflation pulmonaire dilatant les alvéoles, ce sont les vaisseaux alvéolaires (capillaires, artérioles et veinules, selon la pression alvéolaire) qui sont collabés alors que les vaisseaux extra-alvéolaires sont dilatés au maximum 41. L’équilibre entre
les vaisseaux extra-alvéolaires et alvéolaires détermine la résistance vasculaire pulmonaire, mais celle-ci peut être modifiée par des facteurs neuro-humoraux. La présence d’une pression partielle d’oxygène alvéolaire basse ou d’une acidose active la vasoconstriction hypoxique et augmente la résistance vasculaire pulmonaire 42. L’augmentation de la postcharge du
ventricule droit limite l’éjection ventriculaire. En résumé, sous ventilation à pression positive, la baisse de la pression artérielle moyenne et du débit cardiaque est secondaire à la fois à la diminution du retour veineux systémique 43 et à l’augmentation de la résistance vasculaire
pulmonaire 44.
b) Effets de la ventilation mécanique sur le cœur gauche
Augmentation du retour veineux pulmonaire :
Contrairement à l’oreillette droite, le flux sanguin retournant vers l’oreillette gauche ne subit pas de variation en relation avec les changements de la pression pleurale car l’oreillette gauche et les veines pulmonaires sont affectées simultanément par le même régime de pression pleurale. Néanmoins, elles sont soumises à des régimes différents de pression péricardique. Cependant l’inflation pulmonaire détermine la capacitance du réservoir veineux pulmonaire, stockant ou expulsant plus ou moins de sang dans les veines pulmonaires 45 ce
qui affecte de manière cyclique le remplissage auriculaire gauche 46,47.
Diminution de la postcharge du ventricule gauche :
La pression intrathoracique modifie la pression transmurale du ventricule gauche. Un abaissement important de la pression pleurale augmente la postcharge du ventricule gauche (manœuvre de Muller) alors qu’une augmentation de la pression pleurale (manœuvre de Valsalva) diminue la postcharge du ventricule gauche.
2. Variations respiratoires du volume d’éjection systolique et de la pression pulsée
La ventilation mécanique en pression positive induit des modifications cycliques du volume d’éjection systolique ventriculaire gauche par quatre mécanismes différents. L’augmentation inspiratoire de la pression pleurale entraîne une diminution de la précharge ventriculaire droite 48 et une augmentation de postcharge ventriculaire droite 49. Ces deux mécanismes
aboutissent à une diminution du volume d’éjection ventriculaire droit à l’inspiration. Cette baisse du volume d’éjection ventriculaire droit lors de l’inspiration aura pour conséquence une diminution de la précharge ventriculaire gauche quelques cycles cardiaques plus tard (temps de transit pulmonaire) lors de l’expiration 50. La diminution de précharge ventriculaire
gauche expiratoire sera responsable d’une diminution du VES ventriculaire gauche en cas de précharge dépendance. A l’inspiration, le sang est exclu des capillaires pulmonaires vers le cœur gauche, entrainant une augmentation de la précharge ventriculaire gauche45. Ce
mécanisme est mineur sauf en cas d’hypervolémie 51. Enfin, la postcharge ventriculaire gauche
diminue lors de l’inspiration car la pression pleurale positive diminue la pression intracardiaque systolique et la pression transmurale de l’aorte intrathoracique52. Ce
mécanisme entraîne une augmentation du VES ventriculaire gauche (Delta up) et est présent en cas de défaillance ventriculaire gauche 51. Ainsi la ventilation mécanique entraine des
variations cycliques du VES ventriculaire gauche, d’autant plus marquées si les deux ventricules travaillent sur la portion ascendante de la courbe de Franck Starling.
Variations respiratoires de la pression pulsée :
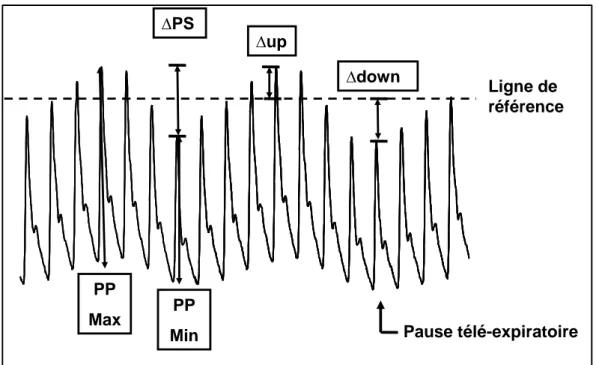
L’amplitude des variations respiratoires du volume d’éjection peut être approchée par l’amplitude des variations respiratoires de la pression artérielle pulsée (Figure 8). La pression pulsée (PP = PAS – PAD) est inversement proportionnelle à la compliance artérielle et directement dépendante du VES. Si l’on considère que la compliance artérielle n’est pas modifiée au cours d’un cycle respiratoire, les variations respiratoires de la pression pulsée (ΔPP) représentent les variations respiratoires du VES. Plusieurs travaux cliniques et expérimentaux ont démontré la capacité de cet indice à prédire la réponse au remplissage
Figure 8: Variations respiratoires de la pression artérielle.
∆PS : variations respiratoires de la pression systolique, ∆up : deltaup, ∆dow : deltadown, PP Max : pression pulsée maximale, PP Min : pression pulsée minimale, ∆PP : variations respiratoires de la pression pulsée, ∆PP=(PPMax-PPMin)/[(PPMax + PPMin)/2] x 100.
Variations respiratoires du VES :
L’analyse du contour de l’onde de pouls permet d’estimer le volume d’éjection systolique et ses variations respiratoires (Figure 9). Ces indices obtenus par les systèmes PiCCOTM (Pulsion
Medical System) ou VigileoTM (Edwards Lifescience, Irvine, USA) ont été validés en pratique
clinique 55.
Figure 9: Mesure de la variation du volume d’éjection systolique (VVE)
Variation du VES au cours d’un cycle en ventilation contrôlé à pression positive ∆up Ligne de référence Pause télé-expiratoire ∆PS ∆down PP Max PP Min
3. Autres indices fréquemment utilisés (Δdown, ΔITV, ΔVPeak, veine cave, pause télé-expiratoire)
Variations de pression artérielle systolique et Deltadown :
Les variations respiratoires de la pression artérielle systolique ont également été étudiées comme indice prédictif de réponse au remplissage vasculaire. Mais, dans la mesure où la pression artérielle systolique dépend de la pression diastolique (pression systolique = pression diastolique + pression pulsée) et que la pression artérielle diastolique peut augmenter au cours de l’insufflation mécanique (en raison de l’augmentation de la pression aortique extramurale), des variations de la pression artérielle systolique peuvent être observées chez certains patients ventilés, même si la pression pulsée et donc le volume d’éjection ne varient pas au cours du cycle respiratoire. La mesure de la diminution de la pression artérielle systolique par rapport à une PA systolique de référence mesurée lors d'une pause télé-expiratoire (deltadown) permet de s'affranchir des variations de pression extra-murale aortique. Tavernier et al. ont démontré qu’un effet deltadown supérieur à 5 mmHg permet de prédire la réponse à une expansion volémique chez des patients septiques 56.
Variations respiratoires de l’ITV aortique et de la vélocité maximale aortique :
Les variations respiratoires du volume d’éjection systolique peuvent être évaluées par la mesure des variations respiratoires de l’intégrale temps vitesse (ITV) à l’anneau aortique par échocardiographie. En effet, L'ITV sous aortique peut être considérée comme un reflet direct du volume d'éjection systolique puisque ce dernier s'obtient par le produit de la surface de la chambre d'éjection sous aortique par l'ITV. Il a été démontré que cet indice (ΔITV) était sensible à l’hypovolémie dans un modèle animal (lapin) 57. Il est également possible de
s’intéresser aux variations respiratoires de la vélocité maximale aortique (Vpeak) également obtenue par échocardiographie. Une valeur de ΔVpeak>12% permet de prédire la réponse à une expansion volémique avec une valeur prédictive positive de 91 % et une valeur prédictive négative de 100 % 58.
Variations respiratoires du diamètre des veines caves :
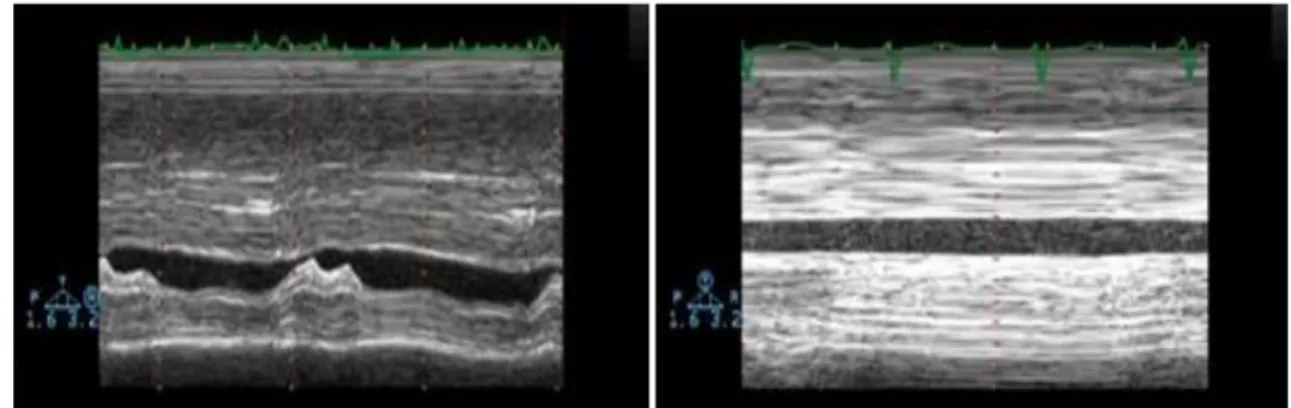
La ventilation mécanique va entraîner un collapsus de la veine cave supérieure (intra-thoracique) et une distension de la veine cave inférieure (extra-(intra-thoracique) dont l’amplitude sera variable en fonction de la volémie des patients (Figure 10). Ces deux indices (collapsibilité de la veine cave supérieure et distensibilité de la veine cave inférieure) peuvent prédire les effets d’une expansion volémique dans une population de patients septiques sous ventilation mécanique 59.
Figure 10: oscillation respiratoire de la veine cave inférieure en ventilation mécanique à pression positive
Veine cave inférieure en mode TM sur vue sous costale. A gauche, importante modulation respiratoire suggérant une hypovolémie. A droite, le calibre reste identique tout au long du cycle respiratoire
Manœuvres d’occlusion télé-expiratoires :
Au cours de la ventilation mécanique, chaque insufflation interrompt le retour veineux systémique par augmentation des pressions intra-thoraciques. Une occlusion télé-expiratoire va interrompre les cycles insufflatoires. Ceci va entraîner une augmentation (absence de diminution) de la précharge cardiaque suffisante pour aider à la prédiction de la réponse à l’expansion volémique. Monnet et al. ont démontré que les patients présentant une augmentation de leur débit cardiaque ou de leur pression pulsée de plus de 5% au cours d’une occlusion télé-expiratoire de 15 secondes prédisait une réponse au remplissage, avec une excellente fiabilité 60. Ce test est très intéressant car il est utilisable en cas d’arythmie,
télé-expiratoire du circuit) ou de compliance du système respiratoire basse 61. De plus, un
monitorage de la pression artérielle sanglante parait suffisant. Cependant ce test n’a été que très peu étudié en contexte périopératoire, et la seule étude réalisée semble négative 62. De
plus, certaines limites potentielles n’ont pas encore été explorées (hyperpression intra-abdominale, défaillance ventriculaire droite …).
D. Stratégie d’optimisation hémodynamique
1. Algorithme de prise en charge
Les différentes études et méta-analyses de haut niveau de preuve, parues ces dernières années, ont conduites en 2012 à l’écriture de recommandations par la Société Française d’Anesthésie et de Réanimation 63.
Quand optimiser ?
Le concept d’optimisation hémodynamique tel qu’il a été initialement proposé par Shoemaker est celui d’une thérapeutique « préemptive ». Il s’agit de maximaliser le débit cardiaque par remplissage vasculaire avant la survenue de l’hypoperfusion d’organe menant à la dysfonction de celle-ci. Le transport en oxygène doit être maximalisé dès le début de l’agression chirurgicale voire même avant selon certains auteurs. Si la thérapeutique est administrée trop tard, c’est à dire après l’apparition de lésions cellulaires, il apparaît que non seulement les patients ne pourront plus atteindre les objectifs thérapeutiques mais qu’également, la thérapeutique risque d’être délétère pour le patient 64.
Comment optimiser ?
Le principe est de titrer les apports liquidiens par petites fractions pour déterminer, sans risque de surcharge, la valeur maximale du débit cardiaque. Quand cette valeur est atteinte, il faut arrêter le remplissage pour éviter toute surcharge hydrique et ne le reprendre que lorsque le débit redescend en dessous de cette valeur maximale. Bien sûr, cette attitude ne s’entend que si les variations de débit sont en rapport avec des variations de retour veineux
(effet vasoplégiant des anesthésiques, saignement chirurgical…). Cette approche a été facilitée, comme vue précédemment, par l’apparition de nouvelles techniques de monitorage moins invasives et par la simplification progressive des protocoles, davantage adaptés à la pratique clinique. Cette évolution des techniques a clairement permis de « démocratiser » l’optimisation hémodynamique au bloc opératoire. Dans les recommandations de la SFAR 63,
deux approches sont proposées pour guider le remplissage vasculaire périopératoire.
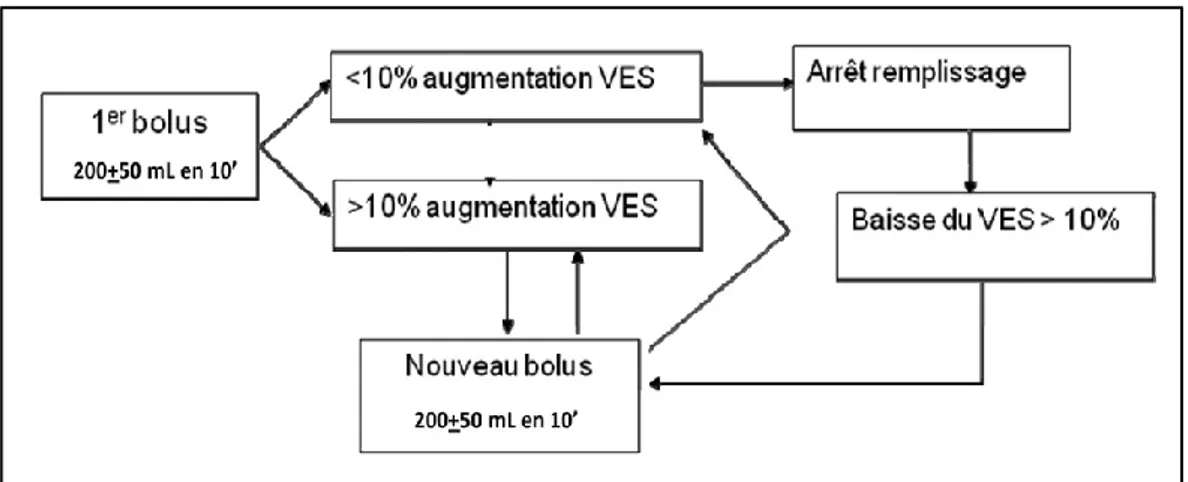
La première est basée sur la titration du remplissage en fonction de la mesure du volume d’éjection systolique (VES) (Figure 11). L’absence d’augmentation du VES en réponse à un remplissage vasculaire témoigne que le plateau de la courbe de fonction cardiovasculaire a bien été atteint et que l’apport liquidien doit être interrompu pour éviter la congestion veineuse (systémique ou pulmonaire) qui surviendrait obligatoirement dans le cas contraire. Comme montré précédemment, de nombreuses études ont évalué la stratégie associant le monitorage du VES par Doppler œsophagien ou échocardiographie et des épreuves de remplissage vasculaire par bolus liquidiens (de l’ordre de 250 mL de colloïde), dès le début de l’anesthésie, répétés en cas d’augmentation du VES, mais interrompus dès que le VES n’augmente plus. L’administration d’un nouveau bolus n’était possible que si le VES baissait par rapport à la valeur maximale obtenue après la titration initiale. Cette stratégie a permis de diminuer l’incidence des complications postopératoires 27.
Figure 11: algorithme proposé par la Société Française d’Anesthésie et de Réanimation pour l’optimisation peropératoire du volume d’éjection systolique.
Le type de monitorage du volume d’éjection systolique est laissé au libre choix de l’anesthésiste et le type de fluide utilisé n’est pas spécifié.
La seconde approche utilise les indices dynamiques de précharge-dépendance (ΔVES et ΔPP) pour prédire l’efficacité du remplissage. Des variations de pression pulsée (ΔPP) de plus de 13% au cours du cycle respiratoire semblent prédire l’augmentation du débit cardiaque en réponse à une épreuve de remplissage vasculaire 7,8. Dans ces études, l’objectif était d’obtenir
une minimisation peropératoire du ΔPP (<10 %) par un apport de fluides. Il a également été démontré qu’une simple minimalisation des variations respiratoires du volume d’éjection systolique permettait d’améliorer la réhabilitation post-opératoire 65.
Qui optimiser ?
Les premiers travaux mettant en évidence une diminution de la morbi-mortalité des patients optimisés se sont focalisés sur des patients à très haut risque chirurgical. Ainsi, ce type de thérapeutique a longtemps été réservé aux patients les plus graves. Récemment, Cecconi et al. ont publié une revue s’intéressant à l’impact de l’optimisation hémodynamique périopératoire en fonction de la mortalité des patients 66. S’il apparaît que cette thérapeutique
est associée à une diminution de la mortalité seulement dans le groupe des patients à très haut risque (mortalité supérieure à 20%), elle est associée à une diminution de la morbidité post-opératoire dans tous les groupes de patients, même les moins à risque (mortalité inférieure à 5%). Ce travail souligne l’intérêt de ce type d’approche même chez les patients à faible risque. Actuellement, la SFAR recommande 63 « de titrer le remplissage vasculaire
peropératoire en se guidant sur une mesure du VES ou sur des indices dynamiques de pré-charge-dépendance chez les patients à haut risque». Ce haut risque correspond à des patients qui, de par leur terrain ou la nature même de l’intervention sont exposés à un risque accru de complications postopératoires.
Quel soluté de remplissage ?
Très peu d’études cliniques ont comparé l’influence du type de fluides (cristalloïdes ou colloïdes) sur l’efficacité du remplissage vasculaire 67. Il semble exister, un certain nombre
l’hydroxy-ethyl-amidon (HEA) pour la correction des hypovolémies 68. Ces arguments se
retrouvent en clinique avec, par exemple, la nécessité d’un apport de cristalloïdes 2 à 4 fois plus important pour restaurer le volume intravasculaire 69. De plus l’utilisation de volumes
importants de sérum salé isotonique expose à un risque d’acidose hyperchlorémique. Toutefois, l’utilisation des HEA a été restreinte depuis 2013 et la publication par l’European
Medicines Agency 70 d’un certain nombre d’interdictions d’utilisation compte tenu de leurs
toxicités, principalement rénale. Ils ne doivent désormais plus être employés en cas de sepsis, de brûlures étendues, d’insuffisance rénale sévère, d’hémorragie cérébrale, d’insuffisance hépatique et de coagulopathie. Par contre, leur utilisation au bloc opératoire, est toujours possible afin de pallier à une hypovolémie par perte sanguine aigue. Cette utilisation ne doit pas dépasser 24 h avec une posologie maximale de 33 ml/kg et doit s’accompagner d’une surveillance de la fonction rénale. Un essai contrôlé randomisé en double aveugle comparant une optimisation hémodynamique avec du sérum salé 0,9% et un HEA (Voluven®) est actuellement en cours 71.
2. Limites d’utilisation de ces marqueurs
Les indices dynamiques dérivés des interactions cardio-respiratoires présentent de nombreuses limites, qui sont présentes chez un peu moins de la moitié des patients (47,3%) équipés d’un cathéter artériel au bloc opératoire 72. Par exemple, ces indices ne sont pas
exploitables en cas d’arythmie 53. Cette limitation n’est pas négligeable car l’incidence des
arythmies supraventriculaires est d’environ 5% en périopératoire 72.
En cas de respiration spontanée, d’efforts inspiratoires, de chirurgie à thorax ouvert, de volume courant inférieur à 8 ml/kg ou de compliance du système respiratoire basse, les interactions cardiorespiratoires ne peuvent pas être utilisées pour prédire la réponse à une expansion volémique. L’utilisation d’un volume courant bas (< 8ml/kg) est de plus en plus fréquent à la fois en réanimation et au bloc opératoire. En effet il a été démontré, qu’un faible volume courant améliorait le pronostic des patients présentant un syndrome de détresse respiratoire aiguë (SDRA) et prévenait l'apparition de lésions pulmonaires induites par la ventilation mécanique 73. Plus récemment, il a été montré que l'utilisation au bloc opératoire
pression expiratoire positive diminuait le taux de complications post-opératoires et la durée de séjour en réanimation 74.
Il a récemment été démontré qu’une fréquence respiratoire élevée entrainant une baisse du rapport FC/FR (inférieur à 3,6) était responsable d’un temps de transit pulmonaire trop court pour entrainer des oscillations du volume d’éjection systolique ventriculaire gauche et entrainait une diminution du ΔPP 75. En cas d’hyperpression intraabdominale, une diminution
de la compliance thoraco-pulmonaire est susceptible d’entrainer des modifications des indices dérivés des interactions cardiorespiratoires et d’affecter leurs capacités à prédire la réponse à une expansion volémique 76.
Les situations d’insuffisance cardiaque gauche ou droite altèrent également la capacité des indices dérivés des interactions cardiorespiratoires à prédire la réponse au remplissage vasculaire. Plusieurs travaux (expérimentaux et cliniques) ont récemment démontré qu’une dysfonction ventriculaire droite et une HTAP entrainaient une inefficacité des interactions cardiorespiratoires à prédire les effets d’un remplissage vasculaire 77, 78. Concernant la
défaillance ventriculaire gauche, elle peut entraîner des variations respiratoires de pression artérielle systoliques par effet up, secondaire à une diminution inspiratoire de post charge liée à une baisse de la pression transmurale cardiaque faussant ainsi l’interprétation des indices dynamiques.
Enfin, la plupart des travaux ayant étudié les indices dynamiques ont utilisé une analyse statistique basée sur des courbes ROC. Cette démarche permet de déterminer un seuil au-dessus duquel le patient répondra au remplissage vasculaire, avec une spécificité et une sensibilité données. Cette approche binaire a récemment été remise en question. Cannesson et al. ont démontré dans un travail rétrospectif réalisé au bloc opératoire, qu’il existait une zone grise (entre 9% et 13%) dans laquelle le ΔPP ne permettait pas de conclure. Dans cette étude, 25% des patients appartenaient à cette zone grise 79. Cette notion de zone grise des
valeurs des indices dynamiques, a été confirmée par Biais et al. 80, qui ont montré quant à eux
l’existence d’une impossibilité de prédire la réponse au remplissage vasculaire pour des valeurs de ΔPP comprises entre 4 et 17%. Dans cette étude 62% des patients se trouvaient dans cette zone grise.
Il existe également, une autre limite à l’utilisation de ce concept de maximalisation du débit cardiaque. En effet, maximaliser le volume d’éjection systolique n’est pas synonyme d’une maximalisation du transport en oxygène. Par exemple chez les patients présentant une défaillance cardiaque, une maximalisation du volume d’éjection systolique par du remplissage ne permettra pas d’atteindre des valeurs souhaitées de transport en oxygène. Cela a été montré par Cecconi et al. 81 qui ont décrit que 55% des patients de leurs études (fracture de
hanche) dont la volémie était optimisée ont nécessité une administration de dobutamine pour atteindre le même objectif. Il existe donc une forte proportion de patients ne pouvant pas atteindre les objectifs par le remplissage seul, avec pour conséquence une augmentation de l’incidence des œdèmes pulmonaires et des insuffisances cardiaques chez ces patients. Malgré les limites décrites ci-dessus, la maximalisation du volume d’éjection systolique est probablement la meilleure manière de débuter une optimisation hémodynamique et peut être suffisante chez les patients ne présentant pas de grave dysfonction (myocardique notamment). Chez les patients dont la fonction myocardique est altérée, d’autres types de traitement et de monitorage sont probablement nécessaires.
III. La Pression Artérielle Moyenne (PAM) : la grande oubliée du concept d’optimisation hémodynamique
Dans les dernières recommandations de la société française d’anesthésie et réanimation 63,
l’optimisation hémodynamique est basée sur l’optimisation du débit cardiaque afin de maintenir un débit de perfusion tissulaire adéquate. Pourtant la pression artérielle moyenne (PAM) est primordiale car elle reflète la pression de perfusion des organes et assure, au même titre que le débit cardiaque, une bonne perfusion tissulaire périphérique. L’objectif de pression artérielle moyenne (PAM) à atteindre doit correspondre à la valeur minimale de maintien de l’autorégulation des débits régionaux des principaux organes (cerveau, cœur, rein…). Cette valeur seuil au-dessous duquel apparaissent des conséquences pour la perfusion varie. En effet, la pression artérielle est une valeur finement régulée sous la dépendance de nombreux facteurs : tonus vasomoteur, élastance artérielle, autorégulation, amplification de l’onde de pouls. De plus, lors d’un remplissage vasculaire à un patient précharge-dépendant, nous avons vu que le débit cardiaque augmentait d’au moins 15% alors que la proportion d’augmentation de la PAM est variable et imprévisible.
A. Autorégulation des débits régionaux, l’exemple du débit sanguin cérébral
La relation entre la pression et le débit est dépendante de la vasomotricité des vaisseaux, qui va donc déterminer pour certaines circulations, une autorégulation sur une plage de pression artérielle (Figure 12). Affirmer par exemple que le genou du plateau d’autorégulation du débit sanguin cérébral est de 50 mmHg est faux, il s’agit en fait d’une reconstruction à partir de multiples extrapolations de courbes, avec une grande variabilité. Par exemple, chez les patients hypertendus, la courbe d’autorégulation est « décalée vers la droite ». En cas de sténose sévère sur un vaisseau, le plateau d’autorégulation n’existe quasiment plus et le débit sanguin est directement proportionnel au débit cardiaque.
Figure 12: Courbe d’autorégulation du débit sanguin cérébral en fonction de la Pression artérielle moyenne.
Déplacement vers la droite de la courbe d’autorégulation du débit sanguin cérébral en cas d’HTA
Dès 1954, il a été démontré que les valeurs seuil de la courbe d’autorégulation variaient en fonction des patients 82. Le but de cette étude était d’obtenir un signe «d’insuffisance
circulatoire cérébrale» (soupir, bâillement, stupeur, confusion, parfois hémiplégie) soit par l’intermédiaire de l’injection d’un ganglioplégique (hexaméthonium) soit par la mise brutale en position proclive. Le niveau de pression artérielle moyenne au moment de cet « accident vasculaire cérébral provoqué » variait en fonction de l’âge des patients et de leurs profils tensionnels (26 à 44 mmHg chez les sujets jeunes normotendus, 23 à 54 mmHg chez les sujets âgés normotendus, 23 à 68 mmHg chez les sujets jeunes hypertendus et 64 à 114 mmHg chez les sujets âgés hypertendus). On voit donc que les signes «d’insuffisance circulatoire cérébrale» se sont produits avec un intervalle important de PAM (26 à 114 mmHg).
Ces résultats ont été retrouvés dans l’étude POISE 83. L’objectif principal de cette étude était
d’évaluer l’intérêt de la prise de β-bloquant (métoprolol 100mg) en périopératoire de chirurgie non cardiaque pour réduire la fréquence des infarctus du myocarde (IDM). Le résultat était positif avec une réduction du nombre d’IDM (176 cas dans le groupe métoprolol [4·2%] vs 239 cas dans le groupe placebo [5·7%] ; HR 0,73 ; 0·60–0·89; p=0·0017), mais au prix
cas dans le groupe métoprolol [3·1%] vs 97 cas dans le groupe placebo [2·3%] ; 1,33 ; 1·03– 1·74; p=0·0317). Pour rappel, 45 % de la population étudiée était sous IEC ou ARA2. Ces AVC se sont produits plus volontiers chez des patients aux ATCD d’AVC, lors d’une hypotension et/ou une bradycardie en per ou postopératoire. Ce sont principalement des AVC ischémiques jonctionnels. L’infarctus jonctionnel, dénommé « watershed » en anglais (ligne de partage des eaux) se produit dans les zones (corticale ou centrale) de jonction des territoires vasculaires non anastomotiques, où la pression de perfusion est la plus basse 84. Sa survenue implique
plusieurs mécanismes physiopathologiques. On observe ainsi dans les infarctus corticaux l’association de mécanismes emboliques, des artères porteuses de lésions athéromateuses sténosantes, et des facteurs hémodynamiques. L’hypotension artérielle en présence soit d’une sténose avérée d’un vaisseau à destinée intracérébrale, soit d’une occlusion ou alors d’un réseau anastomotique incompétent (polygone de Willis) met clairement le patient en danger avec le risque de survenue d’un accident ischémique cérébral de type jonctionnel.
B. Mécanismes de régulation de la pression artérielle
De nombreux systèmes de contrôle de la pression artérielle existent afin de maintenir la pression artérielle dans une gamme de valeurs constantes en dépit des variations permanentes des déterminants de la pression artérielle dans les conditions physiologiques (stress, changement de position, sommeil…) ; variations majorées en cas d’anesthésie générale (Figure 13).
Figure 13: Déterminants de la pression artérielle et du débit cardiaque et principaux effets de l’anesthésie générale
Système baroréflexe à haute et basse pression :
Le système baroréflexe à haute pression est activé par des mécanorécepteurs, situés dans la paroi artérielle carotidienne et de l’arc aortique, sensibles à l’étirement de la paroi du vaisseau
85. Le système baroréflexe à basse pression dispose de barorécepteurs situés dans la paroi des
oreillettes et de l’artère pulmonaire. Ce système de régulation intervient à travers le système sympathique et parasympathique sur le cœur et les vaisseaux 86. Dans les conditions normales,
la régulation centrale de ce système (située dans le noyau du tractus solitaire dans le bulbe cérébral) exerce un effet inhibiteur sur le tonus sympathique Le système baroréflexe est principalement caractérisé par son point de calage, c’est-à-dire la valeur de PA que le système tente de maintenir. En cas de baisse modérée du retour veineux, on observe une baisse de la tension intrapariétale auriculaire, sans baisse de la pression artérielle, entrainant une désactivation isolée des barorécepteurs à basse pression afin de majorer le tonus veineux via le système sympathique. En cas de baisse importante du retour veineux avec chute de la PA, une désactivation des barorécepteurs à haute et basse pression s’observe et conduit à une vasoconstriction artériolaire et veineuse, une majoration modeste de la contractilité myocardique et une augmentation de la FC. A l’inverse en cas d’élévation de la PA (par