MYRIAM FILION
COMPARAISON DE LA SURVIE DES PATIENTES
ATTEINTES D'UN CANCER DU SEIN AYANT
PARTICIPÉ À UN OU DES ESSAI(S) CLINIQUE(S) PAR
RAPPORT À CELLES QUI N'Y ONT PAS PARTICIPÉ
Mémoire présenté
à la Faculté des études supérieures et postdôctorales de l'Université Laval dans le cadre du programme de maîtrise en epidemiologic clinique
pour l'obtention du grade de Maître es sciences (M.Sc.)
DEPARTEMENT DE MEDECINE SOCIALE ET PREVENTIVE FACULTÉ DE MÉDECINE
UNIVERSITÉ LAVAL QUÉBEC
2012
OBJECTIF : L'objectif principal de ce mémoire était de mesurer l'association entre la survie des patientes avec un cancer du sein ayant participé à un essai clinique (EC) par rapport à celles qui n'y avaient pas participé. MÉTHODES : L'étude est basée sur une cohorte de 6 794 femmes issues d'un centre spécialisé dans les maladies du sein, diagnostiquées d'un cancer du sein infiltrant non métastatique entre 1982 et 2008. Des courbes de Kaplan-Meier ont été représentées graphiquement et le modèle de Cox, ajusté pour différents facteurs pronostiques, a été utilisé. RÉSULTATS : Au total, 1 137 (16,7%) femmes diagnostiquées d'un cancer du sein ont participé à au moins un EC. Ces patientes étaient significativement plus jeunes et présentaient des facteurs pronostiques plus défavorables. Le rapport de hasard brut pour la survie de toutes causes était de 0,84 (IC 95% [0,73-0,97]; p = 0,02) et ajusté de 0,96 (IC 95% [0,81-1,14]; p = 0,61) en faveur des patientes sous EC. CONCLUSION : La participation à un EC n'améliore pas la survie des patientes atteintes d'un cancer du sein.
11
Abstract
OBJECTIVES: To assess the association between patients with breast cancer who participated in a clinical trial (CT) versus those who did not participate. METHODS: This study is based on 6,794 women diagnosed with non-metastatic breast cancer treated in a specialized breast center between 1982 and 2008. Kaplan-Meier curves were calculated and the Cox model, adjusted for different prognostic factors, was used. RESULTS: A total of 1,137 (16.7%) patients participated in a CT. These patients were significantly younger and had more unfavorable prognostic factors. The crude hazard ratio for survival from all causes was 0.84 (CI 95% [0.73-0.97]; p = 0.02) and adjusted, 0.96 (CI 95% [0.81-1.14]; p = 0.61) in favor of patients in CT's. CONCLUSION: Participation in CT's does not improve survival of patients with breast cancer.
C'est pour moi une fierté de présenter ce mémoire de maîtrise en epidemiologic clinique car il représente un important accomplissement.
La recherche que ce mémoire contient fera l'objet d'un article qui sera soumis dans une revue scientifique dans le domaine du cancer du sein. Des cliniciens et des épidémiologistes affiliés à l'équipe de l'Unité de recherche en santé des populations (URESP) ont agi à titre de collaborateurs importants pour le bon déroulement du projet, l'analyse des données et leur interprétation. Plus particulièrement, j'aimerais remercier Dr Julie Lemieux, hémato-oncologue et chercheure clinicienne, fidèlement impliquée dans son milieu, pour le support et la confiance qu'elle m'a témoignée. Ce fût pour moi très inspirant et gratifiant de collaborer avec une chercheure qui fait quotidiennement une différence dans la qualité de vie des personnes atteintes de cancer. Dr Lemieux possède des techniques de travail rigoureuses et une incroyable capacité de réflexion qui font d'elle une source de développements et de contributions majeurs dans son domaine. Les analyses principales ont minutieusement été effectuées par la statisticienne Caty Blanchette. Je la remercie pour son aide particulièrement importante et pour sa patience dans la réponse à mes interrogations. Il aurait été pour moi difficile de réaliser ce mémoire sans l'aide et le soutient des personnes suivantes. D'abord, de tout mon coeur, je remercie la présence de mon grand ami Bryan. Il m'a aidé à me relever lors d'épreuves laborieuses et à guérir mes blessures pour ainsi élever ma conscience et continuer d'évoluer dans la vie. Il m'a fourni de précieux outils de façon à organiser ma vie en fonction d'atteindre mes buts et de mes objectifs comme celui de réaliser une maîtrise.
Ensuite, sans la réalisation de ce mémoire, il n'y aurait pu avoir la naissance d'une grande amitié avec Geneviève, qui a été ma voisine de bureau. Je suis très reconnaissante envers la vie que cette personne au cœur d'or ait été sur mon chemin pour arriver aux fins de cette épreuve. Je la remercie sincèrement pour son écoute attentive, son authenticité, son honnêteté et ses précieux conseils qu'elle m'a si bien enseignés.
IV Je tiens aussi à remercier ma grand-maman adorée, Mamie Yvette, pour ses prières, ma mère Emma, qui m'a facilité l'accès à l'éducation, et ma sœur Julie, pour son aide exemplaire dans la qualité du français. Merci à tous les membres de l'URESP pour leur accueil, leur soutien et leurs encouragements ainsi qu'au Centre des maladies Deschênes-Fabia (CMS) de l'Hôpital du Saint-Sacrement pour m'avoir si bien accueilli dans l'ensemble de mes projets.
Finalement, j'aimerais remercier neuf femmes, pour qui j'ai beaucoup d'admiration. Elles ont combattu le cancer du sein tout en participant à un programme d'activité physique pendant leurs traitements. Elles m'ont servi de moteur dans l'avancement de ce mémoire, car elles me permettaient de continuer à me réaliser dans la passion de mon métier de kinésiologue.
m'a toujours guidé vers le chemin de la victoire.
Table des matières
Résumé i Avant-Propos iii Table des matières vi Liste des tableaux viii Liste des figures ix Liste des abréviations x
CHAPITRE 1 1 1. INTRODUCTION 1
CHAPITRE II 2 2. ÉTAT DES CONNAISSANCES 2
2.1. Caractéristiques des EC 2 2.2. Recrutement dans les EC 2 2.3. Avantages des EC sur la survie et « l'effet participation » 3
2.4. Epidemiologic du cancer du sein 5 2.5. Revue de littérature sur les différences entre les patients sous EC versus ceux non
sous EC 6 2.6. Failles méthodologiques relevées dans la littérature 13
2.7. Portée des connaissances 13
CHAPITRE III 15 3. OBJECTIFS : 15
3.1. Primaire 15 3.2. Secondaires 15 3.2.1. Décrire l'évolution temporelle de la proportion des patientes sous EC 15
3.2.2. Mesurer l'association entre la survie des patientes sous EC assignées à différents
groupes de traitement par rapport à celles traitées hors EC 15 3.2.3. Mesurer l'association entre la suivie spécifique au cancer du sein des patientes ayant
participé à un EC par rapport à celles qui n'y avaient pas participé 15
CHAPITRE IV 16 4. MÉTHODOLOGIE 16
4.1. Devis 16 4.2. Population 16 4.3. Collecte des données 17
4.4. Variables à l'étude 21 4.4.1. Variable indépendante 21 4.4.2. Variable dépendante 22 4.4.3. Covariables 22 4.5. Analyses statistiques 24 4.5.1. Hypothèse nulle 24 4.5.2. Taille de l'échantillon 24 4.5.3. Analyse de survie de Kaplan-Meier 25
4.5.4. Comparaison de la survie avec le modèle de Cox 25
4.5.4.1. Covariables du modèle de Cox 26 4.5.4.2. Construction des modèles de Cox 26 4.5.4.3. Gestion des valeurs manquantes 27
4.5.4.4. Analyses de sensibilité 27 4.5.4.5. Correction pour le biais de temps immortel 28
CHAPITRE V 30 5. RÉSULTATS 30 5.1. Caractéristiques des patientes 30
5.1.1. Caractéristiques des EC dans lesquels les femmes ont participé 35 5.2. Évolution temporelle de la proportion de patientes sous EC 41 5.3. Survie de toutes causes entre les patientes qui ont participé à un EC par rapport à
celles qui n'y ont pas participé 43 5.4. Comparaison de la survie entre les patientes sous EC qui étaient dans différents
groupes de traitement par rapport à celles traitées hors EC 45 5.5. Survie spécifique au cancer du sein entre les patientes qui ont participé à un EC par
rapport à celles qui n'y ont pas participé 47 5.6. Analyse de sensibilité par période de diagnostic entre les patientes qui ont participé
à un EC par rapport à celles qui n'y ont pas participé 49
CHAPITRE VI 51 6. DISCUSSION 51 6.1. Résumé des résultats 51 6.2. Comparaisons des résultats de la présente étude avec la littérature 52
6.3. Observations des caractéristiques des patientes 54
6.4. Forces 54 6.5. Limites 55 6.6. Implications cliniques 57 7. CONCLUSION 59 Bibliographie 60 Annexe A 68 Annexe B 71 Annexe C 72 Annexe D 74
Liste des tableaux
Tableau 1. Résumé des revues de littérature et systématiques répertoriées qui ont comparé
les patients ayant participé à un EC avec ceux qui n'y ont pas participé 11
Tableau 2. Caractéristiques de la population au diagnostic 32 Tableau 3. Délais de randomisation des patientes à partir de la date de diagnostic 36
Tableau 4. Caractéristiques des EC de type « adjuvant » ouverts entre 1982-2008 37 Tableau 5. Caractéristiques des EC de type « néo-adjuvant » ouverts entre 1982-2008 39 Tableau 6. Caractéristiques des EC de type « support » ouverts entre 1982-2008 39 Tableau 7. Caractéristiques des EC de type « chirurgical » ouverts entre 1982-2008 40 Tableau 8. Total des décès et proportion des patientes ayant participé à un EC par période
de diagnostic 42 Tableau 10. Rapports de hasard par bras de traitement pour la survie de toutes causes des
patientes sous EC 46 Tableau 11. Modèles de Cox pour la survie spécifique au cancer du sein pour les patientes
sous EC 48 Tableau 12. Survie de toutes causes par période de diagnostic pour les patientes sous EC
par rapport à celles non sous EC 49 Tableau 13. Survie spécifique au cancer du sein par période de diagnostic pour les patientes
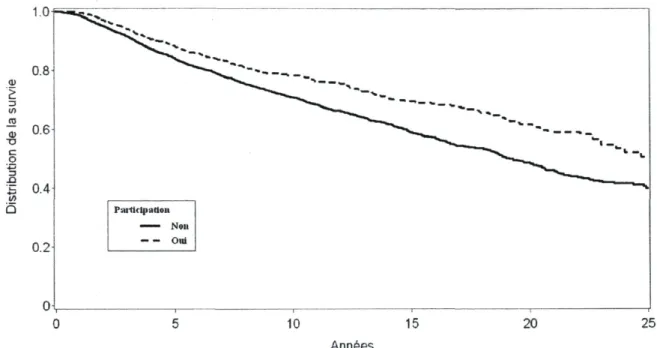
Figure 1. Diagramme de sélection des patientes qui ont participé à un ou des EC 20 Figure 2. Courbes de KM pour la survie de toutes causes pour les patientes sous EC et
celles non sous EC 44 Figure 3. Courbes de survie de KM par bras de traitement pour la survie de toutes causes
Liste des abréviations
EC: URESP: CMS: RH: NSABP FEC ou CEF A C : ISQ: RAMQ: AJCC: HER2: SAS: IC: KM: RE: RP: CMF: FEC-D : TAM: IA: L-PAM : 5-FU: mg/m2 A: Chimio : MF: C : Ana : TAC: FAC: AT: TH: TCH: PG: DD: P : CVAP: EPO: CSS: DGA: E S : Essai cliniqueUnité de recherche en santé des populations Centre des maladies du sein Deschênes-Fabia Rapport de hasard
National Surgical Adjuvant Breast and Bowel Project Fluorouracil, épirubicine, cyclophosphamide
Adriamycine, cyclophosphamide Institut de la statistique du Québec Régie de l'assurance maladie du Québec American Joint Committee on Cancer
Human Epidermal Growth Factor Receptor-2 Statistical Analysis System
Intervalle de confiance Kaplan-Meier
Récepteurs d'oestrogènes Récepteurs de la progestérone
Cyclophosphamide, Methotrexate, fluorouracil
Fluorouracil, épirubicin, cyclophosphamide, doxorubicine; Tamoxifène;
Inhibiteur de l'aromatase Melphalan
5-fluorouracil
Milligramme par mètre carré Adriamycine (doxorubicine) Chimiothérapie
Methotrexate, fluorouracil Cyclophosphamide
Anastrozole
Taxotère, adriamycine, cyclophosphamide Fluorouracil, adriamycine, cyclophosphamide Adriamycine, taxotère
Taxotère, herceptin
Taxotère, cyclophosphamide, herceptin Paclitaxel, gemcitabine
Dose-dense Paclitaxel
Cyclophosphamide, vincristine, adriamycine, prednisone Erythroprotéine
Chirurgie segmentaire du sein Dissection ganglionnaire axillaire Erreur standard
1. INTRODUCTION
Les essais cliniques (EC) sont essentiels à l'évaluation des nouvelles interventions médicales avant leur utilisation dans la pratique quotidienne. Malheureusement, moins de 10% des patients atteints de cancer y participent (1-3). Pourtant, dans les EC, plusieurs avantages sont reconnus : les participants peuvent bénéficier de médicaments ou d'interventions offerts seulement dans le contexte d'un EC et ils ont la chance d'avoir un traitement qui est possiblement supérieur. De plus, tout au long du processus, un suivi étroit est effectué avec le patient car sa sécurité est prioritaire. Un autre avantage postulé est l'obtention d'un gain de survie lorsque les patients participent à un EC. Si un bénéfice de survie était associé à la participation à un EC, cela serait un avantage supplémentaire pour les patients atteints de cancer. D'un autre côté, pour les professionnels de la santé, les EC peuvent représenter des options additionnelles de traitement ayant le potentiel de contribuer à la cure d'une maladie.
Le but de ce présent mémoire de maîtrise est de déterminer s'il existe une différence de survie dans un échantillon de patientes avec un cancer du sein ayant participé à un EC par rapport à celles qui n'y ont pas participé. Il s'inscrit dans le programme de recherche de l'équipe du Dr Lemieux à l'URESP-CMS qui porte sur l'étude des facteurs associés au faible taux de recrutement dans les EC en oncologic
CHAPITRE II
2. ETAT DES CONNAISSANCES 2.1. Caractéristiques des EC
Les EC, définis comme « un type de recherche visant à tester si de nouveaux traitements ou interventions fonctionnent chez les gens » (4), sont essentiels pour faire progresser l'avancement des connaissances (5, 6). Généralement, ils se déroulent en quatre phases distinctes qui évaluent des objectifs différents. Les EC de phase I ont pour but de tester la sécurité d'une intervention. Ils sont conduits chez un petit nombre de sujets. En phase II, le traitement est testé pour connaître son efficacité sur des objectifs substituts {surrogate outcomes) comme par exemple la diminution de la taille d'une tumeur pour l'évaluation des thérapies néo-adjuvantes. Les EC de phase III visent à démontrer l'efficacité du traitement ou de l'intervention. Ils comparent un traitement standard de l'époque à un nouveau traitement qui a été étudié en phase II. Le but de ces EC est d'améliorer des objectifs cliniques qui ont une importance pour les patients telle la survie globale, la survie sans maladie ou la qualité de vie. Ces EC de phase III sont habituellement conduits sur un grand nombre de participants. Les patients qui y participent sont assignés de façon aléatoire dans le groupe de traitement standard ou expérimental. Cela permet de répartir également les patients dans des groupes avec des caractéristiques similaires; ainsi, la seule différence est l'intervention testée dans l'EC. Finalement, la phase IV se déroule au moment où les organismes de santé et de réglementation ont autorisé le médicament. Il s'agit d'études observationnelles qui servent à obtenir de l'information sur l'utilisation du médicament dans différentes populations et sur les effets secondaires à long terme (4, 7). La majorité des EC ouverts dans les établissements de soins de santé sont de phase II et III (8).
2.2. Recrutement dans les EC
Les méta-analyses et les revues systématiques qui incluent les résultats d'EC de phase III représentent le plus haut niveau d'évidence lorsque vient le temps d'établir des guides de pratique (9, 10). L'avantage principal d'un EC de phase III est que la répartition aléatoire
elle consiste à assigner un participant au hasard dans un des groupes d'étude. Ainsi, s'il y a des facteurs confondants (âge, sexe, statut social, etc.), connus ou inconnus, ils seront répartis également et la seule différence entre les deux groupes sera l'intervention étudiée. Une différence clinique pourra donc être attribuée à l'intervention sous étude. Cependant, en général, moins de 10% des patients atteints de cancer font partie d'un EC (1-3). Dans les centres de cancer, ce nombre peut s'élever à 18% (11, 12). Une étude conduite dans un centre canadien spécialisé pour les maladies du sein indiquait que la proportion des patientes recrutées dans un EC était estimée à 16,5% parmi celles qui avaient un EC ouvert pour leur type de cancer (13). Des études effectuées pour comprendre les barrières au recrutement des patients dans les EC ont révélé des problèmes à plusieurs niveaux : patients (ex. désir de choisir son traitement) (14-23), médecins (ex. manque de temps) (2, 11, 22, 24-30), protocoles (ex. critères d'éligibilité trop restrictifs) (11, 12, 22, 31), équipe de recherche (ex. manque de ressources) (32).
Cette faible proportion affecte la conduite des EC de plusieurs façons : prolongation de la durée des EC, retard dans la publication des résultats, diminution de la puissance si l'échantillon prévu n'est pas respecté et fermeture prématurée de protocoles d'EC (33-35). De plus il peut paraître non éthique en rétrospective de faire participer des patients dans des EC qui ne rencontreront pas leurs objectifs (1).
2.3. Avantages des EC sur la survie et « l'effet participation »l
Plusieurs avantages ont été énoncés quant au bénéfice de participer à un EC sur la survie: la possibilité d'un meilleur traitement sous étude, un suivi plus étroit et le fait que d'autres personnes puissent bénéficier de cette recherche dans le futur (17, 36, 37). Cet avantage de survie pourrait être dû au fait que le traitement étudié est supérieur au traitement standard, mais cela s'avère être le cas dans seulement 28% à 29% des EC de phase III (8, 38). Une autre hypothèse tient au fait que les participants à un EC sont différents de la population générale. Par exemple, les patients acceptant de faire partie d'un EC pourrait être plus éduqués ou avoir moins de comorbidités. Une autre hypothèse est que les traitements
respecteraient un protocole rigoureux, dans lequel les doses de médicaments et les soins de support peuvent être donnés de façon plus optimale. Ainsi, la survie pourrait être plus longue par le simple fait de participer à un EC, et ce, même si le traitement sous étude n'est pas démontré plus efficace que le standard. Au niveau du patient, celui-ci pourrait avoir une plus grande observance au traitement et une motivation accrue, par le fait d'être sous étude, de prendre les doses prescrites. Ce bénéfice de survie relié à la participation aux EC est appelé « effet participation ». « L'effet participation » est un concept qui inclut certains éléments précis qui permet de distinguer les groupes de comparaisons des patients sous EC de ceux qui sont traités hors EC. Pour le décrire, Braunholtz et al. (39) sont parvenus à expliquer ce concept en détaillant clairement les effets suivants. Premièrement, il y a « l'effet traitement » qui, lorsque les résultats sont publiés, est démontré plus efficace que les traitements standards. Deuxièmement, il y a « l'effet protocole », dans lequel le déroulement et les procédures pour administrer l'intervention sont soigneusement décrits. En effet, ceci pourrait surpasser les soins offerts dans les pratiques courantes. Troisièmement, « l'effet soins », qui s'apparente légèrement au type d'effet précédant, se définit par des suivis supplémentaires dans lesquels le patient bénéficie de plus de surveillance et une attention accrue du personnel infirmier pour détecter des effets secondaires ou des récidives de maladie plus précocement. Quatrièmement, il y a « l'effet placebo » du traitement qui peut agir directement sur l'aspect psychologique du patient pensant qu'il bénéficie du traitement réel. Finalement, il y a « l'effet Hawthorne » qui concerne le changement de comportement du patient en participant à un EC. Alors que le patient se sent davantage observé, le comportement et les habitudes peuvent être différents de celui qui est traité hors EC. L'effet Hawthorne réfère à la réponse au traitement produit par un stimulus psychologique (40). Dans le cadre d'EC, il peut être défini comme la réponse clinique supplémentaire qui résulte de l'attention accrue influencée par la participation à TEC (41). Par exemple, un patient pourrait bénéficier d'une meilleure qualité de vie pendant sa maladie en ayant développé une relation agréable et plus intime avec le personnel infirmier. Bien que l'effet Hawthorne puisse être présent à des niveaux d'importance variables dans les EC, Braunholtz et al. (39) ont soulevé qu'il était difficile à mesurer. Il est effectivement difficile de quantifier la magnitude d'un tel effet car on ne peut identifier avec précision la ou les caractéristiques qui l'influencent (42). Wolfe et al.
l'arthrite rhumatoïde, avec les résultats des suivis post EC. L'objectif consistait à vérifier si l'amélioration des symptômes notés dans le cadré de TEC était maintenue dans la pratique clinique. Il y a eu une amélioration marquée de 41,3% dans le score sur la qualité de vie, évalué par le Health Assessment Questionnaire, pendant TEC et seulement de 16,5% dans le score des évaluations post EC.
Toutefois, les revues de littérature conduites jusqu'à maintenant démontrent qu'il y a peu d'évidence pour soutenir scientifiquement la présomption que le simple fait de faire partie d'un EC est favorable pour le patient atteint de cancer (39, 43-46). Si un tel effet existait, les patients devraient pour leur propre intérêt être encouragés à prendre part à ces EC. La présence d'un avantage de survie dû à un « effet participation », autre que celui conféré par un traitement expérimental plus efficace que le traitement standard, pourrait ainsi toucher un plus grand nombre de patients enrôlés dans les EC.
2.4. Epidémiologie du cancer du sein
Pour évaluer la portée d'un tel effet sur un patient qui accepte de participer à un EC, une cohorte de femmes atteintes d'un cancer du sein a été utilisée pour les fins de cette étude. Dans la lutte contre le cancer du sein, beaucoup d'efforts sont déployés dans la recherche pour développer de nouveaux médicaments ou de nouvelles interventions et ainsi traiter la maladie plus efficacement. En 2007, le cancer du sein bénéficiait de la proportion la plus importante des investissements spécifiques dans la recherche sur des types précis de cancer et, en 2009, une restructuration des investissements a été élaborée pour définir stratégiquement les priorités dans la recherche pour cette maladie (47). Présentement, 22% des EC ouverts au Canada visent spécifiquement le cancer du sein (48).
Le cancer du sein est le cancer le plus fréquemment diagnostiqué chez les femmes et représente la deuxième cause de mortalité par cancer chez celles-ci (après le cancer du poumon) (49). En 2011, les nouveaux cas de cancer du sein étaient de 23 400 pour le Canada et de 6 200 pour la province de Québec (49). Au cours des 20 dernières années, il y a eu une nette diminution de la mortalité des femmes avec un cancer du sein. Entre 1990 et
2011, la mortalité par cancer du sein au Canada, ajusté pour l'âge, est passée de 31,3/100 000 à 20,7/100 000 (49).
Les hypothèses expliquant cette diminution de mortalité sont multiples : dépistage à large échelle permettant de détecter le cancer à un stade précoce (5), traitements adjuvants (traitement donné après l'exérèse chirurgicale d'un cancer localisé pour prévenir les récidives) plus agressifs (6, 50) et traitements dans la maladie métastatique plus efficaces (51). Il y a un point commun à toutes ces hypothèses: les interventions ont été étudiées et prouvées plus efficaces que le standard antérieur dans des EC.
2.5. Revue de littérature sur les différences entre les patients sous EC versus ceux non sous EC
Actuellement, il n'y a pas d'évidence fermement établie pour ou contre un bénéfice relié au fait de participer à un EC pour les patientes atteintes d'un cancer du sein. Une étude conduite par Hébert-Croteau et al. (52) a démontré une survie favorable pour les femmes qui participaient à un EC dans un échantillon de patientes atteintes d'un cancer du sein habitant au Québec. Les groupes de comparaison étaient des femmes non sous EC traitées selon les guides de pratique et des femmes non sous EC, non traitées selon les guides de pratique. Pour les femmes traitées dans des EC, le rapport de hasard pour le décès de toutes causes était de 0,45 (p = 0,001) comparativement aux femmes traitées hors EC et non traitées selon les guides de pratique comme groupe de référence. Dans une autre étude, moins concluante que la précédente, Twelves et al. (30) ont évalué la survie dans une cohorte de femmes atteintes d'un cancer du sein non métastatique au diagnostic. Il y a eu une tendance de survie favorable dans la mesure ajustée pour les femmes qui participaient à un EC, sans toutefois atteindre la signification statistique (RH ajustée = 0,79 (IC 95%
[0,59-1,04]; p = 0,10).
Dans les 20 dernières années, il y a eu cinq revues de littérature (dont deux systématiques) répertoriées sur les différences de résultats entre les patients sous EC versus ceux non sous EC (39, 43-46). Le tableau 1 résume ces revues de littérature en définissant les types de comparaisons qui ont été effectués entre le groupe qui a participé et celui qui n'a pas participé aux EC. Les groupes de comparaisons pour les patients qui ont été traités hors EC
exemple, il y avait une comparaison si une étude comparait des patients traités dans un EC avec des patients qui avaient refusé de participer. Il y avait deux comparaisons si une étude comparait des patients qui avaient participé à un EC avec des patients qui avaient refusé de participer ainsi que des patients non recrutés pour qui l'EC n'avaient pas été proposé par le médecin.
D'abord, deux (43, 44) de ces revues traitaient exclusivement des patients atteints de cancer alors que dans les trois autres, des études d'autres disciplines médicales étaient incluses (bien que la majorité provenaient du domaine de l'oncologie) (39, 45, 46). Ces revues de littérature ont démontré qu'il y avait peu d'évidence pour soutenir scientifiquement la présomption que le simple fait de faire partie d'un EC conduisait à un bénéfice clinique pour le patient. Étant donné les problèmes méthodologiques des études incluses dans les revues de littérature, une conclusion ferme ne peut être tirée. Premièrement, les moyens sélectionnés pour contrôler les facteurs confondants potentiels sont souvent inadéquats. Les études n'ayant pas démontré l'évidence d'un « effet participation » n'ont généralement pas effectués d'analyses ajustées. Certaines études, au départ, comparaient les facteurs pronostics entre les groupes et, s'il n'y avait pas de différence, il était assumé qu'il y avait absence de confusion (44). Deuxièmement, la survie étant plus longue d'année en année pour le cancer du sein (49, 53), la majorité des études présentent des durées de suivi trop courtes. Une étude de Schmoor et al. (54), souvent rapportée dans les différentes revus, compare la survie de patientes atteintes d'un cancer du sein qui participent à un EC avec celles éligibles à un EC mais non randomisées. Les chercheurs utilisent une médiane de durée de suivi de 5 ans pour évaluer la survie. Comme la survie des patientes avec un cancer du sein s'améliore et que les rechutes peuvent survenir tardivement, un temps de suivi plus long est idéal.
La première revue de littérature réalisée à ce sujet (38), portait sur la survie au cancer en fonction de modèles organisationnels des soins de santé tels que des traitements donnés dans des centres de soins spécialisés, des centres hospitaliers traitant un grand nombre de patients et la standardisation des protocoles de traitements dans le contexte d'EC. Les auteurs ont conclu que les patients traités dans des centres hospitaliers à grand volume, des
centres spécialisés ou des hôpitaux qui offraient la participation à des EC, avaient une meilleure chance de survie.
La revue de littérature de Braunholtz et al. (39) a été conçue suivant une structure narrative exprimant une réflexion sur les effets que pouvaient avoir les EC, principalement sur les patients et les médecins. Ils ont évalué, notamment, les effets positifs et négatifs sur le patient à participer aux EC et les mécanismes qui étaient rattachés à ces résultats. Dans onze études ayant fait des comparaisons directes entre les patients sous EC et les patients non sous EC, six ont rapporté une amélioration globale statistiquement significative sur différentes issues. Ces résultats peuvent être explicables, entres autres, par « l'effet participation ». Quant aux caractéristiques des échantillons, trois étaient représentés par des enfants, deux par des patients atteints de maladies cardiovasculaires et un par des patients avec des problèmes de malnutrition. La plus grosse cohorte (n = 32 506) contenait des patients atteints de maladies cardiovasculaires. Les autres études portaient sur des patients adultes atteints de différents types de cancer avec des tailles d'échantillon variant entre un minimum de 313 sujets et un maximum de 2 084 sujets.
Ensuite, Peppercorn et al. a recensé 26 études dans le domaine de l'oncologie (44). Sur les 26 études (comparaisons entre les patients sous EC et ceux non sous EC), 14 ont démontré un bénéfice pour le groupe de patients sous EC. Les comparaisons ayant démontré un avantage étaient principalement dans le domaine de l'oncologie pédiatrique, de l'hématologie et lorsque le traitement était avant 1986. Parmi les huit comparaisons dénombrées, effectuées avec des contrôles éligibles mais non enrôlés, trois ont rapporté de meilleurs résultats pour le groupe sous EC. Concernant le cancer du sein, trois études ont été rapportées. Marubini et al. (55) ont comparé prospectivement un groupe de patientes ayant participé à l'étude Mil (mastectomie versus quadrantectomie suivie de radiothérapie) à un groupe de patientes traitées avec quadrantectomie et radiothérapie hors EC et, après la fin de l'étude, il n'y avait pas de différence de survie. Schmoor et al. (54) ont collecté prospectivement toutes les patientes éligibles à trois EC du German Breast Cancer Study Group entre 1983 et 1989. Les patientes éligibles mais refusant la participation à TEC étaient suivies de façon prospective de la même façon que les patientes sous EC. La comparaison de ces deux groupes n'a pas démontré de différence significative quant à
Mayers et al. (56) ont analysé rétrospectivement tous les dossiers de patientes ayant reçu une chimiothérapie de type « CMF 2» entre 1980 et 1990 en dehors d'un EC avec celles qui
l'ont reçue sous EC; la participation à un EC a démontré une tendance vers une meilleure survie après ajustement pour d'autres facteurs pronostiques (rapport de hasard = 0,77; p = 0,09).
Enfin, les revues les plus récentes (2005 et 2008) ont toutes deux été conduites par Vist et al. (45, 46). Elles avaient en commun de comparer, entre autres, les résultats d'études sur les patients qui avaient participé à des EC avec des patients comparables ayant reçu les mêmes ou des traitements similaires hors EC. Parmi les 26 études retenues par Peppercorn et al., seulement 14 d'entre elles se trouvaient dans la revue la plus récente publiée dans la Cochrane Collaboration (46). Cela peut expliquer pourquoi il y avait une différence dans les résultats rapportés entre ces revues.
Dans la première revue (45), 24 des 32 comparaisons, résultant de 17 études évaluant la mortalité (six portaient sur le cancer), ne sont pas parvenues à démontrer une différence significative pour différentes issues entre les patients qui participaient versus ceux qui ne participaient pas à des EC. Aussi, quatre études ont rapporté un bénéfice significatif d'être traité dans un EC, tandis qu'à l'opposé, un nombre égal d'études ont rapporté un plus haut risque de mortalité. En somme, autant d'études rapportaient un effet protecteur des EC autant que d'autres rapportaient un effet néfaste.
La deuxième, est une revue systématique qui a été publiée dans la Cochrane Collaboration (46), et toutes les études incluses dans la précédente revue ont été utilisées dans celle-ci. Par ailleurs, comparativement à la revue de 2005, celle-ci comporte 30 études de cohortes observationnelles supplémentaires et aucun EC additionnel n'a été répertorié. Parmi six comparaisons issues de cinq EC, classifies « bien contrôlés » selon l'auteur, aucune n'a rapporté de différence statistiquement significative entre les patients traités dans les EC et ceux traités hors EC. Seulement une étude portait sur un échantillon de patients atteints de cancer (n = 49) dans laquelle l'intervention mesurait l'effet d'un médicament contre la
10 douleur (57). Cette revue n'a malheureusement pas permis de tirer davantage de conclusions que la précédente. De plus, en raison des petites tailles d'échantillon des études incluses, des façons divergentes d'aborder la question et d'une forte hétérogénéité entre les études, les revues systématiques et les méta-analyses sont difficiles à réaliser dans ce domaine. Ceci confirme que la question de participer ou non à des EC doit être explorée davantage.
eu eu es
u
U B 3 -« VJU a. 'Sr
« a + J s S3 es as a. ■D eu ;çu o E eu a.t
n eu 3 er •■a es eu eu eu ■ a en eu 3I
en eu T3 >eu E 3 en 3 es .22 -c 3 cin offer ux nte s s lor édec eu -es en O 4 — > éd & ét é t ce fér e « E -es en — — eu eu eu Q. eu r is no n re c ruté s pa r 1 ce! O . eu * * c o en ' ô O en ôg 7 artici p artici p s pa r 1 Cn' a artici p s pou r is no n re c ruté s pa r 1 T 3 -eu en '« B Q . CL. 2W a "g yan t accept é m a et ceu x non-re c is offer t d'E C C C es a E o U U en u O U UJ en u O O c en ô -CD E fus é d e fus é d e aï s no n recr u u r qu i aucu n an t refus é d e ai s no n recr u yan t accept é m a et ceu x non-re c is offer t d'E C ité s hor s E C gible s ayan t ; U J 5 en -CD en O c en ô -CD E antr e antr e aï s no n recr u u r qu i aucu n an t refus é d e ai s no n recr u yan t accept é m a et ceu x non-re c is offer t d'E C ité s hor s E C gible s ayan t ; _eu cet B en C3 en cj > , > Ï gible s m tient s p o médeci n tient s ay gible s m yan t accept é m a et ceu x non-re c is offer t d'E C i s -eu en en _eu cet B en C3 en ■ a en ca od en en gible s m tient s p o médeci n tient s ay gible s m atient s a rocessu s 'ayan t pi i s -eu en en H O 'S ■4» + J • * > 4 * gible s m tient s p o médeci n tient s ay gible s m en atient s a rocessu s 'ayan t pi * J 4> O en eu .H C ■ Si E tie n tie n gible s m tient s p o médeci n tient s ay gible s m C O en atient s a rocessu s 'ayan t pi tie n tie n O en ca ta ta oj ca -U O. J - O, -eus
atient s a rocessu s 'ayan t pi ca ca ■S b O . a. O H OH -U O. J - O, -eus
a. o. s CU 0 . c o ■—' — r i CO "St i r i vd r~ —< CN 2 a o en ■ M M P S - ^ CS s ( N O SO i—H S - ^ CS s m CM CN O E o U «o . SO 81 -591 3 0 0 E S 76 -166 7 123 -325 0 81 -591 3 16 -277 2 «u s ■?? c « S3 <*■< T. a >-< «N r-■^j- i n « S3 <*■< T. a >-< m •—' CN i n < 8£
41 ca • M es 3 ej en en ■ eo ï en eu r" CU '5 eu S eu u CU .S > .2i ■a o - a S c La eu U B ca U5
O o ce) - — ce) La eu U B ca U en c U c ca U Ma l car d Ma l 'S. en eu La eu U B ca U 3 O H CD CL) u eu 3 '4) 3 3 3 eu 3 '4) eu CT Non -systémati q (structur e narrative ) o - CT '3 CS c a H Non -sy ste m at Non -systémati q (structur e narrative ) Non -systéma t ta E -eu -M en >. C/5 a c o ■ * ■ > OS os holt z 200 0s a
« o y CN "3(n" 4» ** "e 5 e 3 es -< s . 3 _ ; eU D - _ : eu w 9 5 e 3 es -< Bra eta (39) n . ca _ û . eu S en O i r o r > CN* s o en "3 U CS a. E o U E O m "3 L. ^ es S Q . w E o U S Ë ■2 B C B *— ■•s! « eu Q . .Ï5 . „ eu *- 3
il
O • t . «3 S ! :2, B eu ea en ca -mS
eu T3 Q . , 3 O , <_, çn eu C . » eu fi T3 -«> a 3 eu en " 3 C VS i c .2 pî S 3-a
o Cu O CL) -a -eu C 3 ca Q . -CL) 3 O" O . . « CD O C E O cj C es ® s* à 7 3 en •-« -eu »> § a -a ca eu u I fi §I .
O H • : 2" ° ca ; e u Ç« O E ea Ï : eu T 3 en _ÇU 2.1 eu D 6 0 - eu _B - O -H *« E-S O en en eu eu 3 "O C u eu ? c S SH eu 3 a -2 >- 3 tw b crt-fiai
9" eu S . ê « 2 s? *> £ eu <L> a ' g u g w 4L' -eu E ' eu + ^ ca . . en >_ ' * > — -4—> eu - a Q . > • — c O '€ ca o. eu 3 en —; -eu J 2 en ■— w -eu B & 3 o c or e eu — 2? a * E O C O eu T3 •eu S C 3 TJ en CL) en E eu. • -3 «2 *> JJ a -*-* CD - e u - c a 3 * H « B -eu O en& £ 1
en f " « a O H 3 . 3 à e a eu-S .2? O -eu w en c a 3 eu en «-■ r. ca d O H T 3 § * -s ri => § eu —H en 9- 2 ES 1 1
- o a °* S" 9 •ce) 3 eu S 2 3 > .3 « C T3 -<D eo . 2 en -CU c C O en eu 3 cr eu E e« -o eu a . 3 O E (20 3 en -euIl-S
O H * CN 3 < 2 o^ e O H . 3 . B B 0 S enǤ1
-
ss
eu o "B ^3I I
w ■*-» -4-» C eu s u en eu • 4 - * a a a u 4 - T 3 eu 'CD IL-8 CL, U, \ B en t l t CU * • ' ! en 0 0 ce) -<u S* S a1 g . « S ■ en 3 " O 3 . ce) .=°'03 -ou # 43 1 c .S o tJ o.2 "S
so m o o r 0 \ o r-('*• o o T3 eu a H eu i_ «> = - 4 J S c — B s es - <Q-£
en 3 O H CN o .s -S •S C O 3 —-« 3 a o Q. CL) 3 c r E - e u -*^ en >> 0 0 ca c^ ■u s , en O IT O > CN « r )' -a w cd en feb 3 O en en 3 (1) n. a. 3 m O 0) feb X J 3 4 _ i - n eu CL) •ta dJ Q L a. <d <n - 1 Ha
U . 3 ea eu -a e+-< eu c o en C CJ m ca Si 13 •At u. ^a b o m e ) r 3 a ca . 1 H *2.6. Failles méthodologiques relevées dans la littérature
Les études et les revues de littératures et systématiques identifiées comportent certaines limites. Premièrement, aucun article n'a rapporté la puissance présente pour démontrer une différence de survie. Si un effet existait, il est probablement faible et nécessite un grand nombre de patients pour avoir une puissance acceptable afin de détecter un effet. Deuxièmement, la grande variabilité des groupes de comparaisons des patients traités hors EC peut conduire à un biais de confusion. Dans la majorité des études de la revue systématique la plus récente (46), les groupes contrôles étaient composés uniquement de patients qui ne participaient pas, sans détenir systématiquement l'information sur leur éligibilité aux EC. Troisièmement, les résultats provenaient surtout de patients traités avant les années 2000. Plusieurs nouveaux médicaments ont fait leur apparition depuis (ex. taxanes, inhibiteur de l'aromatase etc.) et peuvent maintenant influencer la survie. Ainsi, davantage d'études plus récentes sont nécessaires pour juger de la représentativité des EC dans la pratique générale contemporaine.
Peppercon et al. (44), ,dans leur revue de littérature publiée en 2004, ont suggéré divers critères pour conduire une étude rétrospective méthodologiquement adéquate. Ceux-ci sont : identification systématique de tous les contrôles appropriés, utilisation de contrôles concomitants (« concurrent »), restriction des contrôles à ceux qui auraient rencontré les critères d'éligibilité de TEC, ajustement pour les facteurs confondants potentiels et inclusion de plusieurs EC.
2.7. Portée des connaissances
Premièrement, étant donné que seulement le tiers des EC rapportent des résultats positifs (8), la présence d'un bénéfice pour toutes les patientes, au-delà de celui pour les générations futures, pourra être un incitatif pour le recrutement. Deuxièmement, des pistes pour l'amélioration des soins et des traitements pourront être explorées. La meilleure survie est-elle reliée à une plus grande observance du traitement, à des traitements plus agressifs, à de meilleurs soins de support? Advenant que notre hypothèse s'avère positive, la réponse à ces questions permettra d'améliorer la motivation des médecins pour recruter
14 ainsi que celle des patientes à participer aux EC et, du coup, susciter leur intérêt pour faire progresser la recherche.
L'étude que nous proposons permettra de déterminer s'il existe un bénéfice de survie pour les patientes atteintes d'un cancer du sein infiltrant et traitées dans un EC par rapport à celles traitées hors EC. Advenant une différence, la recherche des raisons qui l'explique pourra conduire à une amélioration du traitement de cette maladie qui afflige plus de 5000 nouvelles femmes par année au Québec.
CHAPITRE III
3. OBJECTIFS 3.1. Primaire
L'objectif principal de cette étude était de mesurer l'association entre la survie des patientes diagnostiquées d'un cancer du sein infiltrant non métastatique entre le 1er janvier
1982 et le 31 octobre 2008 ayant participé à un EC par rapport à celles qui n'y avaient pas participé.
3.2. Secondaires
Les objectifs secondaires se subdivisent ainsi :
3.2.1. Décrire l'évolution temporelle de la proportion des patientes sous EC.
3.2.2. Mesurer l'association entre la survie des patientes sous EC assignées à différents groupes de traitement par rapport à celles traitées hors EC.
3.2.3. Mesurer l'association entre la survie spécifique au cancer du sein des patientes ayant participé à un EC par rapport à celles qui n'y avaient pas participé.
16
CHAPITRE IV
4. METHODOLOGIE 4.1. Devis
Ce mémoire a été réalisé dans le cadre d'une étude de cohorte observationnelle avec une collecte des données réalisée en rétrospective dans laquelle les années étudiées étaient du 1er janvier 1982 au 31 octobre 2008. La raison expliquant le choix de cette période est
que, premièrement, les EC ont débuté en 1982 au CMS et, deuxièmement, le statut vital de la cohorte était disponible jusqu'au 31 octobre 2008. La date limite des EC inclus dans cette étude correspond à la même que le statut vital de la cohorte; soit le 31 octobre 2008. Donc, pour obtenir un suivi minimal de 6 mois pour la survie, la date limite de diagnostic pour une femme avec un cancer du sein, a été fixée au 31 avril 2008. Cette date correspondait à l'entrée de la patiente dans la cohorte. Le décès ou la censure au 31 octobre 2008 correspondaient à la fin du suivi de la patiente. Ainsi, le suivi temporel minimal pour la survie des sujets était de 6 mois et le suivi maximal était de 25 ans. L'autorisation de la Commission d'accès à l'information du Québec (pour l'obtention des données sur le statut vital, les causes de décès ainsi que les comorbidités) en plus de celle du comité d'éthique de la recherche du Centre hospitalier affilié universitaire de Québec (pour la consultation des dossiers) ont été obtenues (cf. Annexe A et B).
4.2. Population
La cohorte a été construite en fonction de la base de données cliniques du CMS. Une description complète de cette base de données (ses objectifs, son contenu, ses applications et son fonctionnement) se trouve dans l'Annexe C. La cohorte était composée de 6 794 femmes ayant reçu un diagnostic de cancer du sein infiltrant non métastatique entre le 1er
janvier 1982 et le 31 avril 2008. Pour déterminer le taux de concordance entre les données entrées dans la base de données cliniques du CMS et les renseignements contenus dans les dossiers des patientes, une validation a été effectuée en 2005. Pour ce faire, les dossiers de
167 patientes ont été révisés. Pour la majorité des variables requises à notre étude, la concordance était supérieure à 95% entre les variables extraites des 167 dossiers et celles déjà compilées dans la base de données du CMS. Concernant la date de diagnostic, quand une restriction de +/- 7 jours était utilisée, la concordance était de 94% et de 97% lorsqu'une restriction de +/- 30 jours était utilisée. La taille de la tumeur avait 91% de concordance car, dans les rapports de pathologie des années 80, elle était plus difficile à établir. Pour les récepteurs hormonaux, la concordance était excellente. Enfin, pour le grade histologique, il était difficile à évaluer dans les anciens rapports de pathologie, ce qui a donné une concordance variant de 68% à 97% (grade tubulaire, mitotique, nucléaire).
Les patientes retenues pour les analyses devaient faire partie de la base de données cliniques du CMS. Elles devaient être diagnostiquées d'un premier carcinome du sein infiltrant non métastatique entre le 1er janvier 1982 et le 30 avril 2008. Une définition
pour le cancer du sein infiltrant est proposée par le site Internet du CMS (58) : « Ce terme signifie que les cellules cancéreuses ont traversé la paroi du canal de lactation ». Les femmes ayant été diagnostiquées de tout autre type de cancer, excepté ceux de la peau non mélanique ou néoplasie cervicale intraépithéliale, ont été exclues de la cohorte.
4.3. Collecte des données
La collecte des données a été effectuée au CMS. Tous les dossiers de recherche des patientes de la cohorte qui avaient participé à un ou plusieurs EC ont été consultés. Ces dossiers ont été remplis et tenus par des infirmières spécialisées en recherche et conservés dans des filières attribuées à chaque EC respectif. Les données ont été collectées à deux niveaux : pour les caractéristiques des EC et pour les patientes qui y avaient participé. EC
Afin de connaître les principales caractéristiques des protocoles de recherche des EC auxquels les patientes avaient participé, un fichier a été créé pour collecter les données suivantes: le nom de TEC, la phase de l'étude (I, II, III, IV), les dates d'ouverture et de fermeture, les bras de traitement (standard, expérimental ou inconnu) et le médicament ou l'intervention sous étude. Les EC ont été classés dans les catégories suivantes : adjuvant,
18 néo-adjuvant, support et chirurgical. Les EC métastatiques n'ont pas été retenus dans les analyses car la base de données du CMS ne contenait pas l'information sur le développement d'une maladie métastatique.
Par souci de compréhension, voici les définitions des différents types d'EC retenus pour cette étude accompagnées de quelques exemples:
• Adjuvant : Les patientes qui étaient éligibles à ce type d'EC ont eu recours à une chirurgie dans laquelle la tumeur du sein a été excisée. Habituellement, les EC offerts en adjuvant évaluent l'efficacité des médicaments dans le but de prévenir le développement de métastases. Par exemple, TEC NSABP B-36 comparait deux types de chimiothérapies (FEC vs. AC ) afin de vérifier celui qui était le plus susceptible de guérir les femmes.
• Néo-adjuvant : Ce type de traitement est habituellement donné aux patientes pour qui la tumeur est de taille plus importante. Le traitement néo-adjuvant est administré avant la chirurgie dans le but de réduire la taille de la tumeur pour en faciliter la résection. • Support : Les EC de type support évaluent, la plupart du temps, des médicaments qui
aident à soulager les effets secondaires des traitements de chimiothérapie. Par exemple, dans TEC NKV102549, le médicament sous étude était un anti-nauséeux.
• Chirurgical : Dans ce type d'EC, ce sont des procédures chirurgicales qui sont comparées lors de l'étape opératoire. Par exemple, dans l'EC NSABP B-32, les investigateurs cherchaient à comparer la procédure actuelle du retrait des ganglions axillaires d'emblée versus la procédure du retrait des ganglions seulement si le ganglion sentinelle était positif.
Pour s'assurer que toutes les patientes ayant participé à un EC ont été entièrement répertoriées, deux méthodes de vérification ont été utilisées. Dans la première, tous les EC ouverts entre le 1er janvier 1982 et le 31 octobre 2008 ont été identifiés afin de collecter
systématiquement l'ensemble des patientes qui y avait participé jusqu'au jour de la collecte (mai 2010). Pour ce faire, deux listes mises à jour régulièrement par la coordonnatrice aux affaires réglementaires et éthiques ont été mises à notre disposition. L'une était une liste descriptive de tous les EC ouverts au CMS depuis 1982 et l'autre
identifiait, par EC, toutes les patientes qui y avaient participé. Dans la deuxième méthode, à la toute fin de la collecte, une liste des patientes pour qui la variable dans la base de données cliniques CMS indiquait qu'elle avait participé à un EC (n - 144), mais qui ne figurait pas dans le fichier des données des patientes sous EC, a été générée par la statisticienne. Les dossiers de ces patientes ont subséquemment tous été récupérés et documentés aux fins des analyses.
Patientes sous EC
Pour documenter les patientes sous EC, un fichier de données a été établi avec les variables suivantes : le numéro de dossier hospitalier, le numéro d'assurance maladie, la date de recrutement, le bras de traitement attribué à la patiente (standard, expérimental ou inconnu), la médication ou l'intervention reçue et le type d'intervention de l'EC (adjuvant, néo-adjuvant, support, chirurgical) dans lequel elle participait.
Un total de 1 137 patientes ont participé à 51 EC évaluant une intervention de type adjuvante, néo-adjuvante, chirurgicale ou de support. Au cours du suivi, une femme pouvait participer à plus d'un EC, mais l'exposition a été comptabilisée uniquement à partir de la date de la première randomisation.
Une femme qui participait à un EC métastatique n'était pas considérée comme exposée à un EC, excepté si préalablement, elle avait participé à un autre type d'EC. La figure 1 illustre les différentes étapes d'exclusion à l'issue de la collecte des données dans les dossiers de recherche des patientes qui avaient participé à au moins un EC. Pour les EC ouverts au recrutement dans la période de diagnostic visée, tous les dossiers ont systématiquement été collectés, pour ensuite conserver ceux qui respectaient les critères d'éligibilité de la présente recherche. Un total de 243 dossiers de patientes ont été exclus du groupe exposé aux EC.
20 Figure 1. Diagramme de sélection des patientes qui ont participé à un ou des EC
Patientes randomisées et collectées (n= 13 80)
Patientes randomisées après le 31 oct. 08(n=7)
Patientes qui ne respectaient pas les critères d'éligibilité de la maladie (n=82) : - métastases au diagnostic (n=2)
- cancer du sein non-infiltrant (n=68) - histoire personnelle de cancer du sein
(n=4)
- antécédents d'un autre cancer (n=8)
Patientes diagnostiquées à l'extérieure de la période du 1er j an.
82 au 30 avr. 08 (n=9)
Patientes ayant participé seulement à des EC métastatiques (n=125)
Patientes randomisées et retenues pour les
4.4. Variables à l'étude
Pour répondre aux objectifs de l'étude, deux variables catégorielles de nature dichotomiques ont été déterminées; l'une représentait la variable d'exposition et l'autre l'issue clinique. La section suivante décrit les particularités qui les définissent.
4.4.1. Variable indépendante
Participation à un EC: Cette variable correspond à l'exposition de la patiente à un ou des EC pour lequel le type devait être adjuvant, néo-adjuvant, chirurgical ou support. Au moment de la date de randomisation, la patiente était considérée dans le groupe des femmes exposées à un EC. Au cours du suivi, les femmes pouvaient participer à plus d'un EC. Par exemple, à partir du diagnostic, une patiente pouvait être eligible à un EC, qui évaluait l'efficacité d'une chimiothérapie adjuvante, et un autre EC, qui évaluait la radiothérapie, pour lesquelles elle participait de façon subséquente. Si la patiente avait participé à plus d'un EC, elle était considérée comme exposée à partir de la date de randomisation dans le premier EC dans lequel elle avait participé.
Pour l'analyse selon le bras de traitement, les patientes étaient soit assignées aux bras expérimental, standard ou inconnu. Pour les patientes qui participaient à un EC à double insu4, le bras de l'intervention était inconnu. C'était le cas pour la majorité des EC où il y
avait une intervention testant une hormonothérapie. Par exemple, pour les patientes qui avaient participé à l'EC ATAC, les bras de traitement étaient inconnus. Pour certaines patientes de cet EC, le code a été levé pour différentes raisons (ex. récidive d'un cancer) et le personnel traitant pouvait avoir accès à la médication attribuée dans chaque bras de traitement soit du tamoxifène donnée seul pour le bras standard et de l'anastrozole seul (bras expérimental 1) comparativement à de l'anastrozole avec du tamoxifène (bras expérimental 2) pour les bras expérimentaux. Si le code était ouvert, la patiente était alors classifiée dans le bras approprié.
22 4.4.2. Variable dépendante
Le statut vital (décès au 31 octobre 2008) : Sous l'approbation de la Commission d'accès à l'information (cf. Annexe A), les données sur la survie ont été disponibles par jumelage de la base de données du CMS avec celle des décès de l'Institut de la statistique du Québec (ISQ) et la Régie de l'assurance maladie du Québec (RAMQ) pour les dates et les causes de décès. Pour les analyses, la coupure temporelle a été déterminée au 31 octobre 2008 car les derniers décès identifiés à 1TSQ se trouvaient au début du mois de novembre 2008. Bien que les dates de décès fussent disponibles jusqu'en 2009 à la RAMQ, les dates de décès de 1TSQ ont été jugées plus fiables que celles de la RAMQ car celles de l'ISQ ont été mis à jour hebdomadairement par un bulletin de décès (formulaire SP-3) de la direction de l'État civil. Le statut vital a été confirmé par la RAMQ dans la grande majorité des cas. Suite à des études de validation entre les bases de données de la RAMQ et de l'ISQ, pour les femmes de la base de données du CMS envoyées, il existe une bonne concordance entre les dates de décès et c'est un petit nombre de femmes n'ont pas été jumelées (n = 25). Pour ces dernières, la raison était qu'elles avaient déménagées à l'extérieur de la province et, dans ces cas, la RAMQ indiquait une date d'interruption. Il y a eu 1 742 (25,6%) femmes de notre cohorte envoyées pour jumelage qui sont décédées. Les autres ont été censurées au 31 octobre 2008 ou à la date d'interruption de leur admissibilité à la RAMQ.
4.4.3. Covariables
Les variables qui suivent, ont, dans un premier temps, permis de décrire et de comparer les caractéristiques des patientes sous EC et celles traitées hors EC. Dans un deuxième temps, certaines d'entre elles ont permis d'ajuster pour des facteurs potentiellement confondants.
• Stade : Le stade représente l'un des facteurs pronostiques les plus puissants (59, 60). Il a été déterminé en fonction de l'atteinte ganglionnaire et de la taille de la tumeur, étant également reconnues comme des facteurs pronostiques importants (60-63). Le stade TNM de la 6ème version de 1' « American Joint Committee on Cancer » (AJCC)
Grade histologique : Le grade histologique, qui correspond à l'aspect des cellules qui forment la tumeur, a été démontré comme un facteur pronostique influençant la survie. Bien que différentes techniques aient été utilisées pour définir le grade histologique, il semble qu'indépendamment de la survie, il ait une valeur pronostique importante (65). Récepteurs hormonaux : Les récepteurs hormonaux sont des facteurs prédictifs et pronostiques (66, 67). Cependant, l'influence sur la survie globale semble moins importante que sur la rechute (68) et s'atténue avec le temps (67, 69).
Envahissement lymphovasculaire : L'envahissement lymphovasculaire a été démontré comme un facteur pronostique pour la rechute locale et la survie globale (70-73). La saisie de cette variable dans la base de données CMS a débuté en janvier
1987.
Age : L'avancement en âge représente un facteur prédictif de la mortalité d'une patiente avec un cancer du sein (74). L'âge peut aussi être un facteur pronostique négatif de la survie chez les jeunes femmes diagnostiquées d'un cancer du sein (75). Toutefois, dans le cas présent, la variable de l'âge a été considérée en fonction du vieillissement, puisque l'association d'intérêt correspond au temps que la patiente a survécu après le diagnostic si elle a participé à un EC.
Comorbidités : Plusieurs études rapportent que la survie des femmes avec un cancer du sein peut largement être affectée par les comorbidités (76-83). Un index des comorbidités, basé sur celui de Charlson, pour mesurer le poids des différentes conditions pathologiques secondaires des patientes sur le cancer du sein a été utilisé. (84, 85). Selon une méthode rigoureuse, cet index a spécifiquement été élaboré en fonction des patientes de la base de données cliniques du CMS (cf. Annexe D).
Statut HER2 : L'expression du gène HER2/neu est un facteur pronostique qui fournit de l'information additionnelle et prédictive sur la récidive d'un autre cancer et la survie globale (86). Cette variable était disponible seulement à partir du début des années 2000.
Traitements : En se basant sur les données recueillies parmi l'ensemble des EC inclus dans cette étude, les traitements sont de plus en plus ciblés et spécifiques aux différents types de cancer du sein diagnostiqués. Les traitements reçus par les patientes ont été divisés en fonction des catégories principales de traitement dont la
24
chimiothérapie, l'hormonothérapie, une combinaison de chimiothérapie et d'hormonothérapie ou aucun traitement.
4.5. Analyses statistiques
Toutes les analyses ont été effectuées à l'aide du logiciel « Statistical Analysis System » (SAS version 9.2). Pour répondre à l'objectif primaire et pour toutes les autres comparaisons, un niveau de signification statistique fixé à 95% (valeur p < 0,05) a été considéré statistiquement significatif. Des intervalles de confiance (IC) à 95% ont été calculés pour appuyer la signification statistique et donner une mesure de précision pour chacune des mesures d'associations. Un rapport de hasard (RH) inférieur à 1 (RH < 1) signifiait que la survie était meilleure dans le groupe des patientes sous EC et l'inverse s'il était supérieur à 1 (RH > 1). Un RH qui égalait 1 signifiait que la participation aux EC et la survie étaient indépendants l'un de l'autre.
4.5.1. Hypothèse nulle
Dans le but de tester la signification statistique pour estimer s'il y avait une association probable entre le fait de participer à un EC et la survie, l'hypothèse nulle amenée était : il n'y a pas de différence de survie entre les patientes avec un carcinome du sein infiltrant non métastatique ayant participé à un EC par rapport à celles qui n'y ont pas participé.
4.5.2. Taille de l'échantillon
Alors que la collecte de données a été réalisée en rétrospective, les analyses ont été effectuées sur une taille d'échantillon qui était fixe. Avec les données disponibles, la médiane du ratio de la survie a été calculée pour le groupe sous EC par rapport à celui non sous EC. Entre 1982 et 2008, 6 794 femmes ont été diagnostiquées d'un cancer du sein infiltrant non métastatique. Les patientes sous EC représentaient 16,7% (1 137) de cette population et le nombre de décès totalisaient 1 742 au 31 octobre 2008. Avec une puissance de 90% (a = 0,05; P - 0,1), l'étude était en mesure de détecter un RH de 0,81 en faveur des femmes sous EC (87, 88).
4.5.3. Analyse de survie de Kaplan-Meier
Pour mettre en relief l'effet sur la survie de participer ou non à un EC (variables dichotomiques), des courbes de survie de Kaplan-Meier (KM) ont été calculées pour chacun des deux groupes. D'abord, elles ont été calculées pour les patientes avec un cancer du sein infiltrant non métastatique n'ayant pas participé à un EC et ensuite pour les patientes avec un cancer du sein infiltrant non métastatique ayant participé à un EC.
4.5.4. Comparaison de la survie avec le modèle de Cox
Les courbes de survie de KM ont été comparées en utilisant le modèle des risques proportionnels de Cox qui a permis de tenir compte du temps dans la survenue des décès pour les deux groupes. Avant d'effectuer les analyses avec le modèle de Cox, le respect de l'hypothèse de la proportionnalité pour confirmer la validité de la mesure a été vérifié. Pour ce faire, certaines conditions ont été prises en compte. Premièrement, les courbes de KM calculées devaient, en tout temps, ne pas se croiser. Deuxièmement, la proportionnalité du RH devait être respectée. En effet, si la fonction des courbes du graphique du logf-log(survie)] et la fonction du log(temps) étaient parallèles, il y avait une constance dans le temps et la condition était ainsi respectée pour toutes les variables étudiées.
Compte tenu des différences souvent relevées entre les groupes de comparaison (sous EC versus non sous EC) et de l'influence importante qu'elles peuvent avoir sur la survie, les variables de l'âge et du stade ont été traitées différemment des autres covariables pour l'ajustement des modèles. Pour permettre une comparaison valide et plus représentative de la réalité, l'âge et le stade ont été rendus plus homogènes dans les analyses à l'aide d'une technique de stratification qui permettait de mieux prendre en compte les facteurs de confusion. Ainsi, l'âge (<49, 50-59, 60-69, >70) et le stade (I, II, III, inconnu) ont été divisés en quatre catégories chacun, pour un total de 16 strates possibles. Ensuite, l'option STRATA, dans la programmation des modèles de Cox avec le logiciel SAS, a été utilisée. Avec cet énoncé, le présupposé était que l'on ajuste des modèles séparés pour chaque strate, sous la contrainte que les coefficients des autres variables dans le modèle étaient
26 égaux, mais que les fonctions de risque de base étaient inégales. Ainsi, les mesures d'associations brutes produites tenaient compte de ces deux variables de stratification.
4.5.4.1. Covariables du modèle de Cox
Afin d'ajuster la mesure d'association pour de possibles différences entre les deux groupes et de déterminer si un changement dans la survie pouvait être attribuable à différents facteurs pronostiques confondants, les variables suivantes ont été utilisées dans le modèle selon leurs disponibilités à travers les années étudiées : les récepteurs hormonaux (RE+ ou RP+, RE-/RP-, inconnu), le grade histologique (peu différencié, modérément différencié, peu différencié, inconnu), l'envahissement lymphovasculaire (oui, non, inconnu) les traitements adjuvants (aucun, chimiothérapie seule, hormonothérapie seule, combinaison de chimiothérapie et hormonothérapie, inconnu) et l'index des comorbidités (0, > 1, inconnu) qui a été disponible à partir de 1987.
4.5.4.2. Construction des modèles de Cox
Les modèles sont tous issus d'analyses multivariées de la régression de Cox. Ils ont tous été stratifiés pour l'âge et le stade pour les raisons mentionnées ci-haut.
Les modèles 1 et 2 ont été construits en fonction de la population entière de l'étude qui compare un groupe de 5 657 femmes non sous EC avec un groupe de 1 167 femmes sous EC. Ils ont été construits en fonction de toutes les informations disponibles dans la base de données cliniques du CMS à partir du 1er janvier 1982. Le modèle 1 présente une
mesure d'association brute. Le modèle 2 présente une mesure d'association ajustée pour les récepteurs hormonaux, les traitements et le grade histologique.
Les modèles 3 et 4 ont été construits en fonction des variables de l'index des comorbidités et de l'envahissement vasculaire, toutes deux disponibles à partir de l'année 1987. La logique est que nous avions suffisamment de puissance pour effectuer une analyse dans une population pour qui des informations supplémentaires étaient disponibles pour l'ajustement. Toutes les femmes pour qui la variable des comorbidités n'était pas disponible dans les dossiers d'hospitalisation avant 1987, ont été exclues (n = 731) des analyses dans les modèles 3 et 4. Le modèle 3 présente une mesure d'association brute sur
une population de femmes pour qui la variable des comorbidités était disponible à partir du mois d'avril 1987. Le modèle 4, étant considéré comme le plus complet, donc le plus valide, présente une mesure d'association ajustée pour les récepteurs hormonaux, les traitements, le grade histologique, l'envahissement lymphovasculaire et l'index des comorbidités. Il est donc important de comprendre que le modèle 1 ne peut être comparé avec le modèle 3 et, que le modèle 2 ne peut être comparé avec le modèle 4, car ils sont basés sur des dénominateurs différents.
Les modèles d'analyse par bras de traitement (tableau 9) ont été traités en quatre catégories nominales (sous EC - traitement standard, sous EC - traitement expérimental, sous EC - traitement inconnu et non sous EC). Les mesures d'association pour le groupe inconnu ne sont pas présentées, car il n'y avait pas suffisamment d'événement pour générer un RH dans le modèle des risques proportionnels de Cox.
4.5.4.3. Gestion des valeurs manquantes
Toutes les variables avec des valeurs inconnues ou sans renseignement ont été conservées dans les analyses en incluant des indicatrices pour les valeurs manquantes. Exceptionnellement, pour la variable de l'index des comorbidités, les valeurs manquantes qui s'y rattachent représentent les femmes pour qui aucun renseignement n'était disponible dans les données d'hospitalisation après avril 1987.
4.5.4.4. Analyses de sensibilité
Accessoirement, des tests d'interaction ont été effectués afin d'explorer davantage l'association entre la participation aux EC et différents facteurs. Ces tests ont été effectués suite aux analyses principales pour comprendre le comportement des mesures d'associations qui étaient, la plupart du temps, très près de la valeur nulle. L'interaction a donc été testée pour la période de diagnostic, le délai de randomisation, l'âge, les traitements de chimiothérapie et le stade. Étant donné que l'interaction s'est avérée significative (p < 0,15) uniquement pour la période de diagnostic, seulement ces analyses sont présentées dans cette étude. La comparaison entre les périodes est limitée en raison de la durée de suivi qui varie entre chacune d'elles.