HAL Id: dumas-01913232
https://dumas.ccsd.cnrs.fr/dumas-01913232
Submitted on 6 Nov 2018
HAL is a multi-disciplinary open access
archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Prise en charge des premières crises épileptiques au
CHU de Rouen : évaluation à deux ans de l’activité
d’hôpital de jour
Aude Doan
To cite this version:
Aude Doan. Prise en charge des premières crises épileptiques au CHU de Rouen : évaluation à deux ans de l’activité d’hôpital de jour. Médecine humaine et pathologie. 2018. �dumas-01913232�
FACULTE MIXTE DE MEDECINE ET DE PHARMACIE DE ROUEN
ANNEE 2018
N°
THESE POUR LE DOCTORAT EN
MEDECINE
(Diplôme d’Etat)
PARDOAN Aude
Née BRETAUDLe 26 DECEMBRE 1990 à PARIS XIVème
PRESENTEE ET SOUTENUE PUBLIQUEMENT LE 1er OCTOBRE 2018
PRISE EN CHARGE DES PREMIERES CRISES
EPILEPTIQUES AU CHU DE ROUEN :
EVALUATION A DEUX ANS DE L’ACTIVITE
D’HOPITAL DE JOUR
PRESIDENT DU JURY : DIRECTRICE DE THESE : MEMBRES DU JURY :
Professeur David MALTETE Docteur Floriane LE GOFF Professeur Marie-Laure WELTER Professeur Emmanuel GERARDIN
ANNEE UNIVERSITAIRE 2017 - 2018 U.F.R. DE MEDECINE ET DE PHARMACIE DE ROUEN
---
DOYEN : Professeur Pierre FREGER
ASSESSEURS : Professeur Michel GUERBET
Professeur Benoit VEBER
Professeur Pascal JOLY
Professeur Stéphane MARRET
I - MEDECINE
PROFESSEURS DES UNIVERSITES – PRATICIENS HOSPITALIERS
Mr Frédéric ANSELME HCN Cardiologie Mme Gisèle APTER Havre Pédopsychiatrie Mme Isabelle AUQUIT AUCKBUR HCN Chirurgie plastique
Mr Fabrice BAUER HCN Cardiologie
Mme Soumeya BEKRI HCN Biochimie et biologie moléculaire Mr Ygal BENHAMOU HCN Médecine interne
Mr Jacques BENICHOU HCN Bio statistiques et informatique médicale
Mr Olivier BOYER UFR Immunologie
Mme Sophie CANDON HCN Immunologie
Mr François CARON HCN Maladies infectieuses et tropicales Mr Philippe CHASSAGNE (détachement) HCN Médecine interne (gériatrie) – Détachement Mr Vincent COMPERE HCN Anesthésiologie et réanimation chirurgicale Mr Jean-Nicolas CORNU HCN Urologie
Mr Antoine CUVELIER HB Pneumologie
Mr Pierre CZERNICHOW (surnombre) HCH Epidémiologie, économie de la santé Mr Jean-Nicolas DACHER HCN Radiologie et imagerie médicale
Mr Stéfan DARMONI HCN Informatique médicale et techniques de communication Mr Pierre DECHELOTTE HCN Nutrition
Mr Frédéric DI FIORE CB Cancérologie
Mr Fabien DOGUET HCN Chirurgie Cardio Vasculaire
Mr Jean DOUCET SJ Thérapeutique - Médecine interne et gériatrie
Mr Bernard DUBRAY CB Radiothérapie
Mr Philippe DUCROTTE HCN Hépato-gastro-entérologie
Mr Frank DUJARDIN HCN Chirurgie orthopédique - Traumatologique
Mr Fabrice DUPARC HCN Anatomie - Chirurgie orthopédique et traumatologique
Mr Eric DURAND HCN Cardiologie
Mr Bertrand DUREUIL HCN Anesthésiologie et réanimation chirurgicale Mme Hélène ELTCHANINOFF HCN Cardiologie
Mr Manuel ETIENNE HCN Maladies infectieuses et tropicales Mr Thierry FREBOURG UFR Génétique
Mr Pierre FREGER HCN Anatomie - Neurochirurgie Mr Jean François GEHANNO HCN Médecine et santé au travail Mr Emmanuel GERARDIN HCN Imagerie médicale
Mme Priscille GERARDIN HCN Pédopsychiatrie M. Guillaume GOURCEROL HCN Physiologie Mr Dominique GUERROT HCN Néphrologie Mr Olivier GUILLIN HCN Psychiatrie Adultes Mr Didier HANNEQUIN HCN Neurologie
Mr Fabrice JARDIN CB Hématologie
Mr Luc-Marie JOLY HCN Médecine d’urgence Mr Pascal JOLY HCN Dermato – Vénéréologie Mme Bouchra LAMIA Havre Pneumologie
Mme Annie LAQUERRIERE HCN Anatomie et cytologie pathologiques Mr Vincent LAUDENBACH HCN Anesthésie et réanimation chirurgicale Mr Joël LECHEVALLIER HCN Chirurgie infantile
Mr Hervé LEFEBVRE HB Endocrinologie et maladies métaboliques Mr Thierry LEQUERRE HB Rhumatologie
Mme Anne-Marie LEROI HCN Physiologie Mr Hervé LEVESQUE HB Médecine interne Mme Agnès LIARD-ZMUDA HCN Chirurgie Infantile Mr Pierre Yves LITZLER HCN Chirurgie cardiaque
Mr Bertrand MACE HCN Histologie, embryologie, cytogénétique
M. David MALTETE HCN Neurologie
Mr Jean-Paul MARIE HCN Oto-rhino-laryngologie Mr Loïc MARPEAU HCN Gynécologie - Obstétrique
Mr Stéphane MARRET HCN Pédiatrie
Mme Véronique MERLE HCN Epidémiologie
Mr Pierre MICHEL HCN Hépato-gastro-entérologie M. Benoit MISSET HCN Réanimation Médicale Mr Jean-François MUIR (surnombre) HB Pneumologie
Mr Marc MURAINE HCN Ophtalmologie
Mr Philippe MUSETTE HCN Dermatologie - Vénéréologie Mr Christophe PEILLON HCN Chirurgie générale
Mr Christian PFISTER HCN Urologie
Mr Jean-Christophe PLANTIER HCN Bactériologie - Virologie Mr Didier PLISSONNIER HCN Chirurgie vasculaire Mr Gaëtan PREVOST HCN Endocrinologie
Mr Jean-Christophe RICHARD (détachement) HCN Réanimation médicale - Médecine d’urgence Mr Vincent RICHARD UFR Pharmacologie
Mme Nathalie RIVES HCN Biologie du développement et de la reproduction Mr Horace ROMAN HCN Gynécologie - Obstétrique
Mr Jean-Christophe SABOURIN HCN Anatomie - Pathologie Mr Guillaume SAVOYE HCN Hépato-gastrologie Mme Céline SAVOYE–COLLET HCN Imagerie médicale Mme Pascale SCHNEIDER HCN Pédiatrie
Mr Michel SCOTTE HCN Chirurgie digestive Mme Fabienne TAMION HCN Thérapeutique
Mr Luc THIBERVILLE HCN Pneumologie
Mr Christian THUILLEZ (surnombre) HB Pharmacologie
Mr Hervé TILLY CB Hématologie et transfusion M. Gilles TOURNEL HCN Médecine Légale
Mr Olivier TROST HCN Chirurgie Maxillo-Faciale Mr Jean-Jacques TUECH HCN Chirurgie digestive Mr Jean-Pierre VANNIER (surnombre) HCN Pédiatrie génétique
Mr Benoît VEBER HCN Anesthésiologie - Réanimation chirurgicale Mr Pierre VERA CB Biophysique et traitement de l’image Mr Eric VERIN HB Service Santé Réadaptation Mr Eric VERSPYCK HCN Gynécologie obstétrique Mr Olivier VITTECOQ HB Rhumatologie
MAITRES DE CONFERENCES DES UNIVERSITES – PRATICIENS HOSPITALIERS
Mme Noëlle BARBIER-FREBOURG HCN Bactériologie – Virologie Mme Carole BRASSE LAGNEL HCN Biochimie
Mme Valérie BRIDOUX HUYBRECHTS HCN Chirurgie Vasculaire Mr Gérard BUCHONNET HCN Hématologie Mme Mireille CASTANET HCN Pédiatrie Mme Nathalie CHASTAN HCN Neurophysiologie
Mme Sophie CLAEYSSENS HCN Biochimie et biologie moléculaire
Mr Moïse COEFFIER HCN Nutrition
Mr Serge JACQUOT UFR Immunologie
Mr Joël LADNER HCN Epidémiologie, économie de la santé Mr Jean-Baptiste LATOUCHE UFR Biologie cellulaire
Mr Thomas MOUREZ HCN Virologie
Mr Gaël NICOLAS HCN Génétique
Mme Muriel QUILLARD HCN Biochimie et biologie moléculaire Mme Laëtitia ROLLIN HCN Médecine du Travail
Mr Mathieu SALAUN HCN Pneumologie
Mme Pascale SAUGIER-VEBER HCN Génétique Mme Anne-Claire TOBENAS-DUJARDIN HCN Anatomie
Mr David WALLON HCN Neurologie
PROFESSEUR AGREGE OU CERTIFIE
Mr Thierry WABLE UFR Communication
II - PHARMACIE
PROFESSEURS
Mr Thierry BESSON Chimie Thérapeutique
Mr Roland CAPRON (PU-PH) Biophysique Mr Jean COSTENTIN (Professeur émérite) Pharmacologie
Mme Isabelle DUBUS Biochimie
Mr Loïc FAVENNEC (PU-PH) Parasitologie Mr Jean Pierre GOULLE (Professeur émérite) Toxicologie
Mr Michel GUERBET Toxicologie
Mme Isabelle LEROUX - NICOLLET Physiologie
Mme Christelle MONTEIL Toxicologie
Mme Martine PESTEL-CARON (PU-PH) Microbiologie Mr Rémi VARIN (PU-PH) Pharmacie clinique Mr Jean-Marie VAUGEOIS Pharmacologie
Mr Philippe VERITE Chimie analytique
MAITRES DE CONFERENCES
Mme Cécile BARBOT Chimie Générale et Minérale Mr Jérémy BELLIEN (MCU-PH) Pharmacologie
Mr Frédéric BOUNOURE Pharmacie Galénique
Mr Abdeslam CHAGRAOUI Physiologie
Mme Camille CHARBONNIER (LE CLEZIO) Statistiques
Mme Elizabeth CHOSSON Botanique
Mme Marie Catherine CONCE-CHEMTOB Législation pharmaceutique et économie de la santé
Mme Cécile CORBIERE Biochimie
Mr Eric DITTMAR Biophysique
Mme Nathalie DOURMAP Pharmacologie
Mme Isabelle DUBUC Pharmacologie
Mme Dominique DUTERTE- BOUCHER Pharmacologie
Mr Abdelhakim ELOMRI Pharmacognosie
Mme Nejla EL GHARBI-HAMZA Chimie analytique
Mme Marie-Laure GROULT Botanique
Mr Hervé HUE Biophysique et mathématiques
Mme Laetitia LE GOFF Parasitologie – Immunologie
Mme Hong LU Biologie
M. Jérémie MARTINET (MCU-PH) Immunologie
Mme Marine MALLETER Toxicologie
Mme Sabine MENAGER Chimie organique
Mme Tiphaine ROGEZ-FLORENT Chimie analytique
Mr Mohamed SKIBA Pharmacie galénique
Mme Malika SKIBA Pharmacie galénique
Mme Christine THARASSE Chimie thérapeutique
Mr Frédéric ZIEGLER Biochimie
PROFESSEURS ASSOCIES
Mme Cécile GUERARD-DETUNCQ Pharmacie officinale Mr Jean-François HOUIVET Pharmacie officinale
PROFESSEUR CERTIFIE
Mme Mathilde GUERIN Anglais
ATTACHES TEMPORAIRES D’ENSEIGNEMENT ET DE RECHERCHE
Mme Anne-Sophie CHAMPY Pharmacognosie
M. Jonathan HEDOUIN Chimie Organique
LISTE DES RESPONSABLES DES DISCIPLINES PHARMACEUTIQUES
Mme Cécile BARBOT Chimie Générale et minérale
Mr Thierry BESSON Chimie thérapeutique
Mr Roland CAPRON Biophysique
Mme Marie-Catherine CONCE-CHEMTOB Législation et économie de la santé
Mme Elisabeth CHOSSON Botanique
Mme Isabelle DUBUS Biochimie
Mr Abdelhakim ELOMRI Pharmacognosie
Mr Loïc FAVENNEC Parasitologie
Mr Michel GUERBET Toxicologie
Mr François ESTOUR Chimie organique
Mme Isabelle LEROUX-NICOLLET Physiologie Mme Martine PESTEL-CARON Microbiologie
Mr Mohamed SKIBA Pharmacie galénique
Mr Rémi VARIN Pharmacie clinique
III – MEDECINE GENERALE
PROFESSEUR
Mr Jean-Loup HERMIL (PU-MG) UFR Médecine générale
MAITRE DE CONFERENCE
Mr Matthieu SCHUERS (MCU-MG) UFR Médecine générale
PROFESSEURS ASSOCIES A MI-TEMPS – MEDECINS GENERALISTES
Mr Emmanuel LEFEBVRE UFR Médecine Générale
Mme Elisabeth MAUVIARD UFR Médecine générale Mr Philippe NGUYEN THANH UFR Médecine générale Mme Marie Thérèse THUEUX UFR Médecine générale
MAITRES DE CONFERENCES ASSOCIES A MI-TEMPS – MEDECINS GENERALISTES
Mr Pascal BOULET UFR Médecine générale
Mr Emmanuel HAZARD UFR Médecine Générale
Mme Marianne LAINE UFR Médecine Générale
Mme Lucile PELLERIN UFR Médecine générale
ENSEIGNANTS MONO-APPARTENANTS
PROFESSEURS
Mr Serguei FETISSOV (med) Physiologie (ADEN) Mr Paul MULDER (phar) Sciences du Médicament
Mme Su RUAN (med) Génie Informatique
MAITRES DE CONFERENCES
Mr Sahil ADRIOUCH (med) Biochimie et biologie moléculaire (Unité Inserm 905) Mme Gaëlle BOUGEARD-DENOYELLE (med) Biochimie et biologie moléculaire (UMR 1079) Mme Carine CLEREN (med) Neurosciences (Néovasc)
M. Sylvain FRAINEAU (med) Physiologie (Inserm U 1096)
Mme Pascaline GAILDRAT (med) Génétique moléculaire humaine (UMR 1079) Mr Nicolas GUEROUT (med) Chirurgie Expérimentale
Mme Rachel LETELLIER (med) Physiologie
Mme Christine RONDANINO (med) Physiologie de la reproduction Mr Antoine OUVRARD-PASCAUD (med) Physiologie (Unité Inserm 1076) Mr Frédéric PASQUET Sciences du langage, orthophonie Mme Isabelle TOURNIER (med) Biochimie (UMR 1079)
CHEF DES SERVICES ADMINISTRATIFS : Mme Véronique DELAFONTAINE
HCN - Hôpital Charles Nicolle HB - Hôpital de BOIS GUILLAUME
CB - Centre Henri Becquerel CHS - Centre Hospitalier Spécialisé du Rouvray CRMPR - Centre Régional de Médecine Physique et de Réadaptation SJ – Saint Julien Rouen
Par délibération en date du 3 mars 1967, la faculté a arrêté que les opinions
émises dans les dissertations qui lui seront présentées doivent être
considérées comme propres à leurs auteurs et qu’elle n’entend leur donner
aucune approbation ni improbation.
A mon Maître et Président de jury de thèse
Monsieur le Professeur David Maltête
Pour votre bienveillance, votre confiance, et vos précieux enseignements dans le
domaine de la maladie de Parkinson et des mouvements anormaux,
A ma directrice de thèse
Madame le Docteur Floriane Le Goff
Pour ta gentillesse et tes conseils, pour m’avoir fait l’honneur d’encadrer ce
travail de thèse et mon mémoire de DES, pour m’avoir transmis avec
enthousiasme tes précieuses connaissances et ton intérêt pour le domaine de
l’épilepsie.
Un immense merci.
A mes Maîtres et membres du jury :
Madame la Professeure Marie-Laure Welter
Pour avoir accepté de participer à mon jury de thèse, pour votre enseignement et
pour votre soutien au cours de ce dernier semestre d’internat.
Je tiens à vous exprimer ici de sincères remerciements et ma respectueuse
gratitude.
Monsieur le Professeur Emmanuel Gérardin
Je vous remercie infiniment d’avoir accepté de participer au jury de ma thèse.
Je vous prie de trouver ici l’expression de ma plus profonde gratitude.
A tous mes aînés, neurologues de Rouen, et neurologues d’ailleurs :
Au Professeur Didier Hannequin, pour m’avoir transmis votre savoir et votre rigueur au cours
de ces années d’internat.
Aux docteurs Nicolas Mirlink et Damien Fetter, pour leur bonne humeur et leur aide précieuse dans les débuts de ma vie d’interne.
A Ozlem Ozkül, Aude Triquenot, et au Dr Guegan-Massardier, pour leur confiance lors de mes gardes.
Un grand merci à Bertrand Bourre, David Wallon, Aline Zarea, Romain Lefaucheur, pour leur disponibilité et tout ce qu’ils m’ont enseigné dans leurs domaines respectifs, à Patrick
Ahtoy et à Jean-Paul Bouwyn également.
Au docteur Yannick Onnient, pour ses conseils et sa précieuse expérience.
A Audrey pour tout ce qu’elle a pu m’apprendre et pour sa sympathie, à Gülden, super chef autant que super co-interne, et à Lou et Benjamin pour leur exemple à suivre.
En neurophysiologie, un immense merci à Lucie Guyant-Maréchal, Anne-Laure
Bedat-Millet mais aussi aux docteurs Edouard, Kelfa-Testu, et à Cécile Laubier pour m’avoir
patiemment formée, et m’avoir transmis savoir-faire et passion pour l’EMG ; à Axel Lebas et
Nathalie Chastan pour leur gentillesse et leur enseignement précieux de l’EEG. Je vous en
suis tous très reconnaissante.
A l’équipe de neurologie d’Evreux : Lucile Berthelot, Michèle Gamahut, Lotfi Kort et
Corinne Delmer, pour leur enseignement et leur bienveillance.
A l’équipe de neurologie d’Elbeuf : Laurent Bouchaud, Pierre Verdure et Fabien Louillet, pour ce formidable semestre passé ensemble, tout ce que vous m’avez appris, vos encouragements et votre gentillesse.
Aux équipes soignantes des services qui ont croisé ma route, et particulièrement celles de
l’UNP, du programmé et de neurophysiologie, pour leur soutien, leur aide et pour faire régner une si bonne ambiance dans les services.
Aux secrétaires du service de neurologie du CHU, pour leur aide précieuse à la fois dans la
Au service de médecine interne d’Evreux, pour m’avoir fait découvrir tant d’autres facettes de la médecine.
A l’équipe médicale et paramédicale d’Henri Ey, au Centre Hospitalier du Rouvray, pour leur
enthousiasme, les staffs aux notes sucrées, et pour l’enrichissement que je retiendrais de mon passage en psychiatrie. Un grand merci à Jean-Baptiste Duboc et Pierre Quesada pour leur confiance, et au Professeur Guillin pour son accueil.
A l’ensemble de mes anciens ou actuels co-internes rouennais, avec lesquels je passe ou ai
passé de très bons moments : les moins jeunes, Grégory, Bruno, Elodie, Adèle, Constance… les plus jeunes, Anaïs, Antoine, Mathilde, Adèle, Gérald, Laura, Margaux, Mélina, Gérald,
Laura, Paul-Alexandre, Linda, Jean et Jean-Loup… Mais aussi Elise, Clara, Guillaume, Clément, Alexandre, Jasmine, Salimata.
Et plus particulièrement : à Julie pour ta bonne humeur, à Clémence pour notre fine équipe du secteur programmé, à Adrien pour les « tea/coffee-time » sur la mezzanine, et ce semestre en UNP. A Morgane, pour ces 18 premiers mois passés ensemble, ton amitié, les covoiturages… (et un EVJF idéal !).
A Céline, Joy et Justine bien sûr, il faudrait se revoir bien plus souvent !
A Emilie et Claire, pour tous les bons moments, les soirées, votre compagnie si agréable. Et enfin à Caroline et Maxime, pour m’avoir soutenue dans la dernière ligne droite !
A mes parents, pour leur amour, leur soutien inconditionnel, et bien plus encore. Je vous en
serai toujours profondément reconnaissante.
A ma grande sœur, que j’aime à la folie, pour m’avoir toujours supportée, aidée, accompagnée,
et entourée de toute sa tendresse.
A ma Mémé, qui prend une place si particulière dans mon cœur.
Et enfin à Pierre, mon époux, sans qui rien n’aurait été possible, et surtout rien n’aurait été
pareil. Je sais que nous continuerons toujours à prendre soin l’un de l’autre, et j’ai hâte de découvrir avec toi ce que l’avenir pourra bien nous réserver. Je t’aime infiniment.
SOMMAIRE
I – Introduction ... 20
I - 1. Epidémiologie ... 20
I - 2. Définition de l’épilepsie ... 21
I - 3. Problématique diagnostique ... 25
I - 4. Evaluation du risque de récidive ... 26
I - 5. Recommandations de prise en charge d’une première crise épileptique ... 28
I - 6. Traitement de la première crise épileptique ... 34
I - 7. Modèle des « first seizure clinic » ... 38
II – Objectifs de l’étude ... 40
III – Matériels et méthodes ... 41
III - 1. Population ... 41
III – 2. Organisation de l’hôpital de jour ... 41
III – 3. Données cliniques et paracliniques ... 43
III – 4. Critères d’évaluation ... 45
IV – Résultats ... 46
IV – 1. Population ... 46
IV – 2. Diagnostics à l’issue de l’hôpital de jour ... 49
IV – 3. Performance de l’interrogatoire et des examens complémentaires ... 51
IV – 4. Délai d’attente ... 59
IV – 5. Conduite à tenir à l’issue de l’hôpital de jour ... 61
IV – 6. Données de suivi ... 65
V – Discussion ... 70
V – 1. Une activité pertinente ... 70
V – 2. Limites et perspectives ... 77
VI – Conclusion ... 79
VII – Annexes ... 80
VIII – Bibliographie ... 82
Liste des abréviations
AVC : Accident vasculaire cérébral CHU : Centre Hospitalier Universitaire CNEP : Crise non épileptique psychogène ECG : Electrocardiogramme
EEG : Electroencéphalogramme
EEG-PS : Electroencéphalogramme après privation de sommeil EGI : Epilepsie généralisée idiopathique
EMJ : Epilepsie myoclonique juvénile HAS : Haute Autorité de Santé
HDJ : Hôpital de jour
ILAE : International League Against Epilepsy IRM : Imagerie par résonance magnétique
MESS : Multicenter Study of Early Epilepsy and Single Seizure NICE : National Institute for Health and Care Excellence SANAD : Standard and New Antiepileptic Drugs
SAU : Service d’accueil et de traitement des urgences SFN : Société Française de Neurologie
I – Introduction
I - 1. Epidémiologie
L’épilepsie est une pathologie fréquente dont la prévalence moyenne est de 5/1000 en Europe et en Amérique du Nord (1). Celle-ci augmente avec l’âge, particulièrement après 60 ans avec des chiffres de prévalence avoisinant les 10/1000 (2), voir plus, dans des populations de personnes âgées avec comorbidités multiples.
L’incidence des premières crises épileptiques non provoquées en France est évaluée de 42 à 57/100 000, tandis que celle des premières crises symptomatiques est de 20 à 39/100 000 (3), bien que l’on dispose de peu de données sur ce sujet et qu’il existe une probable sous-estimation de ces chiffres (les premières crises d’épilepsie ne donnant pas toujours lieu à un bilan auprès d’un médecin). On estime qu’environ 10% de la population mondiale fera un jour une crise épileptique (4,5).
L’épilepsie pose un problème majeur de santé publique, en termes de coût, de morbi-mortalité mais également vis-à-vis de ses conséquences socio-professionnelles et du handicap qu’elle engendre.
Elle contribuait en 2000, sur le plan mondial, à une perte de plus de 7 millions d’années de vie en bonne santé (Disability Adjusted Life Years ou DALY) (6), les conséquences des crises généralisées allant de lésions post-traumatiques bénignes jusqu’au décès. La qualité de vie des patients diagnostiqués épileptiques est réduite, du fait de restrictions affectant la conduite automobile, d’aménagements parfois nécessaires et d’une possible stigmatisation rencontrée dans leur vie professionnelle, de l’importance de respecter une hygiène de vie particulière et de l’impact sur leur vie sociale et familiale. De plus, l’épilepsie peut avoir des conséquences psychologiques non négligeables, avec un taux accru d’anxiété, de dépression et de faible niveau d’estime de soi chez les patients atteints (6).
En Europe, le coût annuel des 6 millions de patients présentant une épilepsie active est estimé à 20 milliards d’euros, selon un rapport de l’Organisme Mondial de la Santé datant de 2010. Dans un pays tel que la France, il représente 0,2% du produit intérieur brut, avec un coût annuel de 3,5 milliards d’euro. On estime qu’une réduction de 10% des erreurs diagnostiques concernant l’épilepsie permettrait des économies de l’ordre de 15 millions d’euros par an (7,8).
I - 2. Définition de l’épilepsie
I – 2.1 Préambule
L’épilepsie est une variété de troubles reflétant une dysfonction cérébrale pouvant résulter de diverses causes, et se caractérisant par la récurrence de crises épileptiques.
à La crise épileptique : éléments de physiopathologie
Une crise épileptique consiste en la survenue transitoire de signes et/ou symptômes liés à une activité neuronale cérébrale excessive ou anormalement synchrone (9,10). En fonction des conséquences cliniques de l’implication de tout ou partie du cortex cérébral, on pourra distinguer les crises focalisées et généralisées.
Sur le plan physiopathologique, le passage d’un comportement neuronal normal à une activité épileptique est globalement causé par l’association entre un renforcement de la connectivité entre neurones ainsi que des signaux excitateurs au sein des réseaux cérébraux, associé à une défaillance des mécanismes inhibiteurs (11). Le cortex cérébral et l’hippocampe sont des structures particulièrement sujettes à la génération de bouffées d’activité synchrone sous-jacentes à de nombreuses formes d’épilepsie ; le thalamus est quant à lui connu comme ayant un rôle majeur dans la genèse des absences épileptiques, impliquant des boucles thalamocorticales (12). De façon générale, les mécanismes sous-tendant la formation des crises épileptiques semblent relever soit de phénomènes excitatoires rythmiques ou toniques incontrôlés, soit d’interactions rythmiques et synchrones entre neurones excitateurs, neurones inhibiteurs, et états de conductances membranaires (13).
L’altération des réseaux neuronaux conduisant à leur hyperexcitabilité et la formation des crises épileptiques, appelée épileptogénèse, est un phénomène complexe et multifactoriel. Il peut être la conséquence d’anomalies dans la structure et l’organisation des neurones dans les malformations corticales, dans le métabolisme neuronal dans les troubles métaboliques, de mutations génétiques aboutissant à un dysfonctionnement de canaux ioniques dans certaines formes d’épilepsie, ou de perturbations de la fonction de certains réseaux cérébraux (comme le réseau thalamocortical dans l’épilepsie absence, ou le réseau limbique dans l’épilepsie du lobe temporal). La prédisposition à la survenue de crises, les différents types d’épilepsie, peuvent être issus d’une combinaison de plusieurs mécanismes étiologiques, et être modifiés par des facteurs génétiques ou environnementaux (14–16).
à Classification des crises épileptiques
La classification actuellement la plus répandue, divisant les crises épileptiques en fonction de leur début partiel (signes focaux initiaux) ou généralisé, avec des crises partielles simples ou complexes en fonction de la survenue d’une perte de contact, et la division des crises généralisées en divers types, est issue du travail d’une commission de l’International League Against Epilepsy (ILAE) de 1981 (17), révisé ensuite à plusieurs reprises.
Très récemment, en 2017, l’ILAE a publié une nouvelle classification ayant pour but de faciliter la description des crises, reposant principalement sur la nature des manifestations cliniques initiales de la crise (début focal, généralisé ou inconnu), et la présence d’une altération de la conscience pour les crises à début focal (18,19). Celle-ci est présentée dans sa version détaillée ci-dessous.
Classification des types de crises épileptiques, version élargie, Fisher et al. 2017
à Les différentes « épilepsies »
L’épilepsie, trouble caractérisé par la récurrence de crises épileptiques, regroupe un vaste ensemble de situations cliniques diverses ; tout d’abord, comme nous venons de le voir, par la variété de la sémiologie des crises épileptiques en elles-mêmes, mais également par la multiplicité de ses causes.
En 2017 la commission pour la classification et la terminologie de l’ILAE a pris position pour une nouvelle classification des types d’épilepsie, mise à jour réalisée à la lumière de l’avancée des dernières décennies concernant la compréhension de l’épilepsie (20). La figure ci-dessous, issue de ce travail, illustre bien l’intrication entre, d’une part, la précision du type d’épilepsie par le clinicien (débutant par l’identification du ou des type(s) de crises présentées par le patient, et pouvant aller jusqu’à celle d’un syndrome épileptique), en parallèle de son étiologie.
Classification des épilepsies de l’ILAE, Scheffer et al., 2017
Les différents types d’épilepsie identifiables sont les suivants, selon ces recommandations :
- L’épilepsie focale : trouble unifocal ou multifocal, caractérisé par l’implication d’un seul hémisphère cérébral dans la genèse des crises. Son diagnostic est principalement clinique, mais l’électroencéphalogramme (EEG) peut le supporter par la mise en évidence de décharges épileptiformes localisées.
- L’épilepsie généralisée : une activité de pointe-ondes ou polypointes généralisées est typiquement présente sur les EEG intercritiques, chez des patients présentant des crises de type généralisé. En l’absence d’anomalies EEG, ou d’éléments cliniques marquants tels que la présence de myoclonies ou d’une histoire familiale significative, il convient
d’être prudent sur le diagnostic car des crises paraissant généralisées peuvent en réalité relever d’un début focal n’ayant pu être mis en évidence initialement.
- Les épilepsies généralisées et focales combinées : là encore, le diagnostic repose sur la clinique avec l’association de crises focales et généralisées chez un même patient, supportée par l’EEG qui peut montrer en intercritique des anomalies généralisées et/ou focales.
Parfois, la précision diagnostique s’arrête à cette étape, lorsque le clinicien ne peut identifier de syndrome épileptique particulier, dernier niveau de précision du type d’épilepsie d’un patient. Un syndrome épileptique réfère à un groupe de caractéristiques clinique, EEG, et d’imagerie tendant à survenir ensemble, souvent âge-dépendant, et pouvant être associé à certaines comorbidités et implications étiologiques, pronostiques ou thérapeutiques.
On peut citer en particulier le groupe des Epilepsies Généralisées Idiopathiques (EGI), comprenant l’épilepsie absence de l’enfant ou de l’adolescent, l’épilepsie myoclonique juvénile, et les crises généralisées tonico-cloniques isolées (anciennement crises généralisées tonico-cloniques du réveil).
En parallèle du diagnostic syndromique sera recherché, et ce dès le début de la prise en charge du patient lors de sa première crise, la cause de son épilepsie. Les étiologies, diverses, peuvent être classées en plusieurs sous-groupes comprenant les causes structurales, génétiques, infectieuses, métaboliques et immunitaires, et peuvent être multiples chez un même patient (20,21). Par ailleurs, il n’existe pas de corrélation parfaite entre un syndrome épileptique (ou un type d’épilepsie) et une étiologie. Une liste plus détaillée des principales étiologies des épilepsies, issue d’un travail de Shorvon publié en 2011, est proposée en annexe 1.
I – 2.2 Définition actuelle de l’épilepsie
Il est essentiel de noter que tout individu, exposé à une situation favorable au déclenchement d’une crise épileptique, peut présenter un tel événement au cours de son existence sans toutefois souffrir d’épilepsie au sens strict, comme c’est le cas dans les crises symptomatiques aiguës (lors d’une agression cérébrale aiguë réversible par exemple). La définition de la pathologie « épilepsie » est donc délicate.
En 2005, l’International League Against Epilepsy l’a défini de façon conceptuelle comme une pathologie cérébrale caractérisée par :
• La survenue d’au moins une crise épileptique
• Une prédisposition durable à générer des crises épileptiques
• Ses conséquences neurobiologiques, cognitives, psychologiques et sociales
Cette définition introduit la possibilité de retenir un diagnostic d’épilepsie suite à la survenue d’une seule crise, au contraire de celle précédemment admise (survenue d’au moins deux crises non provoquées), inadaptée dans certaines situations cliniques.
Suite à un nouveau travail de Fisher et al. , l’ILAE a également adopté une définition opérationnelle de l’épilepsie, en 2014, plus adaptée à son application pratique (22).
Définition clinique de l’épilepsie, Fisher et al., 2014
Un patient peut donc être diagnostiqué épileptique soit suite à la survenue de deux crises épileptiques non provoquées, soit après une crise isolée, en présence d’éléments permettant d’affirmer un risque de récidive suffisamment élevé. Il devient donc crucial après la survenue d’une première crise épileptique d’évaluer ce risque de récidive, par un interrogatoire précis et la réalisation d’un bilan clinique et paraclinique approprié.
I - 3. Problématique diagnostique
Le diagnostic d’épilepsie repose avant tout sur la survenue d’une crise épileptique, la présence d’une prédisposition aux crises ne suffisant pas à elle seule au diagnostic. Aucun signe clinique n’en étant pathognomonique, son identification est difficile et repose sur un faisceau d’arguments comprenant les antécédents du patient, les circonstances de survenue du malaise,
les signes cliniques avant, pendant et après le malaise, avec une anamnèse précise ne pouvant souvent être reconstituée que grâce à un témoin de l’épisode. De ce fait, les erreurs diagnostiques sont très fréquentes et évaluées entre 19 et 26% selon les études (9).
Le problème se pose particulièrement pour les crises généralisées, dont les principaux diagnostics différentiels sont les syncopes convulsivantes et les Crises Non Epileptiques Psychogènes (CNEP, définies comme des épisodes imitant les crises épileptiques, liés à un processus psychique, sans décharge neuronale paroxystique anormale associée).
Or, malaises et syncopes sont des motifs de consultation très fréquents dans les services d’urgence, et les conséquences d’un diagnostic erroné sont importantes (risques d’effets secondaires d’un traitement antiépileptique prescrit de façon inappropriée, conséquences sociales et psychologiques liées au statut d’épileptique telles que citées précédemment, retard au diagnostic d’autres affections). Les consultations aux urgences pour crise d’épilepsie sont fréquentes, elles représentent 0,3 à 1,2% des motifs d’admission (23).
Il semble donc nécessaire de faire appel à une expertise spécialisée pour confirmer la nature épileptique d’un malaise, et le cas échéant établir le diagnostic d’épilepsie. Dans une étude de Heather Angus-Leppan publiée en 2008, on retrouve une faible corrélation entre les diagnostics initiaux et ceux retenus par un neurologue (28,5% de diagnostics cliniques établis initialement par les médecins référant les patients, contre 87,3% après expertise dont 43% d’épilepsie, sur 158 cas), avec environ un diagnostic sur deux d’erroné concernant les patients issus des services d’urgences (24).
De surcroît, l’intervention précoce d’une équipe spécialisée en neurologie est souhaitable afin d’appliquer une approche syndromique la plus précise possible concernant le type de crise, l’identification d’un syndrome épileptique particulier, ceci afin d’adapter les traitements et d’expliquer au patient le pronostic spécifique de son épilepsie.
I - 4. Evaluation du risque de récidive
La nouvelle définition de l’épilepsie impose de réfléchir aux moyens d’évaluer le risque de récidive de crise, le surestimer conduisant à prescrire inutilement des traitements comportant un risque iatrogène chez des patients qui n’auraient peut-être eu spontanément qu’une unique crise au cours de leur vie, le sous-estimer exposant le patient au risque de récidive et à ses complications.
Le risque de récurrence est le plus élevé durant les deux premières années après une première crise épileptique, où il est évalué entre 21 et 45% selon une revue de littérature récente de Krumholz et al. (25).
Risque de récidive après un première crise épileptique, Krumholz et al, 2015
Une revue de la littérature publiée en 2017 dans Seizure a permis de mettre en évidence les facteurs augmentant le risque de récidive (5) :
• Crises partielles, crises nocturnes • Antécédents familiaux d’épilepsie • Examen neurologique anormal • Anomalies épileptiformes à l’EEG
• Présence d’une lésion cérébrale antérieure • Anomalies à l’imagerie cérébrale
On peut également citer les antécédents de trouble des apprentissages et de retard de développement, et l’âge du patient plus élevé au moment de la crise, dont l’impact est plus controversé.
Le facteur de risque principal de récidive reste cependant les antécédents de crises non diagnostiquées jusqu’alors, à rechercher impérativement à l’interrogatoire (26). Après deux épisodes, le risque de récurrence s’élève en effet à environ 57% à un an, et augmente jusqu’à 73% à cinq ans (27).
I - 5. Recommandations de prise en charge d’une première crise épileptique
Afin d’optimiser et d’uniformiser la prise en charge des patients adultes ayant présenté une première crise d’épilepsie non provoquée, la Société Française de Neurologie (SFN) et la Haute Autorité de Santé (HAS) ont établi des recommandations de bonne pratique publiées en 2015 (9).Celles-ci établissent une organisation de la prise en charge en deux temps, et un cheminement clair et pratique de la réflexion du clinicien en quatre points principaux :
• Premier temps, en phase aiguë :
o S’assurer de la nature épileptique de l’épisode clinique o S’assurer de sa nature non provoquée
• Second temps, lors d’une prise en charge différée : o Tenter d’établir un diagnostic syndromique o Evaluer le risque de récidive de crise
I - 5.1 Prise en charge en phase aiguë
A la phase aiguë, correspondant dans la majorité des cas à la prise en charge au sein des services d’urgence, il s’agira donc d’affirmer la nature épileptique et non provoquée de l’épisode.
• Nature épileptique de l’épisode paroxystique
Comme nous l’avons précédemment évoqué, le diagnostic positif de l’événement clinique épileptique est difficile, notamment en l’absence de recommandation internationale sur le sujet. La SFN nous propose une liste d’antécédents, de circonstances de survenue, et de signes cliniques à recueillir en faveur de l’origine épileptique d’un malaise, ou en faveur de ses principaux diagnostics différentiels (syncope et crise non épileptique psychogène).
Cette liste est reprise dans le tableau récapitulatif ci-dessous, directement issu des recommandations de la SFN/HAS.
Particulièrement, on peut retenir comme étant hautement évocateurs, bien que non pathognomoniques, les signes suivants : la morsure latérale de langue constatée (28), la confusion post-critique prolongée (29), une posture inhabituelle avec hypertonie, une notion de déjà vu, déjà vécu avant le malaise.
Arguments cliniques et d’anamnèse en faveur de l’origine épileptique, cardiaque ou psychogène d’un malaise, Recommandation SFN/HAS de 2015
Dans le cas spécifique du sujet âgé, l’accent est mis sur la nécessité de prendre en compte le caractère polypathologique, la présence fréquente de nombreuses médications et la sémiologie moins spécifique des crises (avec une plus grande fréquence des crises focales, des confusions post critiques parfois prolongées et la moindre survenue d’automatisme (30)).
11
En faveur d une origine épileptique
En faveur d une origine non épileptique
Syncope CNEP
Antécédents • ATCD familiaux d épilepsie
• ATCD de crise fébrile
• ATCD neurologique : AVC, infection du SNC, intervention neurochirurgicale • ATCD de TC grave : contusion avec HSD, fracture, PC ou amnésie>24h, âge >65 ans • Présence d une pathologie neurologique dégénérative • Médicaments : antihypertenseurs, antiarythmique, diurétiques, médicaments allongeant le QT • ATCD familiaux de mort subite • ATCD familiaux d hypotension orthostatique • ATCD familiaux de cardiopathie dysrythmique • ATCD psychiatriques Circonstance
de survenue • Lien avec le sommeil : sommeil, réveil, contexte de dette de sommeil • Consommation de toxique • Sevrage alcoolique ou benzodiazépine
• Situations en lien avec des stimulations lumineuses répétitives
• Détente devant la télévision
• Jeux sur écrans
• Consommation récente de médicaments abaissant le seuil épileptogène (antalgiques, antidépresseurs, antibiotiques ) • Circonstances de stimulations vagales : • Pendant ou après miction défécation, vomissements, quinte de toux • Lors de douleurs violente • Lors de prise de sang • Lors du maintien prolongé de l orthostatisme • Lors d un changement brutal de position (passage à l orthostatisme) • Au cours d une situation de confinement
• Pendant une activité sportive
• Contexte de conflit, de stress
Signes
cliniques • Morsure de langue latérale constatée
• Confusion post épisode prolongée
• Posture inhabituelle avec hypertonie
• Déjà vu, déjà vécu
• Sueurs avant l examen
• Sensation vertigineuse • Hypotonie • Mouvement de dénégation • Mouvement de balancement du bassin • Pleurs • Bégaiements
• Yeux clos pendant toute la durée de la crise • Résistance à l ouverture des yeux • Activité motrice asynchrone et irrégulière s arrêtant puis reprenant • Conscience préservée au cours d une activité motrice bilatérale ATCD : antécédent AVC : Accident Vasculaire Cérébral CNEP : Crise Non Epileptique Psychogène HSD : hématome sous dural PC : perte de connaissance SNC : Système nerveux central
Sur le plan biologique, aucun dosage n’est recommandé pour aider au diagnostic positif de la crise épileptique, cependant en cas de doute clinique entre une crise généralisée et une syncope convulsivante, il est possible de réaliser un dosage des CPK (créatine phosphokinase) si ce dernier est effectué́ au moins 4 heures après l’épisode paroxystique, dont l’élévation sera un élément en faveur de l’origine épileptique du malaise.
• Recherche d’un caractère symptomatique aigu
Le caractère provoqué, ou symptomatique aigu, est défini par la survenue de la crise en relation temporelle étroite avec une atteinte du système nerveux central, due à une pathologie métabolique, toxique, structurale, infectieuse ou inflammatoire. Plus précisément, l’ordre de grandeur de la relation temporelle avec l’élément causal diffère selon sa nature : 24h pour certaines anomalies biologiques, sept jours suivant une agression cérébrale telle qu’un accident vasculaire cérébral, une anoxie cérébrale ou une infection du système nerveux central, tant que dure le saignement dans le cadre d’une malformation artério-veineuse avec crise symptomatique de son saignement, et tant que persiste les signes cliniques et/ou biologiques évolutifs dans les maladies infectieuses.
Le bilan biologique recommandé, en accord avec la conférence de consensus française de médecine d’urgence réactualisée en 2006 (23), doit comprendre au minimum la recherche de perturbations métaboliques par une glycémie capillaire, et un ionogramme sanguin avec urée et créatininémie, à l’arrivée aux urgences d’un patient pour première crise d’épilepsie. Le dosage de l’alcoolémie, excepté en cas de contexte médico-légal ou, en fonction du contexte, chez l’éthylique chronique, ne devrait pas être systématique.
Il est à noter que pour les anomalies du bilan biologique, les valeurs seuils à partir desquelles on peut considérer que la crise épileptique leur est imputable ne sont pas précisément définies. Sont rapportées si dessous les valeurs proposées par une sous-commission de l’ILAE, afin de guider le clinicien (31). Ces chiffres ont été définis arbitrairement et à titre indicatif, à partir de cas cliniques ou de petites séries de cas, excepté pour les chiffres de natrémie, corroborés par une étude suédoise rétrospective de 2011 (32).
Valeurs seuils à considérer pour leur imputabilité dans la survenue d’une crise d’épilepsie, Recommandation HAS/SFN pour la Prise en charge d’une première crise épileptique de l’adulte, 2015
Par ailleurs, il convient de rechercher la prise de traitements susceptibles de favoriser la survenue de crises épileptiques comme le Tramadol, le Bupropion, les antidépresseurs tricycliques, ou certains anti histaminiques tel que le diphenhydramine, et de rechercher une notion de sevrage en benzodiazépine, notamment chez le sujet âgé.
Il est également important d’être attentif à la consommation de drogues telles que le l’héroïne, la cocaïne, les amphétamines ; en revanche il n’y aurait pas d’effet précipitant de la consommation de cannabis sur la survenue des crises d’épilepsie.
Pour le cas particulier de l’alcool, une crise peut être considérée comme symptomatique d’un sevrage en alcool si elle survient chez des patients ayant une histoire d’abus chronique d’alcool, ayant une consommation régulière associée à une tentative récente de diminution de leur consommation, en cas d’association d’une crise généralisée tonico-clonique à des signes cliniques observés lors du sevrage alcoolique (tels que la tachycardie, les sueurs, les tremblements), et ce dans les 7 à 48 h suivant la dernière prise d’alcool. Une crise peut également survenir dans le cadre d’une intoxication alcoolique aiguë massive, y compris en l’absence d’antécédent d’abus.
Une imagerie cérébrale ne sera réalisée que lorsque la situation clinique l’exige : présence d’un déficit neurologique focal, d’un début focal à la crise, d’une confusion ou de céphalées persistantes, d’une fièvre, d’un traumatisme crânien, d’un antécédent néoplasique, d’un traitement anticoagulant, d’une immunosuppression, d’un âge > 40 ans, ou bien en cas de suivi ultérieur incertain. Le choix de ces critères, proposés par la SFN et la HAS, se base notamment sur un travail pluridisciplinaire réalisé en 1996 aux Etats-Unis (33).
Le type d’imagerie sera choisi en fonction des disponibilités locales et des étiologies sous-jacentes suspectée.
A la recherche de diagnostic différentiel, l’électrocardiogramme (ECG) doit quant à lui être systématique.
L’électroencéphalogramme est réalisé en fonction des possibilités locales, et peut être effectué lors du bilan différé.
I - 5.2 Prise en charge différée
Dans un second temps, lors d’un bilan différé, le clinicien doit s’évertuer à rechercher des arguments en faveur d’un syndrome épileptique particulier, et évaluer le plus précisément possible le risque de récidive, afin d’établir précocement le diagnostic d’épilepsie même après un unique épisode de crise, conformément à la nouvelle définition de l’ILAE.
Ce type de prise en charge ne pourra être proposé au patient qu’en l’absence de signes de gravité, d’anomalies aux examens paracliniques justifiant une hospitalisation immédiate, ou de doute sur l’adhésion du patient à la prise en charge ambulatoire ultérieure. Les recommandations de prise en charge proposent une liste de critères nécessaires pour autoriser la sortie du patient sans hospitalisation :
• Retour à l’état clinique basal sans symptômes neurologique • Normalité des investigations cliniques et paracliniques • Adhésion au suivi médical ultérieur préconisé
• Transmission d’un document écrit des recommandations de sortie (temps de sommeil suffisant, arrêt de travail si nécessaire, éviter les médicaments pro convulsivants, information sur les dangers de la conduite automobile, éviter la consommation d’alcool et les activités sportives à risque)
• Transmission au médecin traitant et au neurologue d’un compte-rendu médical du passage aux urgences
La prise en charge différée devra comprendre une consultation spécialisée auprès d’un neurologue, idéalement dans un délai court de 15 jours selon les recommandations du National Institute for Health and Care Excellence (NICE 2012) (34), délai repris par la SFN/HAS.
Sur le plan paraclinique, une Imagerie par Résonnance Magnétique (IRM) cérébrale est à réaliser dans un délai maximal de quatre semaines après l’épisode clinique initial. Elle sera systématique, sauf en cas de diagnostic d’épilepsie généralisée idiopathique certain, avec un protocole minimum détaillé en annexe 2.
Le deuxième examen majeur de la prise en charge différée est l’EEG. Son délai de réalisation devra être le plus court possible, de manière à augmenter sa sensibilité : au mieux dans les 24 à 48 heures suivant la crise, à défaut dans un délai de quatre semaines, en fonction des possibilités locales. En cas de normalité de l’examen, le neurologue doit discuter la réalisation d’un nouvel EEG standard ou d’un EEG prolongé, avec ou sans privation de sommeil. Les recommandations HAS/SFN conseillent de réaliser les EEG selon les critères proposés par le groupe de travail sur l’EEG standard de la Ligue Française Contre l’Epilepsie et de la Société́ de Neurophysiologie Clinique de Langue Française (35).
• Recherche d’argument pour porter un diagnostic syndromique ou étiologique
Un des principaux objectifs du bilan différé, comme nous l’avons déjà évoqué, est la précision du diagnostic avec recherche d’une étiologie à la crise épileptique, ou mise en évidence d’un syndrome épileptique particulier chez le patient, une fois le diagnostic de première crise affirmé. Ceci passe par la mise en évidence, soit d’une lésion cérébrale causale en imagerie (par exemple, crise épileptique secondaire à la présence d’une tumeur cérébrale ou séquellaire d’un accident vasculaire cérébral), soit d’un certain pattern électroencéphalographique orientant, en association avec la présentation clinique, vers un syndrome épileptique (par exemple, décharge de polypointes ondes généralisées dans le cadre d’une épilepsie généralisée idiopathique).
Le diagnostic étiologique ou syndromique n’est évidemment pas systématiquement possible, notamment dans les nombreux cas où le bilan paraclinique s’avère normal. Pour exemple, dans l’étude de King et al. publiée en 1998 et portant sur 300 patients ayant consulté pour crise épileptique inexpliquée, 56% des diagnostics de crise généralisée et 21% des diagnostics de crise partielle n’ont pu être précisés à la suite du bilan paraclinique et clinique (36).
• Evaluation du risque de récidive et du pronostic
L’autre objectif principal du bilan différé, primordial dans la prise en charge suite à une première crise épileptique non provoquée, est l’évaluation du risque de récidive. Il déterminera, en partie, la décision de mettre ou non en place un traitement antiépileptique, et pourra permettre (s’il est évalué comme important, grâce à la nouvelle définition de l’épilepsie de l’ILAE) un diagnostic précoce d’épilepsie.
Son évaluation est complexe, et passe par la recherche des différents facteurs de risques de récidive précédemment cités, par l’interrogatoire du patient sur le déroulé de la crise, ses antécédents, les circonstances de survenue, la mise en évidence d’épisodes critiques antérieurs ; par l’examen clinique neurologique ; mais surtout par l’EEG et l’IRM cérébrale. La mise en évidence d’un syndrome épileptique particulier est également un élément majeur du pronostic.
• Objectifs complémentaires
Le troisième objectif du bilan différé est de décider de la mise en place d’un traitement antiépileptique, en fonction de divers facteurs que nous allons détailler dans la partie suivante. Enfin, il est l’occasion de réaliser l’éducation thérapeutique du patient épileptique, indispensable pour obtenir une observance satisfaisante et minimiser le risque de crises par la bonne compréhension de leurs facteurs favorisants. Il convient d’expliquer au patient le diagnostic, le pronostic de la maladie, la conduite à tenir en cas de crise, les modalités de son traitement et ses effets indésirables, et d’aborder les conséquences de l’épilepsie sur l’orientation scolaire et professionnelle ainsi que sur l’aptitude à la conduite et la nécessité d’encadrer les grossesses.
I - 6. Traitement de la première crise épileptique
I - 6.1 Traitement en urgence
Dans le contexte de l’urgence, après une crise unique, aucun traitement n’est indiqué (hormis pour la correction éventuelle de facteurs favorisants, notamment biologiques). L’intérêt de la prescription de benzodiazépines par voie orale n’est pas démontrée chez l’adulte (3). Dans la pratique, ces molécules sont toutefois fréquemment utilisées sur une courte durée de prescription en cas de facteur augmentant le risque de récidive précoce, notamment lorsque l’accès à un avis spécialisé n’est pas immédiatement possible, comme le préconisent d’ailleurs
I - 6.2 Indications au traitement de fond
Concernant le traitement antiépileptique au long cours, il ne semble pas pertinent aux vues des données actuelles de la littérature de des traiter de façon systématique tous les patients ayant présenté une première crise épileptique.
Dans le cas des crises provoquées ou symptomatiques aiguës, l’unique traitement doit consister en la correction des facteurs ayant provoqués la crise, qui sort d’emblée du cadre des maladies épileptiques et n’est que le reflet d’une agression cérébrale transitoire.
Pour les crises non provoquées, le risque de récidive après un premier épisode non traité était estimé entre 40 et 50% dans les deux ans par Berg et al. en 2008 (37), mais le chiffre semble finalement être inférieur, de l’ordre de 21 à 45% selon la revue de littérature de Krumholz de 2015. Dans l’étude MESS (Multicentre Study of Early Epilepsy and Single Seizure, 2005), qui compare l’évolution de patients recrutés après une première crise, on retrouve un risque de récidive à deux ans de 32% dans le groupe de patients ayant été traités au long cours par antiépileptique, et de 39% dans le groupe non traité (38). Cependant, cette différence s’estompe lorsque l’on analyse les données de suivi à plus long terme, et les études de qualité de vie ne retrouvent pas de différence entre les patients traités et non traités, excepté en ce qui concerne la conduite automobile (39). En revanche, il existe bien un sous-groupe de patient dont le risque de récidive précoce est plus élevé, et pour lequel un traitement semble indiqué : il s’agit de ceux ayant finalement présenté plusieurs crises, et/ou ayant des anomalies à l’examen neurologique ou électrophysiologique (40).
La décision doit quoiqu’il en soit relever d’une discussion entre le médecin spécialiste neurologue et le patient, et être idéalement prise lors de la phase différée de prise en charge, en fonction des données des différents examens complémentaires et après information complète du patient sur la situation. L’engagement dans la prise d’un traitement antiépileptique, au long cours, nécessite en effet une bonne compréhension par le patient (voire sa famille ou ses aidants le cas échéant) du rapport bénéfice/risque du traitement afin d’obtenir une adhésion thérapeutique et une bonne observance, qui sont les points clés du bon déroulé de la suite de la prise en charge.
La décision de mettre en place un traitement antiépileptique après une première crise épileptique non provoquée est recommandée par la SFN/HAS dans les situations suivantes (9) : • Le diagnostic d’épilepsie-maladie est affirmé, par la mise en évidence d’une
prédisposition durable à la récidive des crises
• Il existe un déficit neurologique et/ou neuropsychologique
• On retrouve la présence d’anomalies EEG de nature épileptique ou d’une anomalie structurale épileptogène à l’imagerie cérébrale compatibles avec le type de crise En l’absence de ces critères, un traitement peut tout de même être prescrit, si le patient juge inacceptable le risque de récidive (en fonction du type de crise et du mode de vie du patient), ou si le spécialiste estime que le statut médico socio professionnel du patient le justifie. La décision de prescription devra donc également prendre en compte la situation particulière du patient et son mode de vie.
I - 6.3 Choix du traitement de fond
Le choix de la molécule utilisée pour le traitement antiépileptique de fond fait également l’objet de recommandations de la part de la SFN et de la HAS dans leur publication (9), sur la base des préconisations des diverses sociétés savantes américaines, anglo-saxonnes et internationales (34,41–44) et des études portant sur le sujet, notamment les études SANAD (Standard And New Antiepileptic Drugs, essais contrôlés randomisés comparant les différents traitements antiépileptiques) (45,46).
Celui-ci dépendra en premier lieu du syndrome épileptique, ou bien s’il n’est pas précisément déterminé du type principal de crise présenté, et en deuxième lieu des caractéristiques du patient (comprenant son sexe, son âge, ses comorbidités et antécédents, son mode de vie, ses préférences). Un des points importants est le rapport efficacité/tolérance du traitement, dans le cadre d’une prescription au long cours nécessitant une observance thérapeutique rigoureuse.
Sont recommandées en première intention les molécules suivantes : à Pour les épilepsies focales
o Carbamazépine, lamotrigine, lévétiracetam, oxcarbazépine à Pour les épilepsies généralisées
• Suspicion d’épilepsie généralisée idiopathique avec crises tonico-cloniques généralisées seules
o Lamotrigine, valproate de sodium (Lamotrigine à privilégier chez la femme en âge de procréer)
• Suspicion d’épilepsie myoclonique juvénile
o Lamotrigine, valproate de sodium (Lamotrigine à privilégier chez la femme en âge de procréer, mais molécule pouvant majorer les myoclonies)
• Suspicion d’épilepsie-absence
o Lamotrigine, valproate de sodium (Lamotrigine à privilégier chez la femme en âge de procréer)
o L’éthosuximide, médicament de référence dans les absences de l’enfant n’est pas à privilégier dans le cadre des épilepsies de l’adulte jeune car des crises généralisées associées sont possibles dans ce syndrome et peuvent être majorées par l’éthosuximide.
On retiendra comme situations particulières : • La femme en âge de procréer :
Nécessité d’informer la patiente (sur les risques tératogènes, les répercussions neuropsychologiques de l’épilepsie, des crises et des antiépileptiques) ; de préconiser la planification des grossesses pour pouvoir anticiper les modifications thérapeutiques éventuelles ; d’éviter la prescription de valproate de sodium ; de réaliser un dosage médicamenteux de référence avant la grossesse en cas de traitement par lamotrigine ; de débuter une supplémentation en acide folique d’au moins 0,4mg/j (en général 5mg/j) deux mois avant la conception et jusqu’à la fin du premier trimestre.
• La contraception :
La contraception progestative pure et les implants progestatifs ne sont pas recommandés en cas de prise d’antiépileptiques inducteurs enzymatiques (de ce fait augmentant l’élimination des contraceptifs) tels que le phénobarbital, la phénytoïne, la carbamazépine, et dans une moindre mesure le topiramate et l’oxcarpazépine. Les contraceptions œstroprogestatives quant à elles tendent à augmenter la clairance de la lamotrigine et donc en réduire l’efficacité.
• Le sujet âgé :
En cas de crises partielles, il est recommandé en première intention d’utiliser la lamotrigine (en raison du caractère inducteur enzymatique de la carbamazépine et de l’absence de données spécifiques dans cette population pour cette molécule).
En cas de crises généralisées, il est recommandé en première intention d’utiliser la lamotrigine (du fait de la tolérance un peu moins favorable du valproate).
Depuis ces dernières recommandations, d’autres molécules antiépileptiques ont obtenu une autorisation de mise sur le marché en monothérapie, par exemple le lacosamide, le perampanel, ou l’eslicarbazépine, élargissant les possibilités thérapeutiques pour s’adapter au mieux au syndrome épileptique et au profil de tolérance.
I - 7. Modèle des « first seizure clinic »
Afin de répondre aux différents objectifs de prise en charge suite à la survenue d’une première crise épileptique se développent des filières spécifiques. Appelées « first seizure clinics » ou « single seizure clinics » dans les pays anglo-saxons, elles sont également présentes en France et sont un des moyens d’améliorer l’offre de soin des patients épileptiques(47–50).
Par exemple, ont été présentées au congrès de l’European Academy of Neurology en 2016 les données de la clinique « Première crise » de l’hôpital de Tours, confortant l’intérêt d’une filière dédiée aux patients ayant présenté une première crise (47), en permettant un accès facilité à une consultation spécialisée et aux examens complémentaires (EEG, IRM) en un lieu unique.
Plus particulièrement, dans une étude de Syed et al. datant de 2015 (50), le temps d’attente pour rencontrer un épileptologue était réduit de 70,5% par la prise en charge en « Single Seizure Clinic », et le délai pour réaliser un EEG était quant à lui réduit de 89%, montrant l’utilité de ce modèle ; la réduction du temps d’accès aux examens étant essentielle du fait de la prédominance des récidives dans les premières semaines après un premier événement épileptique (5,48).
Par ailleurs, il est établi que la réalisation d’un examen clinique et d’un interrogatoire précis, aidés de l’EEG et de l’IRM, permet d’identifier un syndrome épileptique chez de nombreux patients (36), mais surtout de clarifier des diagnostics douteux ou inadéquats.
Dans une étude de Smith et al. (49) a aussi été montré le bénéfice d’une clinique de ce type dédiée aux adolescents, qui étaient évalués par des neurologues pédiatres et s’occupant d’adultes : outre l’impact sur le diagnostic, la prescription d’un traitement antiépileptique ou son absence avait pu être corrigée chez 42 patients sur 207 et l’éducation thérapeutique être réalisée. Le choix du traitement est un enjeu important dans la prise en charge, il dépend comme nous l’avons vu de facteurs multiples. Parfois les patients sont longuement laissés sous traitement par benzodiazépines par excès, dans l’attente d’un rendez-vous avec un neurologue. On peut également penser que ce type de prise en charge permettrait de diminuer les coûts liés aux hospitalisations et aux passages en services d’urgence de ces patients, d’une part par le raccourcissement des durées de séjour et d’autre part par un diagnostic et un traitement précoces réduisant le nombre de récurrence d’évènements cliniques potentiellement traumatiques ou source de complications (51).
II – Objectifs de l’étude
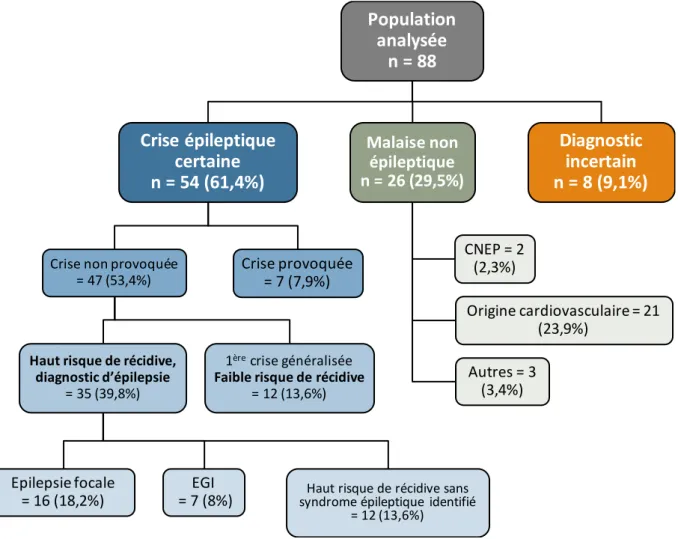
L’objectif principal de notre étude était d’évaluer la nouvelle activité d’hôpital de jour du Centre Hospitalier Universitaire (CHU) de Rouen dédiée à la prise en charge des patients ayant présenté une première crise d’épilepsie, généralisée ou partielle. Nous nous sommes particulièrement intéressés à sa performance diagnostique, et à l’impact des examens complémentaires réalisés.
Les objectifs secondaires étaient de connaître les diagnostics établis lors du suivi des patients, et d’évaluer la place de l’EEG après privation de sommeil dans leur prise en charge.
III – Matériels et méthodes
III - 1. Population
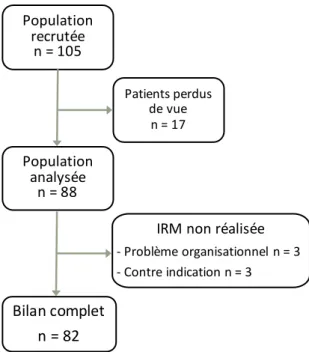
Nous avons réalisé une étude prospective portant sur l’ensemble des patients admis en hôpital de jour (HDJ) de neurologie pour un bilan de première crise épileptique, sur une durée de deux ans à partir de la mise en place de cette nouvelle activité au CHU de Rouen, soit de février 2016 à février 2018.
Les patients étaient recrutés pour l’HDJ lors de leur consultation au Service d’Accueil et de traitement des Urgences adultes (SAU), sur avis spécialisé réalisé par un interne de neurologie et/ou un senior de neurologie, sollicités par les médecins urgentistes.
Les critères d’inclusion pour l’HDJ « première crise » étaient les suivants :
- Patients ayant présenté un premier épisode de malaise, d’origine épileptique certaine ou fortement suspectée, qu’il s’agisse d’une première crise épileptique généralisée ou partielle
- Patients issus de la consultation aux urgences « adultes », sans limite d’âge supérieur - Réponse aux critères de non-hospitalisation des recommandations de la HAS/SFN,
permettant une prise en charge ambulatoire différée
Les coordonnées du patient étaient collectées afin de programmer le patient via une fiche dédiée, dans un délai maximal d’un mois après l’événement clinique. Les patients étaient convoqués par courrier et également prévenus de la date de leur hôpital de jour par appel téléphonique.
III – 2. Organisation de l’hôpital de jour
L’activité d’HDJ « première crise » a été incluse au sein du service d’hospitalisation de jour de neurologie du CHU de Rouen, avec un créneau réservé pour un unique patient par semaine, sur une journée fixée au mercredi.