Thèse de Doctorat
Spécialité Médecine
présentée àl'Ecole Doctorale en Sciences Technologie et Santé (ED 547)
de l’Université de Picardie Jules Verne
par
Mathieu Carpentier
pour obtenir le grade de Docteur de l’Université de Picardie Jules Verne
Mortalité des prématurés de moins de mille grammes.
Evaluation du pronostic par programmation génétique.
Soutenue le 19 Octobre 2018 après avis des rapporteurs, devant le jury d’examen :
M. P. Berquin……….., Professeur Président du Jury
M. P. Tourneux..……., Professeur Directeur de Thèse
M. J. Maizel ...………., Professeur Examinateur
Note de l’auteur
J’ai eu la chance et l’opportunité de travailler sur un sujet qui me tenait à coeur : l’intelligence artificielle. Ce travail, bien que présentant des limites, est l’aboutissement de la réunion des deux sciences qui m’ont toujours passionné : la médecine et l’informatique. Elles offrent l’une comme l’autre, la possibilité de s’interroger sur la définition du vivant, question qui m’a toujours obsédé, que cela soit dans le cinéma, la littérature, la philosophie ou la science. Même si ce travail de thèse n’est pas une dissertation sur cette problématique, j’espère que vous percevrez en toile de fond cette interrogation et que vous prendrez autant de plaisir à lire et à critiquer ce travail que j’en ai eu à le développer, le tester et l’analyser.
Monsieur le Professeur Patrick BERQUIN Professeur des Universités-Praticien Hospitalier (Pédiatrie)
Responsable du centre d'activité "neurologie pédiatrique" Chef du Pôle "Femme - Couple - enfant"
Je vous remercie sincèrement pour m’avoir aidé dans toutes les démarches et m’avoir laissé réaliser une maquette d’internat faite sur mesure. Je ne pouvais espérer mieux. Je suis profondément convaincu que les internes de pédiatrie Amiénois ont des opportunités qui n’existent pas dans tous les CHU de France et nous vous en sommes redevables.
Je vous remercie aussi pour avoir accepté d’être le président de mon jury de thèse. Vous connaissez ma formation atypique et je sais que vous êtes conscient de la valeur émotionnelle que peut avoir pour moi l’obtention de mon doctorat de médecine.
Monsieur le Professeur Pierre TOURNEUX Professeur des Universités-Praticien Hospitalier (Pédiatrie)
Pôle "Femme - Couple - Enfant"
Merci pour la confiance maintes et maintes fois renouvelée, la dernière preuve étant cette thèse de médecine originale et transdisciplinaire. Peu d’enseignants y auraient cru. Merci pour les nombreuses relectures et corrections de mes différents travaux. Quand on connaît mon schéma de pensée, on comprend l’ampleur de la tâche.
Un grand merci pour nos conversations, laissant de côté mon statut d’interne, portant sur la recherche. La médecine est un Art et une Science et nos échanges me permettent de retrouver cet aspect rationnel, base de mon éducation antérieure au monde de l’hopital.
Enfin, merci d’avoir été mon directeur de thèse et d’être présent le jour de la consécration de ce long mais enrichissant parcours.
Monsieur le Professeur Julien MAIZEL
Professeur des Universités-Praticien Hospitalier (Réanimation, médecine d’urgence)
De sincères remerciements pour votre accueil dans le service de Réanimation Médicale où j’aurais tant appris, en plus d’y avoir fait la rencontre d’une équipe que j’apprécie particulièrement. Vous avez ma profonde gratitude pour avoir permis mon inscription au D.E.S.C.Q , qui était une réelle priorité pour moi, malgré le fait que les pédiatres soient une espèce rare au sein de cette filière de formation, pourtant si enrichissante.
Je vous remercie également pour faire partie de mon jury de thèse, c’est un réel honneur.
Enfin, je me permets de vous témoigner ici mon profond respect pour votre savoir et votre gentillesse. Je resterai toujours intimidé à l’entrée de votre bureau, même si à chaque fois, vous m’y avez accueilli chaleureusement lors de nos entretiens.
Monsieur le Professeur Fabrice SERGENT Professeur des Universités – Praticien Hospitalier (Gynécologie obstétrique)
De sincères remerciements pour avoir accepté mon invitation à participer à mon jury de thèse. J’espère que vous aurez pu percevoir l’enthousiasme que j’ai eu à développer ce projet. Je profite aussi de cet espace pour vous témoigner ma profonde admiration, pour vous et l’ensemble de votre spécialité que je considère comme l’une des plus difficiles du monde médical. Vous confiez aux pédiatres le fruit de plusieurs mois de soins auprès des mères, et j’espère l’honorer en prodiguant à nos patients les meilleurs soins possibles dans ma future carrière.
Famille
A Sarou la chipie, Mapime le poulet sumo et Björn le panda viking, parce que vous êtes l’innocence et l’avenir.
A ma Maman, Véronique Carpentier pour son amour, son soutien et sa « connexion ». Pour avoir été la moins prof des profs, pour n’avoir souhaité que mon bonheur sans jamais rien exiger en retour, pour sa gentillesse et sa mauvaise foi. Pour avoir regardé « Renard sacripand », écouté Yann Tiersen, pour m’avoir emmené à l’opéra, pour la superbe Takamine en bois de Koa (hors-classe) et surtout, surtout, pour tout comprendre.
A mon Papa, Philippe Carpentier, pour son sens marin hors pair qui m’a évité des mésaventures en eau froide, pour les après-midi passé au bout de Ré, pour les conversations chez Cardi dans la mousse et la résine, pour les kilomètres pour des concerts et des vagues, pour Machiavel et Yourcenar et pour avoir aussi compris qu’adolescent, j’avais plus besoin de l’océan que de bonnes notes. Et enfin, pour être les épaules de cette famille complexe et attachante avec un désintéressement total.
A ma sœur Pauline : on aura toujours été très différent toi et moi mais sache que j’admire ton courage, ta force de caractère et ton entrain. Tu as été pour moi ces derniers temps « la digue dans la tempête » ! Tu m’as récupéré à la petite cuillère et tu m’as permis d’aller dire un dernier au revoir à notre grand-père. Je t’aime, grande petite sœur.
A mes frères, Martin et Quentin : je ne vous ai pas dissocié car vous êtes mes frères mais vous êtes aussi l’un pour l’autre les meilleurs amis du monde. Merci pour les supers moments passés sur les pistes sur la planche à neige, la planche à roulettes, la planche pour les vagues, les concerts, les voyages et les innombrables souvenirs ! Je sais que je peux compter sur vous ! Pain Blainc !!
A mes oncles, tantes, cousins, cousines, grand-parents, pour tous les bons moments et la gentillesse dont vous avez toujours su faire preuve.
A Fanny, pour le magnifique bout de chemin parcouru ensemble, parsemé de chaos et de rêves. Je te le souhaite moins escarpé pour la suite.
Amis
A Fifoux, pour avoir été le grand-frère que je n’ai pas eu. Sans toi, je serai probablement devenu moine cistercien. Au lieu de ça, j’ai 35 ans, je suis toujours étudiant et je vis en coloc’ ! Et à tout le Féérune Crew, MatBour, Choderch, Krlton, HH et Jalil. Mon père disait « on a les amis qu’on mérite ». Je ne pouvais mériter mieux.
A Galou et Antho, pour le temps passé dans les vagues, pour s’être réchauffé dans un PMU d’Oléron avant de se mettre à l’eau un dimanche matin de janvier. Pour le surf, notre drogue, notre salut, notre machine à rêves ! Saloman forever !
A Alain, pour le cyberpunk, les meilleurs jeux vidéo du monde (Deus Ex), pour ton humour pinçant qui me fait rire de moi.
A Clem, Cam, Jerem et Fred, pour le debriefing de South Park le jeudi matin en cours de finance de marché. Pour avoir été les élèves ingénieurs les plus atypiques qui soient !
A Manue, restauratrice de tableau londonienne. On se donne rarement des nouvelles, mais tu m’impressionnes et je suis tellement fier de connaître quelqu’un comme toi !
Coté médical
A Sandra, Mat Païzon, Benoît,Margaux, Anaïs, Rémi, Victor, Flo, JP, Guillaume. Pour les fous rires sur les bancs de la fac, les soirées guitares ou miroir d’eau. Et une encore plus grosse pensée à Marie, wonder-woman grâcieuse, belle et intelligente ! Ton franc-parler me manque !!!!
A Leslie, co-interne de galère, future coloc’ et collègue. Ca sent l’anarchie ! Merci pour ton soutien inconditionnel ! Et à Mathieu, fiancé (de Leslie) et futur coloc’ ! Maison de l’hématologie et de la réanimation, ça fait froid dans le dos !
A mes co-internes de la promotion 2014 : Perrine, Céline, Lisa et Sophie. Avoir un seul garçon dans la promo, avoir pris le pire !!!! Et un petit up à Maëlle et Ludo pour avoir répondu !
A Alex, pour avoir été mon premier co-interne et avoir bravé nos premières gardes aux urgences ensemble.
A la grosse team de la réa chir, Chloé, Anne-So, Pierre-Yves et Flo, pour mes premiers drains, KT centraux, intubations. Anne-So pour être un sacré bout de femme. Je t’admire, tu as de sacrés valeurs. Chloé, pour ton empathie, ta patience, ta douceur. Pierre-Yves, pour être belge, moqueur et le clône vocal de Scatman. Flo, pour être l’incarnation du diable sur Terre : « Juste un verre ! ». Et à toutes les personnes que vous m’avez permis de rencontrer, que ce soit coté anesthésie ou chirurgical.
A la grosse team de la réa med, Juju, Pauline, Ivona, Rayan, Clément.Il y avait de sacré caractères doublés de sacrés intellects ! Ce n’était pas gagné et pourtant je suis reparti avec de vrais amis. Merci pour tout !!!!
A mon équipe d’Escape Game, drôle, sexy et cardiologue, Bérangère, Dorothée Marion, Maëlle et Arnaud. Oui, même toi Arnaud !
Aux Charlie’s angels de la réa ped de Lille : Steph la coloc, Val, Chloé, Marina, Adèle, Marine, Mariane et Marion. Je n’y serai jamais arrivé sans vous. Chacune d’entre vous mériteriez un pavé de remerciements. Et je sais que ça va faire vieux jeu, mais vous êtes toutes de belles, intelligentes et touchantes jeunes femmes. Je vous suis extrêmement reconnaissant et redevable.
A des médecins à qui je dois énormément, sans ordre de quelque forme : Norik Airapetian, Stéphanie Malaquin, Louise Badoux, Léonie Villeret, Nacim Ammenouche, Yoann « Simple, Basique » Zerbib, Clément « excellent » Brault, Brice « tu regardes le menu » Leonetti, Nathalie Verrier, Thierry Soupison, Bertrand De Cagny, Anne Sagnier, Stéphanie Lavole, Houcine Chaib Deraa, Fanny Eudier, Amel Mathiron, Anne Sweertvaegher, Marie Lévêque, François Moreau, Laurent Ghyselen, Ghida Ghostine, Karine Braun, Céline Raffour, Marie Trujillo, Claire Coquempot, Morgan Recher, Yasmin Karaca, Jérémie Rousseaux, Alexandra Binoche, Ahmed « Morgan Freeman » Sadik, Marie « Reine de la neuro-réa ped » Lampin, Claire Ragot, Nam Bui, François Maigret et Frédéric Guyon. Aux professeurs (et je suis désolé si ça ne fait pas officiel) M. Stéphane Leteurtre, M. Yazine Mahjoub, M. Didier Gruson, M. Frédéric Vargas et M. Igor Sibon. Si vous faites partie de cette liste, c’est que vous avez eu une influence immense sur le médecin que je suis devenu.
Au docteur Salah Zerkly, pour ces conversations enrichissantes, réelles ou par mail, sur les différentes techniques statistiques employées pour ce travail. Merci aussi pour tout le back-office, avec déclarations à la CNIL ou statistiques,qui viennent enrichir ce travail.
Aux équipes paramédicales à Abbeville, Saint-Quentin, Amiens et Lille, en pédiatrie générale, néonatologie ou réanimation. Quand on débute, on se tait, on écoute et on apprend.
A mes patients, de 0 à 97 ans, et à leur famille. Même si je ne le montre pas beaucoup, nombre d’entre vous ont su me toucher.
Invité d’honneur
A Pierrick Legrand, docteur en mathématiques, mentor, et je l’espère, ami.
Je te dois énormément et notament le fait d’être devenu médecin. Tu es le meilleur prof de fac qu’on puisse rêver d’avoir. Je serai fier d’être le dixième de l’enseignant et de l’homme que tu es. Nos vendredi matins au LaBRI comptent parmi mes plus précieux souvenirs. Je te remercie pour tout ce que tu as fait pour moi et j’espère que tu sauras voir une forme d’hommage par le travail qui suit.
A André Noiret, mon grand-père,
Prof de rien du tout, diplômé de ses livres, mais meilleur enseignant de la vie qui ait été,
Pêcheur, peintre en batiment, commerçant, artiste peintre, électronicien autodidacte, amoureux de musique classique et rêveur de bout de table
Qui a préféré prendre la tangente avec les anges le 21 septembre 2018, voyant la date de ma thèse se profiler. Je sais que là où tu es, tu te trouves perché sur un toit, à régler une parabole pour avoir le canal 224 de la télévision Ouzbekh , tout en faisant semblant de perdre une partie d’échec contre un androgyne ailé, avant de retourner à ta peinture ou ta lecture. Tu as préféré voguer vers d’autres mers, le monde te semblant dériver à la méchanceté et à la bêtise. Pourtant, l’homme moderne aurait beaucoup à apprendre de ta gentillesse et de ton intelligence empreinte de rêverie. Tous tes petits enfants ont en eux une once de ta curiosité, de ta sensibilité, de ton courage, de ta fantaisie. Nous sommes tous extrêmement fiers de t’avoir eu pour grand-père !
A chaque fois que je pense à toi, j’entends ton rire, ressemblant à une succession de bends joués par un guitariste de Blues. C’est pour ça qu’en prêtant serment, je sourirai car j’aurais de la musique dans la tête.
Si Dieu est polonais, ne lui fais pas trop de farces. Tu nous manques.
PS : Il n’y a jamais eu de complot Navarro – Jospin, Grand-Papa. Même si j’aimerais que cela soit vrai.
MORTALITÉ DES PRÉMATURÉS DE
MOINS DE MILLE GRAMMES.
EVALUATION DU PRONOSTIC PAR
Table des matières
NOTE DE L’AUTEUR ... 3 REMERCIEMENTS ... 4 FAMILLE...9 AMIS...10 COTÉMÉDICAL...10 INVITÉD’HONNEUR...11 INTRODUCTION ... 17MORTALITÉCHEZLESPRÉMATURÉS...18
CONNAISSANCESACTUELLES...18
PRÉMATURÉSEXTRÊMES …...18
… CONTREPRÉMATURÉSDEMOINSDE 1000 GRAMMES...19
DEL’INTELLIGENCEARTIFICIELLE...19 HISTORIQUE...19 ETATDEL’ART...22 APPLICATIONSENNÉONATOLOGIE...22 LAPROGRAMMATIONGÉNÉTIQUE...23 OBJECTIFDEL’ÉTUDE...27 MATÉRIELS ET MÉTHODES ... 29 POPULATION...29
CRITÈREDEJUGEMENTPRINCIPAL...29
CRITÈREDEJUGEMENTSECONDAIRE...29
PÉRIODESD’ÉTUDE...29 DÉVELOPPEMENTDEL’I.A...30 PROTOCOLEDETRAVAIL...31 ETHIQUE...33 COLLECTEDEDONNÉES...33 MÉTHODESSTATISTIQUES...33 RÉSULTATS ... 35
ANALYSESURL’ENSEMBLEDESPATIENTS …...35
… ETDELEURMORTALITÉ...35
COMPARAISONDES 2 GROUPES...37
ANALYSESTATISTIQUE – RÉGRESSIONLOGISTIQUE...38
RÉSULTATSDEL’INTELLIGENCEARTIFICIELLE...39
RÉSULTATSDESCLINICIENS...41
DISCUSSION ... 43 STATISTIQUESDESCRIPTIVES...43 LESTROISMÉTHODES...46 RÉGRESSIONLOGISTIQUE...46 INTELLIGENCEARTIFICIELLE...46 ETCLINIQUEMENT...47 LIMITESDEL’ÉTUDE...48 ECHANTILLONNAGE...48 DÉVELOPPEMENT...48 APPORTSDEL’ÉTUDE...49
OBJECTIFPRIMAIRE...49 OBJECTIFSECONDAIRE...49 PRATIQUESDESERVICE...49 UNENOUVELLEÉMULATION...50 DENOUVELLESDIRECTIONS...50 INFORMATIQUE...50 ETHIQUE...50 MÉDECINE...51 CONCLUSION ... 53 BIBLIOGRAPHIE ... 55
TABLE DES FIGURES ... 59
INTRODUCTION
La médecine occidentale est à la fois un art et une science. Comme telle, elle repose sur la recherche de preuves obtenues par l’observation et l’expérimentation [1]. Si l’expérimentation occupait une place prépondérante au cours des XIXème et XXème siècles, elle devient plus difficile à réaliser pour des raisons économiques et des raisons éthiques que l’on ne saurait ignorer. L’observation nécessite un recueil de données qui, s’il est facilité par l’informatisation, requiert un temps considérable [2].
La pédiatrie et la néonatalogie ne font pas exception. Pour des raisons facilement compréhensibles, l’expérimentation, en dehors des protocoles de recherche dans des cas exceptionnels où le pronostic vital est engagé, (oncologie, cardiologie, réanimation) reste difficile [3][4]. Néanmoins, il est nécessaire de pouvoir faire bénéficier nos jeunes patients des retombées de la recherche avec le même niveau d’exigence que pour la médecine adulte, en particulier grâce à l’épidémiologie et les analyses statistiques qui en découlent [5].
L’une des sphères ayant bénéficiée de la recherche clinique à la fin des années 90-début des années 2000 est la réalisation de scores prédictifs de mortalité. Nous pouvons citer APACHE-II [6] et SAPS-II [7] en médecine d’urgence de l’adulte, PRISM [8] chez l’enfant, CRIB-II [9] chez le nouveau-né. Les variables sont le plus souvent extraites par régression logistique sur des cohortes importantes de patients, nécessitant un travail de recueil de données conséquent : 5815 patients pour l’APACHE-II, 3027patients pour le CRIB-II.
Parallèlement, une autre discipline a fait de grandes avancées : l’informatique. S’il y a encore quelques années l’intelligence artificielle était principalement réservée à quelques laboratoires de recherche et mise en avant dans les films de science-fiction, elle fait aujourd’hui l’objet de publications scientifiques régulières et suscite l’intérêt du grand public. Combinée avec la création de bases de données et d’algorithmes de Data-Mining (fouille automatisée de données), elle permet le traitement automatisé d’informations en très large quantité.
Ce travail vise à faire l’interface entre ces deux sciences par un travail de pronostic de la mortalité chez les prématurés de moins de 1000g par une intelligence artificielle. Avant de chercher à obtenir un algorithme pouvant se comparer à ceux de grands laboratoires ou de grandes sociétés, nous souhaitions avant tout faire un état de l’art et comprendre le fonctionnement profond d’une technique pour y apporter un regard critique.
Mortalité chez les prématurés
Connaissances actuelles
La prématurité se définit par la naissance avant un terme de 37 semaines d’aménorrhées (SA). Elle est catégorisée en faible prématurité, prématurité modérée (32 à 34 SA, 99% de taux de survie), grande prématurité (27 à 31 SA, 94% de survie) et extrême prématurité (22 à 26 SA, 60% à 25 semaines, moins de 1% à moins de 24 SA)[10]. Elle représente 4.4 ‰ des naissances en 2011 en France. Elle peut entraîner des complications dues au développement incomplet des organes. Plus le nouveau-né est prématuré, plus il est exposé à l’incidence et à la gravité de ces complications qui peuvent aller jusqu’au décès.
La prise en charge des prématurés a évalué favorablement ces dernières années. La morbi-mortalité a régressé avec l’apparition de nouveaux traitements et de nouvelles techniques. Une étude argentine de 2017 [11] étudiant la mortalité en période néonatale (nouveau-nés à terme inclus) montrait une diminution de la mortalité due aux évènements aigus en période natale, alors que celle liée aux malformations congénitales et aux anomalies congénitales augmentait. L’étude rétrospective de 2005 à 2014, basée sur les registres de santé nationaux, objectivait une diminution de 19.2%. C’est dans la période des 28 premiers jours de vie que la mortalité des prématurés a le moins régressé (-13%). En France, selon l’étude Epipage 2 [10], une amélioration nette est observée sur quinze ans avec une augmentation de la survie sans morbidité sévère de 14% pour les prématurés entre 25 et 29 SA et de 6% pour les prématurés entre 30 et 31 SA. Malheureusement, entre 1997 et 2011, dans la cohorte Epipage 2, c’est chez les prématurés extrêmes que la situation évolue le moins.
Prématurés extrêmes …
C’est chez les extrêmes prématurés que les complications sont les plus sévères et que la mortalité est la plus élevée. Mais c’est aussi pour cette population que les progrès en termes de prise en charge peuvent s’avérer les plus importants. Dans l’étude EPICure, conduite en Grande-Bretagne de 2008 à 2014 [12], l’amélioration la plus importante (APC 6.03% (95% CI 2.47 to 3.53) était observée pour les nouveau-nés entre 22 et 23+6 SA. Les facteurs de risque identifiés étaient le poids de naissance, l’âge gestationnel, le sexe, l’administration anténatale de corticoïdes et la gémellité. Cette mortalité est variable selon les régions du monde [13], ce qui explique que la limite du terme pour la prise en charge diffère, par exemple entre le Japon et l’Espagne [14].
L’extrême prématurité a bénéficié de progrès en matière de prise en charge grâce à l’identification de facteurs de risque précis, tels que la température [15], la saturation en
oxygène [16], les facteurs de risque maternels [17] ou encore le petit poids pour l’âge gestationnel [18].
Malgré ces progrès, la décision de réanimer ou non un nouveau-né prématuré extrême peut rester difficile[18]. Elle peut même être source de tensions entre l’équipe médicale, paramédicale et les parents [19]. Dans ce contexte, des outils d’aide à la décision seraient souhaitables.
… Contre prématurés de moins de 1000 grammes
La mortalité néonatale a toujours été associée à l’âge gestationnel. Intuitivement, plus le nouveau-né est prématuré, moins les fonctions physiologiques sont développées. Si cette hypothèse est vérifiée et validée, celle de l’association entre le poids de naissance et la mortalité est plus récente. Dans une étude conduite de 2002 à 2015 sur plus de 1000 000 nouveau-nés [20], il est démontré que la mortalité est significativement associée à l’association prématurité – petit poids pour l’âge gestationnel1. Les dernières études portant sur la mortalité en néonatologie associent dorénavant ces deux variables [21]. Ce couple de variables utilisées en néonatologie peut être comparé à l’idée d’« âge physiologique » qui prend une part importante dans la décision de réanimation du sujet âgé.
De l’intelligence artificielle
Comme constaté ci-dessus, la réanimation néonatale, bien que bénéficiant de nets progrès ces dernières années, reste une discipline où la prise de décision est dépendante de nombreux paramètres et où l’éthique et le pronostic ont un lourd poids. C’est pour cela que le clinicien a toujours cherché à s’appuyer sur une aide objective. Elle consistait en l’utilisation de score pronostique et pourrait bénéficier de l’apport de l’intelligence artificielle, capable d’analyser de multiples facteurs de risques sur de grandes populations de patients pour encore améliorer cette aide à la prise de décision.
Historique
Si l’expression « intelligence artificielle » (I.A) est associée à un concept futuriste2, elle est déjà présente dans la mythologie grecque avec le mythe de Pygmalion et Galathée et conceptualisée depuis l’âge d’or du monde Arabe au IXème siècle avec les fondements de l’algorithmique par Al-Khwarizmi et le désir de résoudre des problèmes de façon automatisée. Au XVIIème siècle en Europe, les mathématiciens et philosophes Descartes et Leibniz 1 PAG pour la suite du document
2 On pense à HAL9000 dans « 2001, l’odyssée de l’espace » de Stanley Kubrick ou au mouton électrique cher à Philip K. Dick
argumentent le fait que toute pensée rationnelle pourrait être assimilée à un raisonnement mathématique. Le XXème siècle fournit des avancées concrètes avec la création de l’algèbre de Boole, le lambda-calcul (aboutissant des décennies après à la création de langages de programmation tels le LISP, connu et utilisé dans le monde de l’intelligence artificielle) ou encore de « la machine » et du « jeu de l’imitation » par Turing3. Tous ces concepts trouveront une application à la création de l’ordinateur moderne dans les années 1950 et à son évolution. Néanmoins, la limitation en puissance de calcul entraînera la nécessité de limiter le temps d’exécution des programmes. Cette limitation, associée à la découverte de problème non résolutifs en un temps polynomial, formalisée mathématiquement par la théorie de la complexité et ses fameux « problèmes NP-complets » mettra un frein au développement de l’intelligence artificielle ; en tout cas de celle fantasmée par l’homme, id. est d’une intelligence à son image.
C’est pour cette raison que la recherche sera recentrée sur l’aide décisionnelle avec la création des systèmes experts [22] dans les années 1960. La déduction de données est basée sur un ensemble de faits connus et de règles à appliquer pour obtenir de nouveaux faits et par constructions successives aboutir à la solution. C’est en réalité un enchaînement de syllogisme, dont on connaît maintenant les limites4. Ces systèmes ont trouvé diverses applications dans le monde médical où ce type de raisonnement s’applique.
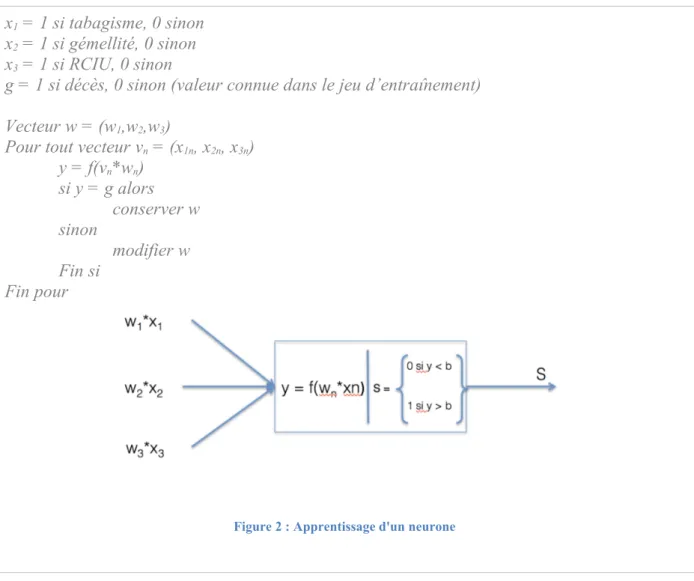
Dans les années 1980, alors que les systèmes experts sont adoptés par l’industrie, John Hopfield relance l’intérêt pour la théorie connexionniste en proposant un nouveau modèle de réseau neuronal, théorie déjà abordée dans les années 60. Le nom de « réseau de neurones » est issu d’une métaphore biologique : un ensemble de variables est donné en entrée du neurone. L’analogie peut être faite avec les neurotransmetteurs au niveau pré-synaptique. Chacune de ces valeurs est pondérée. Une fonction est appliquée à ces variables pondérées et selon le résultat obtenu (seuil de dépolarisation), le neurone retourne à son tour 0 ou 1.
Ce résultat est transmis à d’autres neurones, eux-mêmes interconnectés à d’autres neurones. L’apprentissage pour un neurone consiste à lui fournir des jeux de variables connus 3 voir annexe : imitation game
4 voir annexe : syllogisme
Faits (anamnèse – examen) -> Règles (état de l’art, connaissances) = Nouveau fait (hémoculture , fièvre +) > Si hémoculture – = infection
-(hémoculture -, fièvre +, infection -) -> si fièvre + & infection - = Cancer +
Le système expert évoque un cancer. Pensez à doser les marqueurs spécifiques
pour obtenir en sortie du neurone un résultat connu en modifiant les pondérations si les réponses sont incorrectes. Après avoir été testé sur un nombre suffisant de cas, le neurone peut être alors utilisé sur un jeu de variable afin de classifier ce jeu dans une catégorie A (si 0) ou B (si 1). Dans l’exemple ci-dessous appliqué à notre problème de classification des prématurés de moins de 1000g, on peut très bien imaginer ce neurone, classifiant en fonction des facteurs de risques prénataux interconnecté avec d’autres neurones classifiant en fonction de l’hémodynamique ou de l’état respiratoire du nouveau-né à la naissance.
Parallèlement, une autre branche de l’intelligence artificielle se développe avec l’algorithmique évolutionniste proposant des solutions à des problèmes de classification ou d’optimisation. Le principe est là encore bio-inspiré : il trouve son origine dans la théorie évolutionniste de Darwin. Un ensemble de programmes sont générés aléatoirement (d’où l’appartenance à la famille des algorithmes stochastiques). Pour répondre à un problème donné, ils sont croisés et sélectionnés selon le fait qu’ils proposent une solution optimale sur un jeu de variables d’entraînement. Le meilleur programme issu du brassage est conservé pour répondre au problème posé. La programmation génétique, décrite plus loin dans le présent document est l’œuvre de John Koza, présentée en 1992 [23].
x1 = 1 si tabagisme, 0 sinon
x2 = 1 si gémellité, 0 sinon
x3 = 1 si RCIU, 0 sinon
g = 1 si décès, 0 sinon (valeur connue dans le jeu d’entraînement) Vecteur w = (w1,w2,w3)
Pour tout vecteur vn = (x1n, x2n, x3n)
y = f(vn*wn) si y = g alors conserver w sinon modifier w Fin si Fin pour
A côté de ces méthodes bio-inspirées, nous pourrions aussi citer les méthodes d’apprentissage statistiques, avec la classification naïve bayésienne ou la méthode des k-plus-proches voisins, ou encore l’apprentissage supervisé pour les arbres de décision [24].
Si les théories mathématiques et informatiques restent méconnues du grand public, les applications telles que la reconnaissance vocale ou faciale, la création d’itinéraire en temps réel ou les compétitions de go ou d’échecs marquent les esprits.
Etat de l’art
La médecine est un champ d’application immense pour l’aide à la décision ou pour la classification automatisée. Avec l’avènement de larges bases de données contenant plusieurs milliers de patients, l’automatisation des tâches de classification simplifiera le travail du clinicien pour la sélection des patients constituant la cohorte sur laquelle il souhaite effectuer un travail de recherche [24].
L’aide au diagnostic est aussi un champ de recherche très actif. Dès 1995, un article recensant des algorithmes d’aide au diagnostic utilisant des réseaux de neurones était publié dans le Lancet [25]. Les applications sont de plus en plus nombreuses. Elles concernent la clinique avec l’assistance au diagnostic de l’appendicite, la démence, l’AVC [26], l’extraction dentaire [27], le syndrome coronarien aigu, les douleurs thoraciques (avec l’utilisation de la programmation génétique [28]), l’analyse des gaz du sang (par PG5 [29]), et en imagerie [30] [31]. On en trouve aussi en traitement du signal, avec notamment la détection de signes ECG prédictifs d’hyperkaliémie [32]. C’est aussi dans le cadre du pronostic, en oncologie [33][34], ou en pédiatrie [35] qu’on retrouve l’utilisation de la programmation génétique ou des réseaux de neurones artificiels.
Applications en néonatologie
Les applications en néonatologie existent : prédiction pronostique post-opératoire néonatale à l’aide d’algorithmes de superlearning [36] ou encore pronostic de l’extubation des prématurés à l’aide de réseaux de neurones [37]. Cette dernière a le mérite de proposer un algorithme dont le taux de réussite est de 82% sur le jeu de variable d’apprentissage et 85% pour les variables de test contre 84% et 81% pour le modèle statistique utilisant l’analyse multi variée par régression logistique. Mieux encore, il fait mieux que le clinicien avec ses 78% de réussite à l’entraînement et 70% lors du test. Il faut mesurer ce dernier résultat par le fait que le niveau des cliniciens était hétérogène.
Concernant le pronostic de mortalité chez les nouveau-nés, plusieurs études de l’équipe de Nascimento utilisant la logique floue ont déjà été menées [38][39][40]. Dans la dernière étude de 2014, les paramètres donnés en entrée étaient le poids, l’âge gestationnel, le 5 Programmation génétique, pour le reste du document
score d’APGAR à la cinquième minute et la fraction inspirée d’oxygène et donnait en sortie le risque de décès estimé en pourcentage. Le résultat était satisfaisant avec une aire sous la courbe ROC de 81,9% mais restait inférieur à l’estimation donnée par le CRIB. Toujours en 2014, une autre équipe brésilienne créait un outil de machine learning nommé NiceSIM basé sur des réseaux de neurones artificiels et machine de support de vecteurs pour estimer le risque de mortalité des prématurés [41]. Les valeurs d’entrée retenues après sélection statistique et par une équipe d’experts étaient l’APGAR inférieur à 7, le RCIU, l’âge gestationnel, la détresse respiratoire, la persistance du canal artériel, l’âge au début de la nutrition parentérale et l’âge auquel la nutrition est uniquement entérale. L’âge gestationnel sera remplacé par le poids ultérieurement. C’est avec les réseaux de neurones que le modèle fonctionne le mieux avec une précision de prédiction de 86.7%. Les auteurs ont développé ce projet non pour la prédiction au lit du malade, mais pour proposer de nouvelles variables au simulateur et ainsi isoler de nouveaux facteurs de risques6. Enfin, c’est au moment même de l’écriture de ce manuscrit (le 15 septembre 2018) qu’est sorti sur le site de la revue Nature un article sur l’utilisation de réseaux de neurones pour la prédiction de mortalité chez le nouveau-né de moins de 1500 grammes ou d’âge gestationnel inférieur à 30 semaines d’aménorrhées [42]. Leur algorithme a été entraîné sur une cohorte italienne de 23747 nouveau-nés, venus au monde sur la période 2008-2014 et testé sur 5810 patients inclus entre 2015 et 2016. Il fait mieux que la régression logistique qui avait un taux d’erreur supérieur de 1.2%. Les variables étudiées, basées sur le protocole du Vermont-Oxford Network (réseau prénatal le plus grand au monde) étaient le PN, l’AG, l’APGAR à une et cinq minutes, le sexe, le mode de délivrance, l’ethnie de la mère, la chorioamniotite, les soins prénataux, l’administration anténatale de corticoïdes, la grossesse multiple et l’existence d’une hypertension maternelle. L’avantage de ce nouveau modèle est qu’il aboutit à la création d’un score, supposé plus fin que le CRIB, calculable 5 minutes après la naissance7.
La programmation génétique
Plusieurs méthodes utilisant des réseaux de neurones artificiels sont efficaces pour la prédiction de mortalité chez le nouveau-né et montrent leur supériorité par rapport à d’autres types de machine learning. Dans aucune étude, l’approche par programmation génétique n’a été utilisée. Pourtant ce type d’algorithme évolutionniste a déjà trouvé des applications en médecine. Pour cette raison, il a été décidé d’utiliser ce procédé afin de pouvoir le comparer aux autres méthodes, mais aussi pour en comprendre le fonctionnement intrinsèque.
6 pour se procurer NiceSIM, lien en annexe
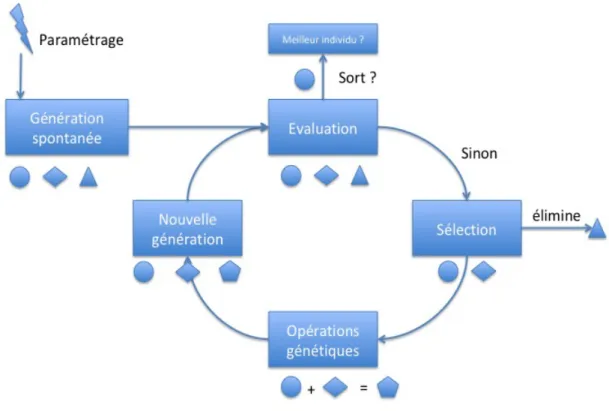
La programmation génétique mise au point en 1992 par Koza [23] fait partie de la famille des algorithmes évolutionnistes. Un ensemble de programme est généré aléatoirement et constitue une population originelle. Ces programmes sont développés pour répondre à un problème donné. Pour ce problème, il existe un jeu de variables avec lequel nous avons une partie de la solution. Ces variables sont données en entrée de chacun des programmes de la population originelle. Une fonction, appelée fonction fitness, attribue un score à chacun de ces programmes. Les programmes avec le meilleur fitness sont reproduits, mutés ou encore croisés entre eux pour donner une nouvelle population. Au fur et à mesure des itérations, le fitness devient meilleur traduisant le fait qu’un programme approche de la solution optimale (voir figure 3). Le programme avec le meilleur fitness est conservé quand celui-ci est supérieur à un seuil donné ou quand on a dépassé un nombre d’itérations fixé au début de la recherche. Il sera utilisé par la suite sur des variables ayant trait au problème donné mais pour lesquelles on ne connaît pas la solution.
Figure 3 : cycle de programmation génétique
Les programmes sont représentés sous forme d’arbre (même si les évolutions de la programmation génétique ces dernières années proposeront de nouvelles formes de représentation), une structure de données universellement connue en informatique et dont la
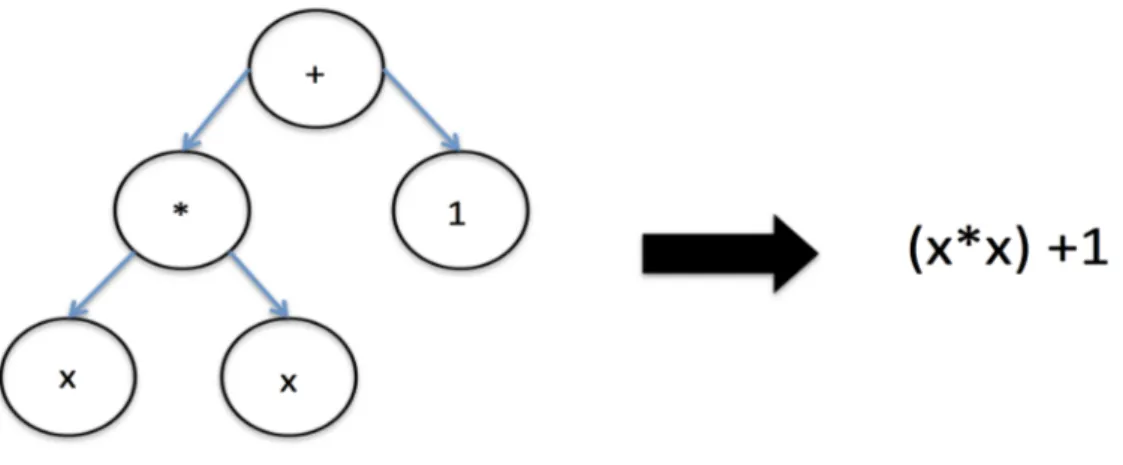
manipulation requiert des connaissances simples en algorithmique [43]. On parle de génotype pour désigner le code d’un programme de la population et de phénotype pour désigner le fitness obtenu lors de l’évaluation. Son génotype est composé de fonctions, situés sur les nœuds de l’arbre, de variables et de constantes situées sur les feuilles de l’arbre. Ces fonctions, variables et constantes sont issues d’une grammaire commune à tous les programmes de la population. Bien souvent, en programmation génétique cette grammaire est composée d’opérandes simples, comme de simples opérateurs mathématiques (+,*,/,-,sin,cos,max) ou de l’algèbre de Boole (ET, OU, NON, OU EXCLUSIF) et de terminaux : variables et constantes en nombre restreint. Le programme est interprété en parcourant l’arbre dont il est la représentation de la racine aux feuilles. Un exemple est donné en figure 4.
Figure 4 : programme mettant la variable x au carré et ajoutant 1
Le programme est interprété avec un ensemble de valeurs dont on connaît la sortie attendue. Si ce programme répond correctement suffisamment de fois au problème donné, il sera sélectionné pour participer à la création de la nouvelle génération par l’utilisation d’opérateurs génétiques.
Cette sélection peut être réalisée de nombreuses manières différentes, toutes ayant un intérêt particulier [23]. Nous nous focaliserons sur la sélection par tournoi, couramment utilisée. Pour l’ensemble de la population comprenant x individus on réalise des tournois de taille y. Il y aura donc x/y tournois. Seul le meilleur de chaque tournoi sera conservé pour l’étape suivante. Cela présente plusieurs avantages. Vous pouvez organiser les tournois de façon parallèle (et gagner en temps machine) et cela permet de conserver un brassage génétique. En effet, de façon occasionnelle, un tournoi ne comprend que des éléments moyens ou mauvais. Par conséquent, un élément ayant un phénotype différent des meilleurs peut venir sporadiquement apporter une caractéristique par le biais du croisement apportant une amélioration à la population.
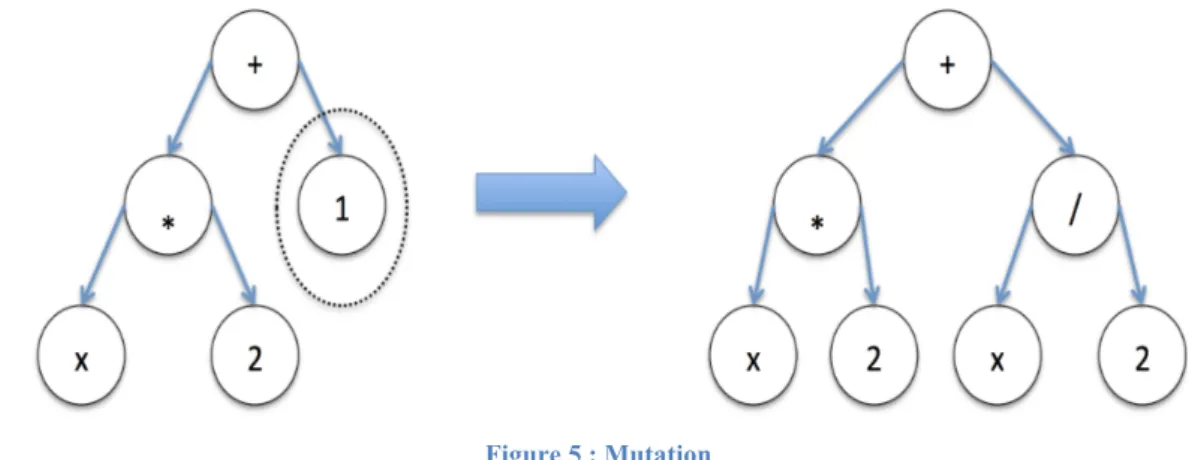
- La mutation : elle consiste à prendre une partie du code génétique du programme et à le modifier aléatoirement.
Figure 5 : Mutation
- La reproduction : le code génétique du programme sera simplement transmis à la génération suivante, sans altération.
- Le croisement : on prend une partie du code génétique de deux programmes et on les intervertit. Vous avez donc quatre programmes : les 2 originaux et les 2 copies modifiées.
Les
Figure 6 : Croisement de deux programmes
Les programmes issus des opérations génétiques sont de nouveau testés avec les données de test pour aboutir à une nouvelle sélection vers de nouvelles opérations génétiques ; jusqu’à obtention d’un programme répondant au problème posé initialement.
La programmation génétique n’est qu’une des nombreuses méthodes de résolution automatisée de problème par intelligence artificielle. Depuis sa création, de nombreuses
améliorations et modifications ont été proposées. Son utilisation a été peu proposée dans le cadre de la néonatologie, contrairement aux réseaux de neurones ou aux arbres décisionnels.
Objectif de l’étude
L’objectif de notre étude était d’évaluer la capacité d’une intelligence artificielle à prédire la mortalité chez les prématurés de moins de mille grammes et de moins de trente-deux semaines. Cette intelligence artificielle serait basée sur des techniques de programmation génétique, cette dernière technique n’ayant pas été testée antérieurement sur cette problématique. Cette intelligence artificielle a pour particularité d’être développée intégralement par un médecin et non par une équipe d’informaticiens. Les résultats obtenus par celle-ci seront comparés à ceux obtenus par les méthodes statistiques usuelles et par des cliniciens.
Matériels et Méthodes
Cette étude a pour particularité de proposer deux séquences. La première, qui est une étude cas-témoins unicentrique au Centre Hospitalier Universitaire Amiens-Picardie portant sur la période 2015-2017, consiste à rechercher des facteurs de risque de mortalité chez les prématurés de moins de mille grammes. La deuxième, basée sur les données de la première séquence a pour objectif le développement d’une intelligence artificielle prédictive de la mortalité de ces mêmes prématurés. Après un temps d’éducation, cette I.A était testée sur une autre base de patients.
Population
Tous les nouveau-nés de moins de 1000 grammes et ≤ 32 SA inclues, provenant de la maternité du Centre Hospitalier Universitaire d’Amiens ou de tout autre centre hospitalier de la région Picardie et ayant bénéficié d’une prise en charge active dans l’unité de réanimation néonatale entre le 14 décembre 2014 et le 8 décembre 2017 étaient inclus dans l’étude.
Les critères d’exclusion étaient la limitation active des thérapeutiques dès la naissance, la quantité de données insuffisantes pour les fournir à notre programme ou le refus de participation des parents à l’étude.
Critère de jugement principal
Définir à partir des données recueillies au cours des 48 premières heures de vie le taux de mortalité à 7 jours de vie.
Critère de jugement secondaire
Définir à partir des données recueillies au cours des 48 premières heures de vie le taux de mortalité à 28 j de vie.
Périodes d’étude
Deux périodes ont été définies :
- 2015-2016 : période de référence servant à construire un algorithme pronostique de la mortalité au CHU d’Amiens selon les données épidémiologiques de la littérature. - 2017 : Période de validation permettant de tester l’algorithme.
Développement de l’I.A
L’intelligence artificielle est basée sur la programmation génétique. L’aboutissement recherché est la création d’un programme simple permettant de répondre par oui ou par non (réponse binaire) à la possibilité de décès du nouveau-né dans les 7 premiers jours de vie. Un deuxième programme sera obtenu avec les mêmes données, celles basées sur les 48 premières heures de vie pour aboutir à une prédiction à 28 jours.
Le langage de programmation choisi est Ruby©, un langage inventé par Yukihiro Matsumoto en 1991. Son concepteur était un grand utilisateur de Lisp©, langage utilisé pour la conception d’I.A. Ruby© a pour particularités entre autres d’être orienté objet (permettant ainsi une évolutivité future facilitée du programme en se basant sur les classes existantes) et de disposer de la gestion du multithreading (gestion de calculs parallèles), utile en programmation génétique. Il est disponible gratuitement et est utilisable sur tout type de plateforme.
La programmation génétique, telle qu’inventée et décrite par Koza en 1992 a été implémentée. Le mode de génération à la phase initiale des programmes est le mode « ramped half and half »8 avec génération de 50% d’arbres complets, 50% d’arbres
incomplets [43]. La profondeur initiale maximale des arbres était de 4, la profondeur maximale en cours d’exécution de 100. Le mode de sélection était le mode tournoi avec une taille de tournoi fixée à 4. Les opérateurs génétiques étaient la mutation, la reproduction et le cross-over (croisement) avec des répartitions de 10%, 10% et 80% sur la population de programme sélectionné. Il y a donc une population de plus en plus petite au fur et à mesure des générations représentant 45% de la population antérieure.Le nombre maximal de générations était choisi entre 15 et 20 et la taille de la population entre 500 et 4000 individus. La grammaire sélectionnée était l’algèbre de Boole avec les opérandes OU, ET, OU EXCLUSIF et NON. Les terminaux étaient les variables concernant les patients retenus et VRAI/FAUX.
Protocole de travail
L’étude se déroulait en trois phases.
Construction statistique d’un score pronostics de mortalité de façon statistique par
régression logistique. Elle s’apparentait à une étude pronostique avec recherche de facteurs de risque de mortalité chez les prématurés de moins de 1000 grammes et ≤32 SA.
Construction par IA d’un score pronostic de mortalité : Cette étape consistait en une
phase d’apprentissage de l’IA grâce aux données des nouveau-nés retenus des années 2015 et 2016. Elle aboutissait sur l’obtention d’un programme simple prédictif de mortalité à 48 heures, et d’un autre, prédictif de mortalité à J28.
Validation de score pronostic de mortalité : Statistique vs IA vs clinicien : La troisième
phase, de contrôle, était une compétition entre le programme obtenu par I.A, un modèle statistique obtenu par régression logistique et les cliniciens du service.
Les variables étudiées étaient issus de la littérature médicale, basées sur les dernières études portant sur l’utilisation d’intelligence artificielle en néonatologie et la mortalité des prématurés. Elles sont présentées dans le tableau 1.
Variables retenues pour l’analyse univariée Âge gestationnel Poids de naissance RCIU Sexe Grossesse gémellaire Grossesse pathologique Transfert in-utero Outborn
Nombre de doses de corticoïdes Corticothérapie anténatale complète Césarienne
Score d’apgar
Nombres de doses de corticoïdes anténataux Administration de surfactant
Cardiopathie congénitale Malformation congénitale
Patient sous amines à H48
Diurèse < 0.5 mL/kg/h dans les 48 premières heures de vie
Ventilation invasive à H48
Pression expiratoire positive supérieure ou égale à 6 ou ventilation haute fréquence
Hémorragie intra-ventriculaire de stade supérieur à 2
Suspicion de chorioamniotite CRP
Hémoculture réalisée dans les 48 premières heures positives
Troubles de l’hémostase
Nombre de défaillances vitales
Décès à J7 Décès à J28 Décès ultérieur
Ethique
L’étude était enregistrée auprès de la CNIL selon la méthodologie MR-003. La non-opposition à l’inclusion dans l’étude était recherchée. De ce fait, les parents recevaient une lettre d’information sur le déroulement de l’étude et sur leur droit de rétractation.
Collecte de données
Les données étaient issues des dossiers informatisés sous DxCare© ou des dossiers papiers retirés aux archives du CHU si le dossier était antérieur à Novembre 2015. Les variables relevées sont présentées en tableau 1. Elles étaient ensuite transformées en variables booléennes (VRAI, FAUX) pour être fournies à l’IA. Ces transformations nécessitaient la fixation d’un seuil pour les variables quantitatives, elles sont présentées dans le tableau 2.
Variable quantitative Seuil Booléen Âge gestationnel < 27 SA VRAI Poids de naissance <750 grammes VRAI
Score d’apgar < 7 VRAI
CRP > 20 VRAI
Tableau 2 : transformation de variables quantitatives en variables booléennes
Méthodes statistiques
Une analyse descriptive était réalisée sur l’ensemble des patients (période 2015-2017). La recherche de facteur de risque de mortalité à J7 et à J28 était effectuée à l’aide du test du Chi². L’ensemble des patients était ensuite scindé en deux groupes : un groupe apprentissage (2015-2016) et un groupe contrôle (période 2017). Ces deux groupes étaient comparés par le test-t de Student. Ensuite, une analyse univariée était réalisée sur les variables booléennes puis une analyse en régression logistique était effectuée pour fournir un modèle prédictif statistique qui sera comparé à l’intelligence artificielle. Le groupe contrôle est donné aux praticiens hospitaliers pour évaluation de la mortalité à J7 et J28. Une sensibilité et une spécificité sont calculés pour le modèle statistique, pour le groupe de médecins et pour l’intelligence artificielle afin d’être comparés.
Le stockage des données était fait sous Microsoft Excel©. Les analyses statistiques étaient réalisées sous PSPP (version libre de SPSS©) et R-Stat©.
Résultats
Du huit décembre deux-mille quatorze au 19 décembre 2017, 154 prématurés de moins de 1000 grammes étaient éligibles pour inclusion dans l’étude. Sur ces 154 patients, 1 a été retiré pour âge gestationnel supérieur à 32 SA et un autre pour mise en place d’une limitation et arrêt des thérapeutiques actives dès la prise en charge en salle de naissance sur demande des parents. Cent cinquante-deux patients étaient donc intégrés à l’analyse descriptive. Cent trois patients (période 2015-2016) étaient inclus dans le groupe
Apprentissage et 49 dans le groupe contrôle (période 2017). Le groupe apprentissage était
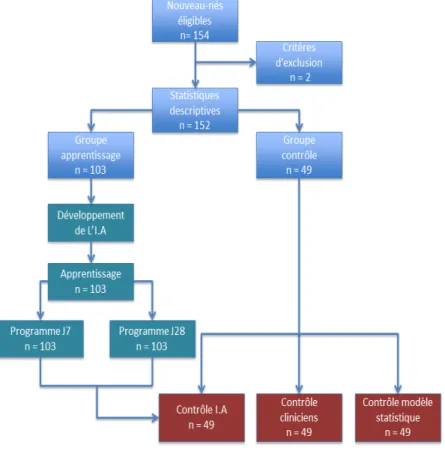
intégralement attribué à la programmation génétique pour obtention de deux programmes ; l’un prédictif de décès à J7, l’autre à J28. Ces deux programmes étaient par la suite testés sur les 49 patients du groupe contrôle et leurs résultats comparés à ceux obtenus par les cliniciens et par le modèle statistique obtenu par régression logistique. Le diagramme de flux de l’étude est présenté en figure 7.
Analyse sur l’ensemble des patients …
Sur les cent cinquante-deux patients, le terme moyen était de 26.6± 2.1 SA avec un minimum à 23 SA et un maximum à 32 SA. Le poids de naissance moyen était 775.4 ± 136.2 g avec un poids minimum de 360get un maximum à 999g. L’Apgar à 5 min était à 7.5 ± 2.7 et la CRP à 10.1±16.2 mg/L. Les patients ne présentaient que 1.7 ± 1.2 défaillances viscérales, bien souvent d’origine respiratoire, avec 107 patients (70.4%) toujours intubés-ventilés à H48. Il y avait 78 (51.3%) filles pour 74 (48.7%) garçons. Les anomalies de développement étaient au nombre de 5 (3.3%) pour les cardiopathies congénitales et de 10 (6.6%) pour les autres (hypospade, os longs courts, lissencéphalie…). On retrouvait un RCIU chez 55 patients (36.2%). Environ la moitié des patients provenait d’un transfert in-utero (74 patients soit 48.7%) et 22 étaient outborn (14.5%). La corticothérapie anté-natale complète était légèrement majoritaire, soit chez 86 patients (56.6%) et l’administration de surfactant presque systématique (135 patients soit 88.8%).
… et de leur mortalité
Concernant les causes de décès à J7, en analyse bivariée à l’aide du test du Chi-2 et du test exact de Fisher, on retrouvait comme facteurs de risques le sexe (sexe féminin protecteur avec 16 patients (69.6%) masculins contre 7 (30.4%) féminins parmi les patients décédés à J7, p = 0.03), le fait d’être outborn (facteur de risque péjoratif, p=0.001), d’être sous amines à H48 (p=0.0001), d’avoir une diurèse inférieure à 0.5 mL/kg/h dans les 48 premières heures de vie (p=0.0001), d’être intubé-ventilé (p = 0.004) et encore plus d’être sous high frequency oscillation (HFO) ou d’avoir une P.E.P supérieure à 6 (OR = 56.53 IC = [16.09-198.61],p = 0.0001), d’avoir une hémorragie intra-ventriculaire de stade strictement supérieur à 2 (p =0.001) ou une hémoculture prélevée dans les 48 premières heures de vie positive (p=0.005). A J7, 23 patients (15.1%) étaient décédés.
A J28, le sexe féminin n’était plus protecteur (p = 0.007). Il n’y avait pas d’autre variable relevée dans les 48 premières heures de vie prédictive de mortalité à J28. Le décès de 21 (13.8%) patients de plus était comptabilisé.
Au total, 67 (51.1%) patients de la cohorte sur 131 étaient décédés en 2018. Les 21 manquants étaient perdus de vue du fait de leur orientation vers un centre hospitalier de périphérie.
Comparaison des 2 groupes
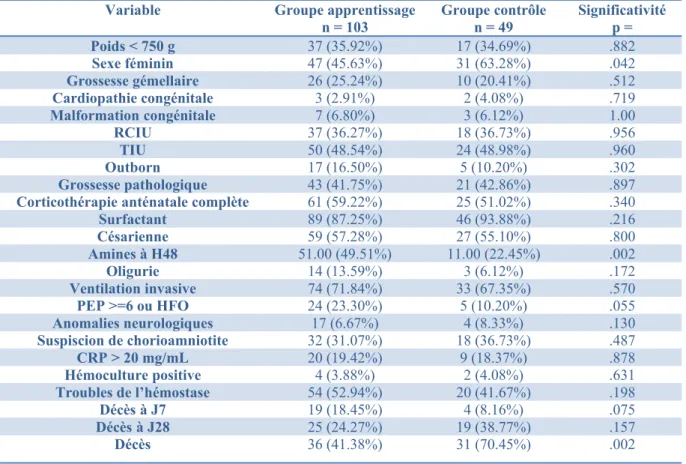
Le groupe apprentissage et le groupe contrôle sont présentés en tableau 3. On note des différences significatives entre les deux groupes en ce qui concerne le décès ultérieur à j28, le nombre de décès total, le sexe et l’utilisation des amines.
Tableau 3: caractéristique des patients
Variable Groupe apprentissage n = 103 Groupe contrôle n = 49 Significativité p = Poids < 750 g 37 (35.92%) 17 (34.69%) .882 Sexe féminin 47 (45.63%) 31 (63.28%) .042 Grossesse gémellaire 26 (25.24%) 10 (20.41%) .512 Cardiopathie congénitale 3 (2.91%) 2 (4.08%) .719 Malformation congénitale 7 (6.80%) 3 (6.12%) 1.00 RCIU 37 (36.27%) 18 (36.73%) .956 TIU 50 (48.54%) 24 (48.98%) .960 Outborn 17 (16.50%) 5 (10.20%) .302 Grossesse pathologique 43 (41.75%) 21 (42.86%) .897
Corticothérapie anténatale complète 61 (59.22%) 25 (51.02%) .340
Surfactant 89 (87.25%) 46 (93.88%) .216 Césarienne 59 (57.28%) 27 (55.10%) .800 Amines à H48 51.00 (49.51%) 11.00 (22.45%) .002 Oligurie 14 (13.59%) 3 (6.12%) .172 Ventilation invasive 74 (71.84%) 33 (67.35%) .570 PEP >=6 ou HFO 24 (23.30%) 5 (10.20%) .055 Anomalies neurologiques 17 (6.67%) 4 (8.33%) .130 Suspiscion de chorioamniotite 32 (31.07%) 18 (36.73%) .487 CRP > 20 mg/mL 20 (19.42%) 9 (18.37%) .878 Hémoculture positive 4 (3.88%) 2 (4.08%) .631 Troubles de l’hémostase 54 (52.94%) 20 (41.67%) .198 Décès à J7 19 (18.45%) 4 (8.16%) .075 Décès à J28 25 (24.27%) 19 (38.77%) .157 Décès 36 (41.38%) 31 (70.45%) .002
Analyse statistique – Régression logistique
Nous voulions proposer un modèle statistique, obtenu par régression logistique, et de l’appliquer sur nos différents groupes afin de comparer les résultats de ce modèle à ceux obtenus par l’intelligence artificielle. Nous étions malheureusement confrontés à deux limites. La première a été mise en évidence plus haut : les deux groupes ne sont pas parfaitement comparables. La deuxième était qu’une régression logistique nécessite un nombre minimum d’évènements (ici le décès) pour pouvoir exprimer une variable comme significative. Hors, le nombre de décès par rapport aux nombres de variables était ici assez faible. Ces limites étaient mises en évidence par notre service de santé publique qui avait procédé à la création du modèle statistique par régression logistique.
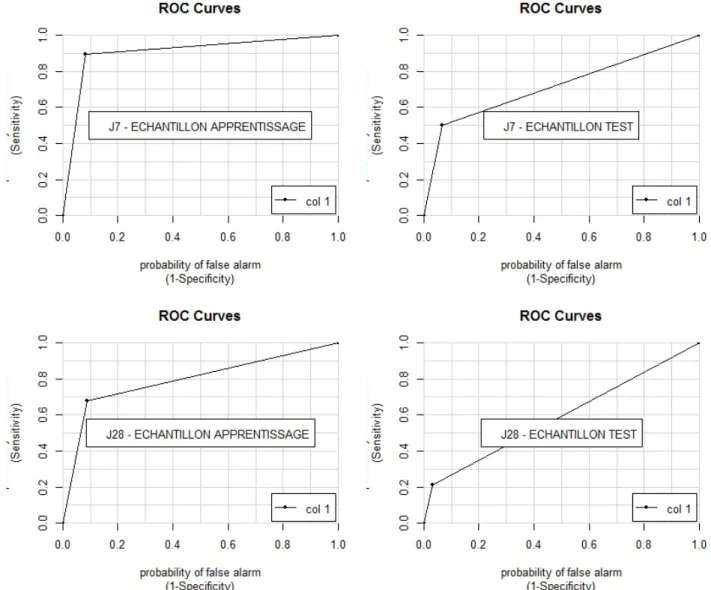
La première phase de construction de ce modèle consistait à sélectionner les variables les plus représentatives. Une analyse univariée de chaque variable par rapport au décès à J7 pour le groupe apprentissage était réalisé, avec un seuil de significativité p = 0.10. Quatorze variables étaient alors retenues. Après discussion, 5 de ces 14 variables ont été retirées (car elles étaient la combinaison de deux variables). Une sélection parmi ces neuf variables (outborn, poids < 750g, amines à H48, défaillance respiratoire, défaillance neurologique, trouble de l’hémostase, hémoculture positive, âge gestationnel < 27SA et Apgar<7) à l’aide d’une méthode d’échantillonnage récurrent, appelée bootstrap, couplée à une méthode de sélection descendante était essayée mais échouait. Au final, une sélection des trois variables les plus significatives étaient réalisées : défaillance respiratoire, utilisation d’amines à H48 et le nombre de défaillances vitales (nombre de défaillance supérieur à 2). Le bootstrap était réalisé de nouveau et la variable défaillance respiratoire apparaissait comme clairement plus significative que les autres. Par une méthode ascendante, pas-à-pas, manuelle, c’est aussi cette variable qui ressortait. La sensibilité était alors de 89 % et la sensibilité de 91 % au seuil de 0.70 en utilisant la variable défaillance respiratoire uniquement. L’aire sous la courbe ROC (AUC) était de 0.91.
Le modèle appliqué sur le groupe contrôle donnait de moins bons résultats avec une AUC à 0.72. Sur la courbe, au point d’inflexion, on retrouve une sensibilité à 50 % et une spécificité à 93 %.
A j28, la même méthode était appliquée : on effectuait une première sélection par analyse univariée puis par bootstrap qui aboutissait à la sélection de la même variable : défaillance respiratoire. Sur le groupe apprentissage, la sensibilité était de 68 % pour 91 % de spécificité avec une AUC à 0.79. Pour le groupe contrôle, l’AUC était très diminuée à 0.59.
Figure 8 : Courbes ROC obtenues après régression logistique
Résultats de l’intelligence artificielle
L’intelligence artificielle avait auparavant été testée sur un problème simple à une variable qui consistait en l’approximation d’une fonction exprimant la somme d’une suite arithmétique de raison 19. Une fois ce modèle validé, elle était ensuite utilisé pour déterminer le pronostic de mortalité à J7 et J28 des prématurés de moins de 1000 grammes. La phase d’apprentissage avait lieu avec pour entrées 19 variables des 103 patients recrutés sur la période 2015-2016. Un run de programmation génétique était réalisé pour obtenir le meilleur programme pronostiquant le décès à J7, un autre pour la mortalité à J28. Afin de respecter le paradigme de Koza, la sortie étant une variable booléenne, les entrées devaient être exprimées sous forme de variables booléennes. Les opérateurs choisis étaient les opérateurs de l’algèbre de Boole. La profondeur initiale maximale des arbres représentant les programmes était de 4 et la profondeur maximale au cours de l’évolution était de 100. Cette profondeur maximale avait été choisie arbitrairement. La population initiale était formée de 4000 individus, par 9 Les phases de développement du projet sont présentées en annexe
contrainte technique. En effet l’ordinateur utilisé ne supportait pas plus de 4000 threads simultanés. Le nombre de générations maximal était 15, même si sur les dernières générations la population se limitait à 4 individus, la population n+1 étant d’une taille de 9/20 de la population n. La fonction de fitness avait pour seuil le produit de la sensibilité et de la spécificité de chaque programme. Le seuil idéal était donc de 1.0 (sensibilité de 100% et spécificité de 100%).
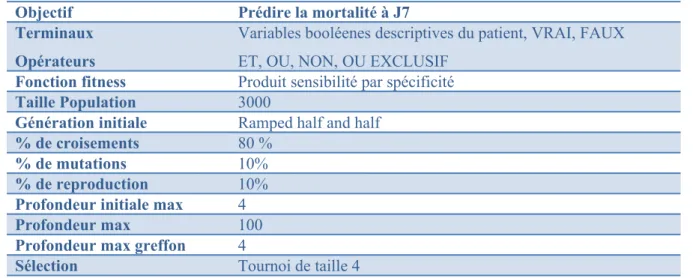
Tableau 4 : Tableau de Koza de la programmation génétique pour prédiction à J7
Objectif Prédire la mortalité à J7 Terminaux
Opérateurs
Variables booléenes descriptives du patient, VRAI, FAUX ET, OU, NON, OU EXCLUSIF
Fonction fitness Produit sensibilité par spécificité
Taille Population 3000
Génération initiale Ramped half and half
% de croisements 80 %
% de mutations 10%
% de reproduction 10%
Profondeur initiale max 4
Profondeur max 100
Profondeur max greffon 4
Sélection Tournoi de taille 4
Concernant la mortalité à J7, le meilleur fitness trouvé était 0.87 (sensibilité 100%, spécificité 87%) avec le groupe apprentissage. La deuxième solution, bien qu’ayant un seuil plus bas, nous apparaissait plus appropriée (fitness 0.82, sensibilité 89 %, spécificité 91%) du fait de sa meilleure spécificité. Toutes les solutions incluaient la variable « respi » (représentant la ventilation à H48 avec une PEP >= 6 ou par HFO) associé à l’opérateur OU. Le programme évaluant la défaillance respiratoire était donc testé sur le groupe contrôle. La sensibilité était alors de 50% et la spécificité de 93%. En étudiant la mortalité à J7 seulement sur 2015 (seuil 0.87) et en appliquant la fonction trouvée [défaillance respiratoire OU outborn] sur les patients de 2016, la sensibilité était alors de 100% et la spécificité de 75%.
Pour la mortalité à J28 (qui intègre aussi les patients décédés à J7), la fonction trouvée via le groupe apprentissage est
[respi OU outborn] ou la fonction
[respi OU neuro]
avec un fitness à 0.63, une sensibilité de 79% et une spécificité à 81%. Un deuxième run avait été réalisé aboutissant à une meilleure fonction (fitness 0.67, sensibilité 76 % et spécificité à 87%). Sur le groupe contrôle, les résultats étaient pour les deux premières fonctions une
sensibilité à 27% et une spécificité à 87% et dans le second cas une sensibilité à 16% et une spécificité à 87%. Là encore, nous avons effectué les mêmes manipulations pour le groupe 2015. Nous obtenons la fonction :
[(((poids OU respi) ET self.respi) ET (cesarienne ET coag)) OU ((neuro ET VRAI) OU ((amines OU cardiopathie) ET respi))]
avec un fitness de 0.66. Son application aux patients de 2016 retrouve une sensibilité de 90% et une spécificité de 76% (soit un fitness de 0.68).
Enfin, nous avons effectué deux runs sur les patients de 2017. Le premier, pour la mortalité à J7, la fonction trouvée était :
[((FAUX OUX gemellite) ET ((neuro OU respi) OU neuro)) OU hemoc]
et avait un fitness de 0.71 avec une spécificité de 75% et une spécificité de 95%. Pour J28, nous trouvions la fonction :
[(cesarienne ET gemellite) OU ((sexe ET sexe) ET ((sexe ET sexe) ET (chorio OU poids)))]
avec un fitness 0.64, une sensibilité à 83 % et une spécificité à 77%.
Résultats des cliniciens
Quatre médecins (2 praticiens hospitaliers, 2 internes) ont accepté d’évaluer, avec les mêmes données que celles présentées à l’I.A les 50 patients du groupe contrôle. Pour J7, la sensibilité était 37.5 % et la spécificité de 89.1 %. A J28, la sensibilité était de 40.7 % et la spécificité à 75.8 %.
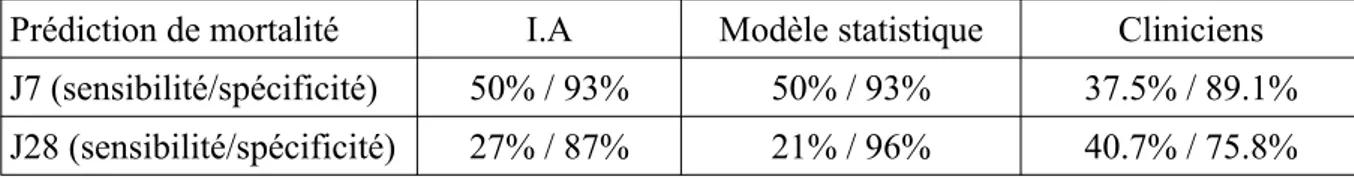
Tableau 5 : Sensibilité et spécificité des 3 méthodes
Prédiction de mortalité I.A Modèle statistique Cliniciens
J7 (sensibilité/spécificité) 50% / 93 % 50 % / 93 % 37.5 % / 89.1 % J28 (sensibilité/spécificité) 27% / 87 % 21 % / 96 % 40.7 % / 75.8 %
Discussion
A travers cette étude, nous avons pu discuter le pronostic de mortalité chez les prématurés de moins de 1000 grammes via l’analyse statistique, l’intelligence artificielle et l’intuition des cliniciens. Nous connaissions déjà certains facteurs de risques prédictifs de mortalité à moyen terme grâce à certaines études au recrutement important comme Epipage 2 [10] et avons essayé d’en mettre d’autres en avant pour la mortalité à court terme (inférieure à 7 jours).
Statistiques descriptives
Concernant les statistiques sur l’ensemble des patients, on peut noter que le poids et l’âge gestationnel moyen, le taux de RCIU, les malformations, le taux de TIU et de transfert outborn sont comparables entre nos deux groupes.
On peut rester critique sur le score d’apgar : avec une moyenne à 7.49 alors que la très nette majorité des patients sont intubés-ventilés, ne peuvent physiologiquement pas avoir une coloration (du fait d’une hémodynamique en plein changement, d’une fonction respiratoire défaillante) ou une mobilité parfaite, nous sommes en droit de penser qu’il est surévalué. Il faut donc clairement revoir les modalités de cotation du score d’apgar et préciser que celui-ci n’est évaluable qu’en air ambiant. Toujours sur le plan respiratoire, on note une très nette majorité de patients intubés-ventilés à la naissance. Seuls les termes au-delà des 30SA avec un poids de naissance proche des 1000 grammes ne le sont pas. On notera avec satisfaction une administration quasi-systématique de surfactant. La réalisation complète de la corticothérapie est plus difficile mais s’explique bien souvent par le contexte d’urgence, ne permettant qu’une administration partielle de la cure.
Sur l’aspect logistique, on note de façon positive le faible taux de patients outborn (14,47%). Même si il peut être encore amélioré, il est le signe que les facteurs de risques de naissance prématurées sont bien détectés en anténatal. De même, dès que les patients présentent le terme, le poids et la stabilité clinique adéquate, ils sont transférés dans le centre hospitalier le plus proche de leur domicile.
Sur la mortalité à J7, on relève que ce sont les facteurs de risque aigus qui s’expriment le plus avec la défaillance respiratoire, dont la profondeur est proportionnelle à la mortalité, la défaillance neurologique ou le fait d’être outborn. Comme attendu, le sexe féminin est protecteur. Sur le plan hémodynamique, nous pouvons être critiques sur la diurèse inférieure à 0.5 mL/kg/h comme facteur de risque. Cette variable est d’une part liée à l’administration d’amines (si la diurèse est insuffisante, le prématuré est mis sous amines) et d’autre part, elle s’exprime assez rarement dans les 48 premières heures de vie. Elle pourrait donc être plutôt considérée de façon secondaire, comme marqueur d’un nouvel évènement sur le plan hémodynamique. L’amine la plus utilisée reste la dopamine, le recours à la noradrénaline en médecine néonatale étant assez rare. Sur le plan infectiologique, on note que c’est la positivité de l’hémoculture qui reste le marqueur sûr de mortalité, la CRP (supérieure à 20) n’étant pas retenue. Enfin, la mortalité à J7 est de 15.13 %, avec une nette amélioration entre la période 2015-2016 et la période 2017 avec une diminution de plus de la moitié des décès, signe d’une amélioration des pratiques de prise en charge des prématurés en salle de naissance. Ce résultat est à pondérer du fait d’une non significativité (p = 0.075) probablement due à la taille insuffisante de l’échantillon.
Pour J28, il n’y avait aucune variable prédictive de décès. Nous pouvons donc en déduire que les variables choisies sont descriptives de la mortalité à court terme mais beaucoup moins à moyen terme (premier mois de vie). En effet, nous n’avons pas étudié la corrélation entre entérocolite ulcéro-nécrosante et décès car cette pathologie n’est pas diagnostiquée à H48 du fait de signes cliniques restant très subjectifs en période post-natale immédiate. Hors, sur la période 2017, les entérocolites sont diagnostiquées vers J14 et le décès survient vers 6 semaines. On note par ailleurs que 23 décès ont lieu après J28 soit à peu près un tiers des décès totaux. La majorité de ces décès étaient dus soit à une infection secondaire soit à une entérocolite. Par conséquent, une étude sur les causes de mortalité dans les trois premiers mois de vie, intégrant des facteurs de risques tels que l’entérocolite ou les critères d’infection serait judicieuse.