Développement d'une méthode verte pour la
construction des y-hydroxybuténolides et synthèse de
produits naturels et d'une nouvelle classe de
peptidomimétiques
Thèse
Marc Alexandre Jean
Doctorat en chimie
Philosophiæ doctor (Ph. D.)
Développement d'une méthode verte pour la
construction des
γ‑hydroxybuténolides et synthèse de
produits naturels et d'une nouvelle classe de
peptidomimétiques
Thèse
Marc-Alexandre Jean
Sous la direction de :
Résumé
Les travaux effectués impliquent la synthèse totale de molécules organiques d'importance biologique incluant des métabolites secondaires et des composés non naturels. Les recherches subséquentes ont amené au développement d'une nouvelle méthodologie verte pour la synthèse d'hétérocycles oxygénés.
Tout d'abord, le développement d'une voie biomimétique pour la synthèse du paracaséolide A est rapporté. Cette synthèse a été effectuée en 4 ou 5 étapes à partir de produis commerciaux passant par la formation de l'akolactone A, un produit naturel envisagé lors de la biosynthèse. Les étapes clés impliquent une réaction d'aldolisation régiocontrôlée et l'oxyfonctionnalisation d'un 2‑silyloxyfurane permettant de générer le précurseur du produit naturel. Ce dernier a été obtenu via la dimérisation par voie de Diels-Alder d'un (E)‑α‑alkylidène‑γ‑hydroxybuténolide suivi d'une épimérisation et d'une cyclodéshydratation. Les détails concernant l'état de transition de cette transformation seront abordés permettant une meilleure compréhension de la biosynthèse du métabolite secondaire. De plus, ces travaux ont permis la découverte de trois réactions sans précédent dans la littérature concernant les transformations d'un α‑alkylidènebuténolide en γ‑hydroxybuténolide ou en 2‑silyloxyfuranes, ainsi que l'oxydation aérobie de ce dernier.
Le développement d'une méthode verte pour la synthèse des γ‑hydroxybuténolides a été entrepris suite à la découverte de l'oxydation aérobie des 2‑silyloxyfuranes. Les détails de l'optimisation des conditions réactionnelles et l'étendue de cette méthode verte sont rapportés. La réalisation d'expérience de contrôle et l'isolation de produits réactionnelles nous ont conduits à proposer un mécanisme pour cette transformation. Enfin, l'application de cette méthode a pu être illustrée par la synthèse totale de l'isofugomycine qui fût réalisée efficacement en cinq étapes pour un rendement global de 35%.
Par la suite, notre intérêt pour les terpénoïdes polycycliques, et plus précisément la famille des labdanes, nous a conduits à la synthèse totale unifiée de trois métabolites secondaires, amomaxins A et B et ottensidione. Ces molécules sont caractérisées par la présence d'un carbocycle à neuf membres peu représentés au sein des produits naturels. Ces trois composés ont été obtenus via un précurseur commun, obtenu en 16 étapes à partir du (+)-sclaréolide. Cette synthèse fait intervenir des réactions importantes en chimie organique telles que la fragmentation de Grob/Wharton, la métathèse de fermeture de cycle et bien d'autres. Enfin, l'obtention de l'amomaxin A, la réassignation d'un centre stéréogène pour l'amomaxin B et la confirmation structurelle de ottensidione constitue, à ce jour, la première synthèse
cas de ottensinin offre un appui à cette théorie.
Enfin, le dernier projet consiste en l'élaboration d'une synthèse orientée vers la diversité de diols peptidomimétiques non symétriques comme inhibiteurs potentiels de la protéase du syndrome de l'immunodéficience humaine (VIH). La synthèse implique l'utilisation de glycoside comme point de départ avec une addition conjuguée comme étape importante. Elle permet ainsi d'effectuer de la diversification à quatre points de divergences précis dans le but d'établir une librairie de composés pouvant potentiellement être impliqués dans une série de tests biologiques.
Summary
The work accomplished concerns primarily the total synthesis of biologically important organic molecules including secondary metabolites and non-natural compounds. Importantly, this research also led to the discovery and development of new methodology for the synthesis of oxygen heterocycles.
First, a concise, biomimetic route to paracaseolide A is described. This complex molecule was synthesized in 4 or 5 steps via akolactone A, a natural product itself that is assumed to be an intermediate in the biosynthesis of paracaseolide A. Key steps include (i) regiocontrolled aldol reaction of α–angelica lactone with myristyl aldehyde, (ii) oxyfunctionalization of a 2-silyloxyfuran to generate an (E)–α– alkylidene–γ–hydroxybutenolide, and (iii) Diels-Alder dimerization of the latter and in situ cyclodehydration to provide paracaseolide A. The stereochemical outcome of the Diels-Alder cycloaddition is discussed. In addition, the synthesis allowed the discovery of three unprecedented transformations, notably the conversion of α–alkylidenebutenolides to γ–hydroxybutenolides and 2-silyloxyfurans, and the aerobic oxidation of the latter.
In particular, a new, green and practical method was developed for converting 2-silyloxyfurans to γ– hydroxybutenolides using oxygen as oxidant. A mechanism for this autoxidation is proposed, supported by control experiments and the isolation of side products. The utility of this method was demonstrated by a short synthesis of isofugomycin (5 steps, 35% overall yield).
Following on from our interest in polycyclic terpenoids, and more precisely the labdane family, we developed a unified route to three structurally novel secondary metabolites, namely, amomaxin A and B and ottensidione. These molecules contain a nine-membered carbocycle which is rarely encountered in Nature. All three targets were assembled from a common precursor, obtained in 16 steps from (+)-sclareolide. The route entailed judicious application of several important reactions, including Grob/Wharton fragmentation and ring closing metathesis (RCM). The synthesis enabled establishment of the correct stereochemistry of amomaxin A, which was misassigned in the original publication. In a related project, we corrected the structure of a new labdane natural product, independently isolated from two Alpinia plants by different research groups, by careful analysis of the reported spectroscopic data and NMR comparison of the chemical shifts with those of ottensinin.
available carbohydrate building-block and makes use of conjugated addition as a key step. It allows divergence at four distinct points, thereby generating a library of new, drug-like compounds for biological screening.
Table des matières
Résumé ... iii
Summary ... v
Table des matières ... vii
Listes des tableaux ... xi
Listes des schémas ... xiii
Listes des figures... xvii
Listes des abréviations ... xix
Remerciements ... xxi
Épigraphe ... xxiii
Chapitre 1:
Introduction générale ... 1
1.1 Les produits naturels au cœur de l'action ... 3
1.1.1 Médecine traditionnelle ... 3
1.1.2 Historique des produits naturels ... 4
1.1.2.a Produits naturels provenant des fungi (champignons) ... 5
1.1.2.b Produits naturels isolés de plantes ... 7
1.1.2.c Produits naturels issus d'un environnement marin ... 9
1.1.3 Les compagnies pharmaceutiques et leur relation avec les produits naturels ... 11
1.1.4 Structure et biosynthèse ... 14
1.2 Les grands principes de la synthèse totale ... 20
1.2.1 Détermination et confirmation de structure ... 21
1.2.2 Découverte et utilisation de nouvelles réactions en synthèse totale ... 23
1.2.2.a La réaction de Diels-Alder ... 23
1.2.2.b Les réactions de couplage croisé catalysées au palladium ... 24
1.2.2.c Les réactions de métathèse ... 24
1.2.3 Stratégies de synthèse ... 25
1.2.3.a Les différents types de synthèse ... 25
1.2.3.b Synthèse biomimétique ... 27
1.2.3.c Synthèse évolutive et hémisynthèse ... 28
1.2.3.d Idéalité d'une synthèse ... 29
1.3 Les objectifs de cette thèse ... 31
‑hydroxybuténolide et nouvelle méthodologie verte ... 37
2.1 Généralités sur les γ-hydroxybuténolides ... 39
2.1.1 Activités biologiques ... 39
2.1.2 Utilisation comme intermédiaire de synthèse ... 41
2.1.2.a Équilibre tautomérique ... 41
2.1.2.b Réaction acide-base ... 42
2.1.2.c Réaction sur le site du carbonyle... 42
2.1.2.d Réaction sur l'hydroxyle ... 44
2.1.2.e Réaction sur la double liaison intracyclique ... 45
2.1.3 Synthèse des γ-hydroxybuténolides ... 46
2.2 Historique et biosynthèse du paracaséolide A ... 49
2.2.1 Isolation, structure et activités biologiques ... 49
2.2.2 Synthèses précédentes ... 50
2.2.3 Élucidation de l'état de transition durant la biosynthèse ... 54
2.3 Notre approche de la synthèse du paracaséolide A ... 56
2.3.1 Une extension de la biosynthèse ... 56
2.3.2 Réaction d'aldolisation régiocontrôlée ... 57
2.3.3 Synthèse biomimétique du paracaséolide A ... 59
2.3.4 Découverte d'une nouvelle réaction ... 62
2.4 Synthèse des γ-hydroxybuténolides par oxydation aérobie des 2-silyloxyfuranes ... 63
2.4.1 L'oxygène en synthèse organique ... 63
2.4.1.a Oxygène triplet ... 63
2.4.1.b Oxygène singulet... 65
2.4.2 Le concept de chimie verte ... 66
2.4.3 Exemples de la littérature ... 68
2.4.4 Optimisation de l'oxydation aérobie des 2-silyloxyfuranes ... 69
2.4.5 Étendue de la méthodologie ... 71
2.4.6 Synthèse totale de l'isofugomycine ... 76
2.5 Conclusion ... 78
2.6 Références ... 79
Chapitre 3:
Synthèse totale de terpénoïdes polycycliques originaux ... 83
3.1 Généralités sur les terpénoïdes polycycliques ... 85
3.1.1 Origine biosynthétique des labdanes ... 85
3.1.2.a Par cyclisation biomimétique ... 87
3.1.2.b À partir de terpènes abondants naturellement ... 88
3.1.3 Le sclaréolide en synthèse ... 90
3.2 Une nouvelle famille de terpénoïdes polycycliques... 93
3.2.1 Produits naturels comportant un carbocycle à neuf membres ... 93
3.2.2 Structure unique des amomaxins A et B ... 97
3.2.3 Exemple unique de la littérature ... 98
3.3 Synthèse totale des amomaxins A et B, et ottensidione ... 99
3.3.1 Plan de synthèse et analyse rétrosynthétique ... 99
3.3.2 Approche racémique ... 101
3.3.3 En route vers la synthèse des produits naturels ... 102
3.3.4 Synthèse de l'amomaxin A ... 108
3.3.4.a Exemple avec la synthèse de ottensinin ... 108
3.3.4.b Formation du cycle γ-pyrone ... 109
3.3.5 Synthèse de l'amomaxin B ... 112
3.3.5.a Formation de la fonction buténolide ... 112
3.3.5.b Synthèse du motif 𝛾-hydroxybuténolide via l'oxyfonctionnalisation ... 113
3.3.5.c Révision de la structure de l'amomaxin B ... 114
3.4 L'acide ottensinique, un cas évident de révision ... 115
3.5 Conclusion ... 118
3.6 Références ... 122
Chapitre 4:
Synthèse orientée vers la diversité de diols peptidomimétiques
comme inhibiteurs potentiels de protéase ... 125
4.1 Généralités sur le virus de l'immunodéficience humaine (VIH) ... 127
4.2 Les inhibiteurs de la protéase du VIH existants ... 128
4.2.1 Inhibiteurs de première génération ... 128
4.2.2 Inhibiteur de deuxième génération ... 129
4.2.3 Introduction des diols peptidomimétiques non symétriques ... 130
4.3 Synthèses de diols peptidomimétiques à partir des glycosides ... 132
4.3.1 Stratégie de synthèse ... 132
4.3.2 Synthèse de l'intermédiaire commun ... 133
4.3.3 Ouverture de la lactone avec une variété d'amines ... 134
4.3.4 Synthèses des diols peptidomimétiques par fonctionnalisation des amines terminales ... 135
4.4 Conclusion ... 138
5.1 Travaux réalisés et perspectives ... 143
5.2 Mots de la fin ... 150
5.3 Références ... 151
Chapitre 6:
Partie expérimentale ... 153
6.1 General Methods: ... 155
6.2 Chapitre 2: Synthèse de produits naturels apparentés au motif γ‑hydroxybuténolide et nouvelle méthodologie verte ... 156
6.3 Chapitre 3: Synthèse totale de terpénoïdes polycycliques originaux ... 179
6.4 Chapitre 4: Synthèse orientée vers la diversité de diols peptidomimétiques comme inhibiteur potentiel de protéase ... 205
6.5 Références ... 223
Chapitre 7:
Annexes ... 225
Listes des tableaux
Tableau 1. Optimisation des conditions réactionnelles pour l'oxydation aérobie des 2-silyloxyfuranes ... 70
Tableau 2. Gamme de substrat pour l'oxydation aérobie des 2-silyloxyfuranes avec les conditions optimisées .. 72
Tableau 3. Optimisation de la réaction de métathèse de fermeture de cycle à neuf membres ... 106
Tableau 4. Optimisation de la cyclisation 6-endo-dig vs 5-exo-dig; formation du cycle 𝛄-pyrone ... 110
Tableau 5. Données RMN 1H (500 MHz) et 13C (125 MHz) d'ottensidione naturel et synthétique ... 119
Tableau 6. Données RMN 1H (500 MHz) et 13C (125 MHz) d'amomaxin A naturel et synthétique ... 120
Tableau 7. Données RMN 1H (500 MHz) et 13C (125 MHz) d'amomaxin B naturel et synthétique ... 121
Tableau 8. Déprotections des éthers benzyliques et synthèses des sulfonamides ... 136
Listes des schémas
Schéma 1. Révision de structure de l'acide gambiérique A ... 22
Schéma 2. Découverte de la réaction de Diels-Alder ... 23
Schéma 3. Les différents types de métathèses en synthèse organique ... 25
Schéma 4. Représentation schématique des synthèses linéaires, convergentes et divergentes ... 26
Schéma 5. Synthèse divergente des agelastatines par Movassaghi ... 26
Schéma 6. Synthèse biomimétique de la tropinone par Robinson en 1917 ... 27
Schéma 7. Procédé industriel pour la synthèse de Halaven® ... 28
Schéma 8. Séquence réactionnelle utilisée pour la production de l'artémisinine ... 29
Schéma 9. Synthèse du milbemycine G via une réaction de Wittig sur une fonction ‑hydroxybuténolide ... 43
Schéma 10. Addition d'organolithien sur un ‑hydroxybuténolide; synthèses d'analogues de la vitamine D ... 43
Schéma 11. Réaction des amines avec les ‑hydroxybuténolides ... 44
Schéma 12. Synthèse du manoalide par Hoffmann via l'utilisation d'un ‑alkoxybuténolide ... 45
Schéma 13. Épimérisation des ‑hydroxybuténolides par utilisation du (+)-menthol ... 45
Schéma 14. Étude de la réaction de Diels-Alder avec les ‑hydroxybuténolides ... 46
Schéma 15. Préparation des ‑hydroxybuténolides (1/2) ... 47
Schéma 16. Préparation des ‑hydroxybuténolides (2/2) ... 48
Schéma 17. Synthèse des ‑hydroxybuténolides par oxyfonctionnalisation des 2-silyloxyfuranes ... 48
Schéma 18. Synthèse du paracaséolide A par Vassilikogiannakis ... 51
Schéma 19. Synthèse du paracaséolide A par Kraus... 52
Schéma 20. Synthèses du paracaséolide A par Mehta (A), Stark (B) et Nan (C) ... 53
Schéma 21. Synthèse du paracaséolide A par Hoye ... 53
Schéma 22. Route initialement proposée pour la dimérisation menant au paracaséolide A ... 54
Schéma 23. Élucidation de l'état de transition lors de la biosynthèse du paracaséolide A... 55
Schéma 24. Analyse rétrosynthétique et hypothèse d'extension de la biosynthèse du paracaséolide A ... 56
Schéma 25. Analyse rétrosynthétique de l'aldolisation régiocontrôlée via la formation de 2-furanolate de bore 58 Schéma 26. Synthèse totale du cadiolide B via l'utilisation de la réaction d'aldolisation régiocontrôlée... 58
Schéma 27. Synthèse totale du villosin ... 59
Schéma 28. Synthèse du précurseur de la réaction de Diels-Alder ... 60
Schéma 29. Synthèse biomimétique du paracaséolide A ... 61
Schéma 30. Formation de sous-produit pendant la réaction de Diels-Alder ... 61
Schéma 31. Découverte de l'oxydation aérobie des 2-silyloxyfuranes ... 62
Schéma 32. Procédé d'auto-oxydation des molécules organiques ... 64
Schéma 36. Exemples d'oxydations aérobies similaires dans la littérature ... 68
Schéma 37. Isolation et structure cristallographique du ‑hydroperoxybuténolide ... 74
Schéma 38. Confirmation par rayon-X de la formation des composés (Z)‑4‑oxo‑2‑alcénoates de triisopropylsilyle ... 74
Schéma 39. Synthèse de l'antrocinnamomine D et d'antrodia A par oxydation aérobie ... 75
Schéma 40. Mécanisme proposé pour la formation des ‑hydroxybuténolides via l'oxydation aérobie ... 76
Schéma 41. Synthèse du 3-(1-héxynyl)-5-méthylbuténolide 120 ... 76
Schéma 42. Application de l'oxydation aérobie avec la synthèse totale de l'isofugomycine 12 ... 77
Schéma 43. Synthèse de produits naturels de type labdanes par cyclisation biomimétique ... 87
Schéma 44. Fabrication à l'échelle industrielle du sclaréolide et d'Ambrox® ... 89
Schéma 45. Synthèse de l'acide 15-oxopuupehenoique à partir du sclaréol par Alvarez-Manzaneda ... 90
Schéma 46. Synthèse du (+)-zérumin B par Boukouvalas à partir du sclaréolide ... 91
Schéma 47. Synthèse du (+)-auréol à partir du sclaréolide par George ... 91
Schéma 48. Synthèse divergente de plusieurs méroterpénoïdes par Baran via l'utilisation du borono-sclaréolide ... 92
Schéma 49. Formation du cycle à neuf membre de l'acide byssochlanique; (A) fragmentation d'oxime de Beckman et (B) photoaddition cyclo-inversion [2+2] ... 94
Schéma 50. Synthèse du coraxeniolide A par Leumann ... 96
Schéma 51. Synthèse de l'antheliolide A par Corey ... 96
Schéma 52. Synthèse du blumiolide C par Altmann ... 97
Schéma 53. Approche racémique pour la synthèse des amomaxins via une réaction de Michael ... 102
Schéma 54. Tirer profit de la chiralité du sclaréolide pour la fragmentation de Grob/Wharton... 103
Schéma 55. Réaction de Negishi et tentative d'hydroboration... 104
Schéma 56. Fonctionnalisation des chaînes latérales du cyclohéxyle chiral (1/2) ... 105
Schéma 57. Fonctionnalisation des chaînes latérales du cyclohéxyle chiral (2/2) ... 105
Schéma 58. Synthèse de Ottensidione ... 106
Schéma 59. Séparation des diastéréoisomères; assignation par une expérience RMN 2D (NOESY) ... 107
Schéma 60. Synthèse de ottensinin avec formation du cycle ‑pyrone ... 109
Schéma 61. Synthèse d'amomaxin A ... 111
Schéma 62. Formation du cycle buténolide via la méthode de Tanabe ... 112
Schéma 63. Identification des produits formés pendant l'installation de l'unité buténolide ... 113
Schéma 64. Synthèse d'amomaxin B ... 113
Schéma 66. Synthèse de la lactone 233 choisie comme point de divergence pour la formation d'une nouvelle
libraire ... 133
Schéma 67. Ouverture de la lactone avec diverses amines ... 134
Schéma 68. Synthèse biomimétique du paracaséolide A isolé de Sonneratia paracaseolaris ... 144
Schéma 69. Développement d'une méthode verte pour la construction des ‑hydroxybuténolides ... 144
Schéma 70. Amélioration potentielle de l'oxydation aérobie grâce au TEMPO ... 145
Schéma 71. Synthèse unifiée des amomaxins A et B isolées d'Amomum maximum et ottensidione de Zingiber ottensii ... 146
Schéma 72. Stratégie de synthèse totale pour l'étude structurelle du nouveau labdane isolé de Alpinia officinarum et Alpinia oxyphylla ... 148
Schéma 73. Synthèse orientée vers la diversité de diols peptidomimétiques comme inhibiteurs potentiels de la protéase du VIH ... 149
Listes des figures
Figure 1. Produits naturels utilisés depuis la médecine traditionnelle ... 4
Figure 2. Prix Nobel de physiologie ou médecine associés aux produits naturels ... 5
Figure 3. Sélection de produits naturels importants issus de fungi ... 6
Figure 4. Produits naturels issus de plantes intervenant contre diverses pathologies ... 7
Figure 5. Hémisynthèse du Taxol® à partir du Baccatin III ... 8
Figure 6. Hémisynthèse de l'anticancéreux Yondelis® à partir du cyanosafracine B ... 9
Figure 7. Halichondrine B et bryostatine 1 accompagnés de leurs analogues simplifiés ... 10
Figure 8. Structure du sorafendib issu de la chimie combinatoire et approuvé par la FDA en 2005 ... 11
Figure 9. Nouveaux médicaments approuvés entre 1981 et 2014; n = 1211 ... 12
Figure 10. Distribution de la distance euclidienne entre les produits naturels et 3211 médicaments approuvés . 14 Figure 11. Vue globale de la biosynthèse des terpénoïdes dans les plantes ... 15
Figure 12. Exemples de cyclisations enzymatiques à partir du monoterpène GPP ... 16
Figure 13. Exemples de synthase de polycétides; PS, synthase de pyrone; CHS, synthase de chalcone; STS, synthase de stilbène; ACS, synthase d'acridone; BPS, synthase de benzophénone ... 17
Figure 14. Relation entre précurseur et produit final dans la biosynthèse des alcaloïdes. Bleu, indole; gris, quinoline et isoquinoline; rouge, tropane; vert, benzophenanthridine; orange, quinolizidine; jaune, pyridine .... 18
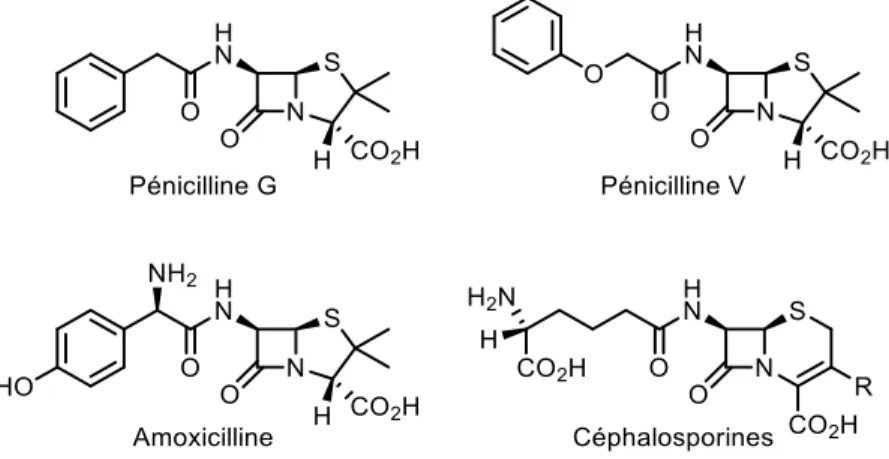
Figure 15. Structures de composés issus de la famille des -lactames ... 19
Figure 16. Structure de la palytoxine ... 21
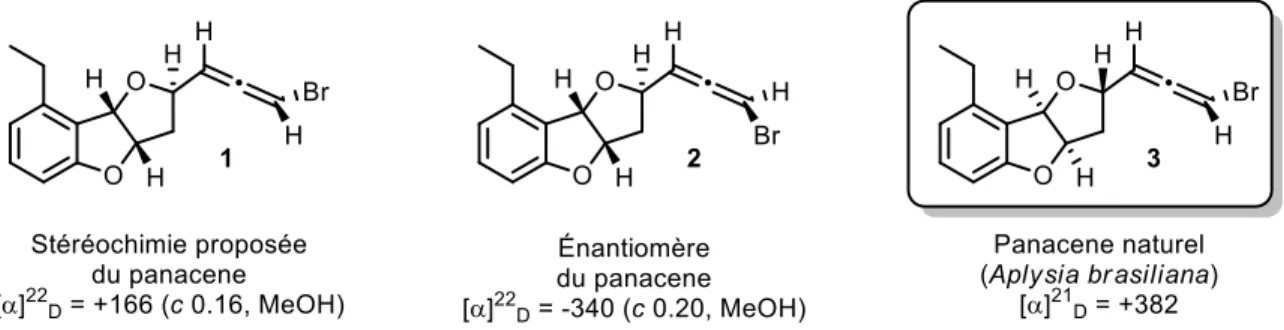
Figure 17. Élucidation de la configuration absolue du panacene par comparaison du pouvoir rotatoire ... 22
Figure 18. Calcul du pourcentage d'idéalité d'une synthèse ... 30
Figure 19. Concept d'économie d'étapes proposés par Wender ... 30
Figure 20. Les objectifs de cette thèse; cibles envisagées et méthodologie de synthèse ... 32
Figure 21. Manoalide (18) et les métabolites reliés isolés de l'éponge marine Luffariella variabilis ... 39
Figure 22. Structure du luffariellolide (22) contenant une unité clé -hydroxybuténolide ... 40
Figure 23. Structure de dysidiolide 23 ... 40
Figure 24. Exemples de l'équilibre tautomérique des -hydroxybuténolides ... 41
Figure 25. Équilibre acido-basique des -hydroxybuténolides ... 42
Figure 26. Structure du paracaséolide A et son monomère; exemples d'-alcénylbuténolides naturels ... 49
Figure 27. Les différents états de l'oxygène moléculaire ... 63
Figure 28. Squelettes de quelques familles de terpénoïdes polycycliques contenant un motif trans-décaline ... 85
Figure 29. Exemples de produits naturels issus de la famille des labdanes accompagnés des leurs activités biologiques ... 86
Figure 33. CP-225,917 et CP-263,114; deux nonadrides complexes aux activités biologiques attractives ... 95
Figure 34. Amomaxins A et B, et isocoronarin D isolés de Amomum maximum ... 98
Figure 35. Composés isolés par Kikuzaki de Zingiber ottensii ... 99
Figure 36. Analyse rétrosynthétique des amomaxins A et B avec révision de structure et ottensidione ... 100
Figure 37. Confirmation de révision de la structure d'amomaxin B par cristallographie des rayons X ... 114
Figure 38. Analyse détaillée des déplacements chimiques en RMN 1H du cas de ottensinin et de la nouvelle structure rapportée, une similarité évidente. ... 115
Figure 39. Comparaison des spectres RMN 1H ... 116
Figure 40. Comparaison des données RMN 13C entre ottensinin naturel et la nouvelle structure rapportée ... 116
Figure 41. Première génération des inhibiteurs de la protéase du VIH... 129
Figure 42. Deuxième génération des inhibiteurs de la protéase du VIH ... 130
Figure 43. Exemples de diols inhibiteurs de la protéase du VIH ... 131
Figure 44. Analyse rétrosynthétique pour la formation des diols peptidomimétiques ... 132
Listes des abréviations
[α] : pouvoir rotatoireAc : acétyle
acac : acétylacétonate ACS : synthase d'acridone
ADN : acide désoxyribonucléique AEC : avant l'ère commune aq : aqueux
Ar : aryle
ARN : acide ribonucléique AROM : aromatique 9-BBN : 9-borabicyclo[3.3.1]nonane BINAP : 2,2’-bis(diphénylphosphino)-1,1’-binaphthyle Bn : Benzyle Boc : tert-butoxycarboxylate BPS : synthase de benzophénone br : broad signal Bu/n-Bu: butyle i-Bu: isobutyle t-Bu : tert-butyle Bz : benzoyle cal : calorie
CAN : nitrate de cérium et d’ammonium cat. : quantité catalytique
CCM : chromatographie sur couche mince CD : dichroïsme circulaire
CDC25 : cycle de division cellulaire 25 CHS : synthase de chalcone
CoA : coenzyme A
Cp : cyclopentadiène/cyclopentadiényle CSA : camphorsulfonic acid
m-CPBA : acide méta-chloroperbenzoïque Cy : cyclohexyle δ : déplacement chimique d : doublets (spectres RMN) Da : Dalton dba : dibenzylidèneacétone DBU : 1,8-diazabicyclo[5.4.0]undéc-7-ène DCC : dicyclohexylcarbodiimide DCE : 1,2-dichloroéthane DCM : dichlorométhane
DEAD : diéthyl azodicarboxylate DFT : transformation de Fourier discrète DHP : dihydropyrane
DIAD : diisopropyle azodicarboxylate DIBAL : hydrure de diisobutylaluminium 4-DMAP : 4-(diméthylamino)pyridine DMAPP : diméthylallyle diphosphate
DMDO : diméthyldioxirane DME : 1,2-diméthoxyéthane DMF : diméthylformamide DMP : Dess-Martin périodinane DMSO : diméthylsulfoxyde
DOS : synthèse orientée vers la diversité dppf : 1,1’-bis(diphenylphosphino)ferrocène dppp : 1,3-bis(diphénylphosphino)propane dr : ratio diastéréoisomérique
DTS : synthèse totale divergente
(R)-dtbm-Segphos : (R)-(−)-5,5′-bis[di(3,5-di- tert-butyl-4-methoxyphenyl)phosphino]-4,4′-bi-1,3-benzodioxole Dtbpf : 1,1′-bis(di-tert-butylphosphino)-ferrocene DXT : phosphate de déoxyxylulose ee : excès énantiomérique
E1cB : élimination avec un intermédiaire carbanionique
E2 : élimination concertée bimoléculaire ED : distance euclidienne
EDC : 1-éthyl-3-(3-diméthylaminopropyl)-carbodiimide
équiv./equiv : nombre d’équivalents EMEA : agence Européenne de la médecine ESI : electrospray ionisation
Et : éthyle
FDA : Food and Drug Administration FPP : diphosphate de farnésyle
FOS : synthèse orientée vers la fonction g : gramme
GFPP : diphosphate de farnésylgéranyle GGPP : diphosphate de géranylgéranyle PG : groupement protecteur (protecting group) GPP : diphosphate de géranyle
h : heure
HBA : accepteur de liaison hydrogène HBD : donneur de liaison hydrogène HG : catalyseur de Hoveyda-Grubbs HMDS : hexaméthyldisilazane HMPA : hexaméthylphosphoramide
HPLC : chromatographie liquide haute performance
HRMS : spectrométrie de masse haute résolution
HTS : cribblage à haut débit (high-throughput screening)
IPP : isopentényl diphosphate IR : spectroscopie infrarouge
J : constante de couplage (spectres RMN) k : kilo
KAPA : 3-aminopropylamidure de potassium LAB : lithium ammonia borane
LDA : diisopropylamidure de lithium lit. : littérature
LiTMP : 2,2,6,6-tétraméthylpipéridide de lithium
LogP : coefficient de partition octanol/eau m : multiplet (spectres RMN), milli M : molaire max : maximum Me : méthyle MHz : mégahertz min : minute mol : moles
mp : point de fusion (melting point) Ms : méthanesulfonyle (mésyle) MVA : acide mévalonique
MVK : cétone de méthyle et de vinyle MW : masse molaire
m/z : rapport masse/charge N : normal (normalité) NBS : N-bromosuccinimide NCE : nouvelle entité chimique NIS : N-iodosuccinimide nm : nanomètre
NMP : N-méthyl-2-pyrrolidone
NMR : nuclear magnetic resonance
spectroscopy NO : oxide nitrique
NPSP : N-(phénylseleno)phthalimide PCC : chlorochromate de pyridinium Ph : phényle
PIs : inhibiteurs de protéase PIDA : diacétate d’iodobenzène pin : pinacol/pinacolyle
PLA2 : phospholipases A2
PNs : produits naturels ppm : partie par million
PPTS : p-toluene sulfonate de pyridinium Pr : propyle
i-Pr : isopropyle PS : synthase de pyrone PSA : aire de la surface polaire PTFE : polytétrafluoroéthylène PTP : protéines tyrosines phosphatases
QED : estimation quantitative de la ressemblance aux médicaments
quant. : quantitatif
RCM : métathèse de fermeture de cycle ref. : référence
Rf : facteur de rétention (chromatographie) RMN : spectroscopie à résonance magnétique nucléaire
rt : température ambiante (room temperature) RTB : liaison libre de rotation
RTIs : inhibiteurs de transcriptase inverse s : singulets (spectres RMN)
SAR : relation structure-activitée SEM : 2-(triméthylsilyl)éthoxyméthyle
SIDA : syndrome de l'immunodéficience acquise
SN2 : substitution nucléophile bimoléculaire
SN2’: substitution nucléophile avec
réarrangement allylique STS : synthase de stillbène t : triplet (spectres RMN) TA : température ambiante
TAHA : traitement antirétroviral hautement actif (HAART)
TBAF : fluorure de tétrabutylammonium TBS : tert-butyldiméthylsilyle
TBDPS : tert-butyldiphénylsilyle
TEMPO: 2,2,6,6-tetramethyl-1-pipéridinyloxy Tf : trifluorométhanesulfonyle (triflyle) TFA : acide trifluoroacétique
TFE : trifluoroéthanol
TFAA : anhydride trifluoroacétique TFEF : 2,2,2-trifluoroéthyle formate THF : tétrahydrofurane
THP : tétrahydropyranyle TIPS : triisopropylsilyle TMS : triméthylsilyle tol : tolyle, toluène
TOS : synthèse orientée vers la cible TPP : tétraphénylporphyrine
Ts : para-toluènesulfonyle (tosyle) μ : micro
UV : ultra-violet
VIH : virus de l'immunodéficience humaine Xantphos : 4,5-bis(diphénylphosphino)-9,9-diméthylxanthène
Remerciements
Tout d'abord, j'aimerais accorder mes sincères remerciements au professeur John Boukouvalas avec qui j'ai eu l'immense plaisir à travailler pendant près de cinq ans. Il a été mon directeur de recherche mais également une personne avec qui j'ai pu avoir des échanges captivants, grâce aux partages de ses connaissances et de ses expériences. Ses brillantes idées ont donné naissance à des projets pour lesquels je me suis passionnés et son souci du détail m'a permis d'augmenter considérablement mes aptitudes et mes compétences
Je souhaiterais également remercier le professeur Denis Giguère pour m'avoir offert la possibilité de travailler en sa collaboration sur un projet remplis de surprise et de rebondissement. Je remercie, bien entendu, le docteur Paresh M. Vadhadiya, stagiaire postdoctoral en ce temps, avec qui j'ai collaboré pendant toute la durée de ce projet. Cela a été un plaisir de le connaître et de partager nos idées et nos connaissances.
Je tiens à remercier l'Université Laval et son département de chimie pour m'avoir offert la possibilité de réaliser mon doctorat, mais également, toutes les personnes qui s'y rattache et que j'ai eu le plaisir de côtoyer toutes ces années. J'aimerais m'attarder sur mes collègues proches avec qui j'ai partagé énormément pendant ces heures innombrables de travail. Ramesh, we started our PhD a few weeks apart, we have been following these years through predocs and seminars and now we are going to defend at close dates. During all this time, you became a sincere friend with whom I had the pleasure to share and laugh. You also allowed me to better understand India and its culture and I hope to have the opportunity to visit your country with you. I wish you all the best for the future and I hope that our paths will recross sooner or later. Vinz, te remercier ne serait pas suffisant tellement tu as eu une importance considérable dans ma vie ces dernières années. Je crois que les mots sont presque inutiles pour dire à quel point je te considère comme un de mes plus cher amis, tu as été le premier à m'accueillir à bras ouvert lors de mon arrivé au Québec avec ma French attitude et mon bonnet! Depuis ce jour, on a appris à se connaître, on a partagé beaucoup de chose personnel, d'activités et de passion et cela a été un immense plaisir et un honneur d'être le témoin de ton union avec Carolyn. Même si la distance nous a éloigner quelque peu, je suis absolument certain que l'on continuera cette belle amitié et pourquoi pas, retravailler ensemble dans un autre lieu, pour une autre chimie, afin de reformer l'équipe de choc! Je tiens également à remercier Charles pour toutes ces discussions captivantes. Tu es un homme d'expérience et c'est un plaisir de t'avoir comme ami. Un remerciement pour Raph avec sa bonne humeur contagieuse et pour toutes les choses quotidiennes qu'il faisait au laboratoire, sans même que personnes
L'université est un cycle perpétuel, les anciens partent et les nouveaux arrivent. La réalisation d'un doctorat est une expérience enrichissante et éprouvante certes, mais elle permet de se découvrir soi-même, de partager des connaissances et des expériences et de réaliser de nombreuses rencontres. Je remercie donc tous les personnes (et la liste est longue) que j'ai eues la chance et le plaisir de découvrir qu'ils soient Québécois, Français, Indiens, Russes, Mexicains, Colombiens, Brésiliens ou encore Vénézuéliens. Je tiens à remercier particulièrement Jeff, Clément et Vincent pour leur soutien quotidien pendant mes recherches et l'écriture de cette thèse.
Je remercie également Jean‑Christophe et Claudia pour leur soutien omniprésent depuis mes débuts au Québec. Merci à vous deux pour votre générosité et à cette soirée spaghetti qui a définitivement marqué le départ d'une grande amitié. Je souhaite que cette dernière dure éternellement car vous êtes deux personnes formidables.
Enfin, je souhaiterais exprimer toutes ma gratitude envers ma famille qui a toujours était présente à mes côtés et qui ont toujours cru en moi depuis tant d'années. Je les remercie du fond du cœur pour avoir accepté mon choix de m'expatrier et pour avoir fait de moi la personne que je suis actuellement. Je remercie ma mère Roselyne pour l'amour qu'elle me porte et sa force de caractère exemplaire et pour qui j'ai une admiration incommensurable, mon père Christian, pour son soutien omniprésent, sa joie de vivre et toutes les valeurs qu'il a sues me transmettre, et enfin, mon frère Yoann, pour qui j'ai le plus grand respect et qui a toujours été à mes côtés depuis le tout début.
Le meilleur est pour la fin, j'aimerais témoigner ma reconnaissance et mon amour pour la personne qui représente absolument tous à mes yeux, ma fiancée et amie Doriane. Je te remercie pour m'avoir accompagné tout au long de ce périple, pour m'avoir aidé dans les moments plus difficile, soutenu dans les périodes importantes et ceux jusqu'à la rédaction de cette thèse. Je te remercie également pour ton amour au quotidien, ta joie de vivre et ta bonne humeur. Je nous souhaite, à tous les deux, que nos vies soient remplies de bonheur, que l'on puisse fonder une famille et être heureux jusqu'à nos vieux jours.
Épigraphe
"That's one small step for a man, one giant leap for mankind"
1.1 Les produits naturels au cœur de l'action
1.1.1 Médecine traditionnelle
Depuis des milliers d'années, l'Homme fait appel à la nature pour répondre à ses besoins vitaux, parmi lesquels, l'utilisation de remèdes naturels afin de traiter un vaste éventail de maladies. Les plantes, en particulier, ont été la base de la médecine traditionnelle.1, 2 les livres anciens ont été minutieusement
étudiés et ont permis de dater les premières utilisations de plantes médicinales sous forme d'huile, d'infusion ou de pommade. En 2600 AEC, environs 1000 substances à base de plantes ont été documentées en Mésopotamie, beaucoup sont encore utilisés de nos jours comme traitement contre le rhume et la toux en passant par les infections parasitaires et les inflammations. La médecine égyptienne date d'environ 2900 AEC et la découverte du papyrus Ebers (un des plus anciens traités médicaux d'Égypte) datant de 1500 AEC répertorie 700 composés médicamenteux (e.g. safran, aloès ou chanvre) pour la plupart originaire de plantes. La médecine traditionnelle chinoise, ayant fait ses preuves depuis de nombreuses années, date d'environ 1100 AEC. De nombreuses études ont été réalisées afin d'expliquer et mieux comprendre l'efficacité de cette pratique. Par exemple, la comparaison des propriétés physico-chimiques de médicaments actuels ou en études cliniques, pour le traitement de la maladie de Parkinson et d'Alzheimer, a démontré une parfaite corrélation avec les composés utilisés dans la médecine traditionnelle chinoise.3
Les produits naturels sont le fruit de millions d'années d'évolution des organismes terrestres et marins. Pour une majorité d'entre eux, ils ont été conçus pour être bioactif; avec le temps, ils ont été utilisés comme traitement contre diverses maladies et continuent aujourd'hui à être une source de médicaments potentiels. Parmi les exemples les plus célèbres utilisés en médecine traditionnelle, on retrouve bien évidemment l'acide acétylsalicylique (aspirine) dérivé de la salicyline qui possède des activités anti-inflammatoires. La quinine, rapportée par les chimistes français Joseph Pelletier et Joseph Caventou en 1820 et approuvé par la FDA (Food and Drug Administration) en 2004, a été largement utilisée comme traitement contre la malaria, la fièvre, l'indigestion, les maladies de bouche et de gorge ou encore le cancer. Enfin, la morphine fût découverte en 1804 intervenante comme médicament contre la douleur (Figure 1).1, 2
Figure 1. Produits naturels utilisés depuis la médecine traditionnelle
Le nombre d'espèces de plantes sur la planète est estimé à 250 000 et l'étude de leurs activités biologiques a été réalisée sur seulement 6% d'entre eux. Avec les méthodes modernes permettant d'évaluer à grande échelle les extraits de plantes, ce nombre aura une forte tendance à évoluer au cours des prochaines années. Le problème qui persiste est la difficulté à sélectionner une espèce par rapport à une autre afin d'en retirer les composés actifs. Les plantes ont un avantage dans ce domaine puisqu'elles ont été utilisées par l'homme depuis une longue période pour le maintien et la prévention de la santé afin d'améliorer ou de traiter des maladies physiques ou mentales.4
1.1.2 Historique des produits naturels
Avec les avancements dans le domaine de la chimie à l'aube du 19ième siècle, le profil thérapeutique des
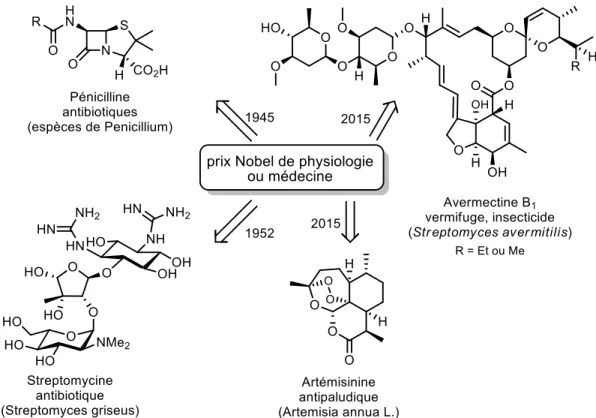
plantes a été minutieusement étudié ce qui, historiquement, entraîna les apothicaires suivis des compagnies pharmaceutiques à utiliser des extraits de plantes pour produire des formules thérapeutiques et ce, jusqu'au milieu du 20ième siècle.5 En 1945, le prix Nobel de physiologie ou médecine a été attribué
à Alexander Fleming, Ernst B. Chain et Howard Florey pour la découverte de la pénicilline et celui de 1952 à Selman A. Waksman pour la découverte de la streptomycine. Il s'en est suivi une période, allant de 1950 à 1960, connue sous le nom d'âge d'or des antibiotiques. Récemment, ce même prix Nobel de physiologie ou médecine a honoré conjointement en 2015 William C. Campbell et Satoshi Omura pour leurs travaux concernant l'avermectine et Youyou Tu pour la découverte de l'artémisinine comme traitement contre le paludisme (Figure 2). Ainsi, plusieurs personnes s'entendent à dire que nous entrons dans un "nouvel âge d'or des produits naturels".6
Figure 2. Prix Nobel de physiologie ou médecine associés aux produits naturels
Le temps qui s'est écoulé entre ces deux périodes aura permis la découverte, l'isolation, la caractérisation et/ou l'étude du profil biologique de nombreux produits naturels provenant d'espèces ou d'environnements variés (terrestres ou marins), parmi eux, certains sont utilisés comme traitements médicaux contre diverses pathologies.
1.1.2.a Produits naturels provenant des fungi (champignons)
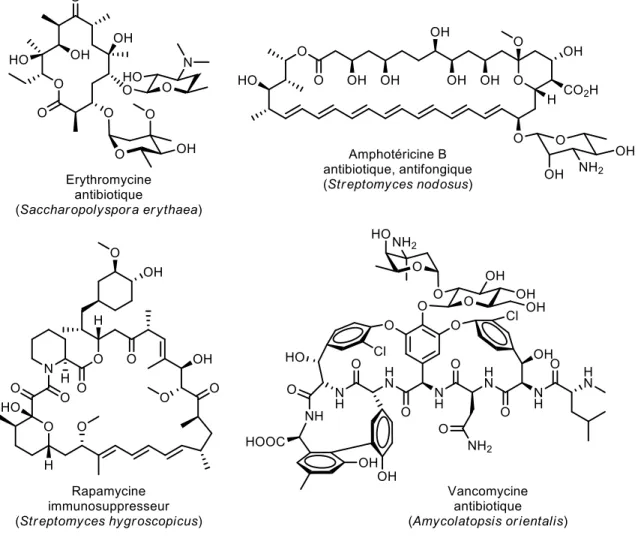
Les fungi sont une source prolifique de métabolites bioactifs possédant des structures diverses et variées et ont permis la découverte et la commercialisation de plusieurs composés pharmaceutiques (Figure 3). Parmi les plus célèbres, on retrouve l'érythromycine, un macrocycle à 14 membres, utilisé comme antibiotique à large spectre notamment pour les personnes allergiques à la pénicilline et dans certains cas d'infections respiratoires. La première synthèse totale a été réalisée par Woodward en 1981.7
L'amphotéricicine B appartient à la famille des polyènes et est célèbre pour ses activités antifongiques. En 1987, Nicolaou et coll. achèvent élégamment la première synthèse totale mettant en valeur, à l'époque, la réaction d'époxydation asymétrique de Sharpless.8 Le rapamycine a été isolé en 1975 par
une équipe de recherche canadienne sur l'île de Pâque au Chili. Considéré au départ comme un antibiotique, il est très vite reconnu comme immunosuppresseur. Cette grande découverte aura permis une avancée fulgurante, dans les années 1980, dans le domaine de la transplantation d'organe afin de
prévenir du rejet.9 Sa première synthèse a été rapportée en 1993 par trois groupes de recherche
(Nicolaou, Schreiber et Danishefsky).10 Enfin, la vancomycine est un antibiotique, appartenant à la
famille des glycopeptides, qui a été isolée en 1953 et dont la structure a été élucidée en 1982. En cette période, ce composé a attiré l'attention des scientifiques du fait de son architecture complexe, son application médicale, mais également son mécanisme d'action intriguant. Les chimistes de synthèse ont vu une opportunité unique de développer des stratégies et technologies de synthèse nouvelles.11 En effet,
sa structure inclut deux éthers macrocycliques à 16 membres et un macrocycle biaryle à 12 membres impliquant une contrainte atropisomère. En 1998, les groupes de Evans12 et Nicolaou13 rapportent deux
synthèses de l'aglycone et en 1999, Nicolaou a publié la première synthèse totale de la vancomycine.14
Figure 3. Sélection de produits naturels importants issus de fungi
Ces quatre composés représentent un exemple très restreint des nombreux produits naturels, issus des fungi, démontrant des activités biologiques diverses. Parmi eux, on peut également citer la tétracycline (antibiotique bactériostatique), la doxorubicine (anticancéreux utilisé en chimiothérapie), le lovastatine (agent hypocholestérolémiant) ou encore la cyclosporine et le FK506 (immunosuppresseur).
1.1.2.b Produits naturels isolés de plantes
Les plantes ont évolué et se sont adaptées depuis des millions d'années en présence de bactéries, d'animaux, de fungi et du climat pour produire des métabolites secondaires uniques et structurellement diversifiés. D'après l'organisation mondiale de la santé (WHO, World Health Organisation), 80% des personnes ont encore recourt à la médecine traditionnelle basée sur les plantes.2 Ils existent
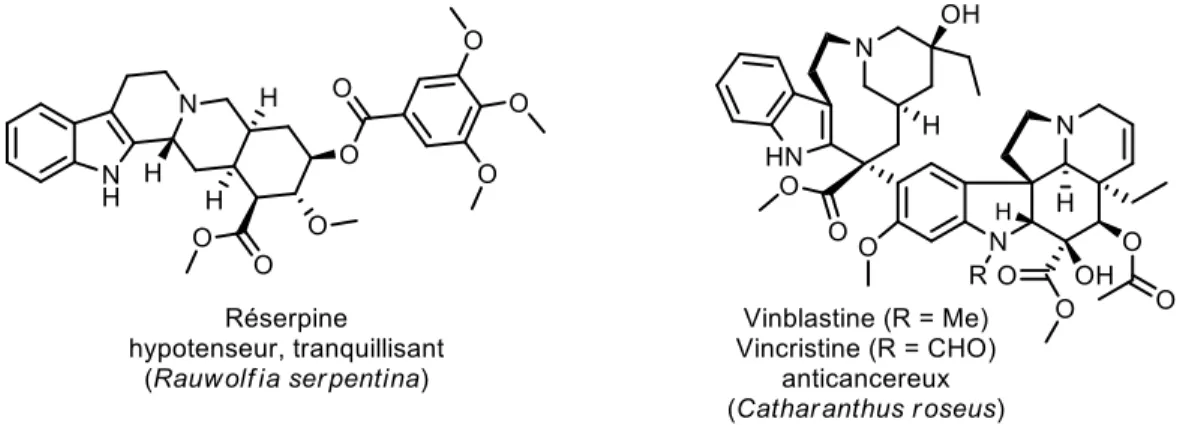
probablement des centaines voire des milliers de produits naturels issus de plantes qui présentent des activités biologiques aussi intéressantes les unes que les autres. La quinine, la morphine et l'artémisinine, que l'on a rencontré précédemment, font partie des meilleurs exemples. D'autres produits naturels ont également fait leur preuve les conduisant ultimement au stade de médicament (Figure 4). La réserpine, isolée en 1952 et dont la structure a été élucidée en 1955, est utilisée aussi bien comme traitement contre l'hypertension que pour les troubles nerveux et mentaux.11 La première synthèse de la réserpine a été
réalisée par nul autre que Woodward en 1958.15 Un bon nombre de personnes s'entendent à dire que
c'est l'une des plus belles contributions du professeur Woodward quant à la manière dont celle-ci a été réalisée. Il a démontré le potentiel de la réaction de Diels-Alder afin de construire un cycle à six membres hautement fonctionnalisés, contrôlé la stéréochimie autour de ce même cycle et induit une épimérisation désirée en contraignant la molécule à adopter une conformation non favorable.
La plante Catharanthus roseus est très appréciée pour sa diversité de plus de 130 alcaloïdes d'indole monoterpénoïde et a été intensivement étudié pour l'amélioration du profil médical des plantes. On y retrouve des composés tel que la vinblastine et la vincristine qui ont une valeur économique forte due à leur utilisation comme médicament de chimiothérapie contre plusieurs types de cancer.16 La demande
annuelle ne cesse d'augmenter d'année en année alors que le procédé industriel continue de faire face à des problèmes. Naturellement, ces deux composés sont produits en très faible quantité, environ 0,0003% des 2,56% d'alcaloïdes issus de Catharanthus roseus.
Actuellement, la production de la vinblastine et la vincristine se fait par extraction de la plante ce qui a pour effet de consommer beaucoup de biomasses. Des méthodes alternatives comme la culture in vitro de cellules et de tissus, jouant un rôle dans la biosynthèse de ces deux métabolites secondaires, sont en cours d'étude.17 Les premières synthèses totales de ces deux alcaloïdes ont été réalisées par Potier en
1976.18
Le paclitaxel (Taxol®), l'un des plus célèbres produits naturels, a été isolé de l'écorce de l'if du Pacifique
(Taxus brevifolia) et sa structure a été élucidée en 1971 (Figure 5).19 La découverte de son mode d'action
en 1979 aura permis une grande avancée quant à son utilisation. Finalement, le Taxol® a été approuvé
par la FDA en 1992 pour le traitement du cancer des ovaires et en 1994 pour le cancer du sein.1
L'architecture complexe du produit naturel, possédant un fort encombrement, est venue défier les chimistes de synthèse. Plusieurs groupes ont travaillé intensivement pendant une vingtaine d'années, et c'est finalement, en 1994, que Nicolaou20 et Holton21 rapportent simultanément la synthèse totale du
Taxol®. Bien que celle-ci ait contribué à l'avancement et l'examen du profil biologique et médical, elle
ne peut être considérée comme une solution quant à la production. L'isolation à grande échelle n'est pas possible également, car elle serait destructrice de la nature. En effet, il faut trois arbres matures de plus de 100 ans pour produire un gramme de Taxol® alors que le traitement d'une personne requiert environ
deux grammes de médicament (ce qui amène à une consommation de 100-200 kg par an, soit 50 000 traitements/année). La solution à ce problème est l'utilisation du baccatin III, isolé en plus grande quantité de la même espèce, comme produit de départ pour la synthèse du Taxol®.
Figure 5. Hémisynthèse du Taxol® à partir du Baccatin III
Le succès du paclitaxel aura permis d'étendre les études pour la synthèse d'analogues comme le docetaxel (Taxotère®) et le cabazitaxel (Jevtana®). Tous deux ont été approuvés comme agent
1.1.2.c
Produits naturels issus d'un environnement marin
Bien que les plantes aient prouvé être une source de produits naturels bioactifs inédits, les environnements marins ont le potentiel d'offrir de nouvelles entités structurelles. En effet, les océans couvrent plus de 70% de la surface de la planète et représentent une ressource énorme de médicaments potentiels. L'introduction de la plongée sous-marine dans les années 1970 et les évolutions technologiques qui en découlent, comme l'utilisation de véhicules sous-marins téléguidés, ont permis l'exploration de plus en plus profonde des océans résultant dans la découverte de milliers de structure unique de produits naturels marins. Parmi tous les composés bioactifs rapportés depuis une trentaine d'années, 56% présente des activités anticancéreuses.23 L'ecteinascidine 743, plus connu sous son nom
commercial Yondelis® et aussi nommé trabectedine, a été approuvé en 2007 par l'agence européenne
des médicaments (EMEA, European Medecines Agency) pour le traitement des sarcomes des tissus mous et en 2009 pour la récidive du cancer des ovaires. Il est actuellement dans plusieurs essais cliniques allant de la phase I à III dans plusieurs pays pour le traitement de divers cancers.1, 2 Incité par son
architecture inhabituelle, incluant 8 cycles, un hétérocycle à 10 membres et 7 centres chiraux, ses activités biologiques et sa faible abondance, le professeur Corey réalise en 1996 la première synthèse totale de l'ecteinascidine 743.24 Afin de subvenir au besoin matériel, un procédé semi-synthétique a été
développé débutant avec le cyanosafracine B, un antibiotique obtenu par fermentation de la bactérie Pseudomonas fluorescens, permettant la synthèse de l'ecteinascidine 743.25
Figure 6. Hémisynthèse de l'anticancéreux Yondelis® à partir du cyanosafracine B
D'autres exemples de produits naturels issus d'un environnement marin incluent l'halichondrine B, un polyéther complexe isolé en très faible quantité de plusieurs sources d'éponges, et bryostatine 1, un autre macrolide complexe possédant un macrocycle à 20 membres et 10 centres chiraux (Figure 7). Ces deux composés présentent de très fortes activités biologiques, notamment anticancéreuses.26 Bien que leurs
bryostatine 128, elles ne peuvent être une solution commerciale envisageable pour le développement du
médicament, dû principalement à la complexité structurelle. Heureusement, des études ont révélé que la partie droite macrocyclique de l'halichondrine B retient en quasi-totalité le potentiel thérapeutique. Ainsi, basée sur les travaux de Kishi, la compagnie pharmaceutique japonaise Eisai a développé plusieurs analogues résultant en la sélection de l'éribuline mésylate (Halaven®) qui fût approuvé par la
FDA en 2010 comme traitement du cancer du sein métastasique.29 De la même manière, l'analogue
simplifié, plus communément appelé bryologue, de la bryostatine 1 a été mis en place par Paul Wender via la synthèse de fonction orientée (FOS, Function-Oriented Synthesis).30 Il conclut que la partie nord
comprenant les deux cycles permet de verrouiller la position des oxygènes clés de la partie sud (entouré en pointillé, Figure 7), considéré comme responsable de la réponse biologique. Ainsi, le composé peut être simplifié sans engendrer une perte d'activité, ceci a pour effet de réduire de plus de la moitié le nombre d'étapes pour le synthétiser.
Figure 7. Halichondrine B et bryostatine 1 accompagnés de leurs analogues simplifiés
De manière générale, les produits naturels sont isolés et leurs structures sont élucidées. Bien qu'ils présentent des activités biologiques variées, cela ne veut pas dire que les structures qui y sont associées sont parfaites, ces dernières peuvent être modifiées ou simplifiées afin d'établir une libraire d'analogue
qui est ensuite testé. L'objectif est d'améliorer au maximum le potentiel d'un produit naturel, mais également d'améliorer des paramètres comme sa toxicité, sa sélectivité, sa lipophilicité ou sa biodisponibilité. Cela permet également de raccourcir le nombre d'étapes de synthèse afin d'optimiser sa production.26, 31
1.1.3 Les compagnies pharmaceutiques et leur relation avec les
produits naturels
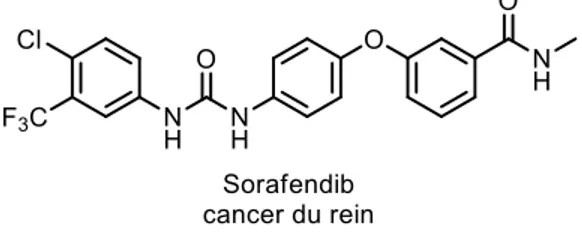
Historiquement, les produits naturels ont été une source très riche de composés pour la découverte de médicaments. Après l'âge d'or des antibiotiques, les compagnies pharmaceutiques ont lancé leurs programmes de découverte de médicaments à partir des produits naturels, ces programmes auront permis la mise sur le marché d'un grand nombre de médicaments ciblant toutes sortes de maladies. Toutefois, un grand nombre de ces compagnies ont fermé leurs programmes au début des années 1990 pour laisser place au criblage à haut-débit (HTS, High-Throughput screening) et à la chimie combinatoire. Ils pensaient que ces techniques seraient suffisantes pour fournir tous les composés nécessaires afin de garantir la découverte de molécule tête de série (en anglais : lead compound). Ceci n'a clairement pas été le cas, car une seule nouvelle entité chimique (NCE, New Chemical Entity), issue de la chimie combinatoire, a été approuvée par la FDA, s'agissant du sorafendib en 2005 visant le cancer du rein (Figure 8).2
Figure 8. Structure du sorafendib issu de la chimie combinatoire et approuvé par la FDA en 2005
En revanche, la chimie combinatoire aura permis le développement de milliers de nouvelles entités chimiques pouvant être utilisé lors de la synthèse d'analogue structurelle. De nombreuses personnes reconnaissent que la complexité architecturale que fournit un produit naturel est plus importante que la taille de la librairie de composé.32 De ce fait, le concept de synthèse de diversité orientée (DOS,
Diversity-Oriented Synthesis) a été adopté permettant aux chimistes de synthétiser des composés qui ressemblent ou qui sont dérivés des produits naturels. Ces composés sont ensuite testés biologiquement afin de déterminer leurs rôles en tant que nouveaux médicaments potentiels.
Une analyse détaillée des nouveaux médicaments approuvés par la FDA (et autres organisations similaires) entre 1981 et 2014 a révélé que la moitié de ces médicaments était en relation directe avec les produits naturels (PNs) (Figure 9).33 Ils ont montré que 33% des médicaments actuels étaient inspiré
ou dérivé des produits naturels (où N = PNs non-modifiés, NB = PNs issus de la botanique, ND = dérivés de PNs), 18% étaient des composés synthétiques avec un pharmacophore de PNs (S*) et enfin 49% étaient purement synthétique (S). Ces statistiques concernent les petites molécules, n'incluant pas les catégories des vaccins et des composés biologiques (comme les peptides ou les protéines). L'utilisation des produits naturels a diminué au cours des deux dernières décennies également en raison des barrières techniques que présentait le HTS envers les produits naturels pour des cibles spécifiques.34
Plus précisément, les extraits naturels (terrestres ou marins) étaient analysés via des essais biologiques et cela conduisaient régulièrement à l'isolation de produits naturels déjà connus et indésirables, on appelle ce phénomène : la déréplication.35 Par ailleurs, ces extraits sont des mélanges compliqués. Tous
les constituants ont le potentiel d'interagir avec la cible biologique, d'autres sont en trop faibles quantités pour induire une réponse positive ou bien l'effet synergique de plusieurs composés peut fausser les résultats. L'isolation de chaque composé d'un extrait brut dans le but de les analyser par la suite serait une méthode trop onéreuse dans le cadre de plusieurs extraits. Avec les méthodes récentes de séparation et d'analyse36 (HPLC, HRMS, IR et RMN), il est possible de simplifier les extraits afin de les rendre
plus adaptés pour les essais biologiques et ainsi favoriser la découverte de nouveaux composés tête de série. Avec ces méthodes, il est donc possible de détecter à un stade précoce de l'essai si le composé responsable de l'activité biologique observée est connu, cela permet de préserver les extraits naturels précieux qui peuvent être utilisés pour d'autres recherches.
Les propriétés physico-chimiques des molécules bioactives sont très importantes quant à leurs devenir en tant que médicaments. La très célèbre règle des 5 de Lipinski et coll., établie en 1997, permet de prédire de manière très simple l'absorption orale d'un composé, mais également sa ressemblance en tant que médicament potentiel (en anglais : drug-likeness).37 Cette règle, largement utilisée par les
compagnies pharmaceutiques, se compose de 4 critères applicables pour un composé donné : (i) le poids N; 67; 6% NB; 9; 1% ND; 320; 26% S; 592; 49% S*; 223; 18% N NB ND S S*
moléculaire doit être inférieur à 500 (MW < 500 Da), (ii) le nombre de donneurs de liaison hydrogène doit être inférieur à 5 (HBD < 5), (iii) le nombre d'accepteurs de liaison hydrogène doit être inférieur à 10 (HBA < 10) et (iv) le calcul logarithmique du coefficient de partition entre le 1-octanol et l'eau (représentatif de la lipophilicité) doit être inférieur à 5 (LogP < 5). Malgré les résultats prometteurs de cette règle, de plus en plus d'exemples de médicaments actuellement sur le marché viennent la contredire (le Taxol® en est un parfait exemple). Depuis le papier de Lipinski, les chimistes médicinaux sont
devenus plus attentifs aux propriétés physico-chimiques que devait présenter un composé candidat notamment au niveau de l'absorption, la distribution, le métabolisme, l'excrétion et la toxicité (ADMET). De nouvelles propriétés sont donc venues se rajouter, ainsi plusieurs groupes de recherche ont analysé des centaines voire milliers de médicaments approuvés afin d'obtenir un modèle de prédiction plus juste.38 Parmi ces propriétés additionnelles, on retrouve le nombre de liaisons rotatives (RTB : rotatable
bonds) et la surface polaire de la molécule (PSA : polar surface area) qui sont apparus dans un premier temps. Par la suite, Hopkins et coll. ont proposé une formule mathématique composée de 8 propriétés : les 4 de Lipinski, RTB, PSA, le nombre de cycle aromatique (AROM) et une alerte structurelle correspondant au nombre de groupements connus pour engendrer de la toxicité (ALERT). Cette formule associe au composé un nombre allant de 0 à 1 et permet une estimation quantitative de la ressemblance d'une molécule à un médicament aussi baptisé QED (quantitative estimate of drug-likeness).39 Enfin, le
nombre d'atomes de carbones tétraédriques (Fsp3) et le nombre de centres stéréogènes (Chiral) sont venus compléter la liste et permettent en partie d'expliquer la défaite vécue par la chimie combinatoire associée au HTS.32 Tous ces paramètres associés ont le potentiel d'améliorer la prédiction de la
biodisponibilité orale et la ressemblance d'un composé à un médicament potentiel. La règle de Lipinski peut être trompeuse, car un composé indésirable peut passer le test en remplissant les 4 critères alors qu'un composé potentiellement meilleur peut échouer, car il manque à une seule des règles. On peut donc imaginer, au vu des exemples de médicaments approuvés, que de nombreux produits naturels ne sont pas étudiés par les compagnies pharmaceutiques à cause d'un simple test. La prise en considération des propriétés présentées ci-dessus peuvent apporter une amélioration dans la sélection des composés bioactifs en vue des essais cliniques.
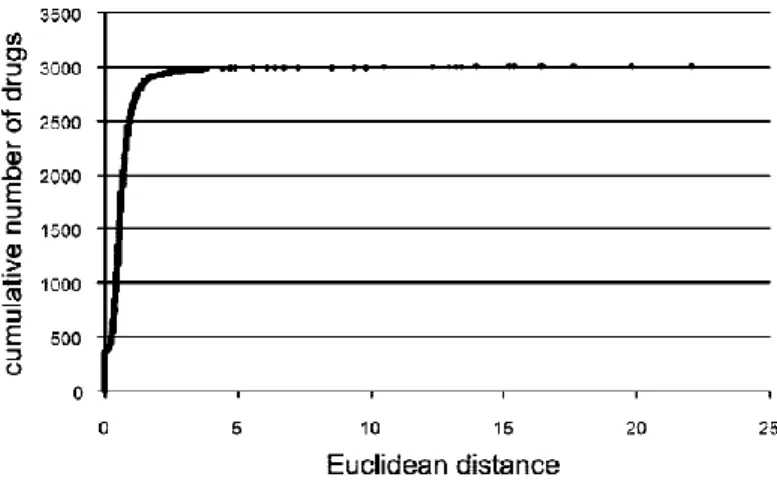
Un autre avantage que les produits naturels ont par rapport à leurs homologues synthétiques est l'espace chimique qu'ils occupent. Une étude a été réalisée permettant de comparer les distances euclidiennes (ED) dans l'espace chimique de médicaments avec tous les produits naturels répertoriés dans le dictionnaire des produits naturels.40 Cette analyse, faite sur 3211
médicaments, a révélé que 99.5% des médicaments ont un produit naturel voisin avec un ED = 10, et que 85% de ces médicaments ont un produit naturel voisin avec un ED = 1, où ED = 0 correspond à une superposition parfaite. Ceci indique que les produits naturels avec un ED proche de celui du médicament approuvé peuvent être potentiellement des composés tête de série envers la même cible. Cette analyse amène également un argument fort que les produits naturels sont une source d'inspiration pour la chimie médicinale.
1.1.4 Structure et biosynthèse
L'ensemble des réactions chimiques qui se déroulent dans un organisme est appelé métabolisme, c'est un processus très dynamique où les molécules sont en continuel renouvellement. La composition d'une cellule à un instant donné est un équilibre entre synthèse et dégradation.41 Bien que les organismes
vivants possèdent des caractéristiques extrêmement variées, les mécanismes misent en jeu dans les organismes sont sensiblement identiques.42 La biosynthèse et la dégradation des protéines, des lipides,
des acides nucléiques et des glucides sont connues comme le métabolisme primaire, tous les composés qui sont impliqués dans ce processus sont définis comme métabolites primaires, ils sont essentiels pour la croissance et la survie de tout organisme vivant. En revanche, lorsque ces organismes biosynthétisent des composés chimiques, le mécanisme mis en jeu est le métabolisme secondaire. Ces composés, que l'on appelle des métabolites secondaires, ne sont généralement pas essentiels à la croissance, au développement ou à la reproduction d'un organisme. Ils sont souvent définis comme uniques, car ils sont associés en particulier à une famille d'organisme résultant en l'expression de l'individualité d'une espèce. Ils sont produits en réponse à l'adaptation de l'organisme à son environnement alentour ou bien comme mécanisme de défense contre des prédateurs afin d'assister à la survie de l'organisme. La biosynthèse
Figure 10. Distribution de la distance euclidienne entre les produits naturels et 3211 médicaments approuvés40
des métabolites secondaires implique des procédés fondamentaux tels que la photosynthèse, la glycolyse et le cycle de Krebs permettant la fabrication de composés intermédiaires qui résultent ultimement à la formation de métabolites secondaires, plus communément appelés "produits naturels". Bien que le nombre de synthons soit limité, la formation de métabolites secondaires est infinie. Il existe donc plusieurs classes de produits naturels, répertoriés suivant la structure chimique du composé.43, 44 La vaste
famille des terpénoïdes (incluant les stéroïdes) est définie comme un arrangement de molécules d'isoprènes et à la vue du nombre de ces molécules, ils peuvent être classés de la manière suivante : hémiterpène (C5), monoterpène (C10), sesquiterpène (C15), diterpène (C20), triterpène (C30) et tétraterpène
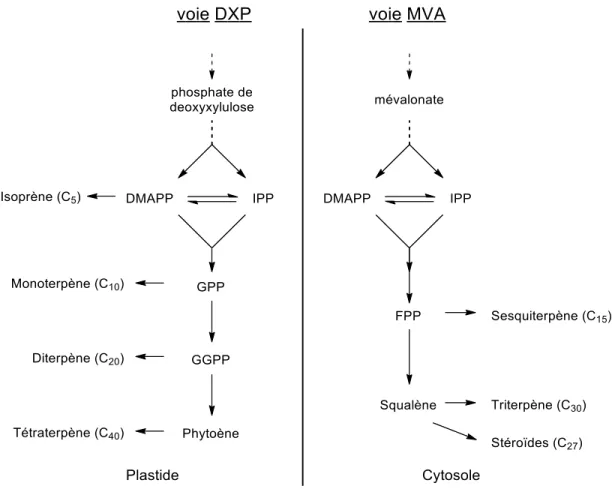
(C40). Plus précisément, les terpénoïdes sont originaires de deux voies biosynthétiques différentes, l'un
provenant de l'acide mévalonique (MVA) dans le cytosol et l'autre du phosphate de déoxyxylulose (DXP) dans le plastide conduisant tous deux aux précurseurs pyrophosphate d'isopentényle (IPP) et son isomère allylique, le pyrophosphate de diméthylallyle (DMAPP) (Figure 11).
Figure 11. Vue globale de la biosynthèse des terpénoïdes dans les plantes
La réaction initiale est catalysée par une prényltransférase de courte chaîne permettant l'élongation de la chaîne de substrats pyrophosphate allylique avec l'IPP. De cette manière et suivant leurs arrangements
C15) et le géranylgéranyl-pyrophosphate (GGPP, C20) sont ainsi obtenus. Par la suite, des réactions enzymatiques variées permettront d'apporter des modifications chimiques (cyclisations, oxydations ou réarrangements) afin de fournir une gamme très diversifiée de produits naturels (Figure 12).
Figure 12. Exemples de cyclisations enzymatiques à partir du monoterpène GPP
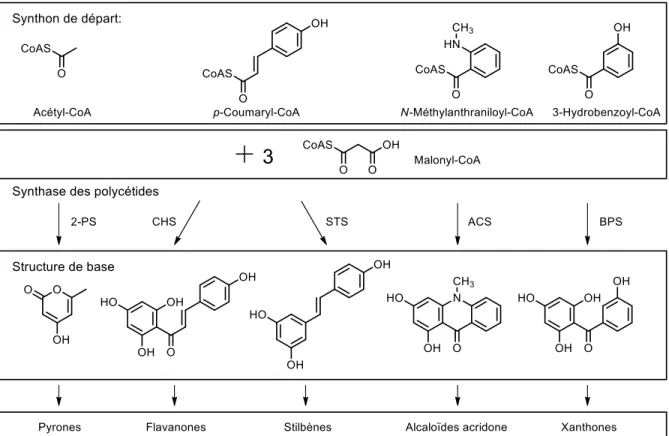
Une autre grande famille de produits naturels sont les polycétides.43, 45 Leurs structures sont obtenues à
partir d'unité à deux carbones dérivés d'acétate activée comme l'acétyle-coenzymeA et/ou le malonyl-coenzymeA qui après condensation offre une chaîne poly-β-cétométhylène (–[CH2CO]n–). Cet
intermédiaire hautement réactif est souvent sujet à des cyclisations conduisant à des fonctions aromatiques à six membres ou des cycles 2-pyrone. Les polycétides extraits de plantes ne sont pas synthétisés exclusivement d'unités acétate, car ils peuvent être mélangés à d'autres synthons comme les phenylpropanoïdes, les terpénoïdes ou les alcaloïdes. Par exemple, l'association du p-coumaroyl-CoA avec trois unités malonyl-CoA conduit à la sous-famille des chalcones et flavanones. L'utilisation de groupement prénylé tel que le DMAPP, GPP (mentionné précédemment) ou autres permettent la formation d'une autre classe de polycétides. Enfin, les polycétides à base alcaloïde sont obtenus lorsqu'un azote ou un précurseur azoté y est incorporé (Figure 13). Il existe donc une infinité de combinaison possible donnant accès à des squelettes très diversifiés, d'autre part, les plantes contiennent une vaste librairie d'enzyme permettant diverses transformations chimiques sur les métabolites secondaires : hydroxylation, époxydation, migration de groupement aryle, glycosylation, méthylation,
sulfonation, acylation, prénylation, oxydation et réduction. Tous ces paramètres combinés font des polycétides une des plus nombreuses familles de métabolites secondaires.46
Figure 13. Exemples de synthase de polycétides; PS, synthase de pyrone; CHS, synthase de chalcone; STS, synthase de stilbène; ACS, synthase d'acridone; BPS, synthase de benzophénone
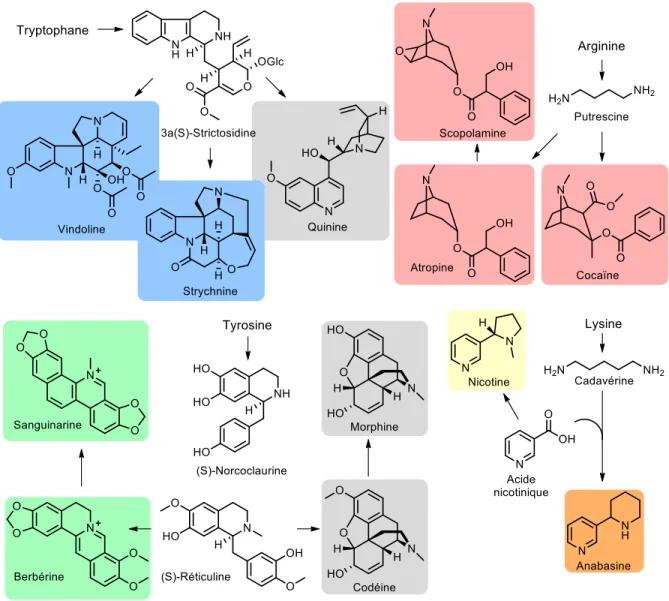
Les alcaloïdes sont principalement des composés cycliques azotés et sont très majoritairement dérivés d'acide aminés.43 La première étape consiste en une réaction enzymatique engendrant la décarboxylation
irréversible de l'acide aminé correspondant. Les diverses enzymes présentent des similarités significatives quant à la production de sous-unités chez les plantes et les animaux, contrairement aux mammifères et insectes qui démontrent une grande spécificité envers leurs substrats respectifs. Dû aux grands nombres d'acides aminés présents dans les organismes, les alcaloïdes constituent une classe importante de produits naturels et correspondent à près de 20% des métabolites secondaires issus de plantes.47 Ils présentent également des activités biologiques très variées telles que relaxant musculaire,
analgésique ou encore antioxydant. Dépendant de leur précurseur biosynthétique et de leur structure hétérocyclique, les alcaloïdes peuvent être classés dans différentes catégories de type indole, tropane, pipéridine, purine, imidazole, pyrrolizidine, pyrrolidine, quinolizidine, quinoléine et isoquinoléine. Par exemple, les composés issus de l'acide aminé tryptophane fournissent la strychnine ou la quinine appartenant respectivement aux catégories des alcaloïdes d'indole et de quinoline. Les alcaloïdes de