Caractérisation des variations saisonnière et spatiale
des éléments nutritifs et de la prise de l'azote dissous
dans l’estuaire du fleuve Saint-Laurent
Mémoire
Vincent Villeneuve
Maîtrise en biologie - avec mémoire
Maître ès sciences (M. Sc.)
Caractérisation des variations saisonnière et
spatiale des éléments nutritifs et de la prise de
l’azote dissous dans l’estuaire du fleuve
Saint-Laurent
Mémoire
Vincent Villeneuve
Sous la direction de :
Jean-Éric Tremblay, directeur de recherche
Michel Gosselin, codirecteur de recherche
Résumé
L’eutrophisation en milieux côtiers et estuariens est souvent reliée à une augmentation des apports en nutriments aux systèmes stimulant leur productivité et représente, à ce jour, l’un des plus gros enjeux associés aux impacts de la pollution par les activités anthropiques. Le Saint-Laurent, considéré comme l’un des plus grands systèmes hydrographiques au monde, fait désormais l’objet d’études cherchant à mieux comprendre les causes du développement d’une zone hypoxique (i.e. zone déficitaire en oxygène dissous) en eau profonde au niveau de son estuaire. Deux grandes causes principales pourraient expliquer cette diminution d’oxygène : une variation au niveau des températures et des teneurs en oxygène des courants de l’Atlantique ainsi qu’une augmentation de la demande en oxygène expliquée par la décomposition de la matière organique. Dans ce contexte, l’objectif principal de ce projet est de caractériser la répartition spatiale et saisonnière des éléments nutritifs de l’estuaire moyen et maritime, entre la ville de Québec et Pointe-des-Monts. Les données recueillies sont issues d’expéditions en mer menées au cours des quatre saisons entre l’automne 2017 et l’été 2019. Des incubations avec enrichissement de nitrate, d’ammonium ou d’urée marqué au 15N
ont également été effectuées à différents points de l’estuaire afin de quantifier et de caractériser la prise d’azote par le phytoplancton. Les résultats indiquent la présence de gradients spatiaux dans les concentrations de nutriments associés à la zone de transition entre la portion d’eau douce et d’eau salée de l’estuaire. Les secteurs de Québec et de l’estuaire moyen présentent une variation saisonnière importante largement associée aux apports provenant de la portion fluviale du fleuve. Les données printanières suggèrent également que les concentrations de surface en nitrate de l’estuaire maritime sont influencées par la propagation des concentrations élevées observées en amont. Les ratios azote:phosphore (N:P) inorganiques dissous indiquent que la région de Québec est passée d’une limitation en phosphore à une limitation en azote depuis les années 1970. Les taux maximaux de prise d’azote par le phytoplancton ont été mesurés dans le secteur de Québec et de l’estuaire moyen au cours des quatre saisons. La contribution relative des différentes formes d’azote indique que le nitrate et l’ammonium sont préférés à l’urée quelle que soit la position dans l’estuaire. Ces travaux, qui pourront désormais servir de référence, permettent une meilleure compréhension de la dynamique des nutriments dans l’estuaire du Saint-Laurent.
Abstract
Eutrophication in coastal and estuarine environments is often linked to an increase in nutrient inputs to ecosystems, stimulating their productivity and, to date, represents one of the biggest issues associated with the impacts of pollution from anthropogenic activities. The St. Lawrence System is considered one of the largest hydrographic systems in the world and is now the subject of studies that are looking into the causes of the development of a hypoxic zone (i.e. a zone lacking in dissolved oxygen) in the deep waters of its estuary. Two main causes have been identified to explain this decrease in dissolved oxygen: a variation in water temperature and oxygen levels in the Atlantic currents, and an increase in oxygen demand due to the decomposition of organic matter. In this context, the main objective of this project is to characterize the spatial and seasonal distribution of nutrients in the Upper and Lower Estuaries, between Quebec City and Pointe-des-Monts. The data has been collected on expeditions conducted in all four seasons between fall 2017 and summer 2019. Incubations with enrichment of 15N-labelled nitrate, ammonium or urea were also carried out at various stations in the estuary to quantify and characterize nitrogen uptake by phytoplankton. The results indicate the presence of spatial gradients in nutrients concentrations associated with the transition zone between the freshwater and marine portions of the estuary. The Quebec City and Upper Estuary sectors show significant seasonal variation largely associated with inputs from the upstream river. The spring data also suggest that surface nitrate concentrations in the Lower Estuary are influenced by the spread of high concentrations observed upstream. Dissolved inorganic nitrogen:phosphorus ratios indicate that the Quebec City area has undergone a transition from phosphorus to nitrogen limitation since the 1970s. Maximum nitrogen uptake rates by phytoplankton were measured in the Quebec City area and the Upper Estuary in all four seasons. The relative contribution of the different forms of nitrogen indicates that nitrate and ammonium are preferred to urea regardless of position in the estuary. This work, which can now be used as a reference, provides a better understanding of the dynamics of nutrients in the St Lawrence Estuary.
Table des matières
Résumé ... ii
Abstract ... iii
Table des matières ... iv
Liste des tableaux ... vi
Liste des figures ... vii
Liste des abréviations, sigles, acronymes ... ix
Remerciements ... xi
Avant-propos ... xii
Introduction générale ... 1
Eutrophisation et nutriments en milieu estuarien ... 1
Le cycle de l’azote marin ... 2
Les différentes formes d’azote dissous ... 2
Les étapes du cycle de l’azote ... 3
Le système du Saint-Laurent et son estuaire ... 4
Problématique ... 7
1. Objectifs ... 9
2. Matériel et méthodes... 10
2.1 Expéditions ... 10
2.2 Échantillonnage ... 10
2.2.1 Nutriments sous forme dissoute ... 15
2.2.2 Phosphore organique particulaire ... 16
2.3 Taux de prise de l’azote dissous et recyclage de l’ammonium ... 16
2.4 Consommation biologique des nutriments à Québec ... 18
3. Résultats ... 19
3.1 Répartition saisonnière des nutriments ... 19
3.2 Répartition spatiale des nutriments... 23
3.3 Ratios élémentaires ... 28
3.4 Taux de prise de l’azote ... 30
3.5 Recyclage de l’ammonium ... 33
4. Discussion ... 37
4.1 Variations spatiales des nutriments ... 37
4.2 Variations saisonnières des nutriments ... 41
4.3 Consommation biologique ... 44
4.4 Transport de nutriments et impact sur les communautés ... 46
Conclusion ... 51
Bibliographie ... 53
Annexes ... 61
Annexe 1. Indice de préférence relative (IPR) des différentes formes d’azote consommées par le phytoplancton en été ... 61
Annexe 2. Composition taxonomique des communautés de phytoplancton durant l’expérience d’enrichissement ... 63
Liste des tableaux
Tableau 1. Taux de recyclage (rNH4 ; µat.g N L-1 j-1) et de prise d’ammonium (NH4 ;
µat.g N L-1 j-1) mesurés entre Québec et l’estuaire moyen. ... 33
Tableau A. 1 Indice de préférence relative (IPR) de la consommation estivale d'ammonium, de nitrate et d'urée à la profondeur associée à 1% de la lumière en surface. ... 61 Tableau A. 2 Indice de préférence relative (IPR) de la consommation estivale d'ammonium, de
nitrate et d'urée à la profondeur associée à 15% de la lumière en surface. ... 62 Tableau A. 3 Indice de préférence relative (IPR) de la consommation estivale d'ammonium, de
nitrate et d'urée à la profondeur associée à 50% de la lumière en surface. ... 62 Tableau A. 4 Composition taxonomique des différents traitements de l’expérience
d’enrichissement. Matane/Québec : eau récoltée à Matane/Québec non-incubée (T0); QM :50% eau de Québec et 50% eau de Matane (sans ajout de phosphate); QC :100% eau de Québec (sans ajout); QP :100% eau de Québec avec ajout de 1 μmol L-1 de
phosphate. Les décomptes sont exprimés en nombre de cellules par litre (cell/L). ... 63 Tableau A. 5 Composition taxonomique des différents traitements de l’expérience
d’enrichissement. Matane/Québec : eau récoltée à Matane/Québec non-incubée (T0); QM :50% eau de Québec et 50% eau de Matane (sans ajout de phosphate); QC :100% eau de Québec (sans ajout); QP :100% eau de Québec avec ajout de 1 μmol L-1 de
Liste des figures
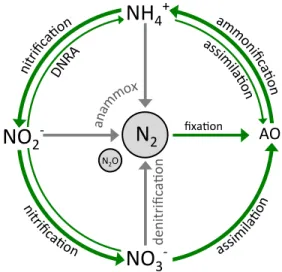
Figure 1. Schématisation simplifiée du cycle de l’azote. AO : azote organique (inclut l’azote organique particulaire et dissous); DNRA : réduction dissimilatrice du NO3- en NH4+.
Figure adaptée de Tremblay et al. (2015). ... 4 Figure 2. Système du Saint-Laurent avec ses portions fluviales (Kingston à Québec) et estuariennes
(Québec à Pointe-des-Monts) en A) et la sous-division entre estuaire moyen (Québec à Tadoussac) et maritime (Tadoussac à Pointe-des-Monts) en B). ... 5 Figure 3. Représentation schématisée des différentes masses d’eau et de la circulation à la frontière
entre l’estuaire moyen et maritime. Figure tirée de Thibodeau (2010). ... 6 Figure 4. Carte de la circulation de surface (flèches) dans l'estuaire maritime et le nord-ouest du
golfe du Saint-Laurent. Le chenal Laurentien est identifié par le trait gris associé à l’isobathe de 200 m. Figure tirée de Plourde et al. (2001). ... 6 Figure 5. Cartes des stations échantillonnées lors des missions SECO.Net A) du printemps 2018 et
B) de l’été 2019. ... 11 Figure 6. Cartes des stations échantillonnées lors des missions A) SECO.Net à l’automne 2017 et
B) Odyssée Saint-Laurent à l’hiver 2019. ... 12 Figure 7. Cartes des stations où des incubations ont été effectuées durant les missions SECO.Net
A) du printemps 2018 et B) de l’été 2019. ... 13 Figure 8. Cartes des stations où des incubations ont été effectuées durant les missions A)
SECO.Net de l’automne 2017 et B) Odyssée Saint-Laurent de l’hiver 2019. ... 14 Figure 9. Concentrations de nutriments inorganiques et organiques entre Québec et la pointe est de
l’île d’Orléans à différentes saisons. Les valeurs représentent les moyennes ± 1’écart-type calculées sur l’ensemble des stations du secteur. Noter que les valeurs de DON incluent l’urée. ... 20 Figure 10. Variations saisonnières des concentrations de nutriments dans les 25 premiers mètres de
la colonne d’eau en fonction de la salinité. La salinité est utilisée comme un indicateur de la position écologique d’une station donnée dans l’estuaire. Les couleurs indiquent la saison d’échantillonnage : printemps (bleu), été (vert), automne (rouge) et hiver (violet). Noter que les valeurs de DON incluent l’urée. ... 22 Figure 11. Répartition horizontale des concentrations de nitrate, d’ammonium et d’urée en surface
entre Québec et Pointe-des-Monts à différentes saisons. ... 25 Figure 12. Répartition horizontale des concentrations de phosphate et de silicate en surface entre
Québec et Pointe-des-Monts à différentes saisons. ... 26 Figure 13 Concentrations estivales de nitrates dans les 25 premiers mètres de la colonne d’eau en
fonction de la salinité pour les stations du secteur de Québec, de l’estuaire moyen et de la rive sud de l’estuaire maritime en (A), ces mêmes stations plus celles de la rive nord de l’estuaire maritime en (B), puis uniquement les stations du centre de l’estuaire
maritime en (C). ... 27 Figure 14. Ratios N:P des nutriments inorganiques des 25 premiers mètres de la colonne d’eau en
fonction de la salinité. Les ratios sont présentés avec une échelle A) linéaire et B) logarithmique. Les couleurs indiquent la saison d’échantillonnage : printemps (bleu), été (vert), automne (rouge) et hiver (violet). Le trait pointillé représente le ratio de Redfield (16:1). ... 28
Figure 15. Variations de la concentration printanière de nitrate et du ratio N:P des nutriments inorganiques entre Québec et Pointe-des-Monts au printemps. Les données ont été interpolées à partir des stations situées au centre de l’estuaire (voir carte) (méthode DIVA; logiciel Ocean Data View, version 5.1.5). ... 29 Figure 16. Prise totale de l’azote dissous (N totale) par profondeur optique (moyenne ± écart-type
; µat.g N L-1 j-1). La barre pointillée indique l’emplacement de Tadoussac par rapport
aux stations d’incubation. Noter que les échelles de l’axe vertical sont différentes entre les saisons. ... 31 Figure 17. Contribution relative moyenne du nitrate, de l’ammonium et de l’urée à la prise totale de
l’azote dissous pour chaque station d’incubation. La barre pointillée rouge indique l’emplacement de Tadoussac par rapport aux stations d’incubation. ... 32 Figure 18. Taux de recyclage (rNH4 ; µat.g N L-1 j-1) et de prise d’ammonium (NH4 ;
µat.g N L-1 j-1) par profondeur optique pour les stations EUTAQ et EUT01 pour trois
saisons. ... 34 Figure 19. Évolution des concentrations de nitrate, phosphate, ammonium et silicate sur toute la
durée de l’expérience de simulation de mélange des eaux fluviales de surface avec les eaux profondes de l’estuaire maritime. QC :100% eau de Québec (sans ajout); QP :100% eau de Québec avec ajout de 1 μmol L-1 de phosphate ; QM :50% eau de Québec et 50%
Liste des abréviations, sigles, acronymes
AA3 : Autoanalyseur (Bran and Luebe Autoanalyzor III) ADN : Acide désoxyribonucléiqueARN : Acide ribonucléique
BQMA: Banque de données sur la qualité du milieu aquatique DIN : Azote inorganique dissous
DON : Azote organique dissous DOP : Phosphore organique dissous HDPE : High Density Polyethylene
IRMS : Spectromètre de masse pour la mesure de ratio isotopique N2 : Diazote N2O : Oxyde nitreux Na2SO4 : Sulfate de sodium NH4+ : Ammonium NO2- : Nitrite NO3- : Nitrate PO43- : Phosphate
PON : Azote organique particulaire POP : Phosphore organique particulaire
SECO.Net : St. Lawrence Ecosystem Health Research and Observation Network Si(OH)4+ : Acide silicique (mesuré comme indicateur du silicate)
TDN : Azote dissous total TDP : Phosphore dissous total
« La légende dira peut-être demain : connaître le Saint-Laurent et voir le monde, car l’univers qu’il a créé est à sa mesure, immense, en équilibre dans la démesure de l’infiniment grand comme dans celle de l’infiniment petit. »1
-Annie Mercier
Remerciements
Je tiens tout d’abord à remercier mon directeur de recherche, Jean-Éric Tremblay, pour m’avoir épaulé tout au long de ce projet et pour avoir su enrichir mon expérience en me permettant de participer à un nombre incroyable d’expéditions sur le terrain. Jongler entre le laboratoire et le terrain n’aura pas été de tout repos, mais m’aura permis de grandir énormément, tant sur le plan professionnel que personnel. Je remercie également mon co-directeur, Michel Gosselin, pour sa présence malgré la distance et pour son enthousiasme à rappeler que le milieu de la recherche est avant tout une expérience humaine.
Un merci spécial à Gabrièle Deslongchamps qui a su me prendre sous son aile et m’appuyer dans toutes les étapes de mon projet. Je suis d’avis que nous formons une équipe du tonnerre sur le terrain et mes multiples périples en mer n’auraient pas été aussi délicieux sans sa présence. Merci à Michel Starr et Michel Lebeuf pour m’avoir fait confiance en acceptant de prendre un jeune étudiant comme moi pour former ce trio restreint de surnuméraires scientifiques qui aura assuré tout l’échantillonnage de SECO.Net durant deux missions en mer.
Je tiens à remercier Jonathan Gagnon pour tous les conseils et l’appui dans la réalisation des analyses en laboratoire. Merci à mes collègues étudiants Francis Dufour, Nicolas Schiffrine, Kasey Cameron-Bergeron et Guillaume Cinq-Mars pour les innombrables conversations au bureau ou autour d’une bière.
Ces remerciements ne sauraient être complets sans mentionner ma famille et mes amis pour leur support et leurs encouragements quand j’en avais besoin. Ce projet de maîtrise aura été parsemé d’embûches, mais leur présence aura su me donner le courage de continuer et d’achever ces travaux de recherche.
Enfin, je tiens à remercier Mylène pour tout, absolument tout. Ta présence durant ces deux années m’aura permis de garder la tête haute, le cœur au bon endroit, et de conserver mon chariot bien enligné.
Avant-propos
Ce mémoire présente les résultats des travaux de recherche effectués au cours de ma maîtrise sous la direction de Jean-Éric Tremblay et la codirection de Michel Gosselin. Ce projet s’insère dans le réseau de recherche St. Lawrence Ecosystem Health Research and
Observation Network (SECO.Net) qui repose sur un partenariat entre Pêches et Océans
Canada (Institut Maurice-Lamontagne) et l’Université Laval, avec la collaboration de l’Institut des Sciences de la Mer (Université du Québec à Rimouski) et de l’Université McGill.
J’ai personnellement participé à chacune des étapes ayant mené à ce mémoire, depuis la préparation des missions d’échantillonnage dans l’estuaire jusqu’à l’écriture du présent document. Les données de ce projet ont été récoltées au cours de quatre missions scientifiques entre novembre 2017 et juillet 2019. L’une de ces expéditions en mer a été rendue possible par une collaboration avec le Réseau Québec Maritime dans le cadre de son programme
Odyssée Saint-Laurent et a permis la récolte de données hivernales en février 2019. J’ai
également accompli la majorité des analyses de laboratoire avec l’aide de Gabrièle Deslongchamps et de Jonathan Gagnon, professionnels de recherche dans le laboratoire de Jean-Éric Tremblay, avant de procéder à l’analyse et à l’interprétation des données et, finalement, de compléter la rédaction du présent manuscrit.
Au cours de ma maîtrise, j’ai également eu le privilège de pouvoir participer à deux autres brèves missions hivernales d’Odyssée Saint-Laurent en 2018 et 2020. Ces données ne sont toutefois pas exploitées ici puisqu’elles étaient similaires à celles, plus complètes, obtenues en 2019. Mon implication dans le regroupement SECO.Net m’a aussi permis de participer aux expériences en mésocosmes qui se sont déroulées à la station aquicole de Pointe-au-Père durant seize jours à l’été 2018. Ces travaux m’ont permis de compléter ma formation pratique. Je remercie mon directeur de recherche pour m’avoir offert ces opportunités.
Introduction générale
L’activité humaine est désormais reconnue comme un vecteur de changements et de transformations de l’écosystème terrestre. Ces activités anthropiques ont des répercussions sur une myriade de systèmes, autant en milieu terrestre, qu’aérien ou aquatique (ex., Vitousek et al. 1997). Un mode important de perturbation humaine résulte d'activités qui mobilisent les éléments nutritifs tels l’azote et le phosphore par le défrichage, la production et l’application d’engrais, les rejets de déchets humains, la production agricole et animale, et l’utilisation de combustibles fossiles (ex., Cloern 2001). Conséquemment, les systèmes hydrologiques mondiaux présentent des concentrations de nutriments en augmentation et cette situation se répercute sur la qualité des milieux aquatiques.
Eutrophisation et nutriments en milieu estuarien
Le phénomène d’eutrophisation est généralement décrit comme une augmentation excessive des apports en matière organique et en éléments nutritifs dans un écosystème aquatique. À ce jour, l’eutrophisation représente l’un des plus gros enjeux associés aux problèmes de pollution en milieux côtiers et estuariens dans le monde ( Nixon 1995; Howarth et al. 2000; Smith et Schindler 2009). Les conséquences de ce phénomène sont multiples : augmentation de la fréquence et de l’intensité des floraisons d’algues toxiques (ex., Alexandrium catenella auparavant A. tamarense), développement de zones hypoxiques (c.-à-d. une zone déficitaire en oxygène dissous), diminution de la biodiversité locale et, à l’extrême, développement de zones mortes. Toutes ces conséquences de l’eutrophisation ont pour effet d’altérer fondamentalement le fonctionnement des écosystèmes atteints ainsi que les services écologiques qui en découlent (Cloern 2001; Diaz 2001; Diaz et Rosenberg 2008).
Les estuaires sont particulièrement sensibles aux apports terrestres en nutriments et en matière organique (Gearing et Pocklington 1990) de par leur grande réactivité biogéochimique face à te tels ajouts. Dans ces écosystèmes, il est reconnu que les surplus d’azote sont fortement associés au développement de zones eutrophes (ex., Nixon et al. 1996; Howarth 1998; Howarth et al. 2006). Le phénomène d’eutrophisation se caractérise, de manière simplifiée, par l’augmentation de nutriments qui stimule la productivité du milieu (phytoplancton, macroalgues, zooplancton, etc.) aussi longtemps que les conditions
nécessaires à la croissance des organismes (lumière, température, nutriments, etc.) sont respectées. Une sénescence accrue des organismes est ensuite observée lorsque le milieu ne soutient plus cette croissance. La décomposition bactérienne de cette matière organique nécessite une consommation de l’oxygène dans le milieu provoquant ainsi une diminution des teneurs de ce gaz vital dans la colonne d’eau et/ou le sédiment. Le terme hypoxie est utilisé lorsque les concentrations en oxygène dissous sont inférieures à 2 mg L-1, soit 62,5 µmol L-1 (Diaz et Rosenberg 1995). Plusieurs facteurs naturels (bathymétrie, stratification des eaux, action des marées, etc.) influencent les teneurs en oxygène d’un milieu; la fréquence et l’intensité de ce phénomène seront notamment influencées par la propension du milieu à développer des zones hypoxiques (Helly et Levin 2004), ainsi que par les pressions environnementales reliées aux activités anthropiques (Rabalais et al. 2010). Plusieurs variables du milieu sont à prendre en compte dans l’étude de l’eutrophisation tels les nutriments (concentrations, formes, ratios, etc.), la production primaire (taxonomie, assemblages spécifiques, biomasse, etc.), les propriétés physiques du milieu (connectivité au milieu terrestre, tributaires, courants, bathymétrie, etc.), et bien d’autres. L’étude de leur variabilité spatiale au sein d’un estuaire est suggérée comme l’approche la plus efficace pour identifier les facteurs clés qui mènent au développement de l’eutrophisation et, conséquemment, de l’hypoxie (Hughes et al. 2011) et s’est avérée efficace dans plusieurs estuaires (ex., Boynton et al. 1996; Kemp et al. 2005; Burkholder et al. 2006).
Le cycle de l’azote marin
Les différentes formes d’azote dissousL’azote dissous peut être regroupé en deux familles distinctes de composés : organique (DON) ou inorganique (DIN). Parmi les formes inorganiques, on retrouve le nitrate (NO3-) qui correspond à l’état le plus oxydé de l’azote et la forme la plus abondante d’azote biologiquement disponible dans les environnements oxygénés. Son assimilation par les organismes nécessite toutefois une réduction préalable en nitrite (NO2-) puis en ammonium (NH4+). Le NO2- est généralement peu abondant dans les écosystèmes aquatiques, puisqu’il s’agit d’un produit intermédiaire n’ayant qu’une très courte durée de vie (Brandes et al. 2007). Le NH4+ correspond à la forme d’azote inorganique la plus réduite et la moins
coûteuse énergétiquement à assimiler ( Glibert et al. 1982; McCarthy et al. 1977). Cette forme de DIN est préférée par le phytoplancton et autres microorganismes marins malgré qu’elle soit généralement moins abondante que le NO3- (Dortch 1990; Song et Ward 2007). Le NH4+ peut toutefois être dominant en fin de bloom et dans les milieux hypoxiques ou affectés par l’activité anthropique. Le DON regroupe plusieurs composés au nombre d’atomes d’azote variable et est principalement retrouvé sous forme d’urée (2 atomes d’azote), d’acides aminés (libres ou protéiques) et d’acides nucléiques (ADN et ARN) dans le milieu aquatique. Leur assimilation nécessite l’action de complexes enzymatiques pour scinder les molécules et les réduire en NH4+ (Jørgensen 2009).
Les étapes du cycle de l’azote
Le cycle de l’azote peut être divisé en quatre étapes majeures : la fixation de l’azote, l’ammonification, la nitrification et la dénitrification (Figure 1). Bien que les activités anthropiques engendrent une augmentation des apports, les différentes formes d’azote entrent dans le système aquatique par trois mécanismes principaux : par précipitations, par ruissellement d’origine terrestre ou par dépôt atmosphériques (et solubilisation) (Capone 2008). La fixation de l’azote est effectuée par les organismes qui possèdent l’enzyme nitrogénase qui permet la réduction du N2 en NH4+, qui peut alors être assimilé par l’organisme ou relâché directement dans l’environnement. L’ammonification (ou recyclage de NH4+) regroupe tous les processus qui permettent la transformation du DON en NH4+ tels que l’excrétion par le zooplancton, la décomposition bactérienne et plusieurs autres. La nitrification est accomplie par des bactéries issues des groupes Nitrosomonas et Nitrobacter ou encore par certaines archées qui permettent l’oxydation du NH4+ en NO2-, puis en NO3 -(Gruber 2008; Ward 2008). Ces étapes du cycle de l’azote sont interreliées et permettent de régénérer les pools de NH4+ et de NO3- assimilables par les microorganismes. La dénitrification, cependant, est une réaction qui a lieu en conditions anoxiques et qui permet le retour du NO3- en N2. Cette étape du cycle de l’azote est généralement observée en eaux profondes ou dans les sédiments et est associée à la décomposition bactérienne de la matière organique (Arrigo 2005). Des études récentes ont également identifié un processus anaérobique (annamox) qui s’ajoute à la dénitrification par l’oxydation du NH4+ permettant ainsi le retour de l’azote en N2 (Mulder et al. 1995; Ward et al. 2007). Une perte d’azote est
également observée lors des réactions de nitrification et de dénitrification et engendre son retour dans l’atmosphère sous forme de N2O (Gruber 2008).
Figure 1. Schématisation simplifiée du cycle de l’azote. AO : azote organique (inclut l’azote organique particulaire et dissous); DNRA : réduction dissimilatrice du NO3- en NH4+. Figure adaptée de Tremblay et al. (2015).
Le système du Saint-Laurent et son estuaire
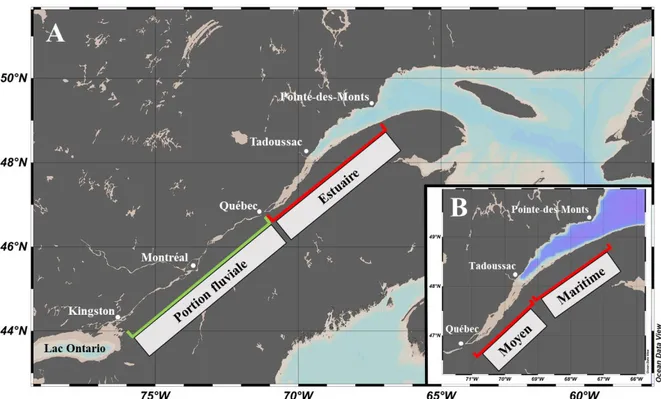
Le système du Saint-Laurent prend origine au niveau des Grands Lacs pour rejoindre l’océan Atlantique sur la côte Est du Canada et il est considéré comme l’un des plus grands systèmes hydrographiques au monde regroupant un peu plus de 45 000 000 d’habitants répartis autour de 76 bassins versants ( Environment and Climate Change Canada 2015; Goyette et al. 2016). Ce système peut être divisé en trois régions principales : la portion fluviale, des Grands Lacs à la ville de Québec, l’estuaire, qui s’étend jusqu’à Pointe-des-Monts, puis le golfe qui débouche sur l’océan (Figure 2). L’estuaire, quant à lui, se divise également en deux parties distinctes caractérisées par des propriétés physiques et processus hydrologiques différents. L’estuaire moyen correspond à la zone de transition entre les eaux douces de la portion fluviale et les eaux salées de l’estuaire maritime et est caractérisé par un mélange vertical important associé en grande partie aux courants de marée (Saucier et Chassé 2000). Pour cette raison, les concentrations en nutriments y sont plutôt homogènes sur l’ensemble de la colonne d’eau. Cette section de l’estuaire correspond également à la zone où la turbidité est à son maximum. Cette zone, qui est caractérisée par une floculation élevée des particules et une importante remise en suspension des sédiments ( Kranck 1979; Lucotte et d’Anglejan
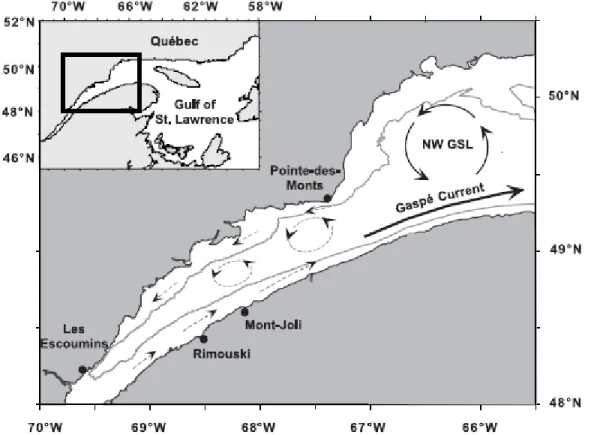
1986), représente un secteur important pour le cycle vital de plusieurs espèces de la chaîne trophique (ex., Dauvin et Dodson 1990; Winkler et al. 2003; Martineau et al. 2004). L’estuaire maritime s’étend de la tête du chenal Laurentien près de Tadoussac jusqu’à Pointe-des-Monts où débute le golfe du Saint-Laurent. Ce secteur est beaucoup plus profond et caractérisé par trois masses d’eau distinctes dans le plan vertical (Figure 3). La couche de surface est constituée des eaux de l’estuaire moyen ainsi que de la rivière Saguenay et s’écoule vers le golfe en longeant la rive sud pour devenir le courant de Gaspé. Les couches profondes et intermédiaires sont constituées en grande partie des eaux en provenance des courants du Labrador et de l’Atlantique Nord qui pénètrent dans l’estuaire vers l’intérieur des terres (White et Johns 1997) (Figures 3 et 4). Les eaux profondes remontent vers la surface dans la région de Tadoussac en réaction au changement abrupt de la bathymétrie et au forçage des marées. Les concentrations en nutriments de l’estuaire maritime présentent une variabilité importante sur l’ensemble de la colonne d’eau selon l’origine différentielle des masses d’eau et l’action des processus physiques qui les mélangent.
Figure 2. Système du Saint-Laurent avec ses portions fluviales (Kingston à Québec) et estuariennes (Québec à Pointe-des-Monts) en A) et la sous-division entre estuaire moyen (Québec à Tadoussac) et maritime (Tadoussac à Pointe-des-Monts) en B).
Figure 3. Représentation schématisée des différentes masses d’eau et de la circulation à la frontière entre l’estuaire moyen et maritime. Figure tirée de Thibodeau (2010).
Figure 4. Carte de la circulation de surface (flèches) dans l'estuaire maritime et le nord-ouest du golfe du Saint-Laurent. Le chenal Laurentien est identifié par le trait gris associé à l’isobathe de 200 m. Figure tirée de Plourde et al. (2001).
Problématique
Une étude récente a mis en évidence le développement d’une zone hypoxique dans l’estuaire maritime du Saint-Laurent (Gilbert et al. 2005). En 2003, la superficie de cette zone était estimée à près de 1300 km2 et les concentrations moyennes annuelles en oxygène étaient de
58,6 µmol L-1. Les données historiques ont permis de mettre en lumière une diminution de
près de 50% des concentrations en oxygène dissous dans ce secteur entre 1930 et 1990. Deux causes principales ont été énoncées pour tenter d’expliquer le développement de cette zone hypoxique : 1) des changements dans la provenance des eaux marines profondes qui pénètrent dans l’estuaire et, 2) une augmentation de la demande en oxygène dissous par la dégradation de la matière organique.
La masse d’eau profonde de l’estuaire maritime est composée en partie des eaux du Labrador et de l’Atlantique Nord qui se mélangent dans le golfe du Saint-Laurent. Les caractéristiques de ces eaux profondes varient alors en fonction de la proportion de chacune des masses d’eau en provenance du golfe (Gilbert et al. 2005). Des études récentes indiquent que des changements dans la circulation des eaux du nord-ouest de l’Atlantique ont affecté la contribution relative de ces deux masses d’eau et favorisé l’apport d’eaux plus chaudes et moins oxygénées à l’estuaire (Claret et al. 2018; Thibodeau et al. 2010; Thibodeau et al. 2018). Toutefois, bien que ces modifications dans la physico-chimie des courants de l’Atlantique Nord affectent les eaux profondes de l’estuaire maritime, ce phénomène n’expliquerait que les deux tiers environ du déficit en oxygène dissous (Gilbert et al. 2005).
Par l’usage de la modélisation, il a été démontré que l’estuaire maritime est un système particulièrement sensible aux apports de matière organique et que la dégradation de cette dernière serait en cause dans le développement de la zone hypoxique qui y est observée (Benoit et al. 2006). Des analyses sédimentaires ont également indiqué que l’eutrophisation serait impliquée dans la diminution des concentrations d’oxygène dissous (Thibodeau et al. 2006), ce qui sous-tend que les nutriments seraient aussi impliqués dans l’apparition de la zone hypoxique située dans l’estuaire maritime. Dans ce contexte, on peut concevoir que le changement de composition des eaux profondes dans l’estuaire maritime a rendu la zone encore plus vulnérable à l’influence de la décomposition locale sur l’hypoxie.
Une étude récente de Hudon et al. (2017) s’est penchée sur la dynamique de l’azote, du carbone et du phosphore dans la portion fluviale du fleuve afin de quantifier les apports au système ainsi que la consommation de ces éléments dans ce secteur. Les auteurs ont démontré que les apports en nutriments au tronçon fluvial sont importants et indiquent qu’il existe une forte connectivité entre les eaux issues des Grands Lacs et celles de Québec. Leurs résultats indiquent également qu’en été, la production primaire accrue dans la portion fluviale représente un puits de nutriments et une source de carbone organique particulaire. Tandis que l’export et la dégradation de ce carbone vers l’estuaire maritime contribueraient à l’hypoxie des eaux profondes, on ignore dans quelle mesure l’estuaire moyen agit comme filtre pour les nutriments et la matière organique qui s’échappe de Québec vers l’aval. À ce jour, aucun projet de recherche n’a permis de caractériser de façon approfondie la dynamique actuelle des nutriments et de la matière organique dans l’estuaire du fleuve Saint-Laurent. Le réseau de recherche St. Lawrence Ecosystem Health Research and Observation Network
(SECO.Net) a été créé afin de répondre à ce manque et a pour objectif de mieux comprendre
le rôle des nutriments et de la matière organique dans le développement et l’intensification du processus d’eutrophisation dans cette portion du Saint-Laurent.
1. Objectifs
La présente étude a comme objectif général d’évaluer la répartition et la propagation des nutriments d’origine fluviale dans le Saint-Laurent entre la Ville de Québec et Pointe-des-Monts; c’est-à-dire, dans l’estuaire moyen et maritime. Pour ce faire, nos travaux ont été structurés autour de deux objectifs principaux pour permettre de mieux comprendre la dynamique observable des nutriments dans l’écosystème. Pour répondre à ces objectifs, des analyses ont été effectuées pour déterminer les concentrations de diverses formes d’azote, de phosphore et de silicium dans le milieu, jumelées à des incubations visant à mesurer la prise d’azote par le phytoplancton. Ainsi, il devient possible d’examiner ce qui est disponible dans le milieu et ce qui est utilisé par le phytoplancton. Pour chacun de ces deux objectifs, des sous-objectifs ont été établis.
1. Caractériser la répartition spatiale et temporelle des nutriments entre la ville de Québec et Pointe-des-Monts.
i. Décrire la répartition saisonnière des nutriments.
ii. Évaluer si les concentrations en nutriments diffèrent selon la rive (nord/sud). iii. Évaluer si la position sur l’axe d’écoulement entre la ville de Québec et
Pointe-des-Monts influence les concentrations de nutriments en surface.
2. Mesurer la prise d’azote à divers points dans l’estuaire pour évaluer la consommation locale
i. Évaluer si la position sur l’axe d’écoulement entre la ville de Québec et Pointe-des-Monts influence la prise d’azote.
ii. Évaluer la contribution relative du nitrate, de l’ammonium et de l’urée dans
la prise d’azote.
iii. Identifier la ou les sources principales d’azote consommée par le
2. Matériel et méthodes
2.1
Expéditions
Ce projet s’insère dans les objectifs du réseau St. Lawrence Ecosystem Health Research and
Observation Network (SECO.Net), qui repose sur un partenariat entre Pêches et Océans
Canada et plusieurs universités du Québec : Université Laval, Université du Québec à Rimouski et Université McGill. Ce programme consiste en une étude multidisciplinaire de l’estuaire du Saint-Laurent entre la ville de Québec et Pointe-des-Monts. Les campagnes d’échantillonnage ont été effectuées pour la majeure partie via le programme SECO.Net en novembre 2017 (automne), avril 2018 (printemps) et juin 2019 (été). Ces missions ont été réalisées à bord de deux navires différents : RV Coriolis II à l’automne 2017 et le NGCC
Frederick G. Creed au printemps 2018 et à l’été 2019. De manière opportuniste, des
échantillons ont été récoltés durant la missions hivernale du programme Odyssée
Saint-Laurent dirigé par le Réseau Québec maritime (RQM) en février 2019 à bord du NGCC Amundsen.
2.2 Échantillonnage
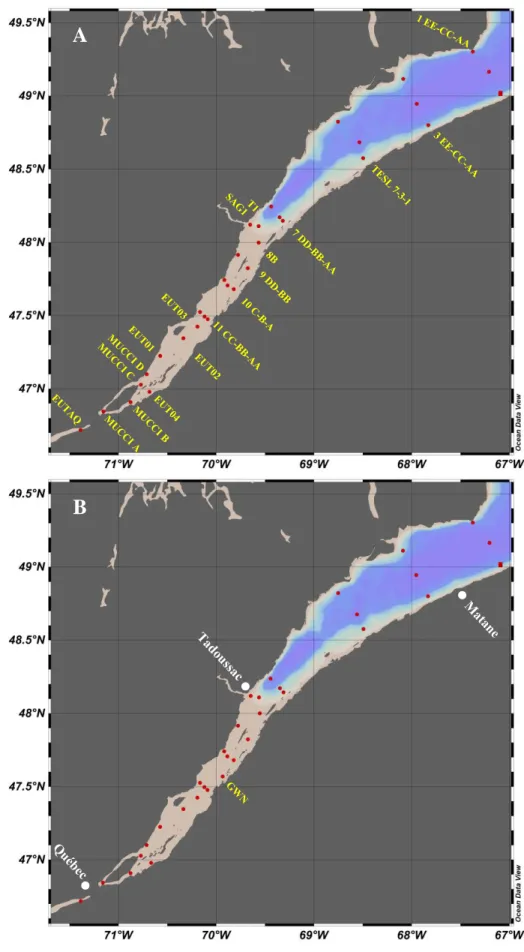
L’échantillonnage pour les nutriments et les variables physico-chimiques de la colonne d’eau a été réalisé aux stations indiquées aux Figures 5 et 6, tandis que la récolte d’eau pour les mesures de prise d’azote par incubation a été faite au sous-ensemble de stations indiquées aux Figures 7 et 8. Tous les échantillons ont été récoltés à l’aide d’une Rosette d’échantillonnage munie de bouteilles Niskin de 12 L de contenance et d’une sonde CTP (conductivité, température et profondeur). Pour les nutriments, les profondeurs visées étaient : surface, 10 m, 25 m, 50 m, 100 m, 150 m, 250 m et fond (environ à 10 m du fond marin) pour les missions SECO.Net, puis surface, 10 m, 25 m, 50 m, 75 m, 100 m, 125 m, 150 m, 175 m, 200 m, 250 m, 300 m et fond (environ à 10 m du fond marin) pour la mission Odyssée Saint-Laurent. Pour les mesures de prise d’azote par le phytoplancton, les échantillons ont été récoltés aux profondeurs optiques qui correspondaient à 50%, 15% et 1% de l’intensité lumineuse en surface. Les profondeurs métriques associées à ces niveaux de pénétration de la lumière ont été déterminées en utilisant un disque de Secchi déployé depuis le pont du navire juste avant le déploiement de la rosette.
a
Figure 5. Cartes des stations échantillonnées lors des missions SECO.Net A) du printemps 2018 et B) de l’été 2019.
A
.
B
Figure 6. Cartes des stations échantillonnées lors des missions A) SECO.Net à l’automne 2017 et B) Odyssée Saint-Laurent à l’hiver 2019.
B
.
Figure 7. Cartes des stations où des incubations ont été effectuées durant les missions
SECO.Net A) du printemps 2018 et B) de l’été 2019.
A
Figure 8. Cartes des stations où des incubations ont été effectuées durant les missions
A) SECO.Net de l’automne 2017 et B) Odyssée Saint-Laurent de l’hiver 2019.
B
A
2.2.1 Nutriments sous forme dissoute
Les échantillons pour les analyses de nutriments sous forme dissoute ont été récoltés en utilisant des seringues et des portes-filtres préalablement lavés à l’acide chlorhydrique (HCl) 10% (v/v). L’eau a été récoltée à l’aide de la seringue, puis filtrée sur des filtres Whatman GF/F (25 mm de diamètre, porosité nominale de 0,7 μm) insérés dans les portes-filtres afin d’en retirer la portion particulaire (phytoplancton, zooplancton et autres débris particulaires). Les nutriments inorganiques (nitrate, nitrite, phosphate et silicate) ont été récoltés dans des tubes de type Falcon de 15 mL également lavés au HCl 10% (v/v) puis analysés frais à bord lorsque possible ou rapidement congelés à -20°C pour analyse ultérieure au laboratoire. Les analyses ont été effectuées par une méthode de colorimétrie adaptée de Hansen et Koroleff (2007) à l’aide d’un autoanalyseur de nutriments Bran and Luebbe III (AA3). Les concentrations en phosphate et en silicate obtenues à l’aide du AA3 ont ensuite été corrigées selon la salinité de l’échantillon pour obtenir les concentrations finales. Les échantillons pour l’analyse des concentrations en ammonium ont été récoltés dans des tubes de verre et analysés frais par fluorométrie selon la méthode de Holmes et al. (1999). Les échantillons pour l’analyse des concentrations en urée ont été récoltés dans des tubes de type Falcon 50 mL et analysés par spectrophotométrie selon la méthode de Goeyens et al. (1998).
Les échantillons pour le phosphore dissous total (TDP) ont été récoltés dans des tubes de type Falcon 50 mL puis congelés à -20°C pour les analyses subséquentes en laboratoire. Les échantillons ont ensuite été transférés dans des tubes de verre nettoyés au HCl 10% (v/v), pour subir une oxydation utilisant le potassium persulfate tel que décrit par Valderrama (1981). Cette méthode permet de transformer le phosphore organique dissous (DOP) en phosphore inorganique dissous (DIP) sous forme de phosphate. Les concentrations en phosphate de ces échantillons ont ensuite été mesurées à l’aide du AA3. Les concentrations en DOP ont finalement été obtenues en soustrayant les concentrations de phosphate aux concentrations de TDP.
Les échantillons pour la mesure de l’azote dissous total (TDN) ont été récoltés et analysés par l’équipe de Michel Lebeuf, collaborateur de l’Institut Maurice-Lamontagne de Pêches et Océans Canada selon méthode de Kattner décrite dans Wurl (2009). Les données
ont été obtenues pour les missions SECO.Net et ont permis de calculer les concentrations en azote organique dissous (DON) en soustrayant les concentrations de nitrate, nitrite et ammonium au concentrations de TDN.
Les limites de détection pour les mesures effectuées sont de 0,03 μmol L-1 pour le NO3-, 0,02 μmol L-1 pour le NO2 et le NH4+, 0,05 μmol L-1 pour le PO43- et le TDP, 0,1 μmol L-1 pour le Si(OH)4+ et l’urée, et 0,01 μmol L-1 pour le TDN.
2.2.2 Phosphore organique particulaire
Les échantillons pour l’analyses du phosphore organique particulaire (POP) ont été récoltés en surface et aux profondeurs visées pour les incubations au 15N. L’eau de mer a été préfiltrée sur filet Nitex de 200 μm de maille afin de retirer le gros zooplancton et les débris particulaires avant d’être récoltée dans des bouteilles Nalgene en HDPE nettoyées au HCl 10% (v/v). Les échantillons ont été ensuite filtrés sur filtres Whatman GF/F (25 mm de diamètre) prébrûlés à 450°C pendant 12 h. Les filtres ont été rincés avec du Na2SO4- 0,17 M, placés dans des tubes cryogéniques de 2 mL et séchés à 60°C pendant 48 h pour leur analyse ultérieure au laboratoire. Les extractions de POP ont été effectuées en milieu acide (HCl) selon la méthode de Solórzano et Sharp (1980). Les échantillons extraits, convertis en phosphates, ont été par la suite analysés à l’aide du AA3 pour déterminer les concentrations en phosphore.
2.3
Taux de prise de l’azote dissous et recyclage de l’ammonium
L’eau destinée aux mesures de prise d’azote a été récoltée dans des contenants opaques en utilisant un filet Nitex de 200 μm de maille afin de retirer le gros zooplancton et autres grosses particules. Ces volumes ont été répartis dans des bouteilles transparentes de 500 mL nettoyées au HCl 10% (v/v), puis 0,1 μmol L-1 d’azote marqué (15N) sous forme de 15NH4Cl, K15NO
3 ou CH415N2O (urée) a été ajouté aux bouteilles. Les bouteilles ont ensuite été placées dans des incubateurs sur lesquels des filtres ont été installés afin de simuler les conditions lumineuses correspondantes à leur profondeur optique d’origine pour une durée de 24h. Afin de standardiser les conditions, la température des incubateurs a été réglée à la température moyenne de l’eau de surface in situ mesurée par le CTD au cours de chaque campagne d’échantillonnage (printemps : 2°C, été : 6°C, automne : incubateurs branchés sur une ligne
d’eau de mer en surface; min : 2°C et max : 12°C, et hiver : 0°C). Après les 24 h d’incubation, les échantillons ont été filtrés sur des filtres Whatman GF/F (24 mm de diamètre) prébrûlés à 450°C pendant 12 h, puis les filtres ont été conservés dans des tubes cryogéniques de 2 mL et séchés à 60°C pendant 48 h. En laboratoire, les filtres ont été séchés à nouveau à 60°C pendant 48h avant d’être enveloppés dans une feuille d’étain et compressés fermement pour retirer toute présence d’air dans la capsule. Les capsules ont ensuite été analysées à l’aide d’un analyseur élémentaire (Costech) couplé à un spectromètre de masse (DeltaV Advantage, Thermo-Finnigan) pour obtenir la masse d’azote organique (PON) et le ratio isotopique 15N/14N de la matière particulaire retenue sur les filtres selon la méthode de Fiedler et Proksch (1975). Les enrichissements isotopiques de l’azote sont exprimés en pourcentage d’atomes en excès de 15N relatif aux standards internationaux de référence (acide
L-glutamique, USGS-40, USGS-41 et IAEA-N3) calibrés par le diazote (N2).
Les prises d’azote (ρNO3-, ρNH4+, ρUrée; µat.g N L-1 j-1) ont été calculées selon Dugdale et Wilkerson (1986) tel que décrit dans Raimbault et Garcia (2008) :
𝜌𝐷𝑁 = 𝑅𝑃𝑂𝑁
𝑅𝐷𝑁∙ 𝑡 ∙ [𝑃𝑂𝑁]
R représente l’enrichissement en 15N atome% de l’azote particulaire (RPON) et de l’azote dissous (RDN), t représente le temps d’incubation, et [PON] représente la concentration finale de PON calculée depuis la masse d’azote particulaire mesurée par le spectromètre de masse et le volume filtré à la fin des incubations.
Les filtrats des échantillons provenant des incubations au 15N-NH4+ ont été conservés par empoissonnement au chlorure de mercure pour déterminer le taux de recyclage de l’ammonium. En laboratoire, le NH4+ présent dans les filtrats a été extrait selon la méthode décrite par Slawyk et Raimbault (1995). L’enrichissement isotopique (ratio 15N/14N) des échantillons a été quantifié par spectrométrie de masse (modèle DeltaV Advantage, Thermo-Finnigan) afin d’estimer les taux de recyclage d’ammonium (rNH4; µat.g N L-1 j-1). Ces derniers ont été calculés au moyen du modèle de Blackburn-Caperon (Blackburn 1979; Caperon et al. 1979) décrit par Laws (1984):
𝑟NH4 = (𝑙𝑛 ( 𝑅𝑓𝑁𝐻4 / 𝑅𝑜𝑁𝐻4 [𝑁𝐻4]𝐹 / [𝑁𝐻4]𝐼
)) ∙ ([𝑁𝐻4]𝐼−
[𝑁𝐻4]𝐹
𝑡 )
où [NH4+]I et [NH4+]F représentent les concentrations initiales et finales de NH4+ mesurées par la méthode fluorométrique décrite dans la section 2.2.1 au début et à la fin des incubations, t représente le temps d’incubation, et RΟ et Rf représentent les enrichissements initiaux et finaux, respectivement, en 15N du NH4+ présent dans le filtrat.
2.4
Consommation biologique des nutriments à Québec
L’analyse préliminaire des données de nutriments récoltées au début du projet ayant mis en évidence des concentrations faibles en phosphate et potentiellement limitantes pour la production primaire à Québec, il s’avérait judicieux d’évaluer l’impact qu’aurait un ajout de phosphore sur la propagation de l’ensemble des nutriments vers l’aval. L’objectif de cette expérience était d’évaluer comment une élévation des teneurs en phosphate qui résulterait soit d’apports fluviaux plus important en amont de Québec, soit de la rencontre des eaux fluviales avec les eaux estuariennes profondes riches en phosphate, affecterait la croissance du phytoplancton et le retrait des nutriments inorganiques dans l’axe d’écoulement du Saint-Laurent.
Lors de la mission d’été 2019 effectuée dans le cadre du programme SECO.Net, 12 L d’eau de surface ont été récoltés à la station EUTAQ (Québec) et à 250 m à la station 3CC (Matane). L’eau provenant de la bouteille d’échantillonnage a été directement filtrée sur filet Nitex de 200 μm afin de retirer le gros zooplancton et autres grosses particules. L’eau a été récoltée dans des bidons opaques en plastique puis conservés à 4°C. Une fois en laboratoire, trois types d’eau ont été générés (en triplicata) : 100% eau de Québec sans aucun ajout de
nutriment (contrôle, QC), 100% eau de Québec avec ajout de 1 μmol L-1 de phosphate (QP),
et 50% eau de Québec/50% eau de Matane (QM) sans ajout de nutriment. Les échantillons ont été placés dans un phytotron (19°C, éclairement journalier de 24 h) pendant 7 jours pour maximiser la croissance du phytoplancton. Des sous-échantillons de nutriments inorganiques (nitrate, nitrite, ammonium, phosphate et silicate) ont été récoltés quotidiennement afin de suivre l’évolution des concentrations.
3. Résultats
Cette section met l’emphase sur les données de surface puisque les eaux de l’estuaire moyen sont généralement bien mélangées verticalement en raison de l’étroitesse et de la profondeur réduite de cette zone.
3.1
Répartition saisonnière des nutriments
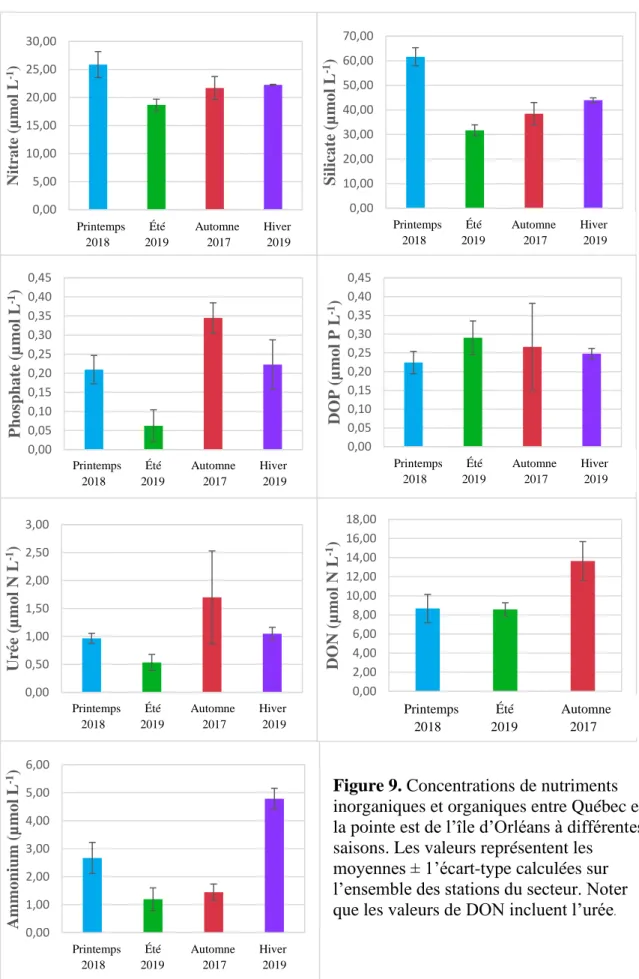
Les données de nutriments récoltées dans le secteur de Québec-île d’Orléans démontrent qu’il y a bel et bien une variation saisonnière des concentrations moyennes en nutriments (Figure 9). Les concentrations moyennes sont toutes minimales en été, mais les maximums mesurés ne sont pas observés aux mêmes saisons selon le type de nutriment. Les concentrations maximales en nitrate (25,9 μmol L-1) et en silicate (61,6 μmol L-1) sont
observées au printemps. Le maximum de phosphate (0,34 μmol L-1) est observé à l’automne
alors que DOP, bien que peu variable entre les saisons, présente un maximum en été (0,29 μmol P L-1). On remarque d’ailleurs que les concentrations moyennes de DOP au printemps, à l’automne et à l’hiver sont plutôt similaires à celles de phosphate, mais qu’en été, il y a près de six fois plus de DOP que de phosphate. Le maximum mesuré d’ammonium (4,79 μmol L-1) est observé en hiver. L’urée (1,70 μmol N L-1) et le DON total
(13,64 μmol N L-1) suivent la même tendance et sont maximaux en automne. Les données
Figure 9. Concentrations de nutriments inorganiques et organiques entre Québec et la pointe est de l’île d’Orléans à différentes saisons. Les valeurs représentent les
moyennes ± 1’écart-type calculées sur l’ensemble des stations du secteur. Noter que les valeurs de DON incluent l’urée.
0,00 1,00 2,00 3,00 4,00 5,00 6,00 A m m onium ( µm ol L -1) 0,00 5,00 10,00 15,00 20,00 25,00 30,00 N it rat e (µ m ol L -1) 0,00 0,05 0,10 0,15 0,20 0,25 0,30 0,35 0,40 0,45 P hos pha te (µm ol L -1) 0,00 10,00 20,00 30,00 40,00 50,00 60,00 70,00 Sil icat e (µm ol L -1) 0,00 0,05 0,10 0,15 0,20 0,25 0,30 0,35 0,40 0,45 DO P ( µm ol P L -1) 0,00 2,00 4,00 6,00 8,00 10,00 12,00 14,00 16,00 18,00 PRINTEMPS ÉTÉ AUTOMNE D O N ( µm ol N L -1) 0,00 0,50 1,00 1,50 2,00 2,50 3,00 U ré e (µm ol N L -1) Printemps Été Automne 2018 2019 2017
Printemps Été Automne Hiver
2018 2019 2017 2019
Printemps Été Automne Hiver
2018 2019 2017 2019
Printemps Été Automne Hiver
2018 2019 2017 2019
Printemps Été Automne Hiver
2018 2019 2017 2019
Printemps Été Automne Hiver
2018 2019 2017 2019
Printemps Été Automne Hiver
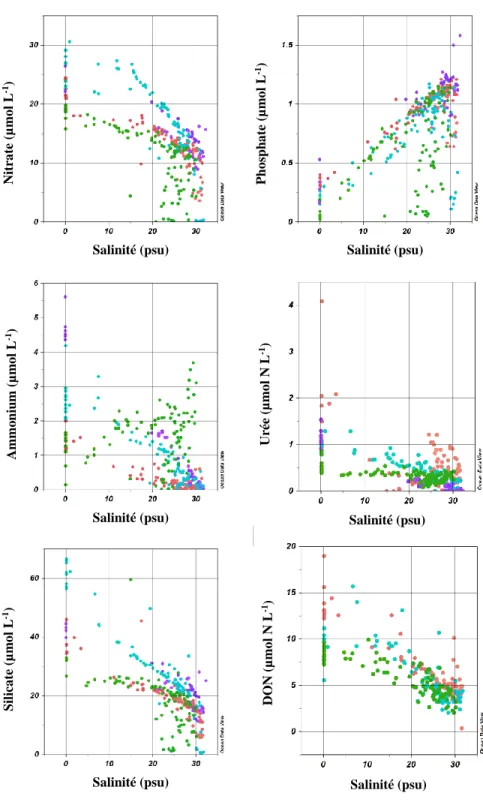
La figure 10 présente les concentrations des différents nutriments sur les 25 premiers mètres de la colonne d’eau en fonction de la salinité. La salinité est utilisée ici comme un indicateur de la position ‘écologique’ d’une station donnée puisque ses coordonnées géographiques ne reflètent pas toujours le même degré de mélange entre l’eau douce (salinité de 0 psu à Québec) et l’eau marine (salinité de surface avoisinant 35 psu près de Pointe-des-Monts). L’estuaire moyen contient la presque entièreté de la zone de transition entre les eaux douces et salées (1-25 psu). Il est à noter que les stations visitées en hiver ne permettent pas d’avoir une couverture complète de l’estuaire moyen, ce qui empêche d’avoir une vision adéquate des concentrations hivernales dans cette section de l’estuaire. Les concentrations de nitrate et de silicate sont plus élevées au printemps qu’aux autres saisons. La répartition des données d’ammonium diffère pour chaque saison et on peut remarquer que les concentrations estivales suivent une tendance inverse aux autres saisons en augmentant vers l’aval. Pour les autres nutriments, cette distinction saisonnière n’est pas toujours présente. Les données de phosphate le démontrent bien puisqu’il n’y a pas de variation saisonnière dans les concentrations mesurées dans l’estuaire moyen. Les concentrations printanières et automnales de l’urée et du DON sont similaires et supérieures à celles mesurées en été.
Toujours en se référant à la figure 10, on peut observer qu’il existe moins de variations saisonnières dans les concentrations en nutriments dans l’estuaire maritime (salinité > 25 psu). En effet, pour chaque nutriment, les concentrations convergent généralement vers des valeurs similaires peu importe la saison. Cette tendance n’est toutefois pas systématique comme le démontrent les concentrations estivales de nitrate, de phosphate et d’ammonium notamment. Cette situation est bien représentée par l’hétérogénéité dans les distributions de données. Ces variations au sein d’une même saison découlent cependant d’une variation spatiale des concentrations de nutriments dans l’estuaire maritime (Figures 11 et 12).
Figure 10. Variations saisonnières des concentrations de nutriments dans les 25 premiers mètres de la colonne d’eau en fonction de la salinité. La salinité est utilisée comme un indicateur de la position écologique d’une station donnée dans l’estuaire. Les couleurs indiquent la saison d’échantillonnage : printemps (bleu), été (vert), automne (rouge) et hiver (violet). Noter que les valeurs de DON incluent l’urée.
Salinité (psu) Salinité (psu)
Salinité (psu) Salinité (psu) Salinité (psu) Salinité (psu) Nitr a te (µm o l L -1) Am m o n iu m (µm o l L -1) S il ica te (µm o l L -1) DO N (µm o l N L -1) Ur ée (µm o l N L -1) Ph o sph a te (µm o l L -1)
3.2
Répartition spatiale des nutriments
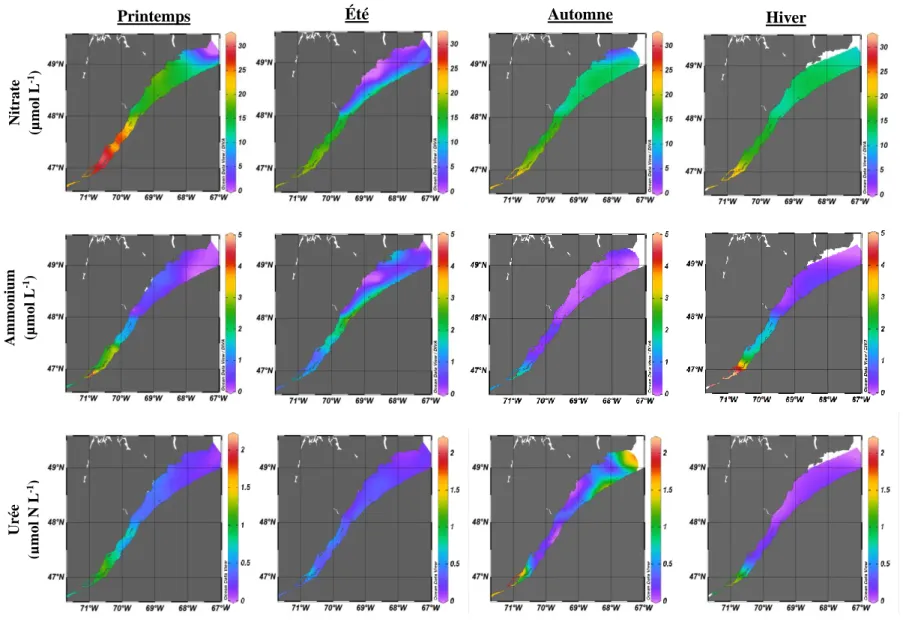
Les concentrations de nutriments en surface sont présentées aux figures 11 et 12 et ont été interpolées (interpolation par la méthode DIVA à l’aide du logiciel Ocean Data View, version 5.1.5) afin de visualiser leur répartition générale. Tout d’abord, on peut observer que le nitrate, le silicate, l’ammonium et le DON (données non présentées) sont généralement plus élevés dans le secteur de Québec et de l’estuaire moyen et que les concentrations diminuent en se dirigeant vers l’aval. Les concentrations en phosphate présentent une relation inverse en étant faibles à Québec et en augmentant vers l’aval. L’urée est détectée de manière constante près de Québec, mais ne présente pas de patron de répartition particulier dans la zone d’étude. L’hétérogénéité spatio-temporelle des concentrations en nitrate, ammonium et phosphate observée dans l’estuaire maritime dans la figure 10 est bien visible dans les eaux de surface (Figures 11 et 12). Dans l’estuaire maritime, les concentrations estivales en nitrate et en phosphate sont plus élevées près de la rive sud, alors qu’elles sont presque nulles au niveau de la rive nord. Cette variation entre les rives nord et sud est également observée dans les données d’ammonium de l’estuaire moyen au printemps ainsi qu’à la zone de transition entre l’estuaire moyen et l’estuaire maritime pendant l’été.
Le DOP n’a été détecté que dans les échantillons de salinité inférieure à 5 psu, soit dans la zone entre Québec et la pointe est de l’île d’Orléans, où les concentrations variaient entre 0 et 0,56 μmol L-1. De plus, les concentrations de DOP ne présentent pas de tendance saisonnière et ne sont pas corrélées avec la salinité. Pour les autres nutriments, les concentrations montrent des changements plus progressifs, voire quasi-linéaires, en fonction de la salinité à l’intérieur de chaque saison (Figure 10). Vu les différences latérales de concentrations observées entre la rive sud et la rive nord en été (Figures 11 et 12), la Figure 13 présente, en guise d’exemple, une vue plus détaillée de la relation entre la salinité et la concentration en nitrate dans les 25 premiers mètres des différentes stations. On peut observer que les concentrations en nitrate des stations entre Québec et la rivière Saguenay (fin de l’estuaire moyen) suivent une même tendance linéaire à la diminution avec l’augmentation de la salinité, bien qu’à une salinité donnée les deux stations situées immédiatement au nord-est de l’île d’Orléans montrent des concentrations légèrement inférieures à celle des stations proches de la rive sud (Figure 13A). Ces dernières s’inscrivent
en continuité avec les stations de la rive sud de l’estuaire maritime. Dans cette portion de l’estuaire, la relation entre la concentration en nitrate et la salinité pour les stations de la rive nord tranchent résolument sur celle observée près de la rive sud, avec des concentrations qui cette fois augmentent avec la salinité (Figure 13B). Cette dernière tendance s’applique aussi aux stations situées au centre des transects entre les rives nord et sud (Figure 13C).
Figure 11. Répartition horizontale des concentrations de nitrate, d’ammonium et d’urée en surface entre Québec et Pointe-des-Nit ra te (µm o l L -1) Am m o niu m (µm o l L -1) Urée (µm o l N L -1)
Figure 12. Répartition horizontale des concentrations de phosphate et de silicate en surface entre Québec et Pointe-des-Monts à différentes saisons. P ho sph a te (µm o l L -1 ) Sil ica te (µm o l L -1)
A
B
C
Salinité (psu) Salinité (psu) Salinité (psu)
Nitr a te ( µm o l L -1) Nitr a te ( µm o l L -1) Nitr a te ( µm o l L -1)
Figure 13 Concentrations estivales de nitrates dans les 25 premiers mètres de la colonne d’eau en fonction de la salinité pour les stations du secteur de Québec, de l’estuaire moyen et de la rive sud de l’estuaire maritime en (A), ces mêmes stations plus celles de la rive nord de l’estuaire maritime en (B), puis uniquement les stations du centre de l’estuaire maritime en (C).
3.3
Ratios élémentaires
La figure 14 présente les ratios molaires entre l’azote inorganique dissous (c.-à-d., nitrate plus nitrite plus ammonium) et le phosphate (N:P) mesurés dans les 25 premiers mètres de la colonne d’eau en fonction de la salinité. On remarque que les ratios à la hauteur de Québec-île d’Orléans (salinité de 0 psu) varient énormément (min : 59 ; max : 1058). Les ratios N:P diminuent graduellement en fonction de la salinité une fois dans l’estuaire moyen jusqu’à atteindre des valeurs en dessous du ratio de Redfield de 16:1 (Redfield et al. 1963) dans l’estuaire maritime. Les ratios entre le silicate et l’azote inorganique dissous (Si:N) sont tous supérieurs au ratio de Brzezinski de 1:1 (Brzezinski 1985).
Figure 14. Ratios N:P des nutriments inorganiques des 25 premiers mètres de la colonne d’eau en fonction de la salinité. Les ratios sont présentés avec une échelle A) linéaire et B) logarithmique. Les couleurs indiquent la saison d’échantillonnage : printemps (bleu), été (vert), automne (rouge) et hiver (violet). Le trait pointillé représente le ratio de Redfield (16:1).
L’analyse des ratios élémentaires nous indique aussi qu’au printemps, les eaux de surface de l’estuaire maritime ne présentent pas les mêmes ratios que les eaux profondes qui remontent à la hauteur de Tadoussac (Figure 15). Bien que les eaux de surface et les eaux avoisinant les 100-150 m de profondeur présentent une concentration en nitrate similaire (~17 μmol L-1), les ratios N:P des nutriments inorganiques (nitrate, nitrite, ammonium et
Ra tio N: P ( m o l/m o l) Ra tio N: P ( m o l/m o l) Salinité (psu) Salinité (psu) A B
phosphate) qui y sont associés sont différents. Il s’agit cependant de la seule saison où on observe une telle différence entre les ratios N:P des eaux de surface et des profondeurs intermédiaires.
Figure 15. Variations de la concentration printanière de nitrate et du ratio N:P des
nutriments inorganiques entre Québec et Pointe-des-Monts au printemps. Les données ont été interpolées à partir des stations situées au centre de l’estuaire (voir carte) (méthode
DIVA; logiciel Ocean Data View, version 5.1.5).
Tadoussac Ra tio N:P Nit ra te (µm o l L -1) Pro fo n d eu r (m ) Distance de Québec (km) Distance de Québec (km) Pro fo n d eu r (m )
3.4
Taux de prise de l’azote
Des incubations avec enrichissement trace de nitrate, d’ammonium ou d’urée marqué au 15N
ont été effectuées à un total de 41 stations réparties sur quatre saisons (Figures 7 et 8). Les incubations ont été effectuées à différentes stations le long de l’axe d’écoulement du Saint-Laurent afin de vérifier s’il y a une différence spatiale dans la prise d’azote par le phytoplancton dans la zone euphotique. La figure 16 présente la prise totale d’azote selon la profondeur optique d’incubation (50%, 15% et 1% de la lumière en surface). À la station
EUTAQ située un peu en amont de Québec, les taux de prise totale d’azote sont plus élevés
qu’ailleurs dans l’estuaire au printemps (entre 0,36 et 0,58 µat.g N L-1 j-1), à l’automne (entre 0,56 et 0,65 µat.g N L-1 j-1) et en hiver (entre 0,25 et 0,29 µat.g N L-1 j-1). En été cependant, c’est à la station MUCCI D (estuaire moyen) que les plus hauts taux de prise d’azote sont observés (entre 0,93 et 2,0 µat.g N L-1 j-1). De manière générale, les taux de prise les plus élevés ont été observés à l’été et, tel qu’attendu, les taux les plus bas ont été mesurés en hiver. Les données de printemps et d’automne démontrent une augmentation des taux de prise dans toute la zone d’étude par rapport à l’hiver. À l’exception du secteur de l’estuaire moyen en été où toutes les stations présentent des taux de prise croissants entre le 50% et le 1% de lumière, aucune tendance constante n’est observée aux autres saisons entre les taux de prise totale d’azote et l’intensité lumineuse d’incubation.
La contribution relative moyenne de chaque composé (nitrate, ammonium et urée) à la prise totale d’azote dissous a été calculée pour chaque incubation et est rapportée à la figure 17. La prise totale de l’azote dissous est majoritairement constituée de nitrate et d’ammonium alors que l’urée présente une faible contribution. En été, la prise d’azote sous forme d’ammonium est généralement plus élevée qu’aux autres saisons. Les contributions relatives de l’ammonium et du nitrate sont relativement constantes partout dans la zone d’étude alors qu’au printemps la prise d’azote semble différente entre les deux régions de l’estuaire. L’estuaire moyen est marqué par une prise totale d’azote principalement sous forme de nitrate (à l’exception de la station EUT01) tandis que l’estuaire maritime présente une augmentation de la proportion en ammonium.
Figure 16. Prise totale de l’azote dissous (N totale) par profondeur optique (moyenne ± écart-type ; µat.g N L-1 j-1). La barre pointillée indique l’emplacement de Tadoussac par rapport aux stations d’incubation. Noter que les échelles de l’axe vertical sont différentes entre les saisons.
Figure 17. Contribution relative moyenne du nitrate, de l’ammonium et de l’urée à la prise totale de l’azote dissous pour chaque station d’incubation. La barre pointillée rouge indique l’emplacement de Tadoussac par rapport aux stations d’incubation.
3.5
Recyclage de l’ammonium
Les mesures de recyclage de l’ammonium ont été effectuées sur les échantillons pris entre Québec et l’estuaire moyen à toutes les saisons. Dans ce secteur, les taux de recyclage d’ammonium sont généralement plus élevés que les taux de prise d’Ammonium (Tableau 1), à l’exception de la station EUTAQ en été (voir la figure 18). Les taux de recyclage d’ammonium les plus élevées sont observées en hiver à la station P01 située près de la pointe ouest de l’île d’Orléans, et ces taux sont entre 12 et 25 fois plus élevés que les taux de prise d’ammonium associées aux mêmes profondeurs optiques.
Tableau 1. Taux de recyclage (rNH4 ; µat.g N L-1 j-1) et de prise d’ammonium (NH4 ;
µat.g N L-1 j-1) mesurés entre Québec et l’estuaire moyen.
Printemps Été Automne Hiver
Station % lumière rNH4 (SD) NH4 (SD) rNH4 (SD) NH4 (SD) rNH4 (SD) NH4 (SD) rNH4 (SD) NH4 (SD) EUTAQ 50 0,610 (0,046) 0,149 (0,006) 0,032 (0,032) 0,494 (0,006) 0,655 (0,035) 0,015 (0,001) 15 0,846 (0,149) 0,153 (0,012) 0,048 (0,015) 0,459 (0,003) 0,950 (0,017) 0,015 (0,002) 1 0,824 (0,041) 0,122 (0,001) 0,250 (0,086) 0,139 (0,014) 0,908 (0,013) 0,015 (0,002) P01 50 1,276 (0,287) 0,102 (0,004) 15 1,900 (0,014) 0,076 (0,015) 1 1,520 (0,204) 0,099 (0,007) EUT01 50 0,929 (0,033) 0,088 (0,005) 0,203 (0,038) 0,133 (0,014) 0,167 (0,014) 0,028 (0,001) 15 0,836 (0,005) 0,113 (0,006) 0,281 (0,044) 0,087 (0,004) 0,301 (0,072) 0,031 (0,000) 1 0,811 (0,012) 0,083 (0,002) 0,231 (0,084) 0,062 (0,003) 0,175 (0,020) 0,033 (0,000) EUT04 50 0,203 (0,000) 0,252 (0,030) 15 0,550 (0,000) 0,196 (0,002) 1 0,293 (0,000) 0,094 (0,001)