La prophylaxie préexposition (PrEP) pour la prévention
du VIH chez les hommes ayant des relations sexuelles
avec d’autres hommes (HARSAH) à Bouaké, en Côte
d’Ivoire :
évaluation qualitative de l’acceptabilité et de la
faisabilité
Mémoire
Sara Jeanne Pelletier
Maîtrise en santé publique - avec mémoire
Maître ès sciences (M. Sc.)
Québec, Canada
© Sara Jeanne Pelletier, 2019
La prophylaxie préexposition (PrEP) pour la prévention
du VIH chez les hommes ayant des relations sexuelles
avec d’autres hommes (HARSAH) à Bouaké,
en Côte d’Ivoire
Évaluation qualitative de l’acceptabilité et de la faisabilité
Mémoire
Sara Jeanne Pelletier
Sous la direction de :
Michel Alary, directeur de recherche
Marie-Pierre Gagnon, codirectrice de recherche
ii
Résumé
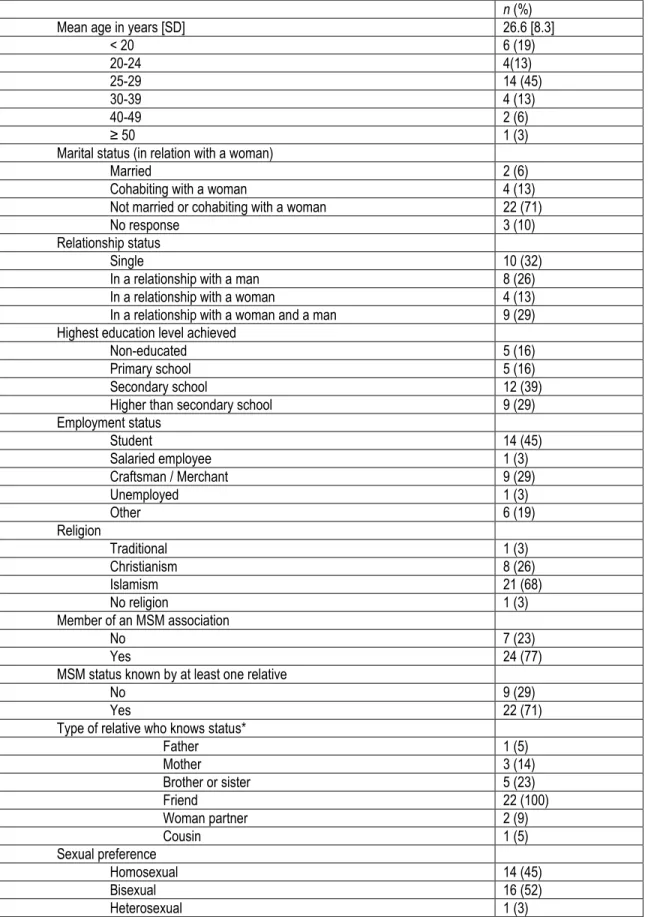
Le VIH demeure une problématique de santé publique importante partout dans le monde. En Côte d’Ivoire, les hommes ayant des relations sexuelles avec d’autres hommes (HARSAH) ont un fardeau disproportionné de VIH. Dans cette étude, nous avons évalué l’acceptabilité et la faisabilité de la prophylaxie préexposition (PrEP), une méthode de prévention contre le VIH, chez les HARSAH de Bouaké, en Côte d’Ivoire. Nous avons conduit quatre groupes de discussion avec 31 HARSAH séronégatifs, huit entrevues individuelles approfondies avec des participants des groupes de discussion et cinq entrevues avec des informateurs-clés. Les données ont été interprétées à l’aide d’une analyse thématique de contenu. Seulement quatre HARSAH (13 %) connaissaient la PrEP avant l’étude. Tous les participants étaient intéressés à utiliser la PrEP : 61.3% préféreraient le régime quotidien et 38.7% le régime sur demande. Plusieurs avantages de la PrEP ont été mentionnés : la protection lors d’un bris du condom, la protection lors de comportements sexuels à risque, l’autonomie, la diminution de la peur du VIH, l’augmentation de la confiance en son partenaire et la facilité d’utilisation. Les barrières à l’utilisation de la PrEP qui ont été nommées incluent : l’absence de protection contre les autres infections transmises sexuellement (ITS), prendre un comprimé régulièrement, la taille du comprimé, les effets secondaires, le coût et l’accessibilité. Six participants (19.3 %) ont admis qu’ils utiliseraient moins les condoms s’ils utilisaient la PrEP. Nos résultats montrent que la PrEP est hautement acceptable chez les HARSAH de Bouaké. Son implantation devrait être faite rapidement et la PrEP devrait être une composante d’un programme de prévention incluant du counseling, un dépistage des ITS et la promotion des pratiques sexuelles sécuritaires. Les autorités de Côte d’Ivoire devraient considérer la PrEP pour tous les groupes à risque afin d’éviter d’accentuer la stigmatisation en ne ciblant que les HARSAH.
iii
Abstract
HIV remains an important public health issue throughout the world. In Côte d’Ivoire, a high burden of HIV is observed in men who have sex with men (MSM). In this study, we assessed the acceptability and feasibility of preexposure prophylaxis (PrEP), an efficient prevention method against HIV, among MSM in Bouaké, Côte d’Ivoire. We conducted four focus groups with 31 HIV-negative MSM, eight in-depth individual interviews with participants recruited from the focus groups and five interviews with key informants. Data were interpreted with a thematic analysis method. Only four MSM (13%) were aware of PrEP before participating in the study. All participants were interested in taking PrEP if available: 19 (61.3%) would prefer the daily regimen and 12 (38.7%) would opt for the on-demand regimen. Many advantages of PrEP were mentioned, such as: protection in case of condom breakage, protection in case of high-risk sexual behaviour, self-reliance, decreasing HIV fear, increasing trust in partner and ease of use. Barriers to the use of PrEP included: it does not protect against other sexually transmitted infections (STIs) which implies that condom use is still necessary, having to take a pill regularly, the size of the pill, possibility of side effects and long-term effects, the cost and the accessibility. Six participants (19.3 %) admitted that they would stop using condoms or would use them less if they take PrEP. Findings indicate that PrEP is highly acceptable within the MSM community. Implementation should be done rapidly, and PrEP should be part of a global prevention program which includes counselling, regular STI screening and promotion of safe sex practices, including condom promotion. Health authorities should consider PrEP for all high-risk groups to avoid worsening stigmatization by targeting MSM only.
iv
Table des matières
Résumé ... ii
Abstract ... iii
Table des matières ... iv
Liste des tableaux ... vii
Liste des abréviations ... viii
Remerciements ... x
Avant-propos ... xi
Introduction ... 1
CHAPITRE 1 - REVUE DE LA LITTÉRATURE ... 3
1.1 Le VIH/SIDA... 3
1.1.1 Le VIH/SIDA chez les HARSAH dans le monde ... 3
1.1.2 Le VIH/SIDA chez les HARSAH en Afrique au sud du Sahara ... 4
1.1.3 Le VIH/SIDA chez les HARSAH en Côte d’Ivoire ... 6
1.1.4 Les cibles de l’ONUSIDA ... 7
1.2 La PrEP ... 8
1.2.1 Les recommandations en lien avec la PrEP chez les HARSAH ... 8
1.2.2 La PrEP comme composante d’un éventail de services préventifs ... 9
1.2.3 Posologie et modalités de prise de la PrEP ... 10
1.2.4 Efficacité de la PrEP chez les HARSAH ... 10
1.2.5 Sécurité de la PrEP ... 16
1.2.6 Risque de développement de résistance aux antirétroviraux (ARV) ... 18
1.2.7 Comportements sexuels à risque sous PrEP ... 19
1.2.8 Autres modalités de PrEP et nouveautés en développement ... 20
CHAPITRE 2 – CADRE THÉORIQUE, OBJECTIF ET SOUS-OBJECTIFS DE LA RECHERCHE .... 23
2.1 Cadre théorique ... 23
2.1.1 Le cadre des domaines théoriques (CDT) ... 23
2.1.2 Le CDT dans les recherches en santé ... 24
2.1.3 Les domaines choisis pour la recherche ... 26
2.1.4 Les domaines non retenus pour la recherche ... 27
2.2 Objectif et sous-objectifs de la recherche ... 27
v
3.1 Devis de l’étude ... 29
3.2 Milieu de l’étude ... 29
3.3. Population à l’étude, échantillonnage et recrutement ... 30
3.3.1 Critères d’éligibilité ... 30
3.3.2 Calcul de la taille d’échantillon ... 30
3.3.3 Recrutement des participants pour le volet qualitatif ... 31
3.4 Collecte de données et instruments ... 32
3.4.1 Cahier des procédures ... 32
3.4.2 Journal de bord ... 32
3.4.3 Entrevues ... 32
3.4.4 Questionnaire ... 36
3.5 Variables à l’étude du volet qualitatif ... 36
3.6 Analyses qualitatives ... 37
3.7 Considérations éthiques ... 37
CHAPITRE 4 – RÉSULTATS ... 39
4.1 Caractéristiques des participants ... 39
4.2 Analyse qualitative des groupes de discussion et des entrevues effectués auprès d’HARSAH ... 41
4.2.1 Les connaissances ... 41
4.2.2 Le renforcement ... 42
4.2.3 Les influences sociales ... 47
4.2.4 Les intentions ... 53
4.2.5 Les croyances en lien avec les capacités ... 55
4.2.6 La régulation comportementale ... 55
4.3 Analyse qualitative des entretiens avec des informateurs-clés ... 56
4.3.1 Les activités de prévention du VIH pour les HARSAH ... 56
4.3.2 Les soins de santé pour les HARSAH ... 58
4.3.3 La prophylaxie préexposition ... 59
4.3.4 Les autres recommandations des informateurs-clés ... 63
CHAPITRE 5 – DISCUSSION ... 65
5.1 Caractéristiques sociodémographiques des participants ... 65
5.2 Niveau de connaissance faible de la PrEP ... 66
vi
5.4 La problématique de l’accès à la PrEP ... 69
5.5 La stigmatisation ... 71
5.6 La compensation des risques ... 72
5.7 Les forces et les limites de l’étude ... 73
5.8 Retombées pour la santé publique ... 75
CONCLUSION ET RECOMMANDATIONS ... 77
Bibliographie ... 79
Annexe I - Les 14 domaines du Cadre des domaines théoriques (CDT) ... 93
Annexe II – Guide d’entrevue pour les groupes de discussion ... 97
Annexe III – Guides d’entretiens individuels approfondis avec les HARSAH ... 101
Annexe IV – Guides d’entretiens individuels approfondis avec les informateurs-clés ... 106
Annexe V - Fiche d’information pour les participants aux groupes de discussion ... 109
Annexe VI – Fiche de consentement pour les participants aux groupes de discussion ... 112
Annexe VII – Registre des enquêtés (volet qualitatif) ... 114
Annexe VIII – Fiche de renseignement pour les participants aux groupes de discussion ... 115
Annexe IX – Fiche d’information pour les entretiens individuels approfondis avec les HSH ... 117
Annexe X – Fiche de consentement pour les entretiens individuels approfondis avec les HSH ... 120
Annexe XI – Fiche d’information pour les informateurs-clés ... 122
Annexe XII – Fiche de consentement des informateurs-clés ... 126
vii
Liste des tableaux
Tableau 1.1 : Résultats des principales études portant sur la prophylaxie préexposition (PrEP) chez
les HARSAH………14
Tableau 1.2 : Résultats des principales études portant sur l’efficacité de la prophylaxie préexposition (PrEP) chez les populations autres que les HARSAH………...15
Tableau 4.1 : Caractéristiques des participants……….…...40
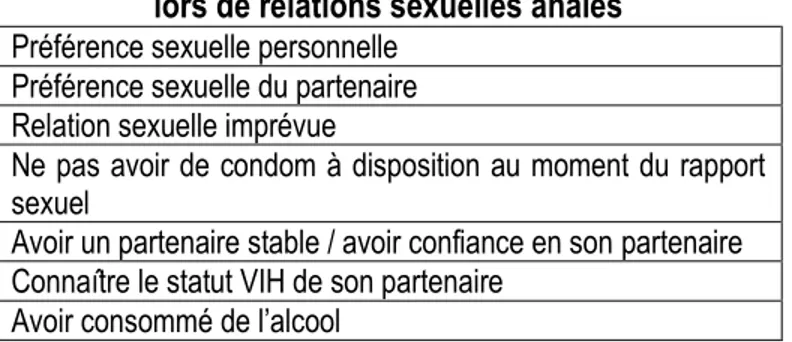
Tableau 4.2 : Raisons pour ne pas utiliser le condom lors de relations sexuelles anales……….42
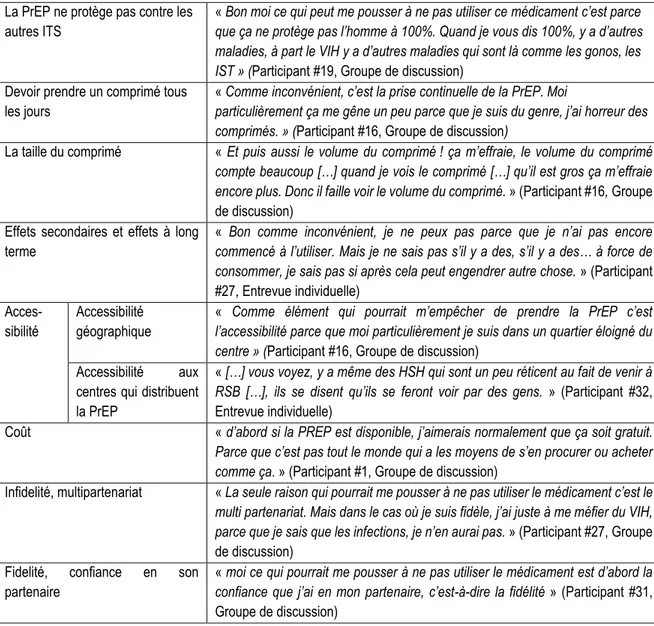
Tableau 4.3 : Résumé des incitatifs et avantages à utiliser la PrEP……….…………... 44
Tableau 4.4 : Résumé des conséquences et barrières à l’utilisation de la PrEP………….…………...47
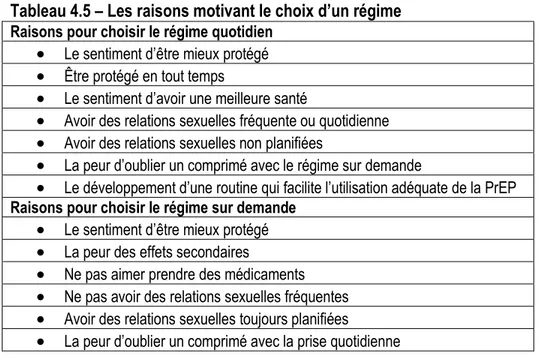
Tableau 4.5 : Les raisons motivant le choix d’un régime……….………54
Tableau 4.6 : Défis et facteurs facilitant pour la mise en œuvre de la PrEP………61
viii
Liste des abréviations
ARV : Antirétroviraux
AST : Aspartate-aminotransférase
CAB : Cabotegravir
CDC : Centers for Disease Control and Prevention CDT : Cadre des domaines théoriques
FTC : Emtricitabine
HARSAH : Hommes ayant des relations sexuelles avec d’autres hommes HSH : Hommes ayant des relations sexuelles avec d’autres hommes ITS : Infections transmissibles sexuellement
MSM : Men who have sex with men OMS : Organisation mondiale de la santé ONG : Organisation non gouvernementale
ONUSIDA : Programme commun des Nations Unies sur le VIH/sida PrEP : Prophylaxie pré-exposition
PVVIH : Personnes vivant avec le VIH
RPV : Rilpivirine
RSB : Renaissance Santé Bouaké
QALY : Quality-adjusted life year ou Années de vie pondérées par la qualité SIDA : Syndrome d’immunodéficience acquise
TDF : Tenofovir Disoproxil Fumarate VIH : Virus d’immunodéficience humaine
ix
Je dédie ce mémoire à mon père qui, au cours de la dernière année, a affronté et surmonté la maladie avec courage et résilience.
x
Remerciements
À mon directeur de recherche, Dr Michel Alary, merci pour votre confiance et pour l’autonomie que vous m’avez accordée. Merci d’avoir partagé avec moi votre expertise immense et, surtout, merci de m’avoir offert l’opportunité de travailler sur ce projet qui a su rejoindre en tous points mes intérêts. À ma co-directrice de recherche, Dre Marie-Pierre Gagnon, merci pour votre disponibilité et vos judicieux conseils. Votre dévouement envers vos étudiants est évident et tellement apprécié.
À Dr Souleymane Diabaté, un énorme merci pour ton accueil et ton accompagnement chaleureux lors de mon séjour en Côte d’Ivoire. Merci également pour tes commentaires et conseils toujours pertinents tout au long du processus de recherche et de rédaction.
Au personnel de Renaissance Santé Bouaké, en particulier M. Josué Biékoua, et au Professeur Ouffoué Kra, merci pour votre implication précieuse dans le projet.
À toutes les personnes qui ont participé à ma recherche et que j’ai eu l’occasion de rencontrer lors de mon séjour à Bouaké, merci pour votre confiance, votre ouverture et vos réflexions toujours pertinentes et souvent touchantes.
Finalement, merci à ma famille, mes amis et mes collègues pour votre support et vos encouragements. À mes parents qui ont toujours su valoriser l’éducation, merci pour votre soutien indéfectible. Un merci particulier à Frédéric pour tes nombreuses relectures de mon travail, tes réflexions pertinentes et ton support au quotidien.
xi
Avant-propos
La présente recherche a été possible grâce au soutien financier des Instituts de recherche en santé du Canada ainsi qu’aux partenariats avec l’Université Alassane Ouattara de Bouaké et avec les organismes Renaissances Santé Bouaké et Secours Social.
Toutes les données présentées dans ce mémoire ont été recueillies par l’étudiante-chercheure, qui a conduit tous les groupes de discussion et les entrevues individuelles lors de son séjour à Bouaké en Côte d’Ivoire en juillet 2018. Une partie de la transcription des verbatim et l’analyse de toutes les données recueillies ont également été faites par l’étudiante-chercheure.
1
Introduction
Le virus de l’immunodéficience humaine (VIH), qui cause le syndrome d’immunodéficience acquise (SIDA), est un problème de santé publique important à l’échelle mondiale, touchant actuellement des millions de personnes, et en ayant tué des millions d’autres. En 2017, 36.9 millions de personnes vivaient avec le VIH et 1.8 millions de personnes ont été nouvellement infectées dans le monde (ONUSIDA, 2018b). Des efforts considérables ont été faits au cours des dernières décennies pour freiner la transmission du VIH et pour élaborer des traitements permettant aux personnes porteuses de l’infection de vivre une vie normale. Ces efforts ont porté fruit puisque, entre 2000 et 2014, le nombre de nouvelles infections a diminué de 35 % et le nombre de décès reliés au VIH a diminué de 24 % dans le monde (OMS, 2015c). Toutefois, certaines régions du monde et certains sous-groupes de la population demeurent à risque accru de contracter le VIH et ont un accès moindre aux traitements. En effet, partout dans le monde il est reconnu que des populations, à cause de contraintes sociales comme la stigmatisation, l’exclusion sociale ou la criminalisation, sont particulièrement vulnérables au VIH. Ces populations sont appelées les « populations clés ». Les cinq principaux groupes qui sont considérés comme des populations clés sont les hommes ayant des rapports sexuels avec d’autres hommes (HARSAH), les travailleurs(ses) du sexe, les utilisateurs de drogues injectables, les personnes transgenres et les personnes incarcérées (ONUSIDA, 2017d). En Côte d’Ivoire, les HARSAH ont un fardeau disproportionné de VIH, avec une prévalence estimée à 12,3 % en 2017 (ONUSIDA, 2018a) soit entre quatre et cinq fois plus que dans la population globale où la prévalence dans la population adulte était de 2,8 % en 2017 (ONUSIDA, 2018a). Également, les HARSAH sont un vecteur de la transmission de l’infection dans la population générale puisque, vu la stigmatisation reliée à l’homosexualité, plusieurs HARSAH sont mariés à une femme ou ont des rapports sexuels avec des femmes. Plusieurs facteurs expliquent la vulnérabilité au VIH des HARSAH de Côte d’Ivoire : des fausses croyances persistent au sein de cette population comme quoi les relations sexuelles anales seraient moins à risque de transmission du virus que les relations vaginales (Aho et al., 2014; Hakim et al., 2015) et la prévalence élevée de comportements sexuels à risque (Hakim et al., 2015).
La prophylaxie préexposition (PrEP) est une méthode de prévention primaire contre le VIH qui consiste en la prise quotidienne ou à la demande d’un médicament appelé Truvada® (Gilead Sciences Inc., Foster City, CA, USA) par les personnes séronégatives, mais à risque de contracter le VIH (Coutinho & Prasad, 2013). Des essais cliniques randomisés ont montré que la PrEP était hautement efficace pour prévenir
2
l’infection à VIH chez les HARSAH (Grant et al., 2010; McCormack et al., 2016; Molina et al., 2017). La PrEP est donc une méthode prometteuse pour diminuer l’incidence du VIH chez les HARSAH de Côte d’Ivoire. Toutefois, afin d’implanter la PrEP de façon à répondre aux besoins des HARSAH, mais sans exacerber la stigmatisation envers ces hommes, il est primordial d’évaluer l’acceptabilité et la faisabilité de cette méthode dans cette population. À notre connaissance, avant notre recherche, aucune étude qualitative sur l’acceptabilité et la faisabilité de la PrEP n’avait été menée chez les HARSAH en Côte d’Ivoire.
Notre étude a eu lieu à Bouaké, deuxième plus grande ville de Côte d’Ivoire en termes de démographie. Afin d’évaluer l’acceptabilité et la faisabilité de la PrEP chez les HARSAH de Côte d’Ivoire, nous avons conduit quatre groupes de discussion avec un total de 31 HARSAH séronégatifs, huit entrevues individuelles approfondies avec des participants des groupes de discussion et cinq entrevues avec des informateurs-clés. Les informateurs-clés étaient des personnes provenant de diverses organisations qui contribuent à la lutte au VIH en Côte d’Ivoire. La collecte de données s’est tenue en juillet 2018. Le présent mémoire est divisé en six grands chapitres. Le premier consiste en une revue de la littérature qui permettra au lecteur de bien comprendre la problématique du VIH chez les HARSAH et de connaître les détails de la PrEP ainsi que les enjeux qui sont reliés à cette méthode de prévention. Le second chapitre présente le cadre théorique qui a été utilisé pour guider la recherche ainsi que les objectifs de l’étude. Le troisième chapitre décrit la méthodologie qui a été utilisée pour la collecte et l’analyse des données qualitatives. Le quatrième chapitre présente les résultats de l’étude. Une discussion de ces résultats est présentée au cinquième chapitre. Finalement, le chapitre six présente les conclusions de l’étude ainsi que les recommandations formulées à la suite de la recherche et qui permettront d’orienter la mise en place de la PrEP en Côte d’Ivoire.
3
CHAPITRE 1 - REVUE DE LA LITTÉRATURE
1.1 Le VIH/SIDA1.1.1 Le VIH/SIDA chez les HARSAH dans le monde
Le VIH, qui est responsable du SIDA, a entraîné plus de 35 millions de décès depuis les premiers cas décrits au début des années 1980 (OMS, 2017b). Malgré les avancées technologiques et médicales, l’infection à VIH reste encore très répandue à travers le monde et demeure une maladie dévastatrice. Le programme conjoint des Nations Unies sur le VIH/SIDA (ONUSIDA) estime qu’en 2017, 36,9 millions de personnes vivaient avec le VIH dans le monde (ONUSIDA, 2018b). De nos jours, des traitements sont disponibles et, bien qu’ils ne soient pas curatifs, permettent d’atteindre une espérance de vie presque normale. Cela explique l’augmentation importante de la prévalence des cas de VIH dans le monde. Toutefois, l’accès au dépistage et au traitement n’est pas équitable pour tous. Malgré les découvertes médicales et les traitements disponibles, presque un million de décès liés au VIH ont été rapportés en 2017 (ONUSIDA, 2018b). De plus, l’incidence du VIH reste encore élevée, avec 1,8 millions de nouveaux cas en 2017 (ONUSIDA, 2018b). Il faut tout de même mentionner les progrès importants à l’échelle mondiale qui ont été réalisés dans la lutte au VIH depuis l’an 2000. En effet, un effort mondial a été fait pour diminuer les cas incidents de VIH et pour rendre davantage disponibles les traitements antirétroviraux. Entre 2000 et 2014, le nombre de nouvelles infections a diminué de 35% et le nombre de décès reliés au VIH a diminué de 24 % dans le monde (OMS, 2015c).
Malgré cette riposte mondiale, le VIH demeure une infection répandue et certains groupes de la population sont davantage touchés. L’Organisation mondiale de la Santé (OMS), dans ses lignes directrices sur le VIH, utilise le terme « populations clés » pour définir les groupes qui ont un fardeau de VIH disproportionné par rapport au reste de la population (OMS, 2015a). Les HARSAH forment l’une de ces populations clés, et ce, partout dans le monde (ONUSIDA, 2017c). En effet, depuis le premier cas de VIH identifié chez un HARSAH à Los Angeles au début des années 1980, les HARSAH sont davantage touchés par l’épidémie de VIH (Beyrer et al., 2012; Smith, Tapsoba, Peshu, Sanders, & Jaffe, 2009). À ce jour, malgré l’incidence en diminution du VIH dans la population générale, l’épidémie de VIH continue de prendre de l’ampleur au sein des populations d’HARSAH dans la plupart des pays du monde (OMS, 2016a).
4
Plusieurs facteurs peuvent expliquer la prévalence élevée de VIH chez les HARSAH. Tout d’abord, il est bien démontré dans la littérature que les relations sexuelles anales sont en soi plus à risque de transmission du VIH que les relations sexuelles vaginales ou orales (Baggaley, White, & Boily, 2010; Mayer et al., 2013; Sullivan et al., 2012). Aussi, les HARSAH semblent avoir des pratiques sexuelles davantage à risque que le reste de la population (Beyrer et al., 2012; Sullivan et al., 2012). En effet, la prévalence de certains comportements sexuels à risque est plus élevée au sein des HARSAH. Ces comportements sont : avoir plusieurs partenaires sexuels, avoir des relations sexuelles sous l’effet de l’alcool ou de drogues, avoir des relations sexuelles transactionnelles et avoir des relations sexuelles non protégées (Beyrer et al., 2012). Ces comportements augmentent le risque de contracter le VIH pour les HARSAH séronégatifs et augmentent le risque de transmettre l’infection pour les HARSAH séropositifs. Également, des facteurs structurels qui discriminent les HARSAH existent encore à plusieurs endroits dans le monde. Par exemple, le fait que certains gouvernements et certains professionnels de la santé ne reconnaissent pas les pratiques sexuelles hommes-hommes et n’en tiennent pas compte dans leurs plans de lutte contre le VIH et dans leur pratique clinique, la discrimination vécue par les HARSAH et le manque de services spécifiques et adaptés constituent des barrières à un accès adéquat à des soins préventifs et au traitement du VIH chez cette population (Sullivan et al., 2012).
1.1.2 Le VIH/SIDA chez les HARSAH en Afrique au sud du Sahara
De toutes les régions du monde, c’est l’Afrique subsaharienne qui est la plus lourdement touchée par l’épidémie de VIH. Des 1,8 millions de nouvelles infections par le VIH dans le monde en 2017, 65 % sont survenues en Afrique sub-saharienne (OMS, 2018b). En 2017, 70 % des personnes vivant avec le VIH (PVVIH) vivaient en Afrique subsaharienne et 70 % des décès reliés au SIDA sont survenus dans cette région du monde (ONUSIDA, 2018b). Ces pourcentages sont très élevés considérant que la population d’Afrique subsaharienne ne compte que pour environ 14 % de la population mondiale (United Nations, 2017). Des progrès ont tout de même été réalisés au cours des deux dernières décennies en Afrique. En 2015, plus de 12 millions des PVVIH en Afrique étaient sous thérapie antirétrovirale (OMS, 2017a) alors qu’en 2000, seulement 11 000 personnes recevaient un tel traitement (OMS, 2015c).
L’épidémiologie de l’infection à VIH en Afrique subsaharienne diffère du reste du monde. En effet, contrairement au reste du monde, ce sont les jeunes femmes qui sont affectées de façon disproportionnée en Afrique subsaharienne. L’incidence du VIH chez les adolescentes et les jeunes femmes de cette région du monde est environ deux fois supérieure à celle des garçons et des hommes
5
du même âge (OMS, 2016b). Vue cette particularité épidémiologique, la transmission de l’infection en Afrique subsaharienne a longtemps été considérée comme étant exclusivement hétérosexuelle et verticale, ce qui a entraîné une orientation de la recherche et des services de prévention et de traitement vers les populations hétérosexuelles et les mères (Baral et al., 2013; Smith et al., 2009). Toutefois, il est maintenant reconnu que la prévalence et l’incidence de VIH chez les HARSAH en Afrique sub-saharienne sont significativement plus élevées que dans la population générale et que ceux-ci contribuent à la transmission de l’infection chez les femmes (Baral, Sifakis, Cleghorn, & Beyrer, 2007; Smith et al., 2009). Le fait de ne pas avoir identifié plus tôt les HARSAH comme une population clé dans l’épidémie de VIH a contribué au manque actuel de services pour cette population. Également, des fausses croyances à l’effet que les relations sexuelles anales ne sont pas à risque de transmettre le VIH ont souvent été rapportées en Afrique et ont pu contribuer à l’augmentation des pratiques sexuelles non protégées chez les HARSAH (Geibel et al., 2008; Smith et al., 2009). Depuis quelques années, les chercheurs s’intéressent davantage aux HARSAH en Afrique subsaharienne, certains bailleurs de fonds priorisent les populations clés dont les HARSAH dans les interventions et les recherches qu’ils financent et certains pays africains ont commencé à reconnaître l’importance d’inclure les HARSAH dans leur riposte au VIH (Beyrer et al., 2016; Sullivan et al., 2012).
La stigmatisation, l’exclusion sociale et la discrimination vécues par les HARSAH en Afrique subsaharienne contribuent également au manque d’accès aux services et prédisposent aux pratiques sexuelles à risque (Beyrer et al., 2012; Calzavara et al., 2012; Couderc et al., 2017; Rebe, Struthers, de Swardt, & McIntyre, 2011). L’origine de cette stigmatisation est multifactorielle, provenant en partie de construits socio-culturels, de croyances religieuses ainsi que de la législation en vigueur dans plusieurs pays qui criminalisent les relations sexuelles entre personnes de même sexe (Baral et al., 2013). Dans les sociétés qui pénalisent l’homosexualité, l’accès à des méthodes de prévention comme le condom, via les programmes de distribution gratuite, au dépistage et à des traitements pour le VIH est limité pour les HARSAH (Baral et al., 2013; Mayer et al., 2013; Sullivan et al., 2012). De plus, les HARSAH qui vivent dans un contexte de criminalisation de l’homosexualité et d’exclusion sociale semblent vivre davantage leur homosexualité de façon cachée et être plus enclins à s’engager dans des relations sexuelles secrètes non protégées (Buchbinder & Liu, 2016; Fauk, Merry, Sigilipoe, Putra, & Mwanri, 2017; Poteat et al., 2011). Dans ce contexte de stigmatisation de l’homosexualité, les HARSAH ont fréquemment des partenaires sexuels féminins et sont souvent mariés (Smith et al., 2009), ce qui contribue à l’épidémie de VIH chez les jeunes femmes de la population générale.
6
1.1.3 Le VIH/SIDA chez les HARSAH en Côte d’Ivoire
La Côte d’Ivoire n’est pas épargnée par l’épidémie de VIH. En effet, avec une prévalence estimée à 2,8 % [IC 1,8-4 %] en 2017 (ONUSIDA, 2018a), la Côte d’Ivoire est le deuxième pays d’Afrique de l’Ouest en termes de prévalence de l’infection par le VIH, le premier étant le Cameroun (GBD 2015 HIV Collaborators, 2016; Hakim et al., 2015; ONUSIDA, 2017a). Malgré une diminution de la prévalence de l’infection par le VIH au cours de la dernière décennie dans la population générale, la prévalence demeure élevée chez les populations clés, dont les HARSAH. En effet, chez les HARSAH, la prévalence du VIH était estimée à 12,3 % en 2017 par ONUSIDA (2018a). Une étude conduite entre 2013 et 2015 auprès d’un groupe d’HARSAH à Abidjan a estimé le taux d’incidence de séroconversion à 15,9 par 100 personnes-années (Couderc et al., 2017).1 Bien que cette étude présente certaines limites, ce taux est très alarmant et justifie l’implantation ou le renforcement de mesures de prévention au sein de cette population. Dans la région sanitaire du Gbèkè, dont Bouaké est le chef-lieu et où s’est tenue l’étude faisant l’objet du présent mémoire, la prévalence du VIH était de 4,4% en 2012 (Institut National de la Statistique (INS) et ICF International, 2012). Selon les résultats préliminaires d’une étude conduite auprès de 200 HARSAH âgés de 15 à 60 ans au Centre hospitalier universitaire de Bouaké, la prévalence du VIH serait de 5% dans cette communauté (Kadiané-Oussou et al., 2017). Toutefois, compte tenu de la sous-déclaration du statut HARSAH dans les milieux de soins (Kushwaha et al., 2017; Petroll & Mosack, 2011) cette prévalence pourrait être sous-estimée.
Malgré les données limitées pour la région de Bouaké, les HARSAH en Côte-d’Ivoire, tout comme les autres HARSAH d’Afrique subsaharienne, semblent donc à risque plus élevé de contracter le VIH. Plusieurs facteurs expliquent en partie ce risque élevé : les fausses croyances sur la transmission du VIH, la prévalence élevée de pratiques sexuelles à risque et la stigmatisation vécue par les HARSAH
(Aho et al., 2014; Hakim et al., 2015). Une étude transversale descriptive menée à Abidjan en 2011 et 2012 a montré qu’une majorité d’HARSAH croyaient à tort que les relations sexuelles vaginales étaient plus à risque de transmission du VIH que les relations sexuelles anales et que l’acte sexuel anal réceptif était au même niveau de risque que l’acte insertif (Hakim et al., 2015). Ces deux croyances sont fausses et peuvent expliquer en partie la faible utilisation du condom dans cette population : dans cette même étude, 65,2% des HARSAH avaient eu des relations sexuelles anales non protégées au cours de la
1 Pour l’OMS, une population à risque important d’infection est définie comme une population ayant une incidence de 3 cas
7
dernière année (Aho et al., 2014; Hakim et al., 2015). Également, près du quart des HARSAH questionnés dans cette étude avaient eu des relations sexuelles transactionnelles au cours des 12 derniers mois. Étonnamment, malgré la prévalence élevée de relations sexuelles à risque, seulement 17,7 % de ces HARSAH se considéraient à haut risque de contracter le VIH (Hakim et al., 2015). Également, le climat hostile envers les HARSAH en Côte d’Ivoire contribue au manque de services et prédispose ces derniers aux comportements à risque élevé. Bien que l’homosexualité ne soit pas illégale en Côte d’Ivoire (ONUSIDA, 2017c), les HARSAH vivent tout de même de l’exclusion et de la stigmatisation (Aho et al., 2014; Smith et al., 2009). D’ailleurs, certains pays frontaliers de la Côte d’Ivoire, soit le Ghana, la Guinée et le Libéria, criminalisent encore l’homosexualité (ONUSIDA, 2017c). Plusieurs HARSAH vivent donc leur sexualité de façon cachée et ne déclarent pas leur statut à leur professionnel de la santé, limitant ainsi l’accès aux services de prévention et de traitement du VIH (Hakim et al., 2015).
1.1.4 Les cibles de l’ONUSIDA
L’ONUSIDA a fixé en 2014 des cibles ambitieuses afin de mettre un terme à l’épidémie de VIH. L’objectif visé est que d’ici 2020, 90 % des PVVIH connaissent leur statut, 90 % des personnes diagnostiquées soient traitées avec des antirétroviraux (ARV) et 90 % des personnes sous ARV aient une charge virale supprimée (charge virale < 1000 copies par mL de sang) (ONUSIDA, 2014). L’atteinte de ces cibles, communément appelées « 90-90-90 », et leur amélioration « 95-95-95 » en 2030, pourrait mettre fin à l’épidémie de VIH d’ici 2030 selon ONUSIDA (2014) par la quasi-élimination des cas incidents de VIH. Pour mettre fin à l’épidémie de VIH, il est important de miser également sur la prévention. Parallèlement à ces objectifs de dépistage et de traitement du VIH, ONUSIDA a donc aussi fixé en 2015 des objectifs de diminution des cas incidents de VIH. La cible est de réduire à 500 000 par année le nombre de nouveaux cas de VIH d’ici 2020 et à 200 000 d’ici 2030 (ONUSIDA, 2015a). Rappelons qu’en 2017, 1.8 millions de personnes ont été nouvellement infectées par le VIH (ONUSIDA, 2018b). Pour atteindre cette cible, plusieurs stratégies préventives doivent être utilisées, et les groupes particulièrement à risque de contracter et de transmettre l’infection doivent être ciblés. Parmi les stratégies de prévention mises de l’avant par ONUSIDA, la PrEP occupe une place importante. Pour ONUSIDA, « il faut identifier les groupes de population susceptibles de bénéficier de la PrEP, y compris les personnes relevant de populations et zones clés, étudier leurs préférences d’accès, ainsi qu’élaborer et tester différents modèles de génération de demande et d’adhésion » (ONUSIDA, 2014, p.30).
8 1.2 La PrEP
La PrEP est une méthode de prévention primaire contre le VIH. Elle consiste en la prise quotidienne ou à la demande d’un médicament appelé Truvada® (Gilead Sciences Inc., Foster City, CA, USA) ou TDF/FTC par les personnes séronégatives, mais à risque de contracter le VIH (Coutinho & Prasad, 2013). Ce médicament a d’abord été approuvé pour le traitement de l’infection par le VIH, puis a été démontré sécuritaire et efficace en prophylaxie de cette maladie (Coutinho & Prasad, 2013). L’OMS, dans ses lignes directrices de 2015, recommande la PrEP chez les individus à risque élevé de VIH, dont les HARSAH (OMS, 2015a). Ces recommandations de l’OMS sont basées sur les résultats d’une revue systématique avec méta-analyse qui a montré que lorsque l’adhésion à la PrEP est de plus de 80%, le risque d’infection est diminué de 70% (Risque relatif (RR) : 0,30, Intervalle de confiance (IC) : 0,21-0,45) (Fonner et al., 2016). En effet, la mauvaise observance au traitement peut diminuer de façon importante l’efficacité observée de la PrEP (McGowan, 2014). La PrEP, prise adéquatement, agit sur le risque individuel de contracter le VIH et pourrait diminuer de façon importante l’incidence du VIH chez les HARSAH (Jiang et al., 2014).
Les prochaines sections porteront sur différents aspects de la PrEP, soit les recommandations, les stratégies de prévention combinées, les modalités de prise de la PrEP, l’efficacité de la PrEP, la sécurité, le risque de développement de résistances aux ARV, les comportements sexuels à risque sous PrEP et les autres modalités de PrEP en développement.
1.2.1 Les recommandations en lien avec la PrEP chez les HARSAH
L’OMS recommande depuis 2012 d’offrir la PrEP aux HARSAH en combinaison avec d’autres méthodes de prévention. Dans ses dernières lignes directrices datant de 2015, l’OMS recommande la PrEP pour toutes les populations clés, dont les HARSAH : « La PrEP orale (avec TDF) devrait être offerte comme choix de prévention supplémentaire pour les populations clés courant un risque important d’infection par le VIH, dans le cadre de stratégies de prévention combinée (forte recommandation, haute qualité des preuves) » (OMS, 2016a, p.44).
Aux États-Unis, les Centers for Disease Control and Prevention (CDC) ont développé des lignes directrices sur la PrEP et recommandent la prise quotidienne de TDF/FTC comme une des options de prévention chez les HARSAH sexuellement actifs à risque de contracter le VIH (Centers for Disease Control and Prevention, 2018).
9
Ailleurs dans le monde, l’Australie, l’Afrique du Sud, le Canada, la France et le Kenya ont également approuvé l’utilisation du TDF/FTC pour la prévention du VIH chez les populations à risque de contracter le VIH (Australian Federation of AIDS Organisations, 2019)(ONUSIDA, 2015b; Santé Canada, 2018). Par ailleurs, la PrEP est officiellement adoptée en Écosse, en Irlande et au Pays de Galles (HIV Ireland, 2019; HIV Scotland, 2019; Public Health Wales, 2019), et en Angleterre, le projet de démonstration « PrEP Impact Trial » la rendra accessible à au moins 13 000 participants entre 2017 et 2020 (Public Health England, 2018).
1.2.2 La PrEP comme composante d’un éventail de services préventifs
Les différentes recommandations présentées au paragraphe précédent mentionnent que la prise de la PrEP doit se faire en combinaison avec d’autres méthodes de prévention. En effet, afin d’atteindre une efficacité optimale et de réduire le risque de contracter d’autres infections transmissibles sexuellement (ITS), la PrEP doit être implantée en combinaison avec d’autres services préventifs (Dieffenbach & Fauci, 2011; Sullivan et al., 2012). Toute intervention préventive implantée seule a peu de chances d’être efficace (Dieffenbach & Fauci, 2011) et les interventions multiples utilisées en combinaison peuvent prévenir davantage d’infections que chaque intervention prise individuellement (Brookmeyer et al., 2014). Les interventions de prévention mises en place devraient avoir des cibles diversifiées et agir au niveau comportemental, biomédical et structurel (Pettifor et al., 2015; Sullivan et al., 2012). Des interventions incontournables à implanter ou à promouvoir en parallèle à la PrEP sont l’augmentation du dépistage du VIH et la promotion de l’utilisation du condom (Reyniers, Hoornenborg, Vuylsteke, Wouters, & Laga, 2017). En effet, le dépistage du VIH, qui permet la prescription rapide d’ARV chez les patients infectés, ce qui freine la transmission du VIH (Cohen et al., 2016; Cohen et al., 2011), et le port du condom (Smith, Herbst, Zhang, & Rose, 2015) sont deux interventions reconnues efficaces pour diminuer l’incidence du VIH (OMS, 2011). Le traitement comme prévention, qui consiste à traiter dès le diagnostic les personnes infectées par le VIH, sans égard à leur niveau sérique de CD4, a démontré son efficacité. En effet, un essai clinique randomisé a montré que la prise rapide d’antirétroviraux était associée à une réduction de 93 % du risque d’infection du partenaire par rapport à la prise retardée (Cohen et al., 2016). Le port du condom chez les HARSAH a pour sa part une efficacité de 70 % pour la protection contre le VIH (Smith et al., 2015). Dans certains contextes, la PrEP, qui pourrait attirer un type de clientèle plus difficile à rejoindre par les systèmes de santé, pourrait servir de point d’entrée vers d’autres services préventifs pour les populations à risque élevé de VIH.
10
1.2.3 Posologie et modalités de prise de la PrEP
Les comprimés de Truvada® (TDF/FTC) sont composés de 200 mg d’emtricitabine (FTC) et de 300 mg de tenofovir (TDF) (Coutinho & Prasad, 2013). Ces deux molécules font partie de la classe des inhibiteurs nucléosidiques de la transcriptase inverse. Il existe deux schémas de prise de la PrEP, soit quotidiennement ou à la demande. La prise quotidienne consiste à prendre un comprimé de TDF/FTC à chaque jour. Dans le cas de la prise quotidienne, on considère le niveau de protection adéquat pour les relations sexuelles anales après 7 jours de prise de la PrEP. La prise à la demande consiste à prendre deux comprimés entre 2 et 24 heures avant le rapport sexuel, puis un comprimé 24 à 48 heures après la première dose. Si d’autres rapports sexuels surviennent les jours suivants, un comprimé par jour doit être pris jusqu’à 48 heures après la dernière relation. Lors de la reprise des activités sexuelles, si le dernier comprimé a été pris à l’intérieur des 6 jours précédents, un seul comprimé doit être pris dans les 2 à 24 heures précédant la relation. Si le dernier comprimé a été pris il y a 7 jours ou plus, il faut alors recommencer tel qu’initialement (AIDES, 2016).
Un essai clinique randomisé conduit auprès d’HARSAH et de travailleuses du sexe au Kenya visait à connaître l’adhésion à la PrEP quotidienne et à la demande (Mutua et al., 2012). Au cours de cette étude, l’adhésion était nettement supérieure chez les patients recevant le régime quotidien que chez ceux recevant la PrEP à la demande. Les hypothèses pouvant expliquer ces résultats sont que la routine reliée à la prise quotidienne peut être facilitante, que plusieurs participants rapportaient consommer de l’alcool avant leurs relations sexuelles, ce qui peut provoquer l’oubli des doses pré et post-coïtales et que la stigmatisation reliée à la déclaration du statut à risque de VIH peut empêcher les personnes de prendre la dose post-coïtale devant leur partenaire (Mutua et al., 2012). Toutefois, cela ne signifie pas que la prise à la demande n’est pas efficace puisque la concentration intra-cellulaire de médication pourrait être suffisante pour protéger contre l’infection à VIH malgré l’adhésion moindre. L’efficacité de la PrEP quotidienne et à la demande sera discutée dans la prochaine section.
1.2.4 Efficacité de la PrEP chez les HARSAH
1.2.4.1 Revue des études sur l’efficacité de la PrEP orale chez les HARSAH
Plusieurs études ont été menées au cours des dernières années concernant l’efficacité de la PrEP pour prévenir l’infection par le VIH. Globalement, les études montrent que la PrEP est efficace pour protéger contre le VIH dans la mesure où elle est prise adéquatement. Les prochains paragraphes présenteront
11
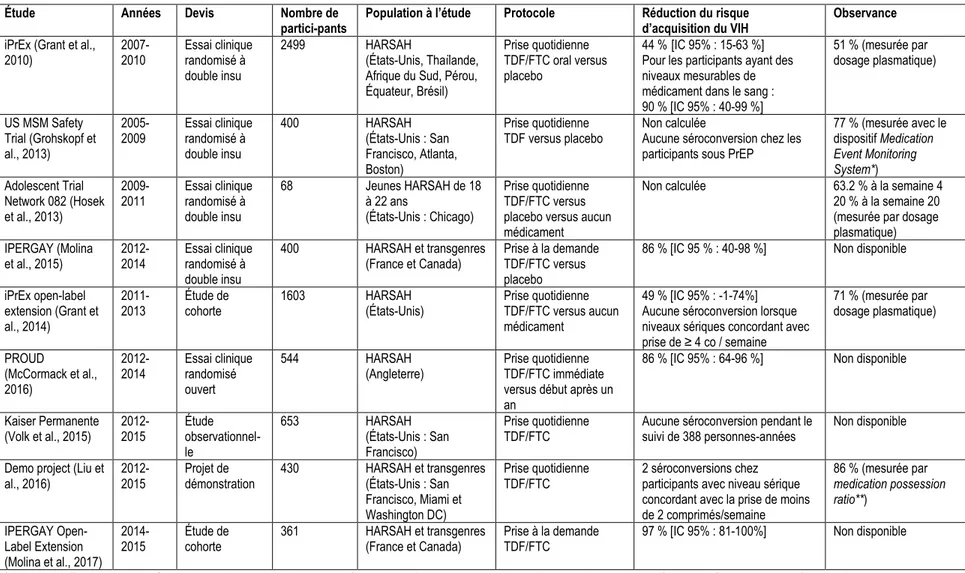
les principales études portant sur l’efficacité de la PrEP et sur l’adhésion à la PrEP chez les HARSAH. Le tableau 1.1 présente un résumé des résultats de ces différentes études.
L’étude iPrEx a été le premier essai clinique randomisé visant à déterminer la sécurité et l’efficacité de la PrEP (Grant et al., 2010). Cette étude portait sur 2 499 HARSAH qui ont été randomisés en deux groupes : un groupe qui recevait la PrEP quotidienne sous forme de TDF/FTC et un groupe qui recevait un placebo. Globalement, les patients qui recevaient la PrEP avaient une réduction du risque de contracter le VIH de 44 % [IC 15-63 % ; p = 0,005]. Toutefois, même si l’adhésion auto-rapportée au médicament était élevée dans l’étude, les niveaux sériques étaient bas ou nuls chez la plupart des participants, indiquant une mauvaise observance chez plusieurs. Les analyses portant sur les participants ayant des niveaux mesurables de médicament dans le sang montraient une réduction du risque d’acquisition du VIH de 90 % [IC 40-99 % ; p = 0,001], indiquant une efficacité nettement meilleure lorsque l’adhésion est meilleure. Notons également que l’observance s’est avérée sous-optimale malgré un soutien offert aux participants.
L’étude US MSM Safety Trial est un essai clinique randomisé qui étudiait la sécurité et les effets comportementaux du TDF chez 400 HARSAH aux États-Unis (Grohskopf et al., 2013). Les participants recevaient quotidiennement le TDF ou un placebo. L’adhésion chez les participants qui recevaient la PrEP était élevée (77%). Au cours de cette étude, aucune séroconversion n’est survenue chez les participants qui prenaient le TDF.
L’étude Adolescent Trials Network 082 (ATN 082) est un essai clinique randomisé qui a évalué la faisabilité et l’acceptabilité de la PrEP chez les jeunes HARSAH (Hosek et al., 2013). Les participants étaient divisés en trois groupes: un groupe recevait la PrEP quotidienne, un groupe recevait un placebo et un groupe ne recevait que des interventions comportementales. Au cours de la phase de recrutement, les résultats de l’étude iPrEx ont été publiés, montrant une bonne efficacité de la PrEP. L’étude ATN 082 a alors cessé le recrutement et l’aveuglement a été levé. L’adhésion à la PrEP a diminué au cours de l’étude, passant de 64 % au cours de la quatrième semaine à 20 % au cours de la vingt-quatrième semaine. Aucune séroconversion n’est survenue chez les patients sous PrEP.
L'étude IPERGAY, conduite en France et au Canada, est un essai clinique randomisé à double insu qui visait à déterminer la sécurité et l’efficacité de la PrEP à la demande (Molina et al., 2015). Les participants étaient assignés aléatoirement à la PrEP (TDF/FTC) ou au placebo. La prise du médicament se faisait
12
ainsi : deux comprimés de 2 à 24 heures avant la relation sexuelle, un comprimé 24 heures après la première dose et un comprimé 48 heures après la première dose puis un comprimé par jour si d’autres relations sexuelles se produisent jusqu’à 48 heures après la dernière relation sexuelle. Après une analyse intérimaire qui montrait l’efficacité de la PrEP, le groupe contrôle a été interrompu et la PrEP a été offerte à tous les participants. Au cours de la phase à double insu, l’efficacité de la PrEP à la demande était de 86 % [IC 40-98 %]. Les participants ont rapporté prendre une médiane de 15 comprimés par mois et les dosages sériques montraient que 86 % des personnes assignées à la PrEP avaient pris la médication au cours de la semaine précédente.
L’étude iPrEx Open-Label extension s’est déroulée à la suite de l’étude iPrEx et ATN 082 (Grant et al., 2014). Il était offert aux participants de ces deux études de recevoir la PrEP quotidienne gratuitement. Parmi les 1 603 participants (1 428 HARSAH et 175 femmes transgenres), 76 % ont reçu la PrEP. Le rapport des taux d’incidence ajusté était de 0,51 [IC 0,26-1,01], montrant une réduction non statistiquement significative de l’incidence de VIH dans le groupe sous PrEP. Toutefois, chez les participants qui avaient des niveaux sériques concordant avec la prise d’au moins 4 comprimés par semaine, aucune infection n’a été détectée.
L’étude PROUD est une étude ouverte (« open-label ») randomisée conduite en Angleterre qui avait comme objectif de déceler l’efficacité de la PrEP chez les HARSAH (McCormack et al., 2016). Les 544 participants ont été assignés aléatoirement et recevaient la PrEP combinée (TDF/FTC) quotidiennement soit immédiatement ou après un délai d’un an. Après une analyse intérimaire qui montrait une différence statistiquement significative dans le nombre de cas incidents de VIH entre les deux groupes, tous les participants ont eu le choix de recevoir la PrEP immédiatement. L’efficacité de la PrEP a été estimée à 86 % [IC 64-96 %].
L’étude Kaiser Permanente est une étude observationnelle conduite auprès de 653 HARSAH recevant le TDF/FTC quotidiennement à San Francisco (Volk et al., 2015) Cette étude visait à reproduire des conditions réalistes de prise de PrEP. La durée moyenne de l’utilisation de la PrEP était de 7,2 mois. Aucun diagnostic de VIH n’a été fait pendant le suivi de 388 personnes-années sous PrEP.
L’étude Demo Project, un projet de démonstration mené aux États-Unis, a suivi 430 HARSAH recevant la PrEP quotidienne (Liu et al., 2016). Au cours du suivi de 48 semaines, deux infections à VIH ont été
13
diagnostiquées, toutes deux chez des participants ayant un niveau sérique de médication concordant avec la prise de moins de deux comprimés par semaine au moment de la séroconversion.
L’étude IPERGAY Open-Label Extension a suivi l’étude IPERGAY et a suivi 361 hommes qui avaient participé à la précédente étude (Molina et al., 2017). Tous les participants suivis recevaient la PrEP à la demande. La réduction relative de l’incidence du VIH, comparativement au groupe contrôle de l’étude originale, était de 97 % [IC 81-100%].
Globalement, ces études montrent que la prise de la PrEP est hautement efficace pour protéger contre le VIH à condition que l’observance soit adéquate. Les essais cliniques randomisés à l’aveugle n’ont pas montré une efficacité élevée de la PrEP vu l’observance faible des participant. Cela s’explique probablement par le devis d’étude peu adapté au contexte de la PrEP. En effet, il est peu intéressant pour une personne de ne pas savoir si elle reçoit la PrEP ou non, ce qui a pu contribuer à l’adhésion faible observée dans ces études.
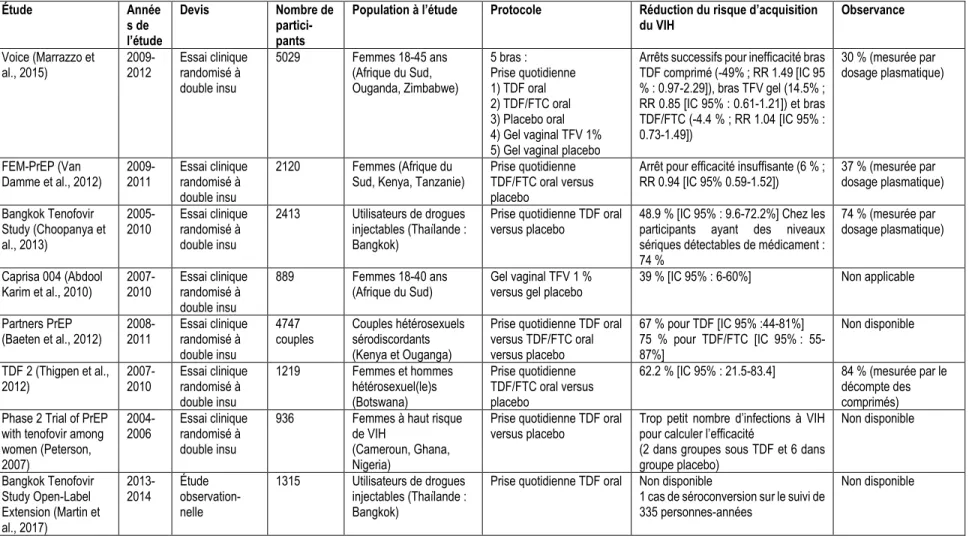
D’autres études chez des populations hétérosexuelles ont également été conduites. Les résultats montrent en général une bonne efficacité lorsque l’adhésion est adéquate. Le tableau 1.2 présente un résumé des autres principales études sur l’efficacité de la PrEP chez des populations autres que les HARSAH. De façon générale, l’efficacité de la PrEP mesurée dans les différentes études semble meilleure chez les HARSAH que chez les femmes. Un facteur qui peut expliquer en partie cette différence est que, lors de la prise orale de la PrEP, les niveaux d’exposition au médicament sont supérieurs au niveau rectal que cervico-vaginal (Brown et al., 2011). En effet, des études ont montré que la concentration du TDF est de 10 (Cottrell et al., 2016) à 100 fois (Patterson et al., 2011) plus élevée au niveau de la muqueuse rectale en comparaison avec la muqueuse vaginale et cervicale. Également, le TDF est détectable pendant 14 jours au niveau du tissu rectal à la suite de la prise orale (Patterson et al., 2011). L’étude de Cottrell et al (2016) a également montré que la prise de seulement deux comprimés par semaine serait suffisante pour assurer une bonne protection au niveau du tissu anorectal, alors que la protection vaginale requerrait la prise d’au moins 6 doses par semaine. Les HARSAH semblent donc être un groupe cible intéressant pour l’implantation de la PrEP puisqu’ils peuvent avoir un bon niveau de protection malgré une adhésion sous-optimale.
14
Tableau 1.1 : Résultats des principales études portant sur la prophylaxie préexposition (PrEP) chez les HARSAH
Étude Années Devis Nombre de
partici-pants Population à l’étude Protocole Réduction du risque d’acquisition du VIH Observance
iPrEx (Grant et al.,
2010) 2007-2010 Essai clinique randomisé à double insu
2499 HARSAH
(États-Unis, Thaïlande, Afrique du Sud, Pérou, Équateur, Brésil)
Prise quotidienne TDF/FTC oral versus placebo
44 %[IC 95% : 15-63 %] Pour les participants ayant des niveaux mesurables de médicament dans le sang : 90 % [IC 95% : 40-99 %] 51 % (mesurée par dosage plasmatique) US MSM Safety Trial (Grohskopf et al., 2013)
2005-2009 Essai clinique randomisé à double insu 400 HARSAH (États-Unis : San Francisco, Atlanta, Boston) Prise quotidienne
TDF versus placebo Non calculée Aucune séroconversion chez les participants sous PrEP
77 % (mesurée avec le dispositif Medication Event Monitoring System*) Adolescent Trial Network 082 (Hosek et al., 2013)
2009-2011 Essai clinique randomisé à double insu 68 Jeunes HARSAH de 18 à 22 ans (États-Unis : Chicago) Prise quotidienne TDF/FTC versus placebo versus aucun médicament
Non calculée 63.2 % à la semaine 4 20 % à la semaine 20 (mesurée par dosage plasmatique) IPERGAY (Molina et al., 2015) 2012-2014 Essai clinique randomisé à double insu 400 HARSAH et transgenres (France et Canada) Prise à la demande TDF/FTC versus placebo
86 % [IC 95 % : 40-98 %] Non disponible
iPrEx open-label extension (Grant et al., 2014) 2011-2013 Étude de cohorte 1603 HARSAH (États-Unis) Prise quotidienne TDF/FTC versus aucun médicament 49 % [IC 95% : -1-74%] Aucune séroconversion lorsque niveaux sériques concordant avec prise de ≥ 4 co / semaine 71 % (mesurée par dosage plasmatique) PROUD (McCormack et al., 2016) 2012-2014 Essai clinique randomisé ouvert 544 HARSAH (Angleterre) Prise quotidienne TDF/FTC immédiate versus début après un an
86 % [IC 95% : 64-96 %] Non disponible
Kaiser Permanente
(Volk et al., 2015) 2012-2015 Étude observationnel-le
653 HARSAH (États-Unis : San Francisco)
Prise quotidienne
TDF/FTC Aucune séroconversion pendant le suivi de 388 personnes-années Non disponible
Demo project (Liu et al., 2016) 2012-2015 Projet de démonstration 430 HARSAH et transgenres (États-Unis : San Francisco, Miami et Washington DC) Prise quotidienne TDF/FTC 2 séroconversions chez participants avec niveau sérique concordant avec la prise de moins de 2 comprimés/semaine 86 % (mesurée par medication possession ratio**) IPERGAY Open-Label Extension (Molina et al., 2017)
2014-2015 Étude de cohorte 361 HARSAH et transgenres (France et Canada) Prise à la demande TDF/FTC 97 % [IC 95% : 81-100%] Non disponible
* Medication Event Monitoring System : capuchon qui s'adapte sur les flacons de médicaments et enregistre l'heure et la date chaque fois que le flacon est ouvert (il s’agit d’un proxy pour l’observance).
** Medication possession ratio : Mesure faite par la pharmacie qui fournit la PrEP qui estime la proportion de jours où la personne prend la médication selon les dates d’approvisionnement (il s’agit d’un proxy pour l’observance).
15
Tableau 1.2 : Résultats des principales études portant sur l’efficacité de la prophylaxie préexposition (PrEP) chez les populations autres que les HARSAH
Étude Année s de l’étude Devis Nombre de partici-pants
Population à l’étude Protocole Réduction du risque d’acquisition du VIH Observance Voice (Marrazzo et al., 2015) 2009-2012 Essai clinique randomisé à double insu 5029 Femmes 18-45 ans (Afrique du Sud, Ouganda, Zimbabwe) 5 bras : Prise quotidienne 1) TDF oral 2) TDF/FTC oral 3) Placebo oral 4) Gel vaginal TFV 1% 5) Gel vaginal placebo
Arrêts successifs pour inefficacité bras TDF comprimé (-49% ; RR 1.49 [IC 95 % : 0.97-2.29]), bras TFV gel (14.5% ; RR 0.85 [IC 95% : 0.61-1.21]) et bras TDF/FTC (-4.4 % ; RR 1.04 [IC 95% : 0.73-1.49]) 30 % (mesurée par dosage plasmatique) FEM-PrEP (Van
Damme et al., 2012) 2009-2011 Essai clinique randomisé à double insu
2120 Femmes (Afrique du
Sud, Kenya, Tanzanie) Prise quotidienne TDF/FTC oral versus placebo
Arrêt pour efficacité insuffisante (6 % ;
RR 0.94 [IC 95% 0.59-1.52]) 37 % (mesurée par dosage plasmatique)
Bangkok Tenofovir Study (Choopanya et al., 2013)
2005-2010 Essai clinique randomisé à double insu
2413 Utilisateurs de drogues injectables (Thaïlande : Bangkok)
Prise quotidienne TDF oral
versus placebo 48.9 % [IC 95% : 9.6-72.2%] Chez les participants ayant des niveaux sériques détectables de médicament : 74 % 74 % (mesurée par dosage plasmatique) Caprisa 004 (Abdool Karim et al., 2010) 2007-2010 Essai clinique randomisé à double insu 889 Femmes 18-40 ans (Afrique du Sud) Gel vaginal TFV 1 % versus gel placebo
39 % [IC 95% : 6-60%] Non applicable
Partners PrEP
(Baeten et al., 2012) 2008-2011 Essai clinique randomisé à double insu
4747
couples Couples hétérosexuels sérodiscordants (Kenya et Ouganga)
Prise quotidienne TDF oral versus TDF/FTC oral versus placebo 67 % pour TDF [IC 95% :44-81%] 75 % pour TDF/FTC [IC 95% : 55-87%] Non disponible TDF 2 (Thigpen et al., 2012) 2007-2010 Essai clinique randomisé à double insu 1219 Femmes et hommes hétérosexuel(le)s (Botswana) Prise quotidienne TDF/FTC oral versus placebo
62.2 % [IC 95% : 21.5-83.4] 84 % (mesurée par le décompte des comprimés) Phase 2 Trial of PrEP
with tenofovir among women (Peterson, 2007) 2004-2006 Essai clinique randomisé à double insu
936 Femmes à haut risque de VIH
(Cameroun, Ghana, Nigeria)
Prise quotidienne TDF oral versus placebo
Trop petit nombre d’infections à VIH pour calculer l’efficacité
(2 dans groupes sous TDF et 6 dans groupe placebo) Non disponible Bangkok Tenofovir Study Open-Label Extension (Martin et al., 2017) 2013-2014 Étude observation-nelle 1315 Utilisateurs de drogues injectables (Thaïlande : Bangkok)
Prise quotidienne TDF oral Non disponible
1 cas de séroconversion sur le suivi de 335 personnes-années
16 1.2.4.2 Coût-efficacité de la PrEP
Les molécules utilisées pour la PrEP sont coûteuses. Bien que l’efficacité de cette méthode de prévention ait été démontrée, il est légitime de se demander si ses coûts d’implantation sont acceptables. Des études de modélisation montrent que l’implantation de la PrEP a un bon rapport coût-efficacité si elle est implantée au sein de populations particulièrement à risque (Alistar, Grant, & Bendavid, 2014; Shen, Xiao, Rong, Meyers, & Bellan, 2018), dont le taux d’incidence du VIH est de 3 cas par 100 personnes-années ou plus (Gomez et al., 2013). La modélisation effectuée dans l’étude d’Alistar et al (2014) a montré que, lorsqu’implantée auprès des populations à haut risque de VIH, la PrEP permettait d’économiser de l’argent comparativement au statu quo. Un modèle appliqué à la population d’HARSAH et de femmes transgenres au Brésil a montré que la PrEP quotidienne augmenterait l’espérance de vie et serait hautement coût-efficace chez cette population (Luz et al., 2018). Le principal déterminant de l’analyse coût-efficacité de la PrEP est donc l’incidence du VIH. Chez les HARSAH de Côte-d’Ivoire, dont le taux d’incidence de VIH a été estimé à 15 cas par 100 personnes-années à Abidjan (Couderc et al., 2017), on peut donc s’attendre à ce que l’implantation de la PrEP soit coût-efficace. Également, il est important de préciser que les études mentionnées précédemment ont été menées dans des pays où la PrEP est particulièrement coûteuse. Le coût du médicament est toutefois beaucoup moindre en Afrique. Il est donc probable que la PrEP aura un bon rapport coût-efficacité chez les HARSAH de Côte d’Ivoire.
1.2.5 Sécurité de la PrEP
Les effets indésirables à court et long terme de la PrEP suscitent parfois de l’inquiétude chez les personnes susceptibles de l’utiliser. Les prochains paragraphes feront une revue des différents effets secondaires recensés dans la littérature.
1.2.5.1 Effets secondaires bénins
Le TDF/FTV est généralement bien toléré par les patients qui le prennent en prophylaxie du VIH. Les études ont montré que des effets secondaires tels que la fatigue, les céphalées, les nausées, les vomissements, les douleurs abdominales et une perte de poids peuvent survenir de façon peu fréquente (Baeten et al., 2012; Thigpen et al., 2012). Les effets secondaires qui semblent être les plus fréquents sont les douleurs abdominales (11,2 %), les céphalées (16,8%) et la fatigue (10,6 %) (Baeten et al., 2012). Toutefois, il semble que ces symptômes soient plus importants au cours du premier mois
17
de la prise de la PrEP et qu’ils s’estompent par la suite (Baeten et al., 2012; Grant et al., 2010; Plosker, 2013; Thigpen et al., 2012).
1.2.5.2 Effets secondaires graves
La plupart des effets indésirables graves évalués dans les études comme le décès, la dépression, les fractures, l’augmentation de la créatinine et du phosphore sériques ne survenaient pas plus fréquemment dans les groupes sous PrEP par rapport aux groupes placebo (Defechereux et al., 2016; Plosker, 2013). Toutefois, dans l’étude iPrEx, l’augmentation des niveaux sériques de créatinine était significativement plus fréquente dans le groupe sous TDF/FTC (Grant et al., 2010). Pour cette raison, la PrEP est contre-indiquée chez les patients ayant un débit de filtration glomérulaire estimé à moins de 60 mL/min/1,73 m2 (Coutinho&Prasad,2013).
Chez des patients séropositifs sous TDF, une diminution de la densité minérale osseuse a été observée au cours de certains essais cliniques (Gallant et al., 2004; Martin et al., 2009). Également, des cas de fractures osseuses et d’ostéomalacie secondaires au TDF chez certains patients séropositifs ont été rapportés (Perrot, Aslangul, Szwebel, Caillat-Vigneron, & Le Jeunne, 2009). Certains essais cliniques portant sur la PrEP se sont donc intéressés aux effets indésirables sur la santé osseuse. Tel que mentionné précédemment, il ne semble pas y avoir davantage de fractures chez les patients sous PrEP que chez ceux sous placebo. Toutefois, des études ont montré que la prise de TDF/FTC dans le cadre de la PrEP était associée à une diminution faible mais statistiquement significative de la densité minérale osseuse au niveau de l’avant-bras, de la hanche et de la colonne lombaire après 24 (Mulligan et al., 2015; Thigpen et al., 2012) et 30 mois (Kasonde et al., 2014) de prise de la PrEP. Les effets à plus long terme de la PrEP sur la densité minérale osseuse ne sont pas encore connus et devront être surveillés.
L’étude FEM-PrEP, un essai clinique randomisé à double insu qui étudiait la PrEP quotidienne chez des femmes africaines, a montré une augmentation significative de l’Aspartate-aminotransférase (AST), une enzyme hépatique, chez les femmes recevant la PrEP en comparaison à celles recevant le placebo (Mandala et al., 2014).
Les patients qui reçoivent la PrEP devraient donc recevoir un suivi médical régulier (Tetteh et al., 2017). Chez ces patients, la fonction rénale devrait être monitorée tous les six mois (Centers for Disease Control and Prevention, 2018). Le calcul de la densité minérale osseuse n’est pas recommandé de
18
routine, ni avant ni pendant la prise de la PrEP, mais devrait être envisagé chez les patients avec un risque individuel élevé d’ostéoporose ou avec un antécédent de fracture pathologique (Centers for Disease Control and Prevention, 2018). Il est recommandé de faire un dépistage de l’infection au virus de l’hépatite B avant de prescrire la PrEP. Les patients non immuns devraient alors recevoir le vaccin. Chez les patients avec une hépatite B chronique, la PrEP n’est pas contre-indiquée, mais un suivi de la fonction hépatique est nécessaire pendant la prise du médicament. Également, comme le TDF/FTC est actif contre le virus de l’hépatite B, ces patients devraient être suivis étroitement lors de l’arrêt de la PrEP puisqu’une réactivation du virus est alors possible (Centers for Disease Control and Prevention, 2018).
1.2.5.3 Interactions médicamenteuses
Le TDF et le FTC sont tous deux éliminés au niveau rénal. Lorsqu’une personne prend la PrEP sous forme de TDF/FTC, une attention particulière doit donc être portée à l’utilisation concomitante de médication affectant la fonction rénale. En effet, l’utilisation d’un médicament qui est éliminé au niveau rénal via la sécrétion tubulaire ou qui diminue la fonction rénale pourrait provoquer l’augmentation des niveaux sériques de TDF ou de FTC (Plosker, 2013).
1.2.6 Risque de développement de résistance aux antirétroviraux (ARV)
L’utilisation de médication antirétrovirale en prophylaxie du VIH suscite la question de l’émergence de la résistance aux ARV (Hurt, Eron, & Cohen, 2011). Deux situations sont particulièrement à risque de développement de résistance. Si une personne est séropositive, mais qu’elle ne connaît pas son statut et qu’elle débute la PrEP, elle est particulièrement à risque de développer une résistance puisqu’elle recevrait alors un traitement incomplet. En effet, le traitement du VIH nécessite trois agents antirétroviraux et la PrEP n’en contient que deux. Il semble que les cas de résistance reliés à la PrEP recensés dans la littérature soient survenus dans ce contexte (McGowan, 2014; Parikh & Mellors, 2012; Parikh & Mellors, 2016). Une autre situation qui serait à risque de résistance concernerait une personne qui devient porteuse du VIH alors qu’elle est sous PrEP. Puisque le TDF/FTC ne constitue pas un régime de traitement complet pour le VIH, des mutations peuvent apparaître chez les individus porteurs du VIH qui reçoivent la PrEP (Plosker, 2013). Pour ces raisons, la PrEP doit toujours être prescrite après qu’un test de dépistage ait confirmé la séronégativité du patient et des tests de dépistages fréquents doivent être faits lorsqu’une personne reçoit la PrEP (ONUSIDA, 2015b). Le CDC
19
recommande de faire un dépistage pour le VIH tous les trois mois chez ces personnes (Centers for Disease Control and Prevention, 2018).
1.2.7 Comportements sexuels à risque sous PrEP
La mise en place de stratégies préventives impliquant la PrEP amène plusieurs d’inquiétudes en lien avec l’exacerbation des comportements sexuels à risque. En effet, il est légitime de se demander si la prise de la PrEP pourrait accentuer la non-utilisation du condom et augmenter le risque de contracter d’autres ITS. Plusieurs études se sont penchées sur cette question et les résultats sont divergents d’une étude à l’autre.
Une revue systématique qui a inclus des essais cliniques randomisés, des prolongations ouverteset des projets de démonstration portant sur la PrEP chez des populations d’HARSAH, mais aussi chez d’autres populations comme les travailleuses du sexe ou les couples sérodiscordants, n’a pas montré de changement significatif des comportements sexuels chez les participants de ces études (Fonner et al., 2016). Toutefois, les essais cliniques randomisés ne sont pas adaptés à l’étude des comportements sexuels à risque puisque, lorsque le devis est à double insu, les participants ne savent pas s’ils reçoivent la PrEP ou le placebo. Les comportements ne sont donc pas représentatifs de ce qui se produirait en réalité chez des personnes sous PrEP.
L’étude observationnelle Kaiser Permanente, menée auprès d’HARSAH à San Francisco qui prenaient la PrEP quotidienne et visant à reproduire la réalité, a pour sa part révélé une augmentation de l’incidence d’ITS de 41 % et une réduction du port du condom chez ces hommes (Volk et al., 2015). Une revue systématique avec méta-analyse portant précisément sur les études ayant comme issue les risques sexuels en lien avec la prise de la PrEP orale quotidienne chez des HARSAH et des femmes transgenres a été publiée récemment (Traeger et al., 2018). Seize études observationnelles et un essai clinique ouvert ont été inclus dans la méta-analyse. Les études à l’aveugle étaient exclues afin de s’assurer que l’issue étudiée, soit la modification des comportements sexuels à risque, était bel et bien le résultat de la perception des participants de la protection par la PrEP. Les analyses ont montré que la PrEP était associée à une augmentation significative de la chlamydia rectale (RR : 1,59 ; IC : 1,19-2,13 ; p = 0,002) et de toutes les ITS rectales (RR : 1,39 ; IC : 1,03-1,87 ; p = 0,03). La plupart des études inclues dans la revue rapportaient une augmentation des relations sexuelles non protégées sous PrEP.
20
Au Canada, une étude de cohorte rétrospective menée à la Clinique l’Actuel à Montréal a montré une augmentation des taux d’incidence d’ITS chez les utilisateurs de la PrEP (RI : 1,72 ; IC : 1,22-2,41) (Nguyen et al., 2018).
Il semble donc que les personnes sous PrEP soient particulièrement à risque de modifier leurs comportements et d’adopter des pratiques sexuelles à risque. Toutefois, cette modification des comportements sexuels sous PrEP ne signifie pas automatiquement que les HARSAH auront davantage d’ITS ni de complications reliées aux ITS au long cours. En effet, la prise de la PrEP est couplée à un suivi clinique, ce qui permet le dépistage régulier et le traitement des ITS. Une étude de modélisation a montré que, sur une période de dix ans, la prise de la PrEP associée au dépistage des ITS à chacune des visites de suivi, soit aux trois mois, ferait diminuer de façon importante le nombre d’ITS en comparaison avec les HARSAH qui ne prennent pas la PrEP (Jenness et al., 2017). Il est donc important que la PrEP soit implantée en combinaison avec d’autres méthodes préventives comme le counseling, la promotion du condom et le dépistage régulier des ITS.
1.2.8 Autres modalités de PrEP et nouveautés en développement
1.2.8.1 Les gels microbicides rectaux
La prise orale de la PrEP peut représenter une barrière pour certains HARSAH. Pour répondre aux besoins de ces HARSAH qui ne veulent pas recevoir la PrEP en comprimés, des gels microbicides pour application rectale ont été développés. Ces gels sont en général composés de TDF (McGowan, 2014). Une étude de phase 2 qui étudiait l’acceptabilité et la sécurité de gels microbicides chez des HARSAH et des femmes transgenres an Afrique du Sud, aux États-Unis, au Pérou et en Thaïlande (Carballo-Dieguez et al., 2017a; Carballo-Dieguez et al., 2017b; Cranston et al., 2017) a montré que les gels microbicides composés de TDF était acceptables chez cette population (Carballo-Dieguez et al., 2017b). Les participants préféraient utiliser les gels à la demande lors des relations sexuelles que quotidiennement. Toutefois, lorsqu’on demandait aux participants la méthode qu’ils préféraient entre l’utilisation du gel microbicide et la PrEP orale, près des trois quarts choisissaient la PrEP orale. La familiarité avec la prise de médicaments per os et la reconnaissance publique de l’efficacité de la PrEP orale sont des facteurs qui peuvent expliquer cette préférence (Carballo-Dieguez et al., 2017a). Malgré tout, 28 % des participants rapportaient préférer les gels microbicides, montrant que cette modalité peut mieux convenir à un nombre non négligeable d’HARSAH. Au cours de cette étude, 75 % des participants qui appliquaient le gel microbicide avant et après les relations sexuelles avaient une