INFORMATION TO USERS
This manuscript has been reproduced from the microfilm master. UMI films the text directly from the original or copy submitted. Thus, some thesis and dissertation copies are in typewriter face, while others may be from any type of computer printer.
The quality of this reproduction is dependent upon the quality of the copy submitted. Broken or indistind print, colored or poor quality illustrations and photographs, print bleedthrough, substandard margins, and improper alignment can adversely affed reproduction.
ln the unlikely event that the author did not send UMI a complete manuscript and there are missing pages, these will be noted. Also, if unauthorized copyright material had to be removed, a note will indicate the deletion.
Oversize materials (e.g., maps, drawings, charts) are reproduced by sectioning the original, beginning at the upper left-hand comer and continuing from left to right in equal sections with small overtaps.
ProQuest Information and Leaming
300 North Zeeb Road, Ann Arbor, Ml 48106-1346 USA 800-521-0600
NOTE TO USERS
•
•
Université de Sherbrooke
Caractérisation, rôle et purification d'un canal chlore des muscles lisses de trachée
Présenté par Dany Salvail
Département de Physiologie et Biophysique
à la Faculté de Médecine en vue de
l'obtention du grade de Philosophiae Doctor (Ph.D.) en Physiologie (Biophysique)
l+I
National Uwaryof Canada du BIJlioNque Canada nationale .a-uisitions and Acquilitiona et
ëiblïographic
Services services bibliographiques315 Welllnglon Slreet •.rue ".JW6igton
QlawaON K1A.. C:.-ON K1ACIN4
c.-a c..da
The author
bas granted
a
non-exclusive licence allowing the
National Library of Canada
to
reproduce, loan, distnbute or
sen
copies of
this
thesis in microform,
paper
or
electronic formats.
The
author retains ownersbip of
the
copyright
in
tbis
thesis.
Neither
the
thesis nor
substantial
extracts
ftom
it
may be
printed
or
otherwise
reproduced
without
the author's
permission.
L'auteur a accordé une licence non
exclusive
pennettant
à
la
Bibliothèque nationale
du
Canada de
reproduire,
prêter,
distribuer ou
vendre
des
copies
de
cettethèse sous
la forme
de
microfiche/fihn,
de
reproduction
sur papier ou sur format
électronique.
L'auteur
conserve
la propriété
du
droit
d'auteur qui
protège
cettethèse.
Ni
la
thèse
ni des extraits substantiels
de celle-ci ne
doivent
être imprimés
ou autrement reproduits sans son
autorisation.
•
pour William et Coralie
•
•
Table des matières
Table des matières Liste des illustrations Liste des tableaux
Liste des symboles et abbréviations RÉSUMÉ
INTRODUCTION
l. Physiologie des voies aériennes
2.
1.1 1.2
1.3
1.4
Anatomie du système respiratoire
Relation structure-fonction au niveau des voies aériennes Contrôle nerveux du tonus des voies aérieMes
Couplage excitation-contraction dans les cellules ML V A 1.4. l
1.4.2
Couplage pharmacomécanique Couplage électromécanique
Rôle électrophysiologique des ions et· dans les ML V A
2.1
2.2
Transport actif: Échangeurs et transporteurs Canaux sélectifs aux anions
c1·
2.2.l
2.2.2
2.2.3
Canaux
c1-
de la famille des CLCCanaux
c1-
activés par des changements de volume celllulaireCanaux activés par des ligands intracellulaires 3. Buts de cette étude
3.1
3.2
3.3
3.4
Caractérisation fonctionnelle du canal reconstitué en bicouches lipidiques planes
Recherche de modes de modulation cellulaire
Détermination du rôle joué par le canal dans le contrôle du potentiel membranaire
Étude du rôle joué par le canal dans la modulation du tonus des cellules musculaires lisses des voies aérieMes
1 IV VII VIII 1 1 3 7 10 li 13 21 22 26 26
32
35 41 4142
42
43
II 3.5 Purification et caractérisation biochimique du canal ci-des ML V A
44
•
de bovins4. Éléments des propriétés biophysiques des canaux c1-
45
4.1 Sélectivité ionique
45
4.2 Conductance unitaire et probabilité d'ouverture
48
4.3 Dépendance au potentiel membranaire
51
4.4 Modulation par des ligands et seconds messagers
53
4_5 Outils pharmacologiques dirigés contre les canaux ci-
54
5. Méthodes utilisées d'étude des courants ioniques et des protéines canal
56
5.1 Reconstitution de canaux dans des bicouches lipidiques planes56
5.2 Mesures de potentiel membranaire à l'aide de la technique de59
microélectrode de haute résistance
5.3 Électrophorèse
61
5.4 Chromatographie liquide à moyenne pression
61
5.5 lmmunodétection du canal c1-
65
RÉSULTATS
6.
Article 166
6.1 Functional identification of a sarcolemmal chloride channel from
67
bovine tracheal smooth muscle.Salvail, D., A. Alioua, & E. Rousseau.
Am. J. Physiol. 271:C1716-C 1724, 1996.
6.2 Conclusions de l'article 1
106
7. Régulation cellulaire du canal c1-
107
7.1 Éléments cytoplasmiques régulant le canal
107
7.2 Modulation du canal c1-par des facteurs extracellulaires
108
7.3 Effets connus des EETs sur les canaux ioniques
116
•
•
8.1
8.2
Direct modulation of tracheal c1· channel activity by 5,6- and 11.12-EET. Salvail, D.; Dumoulin, M.; Rousseau, E .. Am. J. Physio/ . 275:L432-L441, 1998.
Conclusions de l'article 2
9. Caractérisation biochimique du canal c1·
9.1 Élaboration du protocole de purification du canal c1· 1 O. Article 3
10.1 Purification and functional reconstitution of an ecoisanoid-modulated chloride channel from airway smooth muscle. Salvail, D .• E. Rousseau.
Soumis à
Journal of Bio/ogica/ Chemistry,
Août 2000. 10.2 Conclusions de l'article 3DISCUSSION
11. Synthèse des articles
11. I Propriétés biophysiques du canal Ct·
11.2 Identification des modes de régulation du canal et·
11.2.1 Modulateurs cytoplasmiques
11.2.2 Modulateurs extracellulaires ou d'origine paracrine 11.3 Propriétés biochimiques du canal
c1-l c1-l .4 Rôle du canal dans lélectrophysiologie des ML V A 11.5 Identification du canal
c1-
?11.6 Perspectives de cette étude CONCLUSION
REMERCIEMENTS
RÉFÉRENCES GÉNÉRALES
(les références spécifiques aux articles sont attachées à ces derniers)
III 119 166
167
168
170
171 212214
214
217
217
219
221
223224
226
229
231
232
IV
•
Liste des illustrations.
Figure l. Muscles thoraciques impliqués dans le cycle respiratoire 2
Figure 2. Divisions de l'arbre trachéo-bronchique dans les poumons 4
Figure 3. Sections histologiques de bronches canines de cinquième génération 6
Figure 4. Modèle simplifié de couplage pharmacomécanique 12
Figure S. Effets des variations d0
AMPc sur la régulation du tonus IS bronchomoteur
Figure 6. Sites de phosphorylation par la PKA impliqués dans la relaxation 16
des MLVA
Figure 7. Sites de phosphorylation de la PKG connus pour être impliqués 17
dans la relaxation des cellules ML V A
Figure 8. Accumulation de 36Ct· par les cellules ML du vas deferens de 23
cobaye
Figure 9. L'absence de Na+ extracellulaire diminue l'accumulation de 36Cl· 24
par des cellules ML
Figure 10. Représentation schématique des processus de transports cellulaires 25
de et·
Figure Il. Modèle de topologie des canaux de la famille CLC 27
Figure 12. Modèle schématique de la structure du canal sensible à des 33
variations de volume cellulaire
Figure 13. Structures proposées du Icin• basées en A sur la séquence du peptide 34
et en B sur les résultats d'expériences fonctionnelles
Figure 14. Structure du CFTR 36
Figure IS. Activation de Cie. induite par la liaison de métacholine sur les 38
myocytes de trachées de cheval
Figure 16. Analyse structurale du produit de hCLCA-1 40
Figure 17. Modèle de pennéation ionique
à
travers un canal simple 46Figure 18. Courbe 1 I V des canaux
à
rectification sortante 53Figure 19. Représentation schématique de l'incorporation d'un canal ionique 57
•
•
Figure 20. Figure 21. Figure 22. Article 1.Schéma du montage de reconstitution en BLP
Montage permettant la mesure du potentiel membranaire à l'aide de microélectrodes
Système de purification par chromatographie liquide Biologie HR
V
58
60
64
Figure 1. Simultaneous recordings of K • and c1- channels after fusion of a 75 single microvesicle from ASM cells plasma membrane
Figure 2. Biophysical characterization of unitary ASM cr- currents 79 Figure 3. Anionic permeability of the cr- channel studied 83 Figure 4. Blockage of the cr-channel by SO/ and HCQ3- 86 Figure 5. lnsensitivity ofthis c1- channel to cytoplasmic free [Ca2+] 89 Figure 6. Effects of Cl -channel blockers on the ASM anionic current 93
Figure 23. Les
3
voies métaboliques de l'acide arachidonique 109 Figure 24. Mécanismes hyperpolarisants contrôlés par l'endothélium 112 Figure 25. Absence d'effet du NO sur le canal cr- de cette étude 114 Figure 26. Bio-transformation de l'acide arachidonique par le complexe 116cytochrome P-450 monooxygénase
Article 2.
Figure 1. Effect of 11,12-EET on the resting Vm of rabbit tracheal smooth 130 muscle cells
Figure 2. Biophysical characteristics of the reconstituted, Ca2+ -insensitive c1- 136 channels
Figure 3. Dose-dependent inhibition of multiple channels by increasing 139 concentrations of 11, 12-EET
Figure 4. Quantitative analysis of the effect of l l,12-EET on the reconstituted 143 ASM c1- channels
•
•
Figure 5. Dose-dependent decreases in unitary conductance and Po induced by 5,6-EET
VI 146 Figure 6. eontrol experiments showing the absence of effect of arachidonic 149
acid on the reconstituted et· channels
Figure 7. Relaxant response of ASM strips induced by 5,6- and 11, 12-EET 152
following muscarinic and histaminic stimulations
Article 3.
Figure 1. Typical activity of the native et· channel and concentration- 183
dependent inhibition by 8,9-EET
Figure 2. WGA affinity chromatography of the solubilized, microsomal 187
fraction
Figure 3. Separation of the glycosylated transmembrane proteins by anion 191
exchange chromatography
Figure 4. 8,9-EET and DIDS inhibition of the current carried by the purified 195
channel
•
•
Tableau 1. Tableau 2. Tableau 3. Tableau 4. Tableau S. Article 2. VIIListe des tableaux
Récepteurs des cellules ML V A 9-10
Mécanismes impliqués dans le contrôle de la relaxation des cellules 20 MLVA
Classification actuelle des canaux ci- 30-31
Agents phannacologiques agissant sur les canaux c1- 55 Modulateurs dérivés de lipides et agissant sur les ML V A 110
Table 1. Membrane potential measurements ofrabbit and dog tracheal cells 133 in various experimental conditions
Article3.
Table 1. Effects of the EETs on the native and purified ci-channel 204
VIII
•
Liste des symboles et abbréviations
AA Acide arachidonique
AC Adénylate cyclase
A Ch Acétylcholine
AMPc Adénosine monophosphate cyclique
ATP Adénosine triphosphate
BLP Bicouche lipidique plane
CamKII Type Il de la kinase activée par le complexe Ca2
+
-calmoduline
ChTX Charybdotoxine
CLC Chloride channel
CLca Canal et· activé par le Ca2+
CYT P450 Cytochrome P-450
DHETs Acides di-hydroxyeïcosatrienoïques
DIDS Acide diisothiocyanatodisulfurique
DTf Dithiothréïtol
EDHF Endothelium-Derived Hyperpolarizing Factor
EDRF Endothelium-Derived Relaxing Factor
EET Acide epoxyeïcosatrienoïque
EpDHF Epithelium-Derived Hyperpolarizing Factor
EpDRF Epithelium-Derived Relaxing Factor
GMPc guanosine monophosphate cyclique
HETEs Acides hydroxyeïcosatetraenoïques
lbTX lbériotoxine
IP3 1,4,5-inositol triphosphate
rx
•
ML Muscle lisseMLVA Muscle lisse des voies aériennes
NO Oxide nitrique
NOS Nitric oxide synthase
PapaNONOate Propylamine propylamine NONOate
PGs Prostagladines
PKA Protéine kinase dépendente de I' AMPc
PKC Protéine kinase C
PKG Protéine kinase dépendente du GMPc
Po Probabilité d'ouverture
PTX Toxine de Pertussis
SIN-1 3-morpholino-sydnonimine
VSOAC Volume-sensitive outward rectifying anion channel
•
•
RÉSUMÉ
Caractérisation, rôle et purification d'un canal chlore des muscles lisses de trachée.
Dany Salvail
Département de Physiologie et Biophysique Thèse présemée à la Faculté de Médecine en vue de l'obtention du grade de Philosophiae Doctor (Ph.D.)
Dans les muscles lisses, les conductances trans-membranaires sélectives aux anions bénéficient de plus en plus d'attention. Leurs rôles dans le maintien du potentiel membranaire et en tant que contre-transporteurs de charges leur confèrent une importance justifiant une investigation plus détaillée des canaux sélectifs au
ci-
aux niveaux cellulaire et moléculaire. L'absence de marqueurs spécifiques pour ces canaux, de même que l'amplitude relativement faible des courants unitaires rendent difficile l'étude de ce type de protéines. Cette étude visaità caractériser une conductance et· présente dans les muscles lisses des voies aériennes (ML V A) de bovins, de façon à étudier les propriétés biophysiques du courant unitaire produit, puis à
purifier la protéine formant ce canal pour en définir les propriétés biochimiques.
Le premier objectif spécifique était d'incorporer des canaux
ci-
unitaires suite à la fusion de microvésicules dérivés de cellules MLVA dans des bicouches lipidiques planes, afin d'en révéler les caractéristiques unitaires. En présence de 250 / 50mM
CsCI cis / trans, nous avons mis en évidence un canal de conductance unitaire intermédiaire (77 pS), présentant une relation courant-voltage ohmique. L'ordre de sélectivité du canal et·> 1->Br">r
>>S0.2° suggère une bonne sélectivité pour les anions monovalents de la famille des halogènes. Dans nos conditions expérimentales, la probabilité d'ouverture (Po) du canal est élevée ( > 0.75) et insensible aux variations de potentiels dans la gamme testée(±60
mV), aux variations de [Ca2+]
du côtécytoplasmique et au pH. Les kinases PKA, PKG et PKC, ainsi que les composantes de cocktails de phosphorylation (AMPc, ATP, GMPc, GTP) n'ont pas d'effet sur le canal reconstitué. De plus, une phosphatase non-spécifique n'altère pas le comportement du canal.
Le second objectif visait à mettre en évidence les mécanismes modulant l'activité du canal. Nous avons découvert que les acides époxyeïcosatrïénoïques (EET) produits par la
•
cytochrome P-450 monooxygénase modulent l'activité du canal reconstitué. Deux des régioisomères (le 5,6- et le 8,9-EEn causent une inhibition combinant des diminutions concentration-dépendantes de la conductance unitaire et de la Po des canaux (IC50 respectifs: 0.3 et 0.4 µM). Un troisième régioisomère, le 11,12-EET, n'influence que la Po du canal (1Cs0: 1.87 µM) , alors que le 14.15-EET est sans effet.L'apport des conductances ioniques sarcolemmales au maintien du potentiel membranaire a fait l'objet de mesures effectuées à l'aide de microélectrodes de haute résistance empalées dans des ML V A de lapins. Le rôle du canal au niveau cellulaire a été interrogé par cette technique. Les EETs induisent une hyperpolarisation de quelques mV des cellules, qui est reproduite par l'ajout de l'inhibiteur de canaux et· DIDS, et donc partiellement attribuable à
l'inhibition des canaux et· et.
Le troisième objectif visait à purifier le canal caractérisé, afin d'évaluer ses propriétés biochimiques. Le protocole mis au point implique une solubilisation et deux chromatographies séquentielles, une d'affinité sur colonne de WGA et la seconde sur échangeur anionique, tirant profit de l'état glycosylé et de la charge nette négative du canal. La reconstitution après différentes étapes de purification d'un courant et· identique à celui généré par la protéine native suggère une structure monomérique capable de transporter du c1· indépendamment des autres composantes cellulaires. L'analyse par immuno-buvardage à l'aide d'anti-CLC-3 suggère que le canal a une masse moléculaire de
-SS
kDa. De plus, la comparaison des effets des EETs sur les formes native et purifiée du canal suggère que la diminution de Po induite par le 5,6- et le 8,9-EET nécessite la présence de domaines hydrophobes impliqués dans la modulation du canalpar ces molécules.
Les caractéristiques biophysiques et biochimiques du canal, ainsi que sa modulation par des facteurs dérivés de l'épithélium, suggèrent un rôle de ce canal dans le maintien de Vm et dans le contrôle du tonus des cellules ML V A.
•
j
INTRODUCTION
1. PHYSIOLOGIE DES VOIES AÉRIENNES
1.1 Anatomie du système respintoire
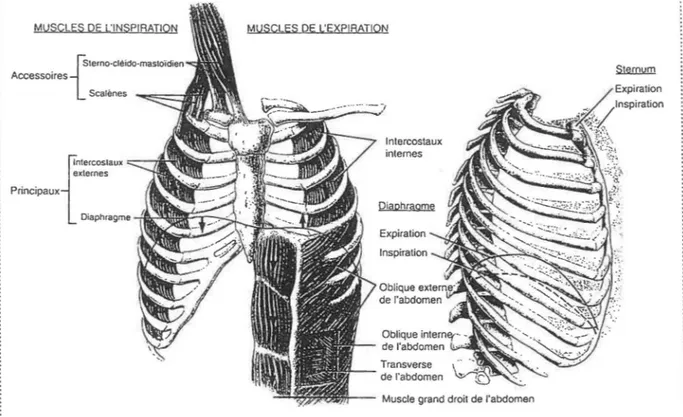
Le système respiratoire est composé de deux parties fonctionnellement distinctes: le thorax et les voies aériennes, incluant les poumons. C'est au niveau du thorax que se trouvent les muscles impliqués dans la mécanique respiratoire extra-pulmonaire. Le diaphragme, muscle principal du cycle respiratoire, sépare la cage thoracique de la cavité abdominale. En se contractant, il s'abaisse et augmente la dimension verticale de la cage thoracique, provoquant une expansion du volume pulmonaire (et modifiant la géométrie de la cage thoracique). Les muscles intercostaux externes complètent l'activité du diaphragme en soulevant les côtes lors de l'inspiration. Dans la mesure où elle est déclenchée par la contraction de plusieurs muscles respiratoires, l'inspiration est considérée comme un processus actif. En revanche, l'expiration est généralement vue comme un phénomène passif, bien qu'il puisse y avoir contraction des muscles intercostaux internes lors d'un exercice. La figure 1 illustre les positions et le sens de contraction des différents muscles respiratoires chez l'humain.
-····-···-···--···-···-···--- ···-···---···----···-···: MUSCLES DE L'INSPIRATION
-L
terno-cléido-mastoïdien Accessoires Scalènes ~::==:::JI { nlercostaux e><ternes Principaux Diaphragme l MUSCLES DE L'EXPIRATION Intercostaux internes Diaphraome Expiration InspirationMuscle grand droit de l'abdomen
Expiration
···-···-···4
Figure l. Muscles thoraciques impliqués dans le cycle respiratoire; les muscles inspiratoires et leurs actions apparaissent à gauche, tandis que les muscles impliqués dans l'expiration apparaissent à droite. Le petit pectoral n'apparaît pas sur cette figure. (Tiré de TORTORA et al., 1994).
Les v01es aériennes peuvent être divisées en deux zones, soit extra-thoracique (supérieures) ou intra-thoracique (inférieures). Les premières comprennent le nez, le pharynx, le larynx et la partie supérieure de la trachée. Ces structures sont impliquées dans le conditionnement thermohydrique et l'acheminement de l'air inspiré. Quant aux voies aériennes intra-thoraciques, elles comprennent une partie de la trachée et l'arbre bronchique dans sa totalité, des bronches principales (génération 1) aux alvéoles (génération 24). D'un point de vue fonctionnel, on y retrouve les zones de convection, de transition, et de respiration. La zone de
I
3 convection s'étend de la trachée aux bronchioles terminales (génération 15), et son rôle est exclusivement de conduire l'air dans les poumons. La zone de transition possède en plus un rôle d'échange gazeux, puisque les bronchioles qu'on y retrouve (générations 15 à 19) sont partiellement alvéolisées. Finalement, la zone respiratoire comprends les canaux alvéolaires, les sacs alvéolaires et les alvéoles (générations 19 à 24), site des échanges gazeux (PRÉFAUT, 1993).
1.2 Relation structure-fonction au niveau des voies aériennes
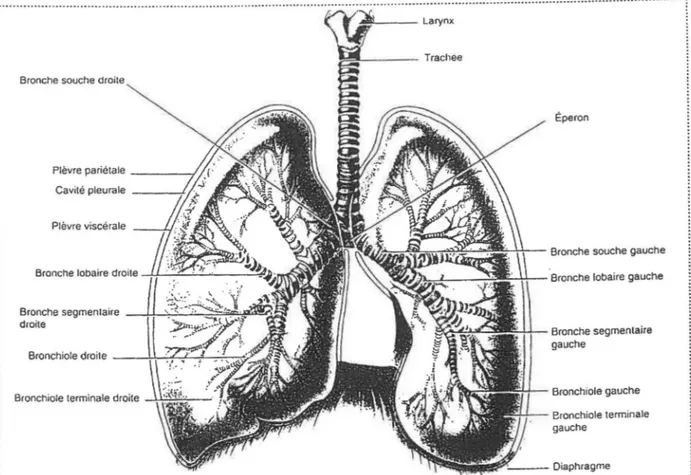
La trachée est caractérisée par la présence d'une armature cartilagineuse (en forme de C, dont la partie ouverte fait face à l 'oesophage) qui disparaît pour être totalement absente au niveau des bronchioles (génération 10). À l'inverse, les muscles lisses ne couvrent que la partie postérieure de la trachée et des bronches externes, mais forment toute la couche interne des bronches moyennes (génération 3-4). La figure 2 schématise les branchement de chacune des générations dans l'ensemble de la cage thoracique et la présence d'armature cartilagineuse sur la trachée et les bronches supérieures.
., ... 1
Bronche souche droite
Éperon
Plèvre viscérale
Bronche souche gauche
Bronche segmenlaire --L+-..:,,....;.--'-"""'=~~~i=
droite Bronche segmentaire
gauche
Bronchiole gauche Bronchiole terminale gauche
:. ... : ... ;
Figure 2. Divisions de l'arbre trachéo-bronchique dans les poumons. La division des bronches souches en bronches lobaires (externes), segmentaires (moyennes) et petites bronches est beaucoup plus rapide qu'illustré sur cette figure. Elle résulte en 24 générations fonctionnelles, dont les 16 premières (de la trachée aux bronchioles terminales) constituent la zone de convection, et les 8 dernières (des bronchioles respiratoires aux alvéoles) forment la zone respiratoire. (Tiré de TORTORA et al., 1994).
Les parois de la trachée et des bronches comprennent une muqueuse (constituée de cellules épithéliales cylindriques ciliées, de cellules caliciformes et de cellules basales), une sous-muqueuse (constituée de glandes séromuqueuses et de cellules musculaires lisses) et des zones cartilagineuses, le tout couvert par l'adventice externe. L'hémisphère cartilagineux constitue un soutien rigide qui empêche les parois de la trachée de s'affaisser, ou donnant aux
5 bronches une rigidité qui leur pennet de supporter la pression positive créée lors de la toux. Les muscles lisses relient les extrémités ouvertes des anneaux de cartilage, et pennettent de contrôler le débit d'air acheminé vers les alvéoles (TORTORA et al., 1994). Il a été démontré que les structures musculaire et cellulaire de la trachée sont comparables à celles des bronches supérieures (mis à part l'arrangement du cartilage qui est plus ordonné au niveau de la trachée), jusqu'à la cinquième génération bronchique (RODGER, 1992). La figure 3 illustre des sections
·--··--···-···-···-···-····:
Figure 3. Sections histologiques de bronches canines de cinquième génération. A: Avant que ne soit éliminé le cartilage; les cellules ML (SM) sont situées sous l'épithélium (EPI), et ne sont pas en contact direct avec le cartilage (CT). B: Après avoir retiré le cartilage, on observe un réarrangement du ML (SM), toujours sous l'épithélium (EPI). (Tiré de STEPHENS et al., 1992).
7 1.3 Contrôle nerveux du tonus des voies aériennes
La contraction des cellules ML V A est contrôlée par le système parasympathique. par lintermédiaire de I' acécylcholine et du récepteur muscari nique situé sur les cellules ML VR. Il existe également une influence bronchoconstrictrice vagale augmentant la résistance de la trachée et des bronches au passage de l'air. Les nerfs sympathiques libèrent de la noradrénaline, induisant une bronchodilatation. Une autre afférence neuronale agissant sur les cellules ML V A inférieures emprunte la voie du nerf pneumogastrique; le système adrénergique, non-cholinergique (NANC) induit une bronchodilatation active et relativement plus importante que le système sympathique par l'intermédiaire du peptide intestinal vasoactif (VIP), et de l'oxyde nitrique (NO). Ce système peut aussi avoir des effets bronchoconstricteurs suite à la libération de tachykinines, la principale dans les voies aériennes intra-thoraciques étant la substance P (JANSSEN et SIMS. l 994a). Enfin, la voie humorale vient y compléter et moduler les influences neuronale. Par exemple, l'histamine sécrétée par les mastocytes et les granulocytes induit une bronchoconstriction (CHIT ANO et al., 1996; KNIGHT et al., 1995). De plus, les effets des prostaglandines et leukotriènes sur les voies aériennes ont fait l'objet de nombreuses études (DEVILLIER et BESSARD, 1997; KNIGHT et al., 1995; DAHLEN et DAHLEN, 1995; FOLKERTS et al., 1995; HENDERSON, Jr., 1994a; HENDERSON, Jr., 1994b; O'BYRNE, 1997; O'BYRNE et al., 1997; SAMPSON, 1996).
1.4 Physiologie des cellules musculaires lisses des voies aériennes
•
•
8 considéré comme multi-unitaire. dans la mesure où chaque cellule ML est innervée et communique peu, via les .. jonctions-gaps", avec les cellules avoisinantes. De plus. l'existence de jonctions endo / épithélio-musculaires (présumée par certains auteurs à partir de mesures fonctionnelles faites sur des tissus vasculaires, voir (EDW ARDS et al., l 998a)) est disputée par des études récentes utilisant des sondes fluorescentes (WELSH et SEGAL, 1998). Chaque cellule musculaire mesure en moyenne 0.8 mm de longueur. pour un volume approximatif de 3000 µm3• La surface cellulaire est considérable, environ 7400 µm2, et résulte de la présence de nombreuses invaginations dans la membrane. Chaque cellule est entourée de lamina basale (sauf dans la région des "jonctions-gaps") et d'une abondance de collagène et de fibres élastiques (CAMERON et al., 1982).
On retrouve à la surface des cellules ML V A une population diverse de récepteurs auxquels se lient les neurotransmetteurs et autres modulateurs. Le tonus des cellules ML V A est régulé par les effets complexes de ces facteurs, responsables de l'activation de
a-,
~1-, ~2,P
3-adrénocepteurs (BARNES et al., 1983; GOLDIE et al., 1990), récepteurs cholinergiques (ROUX et al., 1998), muscariniques -principalement M3 et M2 - (BARNES, 1993), au VIP (Peptide intestinal vasoactit) (KNEUSSL et RICHARDSON, 1978), aux tachykinines (activés par la substance P)(SAID, 1987), au CGRP (calcitonin-gene related peptide) (NINOMIYA et al., 1996), histaminergiques -H1 et H2- (GERTHOFFER, 1996; LEFF et MUNOZ, 1981) et une variété de récepteurs additionnels, activés par des médiateurs lipidiques, ou des dérivés des cellules épithéliales ou du système immunitaire. Le tableau 1 liste certains récepteurs répertoriés à la surface des cellules ML V A, ainsi que leurs agonistes naturels. Le lecteur intéressé par les récepteurs sarcolemmaux des voies aériennes est référé aux articles de revue suivants: (BAI,
•
•
1992: BARNES. 1990; DOUGLAS. 1990; GOLDlE. 1990; HALUSHKA et al., 1989).
T~bleau 1. Récepteurs des cellules MLVA.
Effet Bronchoconstricteur
Médiateur Récepteur Neurotransmetteur
Histamine H, Acétylcholine Leukotriènes LT1 Substance P Thromboxane TP Neurokinine A PGD2 DP CGRP PGF2 FP Neuropeptide Y Isoprostanes TP Cholecystokinine
PAF PAF Bombesin / GRP
Sérotonine 5HT2
Bradykinine
82
Endothéline-1 ETB
Adénosine A1b
Angiotensine II AT-1
(continué sur la page 10)
Récepteur M3 et M2 NK2 NK2 CGRPI/2 9
•
•
10 Effet Broncbodilatateur
Médiateur Récepteur Neurotransmetteur Récepteur
VIP PVRI Épinéphrine
P
2-adrénergiquePACAP PVRI Épinéphrine
P
3-adrénergiquePGE2 EP
PGl2 IP
Adréno-médulline AM
ANP GCA
Oxyde nitrique GC sol., ...
(BARNES, 1998; BAI, 1992; BARNES, 1990; BLACK, 1986; CARST AIRS et BARNES, 1986; DOUGLAS, 1990; GOLDIE, 1990).
1.4 Couplage excitation-contraction dans les cellules MLV A
Le potentiel membranaire (Vm) des cellules ML au repos varie de -45 à -65 mV, et ne présente pas de variations lentes (slow waves) (SMALL, 1988), sauf chez le chien et le cobaye (JANSSEN et DANIEL, 1991; JANSSEN et SIMS, l 994b ). Les cellules ML de personnes non-asthmatiques ne génèrent pas de potentiel d'action spontané (RODGER, 1992). La stabilité relative de Vm dans les cellules ML V A résulte de la prédominance de la perméabilité K. de la membrane, qui hyperpolarise la cellule en s'activant, et de la présence de conductances anioniques dont lactivation tend à dépolariser le sarcolemme. L'efficacité de ces mécanismes opposés est telle que le potentiel membranaire (Vm) n'atteint presque jamais le potentiel seuil d'activation des canaux dépendant du voltage, comme les canaux calciques de type L (approximativement -20 mV). Cette caractéristique électrophysiologique a des conséquences importantes sur les modes de couplage phannacomécanique et électromécanique des cellules ML V A. Ces modes de couplage sont distincts mais non-disjoints, reposant sur les mouvements
•
•
11 de Ca!· transmembranaires et intracellulaires. Ils sont contrôlés par les canaux calciques du sarcolemme -activés par le voltage (VOC) ou par ligand (ROC)- et des réticulums endoplasmique et sarcoplasmique - activés par ligand-. ainsi que par les éléments contractiles cytoplasmiques et différents canaux ioniques de la membrane de surface.
1.4 .1 Couplage pharmacomécanique
Les modèles simplifiés actuels expliquant les grandes étapes du couplage pharmacomécanique des cellules ML impliquent la libération de neurotransmetteurs par les terminaisons nerveuses, I 'acétylcholine
par
exemple. qui activera préférentiellement le récepteur muscarinique de type M3• Celui-ci, couplé à la phospholipase C via une protéine Gq (WANG et KOTLIKOFF, 1997a), causera l'hydrolyse du phosphatidylinositol bisphosphate (PIP2) en inositol 1,4,5-triphosphate (IP3) et diacylglycérol (DAG) (CHIL VERS et NAHORSKI, 1990). L'IP3 libéré diffusera dans le cytoplasme pour se lier aux récepteurs à l'IP3 du réticulum endoplasmique et permettre la libération de Ca2+ de ce compartiment.:···-···-···-···1 : ,· : l ~ne , .. ' l : ... .. ~~le Agoolsts ... , , .. ; ... .. ... l--iàst.an'W'ld .- - , .,,, ; ""'•...
....
Angk:>tenskl 11 .. .,,, _.,,.,,, : ... 1 ... .....
__ _
.... ...
Contraction Grow1h Prolileration....
...
....
: ,,,,,,"""----·
...
~...
~ ' , ' ' Memb<an8 Hyperpotarization , .. '''.. , , ' ' (Relaxmion) ...
•"---
. :. ... . Figure 4. Modèle simplifié de couplage pharmacomécanique. La transduction du signal par le récepteur (R) active la phospholipase C (PLC), qui hydrolyse l'inositol 4,5-bisphosphate (IP2), libérant l'inositol 1,4,5-triphosphate (IP3) et le diacylglycerol. L'IP3 causera une libération de Ca2+ du réticulum endoplasmique vers le cytoplasme en se liant à son récepteur. (Tiré de HATHAWAY et al., 1991).Les ions Ca2+ libérés s'associeront ensuite avec la calmoduline pour permettre la phosphorylation de la chaîne légère de la myosine. En parallèle, le DAG, activera la protéine kinase C, capable elle aussi de phosphoryler des éléments contractiles des cellules ML V A (STEPHENS et SEOW, 1987). Ce type de couplage est considéré comme pharmacomécanique dans la mesure où la contraction des cellules ML V A n'est pas engendrée par un changement de Vm qui active les canaux Ca2+ et permet l'entrée de Ca2+ du milieu extracellulaire vers le
•
•
13 cytoplasme (COBURN et BARON. 1990). Un exemple de couplage pharmacomécanique est observé chez certaines espèces suite à la liaison de l'histamine sur le récepteur H1, causant une contraction cellulaire en condition de voltage imposé (pas de changement de Vm possible) (JANSSEN et SIMS. 1993).
1.4.2 Couplage électromécanique
Un mode de couplage complémentaire actif dans les cellules MLV A consiste en une contraction initiée par une dépolarisation du sarcolemme. Le couplage électromécanique est observé lors d'expériences in-vitro au cours desquelles la concentration extracellulaire de K+ est augmentée de façon à réduire la force motrice agissant sur ces cations. Dans ce cas, la contraction des cellules ML V A est causée par une diminution de la contribution relative des conductances K+ de la cellule. au profit d'une contribution plus importante des conductances anioniques (plus spécifiquement. de type Cl} Les potentiels d'équilibre du K. (Ed et du c1· (Ec1) étant respectivement d'environ -90 et-30 mV (AICKJN et BRADING, 1985) dans ce type de cellules, l'augmentation de la contribution des conductances c1· a pour effet de dépolariser la membrane, pour permettre l'entrée de Ca2+ dans la cellule. Cette augmentation de Ca2+ cytoplasmique initierait la même cascade enzymatique qu'une augmentation sous-tendue par
la libération de Ca2
+ des compartiments intracellulaires (COBURN et BARON, 1990).
Une modulation fine du couplage pharmacomécanique peut être effectuée par les seconds messagers agissant sur les récepteurs membranaires (LUNDBERG et al., 1985). L'élévation de [Ca2+] cytoplasmique est ainsi reconnue pour inhiber les canaux Ca2+ (entre autres mécanismes) (OHYA et al., 1988), tout en augmentant l'activité des canaux
Kea
•
•
14 (SA V ARIA et al.. 1992) et Clca (JANSSEN et SIMS. 1995). Une dépolarisation de la membrane sarcolemmale par les phorbol esters démontre que certains canaux impliqués dans le contrôle de Vm sont modulés par une phosphorylation dépendante de la PKC (BABA et al., 1989). Les canaux Kea de grande conductance sont activé par une phosphorylation par la PKG, une kinase elle-même activée par une augmentation des niveaux cytoplasmiques de GMPc (ALIOUA et al., 1995). Les nucléotides cycliques modulent ainsi la contraction et de la relaxation des cellules ML (TORPHY, 1994). Des études ont démontré que les récepteurs
f3
2-adrénergiques sont couplés à l' adénylate cyclase par une protéine G5, activant la conversion de l 'A TP en AMPc. Ce nucléotide cyclique active à son tour la famille de kinases PKA (AMPc-dépendantes), qui peuvent phosphoryler différents substrats, avec comme effets connus une inhibition de l'hydrolyse de l'IP3 par la PLC (HALL et al., 1989), un re-pompage accéléré de Ca2+ par la SERCA (MUELLER et V AN BREEMEN, 1979), une inactivation de la MLCK et une activation des canaux et transporteurs de la membrane de surface (GUNST et STROPP, 1988; KUME et al., 1989).Les phosphodiestérases (POE) contribuent à la modulation du tonus des ML en hydrolysant les nucléotides cycliques. Des nombreux isoformes connus, la POE l contrôlerait partiellement la vitesse de contraction des cellules ML V A et les isoformes 5 et 4 hydrolyseraient
l'AMPc suite à une stimulation bronchorelaxante (ROUSSEAU et al., 1995). L'inhibition de ces enzymes par le z.aprinast et le rolipram, (sélectifs pour les POE
5
et 4, respectivement) causent une relaxation expliquée par l'hydrolyse plus lente de l 'AMPc. La figure5
illustre certains effets des variations de niveaux cytoplasmiques d' AMPc sur le tonus des MLVA .)
15 :···-····-···-···-···-···: STIMULUS MEMBRANE RESPONSE CholinergieRecep1or a-Adrenergic Recep1or
RESPONSE
INTRACELLULAR jic1MPI
t Co++ ovoitoble to octinomyosin EFFECT t ASM TONE
i9-Adrenergic Receptor
Adenyl Cyclose Aclivity t l tcAMP 1
i
Co++ ovoiloble Io octinomyosint ASM TONE
~. ···-· ... -·· ... ··-···--···· ... ···-· ... ··· .. ··· ---~
Figure 5. Effets des variations d' AMPc sur la régulation du tonus bronchomoteur. La stimulation des récepteurs cholinergiques et a-adrénergiques résulte en une diminution de l'activité de l'adénylate cyclase, entraînant une production d' AMPc moins importante et des taux de phosphorylation par la PKA moins élevés. À l'inverse, l'activation des récepteurs ~
adrénergiques (ou PG, illustré ici) active l'adénylate cyclase, augmentant indirectement l'activité de la PK.A, et cause une diminution du tonus des ML V A. (Tiré de LEFF, 1982).
Les ML V A sont soumis à une stimulation parasympathique qui leur confère un tonus de base. La relaxation des cellules peut donc résulter de l'inhibition de certaines de ces stimulations. En effet, les antagonistes des récepteurs muscariniques et histarninergiques produisent une bronchorelaxation en inhibant la stimulation basale des cellule par le système nerveux ou immunitaire, comme dans le cas d'inflammation chronique (LEFF, 1982; LEFF et
i··· · · ··· ··· ··· ···· ··· · · ·· ·· ··· ··· ··· ··· ··· ···ë·;~;~-~-~~-iÏ~··;~~-~-p··~~;· · · ··· ··· ··· · · ··· · ···· ···1 Receptor
\ e.g. {}2 e.g. histamine \
l ;
: :
~ Na· (3) .
:. ... .. Figure 6. Sites de phosphorylation par la PKA impliqués dans la relaxation des MLV A. Les effets combinés de ces phosphorylations contribuent à diminuer la concentration cytoplasmique de Ca2\ tout en diminuant aussi l'efficacité de la kinase de la chaîne légère de la myosine (MLCK). On retrouve sur ce schéma la régulation négative des récepteurs activant la contraction cellulaire (ici, le récepteur histaminergique), et de la MLCK, ainsi que l'activation par phosphorylation PKA-dépendante des mécanismes de re-pompage et d'extrusion du Ca2
+, et des
canaux repolarisant Kea· (Tiré de KNOX et TATTERSFIELD, 1995).
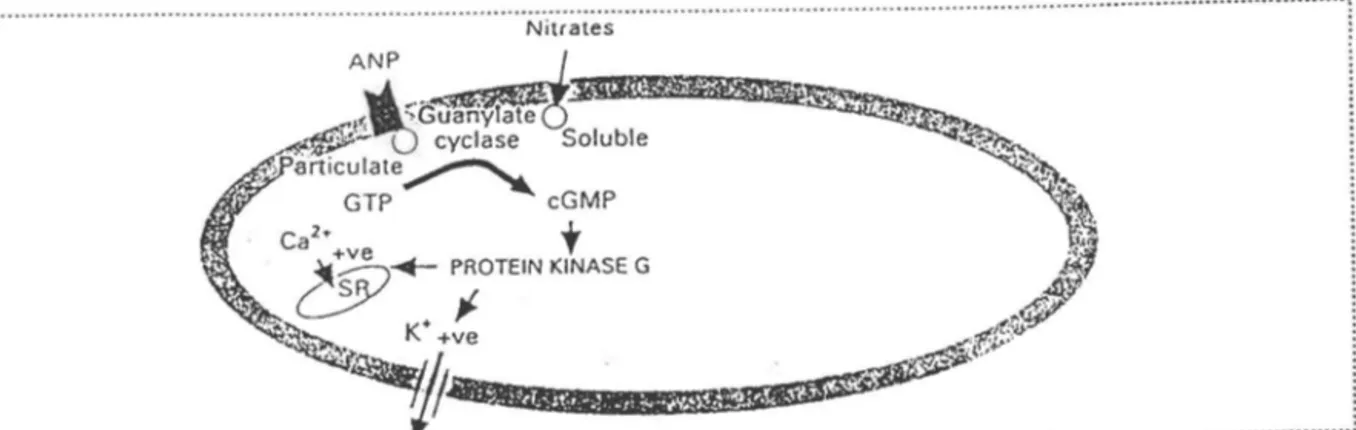
Certains récepteurs dont l'activation résulte également en une relaxation des cellules MLVA sont couplés à la guanylate cyclase plutôt qu'à l'adénylate cyclase. Cet enzyme existe sous deux formes: soluble et particulaire. Les récepteurs du peptide natriurétique de l'oreillette ("ANP"), lorsqu'activés, entraînent une production accrue de GMPc par la guanylate cyclase particulaire, qui active subséquemment une famille de kinases dépendantes du GMPc (PKG). D'autre facteurs aux effets relaxants (oxyde d'azote, nitrates donneurs de NO) activent la forme soluble de la guanylate cyclase. L'activation de la PKG entraîne la phosphorylation de différentes protéines des cellules MLV A, avec comme effets prédominants l'activation des canaux
Kea
(ALIOUA et al., 1995) et une augmentation du taux de re-pompage du Ca2+ dans les compartiments calciques intracellulaires (FELBEL et al., 1988; MCGROGAN et al., 1995). La figure 7 illustre quelques sites de phosphorylation de la PKG qui sont impliqués dans la)
17
relaxation des cellules MLV A.
:···---··· Nitrates ···-···;_.
_:;;·G~
~)
J4~~..:.~ cyclase Soluble · ~(
articulate~ ~"'~,.._ GTP cGMP - ~ Cai.t
~~.
)~.,._
PROTEIN KINASE Gi~1
.
: c__:;7 "'
.-R.9
:
! ' K+ 1f":~".:Y : : ~ ~ • +ve ,;.';((;,·· : : . oe.~ ~ -~;ff!}?iil·1.• ~~ : .l
· ~--lmWill!WW~
l
:. ...•Figure 7. Sites de phosphorylation de la PKG connus pour être impliqués dans la relaxation des cellules MLV A. L'activation des guanylate cyclases particulaires ou solubles par leur(s) ligand(s) induit une production accrue de GMPc qui active la PKG. Cet enzyme phosphoryle les canaux de surfaces de type Kea et la pompe intracellulaire SERCA. Les phosphodiestérases sont absentes de cette illustration. Elles hydrolysent les nucléotides cycliques et favorisent ainsi la relaxation des cellules (Tiré KNOX et TATTERSFIELD, 1995).
La particularité du phénomène couplage excitation-contraction au niveau des cellules ML réside dans la non-exclusivité des deux modes de couplage E-C. La réponse des tissus à !'acétylcholine illustre bien la complexité inhérente à l'existence de ces voies. Il a été démontré que la stimulation cholinergique peut induire une contraction en voltage imposé. En plus, !'acétylcholine active, en absence de contrôle artificiel de Vm une conductance cationique non-sélective (transportant des ions Na+ et Ca2+; (JANSSEN et SIMS,
1992;
WANG etal., 1997)
qui permet l'entrée de cations et dépolarise la membrane. La présence de récepteurs à la ryanodine (R YR, le canal responsable du phénomène de"Ca
2+-induced Ca
2+release")
(SOML YO etSOML YO, 1994) dans les ML suggère que l'influx de Ca2+ à travers les canaux cationiques non-sélectifs pourrait activer ces récepteurs lors du couplage électro-mécanique. Les récepteurs
•
•
18 muscariniques M3 sont aussi couplés à des protéines G sensibles à la toxine pertussique qui inhibent les canaux Kea et réduisent le pouvoir de rectification électrique du sarcolemme des cellules MLVA (KUME et KOTLIKOFF, 1991).
La dépolarisation causée par l'activation des canaux Clca -les canaux
Kea
étant inhibés-tend à favoriser une entrée de Ca2• vers le cytoplasme qui contribue à la contraction, en plus d'assurer le remplissage des compartiments cytoplasmiques de Ca2• et la disponibilité du Ca2• lors de la stimulation subséquente (BOURREAU et al., 1991; BOURREAU et al., 1992). Lerésultat de cette synergie est un couplage excitation-contraction physiologique essentiellement pharmacomécanique finement modulé dans sa durée et l'amplitude de la contraction obtenue par une composante électromécanique. Les interactions entre les structures sarcolemmales et cytoplasmiques lors de l'activation d'une cellule ML sont mieux connues au niveau du système vasculaire; cependant, les données recueillies à ce jour suggèrent que les mêmes mécanismes sont actifs dans les cellules ML V A.
La relation entre le degré de contraction des cellules ML et les niveaux cytoplasmiques de Ca2• est telle qu'une relaxation est généralement précédée d'une diminution de [Ca2+] cytoplasmique, bien que les muscles lisses soient reconnus pour posséder un mécanisme de verrouillage ("latch") leur permettant de demeurer contractés malgré la diminution des taux de phosphorylation de la chaîne légère de la myosine, phosphorylation elle même dépendante de la concentration de Ca2 .. (SIEGMAN et al., 1980). Les principaux systèmes responsables de la diminution de [Ca2+) cytoplasmique étant la pompe Ca2 .. A TPase sarcolemmale, l'échangeur Na ..
1 Ca2
•
•
19
voies de signalisation principales menant à la relaxation des ML V A activent de façon marquée ces enzymes. Les différents mécanismes induisant la relaxation des ML V A sont répertoriés dans le tableau 2 .
•
•
20 Tableau 2. Mécanismes impliqués dans le contrôle de la relaxation des cellules MLV A.
Mécanisme relaxant Effets principaux l . Augmentation de la -" re-pompage du Ca2•
[AMPc] cytoplasmique -"extrusion de Ca2" .._ activité MLCK .._production d'IP3
2. Augmentation de la -" re-pompage du Ca 2-[ GMPc] cytoplasmique -"activité
Kea
3. Inhibition de l'hydrolyse .._ activité des isoformes des nucléotides 1 à V des
cycliques phosphodiestérases
4. Modulation de canaux ""conductances K-10mques
5.
Autres mécanismes -"transport de Na-.._ conductances Ca 2-.._ conductances c1· .._ activité PKC ' activité MLCK Agent relaxant Agonistes (}-adrénergiques VIP Peptide Histidine-lsoleucine Oxyde d'azote Nitrosothiols, Nitrates ANP, BNP, CNPInhibiteurs des PDEs des MLVA
PKA,
PKG, Ca2·, .._[A TP]
PKA,
activateurs de la Na-/ K. ATPaseVerapamil, nicardipine, ... Acide niflumique, DIDS, SITS, ...
H-7, staurosporine, ...
(Compilé à partir de (HALL et CHIL VERS, 1989; HIRAMA TSU et al., 1994; HOGABOOM et FEDAN, 1981; llZUKA et al., 1997; JANSSEN et NANA, 1997; JANSSEN et al., 1997a; JIANG et STEPHENS, 1992; KNOX et TA TTERSFIELD, 1995; REMBOLD, 1992; SOML YO
•
•
21
et SOMLYO, 1994).
2.0 Rôle électrophysiologique des ions
c1-
dans les ML V AL'apport des conductances cationiques (K\ Na·, Ca2·) aux variations de Vm et au tonus musculaires a fait l'objet de dissection électrophysiologiques et pharmacologiques qui ont révélé leur rôle dans ces mécanismes. Il est ainsi admis que la perméabilité élevée du sarcolemme pour les ions K. cause une accumulation de charges négatives sur la surface interne de la membrane plasmique, qui est conjointement responsable (avec les gradients de concentrations ioniques) de la différence de potentiel existant de part et d'autre de celle-ci. Lors de la dépolarisation, la sortie de charges négatives (suite à l'activation d'un courant entrant de Cl", par exemple), contribue à dépolariser le sarcolemme. À l'inverse, les mécanismes tendant à accumuler les charges négatives à l'intérieur du cytoplasme (ou à faire sortir des charges positives vers l'extérieur de la cellule) contribueront à une hyperpolarisation. L'implication des anions monovalents dans ces phénomènes d'accumulation de charges est moins bien connue. Il a longtemps été pris pour acquis que les ions
ci-
diffusaient à travers le sarcolemme des cellules de mammifères, et que leur concentration cytoplasmique était entièrement déterminée par le potentiel membranaire des cellules. Si la perméabilité du sarcolemme des muscles squelettiques est effectivement très élevée, l'utilisation des microélectrodes sélectifs auci-
par Aicldn et Brading en1980
a permis de démontrer qu'il n'en est pas de même dans les muscles lisses. Dans ce type de cellules, l'activité intracellulaire duci-
est jusqu'à cinq fois plus élevée que celle prédite par une distribution passive deci-
(AICKIN et BRADING,1985).
Les activités mesurées et concentrations estimées suggèrent que le c1· n'est pas tamponné par des éléments•
•
22
cytoplasmiques, comme peut l'être le ea2~, de sorte que pour le c1· ces paramètres sont
semblables ( 46 et 51 mM, pour les activité et concentrations de e1· dans le vas deferens de rat. par exemple, AICKIN et BRADlNG, en 1982. Les mesures effectuées sur différents muscles lisses révèlent une large gamme de concentrations intracellulaires de c1· , allant de 39 mM dans le muscle lisse utérin de rat à 141 mM dans le muscle lisse vasculaire aortique de la même espèce (AICKIN, 1990). Il n'existe pas de valeur mesurée directement dans les cellules des
MLV A. Cependan~ les mesures électrophysiologiques de potentiel d'équilibre pour le et· dans
les cellules ML de trachée situent la concentration cytoplasmique de cet anion à 36 mM (JANSSEN et al., 1998).
2.1 Transport actif: Échangeurs et transporteurs
La distribution non-passive de e1· dans la cellules ML V A implique que des mécanismes actifs doivent exister pour accumuler le et· dans le cytoplasme contre son gradient électrochimique. Deux études par Casteels (CASTEELS, 1971) et Aickin et Brading (AICKIN et BRADlNG, 1985) ont permis d'identifier les deux structures responsables de cette accumulation. L'échangeur c1· I HCO; a d'abord fait l'objet d'études vue son implication dans l'accumulation cytoplasmique de
e1·
dans les cellules cardiaques (VAUGHAN-JONES, 1979). Les mesures effectuées sur différents muscles lisses suggèrent un rôle prédominant de ce type d'échange (4 c1· entrant pour 3 HCQ3• extrudés) effectué par une protéine homologue de la bande III des érythrocytes (AICKIN, 1990). L'énergie permettant de faire entrer le c1· contre son gradient proviendrait de la distribution de HC03• Les cellules ML exercent un contrôle de leur pH intracellulaire serré qui engendre un gradient de HC03·, principale source d'energie de la voie de transport de cr· dans ce type cellulaire (AICKIN et BRADlNG, 1984; BRADING et•
23 AleKIN, 1990). La figure 8 illustre la relation entre l'entrée de et· et la présence de HC03·. ainsi que sa sensibilité à l'acide 4.4-diisothiocyanostilbene-2,2'-disulphonique (DIDS).i-• • • • • • : ~ - · - · · · ••••• • • ~- ••••••• •
1
1fj
1 ., 0 8..
,,,,; !! c. 6 ::> 4 2 0 1 1 1 1 1 1 1 1 1 1 0 10 20 30 40 50 60 : ... !!~~ .. c.~!.~1-. ... !Figure 8. Accumulation de 36et· par les cellules ML du vas deferens de cobaye, suite à leur déplétion en et-. En condition contrôle (e), l'échangeur laisse entrer le 36et· en extrudant les anions Heo3·_ Le taux d'accumulation de 36et· diminue considérablement lorsque le gradient de concentration de HC03• est annulé (Il), et diminue d'avantage en présence de DIDS (un inhibiteur de l'échangeur), même si les niveaux de Heo3• cytoplasmiques sont élevés (À). (Tiré de AleKIN et BRADlNG, 1984).
Les évidences en faveur de l'existence d'un échange et· / HC03• important dans les cellules MLVA suggèrent aussi l'existence d'un second mécanisme d'accwnulation cytoplasmique de ci· qui consiste en un CO-transport Na'", K. et CI-, où le gradient de Na•
fournit
l'énergie nécessaire à l'entrée de K+ et de et· (AICKIN et BRADING, 1984). Ce transport dépend de la présence de Na• extracellulaire, mais est peu affecté par l'absence de K.. La figure • 9 illustre la diminution d'accumulation de 36CJ· par des cellules ML en présence et absence de
0
ces ions. Bien que les deux voies d'accumulation du c1· aient été observées dans tous les 24 muscles lisses testés, la contribution relative de chacune varie.···-·: :···--···-···--···-···-··· ~ ., 30 (.) Ol X 0 E E 20 0 * *
Contre\ 0 K. 0 Na• 0 K·. 0 Na• Time (min)
:. ... ;
Figure 9. L'absence de Na+ extracellulaire diminue l'accumulation de 36Cl· par des cellules ML de vas deferens de cobaye, alors que l'absence de K+ extracellulaire a peu d'effet sur ce même paramètre. Toutes ces mesures ont été effectuées après avoir inhibé l'échangeur ci·
I
HC03· avec130 µM DIDS. (Tiré de AICKIN et BRADING, 1990).
Les échangeurs et transporteurs permettant l'accumulation cytoplasmique de c1· dans les cellules MLVA dépendent des gradients électrochimiques d'autres ions, dont les distributions sont elles aussi contrôlées par des transporteurs actifs. La figure 10 schématise l'action de quelques transporteurs et échangeurs impliqués dans l'homéostasie du ci- des MLVA.
0
25 ···-··· ···-···-···-··· Na+cr
K+ Na+cr
cr
cr
--- ..__~-Hco3-~ ... Cl" K+ ci-H+_----.. __ --.---- HC03-···-···Figure 10. Représentation schématique des processus de transports cellulaires de c1-. Dans les cellules ML, l'ensemble des gradients impliqués dans le transport de c1- est maintenu de façon indirect par la pompe Na+,K+ ATPase, qui n'apparaît pas sur ce diagramme. Le gradient de Na+ créé par la pompe fournit l'énergie permettant l'entrée simultanée de K+ et c1-à travers le co-transporteur Na+ ,K+ ,2ci- et est aussi à la base des mécanismes de contrôle du pH cytoplasmique, dont découle l'entrée principale de c1- dans les cellules ML V A via l'échangeur c1- I HC03-. Le résultat de ces transports et conductances est une concentration cytoplasmique de c1- d'environ 36 mM, permettant l'efflux passif de ci- par les canaux du sarcolemme. (Modifié de JENTSCH et GUNTHER, 1997).
Il résulte de l'interaction des mécanismes de transports actifs une distribution de ci-telle que le potentiel d'équilibre de cet anion (Ec1) est d'environ -30 mV. L'ouverture de voies de transport passif pour le c1- (les canaux anioniques) permet la sortie de ci- vers l'extérieur de la cellule, selon son gradient électrochimique. Cette sortie peut résulter d'une acidification de la cellule, ou être utilisée par les cellules ML pour contrôler leur volume dans le cas de changement d'osmolarité du milieu, ou pour contrôler leur potentiel membranaire. Différents types de canaux cellulaires présents dans les cellules ML V A, permettent de transporter le
•
•
26 électrophysiologiques.
2.2 Canaux sélectifs aux anions
c1-2.2. I Canaux
c1-
de la famille des CLCLes neufs canaux anioniques de cette famille sont encodés par la famille de gènes nommés CLC, pour et· Channels. Historiquement, les membres de cette famille de canaux c1·
se distinguaient des autres types connus par la modulation qu'exerce le potentiel membranaire sur leur activité. Le premier membre de la famille des CLC, désigné CLC-0, fut cloné par Jentsch et collaborateurs (JENTSCH et al., 1990) à partir de lorgane électrique de la raie
T orpedo marmorata. Les études biophysiques effectuées sur ce canal ont mesuré une
conductance unitaire d'environ 9 pS, et une sélectivité élevée pour le CL Des études de cinétique et de structure ont aussi mis en lumière une particularité de ce canal; il possède un "double barillet" (deux pores ioniques qui s'ouvrent et se fennent indépendamment un de l'autre (MIDDLETON et al., 1994). Cette caractéristique n'est pas retrouvée chez les autres membres de la famille des CLC. Typiquement, ceux-ci possèdent 12 hélices a dont 10 sont des segments transmembranaires. La figure l l illustre la topologie proposée pour la famille des canaux CLC .
27 . . . . . . . . . . . . . . . . . . ; ~ : :
l
,,,
:=:~~
. . . '
Figure 11. Modèle de topologie des canaux de la famille CLC. Deux régions de moindre hydrophobicité (04 et Dl3) sont perçues maintenant comme non-intégrales, alors que les régions D9 à D 12 doivent être transmembranaires pour permettre le passage des anions. Tiré de JENTSCH et GUNTHER, 1997).
La recherche par homologie d'autres membres de la famille des CLC a rapidement révélé le CLC-1, canal présent exclusivement dans les muscles squelettiques et activé par une dépolarisation du sarcolemme. Avec une conductance unitaire de l'ordre de 1 pS, il est responsable de la repolarisation du PA des fibres musculaires. La conductance c1- y joue un rôle tellement déterminant qu'une mutation des canaux CLC-1 a été associée à l'apparition de potentiels d'actions répétitifs suite à une stimulation unique, une condition conduisant à la myotonie congénitale décrite par Thomsen (STEINMEYER et al., 1994).
Les canaux CLC-2 et 3 ont tous les deux été observés dans les muscles lisses, bien que leur présence ait d'abord été démontré dans les neurones (KAWASAKI et al., 1994; Y AMAZAKI et al., 1998). Les deux canaux sont activés par des hyperpolarizations légères du sarcolemme, et démontrent une régulation différente des autres canaux CLC. En effet, ils sont
•
•
28
du volume cellulaire. notamment en cas de choc hypoosmotique (STRANGE et al.. 1996). L'activation du CLC-2 par un débalancement osmotique et une acidification cytoplasmique résulte en une conductance unitaire de 3 à 5 pS (PUSCH et JENTSCH, 1994 ). Cette activation est reliée à un court segment du tenninal carboxylique, d'où le modèle actuel de cinétique de type "ball and chain". où ce segment C}toplasmique se déplace pour bloquer ou dégager le pore (JENTSCH et GUNTHER. 1997). La délétion de ce segment produit des canaux ouverts de façon tonique. Les courants transportés par le CLC-3 apparaissent aussi suite à des changements osmotiques. mais l'inactivation du canal implique une phosphorylation par la PKC, suggérant une régulation distincte de celle du CLC-2 (DUAN et al., 1999). Il est remarquable que l'activité CLC-3 n'ait pu être exprimée fonctionnellement dans des systèmes hétérologues qu'avec difficulté. fait attribué à la régulation du canal par un isofonne spécifique de la PKC, et par des structures associées au cytosquelette d'actine (KAWASAKI et al., 1994).
Aussi présent dans les cellules ML V A, le CLC-4 est activé par une dépolarisation membranaire ainsi que par une acidification du cytoplasme (FRIEDRICH et al., 1999). Parce que son expression dans des systèmes hétérologues est difficile, peu d'infonnations sont disponibles sur ses propriétés électrophysiologiques (JENTSCH et al., 1995). Certains canaux
et· de la famille des CLC sont exprimés seulement dans le rein: c'est le cas des CLC-5 CLC-Ka et CLC-Kb (JENTSCH et al., 1995). Le rôle suspecté de ces canaux en est un de réabsorption
du
c1·,
mais la confirmation de cette hypothèse a été retardée par le fait que cette conductancen'a pu, à ce jour, être exprimées dans des ovocytes (KIEFERLE et al., 1994 ). Les deux derniers membres de la famille des CLC ont été découverts grâce à des recherches d'homologie; exprimés de façon ubiquitaire, les gènes clc-6 et clc-7 sont supposés encoder des canaux et·
•
•
29 présents dans les membranes intracellulaires et dont les propriétés biophysiques sont mal connues et (BRANDT et JENTSCH, 1995; BUYSE et al., 1998). Le tableau 3 résume les caractéristiques connues des canaux et· de la famille des CLC, ainsi que celles des autres types de canaux discutés plus loin .
30
•
Tableau J. Classification actuelle des canaux c1·Distribution Fonction Dépendance au Pore
tissulaire voltage
CLC-0 Organe électrique Stabilisation de Dépolarisation: Linéaire IO
de la raie Vm dans l'organe activation lente pS Cerveau. muscle et dans les Hyperpol.: Double-squelettique muscles activation rapide Barillet CLC-1 Muscle Stabilisation de Hyperpol.: Rectification
squelettique Vm dans les désactivation entrante
muscles 1 pS
CLC-2 Ubiquitaire Régulation du Hyperpol.: Linéaire volume cellulaire activation 3-5 pS
CLC-3 Cerveau, ?? Rectification
ML, Régulation du sortante
Reins volume cellulaire
CLC-4 Distribution large Balance acidique ? ?
Cerveau, rein ...
CLC-5 Épithélium rénal Transport Trans- ? ?
épithélial
CLC-6 Ubiquitaire Transport de ?
(ln trace li ulaire) contre-charges CLC-7 Ubiquitaire Transport de
(Intracellulaire) contre-charges
CLC-K Rein Concentration ?
(a& b) urinaire
CLCA Ubiquitaire Stabilisation de Activé par le Linéaire
Vm Ca2• 3-7 pS
CFTR Distribution Sécrétions de et· Régulé par Rectification variée dans les Régulation l'AMPc sortante
épithéliums d'autres canaux 5-8 pS
Ici.
Distribution large Régulation du Dépolarisation: Rectificationdans les volume cellulaire désactivation sortante mammifères Régulation
•
, ---....,·,
)
mdr-1 GARA" Distribution large dans les épithéliums Excrétion de drogues Canal post- Inhibition synaptique opéré neuronale par ligand de distribution neur-onale ubiquitaire GABA Glycine??
Niveaux de conductances multiples 10-90 pS 31Ce tableau n'est pas extensif, mais présente plutôt les caractéristiques connues des canaux CLC et des autres canaux c1· ayant fait l'objet d'études approfondies par (HIGGINS, 1995; OKADA, 1997; STRANGE et al., 1996; BRANDT et JENTSCH, 1995; FONG et al., 1998; GRUBER et al., 1999; JENTSCH et al., 1995; KLOCKE et al., 1994; OBERMULLER et al., 1998; PUSCH et al., 1997).
Contrairement à la situation observée avec les canaux K. (ADDA et al., 1996), les résultats obtenus par des méthodes de biologie moléculaire et les techniques électrophysiologiques ne se complètent pas toujours lorsqu'appliquées à l'étude des canaux Cl". Ainsi, les biologistes moléculaires ont identifiés plusieurs gènes encodant des canaux c1·, dont la majorité des membres de la famille CLC. L'impossibilité d'exprimer des canaux fonctionnels dans un système hétérologue, de même que la modulation possible d'un canal par un élément cellulaire spécifique à son environnement natif, limitent les efforts de caractérisation des canaux anioniques identifiés par les biologistes moléculaires. De plus, l'expression hétérologues des canaux introduit parfois des caractéristiques nouvelles et biaisées par le système de reconstitution utilisé (par exemple, une courbe de désactivation différente en absence de kinase ou phosphatase spécifiques, (WANG et KOTLIKOFF, l 997b ).
Des études électrophysiologiques ont pennis de mettre en lumière les caractéristiques d'un grand nombre de courants
et·,
enregistrés dans leur environnement natif. Bien définies, les•
32propriétés biochimique, biophysiques et phannacologiques des protéines sous-tendant les courants sont communément utilisées dans des expériences fonctionnelles. sans connaissances précises de l'identité génomique d'un canal particulier. L'utilisation de deux méthodes de classification -une basée sur le gène encodant le canal. l'autre sur les propriétés fonctionnelles de la protéine et du courant- a donné naissance à deux '"listes de canaux", visant les mêmes structures, mais avec des noms différents. Le meilleur exemple de dualité d'identification des canaux et· est probablement celui des CLC-2 et 3 versus les canaux sensibles aux changements de volume cellulaire et ceux participant à leur régulation. Il a été démontré (CLC-2) ou postulé (CLC-3) que les produits de deux gènes clc jouaient un rôle dans la régulation du volume cellulaire, étant activé par des variations osmotiques. Or, plusieurs études fonctionnelles ont mis en évidence les caractéristiques des canaux activés par ce genre de stimulus ( "VSOAC;
volume-sensilive, ou/Ward-rectifying anionic channef'), mais l'association des CLC-2 et CLC-3 à une de ces conductances unitaires reste à faire.
2.2.2 Canaux
c1-
activés par des changements de volume celllulaireLes canaux sensibles aux changements de volume cellulaire présentent une rectification sortante avec conductance unitaire de 40 à 50 pS à + 120m V, sont inactivés par une dépolarisation et réactivés par une hyperpolarisation. Ils sont surtout sensibles à un gonflement cellulaire tel qu' observé lors des chocs hypoosmotiques (STRANGE et al., I 996). L'activation de ces canaux dépendrait d'une altération du cytosquelette auquel sont reliés les régions dites
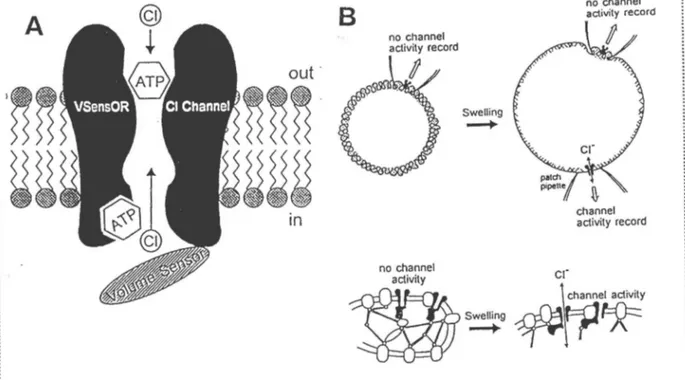
"volume sensors" du canal. Ces régions sont des points d'attaches soupçonnés du canal à des éléments du cytosquelette. La figure 12 illustre la structure proposée des ces canaux et leurs interactions avec les éléments cytoplasmiques sous-jacents, bien que certaines observations
0
33 s'opposent à de telles interactions entre canaux et cytosquelette (BOTCHKIN et MA TTHEWS,
1993). ;:···-···-···--···-···--···-···-···-·-···---···: : !
A
inB
no channel aclivity record Swelling --+-no channel activily record channel activity record no ch_a!lnel cr~s~,~rP~
:. ... .Figure 12. A: Modèle schématique de la structure du canal sensible à des variations de volume cellulaire. Ces canaux sont sensibles aux niveaux cytoplasmiques d' ATP et sont inhibés par des concentrations extracellulaires élevées de ce même nucléotide. B: Les hypothèses actuelles concernant l'interaction de la partie "volume sensor" avec le cytosquelette sont illustrées ici. Un gonflement de la cellule suite à un choc osmotique induirait une déformation du cytosquelette qui modulerait l'activité du canal. Des expériences de patch-clamp supportent un tel mode de régulation cytosquelettique du canal sensible aux changements de volume cellulaire. (Tiré de OKADA, 1997).
Un autre canal activé par des changements de volume cellulaire est le Ic1n, dont l' ADN codant a été cloné en 1992 (P AULMICHL et al., 1992). Icin démontre une conductance à rectification sortante activée par un gonflement cellulaire. Les caractéristiques biophysiques de ce canal le rendent difficile à séparer des canaux VSOAC. L'expression de Icin dans des
systèmes hétérologues et sa présence dans des types cellulaires "natifs" sont associées à
l'apparition de courants ci- activés par des changements de volume, mais sa structure particulière suggère un rôle de régulation plutôt que de pore dans ces conditions (KRAPIVrNSKY et al., 1994). Cette structure est illustrée dans la figure 13.
:···-···-···;
B
COOH Cytoso/j
COOH 1 . . ···-···-···-·-···-·-···Figure 13. Structures proposées du Ie10 , basées en A sur la séquence du peptide et en B sur les
résultats d'expériences fonctionnelles. Les cercles blancs en A formeraient l'intérieur du pore. Le canal fonctionnel tel qu'illustré en B serait un dimère. La partie carboxyle du peptide serait associée au cytosquelette. (Tiré de PAULMICHL et al., 1992).
Deux autres protéines demeurent des candidates dans la régulation du volume cellulaire: la P-glycoprotéine, produit du gène mdr-1 conférant la résistance à de multiple drogues (mufti-drug resistance, mdr), et le canal Maxi ci-. L'expression de ces deux canaux donne naissance
à des courant c1-activés par un gonflement cellulaire. Ces courants à rectification sortante de moyenne et grande amplitudes, respectivement, démontrent des propriétés biophysiques et un mode de régulation semblables à tous les canaux activés par des changement de volume cellulaire, suggérant leur implication dans ce phénomène (STRANGE et al., 1996). Les hypothèses actuelles défendent donc la présence de plusieurs canaux distincts permettant la