HAL Id: dumas-02301885
https://dumas.ccsd.cnrs.fr/dumas-02301885
Submitted on 30 Sep 2019HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de
La mesure flash du glucose, nouvel outil d’auto
surveillance du diabète, conseils à l’officine
Charlène Leblanc
To cite this version:
Charlène Leblanc. La mesure flash du glucose, nouvel outil d’auto surveillance du diabète, conseils à l’officine. Sciences du Vivant [q-bio]. 2019. �dumas-02301885�
UFR DES SCIENCES PHARMACEUTIQUES
Année 2019
Thèse n°48
Thèse présentée pour l’obtention du
DIPLOME D’ETAT DE DOCTEUR EN PHARMACIE
Présentée et soutenue publiquement par
Charlène, Marie-Pierre LEBLANC
Née le 28 décembre 1993 à Villeneuve sur Lot (47)
Le 14 Juin 2019 à Bordeaux
LA MESURE FLASH DU GLUCOSE,
NOUVEL OUTIL D’AUTOSURVEILLANCE DU DIABÈTE,
CONSEILS À L’OFFICINE.
Sous la direction du Docteur Geneviève LACAPE
Membres du jury
Mme Marine AULOIS-GRIOT Professeur des Universités Présidente
Mme Geneviève LACAPE MCU-PH Directrice
Je dédie cette thèse à celles et ceux qui partagent mon quotidien et le rendent meilleur, ainsi qu’à celles et ceux qui veillent sur nous chaque jour.
Remerciements
A Madame la Professeur Marine Aulois-Griot, merci de m’avoir fait l’honneur d’accepter la présidence du jury et de m’avoir accompagnée pendant mes études de pharmacie.
A Madame la Docteur Geneviève Lacape, merci de m’avoir accompagnée, guidée et conseillée pour la rédaction de cette thèse, pour votre attention, votre disponibilité et votre bienveillance.
A Monsieur le Docteur Romain Fontan, merci d’avoir accepté d’être membre du jury, merci pour l’aide que tu m’as apportée pendant mon stage et merci pour ton amitié.
A Monsieur Thierry Bareille et son équipe des laboratoires Abbott, merci pour votre disponibilité, les informations et documents que vous m’avez fournis pour la rédaction de cette thèse.
A toute l’équipe de la Pharmacie Demange, merci pour votre confiance, votre soutien, vos encouragements et votre bienveillance. C’est un plaisir de travailler avec vous. Je remercie également les patients avec lesquels j’ai pu échanger, pour leurs réponses et l’attention qu’ils ont portée à mon travail.
A mes parents et à ma sœur, merci pour tout ce que vous m’avez donné et appris, pour votre soutien, vos encouragements, votre patience et votre amour. Merci de m’avoir aidée à grandir, à m’épanouir et à devenir qui je suis. Quelle chance j’ai d’être si bien entourée.
A ma famille de toujours et qui s’agrandit aujourd’hui, grands-parents, oncles, tantes, cousins et cousines, merci pour toutes les joies, les peines, les larmes, les rires, les fêtes, le réconfort, les voyages, les anniversaires, la confiance et la complicité. Je vous l’ai déjà dit, je ne pouvais pas rêver mieux.
A Marin, merci pour ta confiance, ton soutien et tes encouragements indispensables pendant cette longue période de stress, c’est inestimable. Merci pour tout ce que tu m’apportes chaque jour, que notre route soit encore longue et que nos aventures continuent.
A Mélanie, Julie, Pauline, Solenn et Inès, merci d’être des amies aimantes, présentes et bienveillantes. Je suis tellement reconnaissante d’être tombée sur vous…
A mes amis et amies du lycée, de la fac, de médecine, de pharmacie et d’ailleurs, merci pour votre soutien et vos encouragements pendant la rédaction de cette thèse. Merci pour tous les bons moments que l’on a partagés, les fous rires, toutes ces journées à la BU, les repas au RU, pour toutes les soirées, les WEI, les galas, les voyages… Merci pour tous les souvenirs que l’on a créés ensemble et pour tous les moments que l’on partagera encore longtemps. Les études servent aussi à cela, rencontrer les personnes qui feront partie de votre vie et la rendront plus riche.
Aux pharmaciens bienveillants, aux équipes incroyables que j’ai rencontrés durant toutes mes études, qui m’ont beaucoup appris, qui m’ont fait confiance et qui m’ont donné confiance en moi, merci.
Je remercie également les professeurs de l’Université de Bordeaux qui transmettent leur savoir avec passion, ainsi que les membres du personnel de la scolarité de pharmacie pour leur accompagnement dans les démarches administratives et leur aide à la réalisation de nos projets.
Table des matières
Remerciements ... 3
Table des matières ... 5
Tables des figures, tableaux et illustrations ... 6
Introduction ... 7
Chapitre 1 : Physiopathologie du pancréas et diabète. ... 8
1. Fonctionnement physiologique du pancréas et diabète ... 8
a. Physiologie du pancréas endocrine et régulation de la glycémie ... 8
b. Epidémiologie ... 12
c. Diabète ... 14
2. Prévention des complications du diabète par l’ASG ... 25
a. Complications et impact des variations importantes de glycémie ... 25
b. Surveillance et prévention par l’ASG ... 33
c. Pratique de l’ASG et freins à son observance ... 35
Chapitre 2 : Alternative à la glycémie capillaire sur le marché actuel, le dispositif FreeStyle Libre® des laboratoires Abbott. ... 38
1. Les laboratoires Abbott et le dispositif FreeStyle Libre® ... 38
a. Présentation du laboratoire et mise sur le marché du FreeStyle Libre ® ... 38
b. Mesure du glucose en continu et mesure flash du glucose ... 39
2. Utilisation du dispositif par les patients ... 40
a. Pose et retrait du capteur ... 40
b. Prise de mesure et usage quotidien ... 45
c. Manipulation du logiciel ... 48
d. Gestion des déchets ... 53
3. Fonctionnement du dispositif ... 55
a. Taux de glucose interstitiel ... 55
b. Equivalence des mesures ... 57
4. Avantages, inconvénients et améliorations du dispositif ... 59
a. Avantages ... 59
b. Inconvénients ... 61
c. Les améliorations futures du FreeStyle Libre® ... 62
Chapitre 3 : L’utilisation des capteurs à l’officine, accompagnement et conseils aux patients. ... 63
1. Retour sur expérience personnelle à l’officine ... 63
a. Etudes récentes et questions posées aux patients à l’officine ... 63
b. Réponses obtenues ... 65
c. Discussions avec les patients ... 67
2. Accompagnement des patients diabétiques et utilisateurs du capteur FreeStyle Libre® par les pharmaciens d’officine. ... 69
a. Commandes, prescription, délivrance et remboursement par la sécurité sociale 69 b. Fonctionnement du capteur ... 70
c. Accompagner les patients ... 72
Conclusion ... 81
Bibliographie ... 83
Tables des figures, tableaux et illustrations
Illustration 1 : Anatomie du pancréas dans le système digestif. Page 8 Illustration 2 : Variations de la prévalence du diabète traité par rapport à la prévalence
nationale, par département, France entière, en 2016. Page 13 Illustration 3 : Kit Freestyle Libre® Abbott. Page 39 Illustration 4 : Lecteur et capteurs Freestyle Libre® Abbott. Page 39 Illustration 5 : Pose du capteur Freestyle - désinfection de la peau, ouverture du
matériel. Page 41
Illustration 6 : Pose du capteur Freestyle - assemblage capteur et applicateur. Page 42 Illustration 7 : Pose du capteur Freestyle. Page 43 Illustration 8 : Pose du capteur Freestyle - démarrage du capteur. Page 44 Illustration 9 : Lecture du taux de glucose. Page 45 Illustration 10 : Lecture du capteur - Taux de glucose hors cible. Page 46 Illustration 11 : Glycémie et cétonémie via le lecteur Freestyle Libre. Page 47 Illustration 12 : Consultation de l'historique 1. Page 48 Illustration 13 : Consultation de l'historique 2. Page 48 Illustration 14 : Consultation de l'historique 3. Page 49 Illustration 15 : Paramétrage et calcul des unités d'insuline. Page 50 Illustration 16 : Détail du calcul de la dose d'insuline. Page 50 Illustration 17 : Estimation de la quantité d'insuline résiduelle. Page 51 Illustration 18 : Différents milieux étudiés pour l'ASG. Page 55 Illustration 19 : Echanges du glucose entre les secteurs plasmatique et interstitiel. Page 56 Illustration 20 : Illustration du décalage entre les valeurs de glycémie plasmatique et de
concentration de glucose dans le compartiment interstitiel. Page 58 Figure 1 : Evolution de l'incidence des hospitalisations pour complications liées au
diabète entre 2010 et 2016. Page 14 Figure 2 : Recommandations de la HAS concernant l'ASG chez les patients diabétiques
de type 2 (2011). Page 23
Figure 3 : Modèle curviligne de l'insuline résiduelle. Page 24 Figure 4 : Schéma de la réaction d'oxydo-réduction du glucose par la glucose oxydase. Page 34 Figure 5 : Modèle curviligne de l’insuline résiduelle. Page 53 Figure 6 : Schéma de la réaction d’oxydo-réduction du glucose par la glucose -oxydase. Page 56 Tableau 1 : Les insulines. Page 22 Tableau 2 : Réponses obtenues auprès des patients à l'officine. Page 65
Introduction
Touchant 422 millions de personnes dans le monde en 2014 (1) et plus 3,3 millions de personnes en France en 2016 (2), le diabète est un problème majeur de santé publique. L’hyperglycémie causée par cette pathologie chronique et incurable entraine, lorsqu’elle n’est pas traitée correctement, de graves complications comme des comas, des accidents cardio-vasculaires, des amputations, la cécité, et, par conséquent, de nombreuses hospitalisations. Les traitements que nous avons aujourd’hui à disposition, les insulines, les antidiabétiques oraux ou autres, permettent de diminuer et stabiliser la glycémie.
Pour les patients sous insulinothérapie, la prévention des complications et la gestion de la maladie passent par une surveillance quotidienne de la glycémie que le patient effectue lui-même, on parle d’autosurveillance. Elle se réalise par prélèvement d’une petite goutte de sang au bout des doigts que l’on dépose sur une bandelette préalablement insérée dans un lecteur de glycémie. Cette action est répétée trois à quatre fois par jour par le patient diabétique.
L’autosurveillance du diabète a connu une révolution avec l’arrivée de nouvelles technologies mesurant, via des capteurs sous-cutanés, la concentration de glucose interstitiel, dispensant, de ce fait, le patient des multiples prélèvements. Ainsi, en 2014, le dispositif FreeStyle Libre® des laboratoires Abbott est arrivé sur le marché. Il est actuellement le seul appareil d’autosurveillance par mesure flash du taux de glucose interstitiel remboursé par la sécurité sociale.
Dans cette rédaction nous traiterons du diabète et de ses complications majeures à court et long terme. Nous détaillerons l’intérêt fondamental de l’autosurveillance glycémique dans la prévention des complications de la maladie mais nous expliquerons aussi qu’elles sont les limites de son observance.
Nous aborderons ensuite le sujet du dispositif FreeStyle Libre®, de son fonctionnement, de son utilisation, de ses avantages et de ses inconvénients.
Enfin, en nous appuyant sur notre expérience professionnelle et personnelle à l’officine, suite à de multiples échanges avec des patients sous capteur, nous essaierons de rédiger un guide à destination des pharmaciens d’officine. Ce guide aura pour objectif de permettre aux pharmaciens d’accompagner et de conseiller, le
Chapitre 1 : Physiopathologie du pancréas et diabète.
1. Fonctionnement physiologique du pancréas et diabète
D’après (3), (4), (5), (6), (7), (8), (9), (2), (1), (10), (11), (12), (13).
a. Physiologie du pancréas endocrine et régulation de la
glycémie
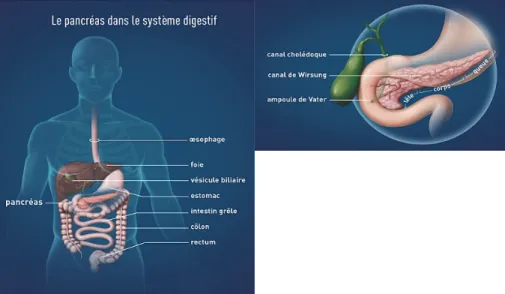
Le pancréas est un organe, de forme allongée, constitué d’une tête et d’une queue, et situé derrière l’estomac. Il s’agit d’une glande mixte, ainsi, on distingue le pancréas exocrine composé de cellules alvéolaires disposées en acini, entre lesquels on retrouve les îlots de Langerhans, constituant le pancréas endocrine. On distingue quatre grands types de cellules pancréatiques :
- les cellules qui sécrètent le glucagon, - les cellules qui sécrètent l’insuline,
- les cellules qui sécrètent la somatostatine, - les cellules F qui sécrètent le polypeptide PP.
Illustration 1 : Anatomie du pancréas dans le système digestif. D’après (3).
Le pancréas exocrine joue un rôle dans la digestion et le pancréas endocrine joue notamment un rôle dans le métabolisme des glucides, des lipides, des protéines et le maintien de la glycémie. Nous nous intéressons ici au pancréas endocrine.
L’insuline :
L’insuline est une hormone protéique, synthétisée par les cellules des îlots de Langerhans, composée de deux chaines peptiques, la chaine A composée de 21 acides aminés et la chaine B composées de 30 acides aminés, toutes deux reliées par deux ponts disulfures. Elle existe sous forme active simple et sous forme inactive de polymère. Elle circule dans le sang sous forme libre et à demi-vie très courte d’environ 6 minutes, elle est catabolisée dans le foie.
L’insuline est uniquement sécrétée par le pancréas et possède notamment trois tissus cibles importants : le foie, les muscles et le tissu adipeux. Cette hormone a de nombreux effets, dits pléiotropes, sur le métabolisme la croissance et la synthèse d’ADN et beaucoup d’autres (la prise alimentaire par exemple). Ces trois actions principales sont hypoglycémiante, lipogénique et anabolisante.
Lors d’un apport nutritionnel, la libération d‘insuline au niveau du pancréas entraine la production de sérotonine, celle-ci agit sur l’hypothalamus et déclenche l’inhibition du neurone à neuropeptide Y ce qui conduit à la diminution de la prise alimentaire. L’insuline est la seule hormone hypoglycémiante de l’organisme, son rôle est donc de diminuer la glycémie en augmentant la consommation du glucose par les tissus ou son stockage. L’action hypoglycémiante de l’insuline va se faire principalement au niveau hépatique mais aussi musculaire et neuronal. Sur le plan hépatique, l’insuline va entrainer le stockage du glucose sous forme de glycogène et inhiber la néoglucogenèse. Au niveau musculaire, la présence de l’insuline entraine l’augmentation du nombre de transporteurs musculaires du glucose GLUT4 et permet l’entrée du glucose dans les cellules musculaires soit pour le stocker et synthétiser du glycogène soit pour faire une glycolyse.
Au niveau du tissu adipeux, l’insuline exerce son action lipogénique, elle active la lipoprotéine lipase qui se trouve à la surface des adipocytes, cette enzyme permet d’hydrolyser les acides gras des triglycérides transportés par les VLDL pour les faire entrer dans les adipocytes et les stocker. Elle inhibe également la lipolyse.
L’action anabolisante de l’insuline se manifeste par l’augmentation de la synthèse protéique et l’augmentation du transport des protéines dans les muscles notamment dans les premières heures qui suivent un repas (elle permet surtout l’entrée des acides aminés). En cas d’absence d’insuline, les protéines sont utilisées comme source d’énergie et on observe une fonte musculaire rapide.
Le récepteur à l’insuline est un récepteur tyrosine-kinase sous forme dimérisée, avec deux chaines transmembranaires et deux chaines extracellulaires qui forment le site de liaison de l’hormone. La liaison de l’insuline à son récepteur a de très nombreuses conséquences: l’activation du transporteur du glucose au niveau du muscle, la lipogenèse au niveau du foie et du tissu adipeux (à forte dose), la glycogenèse dans le muscle et le foie, la synthèse protéique, l’expression de gènes, le blocage de l’apoptose, la synthèse d’ADN.
La régulation de la production d’insuline par le pancréas se fait par la glycémie, les incrétines, la somatostatine.
Après l’apport de glucides dans l’intestin suite à la prise alimentaire, on observe une augmentation de la glycémie qui va entrainer l’augmentation de la sécrétion d’insuline par le pancréas. Lorsque l’insuline a permis de stocker le glucose et diminuer la glycémie, un rétrocontrôle s’effectue et diminue la libération d’insuline. Lors de la digestion, l’intestin envoie différents signaux hormonaux afin de préparer l’arrivée du glucose dans le sang. Les hormones synthétisées sont les incrétines, elles comprennent : le GLP-1 (Glucagon Like Peptide) sécrété par l’iléon, le GIP (Glucose-dependant Insulinotropic Peptide) par le jéjunum et la CCK (Cholécystokinine) par le duodénum. Les incrétines agissent en synergie avec l’insuline dans la régulation de la glycémie, seules elles n’ont que peu d’effets. Il existe une autre régulation de l’insuline par la digestion, il s’agit du phénomène de « repas anticipé ». Lorsque l’on a faim, que l’on s’apprête à manger, notre système nerveux autonome envoie des signaux via la voie de l’acétylcholine pour engager la sécrétion d’insuline avant même que l’on ait commencé à manger. L’acétylcholine va activer en amont les cellules et anticiper la libération d’insuline. La somatostatine est une hormone inhibitrice paracrine synthétisée par le pancréas, elle se compose de 14 acides aminés. Elle a un rôle de freinage, son action inhibitrice s’exerce sur l’insuline et sur le glucagon. Elle a pour but
d’équilibrer le système insuline/glucagon et de trouver l’équilibre afin de ne pas alterner sans cesse les phases d’hypoglycémie et d’hyperglycémie. Elle prévient l’emballement du système.
Le glucagon :
Le glucagon est un petit peptide de 29 acides aminés synthétisé et sécrété par les cellules des îlots de Langerhans, il circule librement dans le sang et sa demi-vie est également très courte (environ 10 minutes).
Il s’agit d’une hormone hyperglycémiante, son rôle est de maintenir ou d’augmenter la glycémie afin de fournir l’énergie nécessaire aux tissus.
Sur le plan hépatique, la glucagon entraine la glucogenèse à partir du glycogène et la néoglucogenèse à partir d’acides aminés et de lipides.
Au niveau des adipocytes, il inhibe la synthèse et le stockage des acides gras et favorise la dégradation des triglycérides. Ainsi, les acides gras sont libérés dans le sang et peuvent rejoindre le foie où ils permettront la synthèse de glucose et de corps cétoniques.
On connaît d’autres hormones possédant une action hyperglycémiante, comme l’adrénaline ou le cortisol. L’adrénaline a une activité sur le glucagon, elle entre en action en troisième position lorsque la glycémie chute beaucoup pour augmenter la libération de glucagon. Cela explique l’élévation de la fréquence cardiaque lorsqu’un sujet est en hypoglycémie. Le cortisol a une action hyperglycémique à long terme, il est produit le matin pour augmenter la glycémie au réveil pour l’activité physique qui suit.
b. Epidémiologie
En 2014, on comptait 422 millions de personnes diabétiques dans le monde, soit 8,5% de la population adulte contre 108 millions de personnes en 1980. En 2012, on a estimé que 1,5 million de décès dans le monde étaient directement liés au diabète et 2,2 millions de décès supplémentaires ont été causés par l’hyperglycémie. On estime que près de la moitié des décès dus à l’hyperglycémie surviennent avant l’âge de 70 ans. Ces résultats reflètent l’augmentation des facteurs de risque associés au diabète tels que le surpoids et l’obésité. L’OMS
prévoit qu’en 2035, on compte 600 millions de diabétique, soit la 7ème cause de
mortalité dans le monde. Ce problème majeur de santé publique est la cible du plan d’action mondial de l’OMS 2013-2020.
Des disparités sont visibles entre les pays, la prévalence du diabète, cette dernière décennie, a augmenté beaucoup plus rapidement dans les pays à revenu faible ou intermédiaire. Il n’existe pas aujourd’hui d’estimations mondiales distinguant la prévalence du diabète de type 1 et celle du diabète de type 2. Dans la majorité des cas, le diabète de type 2 est en cause. Autrefois observé uniquement chez l’adulte, il touche désormais les enfants.
En 2016, la France comptait plus de 3,3 millions de personnes traitées pour un diabète, soit une prévalence de 5%. Cette prévalence ne cesse d’augmenter en particulier le nombre de cas de diabète de type 2, qui représente plus de 90% des cas de diabète en France. Les hommes sont davantage touchés que les femmes avec 1,8 million d’hommes versus 1,5 million de femmes. La fréquence du diabète augmente avec l’âge ; ainsi, un homme sur cinq, âgé de 70 à 85 ans, et une femme sur sept, âgée de 75 à 85 ans, sont traités pour un diabète.
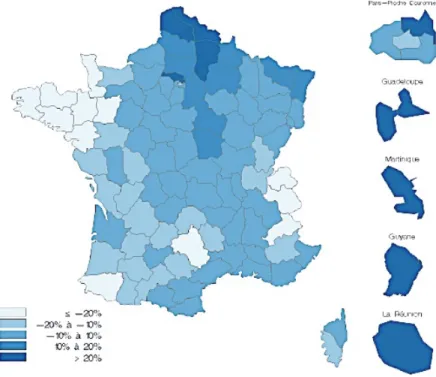
La prévalence du diabète traité connaît des disparités régionales, ainsi, la prévalence dans les départements d’Outre-mer est deux fois plus élevée que la moyenne nationale, et en métropole, elle est plus élevée dans les régions du Nord, Nord-Est et en Île de France.
Illustration 2 : Variations de la prévalence du diabète traité par rapport à la prévalence nationale, par département, France entière, en 2016. D’après (10).
D’après l’étude Entred 2007, l’excès de mortalité, toutes causes confondues, chez les hommes (+34%) et les femmes (+51%) diabétiques est plus élevé, par rapport à la population générale.
Entre 2002 et 2011, une étude réalisée avec 8427 personnes, a estimé la surmortalité des personnes diabétiques sur une période de 10 ans. Sur les 10 ans de l’étude, 35% des patients sont décédés, à l’âge médian de 77 ans pour les hommes et 82 ans pour les femmes. Les principales causes de décès étaient des maladies cardiovasculaires (30%) et des cancers (26%), notamment de la vessie ou leucémie chez les hommes et cancer du l’utérus chez les femmes. Les hommes et les femmes diabétiques ont un excès de mortalité significativement élevé par rapport à la population générale pour les maladies cardiovasculaires et rénales ainsi que pour certaines localisations de cancers tels que le pancréas, le foie et le colon-rectum.
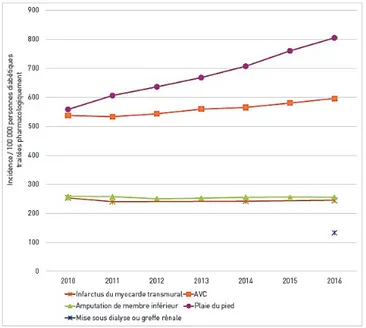
Le diabète et ses complications sont à l’origine de nombreuses hospitalisations. En 2016, en France, parmi les personnes traitées pour un diabète, plus de 8 100
plus de 8 400 personnes pour une amputation du membre inférieur, et plus de 4 400 personnes pour une mise sous dialyse ou un greffe rénale. Entre 2010 et 2016, on note des taux d’incidence des complications du diabète stables, excepté pour les AVC et les plaies du pied dont la fréquence augmente.
Figure 1 : Evolution de l'incidence des hospitalisations pour complications liées au diabète entre 2010 et 2016. D’après (10).
c. Diabète
Lorsque l’on parle de diabète sucré, on parle en réalité d’un groupe de maladies métaboliques caractérisées par une hyperglycémie chronique qui résulte, soit d’un défaut de sécrétion d’insuline, soit d’un défaut d’action de l’insuline (insulinorésistance), soit des deux anomalies associées.
Le diabète est une maladie hétérogène, multifactorielle dans laquelle peuvent intervenir des facteurs génétiques et environnementaux. Le diagnostic d’un diabète doit donc prendre en compte l’âge de l’individu, son poids, la répartition des graisses et le périmètre abdominal, la cétonurie, l’existence d’une hérédité familiale du diabète, l’existence d’antécédents familiaux de maladies auto-immunes, l’hypertension artérielle, l’hyperlipémie dont une hypertriglycéridémie, l’existence d’antécédents de diabète gestationnel ou d’accouchement d’un enfant de plus de quatre kilogrammes (macrosomie), la prise de médicaments potentiellement diabétogènes tels que les corticoïdes.
On compte quatre types de diabètes, le diabète de type 1, le diabète de type 2, le diabète gestationnel et les autres types de diabètes.
Diabète de type 1 :
Le diabète de type 1 est caractérisé par une destruction progressive des
cellules des îlots de Langerhans conduisant à une insulinopénie. L’hyperglycémie se révèle lorsque 90% des cellules sont détruites. Il peut être auto-immun (Ia) ou idiopathique (Ib).
Le diabète de type I auto-immun est une forme qui représente 3 à 10% des diabétiques, il implique des facteurs pré-génétiques disposants auxquels sont associés des facteurs déclenchant et le développement d’un processus auto-immun. Les prédispositions génétiques concernent une dizaine de gènes dont le principal se situe sur le chromosome 6 au niveau du système HLA de classe II, il contribue pour environ 85% au risque familial de développer un diabète. Les facteurs environnementaux impliqués dans l’initiation de la réaction auto-immune sont certains virus comme le CMV, le virus de la rubéole, des oreillons, l’alimentation comme l’introduction précoce du lait de vache ou la présence de nitrites dans l’eau, etc. La présence de ces facteurs environnementaux certainement impliqués a pu être mise en évidence par le fait que 50% des jumeaux homozygotes ne sont pas concordants pour le diabète de type 1. Le processus auto-immun débute 5 à 10 ans voire plus avant le début du diabète. La destruction des cellules est essentiellement due à une infiltration de lymphocytes T helper CD4 et T cytotoxiques CD8 dans les îlots de Langerhans. Des anticorps dirigés contres des antigènes hépatiques sont alors produits tels que les Ac anti-îlots, les Ac anti-insuline chez l’enfant, les Ac anti-GAD (glutamate acide décarboxylase), les Ac anti-IA2 (dirigés contre une phosphatase membranaire des cellules ).
La destruction des cellules des îlots de Langerhans entraine une insuffisance en insuline ce qui conduit à une lipolyse et une cétogenèse accrues pour fournir l’énergie nécessaire au métabolisme cellulaire.
Les conséquences cliniques de la carence en insuline sont multiples :
- le glucose ne peut plus pénétrer les cellules consommatrices et la glycémie augmente rapidement à 3-4 g/L,
- la déshydratation, conséquence de la polyurie, conduit à l’augmentation de la soif afin de compenser les pertes, donc à une polydipsie,
- le seuil de réabsorption rénal du glucose est dépassé (< 10 mmol/L) provoquant une glycosurie,
- le défaut d’apport de glucose intracellulaire, ce qui se traduit par une polyphagie, - la carence relative en glucose entraine lipolyse et amaigrissement, et la formation des corps cétoniques qui elle entraine une cétonémie et une cétonurie,
- les acides cétoniques totalement ionisés au pH plasmatique entrainent une acidose.
Ainsi, le début d’une forme typique de diabète de type 1 est très brutal, associé à un syndrome cardinal composé de polyurie et polydipsie, polyphagie, amaigrissement rapide et massif, et une cétonurie franche associée à une glycosurie.
Le diabète de type 1 touche généralement le sujet jeune, avant 20 ans avec un pic à 12 ans et mince. Il peut également être retrouvé chez des patients adultes plus âgés (à 40 ans par exemple), on parle alors de LADA (Latent Automimmune Diabetes in Adults). Dans cette forme adulte du diabète de type 1, la phase de pré-diabète est très longue et la maladie déclenchée tard. Le pré-diabète de type 1 peut être associé à d’autres maladies auto-immunes.
Diabète de type 2 :
Le diabète de type 2 est une pathologie hétérogène due à une anomalie métabolique fondamentale, l’insulinorésistance. Elle évolue en deux temps, d’abord elle commence par une résistance à l’action de l’insuline prédominante au début de la maladie puis elle évolue vers un déficit insulino-sécrétoire avec résistance à l’action de l’insuline.
L’insulinorésistance est essentiellement musculaire, elle est secondaire à un excès de graisse au niveau des muscles et des tissus adipeux, donc favorisée par l’obésité à répartition abdominale et la sédentarité. L’organisme va alors compenser le manque d’action de l’insuline en augmentant sa sécrétion. Cette phase peut durer plus de 10 ans, elle est asymptomatique et la tolérance au glucose reste normale.
Suit une seconde phase d’insulinodéficience relative puis absolue, due à un dysfonctionnement de la fonction pancréatique et de sa dégradation progressive.
Cela entraine une insulinopénie, concomitante à une diminution de la tolérance au glucose. On passe donc à un état pré-diabétique avec diminution de la sécrétion d’insuline et augmentation de la glycémie à jeun.
La défaillance du contrôle de la glycémie serait génétiquement programmée et secondairement aggravée par le mode de vie.
Dans la majorité des cas, la maladie est asymptomatique, le diagnostic est retardé, souvent fortuit, et dans 20% des cas accompagné d’une complication du diabète. Ainsi, les recommandations sont de dépister toute personne présentant un ou plusieurs des critères suivants :
- surpoids (IMC < 25 kg/m2),
- marqueurs des syndromes métaboliques : répartition androïde des graisses, troubles de la glycorégulation, dyslipidémie,
- sédentarité,
- antécédents familiaux de premier degré,
- antécédent de diabète gestationnel ou d’enfant présentant une macrosomie (poids de naissance supérieur à quatre kilogrammes),
- syndrome des ovaires polykystiques, - origines non caucasiennes.
En l’absence de ces critères, à partir de 45 ans, un dépistage doit être systématique tous les 3 ans.
Diabète gestationnel :
Le diabète gestationnel se définit comme une intolérance au glucose de sévérité
variable apparue ou diagnostiquée pendant la grossesse. Le dépistage est
capital car il existe une relation entre l’hyperglycémie maternelle et la morbidité fœto-maternelle avec un risque important de macrosomie, de complications post-natales de type hypoglycémie, hypocalcémie, polyglobulie. De plus, les femmes ayant un diabète gestationnel sont à risque de développer un diabète de type 2 dans les années qui suivent.
Physiologiquement, la grossesse est une situation d’accélération métabolique avec deux périodes successives :
l’organisme maternel devient très sensible à l’action de l’insuline. Ainsi, durant cette phase, la femme enceinte a une tendance à l’hypoglycémie en particulier la nuit et au réveil.
- Une seconde phase, catabolique, durant laquelle la croissance fœtale est très importante et prélève l’énergie stockée au début de la grossesse. On observe à ce moment un phénomène d’insulinorésistance de l’organisme maternel par rapport à ses propres tissus. La mère épargne son glucose afin de le réserver pour son fœtus. Par conséquent, il y a une diminution de la tolérance au glucose et une tendance à l’hyperglycémie.
La résistance au glucose se met en place progressivement au cours de la grossesse et est réversible après l’accouchement.
Si la fonction pancréatique de la mère est normale, l’organisme diminue l’hyperglycémie par un hyperinsulinisme réactionnel ce qui permet de maintenir la glycémie dans la fourchette de la normalité. En revanche, si la fonction pancréatique est altérée, la sécrétion d’insuline sera insuffisante et induira un diabète gestationnel.
Le diabète gestationnel est donc une situation d’insulinorésistance non compensée par un hyperinsulinisme réactionnel.
Le dépistage se fait chez les femmes « à risque » présentant un ou plusieurs des facteurs de risque tels que le surpoids, l’obésité, les antécédents personnels (au premier degré) de diabète de type 2, l’âge supérieur à 35 ans, le contexte de macrosomie lors d’une précédente grossesse.
Dans la majorité des cas, le diabète gestationnel est réversible après l’accouchement, un nouveau dépistage sera fait 6 à 12 semaines après l’accouchement, si celui-ci est négatif, on renouvellera les analyses tous les 3 ans.
Les autres types de diabètes :
Il existe de nombreux autres types de diabète que nous ne développerons pas ici. Nous pouvons cependant les citer. Certains diabètes sont dus à des défauts génétiques de la fonction des cellules tels que le diabète MODY (Maturity Onset Diabetes of the Young) ou le diabète mitochondrial ; d’autres sont dus à un défaut de l’action de l’insuline. D’autres encore sont appelés diabètes pancréatiques et peuvent être observés dans le cas de pancréatites chroniques, d’une pancréatectomie, d’un cancer du pancréas, d’une hémochromatose ou encore
d’une mucoviscidose. Certains diabètes sont une conséquence d’endocrinopathies telles que l’acromégalie, le syndrome de Cushing, le glucagonome, les phéochromocytomes, les somatostatinomes, etc. Enfin, il existe des diabètes iatrogènes pouvant être induits notamment par les corticoïdes, les sympathicomimétiques, les diurétiques hypokaliémiants (thiazidiques), les progestatifs de synthèse ou encore les anti-protéases utilisés dans le traitement du VIH.
Diagnostic biologique et surveillance :
La glycémie est le taux de glucose retrouvé dans le sang. Cette mesure, lorsqu’elle est faite à jeun, permet à elle seule de poser le diagnostic du diabète. Chez un individu sain, la glycémie à jeun se situe entre 0,70 et 1,00 g/L ou 3,90 et 5,50 mmol/L et la glycémie post-prandiale est inférieure à 1,40 g/L ou 7,80 mmol/L. La glycosurie est le taux de glucose retrouvé dans les urines. Chez un individu sain, elle est nulle car le seuil de réabsorption rénale du glucose est de 10 mmol/L, lorsque l’on est en hyperglycémie (>10mmol/L), le seuil est dépassé et on retrouve alors du glucose dans les urines. La glycosurie n’a aucune utilité dans le diagnostic du diabète.
Le diagnostic du diabète peut être posé de différentes manières, cependant, la méthode de référence est la mesure de la glycémie à jeun, vérifiée à deux reprises, au laboratoire sur ponction veineuse. Une glycémie à jeun comprise entre 5,6 et 6,9 mmol/L soit entre 1 et 1,25 g/L signe un état de pré-diabète, en revanche si elle est supérieure à 7 mmol/L ou 1,26 g/L on est déjà au stade de diabète.
Dans certains cas, le diagnostic peut tout aussi bien être posé lorsqu’un sujet présente les signes cardinaux de la maladie et que l’on mesure une glycémie supérieure à 2g/L ou 11 mmol/L à tout moment de la journée.
Le diagnostic du diabète gestationnel est plus particulier. En effet, dans un premier temps, en début de grossesse, une glycémie à jeun est effectuée afin de déceler
(surpoids, l’obésité, antécédents personnels de diabète de type 2, âge supérieur à 35 ans, contexte de macrosomie lors d’une précédente grossesse) entre la 24ème
et la 28ème semaine d’aménorrhée. Le dépistage se fait par un prélèvement veineux
à jeun et suite à une hyperglycémie provoquée par voie orale : la patiente boit une solution contenant 75g de glucose et on mesure sa glycémie 1h et 2h après l’ingestion. On parle de diabète gestationnel si un ou plusieurs des critères suivants sont retrouvés :
- une glycémie à jeun supérieure ou égale à 0,92 g/L, - une glycémie à 1h supérieure ou égale à 1,8 g/L, - une glycémie à 2h supérieure ou égale à 1,53 g/L.
La surveillance de l’équilibre glycémique du patient diabétique se fait essentiellement par le contrôle du paramètre de l’hémoglobine glyquée HbA1c. Il s’agit de molécules de glucose se fixant, par phénomène passif de glycation, sur les protéines. L’intensité de la glycation dépend de la glycémie et de la durée de vie de la protéine. La concentration de la protéine ayant subit la glycation reflète l’équilibre glycémique et constitue une forme de « mémoire glycémique ».
Ainsi, la protéine la plus utilisée est l’hémoglobine A1c, HbA1c, car elle est la plus abondante, a une faible variabilité inter-individuelle et une longue durée de vie de 120 jours (cela correspond à la durée de vie d’un érythrocyte). L’analyse de l’HbA1c permet d’avoir un reflet de la glycémie sur les 3 derniers mois. Chez un individu sain, elle se situe aux alentours de 5,5%, chez un patient diabétique, elle dépasse les 6,5%. L’objectif donné aux patients diabétiques, en général, est une HbA1c inférieure à 7% (les recommandations dépendent du profil du patient).
Cette technique est très couteuse et est réservée, en France, selon les recommandations de la HAS (Haute Autorité de Santé), à la surveillance de la maladie (aux Etats-Unis, elle est utilisée dans le diagnostic du diabète).
Traitements médicamenteux du diabète :
Le diabète de type 1 est traité par les insulines et analogues de l’insuline qui sont des médicaments injectables, conditionnés en stylos pré-remplis, cartouches ou flacons. Les injections d’insuline servent à reproduire et à se rapprocher au mieux de la sécrétion physiologique par le pancréas. Les insulines et analogues rapides servent à couvrir les besoins prandiaux, ils sont injectés avant un repas. Les
insulines et analogues lents servent, eux, à couvrir les besoins basaux en insuline. Le schéma suivi traditionnellement pour une insulinothérapie est le schéma Gold standard dit basal-bolus, il consiste en une (ou deux) injections d’insuline à longue durée d’action et à trois injections d’insuline d’action rapide avant les principaux repas. Les différents types d’insuline sont classés en fonction de leur rapidité et leur durée d’action.
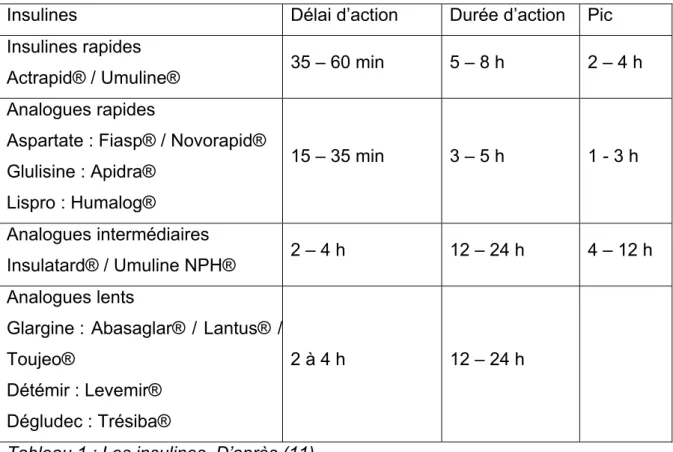
Les insulines rapides ont un début d’action à 35 – 60 minutes et une durée d’action de 5 à 8h, on note un pic entre 2 et 4 heures après l’injection. C’est le cas de l’Actrapid® ou de l’Umuline® rapide par exemple.
Les analogues rapides de l’insuline ont un début d’action à 15 – 35 minutes et une durée d’action de 3 à 5 heures. On observe un pic entre 1 et 3 heures après l’injection. Parmi ces analogues, on distingue : l’insuline aspartate, comme la Fiasp® ou la Novorapid®, l’insuline glulisine comme l’Apidra® et l’insuline lispro comme l’Humalog®.
Les insulines d’action intermédiaires ont, comme leur nom l’indique, une durée d’action intermédiaire, ce sont des insulines isophanes ou NPH (Neutre Protamine Hagedorn). Leur début d’action est entre 2 et 4 heures après l’injection avec un pic entre 4 et 12h et une durée d’action de 12 à 24h. Dans cette catégorie, on peut citer l’Insulatard® et l’Umuline NPH®.
Les analogues lents de l’insuline sont de différents types : l’insuline glargine, l’insuline détémir et l’insuline dégludec.
L’insuline glargine a un début d’action 2 à 4 heures après l’injection, une durée d’action de 24 heures et nécessite une seule administration par jour. On peut citer l’Abasaglar®, la Lantus® ou la Toujeo®. L’insuline détémir (Levemir®) a une durée d’action qui varie selon la dose administrée, elle couvre entre 12 et 24h donc elle peut être eadministré une ou deux fois par jour. L’insuline dégludec (Tresiba®) s’administre une seule fois par jour comme la glargine.
Les insulines prémélangées résultent d’un mélange en proportions variées d’insuline (ou analogue) rapide et d’insuline isophane. Dans la dénomination du médicament on ne cite que l’insuline ou l’analogue rapide. La Mixtard® et l’Umuline profil® contiennent de l’insuline rapide, la Novomix® contient de l’insuline aspartate, l’Humalog mix® contient de la lispro.
Insulines Délai d’action Durée d’action Pic Insulines rapides
Actrapid® / Umuline® 35 – 60 min 5 – 8 h 2 – 4 h
Analogues rapides
Aspartate : Fiasp® / Novorapid® Glulisine : Apidra® Lispro : Humalog® 15 – 35 min 3 – 5 h 1 - 3 h Analogues intermédiaires Insulatard® / Umuline NPH® 2 – 4 h 12 – 24 h 4 – 12 h Analogues lents
Glargine : Abasaglar® / Lantus® / Toujeo®
Détémir : Levemir® Dégludec : Trésiba®
2 à 4 h 12 – 24 h
Tableau 1 : Les insulines. D’après (11).
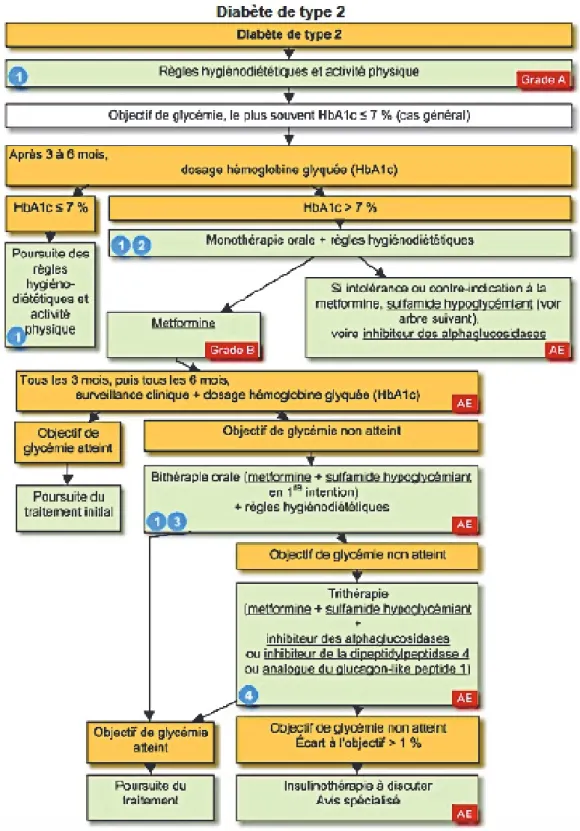
Le diabète de type 2 est traité en première intention par les antidiabétiques oraux ou injectables, il en existe différentes familles.
Par voie orale, nous avons : la metformine, les sulfamides hypoglycémiants, les glinides, les inhibiteurs de l’alphaglucosidase, les gliptines. En injectable, on retrouve les incrétinomimétiques,
La metformine (biguanide) agit en améliorant l’utilisation cellulaire du glucose et en inhibant la néoglucogenèse. Le glibenclamide, le gliclazide, le glimépiride et le glipizide, des sulfamides hypoglycémiants, induisent eux une insulinosécrétion. Les glinides comme le répaglinide sont des insulinosécréteurs non sulfamidés, ils induisent aussi une insulinosécrétion. L’acarbose est un inhibiteur des alphaglucosidases, il agit en diminuant la dégradation intestinale des glucides complexes pour diminuer leur absorption. Les gliptines ou inhibiteurs de la DPP4 (dipeptidylpeptidase 4), à savoir : la saxagliptine, la sitagliptine et la vildagliptine, augmentent le taux des incrétines qui stimulent la sécrétion d’insuline et diminuent la sécrétion de glucagon.
Les incrétinomimétiques (liraglutide, dulaglutide, exénatide) ou analogues du GLP-1 (glucagon-like peptide GLP-1) augmentent la sécrétion d’insuline par les cellules béta-pancréatiques de manière glucose-dépendante, ralentissent la vidange gastrique et diminuent la sécrétion de glucagon.
Dans la stratégie thérapeutique mise en place pour un diabète de type 2, les insulines n’arrivent qu’en dernière intention.
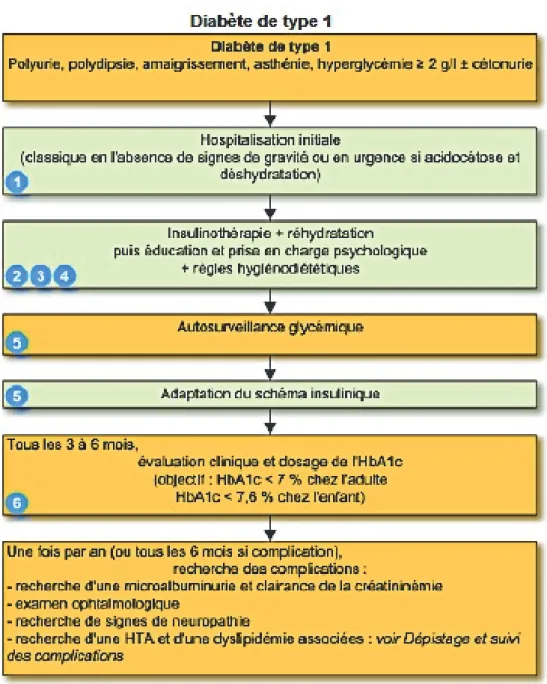
Figure 2 : Résumé des étapes de prise en charge d'un patient diabétique de type 1. D'après (11).
Figure 3 : Résumé de la prise en charge d'un patient diabétique de type 2. D'après (12)
2. Prévention des complications du diabète par l’ASG
D’après (7), (14), (15), (16), (17), (18), (19), (20), (21), (22), (23).
a. Complications et impact des variations importantes de
glycémie
Complications aigües du diabète, les comas :
Parmi les complications aigües du diabète, on retrouve notamment les comas qui correspondent à une souffrance du système nerveux central. On compte quatre types de comas plus ou moins fréquents avec des pronostics plus ou moins défavorables. Par ordre de fréquence nous avons : le plus fréquent, le coma
hypoglycémique puis les comas hyperglycémiques tels que les comas
acidocétosiques, hyperosmolaires et les comas par acidose lactique.
Il s’agit de situations d’urgence dans lesquelles il faut rapidement identifier le type de coma pour adapter au mieux la thérapeutique.
Le coma hypoglycémique est la conséquence d’un déséquilibre entre les apports alimentaires et le traitement hypoglycémiant. L’hypoglycémie entraine l’augmentation du débit vasculaire cérébral afin d’apporter la quantité suffisante d’oxygène et de glucose au cerveau. Cela déclenche une réaction adrénergique de compensation se manifestant par des sueurs, une pâleur et des angoisses. Ces trois signes sont annonciateurs du coma hypoglycémique.
Lorsque les réserves de sucre sont épuisées, le coma s’installe progressivement. Si le patient n’est pas pris en charge et que l’hypoglycémie perdure, les séquelles engendrées au niveau cérébral seront irréversibles.
Ce type de coma apparaît le plus souvent chez le diabétique de type 1 lorsque la dose d’insuline injectée et les apports glucidiques alimentaires ne correspondent pas à l’activité physique ou à la consommation d’alcool. Cependant, le patient diabétique de type 2, polymédiqué et traité par sulfamides hypoglycémiants à longue durée d’action peut également tomber dans ce type de coma. Les
hypoglycémique. Parmi les médicaments et substances qui potentialisent l’effet des sulfamides hypoglycémiants, on retrouve les salicylés, les AVK (anti-vitamine K), les autres sulfamides ou encore l’alcool.
Les signes d’alerte sont fonction du degré de l’hypoglycémie, plus elle est prononcée, plus les troubles vont être délétères.
Les premiers signes sont des troubles visuels, de l’humeur et du langage nécessitant un auto-sucrage et une éducation de l’entourage du patient.
Si la glycémie est inférieure à 3 mmol/L soit environ 0,5 g/L, on observe des signes adrénergiques : sueur, pâleur, palpitation et angoisse.
Si la glycémie est inférieure à 2 mmol/L soit environ 0,35 g/L, on observera des troubles de la conscience, des convulsions, un coma brutal et agité.
Concernant les signes biologiques associés au coma hypoglycémique, on va retrouver une hypoglycémie qui peut être déterminée par prélèvement capillaire, le pH et les bicarbonates sont normaux, pas de trouble de l’équilibre acido-basique, absence de glycosurie et de cétonurie.
Le coma acidocétosique est un coma hyperglycémique compliquant le plus souvent un diabète de type 1. On retrouve une acidose métabolique et la présence de corps cétoniques dans le sang et les urines.
L’hyperglycémie entraine une hyperosmolarité extracellulaire ayant pour conséquence une déshydratation intracellulaire et une hypervolémie. L’hypervolémie va provoquer l’augmentation du débit de filtration glomérulaire à laquelle s’ajoute le dépassement du seuil de réabsorption rénal du glucose. Cela se traduit par une glycosurie associée à une diurèse osmotique d’où une polyurie qui, elle, va entrainer une perte hydrique, donc une hypovolémie et une déshydratation extracellulaire. La déshydratation extracellulaire entraine à son tour une augmentation de l’hématocrite et des protides totaux. La conséquence est une diminution du débit de filtration glomérulaire se traduisant par une insuffisance rénale fonctionnelle qui majore l’hyperglycémie.
La carence intracellulaire en glucose nécessite de trouver d’autres sources d’énergie, l’organisme met en place un catabolisme des lipides et des protéines musculaires.
Elle augmente le catabolisme lipidique à l’origine de l’acidocétose avec cétonémie et cétonurie. L’accumulation des corps cétoniques (acides forts) entraine : des troubles digestifs tels que diarrhées, vomissements majorant la déshydratation et l’acidose métabolique. L’acidose métabolique est d’abord partiellement compensée par une hyperventilation et la diminution de la pression artérielle en CO2. L’hypercatabolisme des protéines musculaires conduit à une augmentation de l’urée et de la créatinine qui s’accumule à cause de l’insuffisance rénale fonctionnelle.
Le coma acidocétosique peut être provoqué lors :
- d’une carence en insuline dans le cas d’un arrêt de traitement (par exemple lorsque le patient vomit, donc considère qu’il n’a pas mangé et ne s’injecte pas d’insuline), d’une erreur de posologie, d’une obstruction de la pompe à insuline ; - d’une augmentation des besoins en insuline dans le cas d’une période d’infection, de maladie sous-jacente, de stress, d’un traumatisme, d’une chirurgie, d’une grossesse, d’un traitement par corticothérapie.
A propos des signes cliniques, au début, on observe une accentuation des signes du diabète avec le syndrome cardinal : polyurie, polydipsie, polyphagie, asthénie. En l’absence de traitement, le coma s’installe progressivement en plusieurs heures voire plusieurs jours avec une phase de pré-coma durant laquelle on notera une asthénie, des vomissements et douleurs abdominales, un amaigrissement, une haleine cétosique, des signes de la déshydratation :
- extracellulaire avec une peau sèche, fripée avec des plis cutanés, la diminution de la tension artérielle, l’accélération du pouls ;
- et intracellulaire avec une sècheresse des muqueuses donc de la bouche avec une sensation de soif.
Suit la phase de coma, calme, profond avec une dyspnée d’acidose de Küssmaul (respiration bruyante en quatre temps).
Les signes biologiques associés comprennent une hyperglycémie supérieure à 2,5 g/L, une glycosurie et une cétonurie importantes ainsi qu’une perturbation de l’équilibre acido-basique avec une acidose métabolique par augmentation des
Le coma hyperosmolaire est également hyperglycémique, il est moins fréquent mais plus grave que le coma acidocétosique.
On observe une hyperglycémie très importante, supérieure à 6 g/L, une déshydratation massive, une hyperosmolarité plasmatique (supérieure à 350 mOsm/L) et l’absence de cétose. Ce coma touche surtout les sujets âgés, atteints d’un diabète de type 2, déshydratés et polymédiqués.
Le scénario sera le même que lors d’un coma acidocétosique, la différence est que le sujet âgé a une sensation de soif très diminuée, donc il ne va pas boire pour compenser un minimum les pertes hydriques dues à la polyurie. Ainsi, cela va aggraver l’insuffisance rénale fonctionnelle, accentuer l’hyperglycémie et induire une hyperosmolarité. A la différence du coma acidocétosique, les diabétiques de type 2 présentent un taux résiduel d’insuline qui ne permet pas de compenser l’hyperglycémie mais qui va inhiber la lipolyse d’où l’absence de cétose.
On observe donc un patient dans un coma conscient au début puis profond, une déshydratation globale : extracellulaire avec la peau sèche et fripée, la diminution de la tension artérielle et l’accélération du pouls, et intracellulaire avec une sècheresse de la bouche et une sensation de soif moins prononcée. On n’observe pas de polypnée, ni d’odeur cétosique. La fièvre et les troubles digestifs associés vont favoriser cet état.
Les signes biologiques retrouvés comptent un hyperosmolarité plasmatique toujours supérieure à 350 mOsm/L, une hyperglycémie supérieure à 6 g/L, une glycosurie très importante, urémie et créatininémie augmentées, pH et bicarbonates normaux. L’augmentation de l’hématocrite, des protides totaux et du sodium qui signe la déshydratation.
Enfin, coma le plus rare avec le pronostic le plus défavorable : le coma avec
acidose lactique. Il apparaît chez les sujets âgés de plus de 70 ans à
prédominance féminine généralement traités par des antidiabétiques oraux type biguanides (inhibent la néoglucogenèse). Toujours très grave, ce coma est caractérisé par un état métabolique d’acidose par accumulation d’acide lactique. L’hyperproduction d’acide lactique est une réponse à l’hypoxie cellulaire due à l’insuffisance cardiaque ou respiratoire. Normalement l’acide lactique passe au
niveau de la circulation, entre dans la voie de la néoglucogenèse au niveau hépatique où il est converti en pyruvate puis en glucose.
Le problème se pose lorsque cette hyperproduction d’acide lactique est associée à un blocage de la néoglucogenèse, par insuffisance hépatocellulaire, intoxication alcoolique ou traitement par biguanides, ou à un défaut d’élimination par insuffisance rénale, ou à une association des deux. Cela conduit à une accumulation d’acide lactique à l’origine d’une acidose métabolique.
Lors de ce type de coma on observe un début brutal, agité et d’aggravation rapide, une polypnée pour compenser l’acidose métabolique et des douleurs musculaires, des crampes dues à l’accumulation d’acide lactique.
Les signes biologiques retrouvés sont une hyperglycémie modérée, une lactatémie supérieure à 7 mmol/L (soit sept fois la normale), un pH et des bicarbonates diminués.
Complications chroniques du diabète :
Les complications chroniques du diabète apparaissent après quelques années et dépendent de la gestion de l’équilibre glycémique du patient. En effet, l’hyperglycémie, en plus des risques aigus de coma, est responsable de complications au niveau de la paroi des vaisseaux. On peut diviser les
complications en deux grandes catégories : les macroangiopathies et les
microangiopathies.
Les complications de la microangiopathie concernent les diabétiques de type 1 et 2. L’altération des petits vaisseaux est une complication caractéristique du diabète et de l’hyperglycémie chronique. Parmi les microangiopathies, on compte la rétinopathie, la neuropathie et la néphropathie.
La rétinopathie est une atteinte des vaisseaux capillaires rétiniens. Il s’agit, en général, de la première complication chronique à apparaître. Elle est retrouvée dans 50% des cas après 15 ans d’évolution et plus de 75% des cas après 20 ans. En France, le diabète est la première cause de cécité, avec 6000 personnes
La rétinopathie se développe à bas bruit. Initialement, des lésions mineures, sans conséquences fonctionnelles et sans symptôme apparent, peuvent être repérées au fond d’œil. Elles évoluent ensuite par la mise en place d’une zone d’ischémie et d’exsudats étendus. La baisse de l’acuité visuelle témoigne de lésions avancées (atteinte de la macula) et la prolifération de capillaires rétiniens en réponse à l’ischémie entraine des conséquences plus graves pouvant mener à la cécité. L’hypertension artérielle est un facteur aggravant de la rétinopathie diabétique. Ainsi, en plus de s’efforcer de maintenir un équilibre glycémique le meilleur possible, une surveillance annuelle par un fond d’œil doit être systématique afin de dépister cette complication le plus tôt possible.
La néphropathie est une microangiopathie touchant le glomérule rénal, on parle de glomérulosclérose diabétique. Il s’agit de la lésion rénale la plus spécifique du diabète, elle affecte les propriétés de filtrage des glomérules rénaux.
Elle touche 30 % des diabétiques de type 1 après 35 ans de diabète. En France, la prévalence des diabétiques parmi les personnes hémodialysées est évaluée à au moins 20%.
Elle se caractérise par une protéinurie, une hypertension artérielle, un déclin rapide de la filtration glomérulaire et une augmentation de la créatininémie.
Elle peut être dépistée par le dosage de la microalbuminurie : lorsque la microalbuminurie est entre 3 et 30 mg d’albumine/mmol de créatinine (ou 30 à 300 mg d’albumine/24h) sans être détectable par bandelette urinaire, une réversibilité est possible par contrôle de la glycémie, le contrôle de la tension artérielle et la limitation des apports protéiques alimentaires. En revanche, si elle est détectable par bandelette urinaire, des lésions irréversibles sont déjà présentes. Seul le contrôle parfait de la tension artérielle peut ralentir l’évolution vers l’insuffisance rénale, dont les derniers stades nécessitent dialyse et greffe rénale.
Les neuropathies peuvent être isolées ou associées à la rétinopathie et glomérulopathie (on parle de triopathie « œil-pied-rein). Elle touche les nerfs périphériques et les nerfs du système nerveux autonome. L’hyperglycémie est, une fois de plus, le facteur causal auquel peuvent s’ajouter d’autres facteurs susceptibles d’aggraver tels que l’âge, l’alcoolisme, la grande taille, etc. Ces microangiopathies sont dues à la glucotoxicité sur les vasa nervorum. La
neuropathie diabétique se présente chez la plupart des diabétiques de type 1 après 20 ans d’évolution.
Concernant les atteintes périphériques, 80 à 85% des neuropathies diabétiques sont appelées polyneuropathies. Elles se localisent aux extrémités distales « en chaussette », « en gant » ou plus rarement au niveau thoraco-abdominal. Ces neuropathies sensitives se manifestent par des douleurs exacerbées la nuit, avec des sensations (continues ou fulgurantes) d’écrasement ou de brûlures, des paresthésies et dysesthésies (fourmillement, démangeaisons, sensation de froid ou de chaud).
La conséquence fréquente de la neuropathie sensitive est le « pied diabétique ». En effet, la neuropathie entraine une hypoesthésie, ainsi, le patient ne ressentira plus la douleur, signe d’alerte très important qui assure une protection contre les ampoules, les brûlures, les durillons, les ongles mal taillés etc. Les troubles trophiques, résultant de la perte de sensibilité aux extrémités, associées à l’absence de perception des traumatismes exposent à de graves complications comme la déformation de l’architecture osseuse du pied et mal perforant avec des complications infectieuses profondes. Le pied insensible devient une porte d’entrée aux plaies chroniques et le risque est d’autant aggravé par la présence d’une artérite des membres inférieurs.
De plus, la neuropathie entraine une hyperkératose responsable du « mal perforant plantaire ». L’hyperkératose forme des durillons sous les points d’appui plantaires qui vont former des petites pierres dures, blessant le tissu sous-cutané et provoquant la formation de petites poches hydriques. Le liquide, sous tension lors des appuis, dissèque les tissus et forme une chambre de décollement. L’ensemble sèche, se fendille et ouvre la porte à la surinfection, formant un abcès sous-cutané. L’abcès peut toucher l’os, les parties molles ou s’ouvrir à la peau, d’où le terme de mal perforant.
Ces plaies chroniques nécessitent des soins infirmiers quotidiens, sur une très longue période, la décharge du pied pour éviter les appuis, la mise sous antibiothérapie si nécessaire. Associé à l’artériopathie des membres inférieurs, le mal perforant pris en charge trop tardivement peut aboutir à l’amputation d’une partie du pied.
des troubles sexuels, une diminution de la perception des signes de l’hypoglycémie. L’amélioration de l’équilibre glycémique reste le principal traitement de ces manifestations.
La macroangiopathie diabétique entraine des complications cardio-vasculaires, elle touche les vaisseaux de moyen et gros calibre allant de l’aorte aux petites artères distales.
L’athérosclérose (notamment l’ischémie coronarienne) est devenue la principale
cause de décès des diabétiques, avant les comas et les complications infectieuses. Les complications de la microangiopathie sont dues uniquement à l’hyperglycémie mais ce n’est pas le cas pour les complications de la macroangiopathie, l’hyperglycémie intervient en potentialisant les autres facteurs de risques cardiovasculaires tels que l’âge, l’hypertension artérielle, l’hypercholestérolémie et le tabagisme. Le risque de macroangiopathie augmente, cependant, avec le degré d’hyperglycémie chronique. Ainsi, on note une augmentation d’environ 12% du risque d’infarctus du myocarde pour chaque point supplémentaire d’HbA1c. De plus, le risque d’AVC est 1,6 fois plus élevé pour un diabétique que pour un individu sain.
Une conséquence importante de l’athérosclérose diabétique est l’artériopathie oblitérante des membres inférieurs (AOMI). Le patient diabétique a un risque dix fois plus élevé que le reste de la population de développer une AOMI. Il s’agit d’une affection généralement douloureuse, se manifestant par une claudication intermittente. Toutefois, chez le diabétique, elle est souvent associée à la neuropathie qui la rend fréquemment indolore et retarde beaucoup le diagnostic. Le dernier stade de cette pathologie comprend une détérioration de l’état de la jambe avec des ulcérations et une gangrène nécessitant l’amputation.
Les complications chroniques du diabète sont donc causées par l’hyperglycémie chronique et la prévalence de ces complications augmente avec la présence de facteurs de risque cardiovasculaires.
La prévention passe par le maintien correct de l’équilibre glycémique, de manière quotidienne avec l’autosurveillance glycémique (ASG) et la surveillance du respect des objectifs d’HbA1c réalisée tous les 3 mois.
Le dépistage des complications doit être systématiquement réalisé une fois par an au minimum, avec une surveillance de la fonction rénale (microalbuminurie, créatininémie, calcul de la clairance rénale), la recherche de facteurs de risque cardiovasculaires (bilan lipidique, ECG et contrôle de la tension artérielle) et la réalisation d’un fond d’œil chez un ophtalmologue.
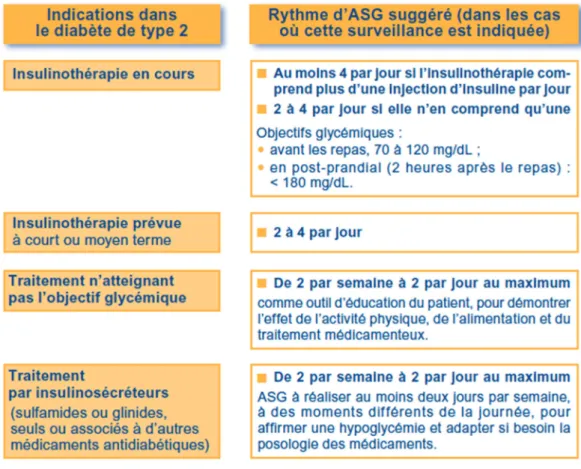
b. Surveillance et prévention par l’ASG
L’autosurveillance glycémique (ASG) est le principe selon lequel le patient diabétique contrôle lui-même sa glycémie, à son domicile. Elle est réalisée à l’aide d’un dispositif comprenant un lecteur de glycémie avec des bandelettes et des lancettes, si on mesure la glycémie capillaire, ou des capteurs sous-cutanés, si on mesure la concentration de glucose interstitiel (on parle alors plus précisément d’autosurveillance du diabète ou autocontrôle du glucose interstitiel).
Traditionnellement, on utilise des lancettes et bandelettes : le patient se pique le bout du doigt avec la lancette et extrait une petite goutte de sang qu’il va déposer sur une bandelette préalablement insérée dans le lecteur. La goutte de sang va remonter par capillarité dans la bandelette et quelques secondes plus tard, le lecteur affiche la glycémie (en général en g/L). Dernièrement, ont été mis sur le marché, les capteurs FreeStyle Libre® qui s’implantent en sous-cutané et sont lus en scannant par le lecteur qui affiche le taux de glucose équivalent à la glycémie. L’intérêt de l’ASG est double, il permet d’une part de détecter rapidement une hypo ou une hyperglycémie, et d’autre part, d’améliorer l’équilibre glycémique et l’observance des traitements lorsqu’elle est intégrée dans une démarche thérapeutique. Le maintien de l’équilibre glycémique est primordial dans la prise en charge d’un patient diabétique car c’est un paramètre qui, lorsqu’il est maitrisé, peut éviter et retarder les complications de la maladie.
Il est important que l’ASG soit systématique et pluriquotidienne chez un diabétique de type 1 et seulement limitée à certains patients, selon la situation clinique, diabétiques de type 2. Elle s’inscrit toujours dans une démarche d’éducation du
stress pour le patient, qui, dans ce cas, ne peut pas intervenir pour changer la situation.
L’ASG dépend, plus que du type de diabète, du traitement que suit le patient. En effet, si le patient est sous insulinothérapie intensive, il est nécessaire de réaliser au minimum quatre ASG par jour : avant chaque repas et avant de se coucher ; soit avant chaque injection d’insuline. Le patient suit une éducation, auprès de personnel formé qui va lui expliquer toutes les bonnes pratiques d’ASG, en passant par l’hygiène et la gestion des déchets. Il va aussi apprendre à interpréter les résultats et agir en conséquence.
Ainsi, tous les patients diabétiques de type 1, obligatoirement traités par insulinothérapie, doivent effectuer ce schéma d’ASG, tout comme certains patients diabétiques de type 2 qui peuvent également être traités par insulinothérapie intensifiée.
La pratique ASG varie en fonction du type de diabète et les objectifs attendus ne sont pas les mêmes en fonction des situations cliniques.
Figure 4 : Recommandations de la HAS concernant l'ASG chez les patients diabétiques de type 2 (2011). D’après (23).
c. Pratique de l’ASG et freins à son observance
Peu d’études ont été réalisées en France concernant la pratique de l’ASG chez les patients diabétiques. La dernière en date a été réalisée en 2014 par B. Guerci et al, et avant elle, l’étude Entred 2001-2002. A presque 10 ans d’écart, les deux études démontrent que l’ASG n’est, en général, toujours pas une pratique réalisée conformément aux recommandations.
L’enquête nationale de 2014, publiée en 2017 dans le journal Santé Publique et réalisée auprès de 449 patients diabétiques, a mis en évidence que parmi les 85 patients diabétiques de type 1 sous insulinothérapie, seuls 29,8% des patients pratiquent l’ASG telle qu’elle leur a été recommandée. Et parmi les 121 patients diabétiques de type 2, également sous insuline à plusieurs injections par jour, seuls 36,4% suivent l’ASG chaque jour de la semaine telle qu’elle a été prescrite. On note, dans cette étude, que l’observance de l’ASG s’améliore avec la diminution de nombre d’ASG à réaliser chaque jour ou chaque semaine.
Concernant la qualité de la mesure, les patients se montraient plutôt observants sur le lavage des mains avant chaque prélèvement, l’utilisation d’une nouvelle lancette à chaque nouvelle ASG et l’attention portée à la taille de la goutte de sang. En revanche, ils portaient beaucoup moins d’attention à la vérification de la date de péremption des bandelettes.
L’autonomie et la connaissance des patients ont également été évaluées. Dans 88,4 à 93,2% des cas selon les groupes, le patient déclarait réaliser seul son ASG, dans le reste des cas, il était assisté d’un proche ou d’une infirmière. On n’observe quasiment aucune différence entre les patients qui ont tous reçus une formation et une explication sur la manière de réaliser l’ASG. En revanche, les objectifs glycémiques à jeun et d’HbA1c étaient loin d’être connus par tous : 68,6 à 81% des patients connaissent leurs objectifs de glycémie à jeun et 70,4% des patients diabétiques de type 1 contre 44,9 à 49,7% des diabétiques de type 2 sous insuline connaissent leurs objectifs d’HbA1c.
l’utilisation du lecteur et l’obtention de résultats discordants. Peu de patients disaient appréhender la piqûre nécessaire pour la glycémie. On relève cependant un résultat de 15% des patients dans le groupe des diabétiques de type 2 sous glinides ou sulfamides et 16% dans le groupe des diabétiques de type 2 sous insuline basal-bolus. Quant à l’impact sur la vie quotidienne, il a été jugé important par 20% des patients diabétiques de type 1 même si en moyenne sur l’ensemble des patients ayant répondu à l’étude il atteint seulement 10%. Entre 85,7 et 98,8% des patients réalisaient l’acte d’autosurveillance sans gêne devant leur famille mais ce pourcentage chute quand il s’agit de le réaliser devant les amis (41,9 à 56,3%) et encore plus devant les collègues de travail (16,9 à 24,4%).
Les freins à l’observance de l’autosurveillance glycémique sont multiples et s’ajoutent les uns aux autres. Le poids de se piquer le bout des doigts au minimum 3 à 4 fois par jour, sans compter les multiples injections d’insuline, chaque jour de sa vie est très lourd à porter. Les chiffres des études le montrent, puisque plus le nombre d’ASG à réaliser par jour ou par semaine diminue, plus les patients respectent les recommandations. Entrent également en compte les croyances personnelles et les ressentis émotionnels des patients, leviers motivationnels très complexes, qui même chez des patients parfaitement éduqués, entrainent un manque de motivation et de confiance en soi.
L’accumulation des contraintes liées à l’ASG (douleur, perte de sensibilité, répétition de l’action, attention constante nécessaire, interprétation des résultats, attention portée à la nourriture et aux boissons, etc) entraine une lassitude palpable chez les patients, en particulier pour les diabétiques de type 1 généralement diagnostiqués jeunes, devant se contrôler quatre à cinq fois fois par jour quoiqu’ils fassent et où qu’ils soient.
L’exposition en tant que personne malade devant les amis ou les collègues de travail est également un poids considérable, tant pour ceux qui choisissent de l’assumer, que pour ceux qui préfèrent le cacher et s’isoler pour se contrôler et s’injecter l’insuline.
Ainsi, l’innovation apportée par la mesure flash du glucose interstitiel est une alternative révolutionnaire pour les patients dont le quotidien est rythmé par la surveillance de leur diabète.
Chapitre 2 : Alternative à la glycémie capillaire sur le
marché actuel, le dispositif FreeStyle Libre® des
laboratoires Abbott.
1. Les laboratoires Abbott et le dispositif FreeStyle Libre®
D’après (24), (25), (26), (27), (28), (29), (30), (31).
a. Présentation du laboratoire et mise sur le marché du
FreeStyle Libre ®
Les laboratoires Abbott ont vu le jour en 1888, dans l’arrière boutique de la pharmacie du Dr Wallace C. Abbott, à Chicago, où le médecin entreprit la production de granules médicinaux « alcaloïdes » à partir de plantes. Il créa, en 1894, l’entreprise Abbott Alkaloidal Compagny, il s’agit alors de la première maison d’édition médicale et d’un laboratoire fabricant de médicaments. L’évolution de la compagnie est rapide, dès 1907, elle s’étend au delà des frontières américaines avec l’ouverture d’un bureau à Londres. Dans les années 1920, le laboratoire s’investit dans la recherche et la production d’une longue série d’anesthésiques qui se soldera en 1935 par l’introduction du Pentothal, l’anesthésique principalement utilisé dans le monde à cette période. En 1964, le laboratoire, par l’acquisition de
M&R Dietetics, devient leader sur le marché de la nutrition. Par la suite Abbott se
développera dans le domaine de l’analyse, du diagnostic et de l’immunologie, nous pouvons notamment citer en 2002 l’approbation par la FDA de l’Humira®, premier anticorps monoclonal humain. En 2006, la firme lance le stent à libération de principe actif Xience V® ; en 2013, elle crée, à partir de son ancienne activité pharmaceutique brevetée, le laboratoire AbbVie. Aujourd’hui, Abbott est présidé par Miles D. White (depuis 1999), compte 99 000 employés à travers plus de 150 pays dans le monde.
Quant au dispositif Freestyle Libre®, technologie Flash d’autosurveillance du glucose en continu, qui nous intéresse ici, il sera lancé en 2014.