ETUDE D'ASSOCIATION ENTRE DES POLYMORPHISMES DU GENE DU RECEPTEUR DE LEUKEMIA INHIBITORY FACTOR ET
LA DENSITE OSSEUSE CHEZ LES FEMMES CANADIENNES FRANÇAISES.
Mémoire présenté
à la Faculté des études supérieures et postdoctorales de l'Université Laval dans le cadre du programme de maîtrise en Biologie cellulaire et moléculaire
pour l'obtention du grade de Maître es sciences (M.Sc.)
Département de Biologie moléculaire, biochimie médicale et pathologie Faculté de Médecine
Université Laval Québec
2012
L'ostéoporose a une forte composante génétique et est caractérisée par une faible densité osseuse. Le récepteur de LIF (LIFR) a un rôle dans la régulation du métabolisme osseux. Le but de cette étude est d'étudier les associations de 3 single nucleotide polymorphisms (SNP) de LIFR (s 1043, s 1045 et s 1046) et différentes mesures osseuses chez des femmes canadiennes françaises. Fous les génotypes ont été déterminés avec une méthode PCR allèle-spécifique. Les SNPs étaient testés par ANCOVA incluant les principaux facteurs environnementaux confondants. Les haplotypes ont été testés. Nous avons trouvé qu'au niveau des vertèbres chez les femmes préménopausées s 1045 (homozygote rare, C/C) était associé avec une densité osseuse élevée (p=0,036) et s 1046 (homozygote rare, T/T) était associé avec une densité osseuse faible (p=0,047).Un haplotype (C-A-A) était associé avec une densité osseuse au talon faible. Ces résultats suggèrent que des variants de LIFR pourraient contribuer à la régulation génétique du métabolisme osseux.
Il
Avant- propos
J'aimerais remercier les gens qui m'ont aidée à cheminer tout le long de ma maitrise et à la réussir avec succès. Je voudrais d'abord remercier les professionnels de recherche Guy Cardinal et Sylvie Giroux qui m'ont soutenue tant au niveau technique que théorique. Je voudrais aussi remercier l'assistante de recherche en statistique, Latifa Elfassihi, qui a eu la patience de répondre à toutes mes questions au niveau statistique. J'aimerais aussi remercier tous les membres du laboratoire du Dr François Rousseau, une très belle équipe toujours prête à s'entraider.
J'aimerais aussi remercier mon directeur de recherche, le Dr François Rousseau qui m'a permis d'intégrer son laboratoire et ainsi de m'initier avec le monde nouveau et fascinant de la génétique humaine. Je le remercie de m'avoir offert un projet motivant et plein de possibilités.
J'aimerais finalement remercier mes parents Diane et Donal qui ont mis toute leur énergie pour m'inculquer de bonnes valeurs et me donner le goût de la réussite. Leur soutient inconditionnel m'a permis de m'accomplir pleinement lors de ma maitrise et dans la vie de tous les jours.
Table des Matières
RESUME I AVANT-PROPOS II
TABLE DES ILLUSTRATIONS VI LISTE DES TABLEAUX Vffl LISTE DES ABREVIATIONS ET DES SYMBOLES IX
1. INTRODUCTION i
1.1 : INTRODUCTION GENERALE A L'OSTEOPOROSE 1
1.1.1 : DEFINITION DE L'OSTÉOPOROSE 1 1.1.2 : DIAGNOSTIC DE L'OSTÉOPOROSE 1 1.1.3 : LES DIFFERENTES MÉTHODES DE MESURE DE LA DENSITE OSSEUSE UTILISEES POUR LE DIAGNOSTIC ET LA
RECHERCHE CLINIQUE 3
1.1.3.1 : L'absorptiométrie biphotonique à rayon X : DXA 3
1.1.3.2 : L'ultrason quantitatif : QUS. 3
1.1.4 : L'INCIDENCE DE LA MALADIE 4 1.1.5 : L'IMPACT ECONOMIQUE 5 1.1.6 : LA MORTALITE CHEZ LES VICTIMES DE FRACTURES OSTEOPOROTIQUES 5
1.2 : LES FACTEURS DE RISQUE IMPLIQUES DE L'OSTEOPOROSE 6
1.2.1 : L'AGE 6 1.2.2 : LE GENRE 6 1.2.3 : LA RACE 7
1.2.4 : L A MASSE CORPORELLE 8 1.2.5 : LA CIGARETTE, L'ALCOOL ET LA CAFEINE 8
1.2.6 : L'ACTIVITE SPORTIVE ET LA NUTRITION 9
1.3 : LE METABOLISME OSSEUX ET LES VARIATIONS DE LA DENSITE OSSEUSE 10
1.3.1 : L'HOMEOSTASIE OSSEUSE 10
1.3.1.1 : Les ostéoblastes 10 1.3.1.2 : Les ostéoclastes 10
1.3.2 : LE MODELAGE ET LE REMANIEMENT OSSEUX 11 1.3.3 : LES VARIATIONS DE LA DENSITE OSSEUSE AU COURS DE LA VIE 11
1.3.4 : LA MENOPAUSE ET LE VIEILLISSEMENT : LES CONSEQUENCES SUR LE REMANIEMENT OSSEUX 12
1.4 : LA GENETIQUE DE L'OSTEOPOROSE ET L'IDENTIFICATION DE GENES IMPLIQUES
DANS L'OSTEOPOROSE 13
1.4.1 : LA GENETIQUE ET L'HEREDITE DELA DENSITE OSSEUSE ET DE L'OSTEOPOROSE 13 1.4.2 : LES DIFFERENTES APPROCHES POUR IDENTIFIER LES GENES IMPLIQUES DANS LA REGULATION DE LA
DENSITE OSSEUSE 14 1.4.2.1 1.4.2.3 1.4.2.4 1.4.2.5 1.4.2.6
Les études de liaison 14 Les études d'association 14 Les études d'association et les études de liaison : le cas des maladies complexes 15
Les avantages des études d'association avec gène candidat. 16 Les désavantages des études d'association avec gène candidat 17
1.4.3 : LES GENES CANDIDATS IMPLIQUES DANS LA PHYSIOPATHOLOGIE DE L'OSTEOPOROSE 18
1.5: LEUKEMIA INHIBITORY FACTOR RECEPTOR (LIFR) 21
1.5.1 : LA STRUCTURE GÉNOMIQUE ET PROTÉIQUE DE LIFR 21 1.5.2 : LE ROLE ET L'EXPRESSION DANS LES TISSUS DE LIFR. 24
IV
1.5.3.1 : LIFR est exprimé dans les ostéoblastes et les ostéoclastes 25 1.5.3.2 : La famille des cytokines de type 1 est importante dans la régulation du métabolisme osseux 26
1.5.3.3 : LIFR médie la réponse cellulaire de LIF et OSM, deux cytokines importantes dans la régulation
du métabolisme osseux 26 1.5.3.4 : Les souris déficientes en LIFR présentent des anomalies structurales et biologiques du squelette.
27
1.5.3.5 : Les estrogènes augmentent le niveau d'expression de LIFR 27 1.5.3.6 : Des variants de LIFR sont impliqués dans le syndrome Stùve-Wiedmenn /Schwartz-Jampel (SWS)
type 2 28 1.6 : LES POLYMORPHISMES ET LES PRINCIPES GENERAUX DU GENOTYPAGE 28
1.6.1 : LES VARIATIONS DANS LE GENOME ET LES « SINGLE NUCLEOTIDE POLYMORPHISMS» 28
1.6.1.1 : Les haplotypes 29
1.6.2 : LES DIFFERENTES TECHNOLOGIES DE GENOTYPAGE DES S N P S 3 0 1.6.3 : LES ERREURS DE GÉNOTYPAGE ET LES ETUDES D'ASSOCIATION 31
1.7 : OBJECTIFS DE TRAVAIL 32
2 : MATERIEL ET METHODES 33
2.1 : RECRUTEMENT ET POPULATION ETUDIEE 33 2.2 : CRITERES D'INCLUSION ET D'EXCLUSION 33
2.3 : MESURES DE DENSITE OSSEUSE 33 2.4 : TRAITEMENT DE L'INFORMATION DES QUESTIONNAIRES, DES MESURES OSSEUSES ET
GESTION DES ECHANTILLONS DE SANG 34 2.5 : EXTRACTION D'ADN GENOMIQUE 35
2.5.1 : PREPARATION DES SOLUTIONS D'ADN POUR LE GENOTYPAGE 35
2.6 : SELECTION DES POLYMORPHISMES INTERESSANTS A GENOTYPER 35 2.7 : GENOTYPAGE DES POLYMORPHISMES A L'AIDE DE LA METHODE D'AMPLIFICATION
D'ADN ALLELE-SPECIFIQUE : PCR-ASO 36
2.7.1 : RESUME DE LA METHODE DE GENOTYPAGE PAR AMPLIFICATION D'ADN ALLELE-SPECIFIQUE :
PCR-ASO 36 2.7.2 :« DESIGN » DES AMORCES 37
2.7.3 : VALIDATION DES SNPs ET OPTIMISATION DES CONDITIONS PCR POUR L'AMPLIFICATION
ALLÈLE-SPÉCIFIQUE DE L'ADN 40
2.7.3.1 : Description des réactifs utilisés pour la méthode d'amplification d'ADN allèle-spécifique par
PCR 41 2.7.3.2 : Détermination des conditions PCR optimales à l'aide d'un gradient de température 41
2.7.3.3 : Validation et optimisation des conditions PCR préliminaires établies lors de l'étape de mise au
point par gradient de température 43
2.1 A : GÉNOTYPAGE DE RS31 10234 (S1043), DE RS2071237 ( S 1 0 4 5 ) ET RS1562137 (sl046) DANS NOTRE
COHORTE DE FEMMES 44
2.7.4.1 : Assurance qualité des génotypes et détermination du taux d'erreurs et de rejet de la méthode... 46
2.8 : ANALYSES STATISTIQUES 46
2.8.1 : STATISTIQUE DESCRIPTIVE DE LA COHORTE 46 2.8.2 : TEST DE HARDY WEINBERG ET CALCUL DE LA FREQUENCE DES SNPs DANS LA POPULATION ET DU
DESEQUILIBRE DE LIAISON ENTRE CHAQUE PAIRE DE S N P S 4 6 2.8.3 : ASSOCIATION ENTRE LES MESURES DE DENSITÉ OSSEUSE ET LES TROIS POLYMORPHISMES INDIVIDUELS.
47
2.8.3.1 : Test exact de permutations 48
2.8.4 : ASSOCIATION ENTRE LES MESURES DE DENSITÉ OSSEUSE ET LES HAPLOTYPES FORMES PAR LES S N P S
S1043S1045ETS1046 48
3 : RESULTATS 50
3.3 : FREQUENCE GENOTYPIQUE ET ALLELIQUE DE S1043, S1045 ET S1046 DANS LA POPULATION ETUDIEE DE FEMMES D'ORIGINE CANADIENNE FRANÇAISE ET TEST
D'EQUILIBRE DE HARDY-WEINBERG 52 3.4 : CALCUL DES MESURES STANDARD DE DESEQUILD3RE DE LIAISON, SOIT LE |D'| DE
LEWONTIN ET LE COEFFICIENT DE CORRELATION 53 3.5 : ASSOCIATION ENTRE LES DIFFERENTES MESURES OSSEUSES (BUA, SOS, STIFF L2L4 ET
COL) ET LES POLYMORPHISMES S1043, S1045 ET S1046 54
3.5.1 :S1043 55 3.5.2 :S1045 56 3.5.3 :sl046 61
3.6 ASSOCIATION ENTRE LES DIFFERENTES MESURES OSSEUSES (BUA, SOS, STIFF, L2L4 ET
COL) ET LES HAPLOTYPES FORMES PAR LES SNPS S1043 S1045 ET S1046 66
3.6.1 : FREQUENCE ESTIMÉE DES HAPLOTYPES FORMES PAR LES SNPs S1043, S1045 ET S1046 DANS LA
POPULATION ÉTUDIÉE DE FEMMES D'ORIGINE CANADIENNE FRANÇAISE 6 6 3.6.2 : ASSOCIATION ENTRE LES MESURES OSSEUSES ET LES DIFFÉRENTS HAPLOTYPES FORMES PAR S1045,
S 1 0 4 6 E T S 1 0 4 3 67
3.6.2.1 : Association entre les cinq mesures osseuses et les différents haplotypes chez les femmes
préménopausées 67 3.6.2.2 : Association entre les cinq mesures osseuses et les différents haplotypes chez les femmes
postménopausèes 70
4 : DISCUSSION 72
4.1 : MISE EN CONTEXTE ET OBJECTIF DE NOTRE ETUDE 72
4.2 : CHOIX DE LA POPULATION ETUDIEE 72
4.3 : CHOIX DU GENE CANDIDAT 73 4.4 : CHOIX DES POLYMORPHISMES (SNPS) INTERESSANTS A ETUDIER 74
4.5 : VALIDATION DES POLYMORPHISMES DANS LA POPULATION ETUDIEE 74 4.6 : FREQUENCES DES POLYMORPHISMES DANS LA POPULATION A L'ETUDE 75
4.7 : ERREURS DE GENOTYPAGE ET QUALITE DES GENOTYPES 77 4.8 : CHOIX DES METHODES D'ANALYSES STATISTIQUES 77 4.9 : ANALYSE D'ASSOCIATION ENTRE LES DIFFERENTES MESURES OSSEUSES ET LES
TROIS POLYMORPHISMES S1043, S1045 ET S1046 78
4.9.1 : S1043 : AUCUNE ASSOCIATION 78 4.9.2 : S1045 ET S1046 : DEUX ASSOCIATIONS SIGNIFICATIVES 79
4.10 : ANALYSE D'ASSOCIATION ENTRE LES DIFFERENTES MESURES OSSEUSES ET LES
HAPLOTYPES FORME PAR LES POLYMORPHISMES S1043, S1045 ET S1046 84
5 : CONCLUSION ET PERSPECTIVES 86
VI
Table des illustrations
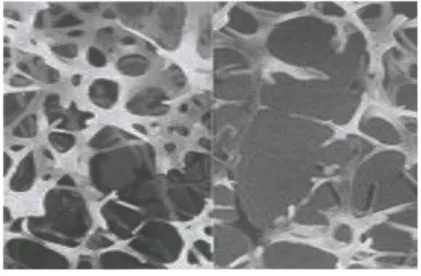
Figure 1 : Tissu osseux d'une personne saine (gauche) et d'une personne touchée par l'ostéoporose (droite), caractérisée par une faible densité osseuse et des défauts
architecturaux 1 Figure 2: Distribution de la densité osseuse minérale chez les femmes en bonne santé de 30 à
40 ans et classification du statut ostéoporotique défini par l'OMS. [9] 2 Figure 3: Nombre de fractures annuelles du col fémoral répertoriées au Canada entre 1981 et
1995 chez les individus de plus de 50 ans [20] 5 Figure 4 : Variation de la masse osseuse au cours de la vie d'un individu. [74] 12
Figure 5 : Position génomique de LIFR, structure génique de l'ARN messager de LIFR et
structure protéique de LIFR 21 Figure 6 : Structure protéique de LIFR et de son corécepteur Gpl30, ainsi que les
mécanismes de la réponse cellulaire via la voie Jak-STAT 23 Figure 7: Les différents complexes de récepteurs utilisant la protéine LIFR pour médier la
réponse cellulaire des protéines LIF, CNTF, OSM et CT-1 24 Figure 8 : Description de 4 méthodes standards de génotypage : hybridation, ligation,
extension d'ADN et enzyme de restriction 31 Figure 9 : Résumé de la méthode de génotypage par amplification d'ADN allèle-spécifique
par PCR 39 Figure 10: Graphique Excel des résultats des signaux de fluorescence en fonction de la
température d'amplification utilisée pour déterminer la tempéramre d'appariement
idéale 42 Figure 11: Graphique Excel utilisé pour la validation et l'optimisation des conditions PCR
préliminaires effectué avec 16 ADN différents 44 Figure 12: Mesures standards de déséquilibre de liaison D' de Lewontin et le coefficient de
corrélation r pour chacune des trois paires de polymorphismes possibles 54 Figure 13: Moyennes de la densité osseuse de la colonne vertébrale (L2L4) chez les femmes
préménopausées homozygotes rares et des femmes homozygotes fréquents et hétérozygotes regroupées associées avec le polymorphisme S1045 à -210pb du site d'initiation de la transcription (G/C) dans la cohorte 1, la cohorte 2 et la cohorte totale. 60 Figure 14: Moyennes de la densité osseuse de la colonne vertébrale (L2L4) chez les femmes
préménopausées homozygotes rares et des femmes homozygotes fréquents et hétérozygotes regroupées associées avec le polymorphisme s 1046 de la cohorte 1, de la
Figure 15: Fréquence estimée des haplotypes à l'aide de l'algorithme EM (% ± ET) dans la population étudiée à partir de 2200 femmes préménopausées et postménopausées de la
cohorte 1 64 Figure 16 : Scores statistiques calculés pour chacun des 6 haplotype testés à l'aide du modèle
statistique Haplo.Score pour chacune des cinq mesures de densité osseuse chez les femmes préménopausées de la cohorte 1 ainsi que la valeur p global et les valeurs p
spécifiques à chaque haplotype 67 Figure 17: Scores statistiques calculés pour chacun des 6 haplotypes testés à l'aide du
modèle statistique Haplo.Score pour chacune des cinq mesures de densité osseuse chez les femmes postménopausées de la cohorte 1 ainsi que la valeur p globale et les valeurs
V I I I
Liste des tableaux
Tableau 1: Gènes candidats de l'ostéoporose et la densité osseuse 19 Tableau 2: Caractéristiques des 12 polymorphismes sélectionnés dans la base de données
publique de NCBI 36 Tableau 3 : Séquences des amorces communes et spécifiques pour chacun des 12
polymorphismes sélectionnés initialement utilisés pour les étapes de mise au point et de
génotypage 40 Tableau 4: Description de la séquence des amorces, de la température d'appariement des
amorces et du nombre de cycles PCR en fonction de l'allèle et du polymorphisme à
génotyper 43 Tableau 5 : Caractéristiques physiques, histoire menstruelle, style de vie et moyennes des 5
mesures osseuses chez les femmes préménopausées et postménopausées dans la cohorte
1 et la cohorte 2 séparément 51 Tableau 6 : Fréquences génotypiques et alléliques de sl043, sl045 et sl046 chez les femmes
postménopausées et préménopausées confondues ainsi que les chi carré et la valeur p des
tests de Hardy-Weinberg 53 Tableau 7 : Moyenne de mesures osseuses (moyenne ± ET) ajustées pour les principaux
facteurs confondants en fonction des génotypes de s 1043 ainsi que la valeur p des sommes de carrés de type III de l'analyse de covariance (ANCOVA) chez les femmes
préménopausées et postménopausées de la cohorte 1 56 Tableau 8 : Moyenne des mesures osseuses (moyenne ± ET) ajustée pour les principaux
facteurs confondants en fonction des génotypes de s 1045 ainsi que la valeur p observée dans une analyse de covariance chez les femmes préménopausées et postménopausées de
la cohorte 1 et chez les femmes préménopausées de la cohorte 2 59 Tableau 9: Moyennes de la densité osseuse de la colonne vertébrale (L2L4) chez les femmes
préménopausées homozygotes rares et des femmes homozygotes fréquents et hétérozygotes regroupées, associées avec le polymorphisme S1045 (G/C) dans lai cohorte 1, la cohorte 2 et la
cohorte totale et des tests de permutations 60 Tableau 10: Moyenne des mesures osseuses (moyenne ± ET) ajustée pour les principaux
facteurs confondants en fonction des génotypes de s 1046 ainsi que la valeur p de FANCOVA chez les femmes préménopausées et postménopausées de la cohorte 1 et de
la cohorte 2 64 Tableau 11: Moyennes de la densité osseuse de la colonne vertébrale (L2L4) chez les
femmes préménopausées homozygotes rares et des femmes homozygotes fréquents et hétérozygotes regroupées associées avec le polymorphisme s 1046, ainsi que le résultat
Liste des abréviations et des symboles
Abréviations A : Adenosine
A/A, A/B et B/B : Homozygote fréquent, hétérozygote, homozygote rare ADN : Acide désoxyribonucléique
ANCOVA : Analyse de covariance ANOVA : Analyse de variance AP2 : Facteur de transcription AP2 APOE : Apolipoprotein E
ARN : Acide ribonucléique
ASO : Oligonucleotide allèle-spécifique ATP : Adenosine triphosphate
BUA : Broadband ulatrasound attenuation BMP4 : Bone morphogenetic protein 4 BMP6 : Bone morphogenetic protein 6 BNP : Brain natriuretic peptide
C : Cytosine
CBD : Cytokine binding domain CNTF : Facteur neurotrophique ciliaire COL 1A1 : Collagène 1A1
COMT : Catechol O-methyltransferase CT-1 : Cardiotrophine I
CTR : Récepteur de cardiotrophine I CYP17 : Cytochrome P450 17 CYP19 : Cytochrome P450 19
D' : Mesure standard de déséquilibre de liaison de Lewontin
|D'| : Mesure standard de déséquilibre de liaison de Lewontin absolue dB/MHz : Décibel par MégaHertz.
DEXA : Absorptiométrie biphotonique à rayon X DMO : Densité minérale osseuse
dNTP : Désoxynucléotide triphosphate EDTA : Acide éthylènediaminotétraacétique EM : Maximisation-Expectation
ER-ct, Récepteur estrogène alpha ERR-ct, Récepteur estrogène relié alpha ET : Écart-type
Etc : Etcetera G : Guanine g : Gramme
g/cm2 : Gramme par centimètre carré
glm : Modèle de régression linéaire H20 : Eau
Ig : Immunoglobuline-ressemblant IGF-I : Insulin growth factor-I IL-1 : Interleukine-1
IL-6 : Interleukine-6, IL-11 : Interleukine-11
I-TRAF : TNF receptor associated factor-1
L2L4 : Mesure par absorptiométrie biphotonique du rachis lombaire entre la vertèbre 2 et 4. LIF : Leukemia inhibitory factor
LIFR : Leukemia inhibitory factor receptor
LRP6 : Low density lipoprotein receptor-related protein 6 m : Mètre
mg : Milligramme (10~3gramme)
MgCU : Chlorure de magnésium min : Minute
mL : MilliLitre (103Litre)
mM : MilliMole (103Mole)
MMP-1 : Matrix metalloproteinase 1 MMP-9 : Matrix metalloproteinase 9
n : Nombre d'individus inclus dans l'analyse statistique NCBI : National Center for Biotechnology Information NF-kB : Nuclear factor-kappaB
NF-IL6 : Nuclear factor-Interleukine-6 ng : Nanogramme (10" gramme) nm : Nanometre (109mètre)
OMS : Organisation mondiale de la santé OSM : Oncostatin M
OSMR : Récepteur d'oncostatin M
p : valeur p, probabilité d'un test statistique pb : Paires de bases
PCR : Polymerase Chain Reaction
pH : Power of hydrogen, Mesure d'acidité d'une solution pmol : Picomole (IO12gramme)
PPAR : Peroxisome proliferative activated receptor PTH : Hormone parathyroi'de
PTHrP : Parathyroid hormone-related peptide QUS : Ultrason quantitatif
RANK L : Nuclear factor kappaB ligand RIL : Reversion-induced LIM
r2 : Coefficient de corrélation
rpm : révolution par minute sem. : Semaine
SNP : Single nucleotide polymorphisms SOS : (Speed of sound) vitesse des ultrasons spl : Facteur de transcription spl
SWS : Stuve-Wiedmenn /Schwartz-Jampel T : Tyrosine
TCIRG1 : T cell immune regulator gene 1 TDT : Transmission Disequilibrium Test. TE-ROX : TRIS-EDTA- ROX
TGF-P : Transforming growth factor-beta 1
TGFBR2 : Transforming growth factor beta receptor type II TNF-a : Tumor necrosis factor alpha
TRIS : 2-Amino-2-(hydroxymethyl)-l,3-propanediol U : Unité
-6-uL : MicroLitre (10°Litre) uM : MicroMole (lO^Mole) VDR : Récepteur de la vitamine D
VNTR : Répétitions en Tandem de Nombre Variable WRN: Werner
Vs : Versus
Symboles
X2 : Chi-carré
AG : Variation d'enthalpie libre X : lambda, long eur d'onde % : pourcentage
a : Alpha p : Beta
> : plus grand que < : plus petit que °C : degré Celcius
1.1 : Introduction générale à l'ostéoporose. 1.1.1 : Définition de l'ostéoporose.
L'ostéoporose a été clairement définie pour la première fois en 1993 comme une maladie du squelette qui touche l'ensemble de l'organisme et qui est caractérisée par une faible masse osseuse et une détérioration de la microarchitecture des tissus osseux (figure 1), dont le résultat est une augmentation de la fragilité osseuse et des risques de fractures de fragilité [1]. L'ostéoporose touche les hommes et les femmes de tous les groupes raciaux. Cependant, certaines strates de la population, telles les femmes caucasiennes de plus de 50 ans [2], sont plus susceptibles d'être atteintes par la maladie. Les fractures de fragilité sont définies comme des fractures causées par un traumatisme normalement insuffisant pour causer une fracture [3]. Elles peuvent affecter n'importe quel os du corps, mais surviennent plus communément au niveau de la hanche, des vertèbres, de l'extrémité supérieure du fémur [5] et du poignet [6].
Figure 1 : Tissu osseux d'une personne saine (gauche) et d'une personne touchée par l'ostéoporose (droite), caractérisée par une faible densité osseuse et des défauts architecturaux. [4]
1.1.2 : Diagnostic de l'ostéoporose.
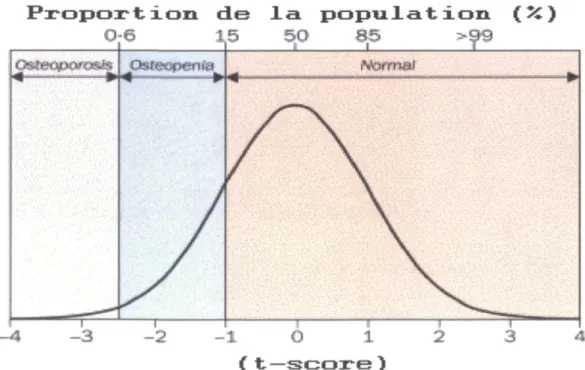
Puisqu'il n'y a actuellement pas de méthode totalement efficace pour mesurer la qualité micro-architecturale des tissus osseux, on pose le diagnostic d'ostéoporose en se basant presque exclusivement sur les mesures de densité osseuse et l'historique familial et personnel de fractures. L'Organisation mondiale de la santé (OMS) [7] [8] a défini
différentes catégories qui permettent de classer les femmes caucasiennes selon la mesure de leur densité osseuse de la hanche. La définition des groupes se base sur la comparaison de la mesure de la densité minérale osseuse de l'individu par rapport à la moyenne des jeunes adultes de la population, ayant le même genre et la même race. Puisque la densité osseuse des jeunes adultes suit approximativement une courbe de distribution normale de type Gaussienne, il est possible d'attribuer un T-score qui équivaut à un écart-type (ET) de la mesure osseuse de l'individu par rapport à la moyenne de la population de référence. Bien que le risque de fracture ne soit pas exclusivement lié à la mesure de densité osseuse, il semble que plus la densité osseuse est basse, plus le risque de fracture est grand. Plusieurs études antérieures suggèrent que le risque de fracture augmente de 1,5 à 2 fois à chaque diminution d'un écart-type (ET) de la densité osseuse [9].
Catégories de risques établies par l'OMS et modifiées par la Fondation internationale d'ostéoporose (figure 2).
♦ Normale : (T-score >-l)
♦ Ostéopénie (faible densité osseuse) : (T-score <-l et >-2.5). ♦ Ostéoporose : (T-score > -2,5)
Figure 2: Distribution de la densité osseuse minérale chez les femmes en bonne santé de 30 à 40 ans et classification du statut ostéoporotique défini par l'OMS. [10] P r o p o r t i o n d e l a p o p u l a t i o n ( >£ ) 0 - 6 X5 5 0 8 5 > ^ 9
Densiti
(t—score)
osseuse
minérab
Plusieurs méthodes sont utilisées pour mesurer la densité osseuse dans le but d'établir un diagnostic d'ostéoporose ou pour réaliser des études cliniques. Parmi les plus populaires, on note la technique d'absorptiométrie biphotonique à rayon X (DXA) et la technique par ultrason quantitatif (QUS ou «Quantitative ultrasound»).
1.1.3.1 : L'absorptiométrie biphotonique à rayon X : DXA.
La technique de référence la plus courante pour déterminer la densité osseuse est l'absorptiométrie biphotonique à rayon X (DXA). Il s'agit d'une méthode non invasive qui permet de mesurer de manière précise et reproductible la densité osseuse du squelette périphérique et axial et de distinguer les zones trabéculaires et corticales [8]. Cette technique repose sur le degré d'absorption d'un rayon X par les tissus osseux en tenant compte de l'épaisseur et de la nature du tissu traversé [11]. Bien que les appareils d'absorptiométrie biphotonique puissent mesurer toutes les parties du squelette, les mesures les plus courantes pour le diagnostic clinique sont le rachis lombaire entre la vertèbre 2 et 4 (L2L4) et le col fémoral. L'erreur de mesure est habituellement expliquée par les variations de graisse osseuse et les parties molles de l'os. Le résultat de l'absorptiométrie est la densité osseuse minérale et est exprimé en gramme/cm2.
Cette mesure de densité osseuse dépend de la quantité de matrice osseuse calcifiée et de son degré de calcification. La corrélation entre la valeur mesurée et la valeur réelle est généralement très élevée et on estime la marge d'erreur à environ 10 % pour le rachis lombaire [12]. Le DXA est reconnu pour être la méthode la plus efficace pour estimer le risque de fractures chez les femmes caucasiennes ménopausées [13].
1.1.3.2 : L'ultrason quantitatif: QUS.
Les appareils de mesure par ultrason quantitatif (QUS) calculent les variations des paramètres ultrasonores mesurés en transmission lors de la traversée des tissus osseux périphériques, tel le talon. L'atténuation et la vitesse du signal sont les deux paramètres habituellement estimés lors de ces mesures. L'atténuation dépend de l'absorption du son qui est influencée par la structure et la composition chimique du tissu osseux. La relation entre la fréquence et le degré d'atténuation fournit une droite appelée « broadband ultrasound attenuation » (BUA) et s'exprime en décibel par MHz (dB/MHz). La vitesse des ultrasons (SOS ou « Speed of sound ») est exprimée en m/s et dépend de la densité des tissus osseux, mais aussi de certaines propriétés mécaniques de
l'os, telle l'élasticité. Donc, les ultrasons permettent de mesurer non seulement la densité osseuse, mais d'estimer certains paramètres de la qualité de l'os [14]. Il ne s'agit cependant pas d'une mesure directe de la qualité du tissu osseux et ce type de mesure est considéré comme une mesure de densité osseuse des parties périphériques du squelette [15]. Bien que le pouvoir de prédiction du risque de fractures par les ultrasons semble être identique à celui des mesures d'absorptiométrie biphotonique [ 16], le QUS reste tout de même une méthode de diagnostic moins populaire. Il existe plusieurs appareils de mesure et bien qu'il y ait une bonne corrélation entre les différents appareils pour le BUA (0,73-0,93) et SOS (0,71-0.92), les résultats entre les appareils ne sont pas interchangeables [17].
1.1.4 : L'incidence de la maladie.
L'ostéoporose est un problème de santé majeur au Canada, aux États-Unis et dans le reste du monde. Au Canada, on évalue que 1,4 million de Canadiens souffrent d'ostéoporose : soit une femme de plus de 50 ans sur quatre et un homme de plus de 50 ans sur 8 qui sont touchés par cette affection [18]. Au cours de leur vie, les femmes canadiennes ont 17,4 % de chance de souffrir d'une fracture de la hanche, ce qui est supérieur au risque de développer un cancer du sein (10,6 %) [19]. Or, avec le vieillissement prévisible, plus de 25 % de la population canadienne aura plus de 65 ans en 2041; on estime que l'incidence de l'ostéoporose et des fractures reliées à cet état montera en flèche, atteignant des niveaux jamais atteints [20]. Depuis le début des années 80, on observe une augmentation constante du nombre de fractures du col fémoral, passant de 17 823 fractures en 1981 à 27 375 en 1995 (figure 3) [21] ; en 2041, on estime que ce nombre pourrait atteindre 88 124 fractures [22]. Ces chiffres sont en corrélation avec ceux des États-Unis où l'on estime qu'en 2002, 44 millions d'Américains souffraient d'ostéoporose ou avaient une masse osseuse faible [23].
30000 25000 2 X ç « 20000
*■ 1
*- E 15000+ v yu ■o *■ tu ô 10000 E 5000fl o Z 0 1981 1982 1983 1584 198$ 1986 198? 1988 1«88 1990 1991 1992 1933 1994 1995 Années 1.1.5 : L'impact économique.En Amérique du Nord, l'augmentation de l'incidence de l'ostéoporose a des répercussions directes sur les coûts du système de santé. Au milieu des années 1990, le coût de la santé et des soins à long terme reliés à l'ostéoporose était estimé à 13,8 milliards de dollars aux Etats-Unis [23] et à 1,3 milliard de dollars au Canada [24]. Il ne s'agit malheureusement que de la pointe de l'iceberg car les factures secondaires à l'ostéoporose causent indirectement des pertes économiques non négligeables. Parmi les effets cachés, on dénombre la perte de productivité au travail, le coût des soins à domicile, les heures de travail perdues par le personnel hospitalier.Une étude canadienne faite sur 504 femmes a estimé que le coût moyen en soins de santé dû à une fracture de la hanche équivaut à 26 527 dollars canadiens par année, par patient [26]. 1.1.6 : La mortalité chez les victimes de fractures ostéoporotiques.
Plusieurs études ont démontré qu'il y a une augmentation de la mortalité, suite à une fracture ostéoporotique [27] [28] [29] [30], La mortalité reliée aux fractures caractéristiques de l'ostéoporose, soit les fractures de la hanche et de la colonne vertébrale, est bien documentée [31] [32] [33]. Le taux de mortalité est beaucoup plus élevé immédiatement après le traumatisme et reste significativement élevé entre 3 mois et 1 an après la fracture. [34]. Ensuite, le taux de mortalité diminue, mais reste légèrement supérieur à la moyenne de la population.
Aussi, il est important de souligner que l'ostéoporose est une maladie débilitante qui entraîne une perte sévère de la mobilité, ce qui diminue la qualité de vie des victimes et des membres de l'entourage. Parmi les survivants, 20 % des patients auront
éventuellement besoin de traitements à long terme, dans une institution [35]. Plus préoccupant encore, seulement la moitié des victimes de fractures de la hanche retrouveront une vie active normale [35].
1.2 : Les facteurs de risque impliqués de l'ostéoporose. 1.2.1 : L'âge.
L'âge est un des facteurs les plus importants dans le développement de l'ostéoporose et dans l'augmentation du risque de fractures de fragilité. L'Organisation mondiale de la santé (OMS) classe l'âge parmi les facteurs de risque les plus importants et conseille de l'inclure dans les critères de diagnostic de l'ostéoporose [36]. Depuis plusieurs années, de nombreuses études épidémiologiques ont établi que l'âge contribuait à l'augmentation de la prévalence de l'ostéoporose et des fractures de fragilité de façon très importante. Une étude (NHANES III) a étudié l'effet de l'âge sur la prévalence de l'ostéoporose et a déterminé que seulement 1 % des femmes de moins de 30 ans étaient touchées par l'ostéoporose, tandis que chez les femmes de plus de 80 ans, 52 % d'entre elles étaient atteintes par cette affection [37]. Aussi, une étude plus récente effectuée chez 200 000 Américaines postménopausées a estimé que le rapport de cote, qui estime le risque relatif d'être touché par l'ostéoporose, est 23 fois plus grand chez les femmes de 80 que chez celles de 50 à 55 ans. Dans ce cas, le rapport de cote est calculé en comparant le rapport entre la probabilité de survenue de l'ostéoporose et la probabilité de non survenue de cette maladie chez les femmes de 80 ans comparé au rapport de cote des femmes de 50 à 55 ans. [38]. La diminution de la densité osseuse avec l'âge est due à plusieurs facteurs physiologiques différents. Parmi ceux-ci, on retrouve le changement de concentration de facteurs chimiques et hormonaux, telle une augmentation de la quantité de l'hormone parathyroïde (PTH) [39] et une diminution de la production d'estrogène à la ménopause. Parmi les autres facteurs responsables de la perte osseuse, on compte aussi la diminution de l'activité physique chez les personnes âgées et la réduction de leur mobilité. Tous ces facteurs réunis vont mener au débalancement du remaniement osseux et favoriser la résorption du calcium dans les os au détriment de la formation de tissus osseux.
1.2.2 : Le genre.
Bien que l'ostéoporose affecte les deux sexes, la prévalence de l'ostéoporose et des fractures de fragilité est deux fois plus importante chez les femmes que chez les hommes. Cependant, les hommes ne sont pas à l'abri et leur risque de développer cette
femme, le début de la perte osseuse commence vers 40 ans et équivaut à environ 1 % par année de la masse osseuse totale [40]. Dans plusieurs études, la densité osseuse des femmes est reconnue pour être plus faible (entre 12 et 25 %) que celle des hommes [41]. La susceptibilité accrue des femmes à développer l'ostéoporose est le résultat d'une plus faible acquisition de tissus osseux durant la croissance, de différents facteurs reliés au vieillissement et de la perte osseuse accélérée durant la ménopause. La période de croissance est une étape déterminante dans l'acquisition des tissus osseux et a des répercussions importantes sur les chances de développer une faible masse osseuse après la ménopause. Ainsi, les jeunes garçons ont un pic de masse osseuse plus élevé que les jeunes filles (3300 g chez les garçons et 2600 g chez les filles) [42]. Les différences
entre les sexes apparaissent dès la puberté et expliquent, en partie, l'incidence plus élevée du nombre de fractures chez les femmes âgées de plus de 50 ans. La durée des menstruations chez les femmes est aussi un facteur de risque important dans le développement d'une faible masse osseuse. En effet, les femmes qui sont menstruées tardivement ou celles qui sont ménopausées précocement auront en moyenne une masse osseuse plus faible que les autres femmes et souffriront plus fréquemment d'ostéoporose après la ménopause [43].
1.2.3 : La race
La variance de densité osseuse entre les différentes ethnies est un sujet d'étude depuis longtemps et il a été clairement démontré qu'il existe des différences de structure et de densité osseuse entre les races [44] [45]. Une étude plus récente effectuée aux États-Unis sur différentes ethnies a quantifié le taux d'individus atteints par l'ostéoporose selon le classement de l'OMS. Les résultats sont évocateurs quant à l'influence de l'ethnicité sur les densités osseuses moyennes entre les différentes ethnies.. Les femmes blanches caucasiennes non hispaniques sont les plus touchées avec 21% de victimes, suivies par les femmes hispaniques avec 10 % de femmes atteintes. Les femmes noires américaines sont les moins touchées par cette maladie avec seulement 5 % de femmes atteintes [46]. Ainsi, les femmes noires sont moins susceptibles d'être victimes de fractures de fragilité. Ce fait se reflète bien dans le nombre de fractures traitées en milieu hospitalier. En 2004, dans un hôpital de New York, 459 caucasiennes sur
américaines [47]. Cependant, l'étude d'évaluation nationale des risques d'ostéoporose portant sur 200 000 femmes a démontré que tous les groupes ethniques ont des représentants dans le groupe de densité osseuse faible (osteopenia + ostéoporose) et que la densité osseuse tend à diminuer avec l'âge pour toutes les ethnies [48]
1.2.4 : La masse corporelle.
L'obésité a été clairement identifiée comme un facteur de protection contre l'ostéoporose [49]. À plusieurs reprises, il a été établi que la densité osseuse minérale est directement reliée à la masse corporelle totale [50] [51] [52]. En effet, les individus qui ont une masse corporelle faible possèdent une densité osseuse faible et le niveau de corrélation varie selon l'étude entre r=0.3 et r=0.6. De larges études prospectives ont permis de déterminer qu'une brusque perte de masse corporelle entraîne une diminution de la masse osseuse [53]. Plusieurs explications ont été proposées pour expliquer l'influence du poids sur l'acquisition de la masse osseuse. Au niveau biomécanique, Faction mécanique due à la surcharge de poids supplémentaire va favoriser la formation de tissus osseux. Au niveau biochimique, les tissus adipeux produisent des hormones et des enzymes impliquées dans la régulation des tissus osseux. Parmi les plus importants, on note les estrogènes produits par les enzymes aromatases [53] et la leptine [55]. On croit aussi que le niveau d'insuline élevé accompagnant une masse adipeuse importante pourrait aussi influencer positivement la formation osseuse [56].
1.2.5 : La cigarette, l'alcool et la caféine.
L'effet négatif de la cigarette sur la formation de tissus osseux est bien connu et quelques études transversales et longitudinales ont rapporté une corrélation entre la cigarette et les risques de fracture de la hanche, des vertèbres et de l'avant-bras [57]. Ainsi, une étude transversale faite sur 116 000 femmes a démontré que les femmes qui fument ont un risque relatif de fractures de la hanche de 1,3. Les effets négatifs de la cigarette tendent à se dissiper seulement 10 ans après avoir cessé de fumer [58]. De plus, il a été montré que la cigarette réduit l'efficacité des traitements hormonaux, augmentant ainsi les doses d'estradiol nécessaires pour obtenir des gains de masse osseuse équivalents à ceux des non-fumeurs [59]. Il semble que la cigarette court-circuite le métabolisme endogène des estrogènes, diminuant ainsi la quantité globale d'estrogènes en circulation [60].
avoir un effet positif sur la formation de tissus osseux. La cause de cet effet est inconnue, mais on observe une diminution des marqueurs du remaniement osseux et un niveau d'hormone parathyroïde (PTH) plus bas [61]. À l'inverse, les femmes consommant plus de 27 verres par semaine ont un risque accru d'être victime d'une fracture de la hanche [62].
La caféine entraîne une balance négative de calcium dans le corps possiblement attribué à l'augmentation du niveau d'excrétion urinaire. Cependant, les études sur l'effet de la caféine sur la masse osseuse dans la population sont contradictoires, certaines observant un effet positif et d'autres un effet négatif ou nul. [63]
1.2.6 : L'activité sportive et la nutrition.
La majorité des études indique une relation positive entre la pratique de l'activité sportive et la formation et le maintien d'une robuste densité osseuse. On observe que l'activité physique a une influence positive sur l'acquisition du pic de densité osseuse chez les enfants et les adolescents [64] [65]. Une étude récente a aussi montré que les femmes postménopausées qui marchent de façon intensive accroissent modérément leur densité osseuse au col fémoral et diminuent légèrement leur niveau de marqueurs biochimiques impliqués dans le remaniement osseux [66].
L'importance d'une bonne diète dans l'acquisition d'une masse osseuse élevée commence dès l'enfance et se répercute tout au long de la vie d'adulte et de la période du vieillissement. La plupart des études ont mis l'accent sur l'influence du calcium et de la vitamine D dans le régime alimentaire. Plusieurs études comparatives ont estimé qu'un régime riche en calcium (> lOOOmg/jour) durant la période de l'enfance et de l'adolescence procure un effet modeste, mais positif sur l'accumulation de tissus osseux [67] [68]. Enfin, chez les femmes ménopausées, la majorité des études indique qu'un régime abondant en calcium tend à réduire la perte osseuse et augmenter le gain de tissus osseux. Une étude effectuée chez 3270 femmes a estimé que la prise de vitamine D couplée à celle du calcium, réduit d'au moins 29 % le risque de fractures de la hanche [69].
10
Plusieurs autres vitamines et nutriments ont une influence positive sur la formation des tissus osseux. Parmi ceux-ci, on retrouve le magnésium, le phosphore, la vitamine K, la vitamine C et les protéines. Ainsi, une alimentation équilibrée et variée est la meilleure assurance pour la santé de l'os.
1.3 : Le métabolisme osseux et les variations de la densité osseuse. 1.3.1 : L'homéostasie osseuse.
Le tissu osseux est en perpétuel remaniement et l'homéostasie osseuse peut être conservée grâce à une fine régulation entre le niveau de formation et de résorption des tissus osseux. Cette régulation est dirigée par différents facteurs chimiques et hormonaux endogènes qui vont agir sur les différentes cellules de la matrice osseuse. Parmi les cellules les plus importantes dans la régulation du métabolisme osseux, on retrouve les ostéoblastes et les ostéoclastes.
1.3.1.1 : Les ostéoblastes.
Les ostéoblastes sont les cellules clés dans la production du tissu osseux minéralisé. Elles sont responsables de la production d'ostéoïde, une matrice osseuse non minéralisée composée majoritairement de fibres de collagène, de proteoglycans et de glycoprotéines. Cette matrice sera ensuite calcifiée sous le contrôle des ostéoblastes, pour former les tissus minéralisés solides. Les ostéoblastes sont toujours regroupés en unité de 100 à 400 cellules et forment une couche unique qui recouvre la paroi osseuse en construction. On retrouve à la surface des ostéoblastes plusieurs récepteurs membranaires qui permettent la liaison et médient la réponse cellulaire de plusieurs hormones (estrogène, androgène l,25(OH) 2 Vitamine D, hormone parathyroïde), cytokines (TGF-P 1, IL-1, 11-6, IGF-I, LIFR) et facteurs locaux (prostaglandine E2, leptine) reconnus pour avoir une influence sur la régulation du métabolisme osseux [70].
1.3.1.2 : Les ostéoclastes.
Les ostéoclastes sont de grosses cellules multinucléées, dont le rebord jouxtant la paroi osseuse est formé de projections membranaires en forme de doigts qui ont pour fonction de médier la résorption de la matrice osseuse calcifiée [71]. La matrice osseuse cristalline sera dégradée par l'environnement acide créé suite au relargage de protons dans le milieu par des pompes ATP-dépendantes situées dans les projections membranaires des ostéoclastes [72]. Plusieurs facteurs chimiques et hormonaux vont
moduler directement la résorption osseuse ostéoclastique grâce à des récepteurs situés à la surface des ostéoclastes, incluant les cytokines (RANK L, TNF-a et IF-y) et les hormones (acide rétinoïque et estrogène) [71].
1.3.2 : Le modelage et le remaniement osseux.
Le squelette est un organe hautement spécialisé et dynamique qui est en perpétuelle régénération. Durant le développement et jusqu'à la fin de la période de croissance, le squelette sera modifié de façon à obtenir la taille et la forme désirée par un phénomène de modelage osseux. Le modelage osseux consiste à retirer du tissu osseux à un site précis du squelette pour le déposer à un endroit différent sur le squelette. Lorsque la croissance est terminée, le squelette continue à se transformer, mais le tissu osseux retiré d'un site du squelette sera remplacé de façon équivalente par du nouveau tissu osseux. Ce phénomène de renouvellement se nomme remaniement osseux [73]. La fonction du remaniement osseux n'est pas encore totalement élucidée, mais serait nécessaire pour réparer l'usure normale du squelette et éviter l'accumulation de vieux tissus osseux, plus vulnérables. Au cours de la vie, le remaniement osseux touche l'ensemble du squelette, mais s'effectue ponctuellement dans les unités fonctionnelles de remaniement osseux, composées d'ostéoblastes et d'ostéoclastes qui forment une structure temporaire. Ainsi, lorsque le remaniement osseux est fonctionnel, la formation de nouveaux tissus par les ostéoblastes est égale à la quantité de tissus osseux résorbée par les ostéoclastes. Un débalancement entre un niveau de résorption trop élevé et un niveau de formation trop faible aura pour conséquence une diminution de la densité osseuse et entraînera des pathologies, telle l'ostéoporose. Un débalancement entre un niveau de résorption trop élevé et un niveau de formation trop faible aura pour conséquence une diminution de la densité osseuse et entraînera des pathologies, telle l'ostéoporose. Le taux de remplacement et la durée de vie des cellules osseuses, la régulation de leur activité, ainsi que le travail qu'elles effectuent sont critiques dans le maintien de l'homéostasie osseuse [71].
1.3.3 : Les variations de la densité osseuse au cours de la vie.
La densité osseuse et la microarchitecture des tissus osseux varient tout au long de la vie. De la naissance à l'âge adulte, le tissu osseux humain est en pleine croissance et le squelette amasse une masse osseuse précieuse avec laquelle il devra composer le reste de sa vie d'adulte. Le plateau est atteint vers l'âge de 25 ans et est communément appelé le pic de densité osseuse. À la fin de cette étape, il n'y aura plus d'augmentation globale
12
de la densité osseuse. Le tissu osseux restera actif, mais on parlera plutôt de rearrangement du tissu osseux plutôt que de formation osseuse additionnelle. Entre 25 ans et la ménopause, la masse osseuse restera stable ou diminuera de manière peu significative. Chez les hommes, comme chez les femmes, la diminution de la masse osseuse débute vers 40 ans, à un rythme de 0,05 % à 1 % par année. Chez la femme, s'ajoute la ménopause qui est caractérisée par une diminution de la production d'estrogène qui aura un impact majeur sur la masse osseuse accumulée. En effet, la masse osseuse va diminuer très rapidement durant les premières années de la ménopause pour un total de 5 à 7 % de la masse totale [74]. Après la période de la ménopause, la masse osseuse va se stabiliser et la perte, bien qu'importante, sera moins rapide et sera due au vieillissement normal du squelette. (Figure 4).
Figure 4 : Variation de la masse osseuse au cours de la vie d'un individu. [75]
a> en ■3 <__■ œ en o (Si œ p u b e r t i
A g e
4 0 ( a n i u 6 0 S O1.3.4 : La ménopause et le vieillissement : les conséquences sur le remaniement osseux.
La perte osseuse durant les premières années de la ménopause est élevée, due à la diminution de la production d'estrogène qui cause une augmentation du taux de remaniement osseux. En effet, la déficience en estrogène va provoquer l'apparition rapide de plusieurs sites de résorption qui ne seront que partiellement remplis par les ostéoblastes. Ainsi dans chaque unité fonctionnelle, il y aura plus de tissu retiré que de
tissu remplacé ce qui, à long terme, va amener une balance négative du remaniement osseux et donc une diminution globale de la densité osseuse [76]. En plus d'être moins efficace, le temps habituellement plus long pour initier la formation de tissu osseux va aussi augmenter le niveau de débalancement dans chaque unité fonctionnelle [77]. La perte osseuse survenant chez les femmes et les hommes entre 80 et 90 ans semble aussi importante que celle survenant à la ménopause et est aussi expliquée par un débalancement du cycle de remaniement osseux. Le débalancement osseux va entraîner une augmentation de la résorption osseuse et une diminution ou aucun changement de la formation osseuse. [78].
La quantité de tissus osseux accumulée durant la période de croissance et celle perdue durant la ménopause et le vieillissement sera différente d'un individu à l'autre et seront influencées par plusieurs facteurs environnementaux (section : 1.2) et génétiques.
1.4 : La génétique de l'ostéoporose et l'identification de gènes impliqués dans l'ostéoporose.
1.4.1 : La génétique et l'hérédité de la densité osseuse et de l'ostéoporose.
La physiopathologie de l'ostéoporose est complexe et implique une grande variété de facteurs endogènes (génétiques et hormonaux) et environnementaux. La majorité des recherches épidémiologiques qui ont pour but d'identifier l'influence des variations génétiques sur l'ostéoporose se sont penchées sur l'héritage génétique de la densité osseuse minérale, un facteur capital de risque de fractures ostéoporotiques. L'héritabilité de la densité osseuse a été évaluée dans de nombreuses études familiales et études de jumeaux ; les variations génétiques ont été estimées responsables de 50% à 80 % de l'ensemble de la variation de la densité osseuse dans la population [79]. L'influence de la génétique sur la densité osseuse semble varier en fonction du site squelettique et du sexe [80]. Il y aussi des études qui suggèrent qu'il existe un lien entre le pic de densité de la mère et la masse osseuse des enfants prépubères de sexemasculin et féminin [81]. Cependant la densité osseuse minérale n'est pas le seul facteur impliqué dans le risque de fractures ostéoporotiques. Les études de jumeaux et familiales ont aussi déterminé que les variations génétiques jouaient un rôle important dans l'acquisition d'autres phénotypes caractéristiques des fractures ostéoporotiques. Parmi ceux-ci, on compte la concentration de marqueurs biochimiques du remaniement osseux, la géométrie du squelette, les propriétés ultrasonographique des os, ainsi que l'âge à la ménopause [82]. L'héritage génétique influence possiblement le risque de
14
fractures et on estime que son héritabilité est d'environ 25 % [83]. Certaines études ont étudié conjointement l'influence des variations génétiques sur la densité osseuse et les risques de fracture ; bien que la densité osseuse soit un des plus forts indicateurs du risque de fractures, les résultats indiquent une indépendance partielle de transmission entre la densité osseuse et le risque de fracture. Ces résultats indiqueraient des mécanismes génétiques partiellement différents [84] [85].
1.4.2 : Les différentes approches pour identifier les gènes impliqués dans la régulation de la densité osseuse.
La découverte de nouveaux gènes impliqués dans la régulation de la densité osseuse est un enjeu majeur dans la compréhension du métabolisme osseux et la découverte de nouvelles approches thérapeutiques dans le traitement de l'ostéoporose. Depuis quelques années, plusieurs types d'études épidémiologiques ont été utilisés pour identifier des gènes impliqués dans la pathologie de l'ostéoporose. Ces méthodes permettent de déterminer s'il existe une relation entre le phénotype étudié (densité osseuse) et les génotypes des individus. Il existe différentes stratégies dont les plus utilisées sont les études de liaison et les études d'association.
1.4.2.1 : Les études de liaison.
Les études de liaison testent la ségrégation d'une région chromosomique avec un phénotype ou une maladie. Cette méthode va conduire à la localisation d'une région chromosomique ou plus rarement d'un seul gène. Elle consiste à rechercher dans les familles, la transmission d'une maladie par rapport à des marqueurs génétiques situés à des endroits précis dans le génome. Ainsi, si un marqueur est situé près d'un gène impliqué dans une maladie, à la fois le gène et le marqueur auront tendance à être hérités ensemble lors de la méiose. Un de ses avantages est de pouvoir explorer l'ensemble du génome et de détecter l'effet de gènes dont le rôle n'est pas encore connu.
1.4.2.3 : Les études d'association.
Les analyses d'association permettent de tester l'influence d'un marqueur situé à un site précis dans le génome, sur une maladie ou un phénotype. Pour cela, on doit comparer la fréquence allélique ou génotypique entre différents groupes de population ayant différents phénotypes pour la maladie à l'étude. Les études d'association cas-témoins sont effectuées sur deux populations distinctes : un groupe d'individus affectés par la maladie ou ayant le phénotype d'intérêt et un groupe de témoins sains. Ainsi, il y
association lorsque l'un des alleles ou génotype étudié est surreprésenté (ou sous-représenté allele protecteur) chez les individus affectés. Les tests statistiques d'association sont habituellement effectués avec un test de Chi carré classique, un test destiné à détecter si la distribution des fréquences des génotypes (ou des alleles) des sous-groupes à l'étude (cas vs témoins) diffère l'une de l'autre.
Les études d'association permettent aussi d'étudier des phénotypes quantitatifs, telle la densité osseuse. Dans ce cas, on compare la moyenne de la densité osseuse entre chacun des groupes génotypiques (homozygote rare, homozygote fréquent ou hétérozygote) ou alléliques dans une population échantillonnée. Il y a une association lorsque la moyenne de la densité osseuse pour un génotype est différente de celle observée pour les autres génotypes. Dans le cas des traits quantitatifs qui sont influencés par des facteurs environnementaux (ex : densité osseuse), la variance entre les différents groupes de génotypes sera classiquement testée à l'aide d'une analyse de covariance (ANCOVA). En effet, ce type d'analyse est supérieur à une analyse de variance simple (ANOVA) puisqu'elle permet d'ajuster les mesures osseuses avec les différents facteurs confondants environnementaux. Ce type de test réduira considérablement la variance attribuée aux facteurs environnementaux ce qui permettra d'avoir une meilleure estimation de celle attribuée aux variants génétiques.
Dû au nombre considérable de marqueurs génétiques présents sur le génome, les études d'association ne permettent habituellement pas de tester l'ensemble des marqueurs du génome. La majorité de ces études doivent donc être effectuées sur une région génomique spécifique ou avec un gène candidat. Ce type d'étude est appelé étude d'association avec gène candidat.
1.4.2.4 : Les études d'association et les études de liaison : le cas des maladies complexes.
Durant les dernières années, plusieurs gènes impliqués dans des maladies génétiques simples ont été identifiés grâce aux études de liaison génétique et de clonage positionnel (ex : locus et gène impliqué dans le syndrome d'Ataxie de Charlevoix Saguenay [86] ou gène impliqué dans la fibrose kystique [87]). Ces méthodes se sont révélées très efficaces pour localiser des gènes impliqués dans les maladies mendéliennes (un seul gène) ou des gènes ayant un effet majeur dans le développement d'une maladie. Elles se sont cependant avérées moins efficaces pour identifier des gènes impliqués dans les
16
maladies complexes, telle l'ostéoporose. [88]. Ce fait peut être expliqué par plusieurs facteurs. Tout d'abord, les maladies complexes impliquent plusieurs gènes qui peuvent ou non interagir ensemble ou avec différents facteurs environnementaux. De plus, les gènes impliqués vont avoir sur le phénotype un effet beaucoup plus petit que les gènes impliqués dans les maladies mendéliennes. [89]. Aussi, les facteurs environnementaux seuls peuvent avoir une grande influence sur le phénotype étudié [90]. Ainsi, pour toutes ces raisons, plusieurs équipes de recherche ont favorisé l'approche des études d'association avec des gènes candidats pour identifier des gènes impliqués dans la régulation de la densité osseuse et la pathologie de l'ostéoporose [91].
1.4.2.5 : Les avantages des études d'association avec gène candidat.
Comparées aux études de liaison, les études d'association présentent plusieurs avantages dans l'étude des maladies complexes. Tout d'abord, Risch et Merikangas ont montré que les études d'association avaient une puissance statistique supérieure aux analyses de liaison génétique, en particulier pour les gènes ayant un effet modeste [92]. Les études d'association sont très simples à effectuer et permettent un recrutement facile. En effet, ces études ne requièrent pas de cas familiaux, alors que les études de liaison nécessitent au moins deux personnes atteintes et apparentées au premier degré. Puisque ces études sont simples, il est facile de répéter les études effectuées dans une population indépendante pour vérifier la validité des associations détectées.
Aussi, l'analyse statistique ne nécessite pas la connaissance du mode de transmission de la maladie, habituellement inconnu dans le cas des maladies complexes. Les études d'association permettent aussi de tester les génotypes en interaction avec des facteurs environnementaux et avec d'autres polymorphismes sur des gènes différents [93].
Les études d'association, à la différence des études de liaison, nous permettent plus souvent d'identifier précisément un gène ou une région précise et ainsi de développer des hypothèses sur la pathophysiologie du désordre et l'implication du gène dans la maladie. Par exemple la découverte d'une association entre le gène APOE et la maladie de FAlzheimer [94] a permis la naissance de vastes études sur la compréhension de l'implication de l'allèle E4 et le développement de nouvelles thérapies [95].
1.4.2.6 : Les désavantages des études d'association avec gène candidat.
Cependant, les études d'association présentent aussi quelques inconvénients et sont soumises à plusieurs critiques. Ces critiques sont survenues à la suite de la non replication de plusieurs études apparues dans la littérature au cours des dernières années [88]. En effet, Ioannidis et ses associés ont effectué une méta-analyse portant sur 36 études d'association portant sur une maladie ou un phénotype quantitatif. Les auteurs ont déterminé que les études d'association sur un même phénotype étaient quelquefois inconsistantes et que la première étude rapportait souvent un effet sur le phénotype plus grand que celui rapporté, lors d'études subséquentes [96]. Plusieurs lacunes dans les études d'association expliquent ce manque de reproductibité.
Fout d'abord, les études d'association sont grandement influencées par les caractéristiques de l'étude, incluant la taille de l'échantillon et le nombre de variables observées. Les études d'association peuvent aussi être influencées par différents biais dans la population échantillonnée, soit le biais de sélection, le biais de rappel ou une mauvaise classification des sujets [97]. Aussi, les facteurs environnementaux confondants non mesurés, telles les habitudes de vie [98] et les différences de structure génétique de certains sous-groupes à l'intérieur d'une même population (stratification) [99] vont diminuer les chances de détecter une association vraie ou augmenter le nombre de faux positifs détectés.
Ce type d'étude est sensible aux phénomènes de stratification, en particulier de stratification ethnique. Il y a présence de stratification génétique lorsque la fréquence des alleles varie entre différents sous-groupes, dans un même échantillon, conséquemment à un bagage génétique différents entre les deux groupes, mais non liés au phénotype d'intérêt. En effet, une étude récente a déterminé que le taux de faux positifs doublait lorsque le pourcentage de stratification atteignait 20 % [100]. Cet inconvénient peut toutefois être réduit au moyen de tests, comme le Transmission Disequilibrium Test (TDT)[\0\~\, qui utilise à titre de témoins les parents d'un sujet atteint. Ce test nécessite toutefois le recrutement de familles. Il existe aussi d'autres méthodes pour s'assurer qu'il n'y a pas de stratification génétique importante au sein d'un échantillon, lorsque les parents du sujet atteint ne sont pas disponibles. Parmis celles-ci, la méthode proposée pas Pritchard JK qui utilise 20 marqueurs génétiques non-reliés [102].
IS
Le manque de profondeur et d'inclusivité des études d'association avec gène candidat a souvent été dénoncé par certains auteurs au fil des années du aux limites de cette méthode à inclure tous les gènes causaux ainsi que tous les polymorphismes possiblement impliqué dans la maladie à l'étude [103]. En effet, la majorité des études antérieures considèrent seulement un petit nombre de gènes candidats et de variants. Les études d'association sont restreintes à des gènes déjà connus, dont on connaît en partie la fonction et dont on soupçonne une implication dans la physiopathologie de la maladie à l'étude. Le choix des variants à l'étude est essentiellement basé sur des études biologiques effectuées antérieurement qui indiquent un rôle probable de ces gènes dans la maladie ou le caractère à l'étude. Cela exclut une quantité de gènes importants dont on ne connaît pas encore le rôle. Cependant ce type d'étude est très utile pour valider des associations déjà rapportées ou pour déterminer leur importance réelle dans le contexte de la population générale. Le nombre de variants disponibles est aussi une limite importante dans ce type d'étude [103]. En effet, le nombre de variants fonctionnels connus est faible et on ne connaît pas ou peu leur implication dans le phénotype étudié. Cependant, le projet de séquençage du génome humain, les projets de détection de polymorphismes à grande échelle (Ex: Hapmap) [104] ainsi que le développement de nouvelles méthodes de génotypage à haut débit ont amélioré de manière significative le choix et la qualité des gènes et des variants, permettant des études beaucoup plus complètes et inclusives.
La non replication des associations pourrait aussi être expliquée par la mauvaise connaissance des différentes structures des déséquilibres de liaison dans le génome et dans les différentes populations échantillonnées [105]. En effet, la structure des déséquilibres de liaison varie dans les populations en fonction de leur histoire et de la pression de la sélection naturelle. Par exemple, un polymorphisme associé avec un phénotype peut ne pas être causal, mais être en déséquilibre de liaison avec un marqueur fonctionnel. Le polymorphisme, génotype dans une deuxième population, pourrait être en plus ou moins grand déséquilibre de liaison, résultant en une incapacité à répéter l'association détectée dans la population initiale [106].
1.4.3 : Les gènes candidats impliqués dans la physiopathologie de l'ostéoporose. L'ostéoporose est une maladie complexe et plusieurs gènes individuels semblent avoir une influence sur la densité osseuse de la population. Les gènes candidats de
l'ostéoporose les plus étudiés se divisent majoritairement entre la famille des cytokines, la famille des facteurs de croissance et les protéines de la matrice osseuse. Les gènes du récepteur de la vitamine D [107], du collagène de type 1 [108], du récepteur alpha de F estrogène [109] et du facteur de transformation [110] ont été scrutés à la loupe au cours des dernières années et sont parmi les gènes candidats les plus importants. Il existe une panoplie de gènes qui ont fait le sujet d'étude d'association, le tableau 1 tiré de la récente revue de literature de A.G. Uitterlinden résume bien les principaux gènes étudiés [111].
Tableau 1: Gènes candidats de l'ostéoporose et la densité osseuse [111].
Nom du Gène Symbole Nom du Gène Symbole
Protéines de la matrice Récepteur senseur de calcium CASR
Osteocalcine BGLAP Récepteur de calcitonine CALCR
a2HS Glycoprotéine AHSG Hormone parathyroide PTH
Ostéopontine SPP1 Récepteur PTH PTHR1
Ostéonectine SPOCK Fracteur de croisance
épidermique EGF
Collagène de type Ial C0LIA1 Hormone de relâchement de
gonadoprotéine GNRH1
Collagène de type Ia2 C0LIA2 Récepteur de l'hormone de relâchement de gonadoprotéine GNRHR Enzymes associées à la matrice Hormone de beta-peptide de lutéinizine LHB Cathepsine CTSK Récepteur de LH-choriogonadotropine LHCGR
Phosphatase Alcaline ALPL Facteurs de croissance,
cytokines, Récepteurs
Anhydrase Carbonique CA2 Interleukine de type-1P
antagoniste IL-1RN
Metalloproteinase de
matrice 3 MMP3 Interleukine de type 4 IL-4
Oxydase lysil LOX Interleukine de type 6 IL-6
Lysine Hydroxylase PLOD Facteur de croissance transformant pi TGFB1
Lysine Hydroxylase 2 PLOD2 Facteur de croissance
transformant P2 TGFB2
Lysine Hydroxylase 3 PLOD3 Hormone de croissance GH1
Hormones stéroïdes,
récepteurs, enzymes ESR1
Récepteur de facteur de
croissance GHR
20
Récepteur d'estogènes b CYP19 Facteur de croissance insuline
ressemblant II IGF2
Aromatase AR
Récepteur du facteur de croissance insuline ressemblant I
IGF1R Récepteur de
glucocorticoide GRNR3C
Récepteur du facteur de croissance insuline ressemblant II
IGF2R
Récepteur d'androgène VDR Protéine liant IGF de type 3 IGFBP3
Récepteur de la vitamine D DBP/GC Facteur a de tumeur nécrosante TNF
Récepteur de B3
-adrenergique ADRB3 Récepteur TNF superfamille/lp TNFRG5
Récepteur gamma du peroxisome proliférateur-activé
PPARG Protéine morphogénétique osseux de type 2 BMP2 Protéine morphogénétique
osseux de type 3 BMP3 Béta-synthase de Cystationine CBS
Sclérostine SOST Reductase synthase de
Methionine MTRR Ostéoprotègrine OPG/TNFRSF11B Homocysteine s-methyltransférase de methyltetrahydrofolate MTRR
RANK 18q22.1 RANK/TNFRSF1 IB Synthéase thymidylate TYMS
RANL-ligand/OPG-ligand RANK/FNFRSF1
1 Divers
Signalisation WNT Complexe majeur d'histocompatibilité MHC/HL A
Récepteur- protéine 5-relié de lipoprotéine de basse densité. LPR5 Apoliprotéine E APOE Voies de l'homéocystéine Reductase de méthylène TétraHydroFolate MTHFR
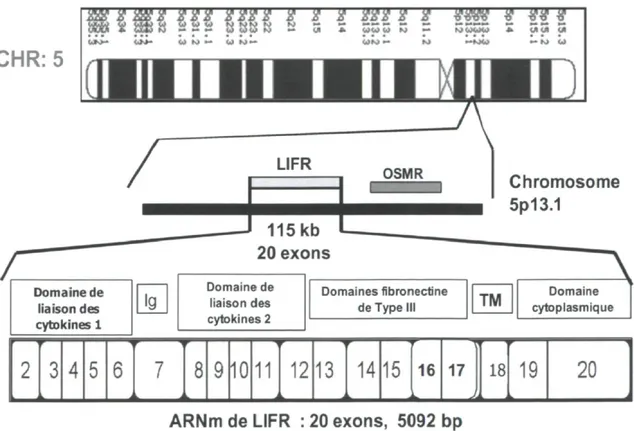
1.5: Leukemia Inhibitory Factor receptor (LIFR). 1.5.1 : La structure génomique et protéique de LIFR.
Le gène de LIFR est localisé sur le chromosome 5pl3.1 [112] et est situé près du récepteur OSM (oncostatin M), un récepteur transmembranaire de la même famille. Le gène de LIFR couvre environ 115 kilobases et divise en 20 exons (voir figure 5) [113]. Aucun promoteur n'a été clairement identifié, mais une équipe américaine a indiqué l'existence possible de deux promoteurs. Le premier, spécifique pour les tissus placentaires, est juxtaposé au site d'initiation de la transcription et possède une région amplificatrice à -4800 paires de bases. Le deuxième, non spécifique et exprimé dans les cellules osseuses (U-2 OS), est situé en aval du premier site d'initiation de la transcription dans l'intron 1 [114]. Ces résultats restent cependant à confirmer à l'aide d'études fonctionnelles plus approfondies. L'ARN messager s'étend sur une longueur de 5092 paires de bases et la protéine finale est transmembranaire et contient 1097 acides aminés.
Figure 5 : Position génomique de LIFR, structure génique de son ARN messager et structure protéique de LIFR.
CHR: 5
'2 222 2222 2 2 2 222 2 2 *«W $22 2 ' W W W W N N M N N — — _•_-— — — _ _ _ _ — __ __. _ M «- " " W WW KJ — m » WWW M — W U U U * U<J* U fc»*- o » * . w M — U N — Domaine de liaison des cytokines 1 ig Chromosome 5p13.1 Domaine de liaison des cytokines 2 Domaines fibronectine de Type III TM Domaine cytoplasmique2 3
m
910 11 12 13 14 15 16
1718 19
20
22
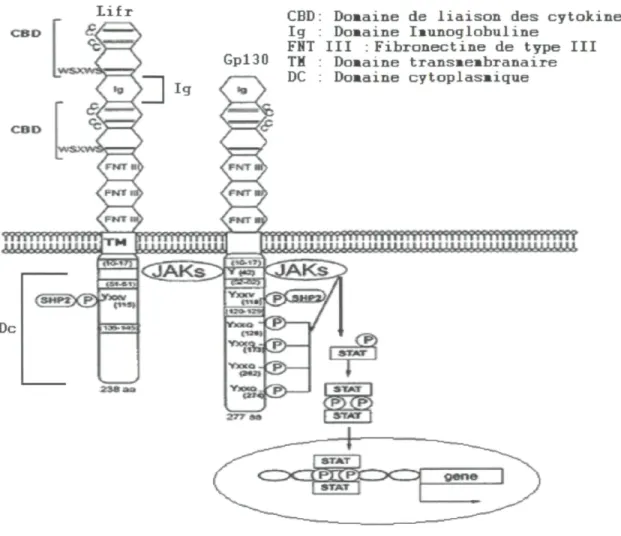
LIFR est un récepteur transmembranaire (Leukemia inhibitory factor) qui fait partie de la grande famille des récepteurs de la famille des cytokines de type I et du sous-groupe des récepteurs de cytokines de type 116, qui inclut les récepteurs de IL6 (interleukine -6), IL-11 (interleukine-11), OSM (oncostatine M), CNTF (facteur neurotrophique ciliaire) et CT-1 (cardiotrophine-1). LIFR partage plusieurs homologies de structure et de séquence avec ces récepteurs. LIFR contient 6 domaines différents : deux domaines de liaison des cytokines (CBD), un domaine immunoglobuline-ressemblant (Ig), trois domaines de fibronectine de type III (FNT III), un domaine transmembranaire et un domaine cytoplasmique (figure 6)). Les deux domaines de liaison des cytokines et le domaine immunoglobuline-ressemblant semblent être impliqués dans la liaison de LIFR et de son ligand principal LIF [116]. On ignore la fonction des domaines de fibronectine de type III. LIFR ne possède pas d'activité tyrosine kinase intrinsèque, mais son domaine cytoplasmique possède des tyrosines phosphorylables. Ces tyrosines permettent l'attachement des domaines SH2 des protéines Stat et servent d'intermédiaires à la signalisation cellulaire via le système Jak-STAT [117].
Figure 6 : Structure protéique de LIFR et de son corécepteur Gpl30, ainsi que les mécanismes de la réponse cellulaire via la voie Jak-STAT. [117]
Lifr
Gpl30
CBD: Domaine de liaison des cytokines Ig : Domaine Imunoglobuline
FHT III : Fibronectine de type III TM : Domaine transmembranaire DC : Domaine cytoplasmique
La codimérisation avec son co-récepteur gpl30 est essentielle pour initier la réponse cellulaire en permettant l'activation de jakl et jak2, suivie de la phosphorylation des tyrosines des domaines cytoplasmiques des deux récepteurs et finalement l'initiation de la cascade de phosphorylation du système Jak-STAT [117].
Une forme soluble de ce récepteur a été identifiée chez la souris [118] et chez l'humain [119]. La structure de la région exoplasmique est conservée, mais les parties transmembranaires et cytoplasmiques sont manquantes. Ce récepteur soluble origine du même gène que la forme membranaire et est le résultat d'un épissage alternatif qui introduit un codon stop prématurément [120]. Cette protéine tronquée a été détectée en grande quantité dans l'utérus et le foie, durant les premiers jours de la grossesse chez les muridés [121], ainsi que dans l'urine, le plasma et le placenta chez l'humain [119]. Le rôle de ce récepteur n'a pas été clairement démontré, mais le récepteur soluble des muridés se lie à LIF et inhibe son action in vivo et in vivo, en agissant comme un
![Figure 4 : Variation de la masse osseuse au cours de la vie d'un individu. [75]](https://thumb-eu.123doks.com/thumbv2/123doknet/7574834.230938/26.918.182.775.554.894/figure-variation-masse-osseuse-cours-vie-individu.webp)
![Tableau 1: Gènes candidats de l'ostéoporose et la densité osseuse [111].](https://thumb-eu.123doks.com/thumbv2/123doknet/7574834.230938/33.918.161.814.377.1114/tableau-gènes-candidats-ostéoporose-densité-osseuse.webp)

![Figure 8 : Description de 4 méthodes standards de génotypage : hybridation, ligation, extension d'ADN et enzyme de restriction [164]](https://thumb-eu.123doks.com/thumbv2/123doknet/7574834.230938/45.918.178.776.207.890/description-méthodes-standards-génotypage-hybridation-ligation-extension-restriction.webp)