HAL Id: dumas-01676754
https://dumas.ccsd.cnrs.fr/dumas-01676754
Submitted on 6 Jan 2018HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Transplantation hépatique avec greffons issus de
donneurs âgés : étude observationnelle monocentrique
sur 10 ans d’expérience
Mylène Defaye
To cite this version:
Mylène Defaye. Transplantation hépatique avec greffons issus de donneurs âgés : étude observa-tionnelle monocentrique sur 10 ans d’expérience. Médecine humaine et pathologie. 2017. �dumas-01676754�
1 Université de Bordeaux
UFR DES SCIENCES MEDICALES
Année 2017 Thèse N°3087
Thèse pour l’obtention du
DIPLOME D’ETAT de DOCTEUR en MEDECINE Spécialité ANESTHESIE-REANIMATION
Présentée et soutenue publiquement par
Mylène Maeva DEFAYE
Née le 20 août 1986 à Périgueux (24) Le 29 septembre 2017
TRANSPLANTATION HEPATIQUE AVEC GREFFONS ISSUS DE
DONNEURS AGES : ETUDE OBSERVATIONNELLE
MONOCENTRIQUE SUR 10 ANS D’EXPERIENCE
Directrice de thèse :
Madame le Docteur Stéphanie ROULLET
Rapporteur de thèse :
Madame le Professeur Catherine PAUGAM-BURTZ
Membres du jury :
Monsieur le Professeur Alexandre OUATTARA Président du jury
Madame le Professeur Laurence CHICHE Juge
Monsieur le Professeur Christophe LAURENT Juge
Madame le Dr Martine NEAU-CRANSAC Juge
2
REMERCIEMENTS
A notre président du jury, Monsieur le Professeur Alexandre OUATTARA
Vous m’avez fait l’honneur d’accepter la présidence de ce jury de thèse. Je vous remercie pour votre disponibilité et pour la confiance que vous m’avez accordée. Merci de m’avoir confortée dans mon envie d’exercer notre spécialité et des opportunités futures que vous m’offrez. Soyez assuré de ma sincère reconnaissance et de mon profond respect.
A notre rapporteur de thèse, Madame le Professeur Catherine PAUGAM-BURTZ
Je suis extrêmement honorée que vous ayez accepté de rapporter notre travail. Merci de m’avoir donné la possibilité de vivre une expérience parisienne enrichissante et formatrice tant sur le plan professionnel que humain. Je vous remercie pour votre disponibilité et vos conseils. Veuillez recevoir l’expression de ma gratitude, de mon respect et de ma profonde admiration.
A Madame le Professeur Laurence CHICHE
Vous m’avez fait l’honneur d’accepter de juger notre travail. Votre expertise dans le domaine de la transplantation hépatique rend votre jugement précieux. Soyez assurée de ma profonde estime et de mon respect.
A Monsieur le Professeur Christophe LAURENT
Je vous remercie de m’avoir fait le plaisir et l’honneur de juger cette thèse. Merci pour vos explications détaillées au bloc opératoire toujours dans la bonne humeur alors même que vous étiez en train d’opérer et pour votre cours « la chirurgie pour les nuls ». Veuillez recevoir l’expression de ma gratitude, mon respect et ma profonde estime.
A Madame le Docteur Martine NEAU-CRANSAC
Tu m’as fait l’honneur d’accepter de juger cette thèse. Je te remercie pour ton expertise et ton implication dans ce travail. Merci pour tes nombreuses explications sur ce domaine obscur qu’est l’immunosuppression. Sois assurée de ma reconnaissance et de mon profond respect.
A Madame le Docteur Alice QUINART
Je suis très honorée que tu aies accepté de juger notre travail. Je tiens à te remercier pour ton enseignement et tes précieux conseils. Ces 6 mois au 5ème en ta compagnie m’ont confortée dans mon choix de travailler un jour dans le domaine de la transplantation hépatique. Sois assurée de ma gratitude et de mon amitié.
A notre directrice de thèse, Madame le Dr Stéphanie ROULLET
Je suis fière d’avoir travaillé à tes côtés et j’espère avoir été à la hauteur de tes attentes. Merci pour ta patience, ta rigueur et ton implication quelles que soient la question et l’heure de la journée. Pour ton investissement total dans ce travail sur les vieux foies ainsi que dans notre formation au quotidien, je tiens à t’exprimer ma reconnaissance et ma profonde admiration.
3
TABLE DES MATIERES
Introduction
4
Objectif du travail de thèse
19
Article original en cours de publication
20
Résumé de l’article
22
Introduction
24
Patients et méthodes
24
Résultats
26
Discussion
28
Conclusion
30
Références de l’article
31
Tableaux
35
Figures
41
Discussion des résultats
45
Conclusion
52
Bibliographie
53
4
INTRODUCTION
La première transplantation hépatique (TH) a été réalisée en 1963 par Thomas Starzl à Denver (1). Après une phase de développement, marquée par l’amélioration des techniques chirurgicales, des modalités d’anesthésie-réanimation péri-opératoires et du contrôle du rejet d’allogreffe, la transplantation hépatique est actuellement le traitement de référence de la majorité des maladies hépatiques au stade terminal. Elle devenue un acte courant avec une évolution exponentielle du nombre de greffes et d’excellents résultats (2).
Depuis les années 1980, les indications de TH se sont étendues. Les principales indications actuelles chez l’adulte sont le carcinome hépatocellulaire (CHC) (29,6% des nouveaux inscrits), la cirrhose alcoolique (27,9% des nouveaux inscrits), les cirrhoses virales B et C (respectivement 1,8 et 4,7%), l’insuffisance hépatique aiguë (5,6%), les pathologies biliaires (7,5%) et métaboliques (3,4%) et la retransplantation (8%) (3,4).
Environ 7000 TH sont réalisées chaque année en Europe dont plus de 1300 en France en 2015 avec, sur la période 2008-2010, une survie de 85% à un an et 73% à 5 ans.
Plusieurs progrès ont accompagné l’augmentation du nombre d’indications et ces excellents résultats : le développement des thérapeutiques immunosuppressives permettant une prévention efficace du rejet, la standardisation des politiques d’attribution des greffons (basée sur la gravité du receveur) et une politique active d’optimisation du taux de prélèvement contribuant à l’augmentation du pool de greffons. Ces avancées ont entrainé une augmentation constante du nombre d’inscrits sur liste d’attente de greffe hépatique.
Malheureusement, l’applicabilité de la TH reste limitée par la pénurie d’organes et, en l’absence de perspective d’alternative efficace à la TH pour le traitement des hépatopathies terminales, le principal défi reste l’optimisation du recrutement des greffons. Une fois le potentiel maximal du don atteint (sensibilisation de l’opinion publique, prélèvements à cœur arrêté, donneur vivant), l’expansion du pool d’organes devra passer par l’utilisation de greffons, qui, jusqu’à récemment, étaient considérés comme à haut risque de dysfonction voire de non fonction. Parmi ces greffons dits marginaux, l’augmentation de l’âge des donneurs semble être un moyen intéressant pour pallier la pénurie d’organes. Cependant, l’âge limite de prélèvement reste mal défini et de nouvelles études semblent nécessaires afin de permettre d’utiliser efficacement ces greffons.
5 Par ailleurs, chaque centre se doit d’évaluer ses propres performances afin de combiner les facteurs de risque reconnus au niveau national et international à ses facteurs de risque indépendants, pour permettre un appariement optimal des donneurs marginaux à certaines catégories de receveurs.
Après une revue rapide des indications de la TH, des notions de donneur idéal et marginal et de la physiopathologie du vieillissement du foie, nous présenterons notre travail qui a consisté en l’étude des résultats de la TH avec des greffons issus de donneurs âgés au CHU de Bordeaux.
6
Evolution des indications de transplantation hépatique :
L’année 1984 aura été, en France, un tournant pour les indications de la TH. En effet, auparavant, seuls étaient considérés pour la TH les patients « mourants » ou avec un pronostic de survie inférieur à quelques mois. Le changement majeur a été de proposer de transplanter les patients à un stade plus précoce dans l’histoire naturelle de leur maladie.
Dans les années 1985-1990, la cirrhose biliaire primitive et la cirrhose due au virus de l’hépatite B (5,6) étaient les principales indications de greffe, alors que la cirrhose alcoolique, considérée comme une maladie auto-infligée, restait une indication conflictuelle. La cirrhose virale C est progressivement devenue dans les années 1990-2000 la principale indication de TH en Europe. Initialement considérée à tort comme associée à un risque de récidive viral faible, la récidive est apparue par la suite comme un facteur limitant (7). Un accès récent plus large à de nouvelles thérapeutiques efficaces et bien tolérées tend à une éradication virale avant la greffe dans la majorité des cas et à une modification considérable de l’épidémiologie de cette pathologie. La TH s’est par la suite ouverte aux patients atteints de cirrhose alcoolique et c’est dans le cadre d’une prise en charge pluridisciplinaire qu’elle est devenue maintenant la deuxième indication de TH en France (28% des nouveaux inscrits) (4,8).
L’indication de TH pour CHC, initialement considérée comme excellente dans les années 1980, a connu des modifications importantes. Les premiers patients transplantés pour CHC avaient essentiellement des tumeurs volumineuses qui ne pouvaient être réséquées par hépatectomie partielle. La récidive du cancer et la faible survie post-transplantation ont freiné les indications et c’est seulement dans les années 1990 que les indications se sont affinées avec l’apparition des critères de Milan (un nodule unique de moins de 5 cm ou trois nodules de moins de 3 cm avec absence d’extension vasculaire) (9,10). Depuis 2012, les indications ont été de nouveau élargies avec de nouvelles règles d’accès à la TH pour les malades porteurs d’un CHC, prenant en compte notamment l’agressivité de la tumeur, la récidive et le délai d’inscription sur liste (11). Il s’agit donc actuellement de la principale indication de greffe en France depuis 2014 (30% des nouveaux inscrits) (4).
La cause la plus fréquente de pathologie hépatique dans les pays développés est la maladie stéatosique hépatique non liée à l’alcool, incluant les stéato-hépatites (NASH), qui est étroitement associée au syndrome métabolique. Cette pathologie peut évoluer à la fois vers une cirrhose et un cancer primitif du foie. Son incidence est en constante augmentation ce qui en fait actuellement une des indications de TH pour cancer les plus fréquentes aux Etats-Unis.
7 Pour finir, la TH a été indiscutablement une révolution dans le traitement des hépatites fulminantes (12) et a imposé la nécessité de déterminer tôt le pronostic de ces malades.
Il existe d’autres indications plus anecdotiques. Certaines maladies métaboliques et génétiques avec atteinte hépatique comme la maladie de Wilson, le déficit en alpha-1-antitrypsine, et l’hémochromatose peuvent être des indications de TH. Concernant les indications dans un cadre néoplasique, une TH peut être proposée à certains patients atteints de cholangiocarcinome (tumeurs de Klatskin) ou de métastase de tumeurs neuroendocrines (13). La TH pour des métastases hépatiques non résécables de cancers colorectaux (14) montre des résultats encourageant en terme de survie à 5 ans dans des séries pour l’instant rétrospectives et tend à devenir une nouvelle indication.
Ainsi, progressivement, l’évolution des indications de TH s’est faite par l’augmentation des transplantations dues au virus des hépatites B et C (VHB et VHC), actuellement en nette diminution, l’augmentation significative des TH pour cirrhose alcoolique et la transplantation de patients atteints de petits CHC (3).
Evolutions techniques :
Depuis les débuts de la TH, la transplantation orthotopique de foie total reste la technique de référence. Parmi les évolutions introduites ces 30 dernières années, on note l’utilisation de la circulation extracorporelle (15) (actuellement très peu utilisée), le passage de la technique du clampage cave total au clampage cave partiel, l’utilisation de liquides de conservation plus performants et l’amélioration des techniques anesthésiques. La technique du foie partagé (split) permet de greffer un greffon à deux patients (avec comme couple idéal un receveur pédiatrique pour le foie gauche et un receveur adulte pour le foie droit) (16). Plus récemment, la TH à donneur vivant s’est développée (17), mais nécessite une hépatectomie droite, responsable d’une morbidité de 3% chez le donneur, ce qui est un facteur limitant .
Evolution des résultats :
En matière de survie, les résultats se sont constamment améliorés passant de 20% de survie au des débuts des années 1980 à quasiment 90% de survie à un an actuellement (4). La récidive virale B est maintenant évitée par les traitements antiviraux (6) et les immunoglobulines anti-HBs ; la récidive virale C tend à diminuer depuis l’avènement des nouvelles molécules
8 antivirales. Le rejet chronique est désormais une complication rare en dehors du problème de rupture de compliance au traitement immunosuppresseur. A l’inverse, l’amélioration des résultats à un an a permis de mettre en lumière des complications de survenue plus tardive pouvant altérer la survie à moyen et long terme. Ces complications sont principalement en relation avec le problème de la récidive de l’alcoolisation après la TH, l’apparition de cancers de novo et la survenue de désordres métaboliques, cardiovasculaires et rénaux liés en particulier à un traitement immunosuppresseur au long cours.
La situation actuelle de la transplantation hépatique :
En 2015, 1355 greffes ont été réalisées en France et 7000 en Europe. La survie après TH en France chez les patients transplantés dans la période 2008-2010 est de 94% à 1 mois, 85% à 1 an et 73% à 5 ans, toutes indications confondues (4).
Règles d’attribution des greffons :
En 2007 en France, les règles d’attribution des greffons par l’Agence de la biomédecine ont été modifiées en profondeur. Ainsi, depuis mars 2007, les greffons sont attribués en dehors de certaines priorités (par exemple, la priorité dite de super-urgence pour les hépatites fulminantes ou les retransplantations en urgence), nominativement à un patient donné en fonction d’un score national. Ce score (4) intègre dans son calcul notamment le Model for End Stage Liver Disease score (MELD) (18,19) de gravité des cirrhoses couplé à la natrémie (MELD-Na) (20), la distance entre le centre de prélèvement et le centre de greffe mais aussi le type d’indication (notamment le CHC). Ce score foie privilégie donc principalement les patients ayant les hépatopathies les plus graves tout en prenant en compte d’autres paramètres. Il est en constante évolution avec pour objectif une réduction de la mortalité sur liste et de la mortalité post opératoire.
Evolution de la pénurie d’organes :
L’application de la TH est limitée, par nature, par l’inadéquation entre le nombre de greffons disponibles et le nombre de patients sur liste d’attente. Pour cette raison, il est indispensable de considérer les possibilités d’augmentation du nombre d’organes disponibles pour ajuster l’offre
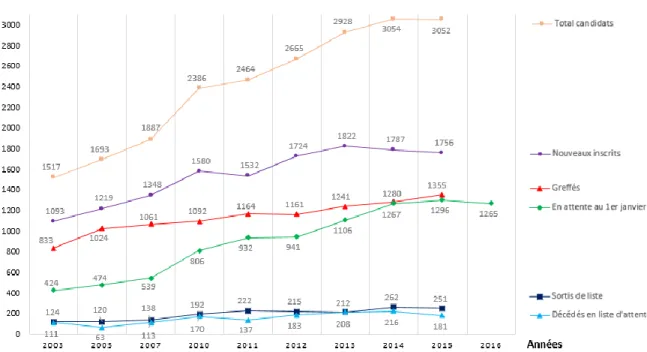
9 de soins à la demande. L’évolution du nombre de malades inscrits sur la liste nationale d’attente en vue d’une TH et celle du nombre de greffes réalisées annuellement depuis 2002 illustre la pénurie d’organes et les besoins de TH en France (figure 1). En effet, le nombre de patients inscrits sur liste d’attente a doublé entre 2002 et 2015 et le nombre de receveurs potentiels par greffon disponible est de 2,3 en 2015.
Malgré une augmentation régulière du nombre de prélèvements, qui est passé en France de 850 patients prélevés en 2002 à 1361 patients prélevés en 2015, seuls 57% des malades inscrits ont accès à la TH dans l’année suivant leur inscription et 72% sont greffés dans les 3 ans. Le pourcentage de décès sur liste d’attente reste stable aux alentours de 7% et le pourcentage de sortie de liste pour aggravation avoisine les 10% entre 2010 et 2015 (4).
La disparité croissante entre candidats à la TH et organes disponibles ne peut être mathématiquement atténuée qu’en augmentant le nombre de greffons, d’une part, et en développant des alternatives thérapeutiques à la TH d’autre part. L’augmentation du nombre d’organes disponibles est un enjeu majeur de santé publique qui a fait l’objet d’un plan d’action européen sur la période 2009-2015 (21).
L’un des principaux objectifs de ce programme est d’atteindre le potentiel maximal du don d’organes, de promouvoir ce don à partir de donneurs vivants et de sensibiliser l’opinion publique au prélèvement d’organes. L’expansion du pool de greffons, une fois le potentiel maximal du don atteint, devra passer par l’utilisation de greffons, qui, jusqu’à récemment, étaient considérés comme à haut risque de dysfonction, voire de non fonction. L’élargissement des critères de sélection à des donneurs marginaux pose les questions de la majoration du risque pour le receveur, de la limite au-delà de laquelle le risque n’est plus acceptable et de l’appariement optimal des donneurs marginaux à certaines catégories de receveurs.
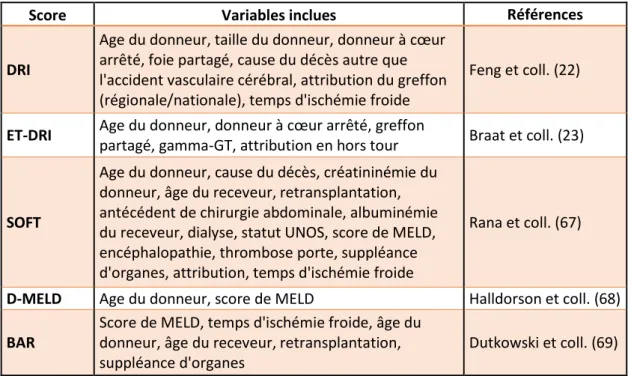
Les facteurs de risque de dysfonction du greffon sont actuellement mieux identifiés : âge du donneur, ethnie, taille ou indice de masse corporelle, cause de décès du donneur (traumatique versus cardiovasculaire), stéatose, temps d’ischémie froide, utilisation d’un greffon partiel, greffon hors tour (22,23). Ces données permettent d’envisager la construction d’un index de risque du donneur, qui combiné à l’évaluation du risque opératoire chez le receveur pourrait permettre d’identifier, pour un greffon donné, le receveur pour lequel le gain de survie apporté par la TH resterait très favorable. Le bien-fondé de ce concept doit cependant être validé avant généralisation et mise en place d’un système d’attribution des organes intégrant en temps réel les caractéristiques du greffon. De ce fait, un programme hospitalier de recherche clinique
10 (PHRC) national (OPTIMATCH) actuellement en cours a pour objectif de concevoir un modèle d’attribution des greffons afin d’optimiser le couple donneur-receveur et d’améliorer l’efficacité du système d’attribution français.
Figure 1. Evolution de la liste d’attente et devenir des candidats en greffe hépatiques (4).
Notion de donneur idéal et de donneur marginal :
Un donneur « idéal » est un donneur en état de mort encéphalique, âgé de moins de 40 ans, dont la cause de la mort est traumatique, dont l’hémodynamique est stable au moment du prélèvement, qui n’a pas de stéatose ni d’autre lésion parenchymateuse chronique sous-jacente et qui n’a pas de maladie transmissible (22). Pour un donneur « idéal », le risque de non-fonction ou de dysfonction du greffon conduisant au décès ou à la retransplantation est inférieur à 5 %. Par définition, un donneur marginal est un donneur dont une ou plusieurs des caractéristiques diffèrent de celles d’un donneur idéal. Les donneurs marginaux sont un groupe mal défini qui inclut principalement les donneurs âgés (sans limite d’âge précise), les donneurs avec une hypernatrémie, les greffons avec une stéatose macrovésiculaire supérieure à 30%, les donneurs avec une sérologie virale B ou C positive, le temps d’ischémie froide de plus de 12 heures, les donneurs à cœur arrêté, les greffons partagés et les greffons issus de donneurs vivants (2,22– 25). Certains facteurs qui n’affectent pas le risque de dysfonction du greffon, tels que les maladies transmissibles, doivent être pris en compte dans la définition du donneur marginal. A
11 l’inverse, des facteurs indépendants du donneur liés à des difficultés techniques survenant après le prélèvement par exemple, ne doivent pas être pris en compte dans cette définition.
Age des donneurs et des receveurs :
Parmi les évolutions, on note un vieillissement régulier de l’âge des donneurs de greffons hépatiques et de l’âge des receveurs. En France, en 2015, 19% des greffons provenaient de donneurs entre 56 et 65 ans et 35% de donneurs âgés de plus de 65 ans. La moyenne d’âge des donneurs était de 55,3 ans. L’élévation de l’âge des donneurs est également constatée au niveau européen (figure 2). En France, 43% des receveurs avaient entre 56 et 65 ans et 10% plus de 66 ans pour une moyenne d’âge des receveurs de 52 ans (4). Le vieillissement de la population des receveurs est expliqué par plusieurs éléments : d’une part l’allongement de la durée de vie en France, d’autre part, les indications majoritaires de transplantation (CHC, cirrhose alcoolique) qui touchent des populations souvent âgées de plus de 60 ans. Le vieillissement de l’âge des donneurs est dû aux modifications de l’épidémiologie des donneurs avec une diminution significative des décès par accident de la voie publique et traumatisme crânien et une augmentation des décès par accident vasculaire cérébral. Le foie est considéré comme un organe résistant bien au vieillissement. Cependant, le vieillissement est associé à des modifications physiopathologiques susceptibles d’avoir un impact sur le devenir du receveur.
12
Physiopathologie du vieillissement du foie :
Le vieillissement est associé à une altération progressive de la structure et de la fonction hépatique, ainsi qu’à diverses modifications hépatocytaires et endothéliales. Il peut également accroître les risques de maladie hépatique sous-jacente.
- Vieillissement et volume hépatique, flux sanguin et fonction
Les greffons provenant de donneurs âgés peuvent être considérés comme sub-optimaux, en comparaison avec des greffons provenant de patients plus jeunes, du fait d’une taille plus petite. D’après des études basées sur l’échographie, le volume du foie diminue de 20 à 40% avec l’âge. Ces changements sont liés à une diminution du flux sanguin hépatique qui diminue d’environ 35% chez les patients de plus de 65 ans, comparés aux patients de moins de 40 ans (26). D’autres études suggèrent une diminution non pas du volume total du foie mais de la masse de cellules hépatiques fonctionnelles (27).
Les résultats concernant les marqueurs biologiques de la fonction hépatique ainsi que les différentes enzymes sont mitigés. La bilirubinémie et l’albuminémie sont décrites comme stables ou très légèrement abaissées. Les transaminases sont peu modifiées par l’âge mais les niveaux sériques de phosphatases alcalines (Pal) et de gamma-glutamyltransférase (gamma-GT) s’élèvent avec le vieillissement (28).
Le volume de graisse et de cholestérol du foie ainsi que le taux de cholestérol sanguin augmentent progressivement avec l’âge et son métabolisme diminue de 35%. Dans une étude publiée en 2012, Tanemura et coll. ont décrit une proportion plus importante de stéatose (41% versus 13%) sur des greffons provenant de donneurs âgés de plus de 50 ans (lobe droit de patients donneurs vivants) (29).
D’autres changements peuvent limiter l’utilisation de l’oxygène et d’autres composants. L’une des fonctions importantes du foie est sa capacité anti-oxydante, supportée par la glutathion réductase. Cette enzyme diminue avec l’âge (30). De plus, le contenu en cytochrome P450 des cellules hépatiques est abaissé de plus de 30% après 70 ans (26).
- Vieillissement et cellules hépatiques
Les changements liés au vieillissement des hépatocytes incluent des modifications du volume cellulaire. En effet, le nombre d’hépatocytes semble diminuer alors que leur taille augmente. Les noyaux sont polypoïdes et augmentés de volume, le réticulum endoplasmique est plus petit et le nombre de mitochondries est abaissé. Il existe par ailleurs une accumulation de lipofuscine
13 à l’intérieur des cellules hépatiques. Elle est liée à des agrégats de protéines endommagées par du stress oxydatif non dégradées à l’intérieur des cellules hépatocytaires et provoque une augmentation de la génération de dérivés réactifs de l’oxygène dans les cellules et une survie cellulaire réduite (31). En raison du vieillissement, la polyploïdie tend à se produire plus fréquemment au fil du temps et s’accompagne d’une diminution du nombre et d’un dysfonctionnement des mitochondries, qui entrainent une baisse de la synthèse d’ATP (32,33). La réduction du réticulum endoplasmique est de son côté responsable d’une réduction de la synthèse des protéines microsomales dans le foie (34).
Les données concernant les autres types cellulaires sont plus pauvres. Certaines études suggèrent que le vieillissement entraine un changement morphologique des cellules endothéliales sinusoïdales. Leur largeur est augmentée de 50% alors que le nombre et la taille de leur fenestration sont diminués. Cela peut entrainer le dépôt de lipoprotéines dans le foie et perturber l’élimination des substances accumulées (34). L’endocytose est elle aussi perturbée avec l’âge et est responsable d’un dépôt de produits circulants pouvant augmenter le risque de pathologies telles que le diabète, l’athérosclérose et les maladies neurodégénératives (35).
- Insuffisance hépatique aiguë et régénération hépatique
Les changements liés au vieillissement, y compris l’augmentation du stress oxydatif et de la réponse inflammatoire, la sénescence cellulaire accélérée et le dysfonctionnement organique progressif affectent de manière significative les réponses cellulaires aux agressions (36). Les lésions hépatiques étaient plus importantes chez des rats âgés comparés à des rats plus jeunes dans des modèles murins d’insuffisance hépatique aiguë. Cela peut être lié à une réparation insuffisante et à l’augmentation des lésions liées à l’exposition à l’agent toxique (37).
En outre, le vieillissement du foie diminue la capacité de régénération, ce qui retarde la restauration de la fonction hépatique. La régénération hépatique peut être déclenchée par plusieurs stimuli tels que la résection chirurgicale ou l’exposition à des toxiques. Contrairement aux foies d’animaux plus jeunes, les foies d’animaux plus âgés présentent une réduction significative de prolifération en réponse à une agression ou à une résection (38). Plusieurs voies de transduction du signal ont été impliquées dans la réduction de la capacité de régénération hépatique comme le montrent des études récentes.
14 - Fibrose hépatique
La fibrose hépatique est la conséquence d’une cicatrisation excessive secondaire à une agression hépatique chronique (39). Au stade terminal de fibrose hépatique, la cirrhose, la destruction de l’architecture normale du foie et la perte des hépatocytes altèrent les fonctions de synthèse et les fonctions métaboliques du foie. L’âge est considéré comme un facteur de risque de progression de la fibrose dans l’hépatite virale C et les hépatites alcooliques aiguës sévères (40,41). Il a donc été suggéré que l’âge augmentait la susceptibilité à la fibrose hépatique. Les mécanismes pouvant expliquer cette prédisposition sont mal connus et des résultats discordants ont été publiés. L’âge est généralement associé à une augmentation du stress oxydatif et à une mauvaise tolérance aux dommages oxydatifs. Dans une étude retrouvant une augmentation de la fibrose en réponse à une agression hépatique aiguë chez les souris âgées, les marqueurs du stress oxydatif n’étaient pas significativement augmentés entre les souris jeunes et âgées. Le principal facteur de susceptibilité à la fibrose retrouvé dans cette même étude était une réponse inflammatoire accrue, composée principalement de lymphocytes T CD4 et de macrophages (42). L’étude de Collins publiée en 2013 montrait une fibrogénèse plus importante en réponse à une agression chronique chez des rats âgés comparés à des rats plus jeunes. Cette fibrogénèse exacerbée semblait là aussi être liée au recrutement des macrophages (43).
Malgré ces modifications physiopathologiques, le foie est considéré comme un organe résistant bien à l’âge. De nombreuses études suggèrent finalement que la fonction de synthèse du foie n’est que peu ou pas affectée par le vieillissement du fait d’une bonne fonction de réserve, de sa double vascularisation et de ses capacités de régénération qui sont bien au-delà de ses besoins métaboliques (44).
La non fonction du greffon est finalement une complication rare après utilisation de greffons provenant de donneurs âgés de plus de 60-70 ans.
Cependant, l’impact de l’âge du donneur sur le devenir du receveur nécessite d’être évalué. L’âge limite de prélèvement reste mal défini et de nouvelles études semblent nécessaires afin de permettre d’utiliser efficacement ces greffons, d’autant que des travaux récents retrouvent des résultats contradictoires.
15
Résultats prometteurs mais controversés de l’utilisation de greffons issus de donneurs âgés :
Comme cité précédemment, l’âge moyen des donneurs a augmenté en France comme dans la plupart des autres pays d’Europe et aux Etats-Unis. Il n’existe pas de limite formelle concernant l’âge du donneur en transplantation hépatique. Des greffons prélevés chez des donneurs de plus de 80 ans peuvent être transplantés avec d’excellents résultats. L’étude d’Anderson et coll. incluait 741 patients dont 91 patients receveurs de greffons de plus de 60 ans et 650 patients receveurs de greffons âgés de moins de 60 ans. La survie globale à 1, 3 et 5 ans dans le groupe donneurs âgés était respectivement de 86,8%, 72,6% et 67,6% et n’était pas statistiquement différente de la survie du groupe donneurs de moins de 60 ans (87,1%, 81,8% et 75,5%, p = 0,39). La survie du greffon à 1, 3 et 5 ans était de 82,4%, 81,8% et 62,5% dans le groupe des patients recevant des greffons de plus de 60 ans et ne différait pas significativement de celle de l’autre groupe (84%, 78,6% et 72,3%, p = 0,39) (45). Jimenez-Romero et coll. ont analysé la survie à long terme de patients ayant bénéficié d’une transplantation hépatique à partir de greffons issus de donneurs de plus de 70 ans. Les patients étaient divisés en 3 groupes (âge du donneur de plus de 60 ans, de 60 à 70 ans et de 70 ans et plus). Il n’y avait pas de différence statistiquement significative entre les groupes en termes de survie globale et de survie du greffon à 1, 3 et 5 ans (p = 0,54 et 0,70 respectivement) (46). Borchert et coll. ne retrouvaient par ailleurs pas de différence en ce qui concerne la fréquence de retransplantation ou de rejet entre des donneurs âgés de plus de 70 ans et des donneurs plus jeunes (47). Une autre étude rétrospective monocentrique parue en 2014, a comparé 4 groupes de patients (moins de 60 ans, 60 à 69 ans, 70 à 79 ans et plus de 80 ans) et n’a pas retrouvé de différence statistiquement significative en terme de survie du greffon à 1 et 5 ans (p = 0,065), à l’exception d’un sous-groupe de receveurs porteurs du VHC ayant bénéficié d’un greffon de plus de 80 ans (48). Cependant, certaines sociétés savantes estiment que l’utilisation de greffons marginaux âgés constitue un facteur de risque indépendant de dysfonction primaire du greffon, de reprise de fonction retardée, de perte du greffon et de mortalité. Ainsi, Feng et coll. ont identifié un âge du donneur supérieur à 60 ans comme facteur de risque indépendant de perte du greffon (RR = 1,53, p < 0,0001) (22). L’étude de Selzner retrouvait également une diminution significative de la survie du greffon mais aussi de la survie globale à 1, 3 et 5 ans chez les receveurs transplantés avec des greffons de plus de 60 ans (p < 0,0002 et p < 0,003 respectivement) (49). Une étude prospective de Serrano et coll. a inclus 149 cas de premières TH réalisées entre 2000 et 2005 dont 47 réalisées à partir de donneurs de plus de 60 ans. Il n’y avait pas de différence
16 significative en termes de rejet aigu ou chronique et de complications vasculaires ou anastomotiques biliaires. Les complications à type de sténose biliaire non-anastomotique étaient en revanche clairement plus fréquentes dans le groupe donneurs âgés (17% contre 4,9%, OR = 3,9, p = 0,025). La survie du greffon à un an était de 86,7% dans le groupe donneurs jeunes contre 71,4% dans le groupe donneurs âgés (p < 0,05) mais il n’y avait pas de différence de survie globale. L’âge du donneur (supérieur ou égal à 60 ans) était aussi associé au risque de sténose biliaire intrahépatique non ischémique en analyse multivariée (OR = 15,4, p = 0,024) (50). D’autres complications ont également été rapportées. Dans l’étude de Stewart, l’âge du donneur supérieur à 50 ans a été identifié comme facteur favorisant la perte du greffon par thrombose de l’artère hépatique (RR = 1,45, p < 0,001) avec un risque augmentant de façon proportionnelle avec l’âge du greffon (jusqu’à une augmentation de 61% pour les greffons de plus de 70%, RR = 1,61, p < 0,001) (51).
L’âge a un impact particulièrement marqué chez les receveurs ayant une infection par le virus de l’hépatite C. Plusieurs études ont clairement montré que la récidive de l’hépatite C est plus sévère et que la fibrose est plus rapidement évolutive lorsque le donneur est âgé (52–56). La majoration du risque semble exister dès que l’âge du donneur excède 40 ans (55). Dans une étude rétrospective menée par Selzner et coll. incluant 201 patients atteints d’une hépatite virale C (46 cas de donneurs vivants, 155 cas de donneurs cadavériques), il existait une corrélation significative entre l’âge du donneur et la progression de la fibrose après TH. Le risque relatif de développer une fibrose sévère (score Métavir supérieur ou égal à 3) pour un donneur de 45 ans et plus était de 8,1 (p = 0,001). Les auteurs concluaient à un bénéfice de choisir un greffon plus jeune dans les indications de TH pour une cirrhose virale C (52). Une autre étude identifiait l’infection par le VHC comme un facteur de risque indépendant de perte du greffon et de mortalité chez les patients receveurs d’un greffon de plus de 60 ans (p < 0,02, HR = 3). La survie globale et la survie du greffon à 1, 3 et 5 ans des patients atteints d’une hépatite C étaient plus faibles chez les receveurs de greffons âgés de 60 ans et plus (p < 0,05 et p < 0,009 respectivement) (49). Les mécanismes impliqués dans l’interaction entre l’âge du donneur et la sévérité de la récidive virale C n’ont pas été clairement identifiés. Empiriquement, on évite généralement de transplanter des receveurs jeunes avec des greffons prélevés chez des donneurs âgés. Toutefois, en dehors du cas particulier de l’hépatite C, il n’a pas été identifié de population à haut risque vis-à-vis des donneurs âgés.
Malgré les complications décrites ci-dessus, l’utilisation de greffons provenant de donneurs âgés semblent être une perspective intéressante pour augmenter le pool d’organes disponibles
17 et diminuer la mortalité sur liste d’attente de transplantation. Plusieurs équipes ont ainsi optimisé l’utilisation de ces greffons en sélectionnant les couples donneurs-receveurs en fonction de différents facteurs de risque liés au receveur, afin d’améliorer au maximum la survie globale des patients et de leur greffon. Segev et coll. ont de cette façon divisé leurs receveurs en 2 groupes, sélectionnés ou non selon les caractéristiques suivantes : première TH, 45 ans et plus, IMC < 35, OMS 1, durée d’ischémie froide de moins de 8h, indication autre que la cirrhose virale C. La survie des patients et des greffons après TH a ensuite été comparée entre 3 différentes tranches d’âge : donneur âgé de plus de 70 ans, donneur âgé de moins de 70 ans et donneur idéal de moins de 40 ans. Les résultats ne retrouvaient pas de différence significative de survie globale ou de survie du greffon à 3 ans après une sélection soigneuse du receveur. En revanche, en l’absence de critères de sélection du receveur, les taux de survie globale et de survie du greffon étaient significativement diminués dans le groupe de greffons les plus âgés, comparativement aux 2 autres groupes (respectivement 50,4%, 70,7% et 74,7%, p < 0,001 et 64,4%, 77,4% et 80%, p < 0,001) (57).
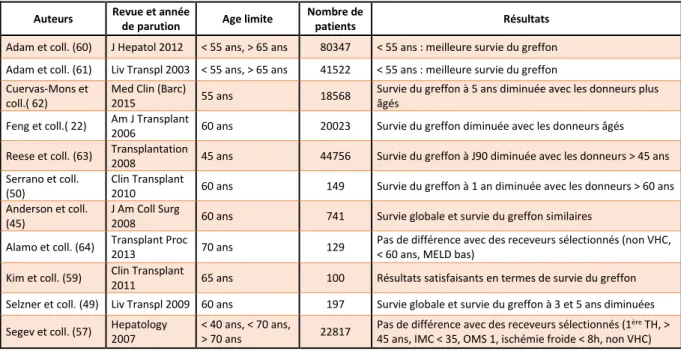
De façon similaire à la sélection soigneuse des receveurs, les conditions du greffon doivent elles aussi être optimisées dans le but d’obtenir de meilleurs résultats. Cascales et coll. ont retrouvé d’excellents résultats chez 11 patients transplantés avec des greffons âgés de plus de 75 ans (âge moyen de 77,3 +/- 2 ans) et un temps d’ischémie froide de moins de 5 heures dans la majorité des cas (270 +/- 76 minutes) (58). Ces résultats suggèrent l’importance d’un temps d’ischémie froide le plus court possible pour la récupération des vieux foies. Une étude rétrospective allemande a rapporté les résultats de 230 TH dont 54 réalisées à partir de donneurs de plus de 65 ans. La mortalité à 1 an était de 22,2% versus 19,5% chez les receveurs ayant bénéficié de greffons de moins de 65 ans (p non significatif). Les auteurs suggéraient qu’une courte durée d’ischémie froide était un facteur pronostic fondamental pour les greffons âgés. Dans cette étude, le temps d’ischémie froide était de moins de 9 heures. Kim et coll. ont évalué les différents facteurs de risque de perte du greffon après des TH utilisant des greffons de plus de 65 ans. Quatre facteurs de risque ressortaient en analyse multivariée : l’infection virale C, un score de MELD > 20, une hyperglycémie supérieure à 2 g/L au moment du prélèvement et une durée de plus de 40 minutes entre l’incision et le clampage aortique (p = 0,04). La survie du greffon à 5 ans en l’absence de ces facteurs de risque était de 100%. En présence d’un, deux, trois ou quatre facteurs de risque, elle était respectivement de 82%, 81,7%, 39,3% et 25% (p < 0,05) (59). De bons résultats peuvent donc être obtenus avec des greffons âgés après une sélection appropriée des receveurs. Le tableau 1 reprend les résultats de ces différentes études.
18
Auteurs Revue et année
de parution Age limite
Nombre de
patients Résultats Adam et coll. (60) J Hepatol 2012 < 55 ans, > 65 ans 80347 < 55 ans : meilleure survie du greffon Adam et coll. (61) Liv Transpl 2003 < 55 ans, > 65 ans 41522 < 55 ans : meilleure survie du greffon Cuervas-Mons et
coll.( 62)
Med Clin (Barc)
2015 55 ans 18568
Survie du greffon à 5 ans diminuée avec les donneurs plus âgés
Feng et coll.( 22) Am J Transplant
2006 60 ans 20023 Survie du greffon diminuée avec les donneurs âgés Reese et coll. (63) Transplantation
2008 45 ans 44756 Survie du greffon à J90 diminuée avec les donneurs > 45 ans Serrano et coll.
(50)
Clin Transplant
2010 60 ans 149 Survie du greffon à 1 an diminuée avec les donneurs > 60 ans Anderson et coll.
(45)
J Am Coll Surg
2008 60 ans 741 Survie globale et survie du greffon similaires Alamo et coll. (64) Transplant Proc
2013 70 ans 129
Pas de différence avec des receveurs sélectionnés (non VHC, < 60 ans, MELD bas)
Kim et coll. (59) Clin Transplant
2011 65 ans 100 Résultats satisfaisants en termes de survie du greffon Selzner et coll. (49) Liv Transpl 2009 60 ans 197 Survie globale et survie du greffon à 3 et 5 ans diminuées Segev et coll. (57) Hepatology
2007
< 40 ans, < 70 ans,
> 70 ans 22817
Pas de différence avec des receveurs sélectionnés (1ère TH, >
45 ans, IMC < 35, OMS 1, ischémie froide < 8h, non VHC)
19
OBJECTIF DU TRAVAIL DE THESE
L’utilisation de greffons provenant de donneurs âgés est débattue par les différents auteurs, notamment du fait de certains résultats négatifs sur la survie globale des patients. Augmenter l’âge des donneurs semble malgré tout une solution intéressante à l’actuelle pénurie de transplants mais l’âge limite de prélèvement reste mal défini. La plupart des études compare généralement deux groupes : greffons issus d’un donneur idéal de moins de 40 ans et greffons provenant d’un donneur âgé de plus de 65 ou 70 ans. Peu d’auteurs se sont intéressés spécifiquement à des donneurs plus âgés. Dirican et coll. rapportent des résultats mitigés à propos de 13 TH à partir de greffons de plus de 80 ans tandis que les résultats de Ghinolfi sont meilleurs.
L’objectif de notre travail était de rapporter l’expérience en transplantation hépatique du CHU de Bordeaux entre 2005 et 2014 avec des greffons provenant de donneurs âgés et très âgés. Les résultats à court, moyen et long terme ont comparé l’utilisation de 27 greffons issus de donneurs de plus de 80 ans à ceux de donneurs plus jeunes stratifiés en fonction de l’âge, de moins de quarante à plus de 80 ans.
20
ARTICLE ORIGINAL EN COURS DE PUBLICATION
21
Liver transplantation with old grafts: a ten years’ experience
Stéphanie Roullet MD,1,3 Mylène Defaye,1 Alice Quinart MD,1 Jean-Philippe Adam MD,2
Laurence Chiche MD PhD,2 Christophe Laurent MD PhD, 2 and Martine Neau-Cransac MD4
1. Department of Anesthesia and Intensive Care and Liver Transplantation Unit
2. Department of Digestive Surgery and Liver Transplantation Unit
3. Inserm UMR 12-11, Bordeaux, France
4. Department of Hepatology and Liver Transplantation Unit
CHU Bordeaux, Hôpital Haut-Lévêque, 1 avenue de Magellan, 33600 Pessac, France Corresponding author:
Stéphanie Roullet
Anesthésie-réanimation digestive et Transplantation hépatique Service d'Anesthésie Réanimation II
CMC Magellan – Hôpital Haut-Lévêque 1 avenue de Magellan
33604 Pessac Cedex France
e-mail: stephanie.roullet@chu-bordeaux.fr
Tél: +33557656866
Fax: +33557656811
E-mail addresses:
alice.quinart@chu-bordeaux.fr; jean-philippe.adam@chu-bordeaux.fr; laurence.chiche@chu-bordeaux.fr; christophe.laurent@chu-bordeaux.fr; martine.neau-cransac@chu-bordeaux.fr
The authors declare no conflicts of interest.
22
Abstract
Background. The persistent scarcity of donors has prompted liver transplantation (LT) teams to find solutions for increasing graft availability. We report our experience of LT performed with grafts from older donors, especially over 70 and 80 years-old.
Patients and methods. We analyzed our prospectively maintained single-center database from 1st January 2005 to 31st December 2014, with 380 LT performed in 354 patients. Six groups were composed according to donor age: under 40 (n=84), from 40 to 49 (n=67), from 50 to 59 (n=62), from 60 to 69 (n=76), from 70 to 79 (n=64) and 80 years and over (n=27).
Results. Donors under 40 had a lower BMI, died more often from trauma, and more often had cardiac arrest and high transaminase levels. In contrast, old donors (≥70) died more often from stroke. Recipients of grafts from donors under 50 were more frequently infected by hepatitis C virus, recipients of oldest grafts more often had hepatocellular carcinoma. Cold ischemia time was the shortest in donors over 80. Patient survival was not significantly different between the groups. In multivariate analysis, factors predicting graft loss were transaminase peak, retransplantation and cold ischemia time but not donor age.
Conclusion. Older donors over 70 years and over 80 years could provide excellent liver grafts.
23
Research Highlights
- We analyzed 380 liver transplantations (LT) performed between 2005 and 2015 - 16.8% of the donors were older than 70 years and 7% older than 80 years - Results of LT with grafts from carefully selected old donors were excellent
24
Introduction
The persistent scarcity of organ donors resulting in longer delays on waiting lists for recipients has led liver transplantation (LT) teams to find solutions for increasing graft availability, one of which is to use grafts from extended criteria donors (ECD). However, the definition of ECD is still not clear and includes clinical and biological characteristics such as age over 60 or 65 years, non-heart-beating donors, split or partial grafts, hepatitis C or B positive serology, liver test abnormalities and liver steatosis, hypernatremia, length of stay in intensive care unit (ICU) over 7 days, hemodynamic instability, and cold ischemia time (CIT) over 12 hours (1-4). The impact of donor age on graft and recipient survival has been found to be negative (5 6) or to have no impact (7). Little is known about the age limits for being a donor and most of the studies have compared two groups: ideal donor under 40 years old and older donors over 65 or 70 years old but with few other details (4-9). Few studies focused specifically on elderly donors. Dirican reported the mitigated results of 13 LT with grafts from donors over 80 (10), whereas results of Ghinolfi et al were better (11). The most important issue when grafts from old or very old donors are transplanted is to make sure that donors’ and recipients’ characteristics are taken fully into consideration (8 9).
We report our experience of liver transplantations performed from 2005 to 2014 with grafts from older donors, of which 27 from donors over 80 years old, and compare early and late liver transplantation outcome with younger donors stratified by age from under 40 years old to over 80 years old.
Patients and methods
We retrospectively analyzed our single-center prospectively maintained database (CNIL declaration number 1478500 v 0) from 1st January 2005 to 31st December 2014.
Donor selection
Criteria for determining organ suitability were clinical (age, sex, BMI, cause of death, length of time in ICU before organ procurement, use of vasopressors, occurrence of cardiac arrest, medical history), biological (aspartate–aminotransferases (ASAT), alanine-aminotransferase (ALAT), total bilirubin, - glutamyl transferases (GT) and alkaline phosphatase (AP),
25 prothrombin time (PT), viral or bacterial infection) and radiological (total body non-enhanced and non-enhanced computed tomography (CT)). In the beginning of our experience and until 2011, we systematically carried out a liver biopsy in donors over 70 years old before graft procurement to evaluate fibrosis and steatosis. In the event of fibrosis over stage 2 associated with macrovacuolar steatosis involving over 30% of the hepatocytes, procurement was not performed. Since 2011, we have been particularly attentive to the liver-to-spleen attenuation ratio on CT images. We previously reported its value for evaluating liver steatosis (12). Finally, we were highly selective when analyzing donors over 70 years old.
Recipients
Age, sex, indication for liver transplantation, MELD score, hemodialysis, mechanical ventilation support, ICU hospitalization before liver transplantation, total surgery duration, CIT and intraoperative blood transfusions were evaluated. DRI (13) and BAR (14) scores were calculated. Our upper limit of age to establish an indication for liver transplantation was 70 years-old.
Liver transplantation was performed using the piggy-back technique without venovenous bypass from 2005 to 2013. Thereafter lateral cavo-cave anastomosis was performed. A liver reperfusion biopsy was systematically performed.
After transplantation, liver function was assessed by biological liver parameters (ASAT, ALAT, total bilirubin, GT, PA, PT and factor V). Hepatic ultrasound echography was performed at day 1 post- transplantation. Enhanced hepatic CT and cholangiography by T-tube were performed at day 7 post- transplantation. Cholangiography was also controlled at month 3 post-transplantation before T-Tube ablation.
The immunosuppressive regimen comprised tacrolimus, mycophenolate mofetil and corticosteroids. Steroids were discontinued at month 3 post-transplantation except for patients transplanted for auto- immune hepatic disease. Basiliximab or lymphocyte anti-globulins were added in the event of renal dysfunction before transplantation, retransplantation or pre-formed donor-specific anti-HLA antibodies. Early allograft dysfunction (EAD) was defined according to the criteria published by Kolthoff (15).
Statistical analysis
Quantitative data are presented as median (IQ 25-75) and were compared with the Kruskal-Wallis test and multiple pair comparisons. Qualitative data are presented as numbers (%) and
26 were compared with the Chi-square test or Fisher exact test when appropriate. Survival data were analyzed with Kaplan- Meier analysis and compared with the log-rank test. Univariate and multivariate analyses (logistic regression including factors with p<0.2 in the univariate analysis) were performed for prediction of graft loss. All statistical tests were performed using commercially available statistical software (XLSTAT 2016, Addinsoft, Paris, France).
Results
Three hundred and eighty-seven LT were performed from 1st January 2005 to 31st December 2014. We excluded from the analysis one living-donor LT and six patients who died the day of the LT. Therefore 380 LT in 354 patients were analyzed.
Donors
Between 2005 and 2014, median donor age increased from 53 (18-75) to 59 (21-88) years (p<0.001). There were no donors over 80 years old in 2004 and 6/59 (10%) in 2014. Finally, 64/380 (16.8%) donors were older than 70 years and 27/380 (7%) older than 80 years (Figure 1). Six groups were composed according to donors’ age: under 40 years (group I), from 40 to 49 years (group II), from 50 to 59 years (group III), from 60 to 69 years (group IV), from 70 to 79 years (group V) and 80 years and over (group VI).
Donors’ characteristics are shown in Table 1. Between the groups, BMI, causes of death, length of ICU stay before death, history of cardiac arrest and maximum ASAT or ALAT levels were significantly different. Indeed, young donors (group I) had a lower BMI, died more often from trauma, and more often had cardiac arrest and higher transaminase levels. In contrast, old donors and especially very old donors (groups V and VI) died more often from stroke but had no cardiac arrest or high transaminase levels. Moreover, very old donors received lower doses of vasopressors and stayed for a shorter period in the ICU before organ procurement.
Recipients
The median follow-up after transplantation was 43 (24-78) months. Clinical characteristics of recipients are summarized in Table 2.
There was no statistical difference between donor groups with regard to age of recipients, MELD score or SAPS II score but time on waiting list was much longer in oldest donor group. Recipients who received graft from donors under 50 years old (group I and II) were more frequently infected by hepatitis C virus than groups V and VI (35% and 42% versus 11% and
27 7%, p<0.001). Recipients of grafts from the oldest donors more often had hepatocellular carcinoma (HCC) than groups I and II but this was not statistically significant (41% and 52%
versus 39 and 24%, p= 0.15).
Concerning surgical procedure, CIT was 420 (315-562) min for group I, 480 (355-627) min for group II, 450 (296-584) min for group III, 436 (290-627) min for group IV, 405 (265-577) min for group V and 316 (242-415) min for group VI (p=0.03). Median CIT was significantly shortened during the study period, decreasing from 525 (427-642) to 270 (195-337) min (p<0.0001). The graft biopsy performed just after arterial and portal vascularization of the graft showed significantly fewer preservation lesions in group VI than in the other groups. This group also had less macrovacuolar steatosis but the difference was not significant (Table 3). BAR score was significantly higher in groups II (p=0.01) and V (p=0.03) than in donors under 40 years old but there was no significant difference with the oldest donors (over 80 years old) (p= 0.86). Furthermore, DRI score was significantly worse in donors over 40 years old than in those under 40 years old (Table 3).
Postoperative evolution and grafts and patients’ survival
Results concerning postoperative evolution are detailed in Table 3. The overall incidence of primary graft non-function (PGNF) was 8/387 (2%). There was no PGNF in groups I and VI, 2 in groups II and III, 4 in group IV and 2 in group V. There were 4 retransplantations (1%) but only one in group VI. The overall incidence of EAD was 92/380 (24%). There was no difference in the occurrence of EAD or PGNF in all groups.
Although the total bilirubin peak was not different between the groups, bilirubin levels returned to normal significantly later in the group of oldest donors. On the other hand, the delay to obtain factor V over 50% was similar and the cytolysis peak was significantly lower (p=0.01).
Grafts and patient survival are detailed in Table 4 and Figure 2. Graft survival was significantly better in group VI at 1, 5 and 10 years post-transplantation (p=0.04). Patient survival was not significantly different between the groups (p=0.07).
The causes for graft loss are shown in Table 5. The incidence of biliary or vascular complications and the recurrence of HCV or HCC were not different between the groups. After an univariate analysis including all the donors, recipients and surgical characteristics, the multivariate analysis found that factors predicting graft loss were ASAT peak (p=0.001), retransplantation (p=0.0003) and CIT (p=0.001) but not donor age (Table 6).
28
Discussion
In this prospective descriptive single-center study, liver grafts from older donors, whose number has increased significantly in the last ten years, provided very good results for liver transplantation. The grafts came from very selected old donors. First, when we began to use these old grafts, liver biopsy was systematically performed before organ procurement to ensure the absence of significant steatosis or fibrosis. Second, based on previous studies about LT with marginal donors, we have also eliminated other known risk factors of decreased graft survival (donor’s cardiac arrest, long ICU stay before organ procurement, hypernatremia, high dose of vasopressors). Third, these grafts were preferentially accepted for recipients without HCV, with low MELD cirrhosis or HCC and who have been waiting for a long time. Last, we optimized our organization to shorten the CIT. Taken altogether, these criteria allowed us to perform transplantation with carefully selected old grafts and grafts and patients’ survival were as good as those with younger donors and donors’ age was not a risk factor for graft loss. The concept of marginal donor or ECD was developed in order to establish donors’ characteristics that could be associated with poor graft outcome (16-18). Obviously, strategies and precautions are implemented to ensure the safe use of such grafts (19). In addition, recipients’ criteria are also associated with decreased survival after liver transplantation such as life support before transplantation, MELD score, age, CIT, retransplantation, mechanical ventilation and hemodialysis (20). Objective scoring methods taking these criteria into account have been constructed such the DRI or BAR systems. However, they cannot predict short-term outcome of liver transplantation with good specificity and sensitivity. Some of them take into account donor’s age with a different cut-off: >40 years in the BAR, >55 years in the ECD, >70 years in the DRI in the oldest group (5 21 22). In other systems, donor age is not a risk factor of mortality or poor graft survival (10 21 22 23).
For this reason, there is still controversy about the upper age limit for liver graft procurement, the definition of what an “old donor” is and also about the impact of donor age on graft function and survival. A case of a 93-year-old donor with good graft function was reported and there are now small series describing goods results for octogenarian and nonagenarian donors by matching donors to recipients and by drastically selecting old donor (8). Our results are consistent with these previously described good results, with a consistent number of donors over 70 and 80 in our study.
From 2007 to 2014 in France as in other countries in Europe (24), mean donor age increased from 50.5 to 57.7 years (Data from the French Biomedicine Agency). An allocation graft
29 scoring system based on MELD was introduced in France in March 2007. The number of patients with cirrhosis who had a low MELD score and/or HCC increased substantially on the list with time and waiting time on the list increased in these patients with high risk of disease progression. Like others, we felt that the use of old donors could be a rapid solution to overcome organ shortage (5 22 23 25). In our experience of using donors over 70 or even 80 years old, results have been good with no significant difference in graft or patients’ survival.
Like other authors, we have been very careful to exclude potential donors who had known risk factors for graft dysfunction by a strong examination of clinical and biological data of the donors and by decreasing CIT. We implemented this strategy as no significant difference was evidenced in BAR and DRI scores between the donor groups, given that donor age is important in these scores (13 14). Our oldest donors had less hepatic cytolysis, shorter stay in ICU, lower doses of vasopressor and shorter CIT (which implies involvement of the entire transplant team). When this approach is not followed, PGNF may be as high as 20% of liver transplantation ( 1 0 2 6 ) . Indeed, old livers seem to be more sensitive to ischemia (8 27). This is perhaps why the time to normalize bilirubin levels after transplantation in recipients of grafts from older donors was longer. However, peak ASAT levels were not different.
Considering patients who received a graft only from old donors, Barbier et al. showed that risk factors associated with poor graft survival were HCV infection, retransplantation and emergency transplantation. In our experience, retransplantation, peak transaminase level and CIT were associated with poor graft survival but not hepatitis C infection or emergency (25). Because high-risk liver grafts should be given to candidates with a lower MELD score on the basis of the rationale that patients in better health should better withstand graft dysfunction or complications after transplantation (2 23 24) and because donor age over 45 years of age is known to be a high risk factor for HVC recurrence (28-30), we selected the recipients of old donor grafts by ruling out those with high MELD cirrhosis or infected with HCV. This approach now needs to be reconsidered in the era of the new anti-HCV therapies (31). Finally, we did not observe any biliary or vascular complications even though some authors reported them as occurring more frequently in old graft recipients (32). However, by accurate donor selection and thanks to appropriate surgical procedures such as a temporary porto-caval shunt, biliary complications can be avoided (33 34). We also used total body enhanced CT, which can help in the vascular evaluation of donors and also graft steatosis when we stopped to perform systematic liver biopsy before procurement.
30 number of old and very old donors, so these results need confirmation in larger multicenter studies. Second, even if our database was prospectively fulfilled, we performed a retrospective analysis and could have missed some data. Third, this study covers over 10 years during which we have improved our practice.
In conclusion, in our experience, the application of a selective graft allocation policy by liver biopsy or liver-to-spleen attenuation ratio on CT images, elimination of known risk factors such as cardiac arrest, long ICU stay, hypernatremia, high dose of vasopressor, discussion with surgeon to decrease CIT and attribution of the graft to also selected recipients with low MELD score (all data available at the time of organ procurement), we obtained very good results of grafts and patients' survival using donors over 70 and even 80 years. This attitude requires the mobilization of the whole team, from procurement to liver transplantation. So, in the current period of organ shortage, these results plead for the pursuit of liver graft procurement in carefully selected old donors for transplantation in recipients who are also carefully selected.
Acknowledgment
31
References
1. Merion RM Goodrich NP, Feng S. How can we define expanded criteria for liver donors? J Hepatol 2006; 45: 484–8
2. Nemes B, Gámán G, Polak WG, et al. Extended criteria donors in liver transplantation Part I: reviewing the impact of determining factors. Expert Rev Gastroenterol Hepatol 2016; 10: 827–39
3. Nadig SN, Bratton CF, Karp SJ. Marginal donors in liver transplantation: expanding the donor pool. J Surg Educ 2007; 64: 46–50
4. Silberhumer GR, Rahmel A, Karam V, et al. The difficulty in defining extended donor criteria for liver grafts: the Eurotransplant experience. Transpl Int 2013; 26: 990–8
5. Frühauf NR, Fischer-Fröhlich C-L, Kutschmann M, Schmidtmann I, Kirste G. Joint impact of donor and recipient parameters on the outcome of liver transplantation in Germany. Transplantation 2011; 92: 1378–84
6. Busquets J, Xiol X, Figueras J, et al. The impact of donor age on liver transplantation: influence of donor age on early liver function and on subsequent patient and graft survival. Transplantation 2001; 71: 1765–71
7. Bertuzzo VR, Cescon M, Odaldi F, et al. Actual Risk of Using Very Aged Donors for Unselected Liver Transplant Candidates: A European Single-center Experience in the MELD Era. Ann Surg 2016; doi: 10.1097/SLA.0000000000001681
8. Jiménez-Romero C. Using old liver grafts for liver transplantation: Where are the limits? World J Gastroenterol 2014; 20: 10691
9. Dudek K, Kornasiewicz O, Remiszewski P, Zieniewicz K, Wróblewski T, Krawczyk M. Results of liver transplantation from old donors. Transplant Proc 2014; 46: 2762–5
10. Dirican A, Soyer V, Koc S, et al. Liver Transplantation With Livers From Octogenarians and a Nonagenarian. Transplant Proc 2015; 47: 1323–5
32 11. Ghinolfi D, Marti J, De Simone P, et al. Use of octogenarian donors for liver
transplantation: a survival analysis. Am J Transplant 2014; 14: 2062–71
12. Rogier J, Roullet S, Cornélis F, et al. Noninvasive assessment of macrovesicular liver steatosis in cadaveric donors based on computed tomography liver-to-spleen attenuation ratio. Liver Transpl 2015; 21: 690–5
13. Feng S, Goodrich NP, Bragg-Gresham JL, et al. Characteristics associated with liver graft failure: the concept of a donor risk index. Am J Transplant 2006; 6: 783–90
14. Dutkowski P, Oberkofler CE, Slankamenac K, et al. Are There Better Guidelines for Allocation in Liver Transplantation?: A Novel Score Targeting Justice and Utility in the Model for End-Stage Liver Disease Era. Ann Surg 2011; 254: 745–54
15. Olthoff KM, Kulik L, Samstein B, et al. Validation of a current definition of early allograft dysfunction in liver transplant recipients and analysis of risk factors. Liver
Transpl 2010; 16: 943–9
16. Attia M, Silva MA, Mirza DF. The marginal liver donor--an update. Transpl Int 2008;
21: 713–24
17. Dutkowski P, de Rougemont O, Clavien P-A. Machine perfusion for ‘marginal’ liver grafts. Am J Transplant 2008; 8: 917–24
18. Nachmany I, Dvorchik I, Devera M, et al. A validated model for predicting outcome after liver transplantation: implications on transplanting the extremely sick. Transpl Int 2013; 26: 1108–15
19. Rana A, Hardy MA, Halazun KJ, et al. Survival outcomes following liver transplantation (SOFT) score: a novel method to predict patient survival following liver transplantation. Am J Transplant 2008; 8: 2537–46
20. Schrem H, Reichert B, Frühauf N, et al. The Donor-Risk-Index, ECScore and D-MELD-Score all fail to predict short-term outcome after liver transplantation with
33 acceptable sensitivity and specificity. Ann Transplant 2012; 17: 5–13
21. Cescon M, Grazi GL, Cucchetti A, et al. Improving the outcome of liver transplantation with very old donors with updated selection and management criteria. Liver Transpl 2008; 14: 672–9
22. Jiménez-Romero C, Clemares-Lama M, Manrique-Municio A, García-Sesma A, Calvo-Pulido J, Moreno-González E. Long-Term Results Using Old Liver Grafts for Transplantation: Sexagenerian Versus Liver Donors Older than 70 Years. World J Surg 2013; 37: 2211–21
23. Romagnoli J, Urbani L, Catalano G, et al. Liver transplantation using a 93-year-old donor. Transplant Proc 2001; 33: 3797
24. Halldorson J, Roberts JP. Decadal analysis of deceased organ donation in Spain and the United States linking an increased donation rate and the utilization of older donors: Decadal Analysis of Deceased Organ Donation. Liver Transpl 2013; 19: 981–6
25. Barbier L, Cesaretti M, Dondero F, et al. Liver Transplantation with Older Donors: A Comparison with Younger Donors in a context of Organ Shortage. Transplantation 2016; 100: 2410-5
26. Zapletal C, Faust D, Wullstein C, et al. Does the Liver Ever Age? Results of Liver Transplantation With Donors Above 80 Years of Age. Transplant Proc 2005; 37: 1182– 5
27. Lué A, Solanas E, Baptista P, et al. How important is donor age in liver transplantation?
World J Gastroenterol 2016; 22: 4966–76
28. Berenguer M. Risk of extended criteria donors in hepatitis C virus-positive recipients.
Liver Transplant 2008; 14 Suppl 2: S45–50
29. Berenguer M, Aguilera V, Prieto M, et al. Worse recent efficacy of antiviral therapy in liver transplant recipients with recurrent hepatitis C: impact of donor age and baseline
34 cirrhosis. Liver Transpl 2009; 15: 738–46
30. Rayhill SC, Wu YM, Katz DA, et al. Older donor livers show early severe histological activity, fibrosis, and graft failure after liver transplantation for hepatitis C.
Transplantation 2007; 84: 331–9
31. Jothimani D, Govil S, Rela M. Management of post liver transplantation recurrent hepatitis C infection with directly acting antiviral drugs: a review. Hepatol Int 2016; 10: 749–61
32. Cescon M, Zanello M, Grazi GL, et al. Impact of Very Advanced Donor Age on Hepatic Artery Thrombosis After Liver Transplantation: Transplantation 2011; 92: 439–45
33. Rayar M, Levi Sandri GB, Cusumano C, et al. Risk analysis of ischemic-type biliary lesions after liver transplant using octogenarian donors. Liver Transpl 2016; 22: 1301– 2
34. Ghinolfi D, De Simone P, Lai Q, et al. Risk analysis of ischemic-type biliary lesions after liver transplant using octogenarian donors. Liver Transpl 2016; 22: 588–98
35
TABLE 1. Donor characteristics
36
TABLE 2. Recipient characteristics
37
TABLE 3. BAR and DRI scores and postoperative evolution
38
TABLE 4. Patient and graft survival
39
TABLE 5. Causes of graft lost
40
TABLE 6. Logistic regression for graft lost (n=114)
Equation of the model:
Prediction (graft loss) = 1 / (1 + exp(-(-2.444 + 0.0001*ASAT peak + 0.002*cold ischemia time
min + 0.189 if etiology for LT-alcohol + 0.794 if etiology for LT-hepatitis C + 0,164 if etiology
for LT-other + 0,208 if etiology for LT-cholestatic + 0.662 if etiology for LT-fulminant + 1.670
if etiology for LT- retransplantation)))
41
Figure legends
Figure 1: Evolution of donor age from 2005 to 2014 (p<0.001). Data are shown as box plots with median represented by horizontal line with 75th percentile at top and 25th at bottom. The 10th and 90th percentiles are shown as whiskers.
42
43
44