UNIVERSITE TOULOUSE III – PAUL SABATIER
U.F.R. Sciences de la Vie et de la TerreTHESE
Pour obtenir le grade de
DOCTEUR DE L’UNIVERSITE TOULOUSE III
Discipline : Biosciences VégétalesPrésentée et soutenue par
Tatiana VERNIÉ
Le 25 avril 2008
JURY
Mathieu Arlat, Professeur de l’Université Paul Sabatier, Toulouse, Président Martin Crespi, Directeur de Recherche CNRS, Gif-sur-Yvette, Rapporteur Marcelle Holsters, Professeur de l’Université de Gent, Belgique, Rapporteur Didier Bogusz, Directeur de Recherche IRD, Montpellier, Examinateur
Fernanda de Carvalho-Niebel, Chargée de Recherche CNRS, Toulouse, Examinateur Florian Frugier, Chargé de Recherche CNRS, Gif-sur-Yvette, Examinateur
Pascal Gamas, Directeur de Recherche, Toulouse, Co-directeur de thèse Andreas Niebel, Chargé de Recherche, Toulouse, Co-directeur de thèse
Analyse fonctionnelle d’EFD,
Un régulateur transcriptionnel de la nodulation au cours de l’interaction
symbiotique entre Medicago truncatula et Sinorhizobium meliloti
UNIVERSITE TOULOUSE III – PAUL SABATIER
U.F.R. Sciences de la Vie et de la TerreTHESE
Pour obtenir le grade de
DOCTEUR DE L’UNIVERSITE TOULOUSE III
Discipline : Biosciences VégétalesPrésentée et soutenue par
Tatiana VERNIÉ
Le 25 avril 2008
JURY
Mathieu Arlat, Professeur de l’Université Paul Sabatier, Toulouse, Président Martin Crespi, Directeur de Recherche CNRS, Gif-sur-Yvette, Rapporteur Marcelle Holsters, Professeur de l’Université de Gent, Belgique, Rapporteur Didier Bogusz, Directeur de Recherche IRD, Montpellier, Examinateur
Fernanda de Carvalho-Niebel, Chargée de Recherche CNRS, Toulouse, Examinateur Florian Frugier, Chargé de Recherche CNRS, Gif-sur-Yvette, Examinateur
Pascal Gamas, Directeur de Recherche, Toulouse, Co-directeur de thèse Andreas Niebel, Chargé de Recherche, Toulouse, Co-directeur de thèse
Recherches effectuées au Laboratoire des Interactions Plantes-Microorganismes
UMR CNRS/INRA 2594/441, Chemin de Borde Rouge, BP 52627, 31326 Castanet-Tolosan Cedex, France
Analyse fonctionnelle d’EFD,
Un régulateur transcriptionnel de la nodulation au cours de l’interaction
symbiotique entre Medicago truncatula et Sinorhizobium meliloti
Auteur : Tatiana Vernié
Titre : Analyse fonctionnelle d’EFD, un régulateur transcriptionnel de la nodulation au cours de l’interaction symbiotique entre Medicago truncatula et Sinorhizobium meliloti
Directeurs de thèse : Pascal Gamas et Andreas Niebel
Résumé : Les Légumineuses sont capables d’établir une interaction symbiotique avec des bactéries de la rhizosphère, appelées Rhizobia. Cette interaction implique deux processus étroitement contrôlés par la plante : une infection bactérienne et la formation d’un nouvel organe : le nodule, dans lequel l’azote atmosphérique est réduit. Les mécanismes de ces contrôles restent peu connus. A partir d’études transcriptomiques, nous avons sélectionné un régulateur potentiel, EFD (Ethylene response Factor required for nodule Differentiation), codant pour un facteur de transcription de type ERF.
Le profil d’expression d’EFD a été caractérisé par des analyses de RT-PCR quantitatives, d’hybridation in situ et de fusions promoteur:GUS. Ces études ont révélé une expression spécifique d’EFD dans les primordia nodulaires et racinaires, ainsi que dans la zone d’infection des nodules, où les bactéries et tissus végétaux se différencient. Puis, grâce à des approches de surexpression et de RNAi sur des racines transformées, et à l’analyse d’un mutant de délétion, un rôle d’EFD lors de l’initiation et de la différenciation des nodules a été mis en évidence. Enfin, une cible principale, Mt RR4, a été identifiée par une approche transcriptomique. RR4 code pour un régulateur de la réponse aux cytokinines, dont le rôle lors de l’initiation des nodules a récemment été démontré. Nous proposons donc qu’en régulant l’expression de RR4, EFD modulerait la voie de réponse des cytokinines lors de la nodulation et coordonnerait ainsi l’initiation et le développement des nodules. Enfin, après avoir montré l’induction d’EFD en réponse à deux hormones impliquées dans la régulation des infections (jasmonates et acide salicylique), nous avons étudié l’implication d’EFD lors d’une interaction avec une bactérie pathogène, Ralstonia solanacearum. Nos résultats préliminaires suggèrent qu’EFD est un régulateur positif du développement de la maladie.
Mots-clés : Medicago truncatula, Sinorhizobium meliloti, Ralstonia solanacearum, symbiose, facteur de transcription, organogénèse, autorégulation, EFD, cytokinines, pathogénicité.
Discipline administrative : Biosciences Végétales
Intitulé et adresse du laboratoire : Laboratoire des Interactions Plantes – Microorganismes, CNRS/INRA 2594/441, Chemin de Borde-Rouge, BP52627, 31326 Castanet-Tolosan Cedex.
Author: Tatiana Vernié
Title: Functional analysis of EFD, a transcriptional regulator that controls nodulation during symbiotic interaction between Medicago truncatula and Sinorhizobium meliloti
Ph. D Supervisors: Pascal Gamas and Andreas Niebel
Abstract: Leguminous plants can establish symbiotic interaction with bacteria from the rhizosphere, called Rhizobia. During this interaction, plants control tightly two mechanisms: bacterial infection and formation of a new organ, the nodule in which nitrogen is fixed. But how plants control these mechanisms is still largely unknown. Starting from transcriptomic studies, we selected a potential regulator, EFD (Ethylene response Factor required for nodule Differentiation), coding for a transcription factor belonging to the ERF family.
The expression profile of EFD has been characterized by quantitative RT-PCR, in situ hybridization and promoter:GUS fusion. These studies revealed a specific expression of EFD in nodule and root primordia, and in the infection zone of mature nodules, where bacteria and plant tissues differentiate. Using overexpression and RNAi approaches on transformed roots, and study of a deletion mutant, we then showed that EFD plays a role to control the number of nodules and their differentiation. Finally, we identified a major target of EFD by a transcriptomic approach. This target, Mt RR4, encodes a cytokinin response regulator. Cytokinins have recently been shown to be positive regulators of nodule initiation. Consequently, we propose that by regulating RR4 expression, EFD modulates the cytokinin pathway during nodulation to coordinate nodule initiation and development. Finally, we showed that EFD expression is induced by two hormones important in biotic interactions (jasmonates and salicylic acid) and studied the implication of EFD during the interaction of M. truncatula with Ralstonia solanacearum, a bacterial pathogen. Our initial results suggest that EFD is a positive factor for disease development.
Key words: Medicago truncatula, Sinorhizobium meliloti, Ralstonia solanacearum, symbiosis, transcription factor, organogenesis, autoregulation, EFD, cytokinins, pathogenesis.
SOMMAIRE
INTRODUCTION 12
I La symbiose fixatrice d’azote Légumineuse / Rhizobium 13 1.1 Les symbioses fixatrices d’azote 13
1.1.1 Les différentes symbioses fixatrices d’azote chez les plantes 14
1.1.2 La symbiose Rhizobium / Légumineuse 16
1.2 Les partenaires 19
1.2.1 Les Légumineuses 19
1.2.2 Les Rhizobia 22
1.3 Le choix de deux Légumineuses modèles 24
1.3.1 Génomique des Légumineuses 24
1.3.2 Choix de deux plantes modèles : Medicago truncatula et Lotus japonicus 25 1.3.3 Développement des ressources génétiques et génomiques pour M. truncatula 27
II La mise en place de la nodulation chez les Légumineuses formant des nodules indéterminés 32
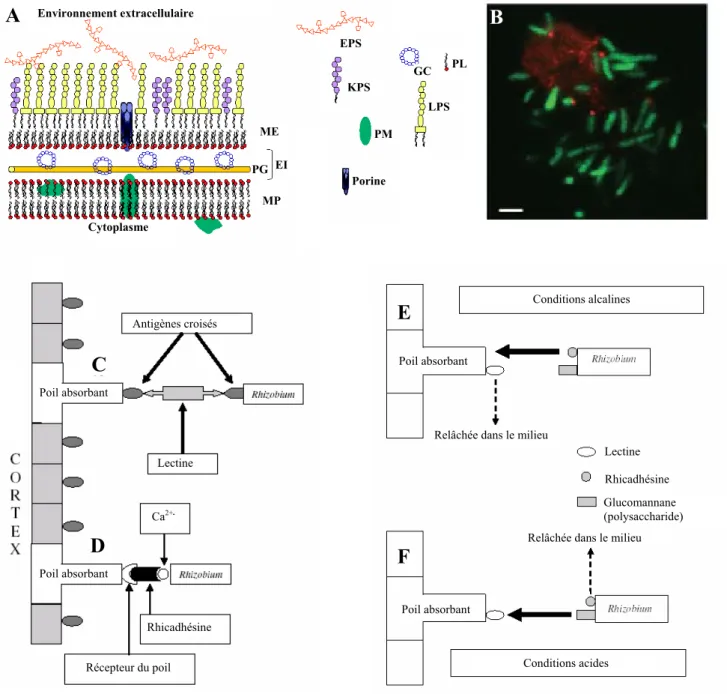
2.1 L’infection rhizobienne 32
2.1.1 Adhésion des rhizobia aux poils absorbants des racines hôtes 33 2.1.2 Déformation des poils absorbants en croissance 35
2.1.3 Création des cordons d’infection 40
2.1.4 Progression des cordons d’infection au travers de la racine 44
2.2 Le développement nodulaire 48
2.2.1 Formation d’un primordium nodulaire 48
2.2.2 Invasion du nodule par les cordons d’infection 50
2.2.3 Différenciation du nodule indéterminé 52
2.2.4 La fixation azotée 57
III Bases moléculaires de la symbiose 59
3.1 Reconnaissance spécifique des partenaires 59
3.1.1 Les flavonoïdes 59
3.1.2 Les facteurs Nod 60
3.1.3 Les réponses induites chez la plante par les facteurs Nod 62
3.2 Perception et transduction du signal : caractérisation génétique des étapes précoces de la
nodulation 64
3.2.1 Des extraits cellulaires capables de lier les facteurs Nod 65 3.2.2 Caractérisation de récepteurs potentiels aux facteurs Nod appartenant à la famille des
LysM-RLKs 66
3.2.3 Modèle génétique de la transduction du signal facteurs Nod 68
3.3 Caractérisation génétique des étapes tardives de la nodulation 74
3.3.1 Identification de gènes contrôlant l’infection et la nodulation 75 3.3.2 Identification de gènes contrôlant la différenciation des nodules 77 3.3.3 Identification par profil d’expression de gènes impliqués dans la nodulation 81
IV La régulation hormonale de la symbiose par la plante hôte 83 4.1 Régulation de l’initiation de l’organogénèse nodulaire 84
4.1.1 Rôle de l’éthylène dans la détermination du site d’initiation des divisions cellulaires 84 4.1.2 Rôle de l’auxine dans la détermination du site d’initiation des divisions cellulaires et dans leur
maintien 85
4.1.3 Implication des cytokinines lors de l’initiation et du maintien des divisions cellulaires 89 4.1.4 Régulation négative des divisions cellulaires par l’ABA, l’éthylène et les jasmonates 93
4.2 Mécanismes de régulation de l’infection mis en place par la plante hôte 96
4.2.1 L’éthylène : un régulateur négatif de l’initiation et de la progression des cordons d’infection 96 4.2.2 L’éthylène et les gibbérellines : des régulateurs positifs de l’infection par crack entry chez S.
rostrata 97
4.3 Mécanismes de régulation du développement nodulaire 101
4.3.1 Développement des primordia 101
4.3.2 Régulation de la fixation azotée 103
4.3.3 Régulation de la sénescence des nodules 103
4.4 Mécanismes de la régulation du nombre de nodules par la plante hôte 104
4.4.1 Influence du statut azoté de la plante hôte sur la nodulation 105 4.4.2 Classification des mutants formant un plus grand nombre de nodules 106 4.4.3 Différentes hormones suggérées comme signal d’autorégulation 108
V Présentation du sujet de thèse 111
5.1 Thématique de recherche de l’équipe 111
5.2 Projet de thèse 112
5.2.1 Sélection de deux facteurs de transcription potentiellement impliqués lors de la nodulation 112 5.2.2 Etude préliminaire du gène MtMADS1 codant pour un facteur de transcription de type MADS 113 5.2.3 Etude fonctionnelle du gène MtEFD codant pour un facteur de transcription de type ERF 115
CHAPITRE 1 120
Article : Mt EFD, an AP2-ERF transcription factor, involved in the control of nodule number and differentiation in Medicago truncatula
CHAPITRE 2 163
I Les signaux inducteurs de l’expression d’EFD 164
1.1 Stratégie d’étude 164
1.2 L’expression d’EFD n’est pas induite par l’éthylène, les CKs, l’ABA et l’H2O2 164
1.3 Induction de l’expression d’EFD en réponse au SA et au MeJA 165
II Implication d’EFD lors de l’interaction M. truncatula / R. solanacearum 167
2.1 Choix du pathosystème M. truncatula / R. solanacearum 167 2.2 L’expression d’EFD est induite par R. solanacearum 168 2.3 L’expression d’EFD dans les racines est co-localisée avec R. solanacearum 168
2.4 EFD, un régulateur positif de l’infection par R. solanacearum ? 170
CHAPITRE 3 172
Article : The MtMMPL1 early nodulin is a novel member of the matrix metalloendoproteinase family with a role in Medicago truncatula infection by Sinorhizobium meliloti
DISCUSSION ET PERSPECTIVES 199
I EFD, un nouveau facteur de transcription impliqué dans la régulation de la symbiose M. truncatula /
S. meliloti 200
1.1 EFD, un nouveau facteur de transcription symbiotique 200
1.1.1 Les facteurs de transcription symbiotiques 200
1.1.2 Les ERFs symbiotiques du groupe V 201
1.1.3 EFD, un ERF classique se liant aux boites de régulation GCC ? 203
1.2 EFD, un acteur de l’autorégulation de la nodulation ? 204
1.2.1 EFD, un régulateur négatif de l’initiation nodulaire 204 1.2.2 efd-1, un nouveau mutant supernodulant 205 1.2.3 EFD, un nouvel élément de l’autorégulation nodulaire ? 205
1.3 EFD, un acteur de la différenciation nodulaire 207
1.3.1 Implication d’EFD lors de la différenciation des tissus nodulaires 207 1.3.2 efd-1, un nouveau mutant de différenciation nodulaire 209
1.4 EFD, un modulateur de la voie des cytokinines lors de la symbiose ? 210
1.4.1 Un régulateur de réponse aux cytokinines comme cible majeure d’EFD lors de la symbiose 210 1.4.2 Rôles opposés des cytokinines durant la formation des nodules et des racines ? 211
II EFD, une noduline impliquée dans la propagation de la maladie en réponse à R. solanacearum 213 2.1 Existe-t-il un programme de réponse commun entre les interactions symbiotiques et
pathogènes ? 213
2.2 EFD, un régulateur positif de l’infection par R. solanacearum ? 214 2.3 Identification d’un nouveau rôle des cytokinines lors de l’infection par R. solanacearum ? 216
III EFD, un facteur de transcription impliqué dans le contrôle des réponses aux stress
environnementaux ? 217
MATERIELS ET METHODES 220
TABLE DES ABBREVIATIONS 224
ILLUSTRATIONS ET TABLEAUX
INTRODUCTION
Figure 1. Les nodules fixateurs d’azote chez les plantes
Figure 2. La symbiose avec les cyanobactéries et la fixation azotée par les bactéries endophytes Figure 3. Etapes du processus de nodulation lors de la symbiose Légumineuse-Rhizobium Figure 4. La nodulation aérienne chez Sesbania rostrata
Figure 5. Les différents types de nodules chez les Légumineuses
Figure 6. Les racines de Lotus japonicus déterminent la spécificité d’hôte Figure 7. Diversité des Légumineuses
Figure 8. La mycorhization des racines des Légumineuses
Figure 9. Classification des Légumineuses selon les séquences du gène matK Figure 10. Classification des Rhizobia selon les séquences de l’ARN 16S
Figure 11. Relations entre la phylogénie des Rhizobia et leurs propriétés symbiotiques Figure 12. Les Légumineuses partagent de la synténie
Figure 13. Les deux légumineuses modèles : Medicago truncatula et Lotus japonicus Figure 14. La plante modèle Medicago truncatula
Figure 15. Exemples de modèles d’interactions pathogènes avec M. truncatula
Figure 16. Localisation des séquences satellites au niveau de l’hétérochromatine péricentrométrique chez M.
truncatula
Figure 17. Distribution des ESTs dans les organes et les différentes conditions physiologiques
Figure 18. Le processus d’infection dans les poils absorbants et les cellules sous-jacentes Figure 19. Attachement des rhizobia aux poils absorbants en deux étapes
Figure 20. La première étape d’attachement des rhizobia aux poils absorbants via une liaison faible Figure 21. Formation et développement des poils absorbants
Figure 22. Organisation du cytosquelette dans les poils en croissance chez les Légumineuses
Figure 23. Réorientation de croissance des poils absorbants en réponse aux rhizobia chez M. truncatula Figure 24. Réorganisation du cytosquelette en réponse aux rhizobia
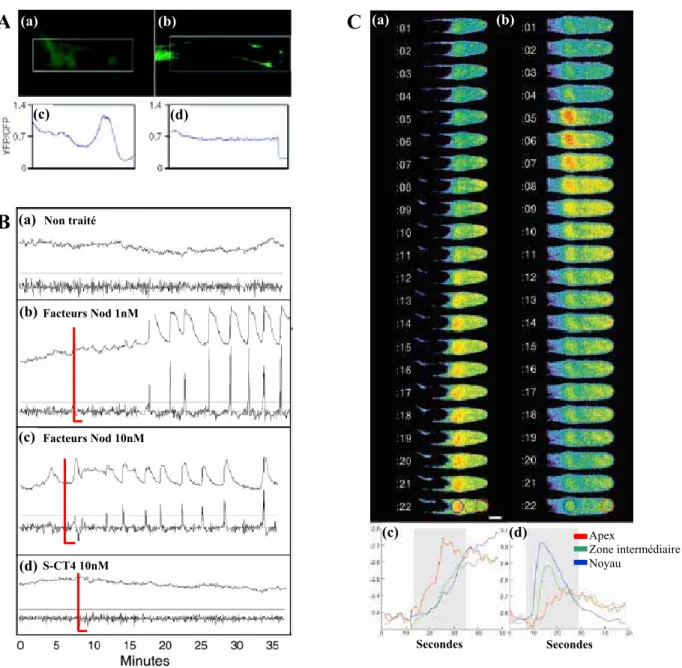
Figure 25. Les changements calciques dans les poils absorbants de M. truncatula en réponse aux facteurs Nod Figure 26. Création d’un site d’entrée dans le poil absorbant
Figure 27. Composantes végétales du cordon d’infection
Figure 28. Phénotype symbiotique des mutants S. meliloti exo (EPSI) chez M. sativa Figure 29. Phénotype symbiotique des mutants S. meliloti nodL, nodFE et nodF/nodL Figure 30. Croissance des cordons d’infection
Figure 31. Réactivation des cellules du cortex des racines de Légumineuses inoculées par leurs symbiontes Figure 32. Modifications pariétales liées au passage du cordon d’infection chez P. sativum
Figure 33. Le cycle cellulaire lors de l’organogénèse nodulaire
Figure 34. Activation des cellules du péricycle et du cortex chez Medicago spp. Figure 35. Expansion et infection du primordium nodulaire chez Medicago spp. Figure 36. Libération des bactéries et formation des symbiosomes
Figure 37. Formation du méristème nodulaire chez Medicago spp. Figure 38. Organisation du nodule indéterminé différencié chez M. sativa
Figure 39. Organisation des organelles et des bactéroïdes dans les cellules des nodules indéterminés de M. sativa Figure 40. Internalisation des facteurs Nod et organisation des microtubules dans les nodules indéterminés Figure 41. Différenciation des bactéroïdes dans les nodules indéterminés
Figure 42. La fixation de l’azote via le complexe nitrogénase
Figure 43. Association des leghémoglobines et de la fixation dans les nodules
Figure 44. Dialogue moléculaire entre les rhizobia et les Légumineuses
Figure 45. Structure et synthèse des facteurs Nod majoritaires produits par S. meliloti Figure 46. Principales réponses observées dans les racines en réponse aux facteurs Nod. Figure 47. Modèle de reconnaissance des facteurs Nod à deux récepteurs
Figure 48. Perception des facteurs Nod chez M. truncatula
Figure 49. Implication des récepteurs NFR dans la spécificité d’hôtes
Figure 50. Modèle génétique de la voie de perception / transduction du signal facteurs Nod chez les deux
Légumineuses modèles.
Figure 51. Structure et localisation cellulaire des protéines impliquées dans la voie de transduction du signal
facteurs Nod chez M. truncatula
Figure 52. Localisation de l’expression des gènes impliqués dans la transduction du signal facteurs Nod dans la
zone d’infection des nodules
Figure 53. Induction d’ENOD11 et formation de nodules spontanés par une forme auto-active de DMI3 Figure 54. Le gène NIN est impliqué dans l’organogénèse nodulaire et la régulation de la noduline ENOD11 Figure 55. Modèle de transduction du signal facteurs Nod chez les Légumineuses modèles
Figure 56. Implication des gènes de M. truncatula lors des premières étapes d’infection Figure 57. Gènes impliqués au cours de la différenciation des nodules chez M. truncatula Figure 58. Localisation tissulaire et subcellulaire des nodulines de type NCR
Figure 59. Rôle de l’éthylène dans la détermination des sites de formation des nodules
Figure 60. Implication de l’inhibition du transport de l’auxine lors de la formation des nodules
Figure 61. Activation des divisions cellulaires en réponse à une accumulation de l’auxine dans les cellules du
cortex en face des pôles de xylème
Figure 62. Implication des flavonoïdes dans l’inhibition du transport d’auxine lors de la nodulation Figure 63. Régulation de la balance d’auxine dans les nodules de M. truncatula
Figure 64. Voie de signalisation des cytokinines chez A. thaliana
Figure 65. Localisation des cytokinines chez les Légumineuses lors de la formation des racines latérales et des
Figure 66. Modèle d’interaction des voies de signalisation des facteurs Nod et des cytokinines lors de
l’organogénèse nodulaire chez L. japonicus
Figure 67. L’acide abscissique régule négativement le nombre de nodules
Figure 68. Insensibilité à l’éthylène du mutant supernodulant sickle de M. truncatula
Figure 69. Modulation par l’éthylène et les jasmonates des oscillations calciques induites en réponse aux
facteurs Nod chez M. truncatula
Figure 70. Modes d’infection chez la Légumineuse semi-aquatique S. rostrata Figure 71. Réactions de défenses liées à l’avortement de l’infection chez M. sativa
Figure 72. Effets inhibiteurs de l’acide salicylique sur la nodulation mis en évidence par l’étude de racines
transgéniques de M. truncatula surexprimant le gène NahG
Figure 73. Production et implication des ROS lors de la nodulation
Figure 74. Localisation et production du monoxyde d’azote dans les nodules de M. truncatula
Figure 75. Mise en évidence d’un système d’autorégulation de la nodulation via un signal longue distance chez
V. sativa
Figure 76. Les différentes catégories de mutants formant un nombre élevé de nodules
Figure 77. Implication d’un récepteur kinase CLAVATA1-like dans le système d’autorégulation de la
nodulation via un signal longue distance
Figure 78. Modèle du rôle de l’auxine dans l’autorégulation de la nodulation chez M. truncatula Figure 79. Implication du MeJA dans l’autorégulation de la nodulation chez L. japonicus
Figure 80. MtMADS1 un facteur de transcription associé au processus de divisions cellulaires lors de la
nodulation chez M. truncatula
Tableau I. Les Légumineuses les plus étudiées et leurs différents symbiontes
Tableau II. Nombre de chromosomes et taille du génome des Légumineuses modèles et des principales espèces
cultivées
Tableau III. Nodulines activées en réponse aux facteurs Nod chez M. truncatula Tableau IV. Caractérisation des sites de liaison aux facteurs Nod chez Medicago spp.
Tableau V. Réponses aux facteurs Nod observées chez les mutants symbiotiques de M. truncatula Tableau VI. Classes phénotypiques des mutants de nodulation chez M. truncatula et L. japonicus Tableau VII. Localisation tissulaire et rôles supposés lors de la nodulation de quelques nodulines chez
Medicago spp.
CHAPITRE I
Figure 1. Phénotype symbiotique du mutant efd-1
Figure 2. Le nombre de nodules et d’infections est fortement réduit chez des racines surexprimant la protéine
EFD fusionnée au domaine activateur VP16
Figure 3. La caractérisation microscopique des nodules efd-1 révèle des défauts de libération des bactéries et de
Figure 4. Caractérisation en microscopie électronique d’une partie des zones II et III des nodules sauvages et
efd-1
Figure 5. Analyse par PCR-quantitative de l’expression d’EFD dans différents tissus
Figure 6. Expression d’EFD dans la région sous-méristématique des nodules et dans les primordia nodulaires et
racinaires
Figure 7. Arbre phylogénétique du groupe V des ERFs d’A. thaliana et M. truncatula Figure 8. Localisation nucléaire de la protéine EFD fusionnée à la RFP
Figure 9. Trans activation de PRR4, PEFD et PMMPL1 chez N. benthamiana
Figure 10. Modèle d’action d’EFD dans le contrôle des développements nodulaire et racinaire
Figure S1. Un phénotype de supernodulant faible est observé sur des racines RNAi-EFD Figure S2. Une diminution de la nodulation est observée sur des racines surexprimant EFD
Figure S3. Analyse par PCR-quantitative de l’expression de gènes bactériens symbiotiques dans des nodules
sauvages et efd-1
Figure S4. L’expression d’EFD n’est pas induite par l’éthylène
Figure S5. Analyse des protéines ERFs du groupe V d’A. thaliana et de M. truncatula
Figure S6. Induction de l’expression de RR4 par les cytokinines, à travers une voie ne nécessitant pas la
biosynthèse de protéines
Tableau S1. Analyse par PCR-Quantitative de l’expression d’EFD et d’ENO11 dans les racines de mutants de
nodulation de M. truncatula
Tableau S2. Gènes différentiellement exprimés entre les nodules sauvages et efd-1 Tableau S3. Validation par PCR-Quantitative des gènes identifiés sur microarray
Tableau S4. Gènes différentiellement exprimés entre les racines transgéniques 35S:EFD::VP16 et vecteur vide Tableau S5. Amorces utilisées pour le séquençage du promoteur PEFD
Tableau S6. Amorces utilisées pour les analyses de PCR quantitatives
CHAPITRE II
Figure 1. Etude de l’expression d’EFD par Q-PCR en réponse à des traitements d’H2O2et d’ABA chez M. truncatula
Figure 2. Analyse par Q-PCR de l’induction de l’expression d’EFD en réponse au MeJA et au SA Figure 3. L’expression d’EFD est associée à la progression de R. solanacearum dans les racines Figure 4. Implication d’EFD lors de l’interaction avec R. solanacearum
CHAPITRE III
Figure 1. Structure générale des MMP et analyse de l’alignement de Mt MMPL1 et de quatre autres MMPs de
plantes
Figure 2. Arbre phylogénétique d’une sélection de protéines MMP provenant de plantes et d’animaux
Figure 3. Comparaison de l’expression de MtMMPL1 et de MtENOD11 dans des nodules induits par S. meliloti
et des racines inoculées par S. meliloti
Figure 4. Pattern d’expression de MtMMPL1 dans des nodules induits par S. meliloti et des racines inoculées par
S. meliloti
Figure 5. Niveaux d’expression de MtMMPL1 dans des racines transformées par les constructions
35S :MtMMPL1 et RNAi-MtMMPL1
Figure 6. Formation des nodules sur les racines exprimant les constructions 35S :MtMMPL1 et RNAi-MtMMPL1 Figure 7. Modification de l’infection par S. meliloti dans les nodules RNAi-MtMMPL1 et les racines
35S :MtMMPL1
Tableau I. Analyse par PCR quantitative de l’expression de MtMMPL1 et MtENOD11 dans des racines de
plantes sauvages ou des mutants lin (allèle D8) et hcl (allèle B56) inoculées par la souche sauvage S. meliloti ou la souche mutée exoA
Tableau II. Quantité de S. meliloti contenues dans les nodules sauvages et RNAi-MtMMPL1
Figure S1. Analyse d’alignements multiples des protéines prédites pour les gènes MtMMPL1 et le cluster de
gènes MtMMPL1-like
Figure S2. Northern électronique du cluster de MtMMPL1 (MtC40019) et de deux autres clusters proches
DISCUSSIONS ET PERSPECTIVES
Figure 1. Séquences cibles des protéines ERFs et recherche de ces éléments dans PRR4
Figure 2. Modèle d’action d’EFD lors de la nodulation via une modulation de la réponse aux cytokinines Figure 3. Modèles d’action d’EFD en réponse à S. meliloti et R. solanacearum
Figure 4. EFD, un intégrateur des stress environnementaux modulant la réponse aux cytokinines dans les racines
I
La symbiose fixatrice d’azote Légumineuse / Rhizobium
L’azote en tant que composant omniprésent dans les biomolécules (protéines, acides nucléiques, vitamines…) est un composant essentiel à la croissance et au développement de tous les organismes. De grandes quantités d’azote sont présentes sous forme minérale dans l’atmosphère ; cependant, la capacité à fixer l’azote atmosphérique via un complexe enzymatique, la nitrogénase, est restreinte à quelques bactéries. L’accès à l’azote minéral limite donc souvent la croissance des plantes. Certaines plantes ont réussi à s’affranchir de cette limitation en établissant des relations symbiotiques avec des microorganismes capables de fixer l’azote atmosphérique. Au cours de ces associations à bénéfice réciproque, la plante fournit de l’énergie à son symbionte, tandis que celui-ci fixe l’azote, le rendant assimilable par la plante. Ces associations symbiotiques sont responsables chaque année de la réduction de 120 millions de tonnes d’azote atmosphérique en ammonium (Freiberg et al., 1997). Parmi ces associations symbiotiques, la symbiose entre les plantes de la famille des Légumineuses et les bactéries de la famille des Rhizobia est une des plus efficaces en termes de fixation azotée. Ainsi, les Légumineuses cultivées en association avec leurs symbiontes fixent 40 à 60 Mt d’azote par an, tandis que 3 à 5 Mt d’azote sont fixées par les Légumineuses des écosystèmes naturels (Graham et Vance, 2003). Chaque année, les Légumineuses associées à leur symbionte produisent autant d’azote que l’industrie mondiale des engrais. L’indépendance vis-à-vis des engrais azotés est particulièrement intéressante pour l’agriculture dite durable. La rotation des cultures avec les Légumineuses permet d’économiser les engrais azotés, très couteux en énergie fossile et contribuant à l’effet de serre via l’émission de grandes quantités d’oxyde nitrique (Crutzen et al., 2007).
1.1 Les symbioses fixatrices d’azote
L’atmosphère est riche en azote minéral, mais seules certaines bactéries sont capables de fixer cet azote minéral grâce au complexe enzymatique de la nitrogénase. Plusieurs de ces organismes sont capables de s’associer avec des plantes leur fournissant ainsi un apport naturel en composés azotés. La symbiose Rhizobium-Légumineuse, au cœur de cette thèse sera plus particulièrement abordée.
Figure 1. Les nodules fixateurs d’azote chez les plantes
A-C. La symbiose fixatrice d’azote Rhizobium-Légumineuse, exemple de Medicago sativa et son symbionte
S. meliloti. A. Tige et fleur de M. sativa. B. Nodules entiers. C. Section longitudinale d’un nodule.
D-F. La symbiose fixatrice d’azote Rhizobium-Parasponia sp. D. Tige de Parasponia. E.Nodule multilobé de Parasponia rigida. F. Coupe longitudinale d’un lobe nodulaire de Parasponia.
G-I. La symbiose fixatrice d’azote avec Frankia. G. Jeune nodule d’aulne. H. Nodule âgé d’aulne. I.
Morphologie des bactéries Frankia isolées et anatomie d’un nodule actinorhizien chez l’hôte Discaria trinervis. f, filament ; v, vésicule ; s, sporange.
C : Vasse et al., 1990 ; D-F : Lancelle and Torrey, 1985 ; G, H : Duhoux and Nicole, 2004 ; I : Wall, 2000.
E
F
D
Méristème apical Filaments intercellulaires Zone d’infection Zone de fixation Zone de sénescence Tissu vasculaire central Formes isolées de Frankia Nodule ActinorhizienI
G
H
1.1.1 Les différentes symbioses fixatrices d’azote chez les plantes
Les symbioses fixatrices d’azote les plus connues font intervenir la famille des Légumineuses avec ses symbiontes bactériens, les Rhizobia. Au cours de cette interaction un nouvel organe, le nodule, est formé sur les racines ou plus rarement sur les tiges. C’est au sein de cet organe protecteur que l’azote atmosphérique est fixé par les bactéries (Figure 1A-C). Ce nodule contient des nouveaux composés, absents des bactéries en vie libre et des plantes non infectées. A ce jour, les seules plantes non légumineuses capables de noduler avec des rhizobia sont de petits arbres tropicaux appartenant au genre Parasponia de la famille des Ulmaceae (Figure 1D-F) (Lafay et al., 2006). Bien que la symbiose Légumineuse-Rhizobium, soit une interaction hautement adaptée et régulée, il ne s’agit pas d’une interaction obligatoire ou permanente. En effet, les deux partenaires peuvent vivre indépendamment et de manière autonome et chaque nouvelle génération de plante doit être infectée par de nouvelles bactéries. Il est cependant intéressant de noter que seules les bactéries différenciées (bactéroïdes) fixent l’azote ; en culture libre, les bactéries n’expriment pas la nitrogénase (Kneip et al., 2007).
D’autres bactéries fixatrices d’azote sont capables d’interagir avec les plantes, comme les actinomycètes, les cyanobactéries ou encore certaines bactéries endophytes.
Les actinomycètes du genre Frankia sont capables de noduler presque 220 espèces de plantes appartenant à 25 genres et regroupées dans huit familles (Betulaceae, Casuarinaceae, Coriariaceae, Datiscaceae, Elaeagnaceae, Myricaceae, Rhamnacaceae et Rosaceae) composées principalement d’arbres ou de buissons à l’exception du genre Datisca (Figure 1G-I). Le genre Frankia est composé de bactéries filamenteuses du sol gram positives. Il est caractérisé par sa capacité à induire des nodules sur un large spectre d’hôtes avec un degré de spécificité variable. Les bactéries peuvent se différencier en trois types cellulaires, tous présents à l’état symbiotique (sauf quelques exceptions) : les hyphes, les vésicules et les sporanges (Figure 1I). L’azote peut être fixé au sein des vésicules en condition libre ou symbiotique. A la différence des nodules rhizobiens, les nodules actinorhiziens ont une vascularisation centrale et sont issus du péricycle racinaire. Ils sont de type indéterminé (voir I.1.1.2.b). Ces plantes actinorhiziennes poussent souvent sur des sols pauvres et peu fertiles, comme ceux de la toundra (Dryas), des dunes côtières (Casuarina, Hippophae, Myrica et Elaeagnus), des milieux froids (Alnus et Dyas) ou montagneux (Alnus) mais aussi des forêts (Alnus, Casuarina, Coriaria et Shepherdia). Elles sont donc utilisées pour la restauration des
Figure 2. La symbiose avec les cyanobactéries et la fixation azotée par les bactéries endophytes
A-C. La symbiose Azolla-Anaebaena. A. Morphologie des frondes d’Azolla. B. Coupe de la cavité du lobe dorsal
d’Azolla. c, filament d’Anaebaena ; E, épiderme ; H, poils ; M, mésophylle. C. Hétérocyste de Nostoc à paroi épaisse (flèches).
D. Une diatomée marine du genre Rhizosolenia contenant des cyanobactéries de l’espèce Richelia intracellularis
(flèche). Barre = 30 μm.
E-F. La symbiose entre Gunnera magellanica et Nostoc. E. Gunnera magellanica. L’accolade indique la situation de
la section de tige observée en F. F. Section montrant les glandes de Gunnera (flèche) contenant les cyanosymbiontes. Barres = 1,3 cm (E) ; 4 mm (F).
G-I. Fixation de l’azote par une bactérie endophyte (Klebsiella pneumoniae) du blé (Triticum aestivum). G. T.
aestivum inoculé par une souche de K. pneumoniae fixatrice d’azote (Kp342) et une souche mutée pour la nitrogénase (nifH) et donc incapable de fixer l’azote. H. Localisation de Kp342 (en vert) dans une coupe transversale de racine. I. Immunolocalisation de la protéine NifH (en rouge) dans une section de racine colonisée par Kp342 (en vert). Les bactéries exprimant la nitrogénase (NifH) et donc fixant l’azote, apparaissent en jaune. Barres = 50μm.
A-C : Duhoux and Nicole, 2004 ; D-F : Rai et al., 2000 ; G-I : Iniguez et al., 2004.
G
H
I
sols et des côtes, la production de bois et de dérivés, la prévention de la désertification et l’agroforesterie (Benson et Silvester, 1993 ; Wall, 2000). L’ensemble de ces symbioses actinorhiziennes fixe à peu près autant d’azote que les symbioses Rhizobia-Légumineuses (Doyle, 1998). Des analyses phylogénétiques basées sur le gène chloroplastique rbcL (codant pour la large sous-unité de la ribulose biphosphate carboxylase / oxydase) indiquent que les familles de plantes impliquées dans les symbioses rhizobiennes et actinorhiziennes appartiendraient à la même sous-classe : les Rosidées ; ce qui suggère une seule origine de « prédisposition » des plantes à noduler (Soltis et al., 1995). Cependant elles ne représentent qu’un quart des familles de ce clade, et exceptées pour les Légumineuses, seule une minorité de genres de ces familles est capable de noduler. Ceci, ajouté au fait que les nodules issus d’interactions avec des rhizobia sont de structures différentes de ceux issus d’interactions avec les actinomycètes, suggère que la capacité de nodulation observée pour l’ensemble de ces plantes aurait des origines indépendantes (Doyle, 1998).
Les cyanobactéries sont des bactéries filamenteuses gram positives appartenant à un ancien groupe de procaryotes morphologiquement très varié, capable de photosynthèse et souvent de fixation azotée dans des cellules spécialisées, les hétérocystes (Figure 2C). Elles peuvent vivre de façon autonome (en fixant l’azote) ou en symbiose avec un très large spectre d’hôtes comprenant chez les plantes : des algues, des bryophytes, des ptéridophytes, des gymnospermes ou des angiospermes. Il n’y a pas de nodule, ces symbioses sont généralement extracellulaires, les cyanobactéries se logeant dans des cavités (Figure 2A-B). Cependant elles sont parfois intracellulaires (Figure 2D) comme lors de l’interaction entre le genre Nostoc et le genre végétal Gunnera, les cyanobactéries pénétrant alors dans les cellules méristématiques de glandes spécialisées au niveau des pétioles (Figure 2E-F). Les principales adaptations de la cyanobactérie à la vie symbiotique concernent des changements morphologiques et physiologiques comprenant une augmentation du nombre d’hétérocystes et de la fixation azotée souvent accompagnées d’une diminution de l’activité photosynthétique de la bactérie. Parfois, ces symbioses sont obligatoires, c’est le cas de l’interaction symbiotique entre Anabaena azollae et la fougère d’eau Azolla (Figure 2A-C) (Rai et al., 2000). Cette symbiose avec les cyanobactéries n’est pas aussi spécifique que les deux précédentes, mais elles ont une même particularité : il s’agit de symbioses non obligatoires et non permanentes (exceptée pour l’interaction A. azollae-Azolla) (Kneip et al., 2007).
Enfin, certaines bactéries endophytes sont aussi capables de fixer l’azote. Ces bactéries colonisent les racines et ne peuvent être isolées en culture libre. Bien qu’elles soient localisées dans les espaces intercellulaires et intracellulaires des racines et qu’il n’y ait aucun signe de
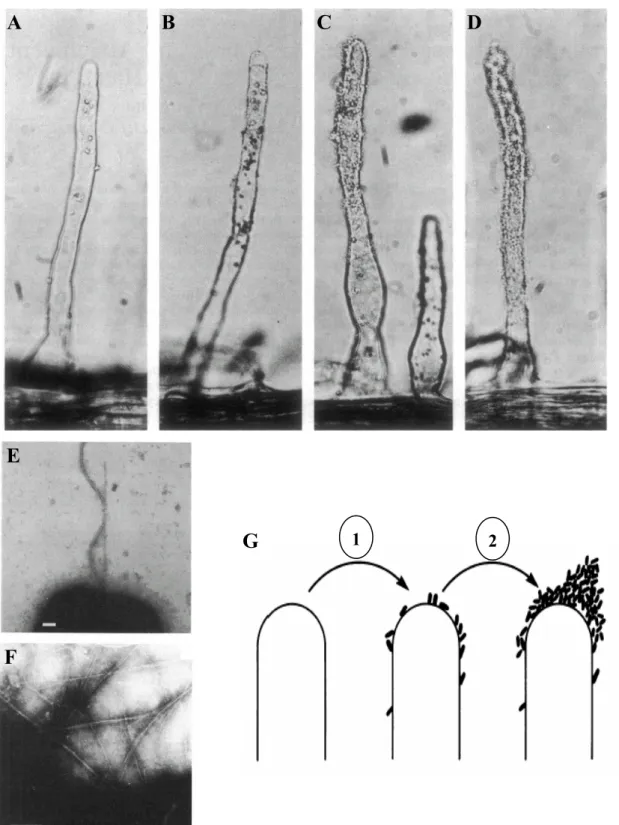
Figure 3. Etapes du processus de nodulation lors de la symbiose Légumineuse-Rhizobium A. Les rhizobia (rh) colonisent la rhizosphère et s’attachent aux poils absorbants (r).
B. Les bactéries induisent la déformation du poil en crosse de berger et initient un cordon d’infection (it) au centre de la
courbure à partir d’un centre infectieux (ci).
C. Le cordon s’allonge et atteint la base de la cellule épidermique.
D. Le cordon se ramifie (rit) à l’approche du primordia nodulaire formé suite à la division des cellules du cortex (c). E. Les bactéries sont relâchées dans les cellules du nodule et forment des symbiosomes, où elles se différencient en
bactéroïdes fixateurs. Des granules de PHB s’accumulent dans les bactéroïdes entourés d’une membrane péribactéroïdienne.
F. Fixation de l’azote et transport de l’ammonium dans le symbiosome. La leghémoglobine maintient une
concentration basse en oxygène permettant le fonctionnement de la nitrogénase qui transforme l’azote en ammoniac dans le bactéroïde. L’ammoniac diffuse dans l’espace péribactéroïdien où il est transformé en ammonium qui est ensuite exporté dans le cytoplasme végétal via un canal et assimilé en glutamine par la plante. L’ammoniac peut aussi être assimilé au niveau du bactéroïde dans des acides aminés ensuite exportés vers le cytoplasme végétal.
r, poil absorbant ; rh, rhizobium ; ep, épiderme ; c, cortex ; it, cordon d’infection ; n, noyau ; ci, centre infectieux ; rit, ramifications du cordon d’infection ; ed, endoderme ; b, bactéroïdes ; pb, membrane péribactéroïdienne ; s, symbiosome ; d, vacuole ; phb, polyȕ-hydroxybutarate ; ETC, Electron transport chain ; PBS, espace péribactéroïdien. A-E : Perret et al., 2000 ; F: d’après Day et al., 2001.
Paroi végétale Faible concentration en O2 Leghémoglobine Glutamine Cytoplasme végétal acide alcalin acides aminés bactéroïde
F
maladie en conditions naturelles, aucune nouvelle structure symbiotique n’a été observée. Il n’y a donc pas de preuves qu’il s’agisse d’endosymbioses. Cependant, plusieurs études ont mis en évidence un effet promoteur sur la croissance des plantes et une contribution en apport azoté des bactéries endophytes lors des interactions entre Gluconacetobacter diazotrophicus et la canne à sucre (Sevilla et al., 2001), Azoarcus sp. BH72 (souche séquencée, Krause et al., 2006) colonisant le riz (Miche et al., 2006 ; Egener et al., 1999) et l’herbe Leptochloa fusca (L.) Kunth (Hurek et al., 2002) ou encore Klebsiella pneumoniae 342 et le blé (Iniguez et al., 2004) (Figure 2G-I).
1.1.2 La symbiose Rhizobium / Légumineuse
Il existe deux types de nodules, déterminés ou indéterminés, formés généralement sur les racines des plantes et parfois aussi sur les tiges (ou les hypocotyles) dans le cadre des interactions spécifiques entre un Rhizobium et une Légumineuse.
a. La formation de nodules racinaires ou caulinaires
Pour obtenir un nodule fixateur, trois mécanismes sont mis en place sous le contrôle de la plante : l’infection bactérienne, l’organogénèse nodulaire et enfin la fixation de l’azote. En ce qui concerne la nodulation racinaire, les bactéries colonisent la surface de la racine (Figure 3A) puis pénètrent dans les tissus au niveau des poils absorbants (infection intracellulaire ; Figure 3B) ou plus rarement par les cellules épidermiques (infection par « crack entry » ou intercellulaire ; Goormachtig et al., 2004a ; Goormachtig et al., 2004b ). Les bactéries envahissent ensuite le cortex de la racine via des structures tubulaires, les cordons d’infection (Figure 3C), puis sont libérées dans des vésicules appelées symbiosomes situées à l’intérieur des nodules formés à partir de divisions du cortex racinaire. En effet, parallèlement à la progression de l’infection, l’organogénèse nodulaire s’est mise en place. Les cellules du cortex et du péricycle ont été activées pour entrer en division et former un primordium nodulaire (Figure 3D), qui se différencie ensuite en nodule mature (Crespi et Galvez, 2000). C’est dans les symbiosomes que les bactéries se différencient en bactéroïdes fixateurs d’azote (Figure 3E). L’azote est réduit par la nitrogénase bactérienne et exporté vers le cytosol de la cellule hôte sous forme d’ammonium ou d’acides aminés par le biais de systèmes navettes (Figure 3F) (Udvardi et Day, 1997). Lors de ce processus, la plante en produisant de la leghémoglobine autour des symbiosomes, maintient une pression partielle
Figure 4. La nodulation aérienne chez Sesbania rostrata A. Primordium racinaire émergeant des structures de la tige.
B. Tige portant des nodules aériens matures formés à partir des primordia racinaires de la tige. C. Coupe de nodules caulinaires.
A : Tsien et al., 1983 ; B-C : Duhoux and Nicole, 2004.
Figure 5. Les différents types de nodules chez les Légumineuses
A. Représentation des deux principaux types de développement nodulaire chez les Légumineuses. Le primordium nodulaire des nodules indéterminés est initié dans les cellules du cortex interne alors que celui des nodules déterminés provient du cortex externe. Dans les nodules matures, le méristème est persistant dans le cas des nodules indéterminés alors qu’il disparaît dans les nodules déterminés. Enfin, le nodule indéterminé se différencie en plusieurs zones, alors que le nodule déterminé mature possède uniquement une zone de fixation (zone III).
B. Représentation des deux types de nodules matures. Il n’y pas de méristème dans le nodule déterminé mature. C-D. Nodules indéterminés de Medicago sativa entiers (C) et en coupe longitudinale (D). Les nodules sont allongés et différenciés en 5 zones. La zone méristématique (I), la zone d’infection (II), la zone de fixation (III), la zone de sénescence (IV) et la zone saprophytique (V).
E-F. Nodules déterminés de Lotus japonicus en coupe transversale (E) et entier (F) Organisation homogène avec une
zone unique de fixation.
A : Crespi and Galvez, 2000 ; B : Duhoux and Nicole, 2004 ; D : Timmers et al., 2000; E-F : Ott et al., 2005. Nodule indéterminé Nodule déterminé Endoderme Flux de carbone Stèle racinaire Primordia nodulaire Cellules méristématiques Division des cellules du cortex Rhizobia Courbure des poils Cordon d’infection Nodules matures Tissus vasculaires Développement d’un nodule déterminé Développement d’un nodule indéterminé Temps post inoculation
A
B
C
IF
II III IV VD
E
basse en oxygène nécessaire au bon fonctionnement de la nitrogénase, tout en assurant un approvisionnement suffisant en oxygène pour la respiration des bactéroïdes (Ott et al., 2005).
La nodulation sur les tiges est beaucoup plus rare. La légumineuse tropicale Sesbania rostrata est un des exemples les plus étudiés. C’est une plante tropicale d’Afrique de l’ouest adaptée à la croissance en conditions humides. Suite à une infection par Azorhizobium caulinodans, des nodules peuvent être formés sur les tiges au niveau de sites prédéterminés correspondant à des primordia racinaires dormants disposés en rang le long de la tige (Figure 4). A la différence des nodules racinaires, le nodule se forme donc ici à partir d’une « pré-structure » mais le développement des nodules aériens et racinaires est morphologiquement équivalent (Goormachtig et al., 1997). Il existe aussi des rhizobia photosynthétiques capables de former des nodules sur les tiges d’Aeschynomene ou les hypocotyles du genre Lotonis (Giraud et Fleischman, 2004).
b. Deux types de nodules déterminés / indéterminés
Le type de nodule dépend de la plante hôte et non de son symbionte. Ainsi, les Légumineuses tempérées (pois, luzerne, trèfle…) forment généralement des nodules indéterminés, alors que les Légumineuses tropicales (soja, haricot…) forment habituellement des nodules déterminés (Hirsch, 1992). Cependant, certaines plantes comme Sesbania rostrata peuvent former des nodules des deux types selon les conditions environnementales (Fernandez-Lopez et al., 1998). C’est notamment selon le site d’initiation des divisions cellulaires du cortex que les deux types de nodules se distinguent. Les nodules indéterminés se développent à partir des cellules du cortex interne alors que les nodules déterminés se développent à partir des cellules du cortex externe (Figure 5A-B). Les nodules indéterminés sont caractérisés par la présence d’un méristème persistant. Des cellules sont constamment ajoutées à la partie distale du nodule, ce qui lui confère une forme allongée (Hirsch, 1992 ; Crespi et Galvez, 2000). Toutes les étapes de développement nodulaire sont présentes au sein d’un même nodule selon un gradient de différenciation de la partie distale (méristème) à la partie proximale (racine). Ainsi le nodule est divisé en cinq zones (Figure 5C-D) : la zone méristématique (I) ; la zone d’infection (II) où les bactéries sont libérées ; l’interzone (II-III) riche en amyloplastes ; la zone de fixation (III) où l’azote atmosphérique est fixé par les bactéroïdes ; la zone de sénescence (IV) où bactéroïdes et cellules végétales dégénèrent et la zone saprophytique (V) apparaissant plus tardivement et constituant une niche pour les bactéries non différenciées (Vasse et al., 1990 ; Timmers et al., 2000). Au contraire, les nodules déterminés ont une activité méristématique qui disparait très tôt après l’initiation du
E
F
G
H
I
J
K
L
Figure 6. Les racines de Lotus japonicus déterminent la spécificité d’hôte
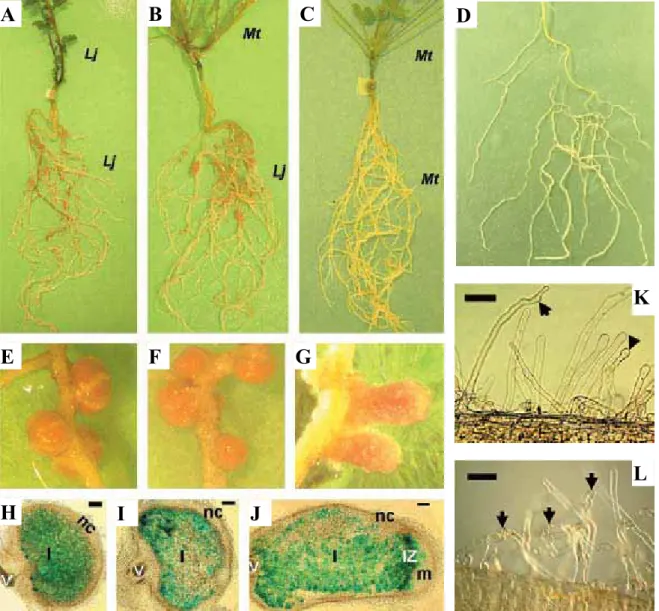
A. Racine inoculée de Lj greffée sur une tige de Lj. B. Racine inoculée de Lj greffée sur une tige de Mt. C.
Racine inoculée de Mt greffée sur une tige de Mt. D. Racine inoculée de Mt greffée sur une tige de Lj. A-B. Inoculation avec M. loti. C-D. Inoculation avec S. meliloti. E, F, et G présentent les nodules observées sur les plantes A, B et C ; il n’y’a pas de nodule formé sur la plante D. H, I et J représentent les sections des nodules des plantes A, B et C. K et L. Poils absorbants des racines D et C. K. Poils gonflés (tête de flèche) et déformés (flèche). L. Poils en crosse de berger (flèches). La coloration bleue indique la présence de rhizobia exprimant laȕ-galactosidase. Barres = 300μm (H) ; 100μm (I-J) ; 50μm (K-L).
Lj : Lotus japonicus ; Mt : Medicago truncatula ; I : Zone envahie ; nc : cortex nodulaire ; V : vascularisation ; IZ : Zone d’infection ; m : méristème.
nodule. La croissance du nodule se fait par élargissement des cellules, donnant une forme arrondie au nodule (Figure 5E-F). Il n’y a pas de différenciation spatiale du nodule, juste une différenciation temporelle. Enfin, dans les nodules indéterminés l’azote est principalement exporté sous forme d’asparagine et de glutamine, et sous forme d’uréides dans les nodules déterminés.
c. La spécificité d’hôte
L’interaction Rhizobium / Légumineuse est caractérisée par la spécificité avec laquelle elle s’établit. En général, chaque Légumineuse ne peut être infectée que par un nombre restreint de souches de rhizobia et réciproquement, chaque souche de rhizobia ne peut infecter qu’un nombre limité de genres de Légumineuses. Ainsi, Medicago truncatula ne peut être nodulée que par Sinorhizobium meliloti et Sinorhizobium medicae. Cependant, le degré de spécificité d’une souche est très variable, pouvant aller de quelques hôtes à plus d’une centaine d’hôtes. Ainsi Sinorhizobium NGR234 possède un spectre d’hôtes exceptionnellement large. Il est capable de noduler 112 genres de Légumineuses (Broughton et Perret, 1999).
Afin de déterminer si la spécificité d’hôte et la détermination du type de nodule sont contrôlées par la tige ou la racine des Légumineuses, des expériences de greffe entre M. truncatula et Lotus japonicus ont été réalisées. Ces deux Légumineuses ont des symbiontes différents (S. meliloti et Mesorhizobium loti) et forment respectivement des nodules de type indéterminé et déterminé. Les racines de L. japonicus greffées sur des tiges de M. truncatula sont toujours infectées par M. loti et forment des nodules déterminés normaux. Cependant, des racines de M. truncatula greffées sur des tiges de L. japonicus ne sont infectées ni par S. meliloti, ni par une mixture S. meliloti et M. loti. Ces résultats indiquent un rôle de la racine (et non de la tige) dans la détermination du type de nodule et de la spécificité d’hôte chez L. japonicus, tandis qu’un facteur provenant de la tige, serait requis pour l’initiation des primordia et le développement des nodules de type indéterminés chez M. truncatula (Figure 6) (Lohar et VandenBosch, 2005).
Figure 8. La mycorhization des racines des Légumineuses
A. Racines de Medicago truncatula colonisées par Glomus intraradices. Des arbuscules sont visibles dans les
cellules du cortex (flèche). v, vésicule.
B. Arbuscule mature de Glomus versiforme dans des racines de Medicago truncatula.
C. Représentation schématique de l’endosymbiose avec Glomus sp dans une cellule corticale.
A-B : Harrison, 2005 ; C : Parniske, 2000.
A
B
C
Figure 7. Diversité des Légumineuses
A. Pisum sativum, le pois cultivé (Papilionoideae). B. Vicia faba, la fève (Papilionoideae).
C. Trifolium repens, le trèfle (Papilionoideae). D. Arachis hypogaea, l’arachide (Papilionoideae). E. Tamarindus indica, le tamarinier (Caesalpinoideae). F. Glycine max, le soja (Papilionoideae).
G. Cercis siliquastrum (Caesalpinoideae). H. Albizia julibrissin (Mimosoideae).
C
E
1.2 Les partenaires
1.2.1 Les Légumineuses
a. Intérêt des Légumineuses
Les Légumineuses ou Fabaceae représentent une famille importante et variée des angiospermes. En effet, il s’agit de la troisième plus grande famille chez les plantes supérieures avec plus de 720 genres et 20000 espèces allant de la luzerne, espèce herbacée, aux arbres composant les forêts tropicales d’Amérique Latine et d’Afrique Tropicale (Cronk et al., 2006).
Seconde famille derrière les Graminées, les Légumineuses ont une grande importance au niveau de l’agriculture. Elles sont cultivées pour leurs graines (riches en protéines) ou pour leurs propriétés fourragères et représentent 12 à 15% des terres cultivables dans le monde et 27% de la production mondiale des cultures. Les Légumineuses à graines contribuent pour 33% aux besoins azotés de l’alimentation humaine, avec par ordre d’importance : le haricot (Phaseolus vulgaris), le pois (Pisum sativum), le pois chiche (Cicer arietinum), la fève (Vicia faba), le pois d’Angole (Cajanus cajan), le pois à vache (Vigna unguiculata) et la lentille (Lens culinaris) (Graham et Vance, 2003). Enfin, plus de 35% des huiles végétales proviennent de Légumineuses avec en tête le soja et l’arachide. Elles entrent donc dans l’alimentation humaine mais sont aussi indispensables à la production animale en termes de nourriture animale et de fourrages. Les Légumineuses fourragères sont principalement constituées dans les zones tempérées de la luzerne (Medicago sativa), des trèfles (Trifolium spp), du lotier (Lotus corniculatus), des mélilots (Melilotus spp) et des vesces (Vicia spp) (Figure 7) (Graham et Vance, 2003).
Leur capacité à établir des symbioses avec les bactéries de la famille Rhizobium leur permet de produire de grandes quantités d’ammonium. Les Légumineuses jouent donc un rôle essentiel dans les écosystèmes naturels, en agriculture et en agroforesterie, en colonisant des espaces pauvres en azote et en constituant une source majeure de fertilisants naturels et économiques pour les cultures. Ce sont notamment des agents importants lors de la rotation des cultures. Cependant, beaucoup de Légumineuses sont sensibles à la sécheresse et à l’acidité des sols, ce qui gène l’expansion de ces cultures dans les pays secs. Ainsi, l’identification d’espèces hôtes et rhizobiennes tolérantes au sel et/ou à l’acidité des sols sont une priorité dans le domaine de la recherche agricole (Graham et Vance, 2003).
Figure 9. Classification des Légumineuses selon les séquences du gène matK
La superfamille des Légumineuses (en jaune) est divisée en trois familles (en orange) : les Caesalpinoideae, les Mimosoideae et les Papilionoideae. Les sept clades des Papilionoideae sont présentés (en bleu). Les principaux genres des différents clades sont présentés à droite de l’arbre. Sont soulignés en vert les deux genres contenant les deux principales Légumineuses modèles.
D’après Wojciechowski et al., 2004.
changements Genistoides Dalbergioides Cladrastis Mirbelioides Milletioides Robinioides Galégoides IRLC
Papilionoideae
Bien que toutes les Légumineuses ne soient pas capables de noduler (88% des espèces examinées forment des nodules (Graham et Vance, 2003) il a été observé que les Rhizobia peuvent infecter les racines de Légumineuses non nodulantes et qu’une activité nitrogénase est détectée chez ces plantes (Doyle, 1998).
Enfin les Légumineuses, comme 80% des plantes, établissent des symbioses avec les champignons mycorhiziens, qui leur assurent un meilleur approvisionnement en phosphates (Figure 8). L’étude de ces plantes permet donc la comparaison des deux types de symbiose : bactérienne et mycorhizienne.
b. La phylogénie des Légumineuses
Les Légumineuses sont classiquement divisées en trois sous-familles : les Caesalpinoideae, les Mimosoideae et les Papilionoideae (ou Faboideae) (Figure 9). La plupart des espèces cultivées appartiennent à cette dernière sous-famille.
Les Caesalpinoideae (environ 150 genres et 2200 espèces) sont principalement constituées de plantes ornementales et d’arbres à bois ou alimentaires (Poinciana et Tamarindus) (Young et al., 2003). Très peu de membres de cette sous-famille sont capables de noduler, 30% selon Soltis et al. (1995) contre 90% chez les deux autres sous-familles ; Chamaecrista fasciculata est une des espèces nodulées (Doyle, 1998).
Les Mimosoideae (62 genres et environ 2500 espèces) sont présentes principalement dans les forêts tropicales et subtropicales avec notamment les genres Acacia et Albizia (Young et al., 2003).
Enfin, les Papilionoideae représentent la sous-famille la plus diverse avec 429 genres et environ 12000 espèces. Deux groupes majeurs de plantes cultivées sont présents au sein de cette sous-famille : les légumineuses tropicales (ou Phaséolides) et les légumineuses tempérées (ou Galégoides). Parmi les Phaséolides se trouvent notamment les genres Cajanus, Glycine (soja), Phaseolus (haricot) et Vigna (vigne) et parmi les Galegoides les genres Cicer (pois chiche), Lens (lentilles), Lotus (lotier), Medicago (luzerne), Melilotus (mélilots), Pisum (pois), Trifolium (trèfle) et Vicia (vesce). Des plantes fourragères ainsi que des arbres (Robinia) sont aussi présents dans cette sous famille (Young et al., 2003).
La monophylogénie de cette sous famille a été clairement établie, et l’analyse phylogénétique basée sur les séquences du gène matK (maturase chloroplastique K) divise la sous-famille des Papilionoideae en 7 clades (Figure 9) (Wojciechowski et al., 2004). Les deux derniers clades, Robinioids et IRLC (Inverted Repeat Loss Clade) sont regroupés au sein de l’ensemble fréquemment appelé Hologalegina ou Galégoides (Cronk et al., 2006).
Goupe
monophylogénétique Nom actuel Ancien nom Plantes hôtes associées
1 Genre Rhizobium R. etli bv phaseoli R. gallicum bv gallicum bv phaseoli R. giardinii bv giardinii bv phaseoli R. hainanense R. huautlense R. leguminosarum bv trifolii bv phaseoli bv viceae R. mongolense R. tropici TypeA Type B R. leguminosarum bv phaseoli type I R. trifolii R. phaseoli R. phaseoli, R. leguminosarum bv phaseoli type II Phaseolus vulgaris Phaseolus spp. Phaseolus spp. Phaseolus spp. Phaseolus spp. Arachis hypogaea Sesbania rostrata Trifolium spp. Phaseolus vulgaris
Lens spp, Pisum spp, Vicia spp
Medicago ruthenica,Phaseolus vulgaris
Phaseolus vulgaris Phaseolus vulgaris
Genre Allorhizobium
A. undicola Medicago sativa, Lotus arabicus
Genre Sinorhizobium S. fredii S. medicae S. meliloti S. saheli S. terangae bv sesbaniae S. xinjiangense R. fredii S. meliloti R. meliloti
Glycine max cv Peking, Glycine soja,
Medicago sativa
Medicago orbicularis, M. polymorpha, M. rugosa,M. truncatula Medicago spp., Melilotus spp. S. rostrata S. rostrata Glycine max 2 Genre Ensifer
E. adharens Medicago sativa
3 Genre Mesorhizobium
M. loti
M. tianshanense
R. loti
R. tianshanense
Lotus corniculatus,L. japonicus, L. tenuis, L. kryvolii, L. filicalius, L. schoelleri Glycine max 4 Genre Bradyrhizobium B. elkanii B. japonicum B. liaoningense B. japonicum DNA homologie groupe II R. japonicum Glycine spp Glycine spp
Glycine max,G. soja
6 Genre Azorhizobium
A. caulinodans Sesbania rostrata
9 Genre Ralstonia
R. taiwanensis Mimosa pudica
Tableau I. Les Légumineuses les plus étudiées et leurs différents symbiontes
1.2.2 Les Rhizobia
a. La phylogénie des Rhizobia
Les Rhizobia sont d’abord définis par leur capacité à vivre à l’intérieur des nodules des Légumineuses hôtes (et de Parasponia) et à réduire l’azote atmosphérique en ammonium assimilable par la plante.
Tous les Rhizobia caractérisés sont des bactéries Gram-négatives (au contraire des actinomycètes), présentes dans le sol et appartenant aux sous-classes Į et ȕ des protéobactéries. Selon une analyse phylogénétique basée sur l’ARN 16S, elles sont dispersées dans 12 genres parmi neuf groupes monophylogénétiques (Sawada et al., 2003).
La plupart des espèces se trouvent dans la sous-classe Į, divisée en sept groupes monophylogénétiques (Figure 10) :
Rhizobium et Allorhizobium, Sinorhizobium (et Ensifer), Mesorhizobium,
Bradyrhizobium,
Methylobacterium (Jaftha et al., 2002 ; Sy et al., 2001), Azorhizobium,
Devosia (Rivas et al., 2002).
Chez la sous classe ȕ, des Rhizobia sont présents parmi les groupes monophylogénétiques : Burkholderia (Moulin et al., 2001),
Ralstonia (Chen et al., 2003).
Il est intéressant de noter que certaines espèces de Rhizobia sont très proches de bactéries pathogènes comme Agrobacterium tumefaciens (Į –protéobactérie) ou Ralstonia solanacearum (ȕ-protéobactérie) (Figure 10). Bien que les Rhizobia soient étudiés depuis plus de 100 ans, des symbiontes ont été identifiés pour moins de 10% des 720 genres de Légumineuses. Il est donc probable que de nouveaux genres de Rhizobia soient découverts parmi les sous-classes Į et ȕ des protéobactéries et peut-être même parmi d’autres taxons. Le Tableau I présente les Rhizobia caractérisées (en février 2003) pour les hôtes les plus étudiés. Parmi ces couples, de nombreux travaux de recherche ont été réalisés avec :
Trifolium repens et Rhizobium leguminosarum, Vicia faba et Rhizobium leguminosarum,
Figure 11. Relations entre la phylogénie des Rhizobia et leurs propriétés symbiotiques
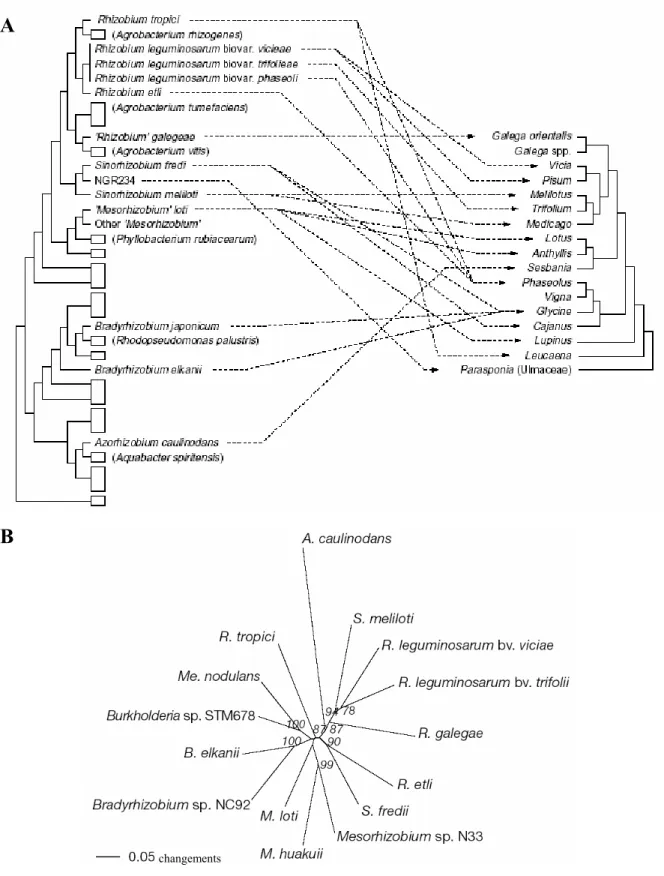
A. Comparaison des phylogénies moléculaires des Rhizobia et des Légumineuses. A gauche, arbre phylogénétique
de représentants des Rhizobia basé sur l’ARN 16S. Les rectangles indiquent des genres non symbiotiques, dont des représentants sont donnés entre parenthèses. A droite, un arbre phylogénétique d’espèces représentantes des Légumineuses basé sur les séquences du gène rbcL. Les flèches connectent les Rhizobia et leurs hôtes. Le large spectre de NGR234 est juste représenté par sa capacité à noduler Parasponia. Bien que les spectres d’hôtes soient plus larges que ceux indiqués, le manque de corrélation entre les deux arbres apparaît clairement.
B. Arbre phylogénétique des principaux représentants symbiotiques des Į-protéobactéries et d’une ȕ-protéobactérie (Burkholderia sp) basé sur les séquences du gène symbiotique nodA. A, Azorhizobium ; B, Bradyrhizobium ; M, Mesorhizobium ; Me, Méthylobacterium ; R, Rhizobium ; S, Sinorhizobium.
A : Doyle, 1998 ; B : Moulin et al., 2001.
B
Phaseolus vulgaris et Rhizobium etli ou leguminosarum, Medicago truncatula et Sinorhizobium meliloti,
Lotus japonicus et Mesorhizobium loti, Glycine max et Bradyrhizobium japonicum, Sesbania rostrata et Azorhizobium caulinodans.
Les analyses phylogénétiques à partir de l’ARN 16S ont permis de mettre en évidence une grande diversité évolutive des Rhizobia et excluent apparemment toute coévolution large avec leur plante hôte (Figure 11A). Le niveau élevé de transfert de gènes peut cependant gêner cette analyse (Doyle, 1998). Ainsi, les Rhizobia appartiennent à quelques groupes majeurs des protéobactéries, mais généralement chaque groupe contenant des bactéries symbiotiques est plus proche d’un groupe sans aucune capacité symbiotique (comme Rhizobium spp proche d’Agrobacterium tumefaciens) que des autres groupes de bactéries capables de noduler. Il est cependant possible qu’une analyse phylogénétique basée sur l’ARN 16S n’apporte pas les bonnes réponses en ce qui concerne les origines symbiotiques. En effet, beaucoup de gènes bactériens intervenant au cours de la nodulation se trouvent sur les plasmides et les transferts horizontaux pourraient avoir joué un rôle important dans l’évolution du processus de nodulation. De plus, beaucoup de gènes de nodulation bactériens sont groupés en « îles symbiotiques » (Doyle, 1998). Ainsi, lorsque les analyses phylogénétiques sont réalisées à partir de gène nodA (et plus de l’ARN 16S), les distances entre Rhizobia sont plus courtes (Figure 11B), ce qui suggère de nouveau un transfert de gène horizontal (Moulin et al., 2001).
b. Génomique des Rhizobia Six souches sont entièrement séquencées :
Mesorhizobium loti MAFF303099 (Kaneko et al., 2000),
Bradyrhizobium japonicum USDA110 (Gottfert et al., 2001 ; Kaneko et al., 2002), Sinorhizobium meliloti 1021 (Barnett et al., 2001 ; Galibert et al., 2001),
Rhizobium etli CFN42 (Gonzalez et al., 2003 ; Gonzalez et al., 2006), Rhizobium leguminosarum 3841 (Young et al., 2006),
Bradyrhizobium sp. BTAi1 et ORS278 (Giraud et al., 2007).
Pour d’autres Rhizobia seules les « îles symbiotiques » ou les plasmides symbiotiques ont été séquencés. C’est le cas par exemple de Rhizobium sp. NGR234 (plasmide symbiotique de 536kb ; Freiberg et al., 1997) ou Mesorhizobium loti R7A (« île symbiotique » de 611kb ; Sullivan et al., 2002).
chromosomes (Mb/1C) Medicago Trifolium Melilotus Pisum Vicia Lens Cicer Lotus Phaseolus Vigna Glycine Cajanus M. truncatula M. sativa T. pretense T. repens M. officinalis P. sativum V. faba L. culinaris C. arietinum L. japonicus P. vulgaris V. unguiculata G. max C. cajan 2n=2x=16 2n=4x=32 2n=2x=14 2n=4x=32 2n=2x=16 2n=2x=14 2n=2x=12 2n=2x=14 2n=2x=16 2n=2x=12 2n=2x=22 2n=2x=22 2n=4x=40 2n=2x=22 466 1 715 637 956 1 103 4 337 13 059 4 116 931 466 588 515 1103 858
Figure 12. Les Légumineuses partagent de la synténie
Carte consensus issue de la comparaison de six espèces de Légumineuses : Glycine max (Gm), Medicago truncatula (Mt), Medicago sativa (Ms), Pisum sativum (Ps), Vigna radiata (Vr) et Phaseolus vulgaris (Pv). S, Bras court des chromosomes de M. truncatula ; L, bras long. Les blocks de synténie sont dessinés à l’échelle, basée sur les distances génétiques. Les lignes solides correspondent aux réarrangements postulés, les doubles flèches aux inversions postulées.