UNIVERSITE de TOULOUSE III – PAUL SABATIER
Ecole Doctorale GEET
THESE
En vue de l’obtention du
DOCTORAT DE L’UNIVERSITE DE TOULOUSE
Délivré par l’Université Toulouse III – Paul Sabatier
Discipline : Anatomie et Imagerie en Médecine
présentée et soutenue
par
Frédéric LAUWERS
Le 17/12/2007
ETUDE QUANTITATIVE TRIDIMENSIONNELLE DU
RESEAU MICRO-VASCULAIRE DU CORTEX
CEREBRAL HUMAIN
Directeur de thèse : Jean-Pierre Marc-Vergnes
JURY
Me Isabelle Berry
Président
Mr Jacques Roland
Rapporteur
Mr Grégoire Malandain
Rapporteur
Mr Jean-Pierre Marc-Vergnes
Directeur
Mr Henri Duvernoy
Examinateu r
Mr Francis Cassot
Examinateur
INTRODUCTION 4
ORGANISATION DU MANUSCRIT 5
1 MATERIELS ET METHODES 7
1.1 MATERIEL ANATOMIQUE 7
1.2 CONSTRUCTION DES MOSAÏQUES 9
1.2.1 ACQUISITION DES DONNEES EN MICROSCOPIE CONFOCALE 9
1.2.2 TRAITEMENT DES BLOCS 10
1.2.3 RECALAGE DES BLOCS 11
1.3 SEGMENTATION DU RESEAU VASCULAIRE. 15
1.3.1 SEUILLAGE DE LA MOSAÏQUE 15
1.3.2 MASQUAGE 15
1.3.3 CARTE DE DISTANCES ET EXTRACTION DE LA LIGNE CENTRALE 16
2 ANALYSE DU RESEAU SEGMENTE -CONNECTIVITE. 19
2.1 DEFINITIONS 19
2.2 CONNECTIVITE 19
3 MORPHOMETRIE ELEMENTAIRE 23
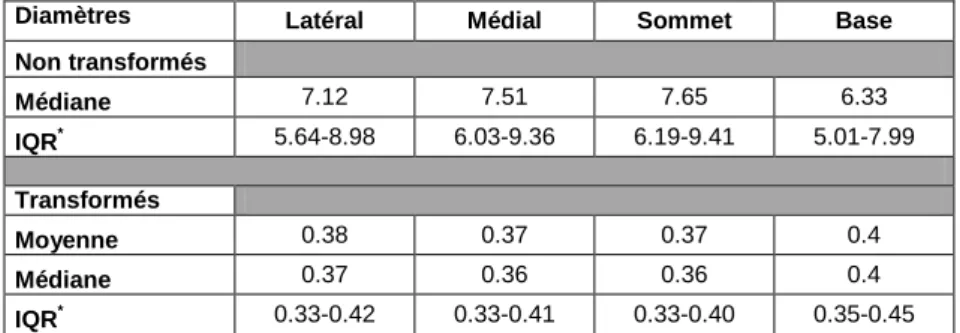
4 DIAMETRES ET LONGUEURS 28
4.1 CARACTERISTIQUES DES DISTRIBUTIONS DES DIAMETRES ET DES LONGUEURS : 28
4.1.1 HISTOGRAMME DES LONGUEURS 28
4.1.2 HISTOGRAMME DES DIAMETRES 29
4.2 COMPARAISONS DES DIAMETRES 29
4.2.1 REGION PAR REGION : LATERAL, MEDIAL, SOMMET, BASE 29
4.2.2 COUPE PAR COUPE (V16,V17,V18) 30
4.3 DIAMETRES ET LONGUEURS CAPILLAIRES 31
5 ANALYSE DES STRUCTURES ARBORESCENTES 33
5.1 EXTRACTION DES ARBORESCENCES DU RESEAU 33
5.1.1 METHODES 33
5.1.2 RESULTATS 34
5.2 DIFFERENCIATION ARTERIO-VEINEUSE 38
5.2.1 METHODES 38
5.2.2 RESULTATS 43
5.2.2.1 Différenciation artério-veineuse et classification 43
5.3 ANALYSE TOPOLOGIQUE 55
5.3.1 DESCRIPTION GENERALE 55
5.3.2 APPLICATION AUX VAISSEAUX DU CORTEX CEREBRAL 56
5.3.2.1 Notion de groupe – Classification des arborescences selon Strahler-Kassab 56
5.3.2.2 Apport de l’analyse topologique dans la discrimination artério-veineuse 60
5.3.3 ESSAI DE GENERALISATION DES LOIS DE HORTON 65
5.3.3.1 Rappel 65
5.3.3.2 Bases du raisonnement : analyse des lois de Horton « expérimentales » 66
5.3.3.3 Généralisation à l’ensemble des arborescences : lois de Horton généralisées 67
5.3.3.4 Mise en évidence des lois généralisées pour N, L, D quelle que soit l’arborescence 68
5.3.3.5 Comparaison des lois généralisées aux données expérimentales. Ajustement final des
paramètres 69
5.3.3.6 Analyse des écarts entre les variables réelles et leurs valeurs prédites par les lois de Horton
généralisées 71
5.3.4 POUR CONCLURE CETTE SECTION 72
5.4 ANALYSE TYPOLOGIQUE ET MORPHOMETRIQUE DES BIFURCATIONS 73
5.4.1 DEFINITIONS ET METHODES 73
5.4.2 RESULTATS 74
5.4.2.1 Répartition des bifurcations 74
5.4.2.2 Statistique descriptive 75
5.4.2.3 Analyse des distributions statistiques 76
5.4.3 EN CONCLUSION DE CE CHAPITRE 78
6 ANALYSE SPATIALE DE LA DENSITE VASCULAIRE 80
6.1 CARTES DE DENSITE 80
6.2 ANALYSE DE LA DENSITE EN FONCTION DE LA PROFONDEUR 82
6.3 ANALYSE DE LA DENSITE TANGENTIELLEMENT A LA SURFACE DU CORTEX 86
7 ELEMENTS DE DISCUSSION – PERSPECTIVES METHODOLOGIQUES 89
8 PERSPECTIVES D’APPLICATIONS ET CONCLUSION 93
8.1 IMAGERIE FONCTIONNELLE 93
8.2 DIFFUSION DE L’OXYGENE 94
8.3 ANGIOGENESE NORMALE ET PATHOLOGIQUE 95
CONCLUSION 96
INDEX 97
BIBLIOGRAPHIE 100
A NOVEL THREE-DIMENSIONAL COMPUTER-ASSISTED METHOD FOR A QUANTITATIVE STUDY OF MICROVASCULAR NETWORKS OF THE HUMAN
CEREBRAL CORTEX Microcirculation, 13: 15–32, 2006 109
MORPHOMETRY OF THE HUMAN CEREBRAL CORTEX MICROCIRCULATION: GENERAL CHARACTERISTICS AND SPACE-RELATED PROFILES. Neuroimage 127
INTRODUCTION
Ce travail consiste en une étude quantitative du réseau micro-vasculaire du cortex cérébral humain. Il s’inscrit dans la thématique de l’unité 825 de l’INSERM développée autour de l’imagerie neuro-fonctionnelle. Dans ce domaine particulier, la microcirculation du cortex est le trait d’union singulier entre l’activation neuronale et le signal enregistré. Nous ne disposons pas actuellement de données anatomiques suffisantes qui permettraient de formaliser les modifications physiologiques de la microcirculation qui sous-tendent les hypothèses posées par le paradigme d’activation cérébrale. La modélisation mathématique du réseau vasculaire cortical humain est probablement aujourd’hui une étape nécessaire à la compréhension du système. Cette approche intégrée a déjà servi l’étude de la macrocirculation cérébrale (18) et fait la preuve de son intérêt dans d’autres domaines de la microcirculation puisque certains modèles ont été validés in vivo (mésentère de rat) (117).
Dans le domaine de la microcirculation, le manque d’informations anatomiques, quantitatives, tridimensionnelles, précises est un problème récurrent. Sans vouloir en dresser une liste exhaustive, ces informations sont indispensables à la compréhension de nombreux phénomènes physiologiques ou physiopathologiques. La distribution des pressions et les contraintes de cisaillement dans les micro-vaisseaux (120), le transport et la diffusion de l’oxygène et autres métabolites ou agents thérapeutiques dans les systèmes physiologiques (10, 113) sont étroitement liés à l’architecture du réseau micro-vasculaire.
L’anatomie de la microcirculation influence la régulation du débit sanguin, l’angiogénèse et le remodelage vasculaire (17, 82), et l’adaptation immédiate ou progressive du lit vasculaire en réponse à la demande fonctionnelle des tissus (119), comme elle influence les variations du débit sanguin liées à l’activité neuronale.
L’anatomie de la microcirculation influence aussi l’interprétation des images fonctionnelles basées sur l’enregistrement de telles variations hémodynamiques (4, 54, 64, 88, 142).
Dans tous ces domaines, de nombreux chercheurs ont mis l’accent sur le rôle fondamental de l’architecture du réseau et sur la nécessité de traiter ce sujet dans sa dimension anatomique, proprement tridimensionnelle (149).
Cependant, pour des raisons essentiellement d’ordre technique, les études micro-anatomiques chez l’homme sont rares (12) et il n’existe dans la littérature que peu de données quantitatives concernant le réseau micro-vasculaire du cortex cérébral humain. En effet, si la « macrocirculation » du système nerveux central a fait l’objet de très nombreux travaux (79, 80), l’essentiel de nos connaissances concernant les vaisseaux du cortex cérébral humain provient des écrits de Duvernoy (34-36). Henri Duvernoy a décrit les principales caractéristiques des vaisseaux du cerveau humain depuis le réseau pie-mérien jusqu’aux couches profondes du cortex. A partir de ses observations il a proposé une organisation fonctionnelle du réseau et décrit une unité vasculaire centrée par une veine et entourée par une couronne artérielle. Les informations quantitatives et qualitatives proposées nécessitent d’être complétées notamment d’un point de vue topologique.
Les réseaux vasculaires pulmonaires (44, 59, 67, 69, 136, 148) et coronaires cardiaques (9, 70, 99, 155) ont été à la base des développements les plus récents en matière
d’évaluation quantitative. Kassab a notamment mis en avant plusieurs approches innovantes pour l’étude des arborescences vasculaires (70, 71). L’un des éléments les plus marquants de la microcirculation du cortex cérébral est sa complexité géométrique associée à sa nature proprement tridimensionnelle. Des comparaisons entre les résultats obtenus en morphométrie 2D et 3D ont montré que seule une information tridimensionnelle pouvait permettre d’acquérir des données fiables sur les réseaux complexes, les techniques bidimensionnelles devant se cantonner à l’analyse de réseaux plats (bidimensionnels) pour éviter la sous-estimation des paramètres étudiés (97). Au moment où nous écrivons ces lignes peu d’études anatomiques tridimensionnelles ont été publiées concernant le cortex cérébral. Certaines approches originales ont cependant vu le jour (29, 55) concernant la numérisation de grands échantillons du réseau vasculaire cortical chez l’animal. Des résultats quantitatifs en sont issus (125). Au regard des règles méthodologiques imposées, aucune étude, à notre connaissance, n’a concerné le cerveau humain. D’autre part, la mise en évidence d’une potentielle organisation du réseau vasculaire à l’échelle de l’architecture fonctionnelle neuronale requiert une surface critique qui pourrait être estimée aux alentours de 10 millimètres carrés (143).
L’objectif de ce travail est d’introduire une méthode d’analyse numérique tridimensionnelle des vaisseaux du cortex cérébral humain permettant d’obtenir les données morphométriques et topologiques pertinentes, indispensables à une approche biomécanique du système.
ORGANISATION DU MANUSCRIT
La première partie décrit les différentes étapes qui permettent de passer du cerveau à l’image virtuelle tridimensionnelle, incluant la préparation anatomique, l’acquisition des images en microscopie confocale et la segmentation des vaisseaux.
Les développements qui suivent s’en tiennent à vérifier la précision de la méthode et contribuent à sa validation à travers une étude morphométrique du réseau dans sa globalité.
Une troisième partie concerne l’étude des artères et des veines du cortex cérébral. Nous verrons que la discrimination entre artères et veines reste un problème incomplètement résolu à l’échelle d’un matériel anatomique inerte. Cette séparation des vaisseaux est incontournable pour avancer dans la compréhension du réseau. Dans cette section sont décrits les principes de l’étude topologique des arborescences et leurs perspectives en termes de modélisation sont illustrées par un essai de généralisation des lois qui gouvernent cette organisation topologique.
L’analyse des bifurcations vasculaires fait suite à l’étude topologique des arborescences. En effet, la classification des bifurcations tient compte de cet aspect. Les résultats préliminaires concernant la population globale des arborescences, les artères et les veines en particulier, sont présentés.
Le dernier chapitre de ce manuscrit s’intéresse à la distribution spatiale du réseau de manière quantitative. Le paramètre étudié est la densité vasculaire et ses variations en fonction de la profondeur corticale mais également dans un plan parallèle à la surface cérébrale. Dans cette étude les populations capillaires et arborescentes sont séparées, ceci permet de décrire la contribution relative de chacune d’entre elles à l’organisation laminaire du cortex dans les deux plans de
l’espace définis préalablement. Les résultats obtenus sont discutés et leurs implications en matière d’imagerie fonctionnelle font l’objet d’une réflexion particulière.
La discussion qui conclu ce travail développe les perspectives qui s’ensuivent, leur portée scientifique en matière de recherche anatomique et les enjeux biomédicaux qui en dépendent. S’agissant d’une approche méthodologique originale, ces perspectives dépassent le domaine d’applications qui leur est donné ici. Le cortex cérébral est un champ d’investigation pérenne, la masse de données traitées à l’occasion de cette thèse a souvent dérouté le matériel informatique utilisé, nous restons pourtant, à l’échelle du cortex, dans l’infiniment petit.
1 MATERIELS ET METHODES
1.1 MATERIEL ANATOMIQUE
Les 3 coupes que nous avons utilisées sont issues du cerveau d’une femme de 65 ans décédée depuis 2 heures d’un lymphome digestif. L’injection a été réalisée selon le protocole décrit ci-après en 1978 par Henri Duvernoy à Besançon.
Le prélèvement cérébral est réalisé par une craniotomie circulaire du pôle frontal au pôle occipital. D’abord à la scie pour la table externe puis au ciseau à frapper pour la table interne afin d’épargner la dure-mère d’une blessure potentielle. Le volet calvarial est prudemment détaché de la dure-mère. L’intégrité de celle-ci est un facteur prépondérant de la réussite de l’injection. Le décollement est poursuivi au niveau de la base d’avant en arrière. Les pédicules nerveux et vasculaires sont sectionnés au fur et à mesure. La tente du cervelet est désinsérée de ses attaches osseuses et laissée avec la préparation. Les artères carotides internes et vertébrales sont individualisées et canulées en vue de l’injection. Les canules sont des cathéters en polyéthylène de 1,7 à 2 mm de diamètre interne, un trocard mousse est introduit dans chaque artère et maintenu par une ligature solide.
L’injection est réalisée alors que le cerveau est suspendu dans un bac d’eau courante tiède. Selon l’auteur la phase de rinçage utilisant du sérum physiologique tiède n’est pas impérative dans la mesure où l’injection a lieu dans des délais post-mortem normaux (inférieur à 6 heures). Cependant un rinçage succinct permet d’observer le cerveau blanchir et d’estimer la qualité du lit vasculaire. Le retour veineux est habituellement très rapide.
Préparation de la solution d’injection (400 cc) :
On injectera 100 cc de solution par chaque tronc artériel à l’aide d’une seringue en verre de 100 cc.
Dans un premier temps on dissout la gélatine à froid dans 200 cc d’eau distillée (10 % de gélatine Gépulver®, laboratoire Merck). Le mélange est battu jusqu’à l’obtention d’un liquide homogène puis chauffé progressivement et maintenu à une température constante de 45° au bain-marie.
On ajoute alors à ce premier volume 200 cc d’encre de Chine (Pélikan® noir). La solution parfaitement homogène est gardée à température constante (45°).
Les 4 artères sont injectées successivement en clampant tour à tour celles qui ne sont pas utilisées. La pression d’injection n’est pas mesurée, l’injection est manuelle, la pression est forte (subjectif). On observe le cerveau noircir. En fin d’injection les 4 canules sont clampées à l’aide de pinces hémostatiques. Le cerveau injecté est laissé dans un bain d’eau courante froide pour une durée de 4 heures au minimum. Ceci permet la prise de la gélatine. A l’issue de cette phase de refroidissement les canules sont coupées et la phase de fixation est envisagée.
Le cerveau injecté est suspendu dans un récipient contenant une solution de 10 litres de formol à 10 %. Pour améliorer la fixation dans les zones les plus profondes, la même solution est injectée dans le système ventriculaire au niveau des cornes frontales des ventricules latéraux. Un trocard est introduit progressivement dans la région orbitaire, le piston de la seringue descend spontanément dès que la corne frontale est atteinte.
Cette phase de fixation dure 45 jours. Le cerveau est alors lavé à l’eau courante. La fixation au formol s’associe à une rétraction globale de la pièce anatomique. Des blocs de 1 cm d’épaisseur sont découpés pour être inclus en paraffine. Idéalement une section sagittale médiane permet de localiser les 2 commissures et de réaliser les coupes ultérieures à partir de ces repères. H. Duvernoy a traité le cerveau dont les coupes que nous utilisons sont issues en sections coronales totales sans référence directe au “plan bi-commissural”.
Les blocs de 1 cm d’épaisseur sont plongés dans un bain d’alcool à 97 % changé tous les 5 jours. La manœuvre est répétée 4 à 5 fois. Enfin ces blocs sont passés dans 2 bains successifs d’alcool absolu à 2 jours d’intervalle.
Les pièces sont alors trempées dans des bains de toluène changés tous les 4 jours. Quatre bains successifs sont au minimum nécessaires pour envisager l’inclusion en paraffine.
Deux bains de paraffine à l’étuve à 57° sont suffis ants. La pièce est alors incluse dans un volume de paraffine adapté à sa taille et refroidie.
Les coupes sont réalisées par un microtome permettant de traiter des organes entier (Leica®). La réalisation de coupes paraffinées épaisses (350 à 400 µm) est délicate. Elle nécessite un chauffage prudent de la surface du bloc à l’aide d’un bec-bunsen. La coupe obtenue est étalée sur une plaque en verre préalablement nettoyée et dégraissée, enduite d’une solution de gélatine à 5 % et posée sur une plaque chauffante.
Les coupes étalées sur leur lame vont subir une étape de diaphanisation qui consiste à les rendre transparentes de façon à obtenir un meilleur contraste, une meilleure visualisation de l’arbre vasculaire injecté aux dépends du tissu cérébral proprement dit.
Un premier temps consiste à enlever la paraffine par des bains successifs de toluène. Au moins 3 bains sont nécessaires à 4 jours d’intervalle.
La solution de Spalteholz consiste en un mélange de salicylate de méthyl et de benzoate de benzyl dans des proportions respectives de 3 volumes pour 2. Deux bains sont habituellement suffisants, à quelques jours d’intervalle. Dès lors la coupe diaphanisée, étalée sur sa lame, est séchée à l’air. Une lamelle de dimension adaptée est posée après interposition d’une quantité suffisante de baume du Canada.
La mise en forme d’une coupe selon cette technique nécessite donc au minimum 3,5 mois entre le moment où le cerveau est prélevé et le moment où la coupe est prête pour une observation microscopique. C’est une technique longue et minutieuse qui nécessite une certaine habitude. Selon Duvernoy qui a injecté et conditionné lui-même plusieurs centaines de cerveaux, le temps le plus aléatoire reste celui de l’injection proprement dite. Le facteur le plus favorable à un résultat satisfaisant est le délai d’injection post-mortem qui ne doit pas dépasser 6 heures. L’âge et les causes du décès jouent également un rôle prépondérant. Le problème de la rétraction inhérent à certaines étapes de cette technique de préparation n’a pas fait l’objet d’une quantification précise. Il est toutefois nécessaire d’en tenir compte dès que sont abordées des données chiffrées. Les coupes utilisées pour notre étude sont numérotées 231 V16, V17 et V18. Le premier nombre correspond au numéro chronologique du cerveau injecté (231e cerveau injecté). Le chiffre et le nombre qui suivent correspondent au numéro de la coupe dans le cerveau. Il s’agit de coupes frontales passant par la commissure postérieure. La zone que nous avons sélectionnée avec H. Duvernoy est située
au niveau du lobe temporal de part et d’autre du sillon collatéral (gyrus temporo-occipital médial (para-hippocampal) en médial et gyrus temporo-temporo-occipital latéral (fusiforme) en latéral). Cette zone a été choisie pour l’excellente qualité de l’injection à ce niveau et l’orientation préférentielle des vaisseaux, la coupe paraissant orthogonale au plan de la surface corticale.
1.2 CONSTRUCTION DES MOSAÏQUES
1.2.1 Acquisition des données en microscopie confocale
L’utilisation du microscope confocal en réflexion n’est pas commune (109). Habituellement ce matériel est utilisé en fluorescence. Sans entrer précisément dans des principes énoncés par ailleurs (40), les notions suivantes marquent l’originalité du système par rapport à la microscopie optique conventionnelle :
- illumination d’une petite zone de l’échantillon par une source laser monochromatique à forte luminosité (meilleure résolution latérale), - passage de la lumière réfléchie par un diaphragme (pinhole)
permettant de sélectionner avec précision le plan focal d’acquisition et donc d’éliminer toute lumière qui ne provient pas du plan focal (meilleure résolution axiale),
- balayage de l’échantillon par une micromécanique de balayage optique de précision, ligne par ligne et plan par plan,
- couplage du microscope à un système informatique nécessaire à l’acquisition, au traitement et au stockage des images,
Au total, le microscope confocal à balayage laser est un “microtome opto-digital” qui permet de générer des coupes optiques jointives digitalisées en 2D pixel par pixel.
L’acquisition des images a été réalisée au Centre de Biologie du Développement de l’Université Paul Sabatier sur un microscope confocal Zeiss LSM 410 avec un laser de 543 nm de longueur d’onde et un objectif de grossissement 20x, possédant une ouverture numérique de 0.75 (Zeiss Plan-Apochromat).
Les paramètres d’acquisitions choisis sont un compromis tenant compte de la résolution de l’image, la taille des plus petits vaisseaux, le volume de cortex à numériser et le temps d’acquisition. Les plus petites structures qui composent le réseau vasculaire du cortex cérébral ont un diamètre de 3µ.
- Résolution latérale de l’image : l’objectif utilisé couvre une zone de 625µ x 625µ. Une matrice de 512 par 512 donne une résolution latérale de 1.22µ x 1.22µ suffisante pour visualiser des vaisseaux dont le diamètre est supérieur à 2.45µ (Théorème de Niquyst-Shannon), - Résolution axiale : les coupes de Duvernoy ont une épaisseur
d’environ 300µ, cependant quels que soient la résolution et l’objectif utilisés, au-delà de 200µ le rapport signal sur bruit se dégrade jusqu’à ne plus permettre l’identification des vaisseaux. Les 200µ exploitables sont numérisés avec un pas de 3µ en 70 coupes numérotées de 0 à 69. Ce pas de 3µ peut théoriquement générer un effet de volume partiel sur des structures de petite taille (≤ 3µ) mais de tels vaisseaux sont rares et encore plus rarement situés strictement parallèlement au plan de coupe. Ce compromis d’acquisition est donc choisi car il
représente d’une part, un temps d’acquisition raisonnable et d’autre part, une taille de fichier acceptable.
Chaque pile d’images constitue un bloc (512 x 512 x 70) représentant un volume de 625µ x 625µ x 207µ, la taille du voxel est de 1.22µ x 1.22µ x 3µ.
Dans la mesure où le volume d’acquisition est limité dans la profondeur (z = 207µ), il est développé dans le plan (x ; y) de telle sorte que nous acquérons une mosaïque de blocs représentant une grande surface de cortex. La platine du microscope a été équipée d’un système de déplacement par vis micrométrique (Linear Encoder Heidenhain LS646C, Display Unit ND720). Ce système permet de maîtriser les mouvements de la platine en x et en y avec une précision d’environ 5µ. L’acquisition de la mosaïque est réalisée ligne par ligne, en respectant environ 50 voxels de superposition entre 2 blocs adjacents (en x et en y) pour faciliter le recalage ultérieur des images de la mosaïque. Chaque étape est consignée sur un cahier de numérisation où sont enregistrés le nom de chaque bloc comportant un code chiffre pour la ligne et un code lettre pour la colonne et donc sa position dans la mosaïque. Les paramètres de contraste et de luminosité ne sont pas modifiés pendant l’acquisition. La surface de la coupe n’étant pas strictement horizontale une mise à niveau est réalisée régulièrement afin d’éviter un certain degré de dérive en z.
Le temps d’acquisition est d’environ 7mn incluant le temps de numérisation, d’enregistrement et les manœuvres de déplacement nécessaires avec leur degré de précision. Les données sont stockées sur un disque dur. Chaque image représente 258 Ko, chaque bloc de 70 images représente 17.5 Mo. Les systèmes de visualisation inclus dans le software du microscope confocal permettent de visualiser les blocs de diverses façons notamment en image stéréoscopique ou en codage couleur de la profondeur. En fait, à ce stade, les blocs sont directement traités par un logiciel d’image 3D : ResolveRT 4.0 (Amira Mercury TGS, Merignac, France, San Diego, USA, Zuse Institute, Berlin, Germany).
142 blocs ont été numérisés sur la coupe V16, 143 sur la coupe V17 et 218 sur la coupe V18 qui a bénéficié d’une extension au niveau de la base du gyrus temporo-occipital latéral. A partir de ces acquisitions 10 mosaïques ont été construites.
1.2.2 Traitement des blocs
La construction des mosaïques et la segmentation ultérieures du réseau vasculaire nécessitent un filtrage préalable des blocs. Tout d’abord, un filtre médian 2D permet une diminution globale du bruit lié au microscope. Ensuite, afin de compenser la perte de luminosité dans les coupes les plus profondes, un pré-seuillage est réalisé. Ce seuillage est variable en fonction de la profondeur z et consiste en une fonction arithmétique définie pour chaque point par A = a(a >
s (z)), où a est la valeur pour un point (x, y, z), et s (z) est une fonction linéaire
croissante de z. Pour la plupart des blocs la fonction utilisée est la suivante :
+ × 〉 207 20 60 z a a
1 Une coupe appartenant à un bloc avant seuillage (à gauche), Après application d’un seuil variable (au centre), Projection des 70 coupes du bloc après seuillage (à droite)
Cependant, des corrections plus importantes ont été nécessaires sur certains blocs, probablement en raison de modifications intempestives des paramètres de contraste et de luminosité (ou de variation du pinhole) en cours d’acquisition. Enfin, certaines zones de la coupe V18 ont été numérisées à 4 ans d’intervalle et nous avons pu observer une variation de l’intensité lumineuse des images au détriment de leur partie inférieure notamment. Ceci est probablement dû à la dégradation des qualités optiques du microscope utilisé. Une étude des variations d’intensité en x et en y a conduit à une correction spécifique de ce problème par la fonction arithmétique ci-après :
(
4 6 2)(
3 6 2)
10 . 082 . 5 10 . 1375 . 1 1 10 . 4023 . 1 10 . 661 . 8 1 099 . 1 20 j j i i a − − − − − + − + + 1 ≤ i ≤ 512 1 ≤ j ≤ 512 1.2.3 Recalage des blocsL’ensemble de ces étapes et sont décrites dans la thèse de Céline Fouard (40) et dans les articles scientifiques qui en découlent (39, 41).
La notion de mosaïque tridimensionnelle s’impose à l’analyse de grand volume de cortex dans la mesure où le champ du microscope confocal n’est pas assez étendu pour pouvoir observer l’ensemble de l’échantillon en une seule fois. Le système de déplacement de la platine par vis micrométrique n’est pas toujours d’une précision suffisante. La simple juxtaposition des blocs à partir des déplacements enregistrés sur le système de déplacement fait apparaître des erreurs qui peuvent se cumuler au fur et à mesure de la construction des mosaïques. Lors de l’acquisition des images, un recouvrement partiel d’environ 10% de la taille des images (environ 50 voxels) permet le réalignement. Celui-ci est réalisé automatiquement par une technique de corrélation où la position de deux images adjacentes est estimée en optimisant les résultats d’une mesure de similarité sur la zone de recouvrement (voir Céline Fouard). Le recalage est réalisé d’abord dans le plan XY. Pour ce recalage planaire, les projections en maximum d’intensité des images (ou MIP pour Maximum Intensity Projection) sont utilisées.
Dans le plan Z les images présentent une légère déviation. Celle-ci est due au fait que la surface de la coupe n’est pas strictement parallèle à la lamelle de la préparation. Lors de l’acquisition, ce paramètre est pris en compte et une mise au point est réalisée régulièrement de telle sorte que la numérisation commence au niveau des premiers vaisseaux visibles. Ces mises au point successives induisent un décalage dans la direction Z qui est corrigé avec le même principe.
2 A gauche : noter les zones de superposition qui permette le recalage des blocs. Au centre et à
droite : appréciation de la qualité du recalage sous différentes modalités.
Cette méthode de recalage fonctionne correctement dès lors que les blocs d’images traités sont totalement homogènes en termes d’acquisition et de prétraitement. Au cours de ce travail certains blocs ont été numérisés à plusieurs années d’intervalle et il est probable que les qualités optiques du microscope utilisé voire certaines modifications des paramètres d’acquisition aient pu induire un certain degré d’anisotropie rendant impossible le recalage automatique. Dans ces cas-là, le recalage a été réalisé manuellement en utilisant le logiciel ImagePro et en acceptant le meilleur compromis. Les coordonnées obtenues pour chaque bloc ont été reportées dans ResolveRT pour la suite du traitement. Le système de recalage automatique est parfois tenu en échec pour les mosaïques de très grande taille. Après plusieurs essais, cette constatation est l’un des éléments qui a conduit à découper le cortex étudié en plusieurs zones. Les autres raisons de cette décision étant la limitation propre de la mémoire des ordinateurs utilisés ne permettant pas de manipuler des mosaïques trop importantes, la géométrie du cortex numérisé qui a finalement imposé ce découpage sur des critères anatomiques évidents
3 Identification d’un problème de recalage (V18l)
Dix mosaïques ont été construites à partir de 3 coupes adjacentes de la région du sillon collatéral au niveau du lobe temporal droit. Les limites de chaque mosaïque ont donc été fixées en fonction de la forme du cortex (rectiligne ou curviligne) et de l’appartenance au gyrus temporo-occipital médial (para-hippocampal) ou au gyrus temporo-occipital latéral (gyrus fusiforme).Cette partition du cortex a permis avant tout d’obtenir des volumes de données compatibles avec des temps de calcul raisonnables.
Nous avons par ailleurs supposé que les zones de plicature corticales que sont la base et le sommet des gyrus pouvaient présenter des caractéristiques
morphométriques et topologiques différentes. Enfin, nous avons posé l’hypothèse d’une possible variabilité fonctionnelle entre le cortex situé sur le versant médial du sillon collatéral appartenant au gyrus temporo-occipital médial et le cortex situé sur le versant latéral, appartenant au gyrus temporo-occipital latéral.
Ce découpage régional est illustré par la figure ci-après.
4 A gauche : la coupe V17, à droite : la région du sillon collatéral droit
Les mosaïques sont nommées par le numéro de coupe et une initiale correspondant à la région à laquelle elles appartiennent : l pour latéral, m pour médial, s pour sommet, b pour base. Ce découpage impose un certain degré de superposition et certains blocs sont communs à 2 mosaïques adjacentes.
Ceci est illustré par la figure suivante.
5 Découpage des mosaïques
Sommet Base Gyrus temporo-occipital latéral Gyrus temporo-occipital médial
Les dix mosaïques sont représentées ci-dessous en projection et en codage couleur de la profondeur.
6 Les 10 mosaïques représentées en codage couleur de la profondeur
Chaque mosaïque contient une grande quantité de données (plusieurs giga-octets) et ne peut être chargée et traitée en une seule fois dans la mémoire d’un
V16l V16m V16s
V17l V17m V17s
V18l V18m V18s
ordinateur de bureau. Pour cette raison, ResolveRT utilise un format de stockage particulier (HDF5) qui permet de gérer des données multidimensionnelles associées à des métadonnées et permet donc un accès rapide à des sous-blocs d’une grande image.
1.3 SEGMENTATION DU RESEAU VASCULAIRE. 1.3.1 Seuillage de la mosaïque
Un seuil uniforme est appliqué à l’ensemble de la mosaïque. Compte tenu du seuillage variable déjà appliqué à chaque bloc, il suffit de choisir pour ce seuil une valeur inférieure au minimum du seuil variable. On obtient alors une forme binaire de la mosaïque (labels) où chaque point d’un vaisseau prend la valeur 1 et chaque point du tissu cérébral la valeur 0.
1.3.2 Masquage
Les gros vaisseaux qui occupent le sulcus et certaines zones corticales nécessitent une vérification propre car leur visualisation après seuillage laisse apparaître des « défauts de remplissage » qui sont liés au fait que la lumière émise par le microscope confocal est considérablement atténuée dans les régions axiales de ces gros vaisseaux. Ce phénomène peut conduire à des erreurs de segmentation ou d’estimation du diamètre, certains gros troncs vasculaires pouvant à l’extrême prendre un aspect dédoublé. D’autre part, il est nécessaire d’exclure la zone du sillon qui pourrait parasiter les données quantitatives étudiées globalement. Il est cependant nécessaire d’en délimiter proprement les frontières en respectant notamment la première couche corticale qui ne contient que peu de vaisseaux. Cette phase de masquage précède donc le calcul des distances extra ou intra-vasculaires. Il s’agit d’une opération manuelle, longue et fastidieuse car il faut redéfinir les limites du masque sur chaque coupe de chaque bloc contenant soit une partie du sillon, soit un vaisseau de grand diamètre. On utilise un éditeur de segmentation (ResolveRT), qui permet de réaliser cette opération de masquage de manière interactive à l’aide d’outils de sélection classiques. Les masques ainsi définis, sont des images binaires et sont appliqués à la forme binaire de la mosaïque ou labels.
1.3.3 Carte de distances et extraction de la ligne centrale
L’étape suivante consiste en l’extraction de la ligne centrale des vaisseaux. Les lignes centrales sont des représentations compactes des données vasculaires. Elles donnent des informations directes sur la topologie du réseau, la direction des vaisseaux, les longueurs des segments et les types de connections. Si l’on y ajoute une carte de distance, on obtient des informations sur les diamètres et la densité vasculaires.
Globalement, à partir de l’image binaire, la carte de distance calcule pour chaque point du vaisseau la distance la plus courte qui le sépare du tissu. Une carte de distance est une image dans laquelle le niveau de gris en chaque point de l’objet correspond à sa distance par rapport au fond. ResolveSkel utilise, pour le calcul de cette distance, un masque de chanfrein. Il s’agit d’une transformation qui calcule une valeur approchée de la distance euclidienne. Cette technique réalise un bon compromis entre la précision du résultat et le temps de calcul. Le squelette est obtenu par un procédé d’amincissement (thinning) qui consiste en la suppression successive des couches frontières de l’objet. Le squelette est défini comme le lieu des maxima locaux de la carte de distance. Ce squelette est homotope et centré. Cet algorithme a été adapté au traitement de blocs d’images en tenant compte de la continuité (ou discontinuité) des trajets vasculaires d’un bloc à l’autre.
L’image obtenue est donc une représentation des distances intra-vasculaires, c’est-à-dire de la plus petite distance entre un point et le tissu. Si l’on se situe en un point de l’axe d’un vaisseau (ou ligne centrale ou squelette), cette distance constitue une bonne estimation du rayon en ce point, en admettant que la section du vaisseau soit circulaire, ce qui semble une approximation raisonnable. Notons que, dans le calcul du rayon, l’algorithme retient la distance la plus courte du centre du vaisseau au tissu. Un lissage est généralement appliqué au squelette afin d’en éliminer les petites fluctuations.
Le réseau vasculaire est stocké sous forme de lignes (lineset), elles-mêmes constituées d’une succession de points pour lesquels le rayon est connu. Il peut être représenté par des cylindres dont le diamètre restitue le diamètre vasculaire en chaque point du lineset. Ce « lineset » peut être visualisé et superposé aux différents types de représentations tridimensionnelles de l’image originale obtenue en microscopie confocale à des fins d’illustration ou de vérification.
8 Comparaison du réseau reconstruit à partir du lineset et des images originales : a : image en projection de la mosaïque, b : visualisation du lineset en codage couleur de la profondeur, c :
Les différentes étapes de vérification conduisant systématiquement à un certain degré de sous-estimation du diamètre vasculaire par la méthode de segmentation un facteur correctif sera appliqué systématiquement à toute analyse quantitative du réseau. Déterminé de manière empirique ce facteur est de +25 %.
9 Représentation du squelette. A gauche : représentation d’une zone du squelette non lissé, à droite : la même zone représenté à partir d’un squelette lissé.
Notons que le lineset peut être édité et que les données le composant sont également stockées sous forme d’un fichier ASCII. Chaque ligne de ce fichier correspond à un point du lineset et comprend le numéro du segment auquel il appartient, ses coordonnées x, y, z et le rayon du vaisseau en ce point.
10 Représentation du lineset incluant tous les points du squelette. A droite : les données au format texte qui serviront à l’analyse quantitative. Les 3 premières colonnes sont les coordonnées x, y, z
de chaque point, la quatrième colonne indique le rayon. Les accolades séparent les segments vasculaires.
Pour chacune des dix mosaïques construites, le réseau micro-vasculaire extrait est donc décrit sous la forme d’un « squelette », constitué d’un ensemble de points échantillonnant les lignes centrales de tous les vaisseaux. En chaque point, outre ses coordonnées (X, Y, Z) la segmentation fournit la valeur du rayon du vaisseau en ce point.
Outre le fait que cette forme rend possible une analyse morphologique et topologique, que nous traiterons plus loin, il est intéressant de noter l’énorme compression de données ainsi réalisée, puisqu’elle permet de passer d’une mosaïque d’images de 1 à plusieurs giga-octets à un squelette d’à peine plus d’une dizaine de megaoctets, en perdant peu d’information utile. Dans ce travail nous nous posons en utilisateur des outils mis à notre disposition par le logiciel ResolveSkel. L’ensemble des développements méthodologiques qui vont suivre, appliqués au réseau ainsi résumé nous permettront de juger de l’homogénéité des squelettes obtenus et seront discutés dès que l’une ou l’autre des étapes décrites dans ce chapitre pourront être mis en cause ; depuis la préparation du matériel anatomique jusqu’à la méthode de segmentation.
La genèse de Resolve RT
La possibilité de numériser de grands volumes de la vascularisation corticale a nécessité le développement d’outils informatiques permettant d’extraire automatiquement de l’image les informations pertinentes à l’analyse quantitative du réseau microvasculaire. Historiquement ces informations ont été obtenues manuellement en utilisant le “Neuron tracing system” distribué par Eutectics Electronics, développé par Joseph J. Capowski à partir de 1983 (15, 68) pour tracer, représenter, et cataloguer des neurones dans leur structure tridimensionnelle à partir de l’observation de coupes histologiques en microscopie optique conventionnelle. Ce logiciel permettait de suivre les structures arborescentes jusqu’à un diamètre de 7 microns (78).
A partir des premières mosaïques construites à partir d’images de microscopie confocale l’information a été obtenue à l’aide du logiciel SEIRVIN (Suivi et Échantillonnage Interactif d’un Réseau Vasculaire en Images Numériques), développé par Francis CASSOT (1999), programmé en Visual Basic 5.0. Ce logiciel permettait de tracer manuellement et interactivement le réseau microvasculaire et d’en extraire les principales arborescences pour une étude quantitative (19).
Ce logiciel n’était pas adapté à l’étude du réseau dans sa globalité.
C’est donc pour permettre une étude morphométrique de grande ampleur du réseau microvasculaire cérébral que le projet MicroVisu3D a été créé. Les objectifs étant :
• La construction automatique de mosaïques, à partir d’images 3D, représentant des volumes relativement grands du cortex cérébral,
• A partir des mosaïques, l’extraction de ces données, par des méthodes automatiques ou semi-automatiques de segmentation, du réseau microvasculaire, sous une forme telle qu’elle puisse permettre une analyse quantitative, morphométrique et topologique.
Plusieurs équipes ont travaillé en collaboration pour réaliser ce projet :
• l’unité 455 de l’INSERM,
• l’équipe EPIDAURE (Epidaure Projet Images, Diagnostic AUtomatique, RobotiquE) de l’INRIA (Institut National de Recherche en Informatique et Automatique),
• et la société TGS Europe qui a développé le logiciel de visualisation 3D Resolve.
C’est ainsi que MicroVisu3D est devenu une extension du logiciel AMIRA. Depuis Décembre 2005, une version d’AMIRA dédiée à la microscopie est disponible sous le nom de Resolve RT ; elle inclut le module MicroVisu3D, rebaptisé ResolveSkel.
2 ANALYSE DU RESEAU SEGMENTE -CONNECTIVITE.
2.1 DEFINITIONS
- Le point est l’unité de segmentation. Le réseau vasculaire est segmenté en points, un point est créé tous les 1.6µ. Pour chacun de ces points sont connus :
o les coordonnées dans un repère orthonormé (x, y, z) o le diamètre.
- Le segment est défini par une succession de points entre 2 nœuds. - Le nœud correspond à un évènement du réseau (connectivité) :
o le nœud d’ordre 1 est un nœud sans connexion, il indique un segment terminal
o le nœud d’ordre 2 est un nœud simple, joignant 2 segments. Cet évènement relativement rare semble un accident de la segmentation o le nœud d’ordre 3 indique une bifurcation
o le nœud d’ordre 4 indique une trifurcation
o les nœuds d’ordre supérieur à 4 indiquent généralement des connexions aberrantes et sont des indicateurs de bruit.
Les résultats sont exprimés par mosaïque, par zone (latéral et médial correspondant respectivement aux gyrus temporo-occipital latéral et médial), par coupe et enfin totalisés.
2.2 CONNECTIVITE Mosaïque Nombre de blocs Nombre de segments Sgt/ Bloc Nombre de nœuds Segments terminaux Nœuds
simples Bifurcations Trifurcations
Connexions multiples % % % % % V16l 83 48310 582.05 42221 16193 38.35 1035 2.45 22631 53.60 1802 4.27 560 1.33 V17l 91 44249 486.25 40222 16517 41.06 618 1.54 21893 54.43 1010 2.51 184 0.46 V18l 83 52116 627.90 41449 12139 29.29 392 0.95 25898 62.48 2233 5.39 787 1.90 V16m 56 26777 478.16 23396 8928 38.16 89 0.38 13355 57.08 848 3.62 176 0.75 V17m 59 32814 556.17 27168 8996 33.11 132 0.49 16476 60.64 1178 4.34 386 1.42 V18m 65 41138 632.89 32614 9367 28.72 151 0.46 20821 63.84 1731 5.31 544 1.67 V16s 36 15090 419.17 13608 5594 41.11 36 0.26 7535 55.37 365 2.68 78 0.57 V17s 34 15440 454.12 12968 4253 32.80 70 0.54 8189 63.15 400 3.08 56 0.43 V18s 36 21262 590.61 16918 5047 29.83 478 2.83 9891 58.46 1061 6.27 441 2.61 V18b 81 62046 766.00 48113 12249 25.46 454 0.94 29001 60.28 2858 5.94 1551 3.22 Moyenne 559.33 Ecart type 103.80 Latéral 257 144675 562.94 123892 44849 36.20 2045 1.65 70422 56.84 5045 4.07 1531 1.24 Médial 180 100729 559.61 83178 27291 32.81 372 0.45 50652 60.90 3757 4.52 1106 1.33 Sommet 106 51792 488.60 43494 14894 34.24 584 1.34 25615 58.89 1826 4.20 575 1.32 Base 81 62046 766.00 48113 12249 25.46 454 0.94 29001 60.28 2858 5.94 1551 3.22 V16 175 90177 515.30 79225 30715 38.77 1160 1.46 43521 54.93 3015 3.81 814 1.03 V17 184 92503 502.73 80358 29766 37.04 820 1.02 46558 57.94 2588 3.22 626 0.78 V18 (-b) 184 114516 622.37 90981 26553 29.19 1021 1.12 56610 62.22 5025 5.52 1772 1.95 V18 265 176562 666.27 139094 38802 27.90 1475 1.06 85611 61.55 7883 5.67 3323 2.39 Total 624 359242 575.71 298677 99283 33.24 3455 1.16 175690 58.82 13486 4.52 4763 1.59 Tableau 1 Connectivité
Le nombre de segments par bloc peut être considéré comme un indicateur de bruit. En ce sens, le squelette V18b est probablement le plus bruité. Ceci est corroboré par une grande proportion de connexions multiples (3.22%). A l’inverse, le nombre de segments terminaux augmente avec l’importance du filtrage. En effet, plus le filtrage est intense plus le risque de déconnexion est important. Ce paramètre semble donc varier en sens inverse des indicateurs de bruit cités plus haut.
Environ un tiers des segments sont terminaux ce qui peut paraître énorme. Environ 60% des nœuds d’ordre 1, marquant l’extrémité « libre » de ces segments sont effectivement situés sur les frontières du domaine de la mosaïque. Les 40% restants, soit à peu près 13% des segments, indiquent une interruption « interne » au domaine de la mosaïque. Elle peut être (25) soit d’ordre physiopathologique, soit liée à une injection imparfaite, soit liée à un problème de rupture de la continuité dû à la segmentation. Le fait que le nombre de ces déconnections augmente avec la profondeur indique que cette dernière hypothèse est la plus vraisemblable.
D’autre part, on peut considérer que la partie déconnectée du réseau principal englobe une proportion importante de bruit. Pour isoler cette sous-population de vaisseaux connectés le réseau est injecté à partir d’une arborescence correctement centrée dans la mosaïque, sans contrainte de résistance (ou r = 1000000000). Les résultats de ce filtrage secondaire sont exprimés dans le tableau ci-dessous.
Réseau complet Réseau connecté Réseau déconnecté
Nombre de segments Nombre de points Pts/ Sgt Nombre de nœuds Segments Points Pts/ Sgt Nœuds Segments Points Pts/ Sgt Mosaïque % % % % % V16l 48310 1446033 29.93 42221 83.60 87.08 31.18 73.60 16.40 12.92 23.57 V17l 44249 1662158 37.56 40222 87.74 90.71 38.84 79.01 12.26 9.29 28.45 V18l 52116 1508827 28.95 41449 89.98 92.81 29.86 74.34 10.02 7.19 20.78 V16m 26777 891837 33.31 23396 86.15 89.12 34.46 76.45 13.85 10.88 26.16 V17m 32814 1050282 32.01 27168 90.16 92.68 32.90 75.49 9.84 7.32 23.82 V18m 41138 1195210 29.05 32614 90.00 96.97 31.31 74.81 10.00 3.03 8.79 V16s 15090 547061 36.25 13608 83.37 87.80 38.18 73.76 16.63 12.20 26.60 V17s 15440 605517 39.22 12968 92.25 93.14 39.60 77.95 7.75 6.86 34.72 V18s 21262 613223 28.84 16918 85.10 90.41 30.64 73.93 14.90 9.59 18.57 V18b 62046 1700237 27.40 48113 90.56 93.97 28.44 68.10 9.44 6.03 17.49
Moyenne 32.25 Moyenne 33.54 Moyenne 22.89
Ecart Type 4.16 Ecart Type 4.03 Ecart Type 7.05
Latéral 144675 4617018 31.91 123892 87.16 90.26 33.05 75.60 12.84 9.74 24.21 Médial 100729 3137329 31.15 83178 89.03 93.30 32.64 75.49 10.97 6.70 19.01 Sommet 51792 1765801 34.09 43494 86.73 90.53 35.59 75.07 13.27 9.47 24.32 Base 62046 1700237 27.40 48113 90.56 93.97 28.44 68.10 9.44 6.03 17.49 V16 90177 2884931 31.99 79225 84.32 87.85 33.33 74.47 15.68 12.15 24.78 V17 92503 3317957 35.87 80358 89.35 91.78 36.84 77.65 10.65 8.22 27.70 V18 (-b) 114516 3317260 28.97 90981 89.08 93.87 30.52 74.43 10.92 6.13 16.28 V18 176562 5017497 28.42 139094 89.60 93.90 29.78 72.24 10.40 6.10 16.66 Total 359242 11220385 31.23 298677 88.21 91.72 32.48 74.29 11.79 8.28 21.94 Tableau 2 Proportion du réseau connecté
Ces données permettent encore d’apprécier la qualité de la segmentation et donc indirectement de la numérisation et peut-être de la qualité de préparation
des coupes. Le fait d’éliminer les segments déconnectés du réseau principal élimine une partie du bruit qui s’exprime de façon aléatoire sous la forme de segments aberrants isolés ou connectés en amas, de diamètres et de longueurs variables. Ces segments représentent environ 10% d’une population globale de 359242 segments. On note que l’analyse par région n’entraine pas de variabilité nette. V16 présente une proportion de segments déconnectés plus importante (15.68 %) qui peut encore traduire un filtrage plus agressif.
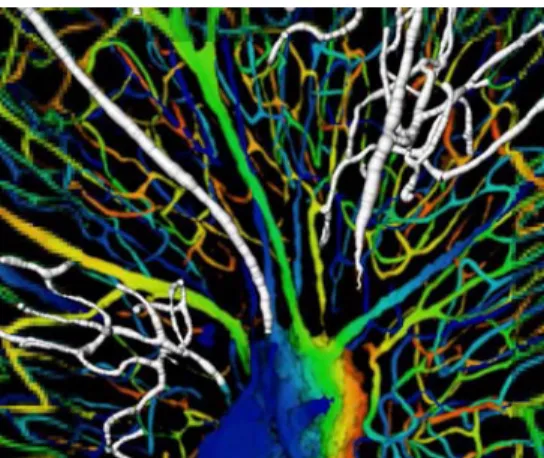
L’image suivante sépare le réseau connecté des segments déconnectés. Elle montre que ces derniers comprennent :
- une part de bruit,
- des segments réels déconnectés au sein du cortex, - une partie du réseau appartenant à la substance blanche.
11 Visualisation de la part connectée et de la part déconnectée du réseau
Ces premiers éléments permettent de valider raisonnablement les différentes étapes de la méthode depuis le choix du matériel anatomique, de la technique de numérisation en microscopie confocale optimisant le rapport signal sur bruit en faisant certes une concession sur l’étendue de l’acquisition en profondeur, mais permettant de segmenter la totalité du réseau vasculaire sans accident notable. L’examen des segments déconnectés montre qu’il s’agit le plus souvent de segments aberrants. On peut noter que si l’on déconnecte d’authentiques parties du réseau, il s’agit exclusivement de zones appartenant à la substance blanche. Ce type de déconnexion en masse ne s’est jamais produit dans le cortex proprement dit. Il ne nous a pas paru nécessaire à l’issue de cette première analyse d’envisager un procédé de raccordement des discontinuités.
Il ressort de cette étape des informations qui nous paraissent fondamentales et qu’il est aisé de vérifier en « se promenant » dans ces images tridimensionnelles du réseau vasculaire du cortex cérébral humain dont la résolution est extrêmement haute :
V18l : lineset complet V18l : réseau connecté V18l : segments déconnectés
- ResolveSkel permet de segmenter automatiquement de très grands volumes vasculaires avec une fiabilité évidente.
- Le réseau vasculaire du cortex cérébral humain est un réseau continu entièrement interconnecté, qu’il est possible à priori de perfuser dans son ensemble. Sur ce volume d’étude qui, au moins en surface, est à l’échelle d’un gyrus, il n’a pas été mis en évidence de rupture dans cette continuité notamment d’ordre pathologique.
Ces premiers éléments ne font pas apparaître d’information spécifiquement quantitative, on peut cependant noter que les trifurcations ne sont pas un évènement fortuit de la segmentation et représentent environ 4.5 % des modes de branchements à l’intérieur de ce réseau.
Il n’est pas possible d’envisager de comparer statistiquement les différentes mosaïques concernant ces données dans la mesure où sur un échantillon de cette taille, toute différence, y compris minime, apparaît significative. Ceci pose le problème du choix pertinent des outils nécessaires à valider et interpréter les résultats qui vont suivre.
3 MORPHOMETRIE ELEMENTAIRE
Pour chaque mosaïque ont été calculés :- le volume tissulaire
- le nombre de segments total et par mm3 - la longueur vasculaire totale et par mm3 - la surface vasculaire totale par mm3
- le volume vasculaire total et la densité vasculaire (pourcentage du volume vasculaire par rapport au volume tissulaire)
Mosaïque Volume tissulaire (mm3) Nombre de segments Longueur vasculaire totale (mm) Surface vasculaire totale (mm2) Volume vasculaire total (mm3) Nombre de segments / mm3 Longueur vasculaire /mm3 (mm/mm3) Surface vasculaire /mm3 (mm2/mm3) Densité vasculaire (%) V/S V16l 4.7 48310 2279 48.14 0.103 10278.72 484.89 10.24 2.19 0.21 V17l 5.17 44249 2585.4 59.19 0.1344 8558.80 500.08 11.45 2.60 0.23 V18l 4.7 52116 2447.1 60.08 0.1456 11088.51 520.66 12.78 3.10 0.24 V16m 2.6 26777 1389.8 34.06 0.0794 10298.85 534.54 13.10 3.05 0.23 V17m 3.165 32814 1658.6 38.46 0.0888 10367.77 524.04 12.15 2.81 0.23 V18m 3.79 41138 1989.1 50.25 0.1207 10854.35 524.83 13.26 3.18 0.24 V16s 2.35 15090 884.6 21.32 0.0484 6421.28 376.43 9.07 2.06 0.23 V17s 2.21 15440 961.8 25.93 0.0666 6986.43 435.20 11.73 3.01 0.26 V18s 2.37 21262 1006 23.35 0.0531 8971.31 424.47 9.85 2.24 0.23 V18b 4.41 62046 2704.1 55.71 0.1172 14069.39 613.17 12.63 2.66 0.21 Moyenne 9789.54 493.83 11.63 2.69 0.23 Ecart type 2194.90 67.20 1.46 0.41 0.01 Latéral 14.57 144675 7311.5 167.41 0.383 9929.65 501.82 11.49 2.63 0.23 Médial 9.555 100729 5037.5 122.77 0.2889 10542.02 527.21 12.85 3.02 0.24 Sommet 6.93 51792 2852.4 70.6 0.1681 7473.59 411.60 10.19 2.43 0.24 Base 4.41 62046 2704.1 55.71 0.1172 14069.39 613.17 12.63 2.66 0.21 V16 9.65 90177 4553.4 103.52 0.2308 9344.77 471.85 10.73 2.39 0.22 V17 10.545 92503 5205.8 123.58 0.2898 8772.21 493.67 11.72 2.75 0.23 V18 (-b) 10.86 114516 5442.2 133.68 0.3194 10544.75 501.12 12.31 2.94 0.24 V18 15.27 176562 8146.3 189.39 0.4366 11562.67 533.48 12.40 2.86 0.23 Total 35.465 359242 17905.5 416.49 0.9572 10129.48 504.88 11.74 2.70 0.23 Tableau 3 Résultats morphométriques sur la totalité de l’échantillon
Mosaïque Volume (mm3) Nombre de segments Longueur vasculaire totale (mm) Surface vasculaire totale (mm2) Volume vasculaire total (mm3) Nombre de segments / mm3 Longueur vasculaire /mm3 (mm/mm3) Surface vasculaire /mm3 (mm2/mm3) Densité vasculaire (%) V/S V16l 4.7 40385 1996.7 44.58 0.0963 8592.55 424.83 9.49 2.05 0.22 V17l 5.17 38822 2355.6 55.23 0.1276 7509.09 455.63 10.68 2.47 0.23 V18l 4.7 46896 2273 56.88 0.1397 9977.87 483.62 12.10 2.97 0.25 V16m 2.6 23068 1247 31.43 0.073 8872.31 479.62 12.09 2.81 0.23 V17m 3.165 29585 1544.1 36.32 0.0833 9347.55 487.87 11.48 2.63 0.23 V18m 3.79 37024 1854.8 47.25 0.1132 9768.87 489.39 12.47 2.99 0.24 V16s 2.35 12580 755.6 18.57 0.0428 5353.19 321.53 7.90 1.82 0.23 V17s 2.21 14243 896.9 24.31 0.0625 6444.80 405.84 11.00 2.83 0.26 V18s 2.37 18095 903.5 21.51 0.0496 7635.02 381.22 9.08 2.09 0.23 V18b 4.41 56187 2546.6 53.5 0.1141 12740.82 577.46 12.13 2.59 0.21 Moyenne 8624.21 450.70 10.84 2.52 0.23 Ecart type 2064.15 70.78 1.55 0.41 0.01 Latéral 14.57 126103 6625.3 156.69 0.3636 8654.98 454.72 10.75 2.50 0.23 Médial 9.555 89677 4645.9 115 0.2695 9385.35 486.23 12.04 2.82 0.23 Sommet 6.93 44918 2556 64.39 0.1549 6481.67 368.83 9.29 2.24 0.24 Base 4.41 56187 2546.6 53.5 0.1141 12740.82 577.46 12.13 2.59 0.21 V16 9.65 76033 3999.3 94.58 0.2121 7879.07 414.44 9.80 2.20 0.22 V17 10.545 82650 4796.6 115.86 0.2734 7837.84 454.87 10.99 2.59 0.24 V18 (-b) 10.86 102015 5031.3 125.64 0.3025 9393.65 463.29 11.57 2.79 0.24 V18 15.27 158202 7577.9 179.14 0.4166 10360.31 496.26 11.73 2.73 0.23 Total 35.465 316885 16373.8 389.58 0.9021 8935.15 461.69 10.98 2.54 0.23 Tableau 4 Résultats morphométriques sur la partie connectée de l’échantillon
Le tableau 3 étudie la totalité des linesets, le tableau 4 étudie la partie connectée du réseau. Pour optimiser ces résultats il a paru nécessaire de restreindre le volume de chaque mosaïque en z afin d’obtenir un échantillon homogène éliminant d’une part les zones vides créées par le recalage des blocs, et éliminant d’autre part les parties du réseau situées en superficie et surtout en profondeur contenant l’essentiel du bruit. Pour chaque squelette les données morphométriques ont donc été recalculées sur ce nouvel échantillon consistant en une « bande » comprise entre deux plans de coordonnées z=ZH et z=ZB. ZH et ZB variant pour chaque mosaïque de telle sorte que z est compris entre 100 et 120 µ. Le tableau 5 donne les paramètres étudiés pour cette nouvelle population.
12 V17l visualisée en (y) ci-dessus et en (x, z) ci-dessous : noter la position irrégulière des blocs après recalage en z
Homogénéisation de l’échantillon par contrainte en Z Mosaïque Volume (mm3) Nombre de segments Longueur vasculaire totale (mm) Surface vasculaire totale (mm2) Volume vasculaire total (mm3) Nombre de segments / mm3 Longueur vasculaire /mm3 (mm/mm3 Surface vasculaire /mm3 (mm2/mm3) Densité vasculaire (%) V/S V16l 2.73 31835 1407.7 31.11 0.07 11671.43 516.09 11.41 2.54 0.22 V17l 2.50 23194 1217.2 28.72 0.07 9281.31 487.07 11.49 2.65 0.23 V18l 2.72 29598 1383 35.06 0.09 10870.43 507.93 12.88 3.13 0.24 V16m 1.66 17491 849.8 21.74 0.05 10554.55 512.79 13.12 3.16 0.24 V17m 1.53 16007 758.6 18.4 0.04 10468.93 496.14 12.03 2.90 0.24 V18m 1.83 20336 926.6 24.26 0.06 11118.64 506.62 13.26 3.26 0.25 V16s 1.36 9613 533 13.39 0.03 7070.46 392.03 9.85 2.32 0.24 V17s 1.28 9767 538.8 15.03 0.04 7635.24 421.20 11.75 3.08 0.26 V18s 1.38 11315 541.5 13.31 0.03 8220.72 393.42 9.67 2.31 0.24 V18b 2.13 28695 1257.7 27.06 0.06 13471.83 590.47 12.70 2.74 0.22 Moyenne 10036.36 482.38 11.82 2.81 0.24 Ecart type 1978.42 62.38 1.27 0.35 0.01 Latéral 7.95 84627 4007.9 94.89 0.22 10645.71 504.18 11.94 2.78 0.23 Médial 5.02 53834 2535 64.4 0.16 10734.17 505.46 12.84 3.12 0.24 Sommet 4.02 30695 1613.3 41.73 0.10 7644.70 401.80 10.39 2.56 0.25 Base 2.13 28695 1257.7 27.06 0.06 13471.83 590.47 12.70 2.74 0.22 V16 5.74 58939 2790.5 66.24 0.15 10260.25 485.78 11.53 2.67 0.23 V17 5.31 48968 2514.6 62.15 0.15 9226.71 473.81 11.71 2.83 0.24 V18(-b) 5.93 61249 2851.1 72.63 0.18 10331.80 480.94 12.25 2.98 0.24 V18 8.06 89944 4108.8 99.69 0.24 11161.80 509.89 12.37 2.92 0.24 Total 19.11 197851 9413.9 228.08 0.54 10353.38 492.62 11.94 2.82 0.24 Tableau 5 Optimisation des résultats par contrainte de l’échantillon en z
Mosaïque ZH ZB Epaisseur (mm) Aire (mm2) Volume (mm3) V16l 30 150 0.12 22.73 2.7276 V17l 100 200 0.1 24.99 2.499 V18l -20 100 0.12 22.69 2.7228 V16m 30 150 0.12 13.81 1.6572 V17m 50 150 0.1 15.29 1.529 V18m 0 100 0.1 18.29 1.829 V16s 30 150 0.12 11.33 1.3596 V17s 30 150 0.12 10.66 1.2792 V18s 15 135 0.12 11.47 1.3764 V18b 0 100 0.1 21.3 2.13 ZH ZB ± 110 µ z
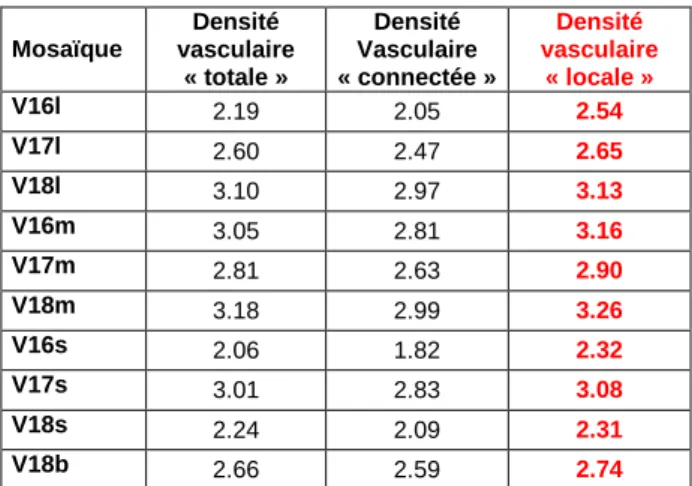
Les données de densités vasculaires des 3 populations sont comparées dans le tableau 6. Les chiffres issus du premier échantillon constituent la densité dite « totale », les chiffres issus du 2e échantillon constituent la densité dite « connectée », les chiffres issus du 3e échantillon constituent la densité dite « locale ». La densité « locale » est la donnée la plus réaliste.
Mosaïque Densité vasculaire « totale » Densité Vasculaire « connectée » Densité vasculaire « locale » V16l 2.19 2.05 2.54 V17l 2.60 2.47 2.65 V18l 3.10 2.97 3.13 V16m 3.05 2.81 3.16 V17m 2.81 2.63 2.90 V18m 3.18 2.99 3.26 V16s 2.06 1.82 2.32 V17s 3.01 2.83 3.08 V18s 2.24 2.09 2.31 V18b 2.66 2.59 2.74
Tableau 6 Optimisation des valeurs de densité vasculaire
Dans sa globalité, le volume d’étude représente 35 mm3 de volume tissulaire, 18 mètres de longueur vasculaire, 400 mm2 de surface vasculaire et 1 mm3 de volume vasculaire appartenant au cortex temporal droit.
Après réajustement des paramètres consistant à ne conserver que la partie connecté de l’échantillon et à éliminer les zones vides et les zones les plus bruitées de chaque mosaïque nous obtenons les valeurs de densité linéique, surfacique et volumique du cortex dans cette région. Ces valeurs moyennées sur les 10 mosaïques sont les suivantes (tableau 5):
- densité linéique : 492.62 mm/mm3 - densité surfacique : 11.94 mm2 /mm3 - densité volumique : 2.82 %
Sur une simple analyse qualitative des résultats, on remarque que ces chiffres sont relativement constant d’une coupe à l’autre, la variabilité n’intégrant probablement que des effets liés à la qualité intrinsèque de chaque coupe. Par contre ces chiffres apparaissent plus nettement différents d’une région à l’autre et il apparaît que la densité vasculaire semble notamment moins importante au niveau de la région du sommet du sillon. Il est peut être hasardeux de se livrer à une interprétation de ce résultat mais notons que dans cette zone le phénomène de gyration se fait en extension. Les variations de l’architecture histologique à ce niveau sont décrites (47, 105) et il existe peut-être un lien entre ces 2 phénomènes. Cette constatation est à prendre en compte et demande à être vérifiée en d’autres zones du cerveau. Il n’existe pas dans la littérature sur la vascularisation cérébrale, que ce soit chez l’homme ou chez les animaux gyrencéphales, de comparaison tenant compte de ces aspects géométriques. La base du gyrus temporo-occipital latéral, où la gyration pourrait entrainer une contraction des structures tissulaires, ne présente pas des valeurs de densité particulièrement plus grandes. Enfin, ces mesures représentant un rapport des longueurs, surfaces ou volumes au volume tissulaire global, l’influence de la rétraction de la pièce anatomique ne nous apparaît pas prépondérante dès lors qu’elle peut être considérée comme globale et homogène sur l’ensemble des constituants tissulaires.
L’intérêt de ces différentes mesures est discuté dans les 2 articles que nous présentons en annexe de cette thèse. Il en est de même de la comparaison des résultats à ceux de la littérature, exploitant essentiellement des informations bidimensionnelles issues de travaux histologiques (tableau 12 p. 30). Cependant, en tenant compte des travaux les plus récents sur le sujet comprenant des études menées chez l’animal sur de grands volumes de cortex (125) les valeurs que nous présentons ici sont pour ainsi dire toujours supérieures aux valeurs publiées. Ceci met en avant la qualité exceptionnelle du matériel de Duvernoy et justifie son utilisation dans ce travail, et ouvre certainement le débat sur les variations observées entre les diverses espèces étudiées et l’homme.
Enfin, l’une des caractéristiques principales de la vascularisation corticale est son hétérogénéité. Les variations de la densité vasculaire en fonction de la profondeur du cortex apparaissent à l’œil nu dans certaines zones de cortex secondaire sur les coupes injectées à l’encre de Chine. Cette particularité fait l’objet d’une approche spécifique dans la dernière partie de ce travail.