A mon Maître et Président du jury
Madame le Professeur Danièle DENIS
Votre dévotion pour l’ophtalmologie marseillaise, en particulier
pour les internes m’a toujours impressionné. Je vous remercie, au
nom de tous de nous avoir chouchouté et accompagné tout au long
de notre internat.
A mon Maître et Membre du jury
Monsieur le Professeur Frédéric MATONTI
C’est un honneur de vous compter parmi les membres de mon jury.
Vous êtes pour moi une véritable figure de l’ophtalmologie
marseillaise et ma déception aurait été immense de ne pas vous
compter parmi les membres de mon jury.
Je regrette de n’avoir que trop peu travaillé avec vous, mais votre
disponibilité, votre pédagogie, et vos compétences resteront gravés
dans ma mémoire.
A mon Maître et Membre du Jury
Monsieur le Professeur Bernard RIDINGS
Je vous remercie d’avoir accepté de faire partie des membres de mon
jury.
Je retiendrai votre sérénité, votre bonne humeur et vos conseils lors
de mes passages à l’Hôpital de la Timone.
Veuillez trouver ici l’expression de mes sincères remerciements et
de mon profond respect.
A mon Maître et Directeur de thèse
Monsieur le Docteur Alban COMET
C’est un honneur de t’avoir comme directeur de thèse
En effet, ce travail n’aurait pu voir le jour sans ton aide, et tes
conseils.
Je te suis sincèrement reconnaissant pour ton écoute et ton
accompagnement, en particulier au cours de ces 2 derniers mois (et
je sais à quel point tu as du t’accrocher :p ).
Plus que mon Maître de thèse, je te considère également comme un
ami, un exemple à suivre.
A mon Maître et Membre du jury
Monsieur le Docteur Benjamin DONNADIEU
Tu as été un fort soutien pendant tout mon internat, par ta
gentillesse et ton dévouement. Je te remercie pour ta constance et ta
patience pour me guider.
A tous mes chefs
Le Pr Louis Hoffart, le Dr Isabelle Rendu, le Dr Hélène Proust, le Dr
Sébastien Guigou, le Dr Caroline Marc, le Dr Marie Boulze, le Dr
Grégoire Alessi, le Dr Laurent Coupier, le Dr Aurore Aziz, le Dr
Magali Sampo, le Dr Helena Guigue, le Dr Elodie Chazalon, le Dr Anne
Le Corre, le Dr Eve Hadjadj…
Aux hybrides (difficile de vous considérer comme des chefs :p )
Au Dr Pierre Gascon : J’ai beaucoup apprécié ces quelques mois
passés ensemble, nous avons eu plusieurs délires assez fun (« Va
bien...»). Plus que mon chef, tu es pour moi un ami, et un modèle tant
sur le plan professionnel que personnel.
Au Dr Maeva CHARDAVOINE : Ta douceur et ta joie de vivre ont
égayé mon internat ! peut-être qu’on arrivera un jour à ne pas se
rater sur Nice :p
Au Dr Gaelle HO WANG YIN : Un caractère bien trempé, mais
finalement toujours présente quand il le faut (aider les internes,
boire des coup, etc…)
Au Dr Nicolas MOINEAU : Surpris d’avoir rencontré quelqu’un avec
autant de points communs (et pas que les bons :p ), tu m’as plus ou
moins tracé un chemin !
Au Dr Lauren Sauvan : super caractère, toujours motivée, on se
connais finalement assez peu mais ta gentillesse et tes compétences
font de toi une référence à mes yeux.
Au Dr Guillaume Holweck : je te considère comme un super poto ! Je
t’attends en Corse !
A mes co-internes
Matthieu Gonzalves (alias Lézardo dans des temps que je n’ai pas
connu) : Je te l’ai toujours dit, je te considère comme mon grand
frère ! Tu m’as toujours accompagné et soutenu, depuis nos avis en
réa à Aix, jusqu’aux galères de l’EBO... Tu n’es pas là aujourd’hui,
mais je suis sûr que tu penses à moi. Au fait, Joyeux Anniversaire !
Thomas Arnoult : Si Matthieu est mon grand frère, tu es mon petit
frère ! Avec ta fidèle Alice, il n’a pas fallu longtemps pour qu’on lie
une amitié solide qui j’en suis certain sera durable.
Francesco Esposito : Parisien et motard comme moi, toujours
présent quand il le faut. Vraiment très content que nos chemins se
soient croisés, et d’avoir partagés tous ses moments (et galères).
D’ailleurs, je suis dispo dès demain pour une petite virée si tu veux ;)
Florian Dalmas : Notre trio avignonnais et notre légendaire check
restera à jamais dans ma mémoire ! A la fois cool et pro, avec un
niveau de planche over 9000, on peut dire qu’on s’est bien marré
tous les deux ;)
Nathanael Levy : Mon premier externe ! Nos discussions et partages
de ragots ont pimenté mon internat. Et t’inquiète je t’attends à Nice
en Juin ;)
Thibault R (mon rouquin pervers préféré), Loic (mélange de
pragmatisme et de déconne), Charles, Victoire, notre semestre à la
Timone a été magique
Kevin Alias Pr Mairot, : futur Grand neurologue. Fait de
l’ophtalmologie à ses heures perdues. Sans tes reprises de gardes je
ne serais pas où je suis.
Juliette H : Une pointe d’hyperactivité, une curiosité incomparable et
assez peu de faille. The Major quoi ^^
Marion C : Probablement l’interne la plus gentille et dévouée que je
connaisse. Toujours présente quand il le faut
Emmanuelle B : L’interne des tié-quar. Merci d’avoir partagé ton
casier avec moi tout ce dernier semestre :)
Mathilde M : Après un premier contact brutal au téléphone (soit
disant une erreur :p ), nous avons commencé à faire nos petites
affaires $$$. Finalement c’est un peu grâce à toi si je suis fiancé
aujourd’hui.
Arthur A : Allé, avoue, ce n’est pas ta photo sur What’sApp :p
Les autres : Alexandra DF, Prithvi, Jeremie B, Marie B, Marie C,
A toutes les infirmières, optométristes et orthoptistes qui m’ont aidé
tout au long de mon internat, de jour comme de nuit !
A mes amis d’ici et d’ailleurs
Thibaut Bergmann, un de mes amis les plus fidèles, il n’y a pas de
doute. Depuis notre rencontre à Avignon nous avons partagé bon
nombre d’aventures et péripéties … entre soirées, motos, pizzas
(sans fromage ! :p ), visite des toits de l’hôpital Nord, chasse aux
mouettes, nos multiples combines, nos kebabs à Aix… affaire à
suivre :)
Sebastien V (je n’ai jamais su écrire ton nom :p) : Pour tous les
délires déjà partagés, et ceux à venir !
Fatou (finalement la plus Parisiennes de mes amies :p) : tu t’es
motivée pour venir, et ça me touche vraiment.
Eric Maurette, mon plus fidèle compagnon d’externat, j’espère que
ça se finira bien pour toi aussi mon ami
Ainsi qu’à tous les autres éparpillés ici et là, Axelle & David, Juliette
M, Sonia R, Damien, Jean M, Lionel, Christophe, Viet-Tuan, Antoine &
Aurèle, Alexis D, Amir, etc…
A ma famille,
A mes parents, Philippe et Mylène pour leur 31 ans de patience (et
ce n’est pas fini). Merci de m’avoir soutenu, au cours de ce si long
cursus, comme dans la vie. Vous avez toujours été là pour moi,
aimants et attentionnés. Vous êtes de formidables parents.
A ma sœur Laura et son mari Robin
Même si nous ne nous voyons que peu, soyez certains que vous
occupez une des places les plus importantes dans mon cœur.
A mes grands-parents Simone et Georget, que je porte dans mon
cœur même si c’est vrai, je suis un petit fils assez distant…
A mes oncles et tantes, Hervé & Sophie, Michel & Elia, Eric qui m’ont
guidé dans mes choix pendant ces longues études
Mention spéciale à ma nouvelle famille Niçoise, en particulier
Chantal, Jean-Marc et Damien, qui m’ont très vite accepté, et soutenu
ces derniers mois.
Je vous apprécie énormément, et je suis très enthousiaste à l’idée de
ce que nous sommes en train de construire !
A ma Fiancée Laura Braka
Tu as débarqué dans ma vie à un moment plutôt inattendu, entre
examens et préparation de thèse... Mais tu m’as tout de suite adopté !
Tu as su m’accompagner et nous avons déjà parcouru un bout de
chemin tous les deux !
J’ai hâte de poursuivre ma vie avec toi, car tu as réveillé chez moi
quelque chose qui ne s’éteindra jamais…
1
THÈSE - ARTICLE
Présentée et publiquement soutenue devant
LA FACULTÉ DES SCIENCES MEDICALES ET
PARAMEDICALES DE MARSEILLE
Le 1
erOctobre 2019
Par Monsieur Michaël COHEN-SALMON
Né le 4 Janvier 1988 à Paris (75)
Pour obtenir le grade de Docteur en Médecine
D.E.S d’OPHTALMOLOGIE
Membres du Jury de la Thèse :
Madame le Professeur DENIS Danièle
Présidente
Monsieur le Professeur MATONTI Frédéric
Assesseur
Monsieur le Professeur RIDINGS Bernard
Assesseur
Monsieur le Docteur COMET Alban
Directeur
Monsieur le Docteur DONNADIEU Benjamin
Assesseur
Facteurs pronostiques d’efficacité de l’implant intra-vitréen de
dexaméthasone en cas d’échec des anti-VEGF dans l’œdème
2 I. Introduction ___________________________________________________ 4 II. Bref rappel des notions fondamentales _________________________ 6
A. Le diabète __________________________________________________________ 6 B. La rétinopathie diabétique _____________________________________________ 6 C. La maculopathie diabétique____________________________________________ 7 1. Généralités _______________________________________________________________ 7 2. Définition ________________________________________________________________ 8 3. Physiopathologie _________________________________________________________ 10 a) Modification des flux sanguins ____________________________________________ 10 b) Rupture de la barrière hémato-rétinienne ___________________________________ 10 c) Altération des mécanismes de réabsorption d’eau par l’épithélium pigmentaire ____ 11 d) Schéma récapitulatif ____________________________________________________ 12 III. Rappels sur la prise en charge de l’œdème maculaire diabétique
13
A. Prise en charge de la rétinopathie diabétique ____________________________ 13
1. Dépistage _______________________________________________________________ 13 2. Contrôle Glycémique ______________________________________________________ 14 3. Contrôle des facteurs de risque associés à la rétinopathie diabétique _______________ 14 4. Contrôle des facteurs favorisant/aggravant l’œdème maculaire ___________________ 15
B. Traitement laser de l’œdème maculaire diabétique _______________________ 15 C. Traitement pharmacologique de l’œdème maculaire ______________________ 15
1. Les Injections Intravitréennes d’anti-VEGF _____________________________________ 16 2. Les Corticoïdes Intravitréens ________________________________________________ 16 a) Mode d’action _________________________________________________________ 17 b) Présentation de l’implant de dexaméthasone Ozurdex® ________________________ 18 c) L’implant intravitréen de fluicinolone Iluvien® ________________________________ 19 3. Recommendations thérapeutiques actuelles ___________________________________ 20 IV. Etude Clinique _____________________________________________ 21
A. Introduction _______________________________________________________ 24 B. Matériel et méthode ________________________________________________ 25
3 1. Collecte des données ______________________________________________________ 25
a) Population ____________________________________________________________ 25 b) Analyse OCT ___________________________________________________________ 27 c) Analyse angiographique _________________________________________________ 27 2. Méthode d’analyse statistique ______________________________________________ 28
C. Résultats __________________________________________________________ 28
1. Caractéristiques à l’inclusion ________________________________________________ 28 2. Efficacité de l’implant de Dexamethasone _____________________________________ 29 a) Sur l’acuité visuelle _____________________________________________________ 29 b) Sur l’épaisseur maculaire centrale _________________________________________ 31 3. Corrélation des biomarqueurs étudiés avec l’augmentation de l’acuité visuelle à 6 mois 32 a) Analyse univariée de la corrélation avec l’Acuité visuelle _______________________ 32 b) Analyse multivariée de la corrélation avec l’Acuité visuelle _____________________ 33 4. Corrélation avec la diminution de l’épaisseur maculaire centrale (CMT) à 6 mois ______ 34 a) Analyse univariée de la corrélation avec l’épaisseur maculaire centrale (CMT) ______ 34 b) Analyse multivariée de la corrélation avec l’épaisseur maculaire centrale (CMT) ____ 36 V. Discussion _________________________________________________ 37 VI. Conclusion _________________________________________________ 40
4
I.
Introduction
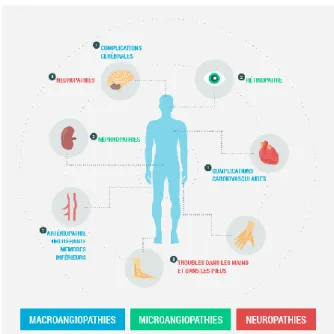
Le diabète se définit comme une affection métabolique caractérisée par une hyperglycémie chronique liée à une déficience soit de la sécrétion de
l’insuline, soit de l’action de l’insuline, soit des deux, avec des conséquences ophtalmologiques (rétinopathie, maculopathie, cataracte…), rénale
(néphropathie), neurologique (neuropathie), cardiaque (infarctus), vasculaires (hypertension artérielle, artériosclérose, accident vasculaire cérébral…), surrisque infectieux (fongique notamment).
Figure 1 Conséquences et complications du diabète
La rétinopathie diabétique est la conséquence neurodégénérative et
microvasculaire la plus commune du diabète et une des principales causes de cécité dans les pays développés (1ère cause chez les moins de 65 ans en France), et fait l’objet d’un dépistage chez tous les patients diabétiques.
L’œdème maculaire dont la première cause est la rétinopathie diabétique se définit par une accumulation de liquide dans la macula, entrainant son épaississement, la macula étant responsable de la vision centrale et de la vision fine.
5
La prise en charge de la rétinopathie diabétique comprend, le traitement général du diabète par le diabétologue (insuline, règles hygiéno-diététiques, anti-diabétiques oraux…), le contrôle de la rétinopathie diabétique
(surveillance, photocoagulation panrétinienne périphérique…) et de ses facteurs prédisposants (hypertension artérielle, hyperlipidémie, syndrome d’apnée obstructive du sommeil), ainsi que la prise en charge de la maculopathie diabétique, en particulier l’œdème maculaire diabétique.
L’œdème maculaire explique 75% des déficits de l’acuité visuelle liés au diabète (la plupart des cas restants étant liés à la prolifération). L’œdème maculaire diabétique représente ainsi la cause de cécité la plus fréquente chez les patients de moins de 50 ans et donc dans la population active, expliquant le fait que la majorité des recherches et développements de médicaments dans le domaine de la rétinopathie diabétique visent la réduction de cet œdème.
Le dernier tournant majeur dans la prise en charge de l’œdème maculaire diabétique a été marqué par l’utilisation des anti-VEGF intra-vitréens (principalement ranibizumab et aflibercept) et plus récemment par l’introduction des implants intravitréens de corticoïdes (en particulier dexaméthasone Ozurdex) dont les efficacités, bien que comparables sont liés à des modes d’actions différents, avec des choix /stratégies
thérapeutiques encore mal définis.
Dans ce travail, nous voudrions définir les situations dans lesquelles les patients ont bénéficié au mieux d’un switch anti-VEGF vers implant de
dexaméthasone dans le traitement de l’œdème diabétique et ainsi suspecter les éventuels facteurs pronostics qui pourraient justifier un switch précoce, voir l’utilisation de ces implants intravitréens en première intention
6
II. Bref rappel des notions fondamentales
A.
Le diabète
Le diabète est un problème de santé publique majeur dans la plupart des pays développés.
Le diagnostic de diabète sucré répond à des critères biologiques précis selon l’OMS : 2 glycémies à jeun supérieure à 1,26g/L, ou une glycémie à
n’importe quel moment de la journée > 2g/L, ou une glycémie supérieure à 2 g/L après test d’hyperglycémie par voie orale (après ingestion de 75
grammes de glucose).
B.
La rétinopathie diabétique
La rétinopathie diabétique est la conséquence neurodégénérative et microvasculaire la plus commune de l’hyperglycémie chronique.
Il existe des facteurs prédisposant au développement de la rétinopathie diabétique tels que l’hypertension artérielle ou l’hyperlipidémie, mais les facteurs les plus importants sont les niveaux moyens de glycémies, la durée d’évolution, le caractère insulinodépendant.
Les principaux mécanismes impliqués dans la pathogénie de la rétinopathie diabétique sont :
- Cascade des polyols : activation de la voie de l’aldol-réductase, conduisant à l’accumulation de sorbitol intra-cellulaire
- La glycation des protéines entrainant un épaississement des membranes basales
- L’activation de la protéine kinase C - Le stress oxydatif
- L’activation du système rénine-angiotensine - L’inflammation
7
- L’hypoxie relative, entrainant la sécrétion de facteurs de croissance angiogénique (notamment le VEGF)
L’ensemble de ces mécanismes vont entrainer des modifications
histologiques vasculaire telles que l’épaississement de la membrane basale, la perte des péricytes, la perte des cellules endothéliale des capillaire
rétiniens, créant des territoires de non-perfusions (ischémie). Ces territoires de non-perfusion, avec diminution du débit sanguin, ont pour conséquences le développement d’anomalies caractéristiques développées aux dépens des capillaires de voisinage : microanévrysmes, hémorragies, exsudats secs, anomalies veineuses, néovascularisations…
Les lésions de la rétinopathie diabétique aboutissent plus tard à : - Une hyperperméabilité capillaire menant à l’œdème rétinien - Une occlusion capillaire menant à une ischémie rétinienne
La prise en charge de la rétinopathie diabétique repose principalement sur l’équilibre glycémique strict, la prise en charge des territoires ischémiques par le biais de la photocoagulation panrétinienne, et une surveillance rapproché dépendant de la sévérité de la rétinopathie.
C.
La maculopathie diabétique
1.
Généralités
Il existe deux types de maculopathie diabétique :
- Une maculopathie ischémique résultant d’une raréfaction capillaire (élargissement de la zone avasculaire centrale, supérieure à 2 fois la normale soit >1000µm)
- L’œdème maculaire résultant d’une rupture de la barrière hémato-rétinienne au niveau capillaire ou au niveau de l’épithélium
8
Ces deux types de maculopathie peuvent coexister, avec des effets indépendants sur l'acuité visuelle.
2.
Définition
Œdème maculaire significatif au fond d’œil, selon l’Early Treatment of Diabetic Retinopathy Study (ETDRS) :
- Epaississement rétinien à moins de 500 µm de la fovéa
- Exsudat sec à moins de 500 µm de la fovéa avec épaississement rétinien adjacent
- Epaississement rétinien d’au moins un diamètre papillaire (DP) et s’étendant en direction de la fovéa jusqu’en être séparée d’un espace inférieur à un DP.
L’œdème maculaire peut ensuite être catégorisé selon sa morphologie sur l’OCT (Tomographie à Cohéence Optique). On distingue 3 types
morphologiques :
- L’œdème maculaire diffus, définit comme un aspect épaissit et spongieux diffus de la rétine, sans logettes cystoïdes, sans décollement séreux rétinien
- L’œdème maculaire cystoïde, qui mets en évidence un regroupement de logettes cystoïdes, que l’on définit comme des logettes oblongues aréflectives à hyporéfléctives de la couche nucléaire interne séparées par des septas hyperréflectifs, pouvant être associée à un aspect d’œdème maculaire diffus
- Le décollement séreux rétinien, définit comme la présence d’une bulle ou d’une lame de liquide sous la neurorétine
9
Figure 2 : Epaississement rétinien diffus
Figure 3 : Oedème Maculaire Cystoïde
10
3.
Physiopathologie
En situation d’hyperglycémie chronique, quatre voies biochimiques principales sont activées : la cascade des polyols ; la voie des produits avancés de la glycation ; la voie de la proteine kinase C ; la voie des hexosamines.
Ces voies augmentent le stress oxydatif, l’inflammation, l’hypoxie et la dysfonction vasculaire. Il en résulte l’activation de différents facteurs de croissance et cytokines, tels que le vascular endothelial growth factor
(VEGF), les angiopoïétines, le tumor necrosis factor (TNF), les interleukines (IL), les métalloprotéinases matricielles qui contribuent à la rupture de la barrière hémato-rétinienne (BHR) et à l’œdème maculaire diabétique (OMD). La rupture de la BHR interne est le mécanisme principal à l’origine de l’OMD. Son bon fonctionnement repose sur l’intégrité structurelle et fonctionnelle des différents éléments qui la composent, mais dépend aussi des interactions dynamiques entre cellules endothéliales, cellules gliales et tissu neuronal au sein du complexe neurovasculaire.
a) Modification des flux sanguins
Avant l'apparition de la rétinopathie avérée, le diabète n’impacte pas le flux sanguin rétinien. Une fois la rétinopathie installée, le flux sanguin rétinien augmente (1). La fonction autorégulatrice des vaisseaux sanguins de la rétine est alors perdue et l’on note une dilatation ainsi qu’un allongement des artérioles et des veinules. En conséquence, on constate une diminution de la résistance des artérioles et une perte de pression sur toute leur longueur. La pression intraluminale effective dans les capillaires rétiniens augmente, ce qui augmente les mouvements de fluides dans le compartiment
extracellulaire (loi de Starling).
b) Rupture de la barrière hémato-rétinienne
La libération de cytokines vasoactives (telles que le VEGF) par les cellules endothéliales, le tissu glial et les leucocytes activés détruit la barrière
11
hémato-rétinienne et conduit à un mouvement de l'albumine dans
l'interstitium. C’est le principal mécanisme conduisant à l’accumulation de liquide et à la formation de l’OMD.
Par ailleurs, des fuites significatives à travers l'épithélium pigmentaire peuvent aussi se produire dès le stade de rétinopathie minime (2). La néovascularisation et les occlusions choriocapillaires résultent
probablement des mêmes mécanismes (dégénérescence de la membrane basale et angiogenèse) qui ont conduit au développement de la rétinopathie diabétique (3).
L'accumulation de fluide due aux fuites capillaires de la rétine interne est généralement limitée par les couches plexiformes interne et externe, ce qui provoque une accumulation de fluide dans la couche nucléaire interne. Ce fluide déplace les tissus dans les couches plexiformes, augmente la densité des tissus et constitue une barrière relative à la propagation de l'œdème. La rupture de la barrière hémato-rétinienne externe provoque souvent une accumulation de fluide entre la couche plexiforme externe et la membrane limitante externe.
c) Altération des mécanismes de réabsorption d’eau par l’épithélium pigmentaire
L’eau accumulée dans le tissu rétinien est normalement éliminée soit par l’épithélium pigmentaire qui déshydrate l’espace sous rétinien, soit par les cellules de Müller qui déshydratent la rétine interne.
Au cours du diabète, il y aurait une délocalisation des canaux aqueux et potassiques des cellules de Müller. L’élimination de l’eau et du potassium intracellulaire vers les vaisseaux rétiniens est ainsi diminuée, ce qui entraîne une ballonisation des cellules de Müller(4).
Concernant l’épithélium pigmentaire (EP) il y aurait au cours du diabète une diminution des jonctions serrées de l’EP, une baisse de l’expression
12
la BHR externe avec une diminution de la résorption des fluides de l’espace sous rétinien.
d)
Schéma récapitulatif
Figure 5 : Physiopathologie de l'œdème maculaire diabétique – Rapport SFO 2016
Au cours du diabète, l’hyperglycémie chronique entraine l’activation de différentes voies biochimiques à l’origine d’un stress oxydatif, d’une réaction inflammatoire, d’une augmentation de
l’hypoxie tissulaire et d’une dysfonction endothéliale. Il en résulte la production de VEGF et de différentes cytokines. Cette sécrétion est à l’origine de lésions tissulaires, d’une leucostase accrue,
d’une apoptose neuronale et d’une activation des cellules gliales de la rétine. Il en résulte l’occlusion des capillaires rétiniens, et la rupture de la barrière hémato-rétinienne.
13
III. Rappels sur la prise en charge de l’œdème
maculaire diabétique
A.
Prise en charge de la rétinopathie diabétique (RD)
1.
Dépistage
L’objectif du dépistage de la rétinopathie diabétique est de prévenir la déficience visuelle due à la rétinopathie, par l’identification précoce de la maladie et la mise en place d’une intervention adaptée.
Le dépistage de la rétinopathie diabétique s’appuie sur la mesure de l’acuité visuelle ainsi que la réalisation du fond d’œil après mydriase thérapeutique, selon un rythme adapté.
Selon l’HAS, chez l’adulte diabétique de type II, le dépistage commence dès le diagnostic. Il peut en revanche être retardé de 3 ans après le diagnostic d’un diabète de type I.
Chez l’enfant, le dépistage commence dès l’âge de 10 ans selon l’HAS. Le rythme de surveillance est lié à l’état du fond d’œil, au contrôle du diabète (utilisation d’insuline ou non), au contrôle des facteurs de risque associés (en atteinte de l’objectif de tension artérielle), c’est pourquoi le suivi du patient diabétique est multidisciplinaire.
- Patient diabétique de type II sans rétinopathie diabétique, avec contrôle glycémique (HbA1c à l’objectif) et tensionnel (tension artérielle à l’objectif), et ne requérant pas d’injection d’insuline : tous les 2 ans
- Patient diabétique ne remplissant pas les caractéristiques sus-cités : o Rétinopathie diabétique absente ou minime : dépistage annuel o Rétinopathie diabétique modérée : tous les 6 mois
o Rétinopathie diabétique sévère : au moins tous les 3 mois A noter qu’une surveillance ophtalmologique rapprochée est nécessaire en cas de grossesse, de rééquilibration glycémique rapide, chez l’adolescent et le jeune adulte (la puberté et l’adolescence constituent une période à risque
14
d’évolution rapide de la RD). Les adolescents ayant un diabète de type 1 (DT1) évoluant depuis plus de dix ans, associé à un mauvais équilibre glycémique (HbA1C > 10 %) ont un risque important de développer une RD floride (grade B). Ils doivent donc bénéficier d’une surveillance
ophtalmologique renforcée au moins tous les 6 mois et cela d’autant plus s’il existe des signes de RD (accord d’experts).
Enfin, la RD et l’OMD peuvent s’aggraver après une chirurgie de cataracte (niveau 2). Si un bon contrôle glycémique et des facteurs systémiques doit être obtenu avant la chirurgie (grade B), la surveillance de la RD doit être renforcée pendant l’année postopératoire (accord d’experts).
2.
Contrôle Glycémique
Le contrôle glycémique est une priorité dans la prise en charge de l’œdème maculaire. Il doit être réalisé au mieux par un diabétologue et doit tenir compte du stade de rétinopathie diabétique, des objectifs d’hémoglobine glyquées, du type de diabète. De nombreuses études, montrent l’intérêt d’un traitement intensif du diabète, notamment l’étude EDIC(6,7), et le rapport Cochrane(8).
Les différents moyens de contrôle sont :
- Les règles hygiéno-diététiques (diabète type II) - Les anti-diabétique oraux (diabète type II)
- Les injections d’insuline (formes à libération immédiate, ou lente) (diabètes type I ou II)
3.
Contrôle des facteurs de risque associés à la
rétinopathie diabétique
Avec l’aide du diabétologue et du médecin traitant, qui devront insister sur l’importance du contrôle de l’HTA, des dyslipidémies(9) notamment du cholestérol, ainsi que du syndrome d’apnée/hypopnée du sommeil
15
4.
Contrôle des facteurs favorisant/aggravant
l’œdème maculaire
Certains facteurs aggravent l’œdème maculaire diabétiques et se doivent d’être contrôlés. Certains sont médiés par les lois de Starling (mécaniques des fluides), qui énonce que le mouvement net du fluide hors des capillaires est déterminé par l’addition des pressions hydrostatique et oncotique : l’hypertension artérielle, tous facteurs à l’origine d’une surcharge volémique (insuffisance rénale, insuffisance cardiaque, hypoalbuminémie), l’apnée du sommeil. D’autre facteurs sont purement mécaniques et représentés principalement par les tractions vitréo-maculaires et les membranes épirétiniennes.
B.
Traitement laser de l’œdème maculaire diabétique
La photocoagulation au laser a longtemps été le traitement de référence de l’œdème maculaire diabétique(10), notamment depuis les travaux del’ETDRS parus en 1985(11). Il reste un traitement de choix dans les œdèmes maculaires focaux, paracentraux et cliniquement significatif, c’est-à-dire menaçant la fonction visuelle
C.
Traitement pharmacologique de l’œdème maculaire
La photocoagulation rétinienne au laser a longtemps été le traitement de référence de la rétinopathie diabétique et de ses complications, notamment l’œdème maculaire et la rétinopathie diabétique proliférante. Cependant, l’efficacité sur le gain d’acuité visuel était modeste.L'utilisation des agents pharmaceutiques intraoculaires, anti- VEGF et implant de corticostéroides, a révolutionné le traitement de la rétinopathie diabétique (RD), et en particulier de l’œdème maculaire diabétique (OMD).
16
1.
Les Injections Intravitréennes d’anti-VEGF
Le mécanisme de développement de la néovascularisation passe par la présence de facteurs proangiogéniques stimulée en général par une lésion vasculaire. Parmi ces facteurs pro-angiogéniques a été identifié la famille des VEGF (A, B, C, D, E et F et le PIGF) dans les années 1980(12–14).
La production du VEGF, induite sous l’influences de certaines conditions a été identifiée au niveau oculaire au niveau des péricytes, des cellules gliales, des cellules endothéliales vasculaires, des leucocytes et de l'épithélium pigmentaire rétinien.
L’œil humain normal présentent des concentrations de VEGF intravitréen de l’ordre de 8,8 ± 9,9 ng / ml [*]. Les yeux pathologiques, notamment ceux présentant un œdème maculaire diabétique, présentent des concentrations plus élevées de VEGF intra-oculaire (15), et il augmenterait la perméabilité rétinienne en agissant sur les jonctions serrées(16,17).
Le blocage de ces facteurs par le biais des anti-VEGF est donc une des stratégies thérapeutiques majeure dans l’œdème maculaire diabétique Les principales molécules anti-VEGF utilisées : aflibercept (Eylea®) et ranibizumab (Lucentis®). En pratique, ils sont utilisés de manière mensuelle initialement, jusqu’au contrôle de l’œdème maculaire, puis ensuite
poursuivis, soit selon un protocole à la demande (Pro Re Nata) soit Treat & Extend.
Leur principale force réside en leur efficacité et leur simplicité, mais ils nécessitent des injections fréquentes, ce qui limite leur observance par les patients
2.
Les Corticoïdes Intravitréens
Les schémas thérapeutiques d’injections intravitréennes répétées d’anti-VEGF ont montré leur efficacité pour traiter l'œdème maculaire diabétique (DME).
Environ 40% des patients présentent cependant une réponse incomplète (18), nécessitant un traitement complémentaire ou alternatif, et ayant conduit
17
au développement de traitement par corticostéroïdes intravitréens. Deux médicaments ont actuellement l’AMM dans cette indication. Il s’agit de
l’implant intra-vitréen de Dexamethasone du laboratoire Allergan : Ozurdex®, et de l’implant de Fluocinolone du laboratoire Alimera : Iluvien® (Repris par Horus Pharma® récemment).
Leur principale force réside dans leur délai d’action, mais ils entrainent un plus fort taux d’hypertonie oculaire (Hypertonie cortico-induite)
a)
Mode d’action
Les corticostéroïdes permettent une diminution de l'œdème maculaire via plusieurs mécanismes :
- Ils se lient à la région promotrice du gène du VEGF et régulent négativement la synthèse de VEGF (19,20).
- Les stéroïdes diminuent l’exsudation en modifiant favorablement l’équilibre de la loi de Starling par vasoconstriction.
- Les stéroïdes diminuent la pression capillaire moyenne dans la lumière, diminuent la pression exsudative transcapillaire moyenne et réduisent le gradient de pression hydrostatique.
18
b)
Présentation de l’implant de
dexaméthasone Ozurdex®
L’Ozurdex® est un implant à libération prolongé biodégradable à destinée intravitréenne distribué dans un système d'administration pour le segment postérieur. L’implant contient 0,7 mg de dexaméthasone micronisée, sans conservateur
La libération de médicament de l’insert suit un schéma biphasique avec des concentrations intraoculaires atteignant leur maximum à 2–6 semaines (vitré, 100–1000 μg / mL; rétine, 100–1 000 μg / g), suivies d’une chute marquée le troisième mois, plateau pendant 3 à 4 mois (vitré, 0,1 à 1 ng / mL; rétine, 0,1 à 1 ng / g), et taux non détectables au bout de 7 à 8 mois (21).
19
Outre de rares cas d'endophtalmie et d'hémorragie du corps vitré, les
injections ont été compliquées par le placement par inadvertance d'un insert dans le cristallin (22–24) ou par la fragmentation de l'insert (25–28).
Son utilisation est encore souvent limitée à cause de son impact sur
l’hypertonie oculaire bien qu’une étude du MEAD study Group (29) démontre un clair bénéfice du traitement malgré cette augmentation, ainsi que son caractère non cumulatif.
c) L’implant intravitréen de fluicinolone Iluvien®
L’implant intravitréen de fluocinolone Iluvien® (Alimera sciences limited, UK), dont l’efficacité a été prouvé par les études FAME(30) vient tout juste
d’obtenir son remboursement et son utilisation en France est encore exotique. Il est actuellement indiqué en dernière intention(31).
20
3.
Recommendations thérapeutiques actuelles
Figure 7 : Algorithme thérapeutique devant un oedème maculaire diabétique (Rapport SFO 2016).
21
IV. Etude Clinique
Présentation de l’étude :
Bien qu’efficace dans le traitement de l’œdème maculaire diabétique, les patients qui bénéficient d’injection intravitréenne d’anti-VEGF ne présentent pas toujours une réponse optimale : En effet, une amélioration de l’acuité visuelle inférieure à 5 lettres est retrouvée chez 40% des patients après 3 IVT dans le protocole I de la DRCRnet (18) ou la persistance d’un œdème maculaire dans 32 à 66% des cas après 6 IVT mensuelles d’après le Retinopathy Clinical Research Network (32).
L’implant intravitréen de dexaméthasone Ozurdex® a donc rapidement trouvé sa place en seconde intention dans l’arsenal thérapeutique, et la prise en charge de ces OMD résistants aux anti-VEGF pose une problématique (33) : D’un côté poursuivre les injections intra-vitréennes d’Anti-VEGF considérant un pourcentage de répondeurs tardifs (34), de l’autre l’intérêt d’un switch précoce vers l’implant intravitréen de
dexaméthasone comme proposé par les résultats du protocole I (18). Les deux attitudes étant mal codifiées dans la littérature, nous essayons par notre étude d’apporter des éléments de réponses.
De récentes études cherchent à distinguer dans la population porteuse d’un œdème maculaire diabétique, des biomarqueurs, c’est-à-dire de
caractéristiques biologiques mesurables, pouvant prédire la mauvaise réponse aux anti-VEGF (35), ou la meilleure réponse à la dexaméthasone (36–43). La plupart de ces biomarqueurs ont été définis sur les images SD-OCT (Spectral Domain-SD-OCT). Certains ont été associé à une moins bonne récupération visuelle : la présence de DRIL (= Désorganisation des couches rétiniennes internes, définit comme une perte de la continuité des couches rétinienne internes) (37). D’autres ont été associés à une remontée de l’acuité visuelle: la présence d’un décollement séreux rétinien(39) ou la présence de points hyper réflectifs de la rétine externe(39).
Notre étude a voulu conforter les résultats sur certains de ces biomarqueurs (Décollement Séreux Rétinien, DRIL, Points hyper-réflectifs), tout en
22
essayant d’en introduire de nouveaux, notamment des biomarqueurs angiographiques avec l’étude des microanévrismes rétiniens.
23
Facteurs pronostiques d’efficacité de l’implant intra-vitréen
de dexaméthasone en cas d’échec des anti-VEGF dans
l’œdème maculaire diabétique
24
A.
Introduction
La prise en charge de l’œdème maculaire diabétique a connu une révolution ces dix dernières années, en particulier grâce à l’émergence de l’utilisation des anti-VEGF intravitréens, qui représente encore actuellement le
traitement de première intention.
En plus d’être la principale cause de baisse d’acuité visuelle au cours de la rétinopathie diabétique (44), l’œdème maculaire diabétique est également une cause accessible au traitement. La stratégie de première intention est actuellement l’utilisation des anti-VEGF intravitréens : le ranibizumab qui a obtenu l’Autorisation de Mise sur le Marché dans l’œdème maculaire diabétique en 2012 suite à l’étude RESTORE (45) et l’aflibercept en 2014 dont l’efficacité a été prouvé dans les études VIVID et VISTA (46).
Cependant une certaine proportion de patients (40%) ne répondent pas de manière satisfaisante comme le montre une analyse des données du
protocole I (18). Ces mêmes données montrent également que les mauvais répondeurs (caractérisés par un gain d’acuité visuelle après la phase
d’induction inférieure ou égale à 5 lettres ETDRS) présentent des résultats décevants à long terme (analyses de données disponibles jusqu’à 156 semaines), nous incitant à rechercher des thérapeutiques se distinguant par leur mode d’action.
La physiopathologie de la rétinopathie diabétique, et en particulier le rôle important et indépendant (47) de l’inflammation dans cette pathologie, nous incite à nous intéresser à l’utilisation des anti-inflammatoires intravitréens dans l’œdème maculaire diabétique.
L’étude MEAD (Macular Edema Assessment of implantable Dexamethasone in Diabète) prouve l’efficacité de l’implant intraoculaire de dexaméthasone dans l’œdème maculaire diabétique en comparant 2 différents dosages de dexaméthasone intravitréen par le biais d’une étude prospective randomisée en double aveugle contre placebo, avec un gain significatif sur l’acuité
visuelle à 3 ans (48), ce qui a permis l’obtention de l’AMM en 2014, en seconde intention dans l’œdème maculaire diabétique.
25
De récentes études cherchent à mieux caractériser l’impact de l’implant intravitréen de dexaméthasone : efficacité selon le type d’œdème maculaire (36), efficacité selon le délai d’introduction de l’implant de dexaméthasone (49), existence de biomarqueurs SD-OCT (38,39), tels que la présence de liquide sous-rétinien, la présence de logettes dans la couche nucléaire externe, la continuité de la ligne ellipsoïde, la présence de points hyper-réflectifs.
Notre objectif était de renforcer les arguments pour ces facteurs pronostiques d’efficacité et d’analyser certains facteurs plus inédits tel que le nombre de microanévrismes en angiographie (50), dans l‘œdème maculaire diabétique résistant aux anti-VEGF et traité par implant intravitréen de dexaméthasone.
B.
Matériel et méthode
Afin de guider le choix du praticien parmi les thérapeutiques intravitréennes dans la prise en charge de l’œdème maculaire diabétique résistant aux anti-VEGF, nous avons réalisé une étude rétrospective observationnelle portant sur tous les patients avec œdème maculaire diabétique résistants au
traitement par injection intravitréenne d’anti-VEGF, traités par injection intravitréenne d’implant de dexaméthasone entre Janvier 2015 et Janvier 2019 à l’hôpital de la Timone (Marseille, France) et à l’hôpital Nord
(Marseille, France). Notre étude adhère aux principes de la Déclaration d'Helsinki. L'approbation du comité d'éthique n'était pas requise en vertu de la loi française (n ° 2004-806 du 9 août 2004), les données étant collectées de manière rétrospective et la gestion des patients non modifiée.
1.
Collecte des données
a)
Population
Nous avons inclus rétrospectivement tous les patients de plus de 18 ans, porteur d’un diabète de type I ou II, présentant un Œdème maculaire diabétique, avec une épaisseur rétinienne sous-fovéolaire > 250µm sur les
26
images SD-OCT (Spectralis, Heidelberg Engineering, Heidelberg,
Allemagne), avec une acuité visuelle supérieure ou égale à 20 lettres sur l’échelle ETDRS (Early Treatment Diabetic Retinopathy Study), ayant eu initialement un traitement par injection d’anti-VEGF (Ranibizumab ou
Aflibercept), ayant bénéficié d’un switch vers l’implant de dexaméthasone à la suite du diagnostic d’échec des anti-VEGF, entre Janvier 2015 et Janvier 2019.
Le diagnostic d’échec des anti-VEGF a été basé sur la définition du protocole du Diabetic Retinopathy Clinical Research Network (DRCR.net protocol) (51) :
- Diminution de l’épaisseur rétinienne sous-fovéolaire - ou du volume maculaire total inférieur à 10%
- et/ou une amélioration de l’acuité visuelle inférieure à 0.1 sur l’échelle décimale.
Les patients ont été retrouvés à partir des archives tenues des séances d’IVT, permettant la détection fiable et complète de tous les patients
concernés, chaque IVT réalisée dans nos centres étant notifiée (Date, côté, indication, numéro de lot des produits, évènement indésirable) et archivée. Lors de la visite précédant la première injection de l’implant de
dexaméthasone, les informations démographiques (délais de switch, le pourcentage d’hémoglobine glyquée (HbA1c%), le nombre d’IVT d’anti-VEGF, l’Age, le sexe) et l’évaluation de la BCVA ont pu être relevée. Ces données ont pu être collectées pour notre étude directement dans les dossiers médicaux et sont présentées dans le tableau l.
Les patients étaient exclus s’ils présentaient une autre cause d’œdème maculaire parmi : DMLA Exsudative, Occlusion veineuse rétinienne, uvéites et œdèmes maculaires post-opératoires. Par ailleurs un minimum de 6 mois de suivi était requis.
27
b)
Analyse OCT
Les caractéristiques anatomiques ont été étudiées par un praticien qualifié unique, sur les images OCT (balayage horizontal central horizontal 6 mm, Spectralis, Heidelberg Engineering, Heidelberg, Allemagne) prises avant les IVT d’anti-VEGF, avant les IVT de dexaméthasone ainsi qu’à 1 mois (M1), 3 mois (M3) et 6 mois (M6) de l’IVT de dexaméthasone. Nous avons recueilli des critères quantitatifs : estimation de l’épaisseur maculaire centrale (CMT), du volume maculaire, de l’estimation de l’épaisseur choroïdienne
rétrofoveolaire, de l’épaisseur de la couche des cellules ganglionnaire (GCC) en interpapillomaculaire, en utilisant le mapping automatique du logiciel de l’appareil, et corrigé manuellement quand nécessaire. Nous avons également relevé des critères qualitatifs : la présence de points hyper réflectifs (HRD), de la présence de DRIL (désorganisation des couches rétiniennes internes) ou d’exsudat. Nous avons également distingué le type d’œdème maculaire, à savoir Décollement Séreux Rétinien (DSR, dès lors qu’il existe un
décollement séreux rétinien), Œdème Maculaire Cystoïde (OMC, quand il existait des logettes d’allures cystoïde, c’est-à-dire oblongue séparée par des septas hyper-réflectifs en OCT, et en l’absence de DSR) ou Epaississement Maculaire Diffus (EMD, définit comme un aspect spongieux et épaissis de la rétine, sans aspect d’OMC, ni de DSR)
c)
Analyse angiographique
Les caractéristiques angiographiques ont été relevées sur les images de la dernière angiographie réalisée avant la première IVT de dexaméthasone. Ainsi, le nombre de microanévrysmes de plus de 50µm de diamètre dans les 1,2mm et 3,6mm centraux, délimités au moyen de la grille virtuelle
d’évaluation ETDRS de l’œdème maculaire, mise à disposition dans le logiciel de l’appareil (Spectralis, Heidelberg Engineering, Heidelberg, Allemagne), le diamètre de la Zone avasculaire centrale, délimité manuellement.
28
2.
Méthode d’analyse statistique
L’analyse statistique a été réalisée par 2 médecins du service du
biostatistique de l’Hôpital de la Timone. Les tests d’efficacité à 1, 3 et 6 mois ont été effectués par un test de Student. Une analyse univariée pour la caractérisation des facteurs pronostiques selon un modèle de régression linéaire avec inférence bayesienne permettant d’obtenir un coefficient de corrélation beta avec intervalle de confiance à 95 %. Nous avons ensuite réalisé des analyses multivariées selon un modèle de régression linéaire multiple avec inférence bayesienne, ajustées sur les critères jugés significatifs de l’analyse univariés ainsi que sur les critères cliniquement pertinents nous permettant également l’obtention du coefficient beta avec un intervalle de confiance à 95%. Concernant l’étude des facteurs pronostiques, nous donnons les résultats à 6 mois.
C.
Résultats
1.
Caractéristiques à l’inclusion
Au total, 32 yeux ont rempli les critères d’inclusion et d’exclusion. Tous les patients inclus ont eu au moins 6 mois de suivi. Les patients ont été suivis par l’ensemble des praticiens des 2 services. Les caractéristiques initiales étaient similaires dans l’ensemble à celles constatées dans les autres études portants sur les œdèmes maculaires diabétiques résistants aux
anti-VEGF(39). La moyenne d’âge des patients était de 66,5 ans, et 20 étaient des hommes (58,82%). L’HbA1c à l’inclusion était de 7,8% en moyenne. Nos patients avaient un œdème maculaire diabétique moyen de 471 µm et
avaient eu en moyenne 6,6 IVT d’anti-VEGF avant un switch qui a été fait environ 521 jours après la première injection d’anti-VEGF. 9,4% d’entre eux présentaient un Décollement Séreux Rétinien, et 58,6% présentaient des zones de désorganisation des couches rétiniennes internes. Les autres caractéristiques ont été reportées dans le Tableau I.
29
2.
Efficacité de l’implant de Dexamethasone
a)
Sur l’acuité visuelle
L’acuité visuelle moyenne à l’inclusion était de 58 lettres (écart type standard de 16,3 lettres).
Caractéristiques à l’inclusion Moyenne
(Ecart-Type)
Age (Années) 66,5 (7,6)
Sexe masculin (%) 58,8
HbA1c (%) 7,8 (1,2)
N Anti-VEGF (nombre) 6,6 (4,7)
Délai de Switch (jours) 520,8 (500,1)
Meilleure Acuité Visuelle Corrigée (lettres) 58 (16,3)
Epaisseur Maculaire Centrale (CMT) (µm) 471 (126,6)
Décollement Séreux Rétinien (%) 9,4
Œdème Maculaire Cystoïde (%) 75
Epaississement Maculaire Diffus (%) 15,6
Volume Maculaire (µL) 10,41 (1,9)
Epaisseur Choroïdienne (µm) 229,2 (46,2)
Epaisseur de la couche des cellules ganglionnaires (µm)
53 (12,4)
HRD (%) 96,6
Présence d’Exsudats (%) 79
Décollement postérieur du vitré (%) 50
Traction Vitréo-Maculaire (%) 10,3
Membrane épi-rétinienne (%) 65,6
Alteration.de la membrane limitante externe (%) 55,2
Logette dans la couche nucléaire externe (%) 100
Désorganisation des couches rétiniennes internes (%) 58,6
N microanévrismes à 1,2 µm (Nombre)
1,1 (2,2)
N microanévrismes à 3.6 µm (Nombre) 7,9 (8,4)
Tableau 1 : Caractéristiques de la population à l'inclusion N AntiVEGF = nombre d’anti-VEGF avant le switch
N microanévrisme à 1.2 = Nombre de microanévrisme dans les 1,2µm centraux N microanévrisme à 3,6 = Nombre de microanévrisme dans les 3,6µm centraux
30
Nous retrouvons une augmentation statistiquement significative de l’acuité visuelle de +7,3 lettres à 1 mois IC95%[2.9257 ; 11.6128]
(p=0,002), de +6,7 lettres à 3 mois IC95%[1.3857 ; 11.9476] (p=0,016) et de +4,8 lettres à 6 mois IC95%[0.6519 ; 8.9481] (p=0,018).
MAVC (Lettres) Moyenne Test de la
Différence par rapport à l’inclusion IC95% / p value Inclusion 58 0 M1 65 +7,3 [2.9257 ; 11.6128] p = 0,002 M3 63 +6,7 [1.3857 ; 11.9476] p = 0,016 M6 63 + 4,8 [0.6519 ; 8.9481] p=0,018
Tableau 2 : Meilleure Acuité Visuelle Corrigée (MAVC) à l'inclusion, à M1, à M3 et à M6 (ETDRS)
Figure 8 : Evolution de l'acuité visuelle sur 6 mois (lettres)
54 56 58 60 62 64 66 Inclusion M1 M3 M6
31
b)
Sur l’épaisseur maculaire centrale
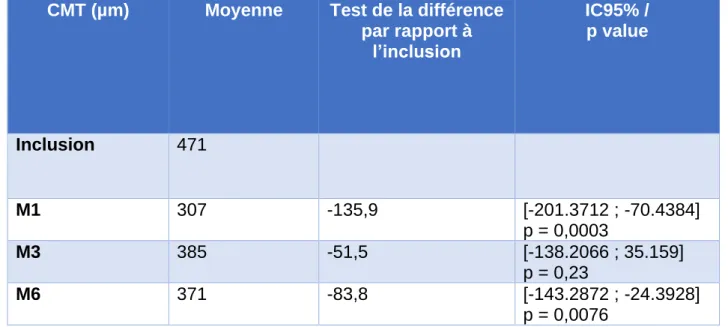
L’épaisseur maculaire centrale moyenne à l’inclusion était de 471 µm (écart type standard de 126,6 µm)
Nous retrouvons une diminution significative de l’épaisseur maculaire centrale de 135,9 µm IC95%[-201.3712 ; -70.4384] (p= 0,0003) à 1 mois
CMT (µm) Moyenne Test de la différence
par rapport à l’inclusion IC95% / p value Inclusion 471 M1 307 -135,9 [-201.3712 ; -70.4384] p = 0,0003 M3 385 -51,5 [-138.2066 ; 35.159] p = 0,23 M6 371 -83,8 [-143.2872 ; -24.3928] p = 0,0076
Tableau 3 : Efficacité de l'implant de dexaméthasone sur l'épaisseur maculaire centrale
Figure 9 : Evolution de l'épaisseur maculaire centrale sur 6 mois
0 50 100 150 200 250 300 350 400 450 500 Inclusion M1 M3 M6
Evolution de l'épaisseur maculaire centrale
moyenne (µm)
32
(307µm), et de 83,8 µm IC95%[-143.2872 ; -24.3928] (p=0,0076) à 6 mois (371 µm ; p = 0,006). Une baisse a été constatée également à 3 mois, mais n’était pas statistiquement significative (-51,5 µm ; p=0,087).
3.
Corrélation des biomarqueurs étudiés avec
l’augmentation de l’acuité visuelle à 6 mois
a)
Analyse univariée de la corrélation avec
l’Acuité visuelle
Variable Coefficient de
corrélation β inférieure Borne
Borne inférieure Décollement séreux Rétinien 4,9 -8,3 18,2 Œdème Maculaire Cystoïde -0,1 -9,3 9,3 Epaississement Maculaire Diffus -3,4 -14,2 7,5 HRD 11,4 -10,9 33,7 Exsudat -7,2 -17,1 2,9 Décollement Postérieur du Vitré -2,1 -8,6 4,4 Traction Vitréo-Maculaire -2,9 -16,5 10,7 Membrane Epirétinienne -2,8 -11,8 6,3 Altération membrane limitante externe 3,7 -4,8 12,2 DRIL -8,9 -16,9 -0,8 Volume maculaire 1,1 -1,3 3,5 Epaisseur Choroïdienne 0,0 -0,1 0,1 Epaisseur de la GCC 0,2 -0,1 0,5 Microanévrismes à 1,2mm -0,3 -2,2 1,5 Microanévrismes à 3,6mm 0,0 -0,6 0,5
Tableau 4 : Résultats de l’analyse univariée pour l'acuité visuelle à 6 mois, avec les bornes de l’intervalle de confiance à 95% (IC95%) du coefficient de corrélation β.
33
Nous avons isolé uniquement 1 facteur corrélé négativement avec l’augmentation de l’acuité visuelle à 6 mois :
- La présence DRIL, avec un coefficient de corrélation β de -8,9 IC95% (-0,8 ; -16,9).
En d’autres termes, la présence de DRIL à l’inclusion entraine une
différence d’acuité visuelle de -8,9 lettres par rapport à l’absence de DRIL.
b)
Analyse multivariée de la corrélation avec
l’acuité visuelle
L’analyse multivariée, a été ajustée sur la présence d’un DSR, de DRIL, d’une altération de la membrane limitante externe, du délai de switch, sur le nombre de microanévrismes dans les 3,6 mm centraux, ainsi que sur
l’épaisseur maculaire centrale. Seule la présence de DRIL demeure corrélée (négativement) au gain d’acuité visuelle avec un coefficient de corrélation β de -9,2 IC95% (-17,0 ; -1,4).
Variable Coefficient de
corrélation β inférieure Borne
Borne supérieure Décollement Séreux Rétinien 9,7 -8,5 27,9 DRIL -9,2 -17,0 -1,4 Alteration de la Membrane Limitante Externe 7,2 -2,1 16,5 Délai de Switch 0,0 0,0 0,0 Microanévrismes dans les 3.6 mm 0,3 -0,3 0,8 Epaisseur maculaire centrale 0,0 0,0 0,0
34
4.
Corrélation avec la diminution de l’épaisseur
maculaire centrale (CMT) à 6 mois
a)
Analyse univariée de la corrélation avec
l’épaisseur maculaire centrale (CMT)
Nous avons isolé 5 facteurs associés significativement à une diminution du CMT à 6 mois :
- La présence d’un Décollement Séreux Rétinien avec un coefficient de corrélation β de -182,5 IC95%(-328,9 ; -35,1),
- La présence de points hyper-réflectifs avec un coefficient de corrélation β de -389,3 IC95%(-609,6 ; -167),
- La présence d’un Décollement Postérieur du Vitré avec un coefficient de corrélation β de -154,6 IC95%(-265; -43,5),
- Un volume maculaire avec un coefficient de corrélation β de -28,5 IC95%(-55,2 ; -2),
- L’épaisseur de la GCC avec un coefficient de corrélation β de -5,3 IC95%(-8,9; -1,8).
Nous avons également isolé 1 facteur significativement associé à une augmentation de l’épaisseur maculaire centrale à 6 mois :
- Le type OMC avec un coefficient de corrélation β de +152,4 IC95%(+43,8 ; +263)
35 Variable Coefficient de corrélation Borne inférieure Borne supérieure Décollement séreux Rétinien -182,5 -328,9 -35,1 Œdème Maculaire Cystoïde 152,4 43,8 263,0 Epaississement Maculaire Diffus -80,0 -238,7 79,6 HRD -389,3 -609,6 -167,5 Exsudat 132,6 -2,2 268,3 Décollement Postérieur du Vitré -154,6 -265,0 -43,5 Traction Vitréo-Maculaire -96,6 -254,0 61,7 Membrane Epirétinienne -9,6 -121,6 104,5 Altération membrane limitante externe -81,9 -183,1 19,8 DRIL 69,3 -34,5 173,9 Volume maculaire -28,5 -55,2 -2,0 Epaisseur Choroïdienne -0,4 -1,5 0,7 Epaisseur de la GCC -5,3 -8,9 -1,8 Microanévrismes à 1,2mm 4,8 -21,3 30,6 Microanévrismes à 3,6mm 1,0 -5,6 7,5
36
b)
Analyse multivariée de la corrélation avec
l’épaisseur maculaire centrale (CMT)
Notre analyse multivariée de la corrélation avec la diminution de l’épaisseur maculaire centrale à 6 mois a été ajustée sur la présence d’un décollement séreux rétinien, le type œdème maculaire centrale, sur la présence
d’exsudats, la présence de points hyper-réflectifs, sur le volume maculaire, sur le délai de switch, sur le nombre de microanévrisme à 3,6 mm, ainsi que sur la meilleure acuité visuelle corrigée.
Restent significatifs
- Le type d’Œdème Maculaire Central avec un coefficient de corrélation β de +130,5 IC95%(+0,4 ; +260,8),
- La présence d’exsudats avec un coefficient de corrélation β de +223,9 IC95%(+76,5 ; +371,2)
- Et la présence de points hyper-réflectifs avec un coefficient de corrélation β de -305,5 IC95%(-467,9 ; -141,7) Variable Coefficient de corrélation Borne inférieure Borne supérieure Décollement Séreux Rétinien -168,3 -373,6 36 Œdème Maculaire Cystoïde 130,5 0,4 260,8 Exsudats 223,9 76,5 371,2 Points Hyper-Réflectifs -305,5 -467,9 -141,7 Volume maculaire -4,7 -29,6 20,4 Délai de Switch 0,07 -0,03 0,2 Microanévrismes à 3.6 mm 0,1 -5,6 5,8 MAVC 0,2 -2,1 2,5
37
V. Discussion
Il existe actuellement 4 acteurs dans la prise en charge de l’œdème
maculaire diabétique, ayant à la fois l’Autorisation de Mise sur le Marché et le Remboursement : 2 anti-VEGFs (le ranibizumab Lucentis® et l’afflibercept Eylea®) utilisables tous les deux en première intention, ainsi que 2
corticostéroïdes, l’implant de dexaméthasone Ozurdex® en deuxième intention(48) et l’implant de fluocinolone, Illuvien® en dernière intention(30). L’implant intravitréen, en particulier l’implant intravitréen de Dexaméthasone est par conséquence un choix logique en cas d’impasse avec l’utilisation des anti-VEGF(48).
Les caractéristiques de base de notre population était assez proches de celles étudiées dans les autres études portant sur l’utilisation de l’implant intravitréen de dexaméthasone dans l’œdème maculaire diabétique, qu’il s’agisse des études portant spécifiquement sur les patients
réfractaires(36,38,39,49,52) aux anti-VEGF ou non (48,53). Concernant les caractéristiques SD-OCT, 9,4% de nos patients présentaient un DSR à l’inclusion, ce qui était significativement plus faible que dans les dernières études(38,39,49), sans que nous ne puissions l’expliquer.
Concernant les autres paramètres, nous avons retrouvé la présence de logettes dans la couche nucléaire externe chez 100% des patients, la présence de points hyper-réflectifs dans 96,6%, la présence d’un DPV dans 50 % et la présence d’une traction vitréo-maculaire dans 10,3% des patients. En comparaisons l’étude récente de Zur. D et al. Par exemple retrouvait dans le sous-groupe des patients réfractaires aux anti-VEGF la présence d’un DSR dans 25,6%, la présence de logettes dans la couche nucléaire externe dans 98,9%, la présence de points hyper-réflectifs dans 97,8%, la présence d’un DPV dans 74.4% et la présence d’une traction vitréo-maculaire dans 2,2% de sa population.
38
Le nombre d’injection d’implant de dexaméthasone dans les 6 mois suivant l’inclusion a été de 1,25 dans notre étude (à 6mois) contre 1,2 sur 9 mois dans l’étude MOZART. La différence aurait été bien plus importante si nous avions prolongé le suivi jusqu’à 9 mois, preuve d’un traitement plutôt bien mené et répété dans notre protocole, pouvant en partie expliquer nos bons résultats visuels.
Nos résultats renforcent encore une fois la preuve de l’efficacité de l’implant intravitréen de dexaméthasone sur l’acuité visuelle et l’épaisseur maculaire centrale. Nous avons en effet constaté une augmentation significative de l’acuité visuelle moyenne de 7,3 lettres à 1 mois, de 6,4 lettres à 3 mois, suivi d’une stabilisation à un gain de 4,8 lettres à 6 mois ce qui est comparable avec les récentes études des patients réfractaires aux anti-VEGF (33,36,39). L’augmentation de l’acuité visuelle constatée n’est toutefois pas aussi
importante que dans l’étude MOZART, qui retrouvait une augmentation de +7.6 lettres à 6 mois, mais qui avait inclus à la fois les patients naïfs et les patients résistants. Dans ce sens, les patients naïfs montrent une
récupération significativement meilleure dans l‘étude IRGREL-DEX (52) en comparaison des patients réfractaires.
Par ailleurs, à 6 mois :
- 15,6% de nos patients avaient gagné 15 lettres ou plus ; - 30% ont gagné 10 lettres ou plus ;
- 12 (37,5%) patients avaient une acuité supérieure à 70 lettres (seuil légal pour la conduite automobile) contre 8 (25%) à l’inclusion. Autrement dit, 17% des patients ayant une acuité <70 lettres à l’inclusion ont présenté des acuité visuelles >70 lettres à 6 mois.
Ils renforcent également la preuve de l’efficacité de l’implant intravitréen de dexaméthasone sur l’épaisseur maculaire centrale. Notre étude retrouve en effet une baisse majeure dès le premier mois et persistante jusqu’au sixième mois : 471µm à l’inclusion (assez semblable aux études citées
39
mois, et 83,8µm au 6ème mois par rapport à l’inclusion. Cette dynamique est la dynamique classique de l’efficacité de l’implant de dexaméthasone.
Encore assez peu d’études ont porté sur les facteurs prédictifs d’efficacité de l’implant de dexaméthasone dans l’œdème maculaire diabétique. Notre étude a encore réduit la population cible se limitant aux patients ayant présenté un échec des anti-VEGFs. Nous avons de plus eu accès à 6 mois de données et nous avons étudié un nombre important de critères.
Concernant la corrélation avec l’efficacité visuelle, nous trouvons à nouveau l’impact négatif des DRIL sur l’acuité visuelle finale confirmée en analyse multivariée. Cette information est intéressante car allant dans le même sens que la totalité des études récentes (37–39).
Les études du Dr Bonfiglio (38) et du Dr Z. Zur (39) allaient également dans le sens d’une corrélation entre l‘efficacité de l’implant de dexaméthasone et la présence d’un décollement séreux rétinien. Dans notre étude, nous retrouvons une corrélation statistiquement significative entre la présence initiale d’un DSR et la diminution de l’épaisseur maculaire centrale en analyses univariées mais nous ne parvenons pas à le conclure sur nos analyses multivariées, probablement à cause d’un manque de puissance. Nous retrouvons enfin que la présence d’un œdème maculaire de type cystoïde était un facteur de mauvais pronostique sur la diminution de l’épaisseur centrale.
L’étude du Dr Bonfiglio (38) retrouvait une corrélation entre la présence de points hyper-réflectifs et l’efficacité de l’implant de dexaméthasone. De même, nous retrouvons ce lien, que ce soir sur l’analyse univariée ou
multivariée. Cependant nous avons retrouvé des points hyper-réflectifs chez presque 100% de nos patients à l’inclusion (96,6%), ce résultat est donc à prendre avec des réserves.
La présence d’exsudats aurait également eu un impact positif sur la diminution de l’épaisseur maculaire centrale mais en analyse multivariée uniquement. Nous n’avons pas trouvé d’autre papier annonçant cela.
40
Une nouveauté qu’a apporté notre étude a été le décompte des
microanévrismes centraux sur l’angiographie, critère qui n’avait jamais été étudié. Nous avions l’intuition d’une meilleure efficacité de l’implant de dexaméthasone dans les cas où il existait une densité importante de microanévrismes. Nous n’avons pas eu de résultat nous permettant de conclure sur leur impact mais nous persistons à croire qu’il existe un lien entre leur nombre ou leur répartition et le succès de l’implant de
dexaméthasone. Notre étude n’avait cependant pas le design adapté pour le montrer. Par ailleurs, nous devons souligner le caractère manuel du
décompte, le caractère unique de l’examinateur, et la fixation arbitraire des limites du décompte (1,2 µm centraux, 3,6 µm centraux, microanévrisme de plus de 50µm). De plus, la date de réalisation de l’angiographie n’a pas pu être contrôlée, ce qui limite d’après nous la comparaison des patients.
Cette étude possède plusieurs limites. D’abord son faible nombre de patients, qui limite sa puissance. Ensuite, certaines données ont été collectées sur des examens inadaptés et par un seul examinateur. Par exemple, le DPV été évaluée sur les coupes OCT maculaires, et l’épaisseur de la couche des cellules ganglionnaire a été faite sur des images parfois mal définie, relevant d’une certaine subjectivité
Nous n’avons par ailleurs constaté aucun cas d’hypertonie oculaire qui n’ait pu être contrôlé par une thérapie hypotonisante locale pure, et aucune complication sévère n’a été constatée, en particulier aucun implant intra cristallinien ou fragmentation de l’implant de dexaméthasone.
VI. Conclusion
Notre étude conforte les dernières conclusions sur l’impact négatif des DRIL sur la récupération visuelle. Elle retrouve également un effet positif des points hyper-réflectifs sur la diminution de l’épaisseur maculaire centrale. Elle va également dans le sens d’une corrélation entre la présence d’un
41
décollement séreux rétinien initial et la diminution de l’épaisseur maculaire centrale.
Par ailleurs, elle pointe d’autres pistes dans la recherche de nouveaux biomarqueurs, comme les exsudats et la catégorie œdème maculaire cystoïde.
Nous avons également réaffirmé l’efficacité de l’implant intraoculaire de dexaméthasone Ozurdex® dans l’œdème maculaire diabétique après échec des anti-VEGF. Toutefois ce n’est pas une étude comparative, et il pourrait être intéressant de comparer, dans ces cas d’échec, le switch vers l’implant de dexaméthasone versus la poursuite des anti-VEGF.
Nous aimerions pousser notre étude plus loin en y incluant une nouvelle base de données.
Enfin, elle laisse en suspens notre suspicion concernant l’impact des microanévrismes sur l’efficacité de l’implant de dexaméthasone.