Développement d’une méthode analytique pour la
spéciation du sélénium dans le plasma des Inuits du
Nunavik
Mémoire
Adel Achouba
Maîtrise en médecine expérimentale
Maître ès sciences (M.Sc.)
Québec, Canada
iii
Résumé
Le sélénium (Se) est très abondant dans l’alimentation marine traditionnelle des Inuits et par conséquent leur apport en Se est parmi les plus élevés au monde. Cette alimentation marine est une source importante de méthylmercure (MeHg) et un apport élevé en Se pourrait contrer certains de ses effets néfastes. Dans cette étude, une méthode de spéciation et de quantification du Se plasmatique et des fractions du Hg associées a été développée puis appliquée à des échantillons de plasma d’adultes inuits ayant participé à l’enquête de santé Qanuippitaa-2004. La glutathion peroxydase 3 (GPx3), la sélénoprotéine P (SelP) et la sélénoalbumine (SeAlb) représentaient en moyenne 25%, 52% et 23% du Se plasmatique total respectivement. En outre, l’Hg coéluait avec chacune de ces protéines dont 50% était associé à la SelP. La relation non linéaire observée entre les concentrations plasmatiques et sanguines de Se suggère qu’un sélénocomposé, possiblement la sélénonéine, s’accumule dans les cellules sanguines.
v
Abstract
Selenium (Se) is highly abundant in traditional marine foods consumed by Inuit and accordingly their Se intake is one of the highest in the world. These marine foods are also a replete of methylmercury (MeHg) and an elevated Se intake may offset some of its deleterious effects. In this study, a method for the speciation and quantification of Se and associated Hg fractions in human plasma was developed and then applied to plasma samples of Inuit adults who participated to the 2004 Qanuippitaa health survey. Glutathione peroxidase 3 (GPx3), selenoprotein P (SelP) and selenoalbumin (SeAlb) represented on average 25%, 52% and 23% of the total plasma Se concentration, respectively. In addition, Hg co-eluted with each Se-containing protein and 50% of plasma Hg was associated with SelP. A non-linear relationship was observed between plasma and blood Se, suggesting that a selenocompound, possibly selenoneine, accumulates in blood cells of our participants.
vii
Table des matières
Résumé ... iii
Abstract ... v
Table des matières ... vii
Liste des tableaux ... xi
Listes des figures ... xiii
Abréviations ... xv Remerciements ... xvii Avant-propos ... xix Chapitre I : Introduction ... 1 1 Historique ... 1 2 Propriétés physico-chimiques ... 2
3 Présence dans l’environnement ... 3
3.1 L’atmosphère ... 3
3.2 L’eau ... 4
3.3 Le sol ... 4
4 Sélénium dans l’organisme humain ... 6
4.1 Les composés organiques séléniés... 6
4.1.1 Les acides aminés séléniés ... 6
4.1.2 La sélénonéine ... 9
4.2 Sélénite et séléniate ... 9
4.3 Les sélénoprotéines ... 9
4.3.1 La famille des glutathion peroxydases (GPx) ... 9
4.3.2 La sélénoprotéine P (SelP) ... 12
4.3.3 La famille des iodothyronines désiodases (DIOs) ... 13
4.3.4 La famille des thiorédoxines réductases (TrxR) ... 14
4.3.5 La méthionine R-sulfoxyde réductase 1 (MsrB1) ... 16
4.3.6 La sélénoprotéine N (SelN) ... 16
4.3.7 La sélénoprotéine O (SelO) ... 17
4.3.9 La sélénoprotéine W (SelW) ... 18
4.3.10 La sélénoprotéine H (SelH) ... 18
4.3.11 La sélénoprotéine M (SelM) ... 18
4.3.12 La sélénoprotéine de 15KDa (Sep15) ... 19
4.3.13 Les sélénoprotéines K et S (SelK, SelS) ... 19
4.3.14 La sélénoprotéine T (SelT) ... 20 4.3.15 La sélénoprotéine V (SelV) ... 20 4.3.16 La sélénophosphate synthétase 2 (SPS2) ... 20 5 Toxicocinétique du sélénium ... 20 5.1 Absorption ... 20 5.2 Distribution ... 21 5.3 Biotransformation ... 21 5.4 Élimination ... 23 6 Sélénium et santé... 23
6.1 Les maladies cardiovasculaires ... 23
6.2 Le diabète de type 2 ... 24
6.3 Le système immunitaire ... 25
6.4 Les maladies infectieuses virales ... 25
6.5 Le cancer ... 25
7 Interaction entre le sélénium et le méthylmercure (Se-MeHg) ... 26
7.1 Diminution de la toxicité par formation de composés MeHg-Se(H) ... 27
7.2 Le sélénium joue un rôle dans la biotransformation du MeHg ... 28
7.3 Le sélénium inhibe le produit de la dissociation du MeHg... 29
8 Population d’étude ... 29
8.1 Les Inuits du Nunavik ... 29
8.2 Alimentation traditionnelle des Inuits du Nunavik ... 30
8.3 Recrutement et échantillonnage ... 31
9 Objectifs ... 32
10 Démarche expérimentale ... 32
10.1 Spéciation du sélénium plasmatique ... 33
ix
Chapitre 2: Article scientifique ... 37
Circulating levels of selenium species in Inuit adults from Nunavik ... 37
Chapitre 3 : Conclusion générale ... 55
xi
Liste des tableaux
Tableau 1 : L’abondance relative naturelle des isotopes du sélénium. ... 2 Tableau 2 : Répartition selon le groupe d'âge et âge médian des Inuits du Nunavik (année
2011) ... 30
Table 3 : Operating conditions for the liquid chromatography (LC) and ICP-MS
instruments ... 52
Table 4 : Analytical performance of the ID-AF-ICP-MS method ... 53 Table 5 : Concentrations of total blood Se, total plasma Se and plasma Se proteins in Inuit
of Nunavik (n=852) ... 54
Table 6 : Concentrations of total blood Hg and plasma Hg associated to selenoproteins in
xiii
Listes des figures
Figure 1 : Cycle biogéochimique du sélénium. ... 5
Figure 2 : Structures chimiques de la sélénocystéine et la cystéine. ... 6
Figure 3 : Les étapes de biosynthèse de la Sec-ARNt(Ser)Sec (A) et le mécanisme d’insertion de la sélénocystéine dans les sélénoprotéines (B) chez les eucaryotes ... 7
Figure 4 : Structures chimiques de la sélénométhionine et la méthionine. ... 8
Figure 5 : Structure chimique de la sélénonéine. ... 9
Figure 6 : Mécanisme d’action des GPx selon Papp et al ... 12
Figure 7 : Mécanisme d’action du système TRx selon Lu et al ... 16
Figure 8 : La biotransformation du sélénium selon Alexander et al ... 22
Figure 9 : Carte géographique du Nunavik ... 29
Figure 10 : Schematic diagram of the ID-AF-ICP-MS method for Se-containing proteins separation and quantification. ... 50
Figure 11 : Typical mass flow chromatogram obtained by AF-ICP-MS analysis of Inuit plasma for both (78Se/77Se) and (200Hg/204Hg) ratios. ... 50
Figure 12 : Relationship between blood and plasma Se concentrations in Inuit of Nunavik (n=852)... 51
xv
Abréviations
ApoER2 récepteur 2 de l’apolipoprotéine E ARNm acide ribonucléique messager ARNt acide ribonucléique de transfert C4H10O2 hydroperoxyde de tert-butyle C9H12O2 hydroperoxyde de cumène Ca++ calcium
CEPT choline/éthanolamine phosphotransférase CHPT choline phosphotransférase
CNX calnexin
CTQ Centre de Toxicologie du Québec DIOs iodothyronines désiodases
DMDSe diméthyldiséléniure DMSe diméthylséléniure
EFSec facteur d’élongation spécifique eIF4a3 facteur d’initiation eucaryotique
ERAD Endoplasmic-Reticulum-Associated protein Degradation ERO espèces réactives de l’oxygène
Fe Fer
Fe2SeO3 sélénite ferrique Gal-1 galectine 1 GPx glutathion peroxydase Grx glutarédoxine Grxr glutarédoxine réductase Grx2 glutarédoxine 2 GSH glutathion GSSeH glutathio-sélénol H2O2 peroxyde d’hydrogène H2Se séléniure d'hydrogène Hg mercure Hgin mercure inorganique HgSe tiemannite
ICP-MS spectrométrie de masse à plasma induit INSPQ Institut National de Santé Publique de Québec LaOOH acide linoléique
LDLs lipoprotéines de basse densité MeHg Méthylmercure
MeHgCl chlorure de méthyl-mercure MeSeH méthane sélénol
Met méthionine
MsrB1 méthionine R-sulfoxyde réductase 1 Na2SeO3 sélénite de sodium
NO monoxyde d’azote
OMS organisation mondiale de la santé RyR récepteur ryanodine
SBP2 protéine de liaison
Se sélénium
Se+IV sélénite Se+VI séléniate
Se0 sélénium élémentaire SeAlb sélénoalbumine
Sec sélénocystéine
SECIS Selenocysteine insertion sequence
SeGalNAc méthyl 2-acetamido-2-deoxy-1-seleno-β-D-galactose SeGluNAc méthyl 2-acetamido-2-deoxy-1-seleno-β-D--glucosamine Se-II sélénure SelH sélénoprotéine H SelI sélénoprotéine I SelK sélénoprotéine K SelM sélénoprotéine M SelN sélénoprotéine N SelO sélénoprotéine O SeLP sélénoprotéine P SelR sélénoprotéine R SelS sélénoprotéine S SelT sélénoprotéine T SelV sélénoprotéine V SelW sélénoprotéine W SelX sélénoprotéine X SeMet sélénométhionine
Sep15 sélénoprotéine de 15KDa
Ser sérine
SeRS séryl-ARNt synthétase SPS2 sélénophosphate synthétase 2 T3 triiodothyroxine T4 thyroxine TMSE triméthylsélénium Trx thiorédoxine TrxR thiorédoxine réductase
UGGT UDP-glucoseglycoprotéine glucosyltransférase
xvii
Remerciements
Tout d’abord je tiens à remercier mon directeur de recherche Dr Pierre Ayotte pour m’avoir donné la chance de réaliser ce projet et de m’avoir guidé avec patience et bienveillance tout au long de mon parcours à la maîtrise.
Mes remerciements vont aussi à Pierre Dumas qui a été plus qu’un collègue, toujours présent pour répondre à mes questions et m’aider dans la réalisation de mon projet.
À Nathalie Ouellette, merci pour tes conseils, ta gentillesse et ta présence à chaque fois que j’avais besoin d’aide.
À tous les membres de l’Institut national de santé publique du Québec (INSPQ) que j’ai côtoyés de près ou de loin et en particulier à Normand Fleury le directeur scientifique du Centre de toxicologie du Québec (CTQ) qui m’a ouvert les portes de l’INSPQ pour la première fois pour un stage qui s’est terminé par une maîtrise.
Enfin, je remercie ma chère épouse Meriem qui m’a soutenu tout au long de cette aventure, mes adorables filles AYA et NADA qui me rendent la joie quand je la perds, mes chers parents qui ne cessent de penser à moi, mes amis ainsi que tous les membres de ma famille.
xix
Avant-propos
Ce mémoire est présenté sous forme d’article scientifique. L’ébauche de cet article a été rédigée par le candidat avec la participation des coauteurs. Pierre Ayotte a révisé l’article d’une manière critique à plusieurs reprises jusqu’à la version finale, laquelle a été approuvée par tous les coauteurs. Pierre Dumas et Nathalie Ouellet ont participé grandement au développement de la méthode analytique.
1
Chapitre I : Introduction
1 Historique
Le sélénium fut découvert accidentellement par le suédois Jacob Berzelius en 1817 [1], lors de ses travaux de recherche sur une maladie qui a touché des individus œuvrant dans la fabrication de l’acide sulfurique. Le chercheur pensait à l’époque que c’était l’arsenic qui était la cause de cette intoxication alors qu’il fit la découverte d’un nouveau composé qu’il nomma Sélénium du nom grec de la déesse de la lune Selênê.
Le caractère toxique que lui a conféré cette découverte a été à l’origine de la mauvaise réputation qui a précédé le sélénium pendant plusieurs années, laquelle fut aggravée par certaines études comme celle de Nelson en 1943 évoquant le risque cancérigène de cet élément [2]. Cependant, en 1957 le premier effet sur la santé d’une carence en sélénium a été mis en évidence par les chercheurs Schwarz et Foltz au cours de leurs travaux sur la nécrose hépatique chez les rats. En effet, leurs résultats montraient clairement qu’un apport insuffisant en sélénium induit une nécrose fatale du tissu hépatique chez cette espèce [3]. Cette découverte fut à l’origine du statut d’oligo-élément essentiel à l’organisme attribué au sélénium. Depuis, plusieurs études ont été réalisées pour essayer de bien cerner les effets reliés au statut en sélénium.
En 1973, le sélénium a été identifié comme un composant essentiel d’un enzyme antioxydant : la glutathion peroxydase (GPx) [4, 5]. Son importance comme élément trace essentiel à l’humain a été confirmée par la première étude de supplémentation visant la prévention de la cardiomyopathie ayant engendré la mort de plusieurs individus dans le comté de Keshan, province chinoise d’Heilongjihang et dont la cause était une carence en sélénium [6]. À partir de 1978, une supplémentation systématique en sélénite de sodium (Na2SeO3) a permis l’éradication presque totale de la maladie dans cette région de la Chine [7].
Durant ces dernières années, plusieurs études de supplémentation en sélénium ont été réalisées afin de connaitre ses effets sur la santé humaine [8].
2 Propriétés physico-chimiques
Le Sélénium (Se) est un métalloïde appartenant à la famille des chalcogènes regroupant l’oxygène, soufre, polonium et tellure. De masse atomique égale à 78.96 g.mol-1 il constitue le 69ème élément sur terre. À l’état naturel, il se présente sous quatre formes d’oxydation: -II (séléniure), 0 (sélénium élémentaire), +IV (sélénite) et +VI (séléniate) [1].
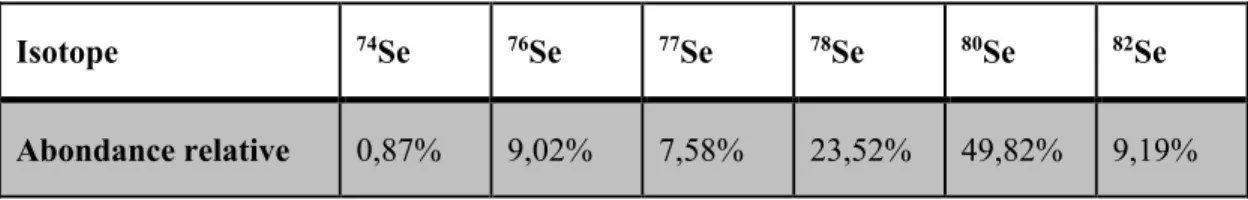
Le sélénium comporte six isotopes naturels stables à savoir le 74Se, 76Se, 77Se, 78Se, 80Se et 82Se. Les plus abondants sont le 78Se et 80Se représentant chacun 23 et 50% respectivement du Se total (voir Tableau 1).
Le sélénium élémentaire est allotropique. Ces formes cristallines et amorphes sont insolubles dans l’eau :
- Le sélénium métallique constitue la forme la plus courante, il est de couleur grise et sa structure cristalline est hexagonale.
- Le sélénium amorphe rouge foncé monocyclique. - Le sélénium vitreux de couleur noir.
La forme la plus réduite du sélénium (Se–II) est présente dans les séléniures inorganiques ainsi que dans l’ensemble des composés organiques séléniés. Le séléniure précipite avec les éléments métalliques, formant ainsi des séléniures métalliques à faible solubilité.
Tableau 1 : L’abondance relative naturelle des isotopes du sélénium.
Isotope 74Se 76Se 77Se 78Se 80Se 82Se
3
3 Présence dans l’environnement
3.1
L’atmosphèreL’atmosphère constitue un réservoir transitoire important de sélénium où a lieu son émission, transport et dépôt dans l’environnement. En effet, des estimations récentes indiquent que 13 000 à 19 000 tonnes de sélénium par année sont recyclées dans la troposphère [9].
Il existe deux catégories de sources d’émission de sélénium dans l’atmosphère: naturelles (60%) et anthropiques (40%). Les sources naturelles, comprennent l’érosion des sols, les volcans, les sels des océans et les processus de biométhylation des organismes vivants (bactérie, algues et plantes). En ce qui concerne les sources anthropiques, la combustion des énergies fossiles constitue la principale source d’émission de sélénium [9].
On distingue trois espèces de sélénium présentent dans l’atmosphère :
- Les composés organiques volatils: le diméthylséléniure (DMSe), le diméthyldiséléniure (DMDSe) et le méthane sélénol (MeSeH).
- Les composés inorganiques volatils: le sélénium élémentaire Se(0), dioxyde de sélénium (O2Se) et le séléniure d'hydrogène (H2Se).
- Les composés particulaires: Se(0) surtout lié aux cendres volantes et particules en suspensions.
Les niveaux atmosphériques de sélénium dans les régions urbaines varient entre 0.1 et 10 ng/m3 provenant essentiellement de la combustion des sources d’énergie fossile et du charbon [10]. Le sélénium dans l’air ambiant se trouve lier aux cendres volantes et
particules en suspension qui peuvent en contenir entre 1.4 à 11 µg/g et 1 à 110 µg/g respectivement [10]. Ces valeurs augmentent au fur et à mesure qu’on se rapproche de la
3.2 L’eau
Le sélénium dans les différentes nappes d’eau provient des dépôts atmosphériques ou par drainage des sols et des sous-sols. Les niveaux varient de 0.06 à 0.12 µg/L dans les eaux de mer [12] et de 0.06 à 400 µg/L dans les eaux de surface et souterraines [1].
Le pH influence grandement la teneur du sélénium dans les eaux de surface. En effet, à pH alcalin (pH >7.5) les niveaux de sélénium sont élevés résultant de l’oxydation des sélénites en séléniates solubles dans l’eau. Cependant, en présence du Fer (Fe), le sélénium se précipite sous forme de sélénite ferrique (Fe2SeO3) ce qui fait diminuer sa concentration dans ces eaux [1, 13].
Le sélénium dans l’eau potable dépasse rarement les 10 µg/L dans la plupart des pays hormis quelques régions sélénifères [14]. Le seuil de potabilité fixé par l’Organisation mondiale de la santé (OMS) pendant plusieurs années de 10 µg/L a été récemment révisé pour atteindre 40 µg/L [15].
3.3 Le sol
Le sélénium est réparti d’une façon hétérogène dans la croûte terrestre. Son abondance est faible et varie en moyenne entre de 0.05 à 0.09 µg/g[16]. La teneur des sols en sélénium dépend en grande partie de la nature des roches mères qui constituent la source primaire par lessivage [1]. Le sélénium dans ces roches est surtout associé à des minéraux sulfurés sous forme de sélénites et séléniures. Ainsi, dans les roches volcaniques, le sélénium peut atteindre des concentrations de 120 µg/g alors que dans le charbon les valeurs sont de l’ordre 0.47 à 8.1 µg/g[13].
Le sélénium peut être présent dans les sols sous différentes formes : sélénites, séléniates, sélénium élémentaire ou en association avec des minéraux. Le pH du sol joue un rôle important en favorisant l’oxydation ou la réduction du sélénium. Ainsi dans les sols à pH
5 alcalin, le sélénium se présente sous forme de séléniate soluble dans l’eau le rendant ainsi disponible aux plantes [13].
La concentration du sélénium dans les sols varie énormément d’une région à une autre. Dans les zones séléniprives, comme le Danemark, Nouvelle Zélande et la Chine, la teneur en sélénium varie entre 0.005 et 2 µg/g. Ces zones sélénifères sont localisées essentiellement en Irlande, Australie, Canada, Colombie et États-Unis; la plus forte teneur (1200 µg/g) a été enregistrée en Irlande [1, 13, 17].
Après avoir exposé la présence du sélénium dans l’environnement, on peut à présent résumer le cycle biogéochimique du sélénium par la figure 1.
Figure 1 : Cycle biogéochimique du sélénium [9, 18].
Émissions volcaniques
Sols
Eau de surface et Océans
Se lié au cendres Dépôts secs Dépôts humides Pluie Atmosphère Émissions anthropiques Biométhylation Bactéries, Algues, poisson et Plantes Humains Animaux
4 Sélénium dans l’organisme humain
Le sélénium dans le corps humain est présent principalement sous forme de sélénites, séléniates, composés organiques séléniés libres ou incorporés dans des protéines appelées sélénoprotéines. Environ 90% du sélénium total est contenu dans des protéines qui exercent leurs activités biologiques grâce aux groupements sélénol (R-Se-H) des résidus sélénocystéine [19, 20].
4.1 Les composés organiques séléniés
4.1.1 Les acides aminés séléniés
4.1.1.1 La sélénocystéine
Analogue sélénié de la cystéine (figure 2), la sélénocystéine (Sec) constitue le 21ème acide aminé du code génétique dans l’organisme humain [21, 22]. Sa découverte fut suite à la mise en évidence de la première liaison covalente du sélénium dans le site actif d’une sélénoenzyme appelé glutathion peroxydase (GPx) [5, 23].
Figure 2 : Structures chimiques de la sélénocystéine et la cystéine.
L’insertion de la sélénocystéine dans les sélénoprotéines est dite spécifique et originale car en plus du fait qu’elle est codée génétiquement, le codon en question est un codon UGA (Stop) impliquant une machinerie complexe faisant interagir plusieurs acteurs [24].
Cystéine Sélénocystéine
7 En effet, la sélénocystéine se différencie des autres acides aminés par le fait qu’elle ne se présente pas comme un acide aminé libre lié à son acide ribonucléique de transfert (ARNt) et qu’une une étape de biosynthèse d’un ARNt spécifique à elle est nécessaire. Ceci commence par le chargement d’une serine (ser) sur un ARNtsec pour former l’ARNt(Ser)Sec [25]. Ce dernier, subit une aminocylation par l’action de la séryl-ARNt synthétase (SeRS) pour former la séryl-ARNt(Ser)Sec (ser-ARNt(Ser)Sec) [26, 27]. Par la suite une phosphoséryl-ARNt(Ser)Sec kinase phosphoryle le résidu séryl en phosphoséryl-ARNt(Ser)Sec (Pser-ARNt(Ser)Sec) [28, 29] avant sa conversion en sélénocystéyl-ARNt(Ser)Sec (Sec-ARNt(Ser)Sec) par la sélénophosphate synthétase 2 (SPS2) [21, 30] (Voir figure 3 (A)).
Une séquence sur l’ARN messager (ARNm) appelée élément SECIS (pour SElenoCysteine Insertion Sequence) est nécessaire à l’insertion de la sélénocystéine et joue un rôle important dans le recodage du codon UGA en Sec [31, 32]. L’élément SECIS en « tige-boucle » va être au centre d’un complexe formé par le facteur d’élongation spécifique (EFSec) et une protéine de liaison (SBP2) pour permettre la présentation de Sec-ARNt(Ser)Sec au ribosome [32]. Au moins 3 autres facteurs sont aussi impliqués à savoir la protéine ribosomale L30 [33], la nucléoline [34] et le facteur d’initiation eucaryotique eIF4a3 [35] (Voir figure 3 (B)).
Figure 3 : Les étapes de biosynthèse de la Sec-ARNt(Ser)Sec (A) et le mécanisme d’insertion de la sélénocystéine dans les sélénoprotéines (B) chez les eucaryotes [24].
ARNt(Ser)Sec (ser)
ser-ARNt(Ser)Sec
Sec-ARNt(Ser)Sec
Pser-ARNt(Ser)Sec
A
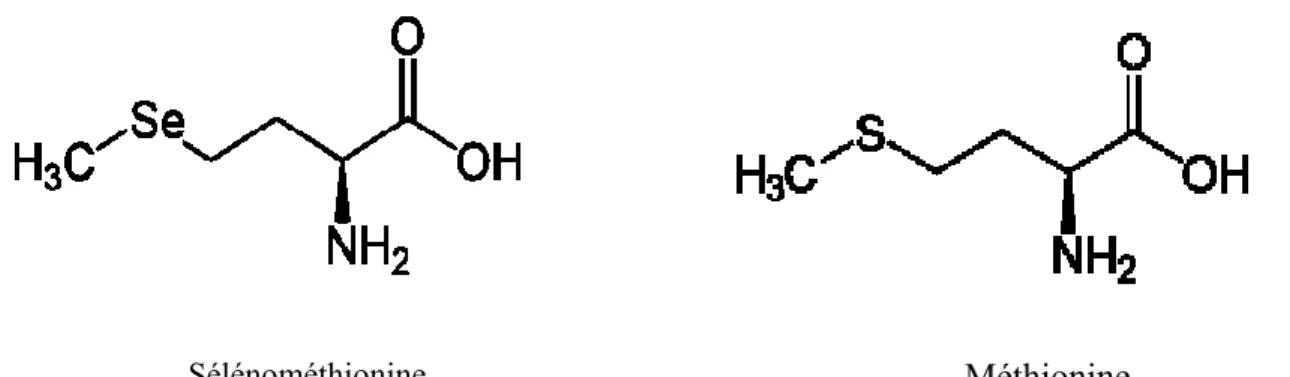
4.1.1.2 La sélénométhionine
Bien que la sélénométhionine (SeMet) ne soit pas codée génétiquement, elle est insérée dans les protéines d’une façon non spécifique. En effet, elle constitue l’analogue sélénié de la méthionine (met), et s’insère à sa place par substitution pour former des protéines séléniées [36].
L’insertion de sélénométhionine dans les protéines n’altère pas leur structure tertiaire. Cependant, lorsque la substitution de la sélénométhionine à la place de la méthionine a lieu au voisinage d’un site actif enzymatique, cela peut perturber son activité car le groupement CH3-Se de la sélénométhionine est plus hydrophobe que le groupement CH3-S de la méthionine. Il en résulte aussi des perturbations au niveau de l’accès du substrat au site actif [37].
L’incorporation de la sélénométhionine se fait essentiellement au niveau des globules rouges et plus précisément dans l’hémoglobine [38]. Dans le plasma elle est incorporée à l’albumine formant ainsi la sélénoalbumine [39][36].
Les sélénoprotéines formées par cette insertion non spécifique constituent un réservoir important de sélénium qui sera utilisé au besoin par l’organisme [37].
Figure 4 : Structures chimiques de la sélénométhionine et la méthionine.
9
4.1.2 La sélénonéine
Récemment découvert par le chercheur Japonais Michiaki Yamashita dans le sang du thon [40], ce sélénocomposé semble être la forme organique prédominante chez les populations dont l’alimentation repose en partie sur les produits de la mer [41]. On ne connait pas beaucoup de choses sur la sélénonéine mais sa présence en tant que composé organique sélénié majeur dans le sang est en faveur d’une activité antioxydante dans l’organisme [41].
Figure 5 : Structure chimique de la sélénonéine.
4.2 Sélénite et séléniate
Ce sont les deux formes oxydées du sélénium dans l’organisme qui partagent les différents systèmes d’oxydoréduction dans le métabolisme du sélénium [13].
4.3 Les sélénoprotéines
Chez l’humain, il existe environ 25 sélénoprotéines comportant un résidu Sec dans leur site actif [20]. Ces dernières sont impliquées dans plusieurs fonctions biologiques dont plusieurs ne sont pas encore identifiées, pour certaines d’entre elles.
4.3.1 La famille des glutathion peroxydases (GPx)
La glutathion peroxydase fut la première sélénoprotéine identifiée chez les mammifères [4, 5]. À présent, il existe au moins 8 isoenzymes dont 5 seulement comportent un résidu Sec, constituant ainsi des sélénoprotéines [13, 20]. Ces 5 isoformes sont réparties dans différents
compartiments cellulaires où elles exercent leur rôle de détoxication des espèces réactives de l’oxygène (ERO) en utilisant le pouvoir réducteur du glutathion (GSH) (figure 6).
4.3.1.1 La glutathion peroxydase 1(GPx1)
La GPx1 est la sélénoprotéine la plus abondante dans l’organisme. C’est une protéine ubiquitaire tétramérique localisée dans le cytosol. Elle réduit essentiellement le peroxyde d’hydrogène (H2O2) et agit comme un antioxydant intracellulaire important [42, 43]. La GPx1 est la sélénoprotéine la plus sensible au changement du statut en sélénium. En effet, l’expression de son ARNm ainsi que sa synthèse diminuent lorsque le niveau de sélénium est faible [44]. C’est aussi le cas, contrairement à ce que l’on peut imaginer, lors du stress oxydatif [45]. Cette exclusion est en fait dans le but de préserver les ressources cellulaires en sacrifiant la sélénoprotéine qui récupère rapidement après le stress oxydatif.
Les expériences sur des modèles animaux suggèrent un effet mineur de cette sélénoprotéine dans des conditions physiologiques normales [43, 46]. Toutefois, on sait maintenant que le peroxyde d’hydrogène est impliqué dans les voies de signalisation de certaines molécules en relation avec des processus biologiques tels que la prolifération cellulaire, l’apoptose et la réponse au stress [47]. Étant donné le grand pouvoir réducteur de la GPx1 sur ce composé, on ne peut que présumer que cette sélénoenzyme est un acteur principal modulant plusieurs de ces activités biologiques [48].
4.3.1.2 La glutathion peroxydase 2 (GPx2)
La GPx2 est un homotétramère exprimé dans tout le tractus gastro-intestinal y compris l’épithélium squameux de l’œsophage [49]. Par sa localisation, elle constitue la première barrière contre le stress oxydatif induit par les aliments pro-oxydants. Son rôle essentiel est de lutter contre le stress oxydatif touchant l’épithélium intestinal en ayant la spécificité à plusieurs substrats incluant le peroxyde d’hydrogène, l’hydroperoxyde de tert-butyle (C4H10O2), l’hydroperoxyde de cumène (C9H12O2) et l’hydroperoxyde de l’acide linoléique (LaOOH) [50]. De plus, son expression non uniforme dans l’épithélium, élevée dans les
11 cryptes et diminuant graduellement en allant vers la surface luminale, lui suggère un rôle dans la prolifération cellulaire [51].
4.3.1.3 La glutathion peroxydase 3 (GPx3)
La GPx3 est la seule sélénoprotéine secrétée dans l’organisme. C’est un homotétramère synthétisé principalement dans les reins par les cellules de l’épithélium tubulaire proximal et les cellules pariétales de la capsule de Bowman puis relâché dans la circulation sanguine [52]. Des études ont aussi révélé qu’elle est exprimée dans d’autres tissus y compris le cœur, où elle représente la 3ème sélénoprotéine en termes d’abondance de son ARNm [53]. La GPx3 est la deuxième plus abondante parmi les sélénoprotéines plasmatiques et la seule de sa famille à exercer une fonction antioxydante extracellulaire. Elle réduit le peroxyde d’hydrogène, les hydroperoxydes d'acides gras et de phospholipides et permet aussi le maintien de la biodisponibilité du monoxyde d’azote (NO) dans les vaisseaux [54, 55].
4.3.1.4 La glutathion peroxydase 4 (GPx4)
Contrairement aux autres membres de la famille des glutathion peroxydases, la GPx4 possède une structure monomérique et se distingue par son large éventail de substrats qu’elle peut réduire [56]. En effet, c’est la seule à avoir une spécificité aux hydroperoxydes de phospholipides et de cholestérol intégrés dans les membranes et les lipoprotéines et peut agir directement en utilisant l’électron des groupements thiols d’autres co-substrats ou par le biais du GSH [57, 58].
La GPx4 est la sélénoprotéine la plus abondante dans les testicules avec différentes localisations : cytosolique, mitochondriale et nucléaire [59]. Elle joue un rôle important dans la maturation des spermatozoïdes en subissant une transformation, au cours des dernières étapes de la spermatogénèse, en une structure protéique entrant dans la composition de la gaine mitochondriale des spermatozoïdes [60]. Elle joue aussi un rôle dans la condensation de la chromatine et assure sa stabilité structurale dans le sperme [61].
Elle est aussi impliquée dans la régulation de l’apoptose [58] [62] et constitue un antioxydant essentiel à l’embryogénèse [63].
4.3.1.5 La glutathion peroxydase 6 (GPx6)
La GPx6 est la dernière sélénoprotéine découverte dans la famille des GPx et son expression semble être confinée aux embryons et à l’épithélium olfactif [20]. Il existe peu de données sur le rôle et la fonction de cette sélénoprotéine mais on peut lui attribuer une fonction antioxydante dans les tissus où elle est fortement exprimée.
Figure 6 : Mécanisme d’action des GPx selon Papp et al [54].
4.3.2 La sélénoprotéine P (SelP)
La SelP représente la sélénoprotéine la plus abondante dans le plasma incorporant plus de 50% du sélénium total plasmatique [64]. Son expression est confirmée dans tous les tissus mais elle est synthétisée majoritairement par le foie ou elle est secrétée sous une forme glycosylée [54]. La SelP possède la particularité de pouvoir contenir jusqu’à 10 résidus Sec dans sa séquence. Cette caractéristique lui vaut son rôle important dans le transport du sélénium du foie vers les différents compartiments du corps, essentiellement vers le cerveau et les testicules [64-66]. Deux récepteurs endocytiques ont été récemment identifiés, impliqués dans l’utilisation de la SelP par les tissus cibles. Il s’agit en premier du récepteur
13 2 de l’apolipoprotéine E (ApoER2) au niveau du cerveau et testicules [67] et en second de la mégaline retrouvée au niveau des reins [68].
En plus de son rôle de transporteur de sélénium vers les tissus périphériques, la SelP peut se lier à l’héparine ou encore aux métaux lourds pouvant aussi jouer le rôle d’agent chélateur [69]. Des fonctions antioxydantes peuvent aussi lui être attribuées grâce à son pouvoir protecteur, démontré in vitro, de cellules endothéliales et astrocytes contre le dommage oxydatif et son inhibition de l’oxydation des lipoprotéines de basse densité (LDLs) [54].
4.3.3 La famille des iodothyronines désiodases (DIOs)
Cette famille regroupe 3 types de sélénoprotéines (DIO1, DIO2 et DIO3) impliquées dans la régulation de l’activité de l’hormone thyroïdienne. Ces sélénoprotéines ont des structures et localisations différentes mais elles partagent la caractéristique d’être des protéines homodimères membranaires et d’avoir toutes un site actif contenant un résidu Sec et deux histidines au sein d’un repliement de type thiorédoxine (Trx) [24].
4.3.3.1 La désiodase type 1 (DIO1)
La DIO1 est retrouvée au niveau des surfaces membranaires plasmiques des cellules et exprimée essentiellement au niveau du foie, des reins et des glandes thyroïde et hypophyse [70]. Elle catalyse la réaction de conversion de la prohormone thyroxine (T4) en une forme active, la triiodothyroxine (T3) et se trouve être responsable de la régulation des niveaux circulants de l’hormone thyroïdienne dans le sérum [71].
4.3.3.2 La désiodase type 2 (DIO2)
La DIO2 est localisée à la surface membranaire du réticulum endoplasmique et retrouvée essentiellement dans le système nerveux central, la glande thyroïde ainsi que les muscles cardiaques et squelettiques [70]. Tout comme la DIO1, elle assure la conversion de la T4 en T3 et joue un rôle important dans la régulation locale intracellulaire des niveaux de T3,
nécessaire à plusieurs processus biologiques comme la thermogenèse dans les tissus adipeux bruns [72] et la différenciation et régénération des muscles squelettiques [73].
4.3.3.3 La désiodase type 3 (DIO3)
Cette dernière sélénoprotéine est associée aux surfaces membranaires plasmiques et retrouvée majoritairement au niveau de l’utérus, du placenta, du cerveau, de la peau et des testicules [70]. Elle catalyse la réaction de conversion de la T3 en une forme inactive, la T2; et impliquée aussi dans la régulation locale des niveaux de T3 dans les tissus [71].
4.3.4 La famille des thiorédoxines réductases (TrxR)
Les thiorédoxines réductases (TrxR) sont des enzymes oxydoréductases utilisant le NADPH pour réduire leur substrat, la thiorédoxine (Trx). Une fois réduite, la Trx est responsable de la réduction de protéines par le bris des ponts disulfures entre les résidus cystéines (figure 7). Ce grand pouvoir antioxydant du système thiorédoxine est la raison pour laquelle on retrouve la TrxR et son substrat dans pratiquement toutes les cellules [74].
Il existe 3 types de TrxR ayant la même structure homodimérique et agissant dans différents compartiments cellulaires :
4.3.4.1 La thiorédoxine réductase 1 (TrxR1)
LA TrxR1 est essentiellement localisée dans le cytosol et le noyau. La forme cytosolique est responsable de la réduction de la Trx qui joue un rôle important en tant qu’antioxydant, régulateur de facteurs de transcription et de l’apoptose [74]. Ce sélénoenzyme réduit aussi une protéine apparentée à la thiorédoxine, connu sous le nom de TRP14, qui possède le même rôle que la Trx et se trouve être impliquée dans la stimulation du TNF-α [75, 76]. La TrxR1 peut aussi agir sur plusieurs autres substrats tels que les sélénites, la vitamine C et les hydroperoxydes [24]. Elle peut faciliter l’action antioxydante des peroxyrédoxines et la méthionine sulfoxyde réductase en agissant comme un donneur d’électron [77, 78].
15 La TrxR1 est essentielle à l’embryogenèse [79] et impliquée dans la réparation de l’ADN, le maintien et la régulation du statut redox intracellulaire [24].
La fonction du résidu Sec a été toujours associée à des activités antioxydantes hypothétiques. Toutefois, une récente étude chez les souris, menée par le chercheur Peng et ses collaborateurs, a démontré que le résidu Sec dans la TrxR1 était le seul responsable de la détoxification du peroxyde d’hydrogène issu du métabolisme du glucose dans les fibroblastes embryonnaires et que la forme équivalente avec un résidu Cys à la place de Sec n’a pas pu empêcher la mort cellulaire massive de celles-ci [80].
4.3.4.2 La thiorédoxine réductase 2 (TrxR2)
De localisation mitochondriale, la TrxR2 réduit, en plus de la Trx, la glutarédoxine 2 (Grx2) [81]. Cette sélénoprotéine semble être nécessaire à l’hématopoïèse, le développement du cœur et la fonction cardiaque [82]. Elle est impliquée aussi dans la régulation du statut redox des mitochondries au cours du développement par la réduction du cytochrome c [83]. Enfin, la TrxR2 joue un rôle aussi dans la prolifération cellulaire [84] et vient d’être récemment associée à la régulation de l’apoptose [85][86].
4.3.4.3 La thiorédoxine réductase 3 (TrxR3 ou TGR)
Retrouvée essentiellement dans les testicules [87], la TrxR3 réduit à la fois la Trx et le glutathion (GSH) du fait qu’elle possède un domaine glutarédoxine (Grx) localisé dans sa partie NH2 terminale [88] . Elle intervient en synergie avec la GPx4 au niveau de la maturation des spermatozoïdes en catalysant l’isomérisation des ponts disulfures des différentes protéines impliquées dans ce processus [89].
Figure 7 : Mécanisme d’action du système TRx selon Lu et al [90].
4.3.5 La méthionine R-sulfoxyde réductase 1 (MsrB1)
Il s’agit d’une sélénoprotéine cytosolique et nucléaire fortement exprimée au niveau du foie et des reins connue aussi sous le nom de sélénoprotéine R ou X (SelR et SelX) [91]. C’est la seule de sa famille, qui comprend deux autres homologues (MsrB2 et MrsB3), possédant un résidu Sec dans son site actif. Elle est responsable de la réduction de l’énantiomère R de la méthionine sulfoxyde assurant ainsi la réparation des dommages causés aux protéines par le stress oxydatif due à l’oxydation de leurs méthionines [92]. La MsrB1 n’agit pas toute seule; elle fait intervenir la thiorédoxine (Trx) pour sa réduction qui est à son tour réduite par la TrxR, une sélénoprotéine [93].
Une étude récente a révélé l’action antagoniste de cette sélénoprotéine contre la mono-oxygénase Mical sur l’assemblage de l’actine. En effet, la Mical oxyde sélectivement deux méthionines parmi les 16 présentes dans l’actine qui sont réduites réversiblement par la MsrB1 [94]. Plusieurs autres rôles biologiques ont été proposés incluant sa nécessité dans la viabilité des cellules du cristallin [95], son effet protecteur contre la neurodégénérescence [91] et son effet contre le vieillissement [96].
4.3.6 La sélénoprotéine N (SelN)
Il s’agit d’une protéine transmembranaire localisée dans la membrane du réticulum endoplasmique [97] et codée par le gène SEPN1, dont la mutation a été associée à plusieurs maladies musculaires [98]. Son expression est majoritaire dans les cellules fœtales et
17 diminue graduellement au fur et à mesure que les tissus deviennent matures incluant essentiellement le muscle squelettique [97]. La SelN est essentielle au développement et la différenciation du muscle squelettique [99]. Elle joue aussi un rôle important dans la régénération des fibres musculaires, suite à une blessure ou un stress, par le maintien d’un équilibre entre l’état de quiescence et la prolifération des cellules satellites responsables de l’action régénératrice [100].
Récemment, la SelN a été impliquée dans la régulation de la mobilisation intracellulaire du calcium (Ca++) par sa liaison au récepteur ryanodine (RyR), responsable de la libération du Ca++ du réticulum sarcoplasmique lors de la contraction musculaire [101]. De plus, cette sélénoprotéine semble jouer un rôle important dans le maintien du statut redox et la protection des cellules contre le stress oxydatif [102].
4.3.7 La sélénoprotéine O (SelO)
La SelO est l’une des sélénoprotéines les moins caractérisées, malgré le fait qu’elle ait été identifiée plusieurs années auparavant [20] . Cependant une récente étude a levé le voile sur cette protéine en démontrant qu’il s’agissait d’une sélénoprotéine de localisation mitochondriale impliquée dans l’activité redox qui s’y produit. Cette étude a révélé aussi que la SelO est essentielle et que sa présence est affectée par le déficit en sélénium [103].
4.3.8 La sélénoprotéine I (SelI)
C’est une sélénoprotéine transmembranaire, retrouvée dans plusieurs tissus, renfermant un domaine CDP-alcool phosphotransférase similaire à celui retrouvé dans la choline phosphotransférase (CHPT) et la choline/éthanolamine phosphotransférase (CEPT) [20] [104]. La SelI diffère des CHPT et CEPT par l’existence d’un résidu Sec dans sa terminaison COOH. La fonction de son résidu Sec demeure encore inconnue, cependant une étude sur l’E. coli a démontré que ce dernier possède une activité éthalonamine transférase [104].
4.3.9 La sélénoprotéine W (SelW)
La SelW est une petite sélénoprotéine de 9 kDa localisée dans le cytosol et fortement exprimée au niveau des muscles et du cerveau [105, 106]. Elle peut se lier au glutathion (GSH) [107] et possède une activité antioxydante démontrée in vitro [108] et in vivo [109] suggérant un rôle important dans la lutte contre le stress oxydatif dans les cellules musculaires et neuronales. Cette sélénoprotéine a été récemment impliquée dans la régulation de la protéine 14-3-3, une protéine très abondante dans les voies de signalisation cellulaire, en favorisant sa dissociation de ses partenaires, à savoir les protéines CDC25B et Rictor, d’une manière réductive [110, 111].
4.3.10 La sélénoprotéine H (SelH)
La SelH est une sélénoprotéine nucléaire fortement exprimée au cours du développement embryonnaire [112]. Cette sélénoprotéine se lie à l’ADN et se trouve être impliquée dans la détoxification cellulaire des espèces réactives de l’oxygène en régulant l’expression des gènes responsables de la synthèse du glutathion [113]. Récemment, la SelH a été identifiée comme une sélénoprotéine protectrice de la senescence cellulaire en réponse au stress oxydatif en maintenant l’intégrité du génome à travers la voie de signalisation impliquant les protéines ATM et p35 [114].
4.3.11 La sélénoprotéine M (SelM)
La SelM est majoritairement exprimée dans le cerveau et localisée spécifiquement dans le réticulum endoplasmique [115]. Sa structure comportant un motif de type CysXXSec au sein d’un repliement de type thiorédoxine lui suggère une activité d’oxydoréduction des ponts disulfures des protéines [116]. Les études réalisées pour démystifier le rôle de cette sélénoprotéine ont démontré que la SelM est impliquée dans la protection des neurones contre les stress oxydatif et qu’elle participe à la mobilisation du Ca++ cytoplasmique [117]. De plus, la SelM interagit avec la galectine1 (Gal-1) laquelle est impliquée dans la prévention de la neurodégénérescence et le la protection du cerveau [118]. La surexpression
19 de cette sélénoprotéine a induit l’inhibition de l’agrégation du peptide β-amyloïde lui suggérant un rôle préventif contre la maladie d’Alzheimer [119]. Il demeure clair que la SelM joue un rôle important dans le cerveau, cependant les mécanismes par lesquels elle exerce ses fonctions sont loin d’être identifiés.
4.3.12 La sélénoprotéine de 15KDa (Sep15)
Cette sélénoprotéine appartient à la même famille que la SelM partageant toutes les deux 31% d’homologie de séquence [120]. La Sep15 est localisée au niveau du réticulum endoplasmique avec des niveaux d’expression élevés dans les reins, le foie, la prostate et les testicules [121]. Similaire à la SelM, sa structure lui suggère des fonctions d’oxydoréduction des protéines [116]. Dans le réticulum endoplasmique, la Sep15 forme un complexe avec l’UDP-glucoseglycoprotéine glucosyltransférase (UGGT) dont l’action consiste à empêcher la sortie des glycoprotéines mal repliées du réticulum endoplasmique et les rediriger vers des voies de dégradation [122]. De plus, la Sep15 est impliquée dans le contrôle de qualité du repliement des protéines en régulant le cycle de la calnexin (CNX), une protéine nécessaire à ce processus [123]. Enfin, une étude récente sur des souris Knock-out a associé le déficit de la Sep15 avec la formation de cataractes par défaut de repliement des protéines du cristallin [124].
4.3.13 Les sélénoprotéines K et S (SelK, SelS)
Ces deux sélénoprotéines ne partagent aucune homologie de séquence mais, par leur topologie et leurs fonctions, elles peuvent être regroupées dans une seule famille. En effet les deux sont des sélénoprotéines transmembranaires présentes dans le réticulum endoplasmique [20] et sont impliquées dans la voie de dégradation des protéines mal repliées par la machinerie ERAD (pour Endoplasmic-Reticulum-Associated protein Degradation) [125].
4.3.14 La sélénoprotéine T (SelT)
La SelT est exprimée dans différents tissus embryonnaires et adultes avec une localisation au niveau du réticulum endoplasmique et l’appareil de Golgi [126]. La SelT est impliquée dans la mobilisation du Ca++ au niveau des cellules neuronales stimulée par le neuropeptide PACAP [127]. Récemment, la SelT a été impliquée dans la régulation de la fonction des cellules β et le maintien de l’homéostasie glucidique.
4.3.15 La sélénoprotéine V (SelV)
Exprimé essentiellement dans les testicules, la SelV possède la même structure que la SelW et la SelH [20, 126]. On ne connait pas de rôles biologiques associés à cette sélénoprotéine mais sa présence dans l’organe où a lieu la spermatogenèse souligne davantage le rôle du sélénium dans ce processus.
4.3.16 La sélénophosphate synthétase 2 (SPS2)
Son rôle dans la synthèse des sélénoprotéines a été évoqué dans la section 4 [30].
5 Toxicocinétique du sélénium
5.1 Absorption
L’absorption du sélénium dans l’organisme humain se produit au niveau de l’intestin avec une efficacité variable, dépendante de la forme ingérée et de la présence ou non des aliments. En effet, l’absorption du sélénium augmente en présence des protéines, de la vitamine E et A et diminue en présence des sulfates, de l’arsénique, du mercure et de la vitamine C [128].
L’efficacité de l’absorption du sélénium, toutes formes confondues, est supérieure à 80%. Toutefois, les formes organiques sont mieux absorbées que celles inorganiques. La
21 sélénométhionine est la forme la mieux absorbée par l’intestin avec une efficacité d’absorption de 90%. Cette dernière l’est par un mécanisme actif similaire à celui de la méthionine. L’absorption de la sélénocystéine quant à elle n’est toujours pas claire avec des évidences que le mécanisme n’est pas actif [17].
En ce qui concerne les formes inorganiques, les séléniates sont mieux absorbés que les sélénites avec une efficacité d’absorption moyenne de 60% [129]. En effet, le séléniate est absorbé par un mécanisme de transport actif similaire à celui des sulfates alors que le sélénite est absorbé par simple diffusion passive [17].
5.2 Distribution
Après absorption intestinale, le sélénium rejoint la circulation sanguine pour être distribué vers différents organes. Chez les individus dont l’apport en sélénium est adéquat, le sélénium est réparti comme suit : 30% dans le foie, 15% dans les reins, 10% dans le plasma et 30% dans les muscles avec une prédominance au niveau du muscle cardiaque. Dans les conditions où l’apport en sélénium est faible, l’accumulation du sélénium diminue dans tous les organes à l’exception des reins ou a lieu la synthèse de la GPx3. Cette diminution a pour but de favoriser sa distribution vers les organes nobles comme le cerveau [13, 17].
Dans le sang, la majeure partie du sélénium est retenue dans les globules rouges alors que dans le plasma il est essentiellement transporté par la SelP (à plus de 50%). Le reste du sélénium plasmatique est partagé entre la GPx3 et la SeAlb [17][64].
5.3 Biotransformation
Le séléniure d’hydrogène (H2Se) constitue le métabolite intermédiaire central autour duquel différentes voies de transformation de sélénium ont lieu (figure 8). Le sélénite et le séléniate sont transformés en H2Se par le système glutarédoxine (Grx, Grxr et GSH) et/ou le système thiorédoxine (TrxR et Trx) [130]. Le séléniate est aussi réduit en sélénite par la voie de réduction des sulfates mais le mécanisme sous-jacent n’est toujours pas clair [131].
Les formes organiques issues de l’alimentation subissent aussi plusieurs biotransformations. La sélénométhionine est soit incorporée non spécifiquement dans des protéines [36] ou soit transformée en sélénocystéine par la cystathionine β-synthase et γ-lyase [132]. La sélénocystéine provenant de l’alimentation ou de la conversion de la sélénométhionine est transformée en H2Se par l’action de la sélénocystéine β-lyase [133]. La méthyl-sélénocystéine est convertie en méthyl-sélénol par la γ-lyase qui sera par la suite transformée en H2Se [134].
Le H2Se ainsi formé est converti en sélénophosphate pour assurer la synthèse des 25 sélénoprotéines codées par le génome [135]. Il peut aussi être métabolisé en séléno-sucres via la glutathio-sélénol (GSSeH) [136] ou subir une méthylation avant d’être excrété [137].
23
5.4 Élimination
L’élimination du sélénium est essentiellement rénale chez les individus dont l’apport en sélénium est normal. Le triméthylsélénium (TMSE) et les séléno-sucres à savoir le méthyl 2-acétamido-2-déoxy-1-séléno-β-D-galactose/-glucosamine (SeGalNAc et SeGluNAc respectivement) représentent les composés majeurs excrétés. À des doses toxiques, le sélénium est aussi éliminé sous forme de TMSE par exhalation. Des formes non métabolisées de séléniate et sélénite sont aussi retrouvées dans les urines [13].
6 Sélénium et santé
6.1 Les maladies cardiovasculaires
L’association de certaines maladies cardiovasculaires aux polymorphismes génétiques des gènes codants pour les sélénoprotéines GPx1, GPx3 et SelS suppose que le sélénium pourrait avoir un effet bénéfique dans la prévention des maladies cardiovasculaires [138-141]. Cependant, les essais cliniques de supplémentation en sélénium n’ont permis de déceler aucun effet protecteur [142, 143]. De plus, l’étude sur les éléments traces CARDIA, réalisée auprès de 3112 jeunes adultes Américains, portant sur l’association de la teneur en sélénium des ongles et l’athérosclérose, était aussi non concluante [144].
Flores-Mateo et ses collaborateurs ont réalisé une méta-analyse comportant 25 études observationnelles et 6 essais randomisés de supplémentation en sélénium, provenant de plusieurs pays de l’Europe, la Chine, les États-Unis et l’Australie. Ils ont pu mettre en évidence une association significative inverse entre le statut en sélénium, mesuré dans le sang et/ou dans les ongles, et le risque de maladies coronariennes. Cependant, l’auteur conclut que ces résultats doivent être validés du fait de la nature observationnelle des études utilisées [145].
L’association entre le sélénium et les maladies lipidiques est aussi complexe. Une supplémentation de sélénium entre 100 et 200 µg par jour chez une population ayant un
statut en sélénium bas s’est avérée bénéfique, en diminuant considérablement le taux du cholestérol total. Toutefois, dans cette même étude le statut élevé en sélénium et/ou la supplémentation de plus de 300 µg par jour étaient associés à une augmentation du taux de cholestérol total [146].
Les différences observées dans ces études sont probablement liées au statut en sélénium des populations étudiées. Les effets bénéfiques du sélénium ont été observés dans les études où le statut en sélénium des participants était bas. En outre, l’optimisation du sélénium au départ des études est aussi un facteur pouvant annuler l’effet bénéfique de la supplémentation en sélénium sur les maladies cardiovasculaires et lipidiques [8].
6.2 Le diabète de type 2
Les résultats des différentes études et essais cliniques visant à déterminer les effets du sélénium sur le diabète divergent. Dans l’étude prospective EVA réalisée en France, le statut élevé de sélénium chez les hommes (entre 94 et 155 µg/L) était associé à une diminution du risque d’hyperglycémie [147]. De même, aux États-Unis, dans une récente étude prospective sur deux cohortes de sexe différent incluant 3630 femmes et 3535 hommes, le taux de sélénium dans les ongles était inversement associé au risque de diabète de type 2 [148]. À l’opposé, deux autres grandes études transversales réalisées aux États-Unis ont montré que le sélénium était associé à une augmentation de la prévalence du diabète [149, 150].
Les résultats de supplémentation en sélénium étaient aussi controversés. Certaines d’entre elles n’ont trouvé aucune association [151, 152] alors que d’autres révèlent une augmentation du risque de diabète du type 2 en relation avec l’apport en sélénium [153, 154].
L’explication de la non-concordance de tous ces résultats peut être attribuée à des différences du statut en sélénium entre les populations et par conséquent à l’activité de certaines espèces de sélénoprotéines, incluant la GPx1, la DIO2 et la SelP [155].
25
6.3 Le système immunitaire
Le sélénium se révèle bénéfique au système immunitaire. En effet, la supplémentation en sélénium à raison de 400 µg par jour chez des personnes âgées a fait augmenter le nombre de lymphocytes T de 27% par rapport au placebo [156]. Chez d’autres personnes supplémentées, le sélénium était responsable de l’augmentation de l’immunité à médiation cellulaire [157] et de la réponse immunitaire à une stimulation antigénique [158]. Le sélénium semble jouer un rôle important dans la régulation de l’expression des cytokines et la prolifération des lymphocytes T activés [159].
6.4 Les maladies infectieuses virales
Le sélénium joue un rôle important dans la lutte contre les maladies virales [159]. Le déficit en sélénium a été associé à une diminution de la survie des enfants infectés par le VIH [160] et une augmentation de la virulence et de la propagation d’autres infections virales [161, 162]. Les essais cliniques randomisés ont démontré aussi des effets bénéfiques de la supplémentation en sélénium chez des sujets VIH-positifs [163, 164].
6.5 Le cancer
De nombreuses études prospectives ont démontré que le sélénium diminue le risque de plusieurs cancers. Cet effet bénéfique est d’autant plus observé chez les populations dont le statut en sélénium est faible [8].
Le sélénium semble diminuer le risque de cancer de prostate dans plusieurs études et essais cliniques [165-167]. De plus, l’essai clinique «The Nutritional Prevention of Cancer» (NPC), regroupant 1312 personnes ayant reçu une supplémentation quotidienne de 200 µg de sélénium a révélé une diminution de l’incidence du cancer de la prostate de 67%. Cette observation était confinée au groupe de participants dont le statut en sélénium au début de l’étude était inférieur à 106 µg/L [168]. Cependant, l’essai clinique SELECT regroupant 35 533 Américains n’a pas pu reproduire les résultats de l’étude NPC avec la même dose de
sélénium par jour, pour une même durée de traitement [154]. Cette différence peut être expliquée par le fait que la forme de sélénium était différente entre les deux études et surtout le statut en sélénium des participants au début de l’étude SELECT qui était supérieur à 106 µg/L [8].
Le sélénium pourrait aussi avoir un effet protecteur contre le cancer du poumon. En effet, une méta-analyse regroupant 16 études cliniques [169] a révélé que le risque relatif (RR) de développer un cancer de poumon chez les individus ayant un statut en sélénium plasmatique élevé était de 0.74 (intervalle de confiance à 95% [0.57-0.97]). De plus, le RR était nettement plus bas, RR=0.46 (intervalle de confiance à 95% [0.24-0.87]), lorsque le sélénium était mesuré dans les ongles.
L’effet du sélénium sur le cancer de la vessie a fait l’objet d’une méta-analyse en 2010 qui a conclu qu’un apport élevé en sélénium est associé à une diminution du risque de cancer de vessie [170].
Toutefois, ces évidences sont à l’opposé de ce qui été observé dans plusieurs études où le statut ou l’apport en Se élevé était souvent non protecteur voire même augmente le risque de certains cancers [154, 168].
7 Interaction entre le sélénium et le méthylmercure (Se-MeHg)
L’effet protecteur du sélénium contre la toxicité du mercure fut rapporté pour la première fois en 1967 par Parizek et Ostadalova qui ont observé une diminution considérable de la toxicité liée au mercure inorganique (Hgin) suite à l’administration simultanée du Hg2+ et du sélénium sous forme de sélénite chez les rats [171]. Suite à cette découverte, les études visant à déterminer les effets du sélénium sur le mercure et les mécanismes d’interaction entre eux se sont accentuées.
Le méthylmercure (MeHg) avec sa capacité à traverser la barrière hémato-encéphalique [172, 173] et placentaire [174] et son absorption gastro-intestinale voisine de 100% [175]
27 constitue la forme la plus toxique pour l’humain et suscite le plus grand intérêt des chercheurs. En 1972, Ganther et al ont publié le premier rapport mettant en évidence une interaction entre le Se et le MeHg. En effet, les animaux nourris avec une diète riche en MeHg et en Se ont présenté une diminution des signes de toxicité et ont vécu plus longtemps que ceux nourris avec une diète riche en MeHg seulement [176]. Suite à ces observations, plusieurs autres études se sont succédées chez différentes espèces animales confirmant l’effet antagoniste que peut avoir le Se sur le MeHg.
L’interaction entre le MeHg et le Se a fait l’objet de plusieurs revues de littérature, dont les plus récentes publications sont celles de Khan et al (2009) [177] et Yang et al (2008) [178]. Le sélénium peut exercer un effet antagoniste sur le mercure par plusieurs mécanismes qui sont présentés ci-dessous.
7.1 Diminution de la toxicité par formation de composés MeHg-Se(H)
Le MeHg présente une grande affinité pour les groupements thiols (SH) qui sont très abondants dans les biomolécules. Cette affinité conduit à la formation de complexes MeHg-S-R avec une constante de formation allant de 1015 à 1017 [179]. La liaison entre le MeHg et le groupement SH, malgré sa force, est instable dans les fluides biologiques et le MeHg peut être déplacé par un autre ligand. Cette instabilité conduit à la formation de complexes méthylmercure sélénol (MeHg-SeH), par un échange de ligand entre les deux groupements sélénol et thiol, dont la constante de formation est beaucoup plus grande que celle du complexe MeHg-SH [180].
La formation de composés MeHg-Se-R entraîne une diminution de la biodisponibilité du mercure et joue un rôle primordial dans la détoxification de celui-ci. En 1979, Magos et coll. ont démontré qu’en incubant des érythrocytes de rat avec du chlorure de méthyl-mercure (MeHgCl) et du sélénite de sodium (Na2SeO3), un composé MeHg-Se extractible dans le benzène apparaissait [181]. Ce composé a été ultérieurement identifié comme étant le séléniure bis(méthyl-mercure) [182]. Plusieurs autres composés MeHg-Se ont été
proposés ou synthétisés par la suite mais aucun d’entre eux n’a été retrouvé dans les organismes vivants [177].
7.2 Le sélénium joue un rôle dans la biotransformation du MeHg
Les mammifères marins présentent de faibles concentrations de MeHg dans le foie et les reins, malgré le fait que l’espèce dominante de mercure dans les muscles des poissons qu’ils consomment soit le MeHg [183, 184]. En effet, le MeHg subit une biotransformation par déméthylation produisant ainsi du mercure inorganique qui va s’accumuler dans ces organes [185-187].
Le ratio molaire Hg:Se voisin de 1 observé dans le foie de plusieurs espèces de poissons [183, 184, 188] a soulevé depuis longtemps le questionnement des chercheurs quant à l’effet protecteur du sélénium contre la toxicité du mercure. L’hypothèse que le Se puisse être directement impliqué dans la déméthylation du MeHg a été proposée par Martoja et Berry en 1980 suite à la découverte de granules de tiemannite (HgSe) dans le foie des dauphins de Cuvier [189, 190]. Ces chercheurs ont supposé que le Se est directement lié à la déméthylation du MeHg et que les granules de HgSe seraient le produit final de cette dégradation. Ils ont aussi suggéré que ce processus est prévu dans les espèces ou le Se et l’Hg coexistent d’une façon équimolaire. Cette hypothèse a été soutenue par Nigro et Leonzio qui ont identifié le même type de granules dans différentes espèces de mammifères marins. Ils ont démontré aussi que ces granules sont principalement localisées dans le cytoplasme des macrophages [190]. Une récente étude publiée en juillet 2012 a révélé, chez les dauphins de Guyane, l’existence de cristaux accumulés dans les cellules de Kupffer qui seraient probablement des granules HgSe [191]. Palmisano et ces collaborateurs ont rapporté la présence de Hg lié à des protéines dans le foie des dauphins [192]. En effet, les granules de HgSe peuvent former des polymères et se lier à une protéine qui semble être la sélénoprotéine P [193]. Le mécanisme responsable de la déméthylation du mercure est encore non élucidé. Il semblerait qu’un seuil de MeHg doive être atteint pour que le processus de formation de granules HgSe se déclenche [192].
29 En résumé, le rôle exact du Se dans la biotransformation du MeHg est loin d’être claire mais son implication, dans la formation de HgSe, est confirmée chez plusieurs espèces de mammifères marins. Il reste à savoir si un tel mécanisme de détoxication pourrait exister chez l’humain.
7.3 Le sélénium inhibe le produit de la dissociation du MeHg
Ganther et ces collaborateurs ont émis l’hypothèse que la toxicité du MeHg n’est pas induite seulement par la molécule intacte et que les radicaux méthyl libres formés par une rupture homolytique de la molécule pourraient être incriminés [194]. Si cette hypothèse s’avère vraie, la glutathion peroxydase (GPx) pourrait contrecarrer l’effet que peuvent induire ces radicaux.
8 Population d’étude
8.1 Les Inuits du Nunavik
Le Nunavik représente la partie arctique du Québec, situé au nord de la 55ème parallèle (Figure 9). Environ 11 000 Inuits y résident dans les 14 communautés qui longent les 2000 km de côtes de l’ouest de la Baie d’Hudson, du détroit d’Hudson et de la Baie d’Ungava. La population inuit du Nunavik est la plus jeune de toutes les populations inuites du Canada avec 37% d’enfants âgés de 0-14 ans et 58% pour le groupe d’âge de 0-24 ans (voir tableau 2) [196].
Groupes d'âge et médiane Nunavik (%) Total - Groupes d'âge 100,0
0 à 24 ans 58,4 0 à 14 ans 37,0 0 à 4 ans 13,1 5 à 9 ans 12,4 10 à 14 ans 11,5 15 à 24 ans 21,4 25 à 64 ans 39,0 65 ans et plus 2,7
Âge médian (années) 21
Tableau 2 : Répartition selon le groupe d'âge et âge médian des Inuits du Nunavik (année
2011) [197].
8.2 Alimentation traditionnelle des Inuits du Nunavik
Les Inuits perçoivent la nourriture traditionnelle comme une composante essentielle pour la santé et le bien-être. Elle représente une partie de l’identité et des valeurs de ce peuple autochtone. Le terme de «nourriture traditionnelle » fait référence à tous les aliments récoltés dans l’environnement local. Il englobe plusieurs variétés et espèces incluant les poissons, le caribou, les oiseaux, le phoque, les baleines, les plantes et les petites baies [198].
Cette alimentation traditionnelle dont le savoir est transmis d’une génération à l’autre est très bénéfique pour la santé par sa richesse en protéines, vitamines et minéraux. De plus, les mammifères marins, consommés en grande quantité, sont riches en sélénium et en acides gras polyinsaturés (oméga-3), lesquels sont essentiels à l’activité métabolique de
31 l’organisme [199]. Toutefois, par cette même alimentation, les Inuits sont exposés à certains contaminants environnementaux qui ne cessent d’augmenter dans l’Arctique [200]. Parmi ceux ci, le méthylmercure (MeHg) est l’élément le plus préoccupant car il est fortement bioaccumulé dans les mammifères marins. Ce dernier a été associé aux accouchements prématurés et retards de croissance fœtale lorsque les parents Inuits sont exposés [201]. De plus, l’exposition des parents Inuits au MeHg est associée au trouble de déficit de l'attention avec hyperactivité (TDAH) observé chez les enfants d’âge scolaire [202, 203].
La présence d’éléments comme le sélénium et les oméga-3 peuvent contrer les effets néfastes du MeHg. Plusieurs études ont démontré que ces deux éléments sont bénéfiques pour la santé. Chez les Inuits du Nunavik, les oméga-3 ont été associés à une augmentation de poids à la naissance, une amélioration de la fonction de mémoire chez les enfants d’âge scolaire et à une diminution de la prévalence des facteurs de risque cardiovasculaire chez les adultes [204-207].
En ce qui concerne le sélénium, les évidences sont de plus en plus fortes en faveur d’une action antagoniste contre le MeHg chez cette même population [208, 209]. Toutefois, des doutes subsistent en ce qui concerne l’innocuité des apports élevés en sélénium observés chez cette population.
8.3 Recrutement et échantillonnage
Notre étude se situe en marge de l’Enquête de santé auprès des Inuits du Nunavik 2004 - Qanuippitaa? How are we? visant à vérifier l’évolution de l’état de santé de la population Inuit du Nunavik. La méthode de recrutement aléatoire stratifiée en deux étapes était utilisée pour maximiser le nombre de participants et avoir un échantillon le plus représentatif de la population. Au terme de ce recrutement, 889 participants âgés de 18 à 74 ans ont été accueillis au bord du bateau de recherche Amundsen où l’équipe de recherche a procédé aux prélèvements sanguins et à l’enregistrement des différents paramètres anthropométriques et cliniques (pression, pouls, température et indice de masse corporelle).
![Figure 1 : Cycle biogéochimique du sélénium [9, 18].](https://thumb-eu.123doks.com/thumbv2/123doknet/6613053.179881/25.918.140.789.506.978/figure-cycle-biogéochimique-du-sélénium.webp)
![Figure 3 : Les étapes de biosynthèse de la Sec-ARNt (Ser)Sec (A) et le mécanisme d’insertion de la sélénocystéine dans les sélénoprotéines (B) chez les eucaryotes [24]](https://thumb-eu.123doks.com/thumbv2/123doknet/6613053.179881/27.918.161.804.668.982/figure-étapes-biosynthèse-mécanisme-insertion-sélénocystéine-sélénoprotéines-eucaryotes.webp)
![Figure 6 : Mécanisme d’action des GPx selon Papp et al [54].](https://thumb-eu.123doks.com/thumbv2/123doknet/6613053.179881/32.918.226.649.418.644/figure-mécanisme-action-gpx-papp-al.webp)
![Figure 7 : Mécanisme d’action du système TRx selon Lu et al [90].](https://thumb-eu.123doks.com/thumbv2/123doknet/6613053.179881/36.918.232.665.103.289/figure-mécanisme-action-système-trx-lu-al.webp)
![Figure 8 : La biotransformation du sélénium selon Alexander et al [13].](https://thumb-eu.123doks.com/thumbv2/123doknet/6613053.179881/42.918.134.736.542.936/figure-biotransformation-sélénium-alexander-al.webp)
![Figure 9 : Carte géographique du Nunavik [195].](https://thumb-eu.123doks.com/thumbv2/123doknet/6613053.179881/49.918.153.808.651.977/figure-carte-géographique-nunavik.webp)
![Tableau 2 : Répartition selon le groupe d'âge et âge médian des Inuits du Nunavik (année 2011) [197]](https://thumb-eu.123doks.com/thumbv2/123doknet/6613053.179881/50.918.107.454.325.592/tableau-répartition-groupe-âge-médian-inuits-nunavik-année.webp)