CHARLEEN SALESSE
PROPRIÉTÉS BIOPHYSIQUES ET RÉGULATION
FONCTIONNELLE DES SYNAPSES INHIBITRICES
SUR LES INTERNEURONES DE L’HIPPOCAMPE
Mémoire présenté
à la Faculté des études supérieures de l‟Université Laval dans le cadre du programme de maîtrise en Biochimie
pour l‟obtention du grade de Maître (MSc)
DÉPARTEMENT DE BIOCHIMIE, DE MICROBIOLOGIE ET DE BIO-INFORMATIQUE
FACULTÉ DES SCIENCES ET DE GÉNIE UNIVERSITÉ LAVAL
QUÉBEC
RÉSUMÉ
Les interneurones du stratum oriens/alveus (O/As), incluant ceux avec une projection axonale s‟étendant jusqu'au stratum lacunosum-moleculare (O-LMs) de l‟hippocampe reçoivent des projections inhibitrices locales, et possiblement une projection extrinsèque provenant du septum. Peu de choses sont connues sur les propriétés des synapses inhibitrices sur les O/As. La technique du « patch clamp » a été utilisée pour caractériser les courants inhibiteurs évoqués dans des O/As par stimulation de différentes voies inhibitrices. Les données montrent que les courants évoqués par stimulation des voies inhibitrices locales diffèrent de ceux du septum suggérant que des synapses formées par des voies distinctes sur les O/As se démarquent en propriétés et en plasticité synaptique. De plus, les courants enregistrés dans les O-LMs montrent différentes propriétés cinétiques et de plasticité dépendamment à l‟âge s‟expliquant par l‟incorporation synaptique de GABAARα5 lors de la maturation post-natale, qui peut représenter un mécanisme potentiel
iv
REMERCIEMENTS
Le travail présenté dans ce mémoire à été réalisé au Centre de Recherche Université Laval Robert Giffard, l‟unité de neurobiologie cellulaire, dirigé par la Dr Lisa Topolnik. Je tiens à adresser mes remerciements aux nombreuses personnes qui ont contribué à sa réalisation.
Je tiens particulièrement à remercier ma superviseure, Dr Lisa Topolnik pour m‟avoir encadrée, aidée, guidée, supervisée…Ce fut un privilège de travailler à ses côtés.
Je tiens aussi à remercier les membres de l‟équipe. Merci à Dimitry Topolnik pour son aide avec les reconstructions et les images. Merci à Simon Chamberland pour m‟avoir aidé dans plus d‟un domaine et de m‟avoir tenu compagnie. Merci à Marie-Andrée
Bellavance pour son aide lors de la rédaction. Merci à Tatyana Pokidchenko pour les résultats préliminaires.
Et merci à mon comité aviseur d‟avoir prit de leur précieux temps pour m‟encadrer lors de mes études gradués.
LISTE D‟ABRÉVIATIONS
o AMPc : Adénosine monophosphate cyclique o CA : champs ammoniques
o CAMKII : protéine kinase Ca2+
-calmoduline dépendante o CCK : cholecystokinine
o CPSI : courant postsynaptique inhibiteur o CV : coefficient de variation
o DG : gyrus denté
o DLT : dépression à long terme o GABA : acide γ-amino-butyrique
o GABAAR : récepteur du GABA de type A
o GABAAα5R : GABAAR contenant la sous-unité α5
o GABABR : récepteur du GABA de type B
o GABACR : récepteur du GABA de type C
o ISI : interneurone spécifique aux interneurones o mGluR : récepteur métabotropique du glutamate o L/M : lacunosum-moleculare
o O-LM : oriens – lacunosum-moleculare o O/A : oriens - alveus
o PKA : protéine kinase A
o PLT : potentialisation à long terme o PPD : dépression du « paired pulse » o PPR : ratio du « paired pulse » o PV : parvalbumine
o PYR : pyramidale o SH : septohippocampale o SPW : « sharp wave » o TBS : tampon Tris-sodium
o VGLUT3 : transporteur du glutamate type 3 O VIP : peptide vasoactif intestinal
vi TABLE DES MATIERES
RÉSUMÉ ... III REMERCIEMENTS ... IV LISTE D’ABRÉVIATIONS ... V LISTE DES FIGURES ET DES TABLEAUX ... VII
1 INTRODUCTION ... 1
1.1 ORGANISATION INTRINSÈQUE ET CONNEXIONS ANATOMO-FONCTIONNELLES DE L‟HIPPOCAMPE ... 1
1.2 ORGANISATION CELLULAIRE DE L‟HIPPOCAMPE ... 2
1.3 L‟INHIBITION DANS L‟HIPPOCAMPE ... 4
1.4 LA TRANSMISSION INHIBITRICE IONOTROPIQUE: MÉCANISMES ET RÉGULATION ... 6
1.4.1 Le récepteur GABAA (GABAAR) ... 6
1.4.2 La plasticité aux synapses inhibitrices ... 9
1.5 HYPOTHÈSE ... 10
1.6 OBJECTIFS SPÉCIFIQUES... 11
1.7 IMPORTANCE DES TRAVAUX ... 12
2 MATÉRIEL ET MÉTHODES ... 13
2.1 PRÉPARATION DES TRANCHES ... 13
2.2 ENREGISTREMENT ET ANALYSE DES CPSIS. ... 13
2.3 ANALYSE DES DONNÉES ... 15
2.4 IMMUNOHISTOCHIMIE ... 15
3 RÉSULTATS ... 17
3.1 PROPRIÉTÉS DES SYNAPSES INHIBITRICES DES INTERNEURONES DU O/A ... 17
3.2 PLASTICITÉ À LONG TERME AUX SYNAPSES INHIBITRICES SUR LES INTERNEURONES DU O/A. ... 22
3.3 PROPRIÉTÉS CINÉTIQUES DES CPSIS DANS DES INTERNEURONES O-LM ... 27
3.4 RÔLE DE LA SOUS-UNITÉ Α5 DU GABAAR DANS LA TRANSMISSION INHIBITRICE SUR LES O-LMS ... 29
3.5 LA PLASTICITÉ À LONG TERME DE SYNAPSES INHIBITRICES DANS LES O-LMS ... 34
4 DISCUSSION ... 37
4.1. PROPRIÉTÉS DES SYNAPSES INHIBITRICES DÉPENDAMMENT DE L‟AFFÉRENCE ... 37
4.2. PROPRIÉTÉS DES SYNAPSES INHIBITRICES LORS DE LA MATURATION POST-NATALE ... 41
5 CONCLUSION ... 44
6 RÉFÉRENCES ... 45
7 ANNEXE 1 : ARTICLE : SYNAPSE-SPECIFIC INHIBITORY CONTROL OF HIPPOCAMPAL FEEDBACK INHIBITORY CIRCUIT ... 56
8 ANNEXE 2 : ARTICLE : THE ALPHA 5 GABAA RECEPTOR SUBUNIT CONTROLS THE DEVELOPMENTAL SWITCH IN THE DYNAMICS OF GABAERGIC TRANSMISSION ONTO HIPPOCAMPAL CA1 ORIENS–LACUNOSUM MOLECULARE INTERNEURONS ... 88
LISTE DES FIGURES ET DES TABLEAUX
FIGURE 1 : ORGANISATION ANATOMIQUE DE L’HIPPOCAMPE ... 1
FIGURE 2 : SECTION CORONALE DE L’HIPPOCAMPE ... 2
FIGURE 3 : DIFFÉRENTS TYPES CELLULAIRES DANS LA RÉGION CA1 DE L’HIPPOCAMPE ... 3
FIGURE 4: REPRÉSENTATION SCHÉMATIQUE DU RÉCEPTEUR GABAA ... 7
FIGURE 5 : REPRÉSENTATION SCHÉMATIQUE DE LA POSITION DES CELLULES PYRAMIDALES, ISIS-III ET DES INTERNEURONES O-LM DANS LE CIRCUIT DE LA RÉGION CA1 DE L’HIPPOCAMPE ... 11
FIGURE 6 : PROPRIÉTÉS DES SYNAPSES INHIBITRICES SUR DES INS DU O/A. ... 18
FIGURE 7 : DYNAMIQUES DISTINCTES DE L’INHIBITION AUX SYNAPSES ISI-O/A ET SH-O/A ... 21
FIGURE 8 : ABSENCE DE PLASTICITÉ À LONG TERME AUX SYNAPSES ISI-O/A ... 23
FIGURE 9 : DIFFÉRENTS TYPES CELLULAIRES ENREGISTRÉS AU STRATUM ORIENS/ALVEUS ... 25
FIGURE 10 : PLASTICITÉ À LONG TERME AUX SYNAPSES SH-O/A ... 26
FIGURE 11 : PROPRIÉTÉS CINÉTIQUES DE CPSIS DANS DES INTERNEURONES O-LM ... 28
FIGURE 12 : EFFET DU L-655,708 SUR LES CPSIS DES INTERNEURONES O-LM. ... 32
FIGURE 13 : PROPRIÉTÉS CINÉTIQUES DES CPSIS DES INTERNEURONES O-LM DES SOURIS GABRA5-/-. ... 33
FIGURE 14 : PLASTICITÉ SYNAPTIQUE À LONG TERME DANS LES SYNAPSES INHIBITRICES SUR LES INTERNEURONES O-LM SUITE À UNE STIMULATION DE 10-HZ ... 35
FIGURE 15 : IMPLICATION DE LA SOUS-UNITÉ Α5 DU RÉCEPTEUR GABAA DANS LA PLASTICITÉ À LONG TERME DANS LES SYNAPSES INHIBITRICES SUR LES INTERNEURONES O-LM ... 36
1
1 INTRODUCTION
1.1 Organisation intrinsèque et connexions anatomo-fonctionnelles de l‟hippocampe
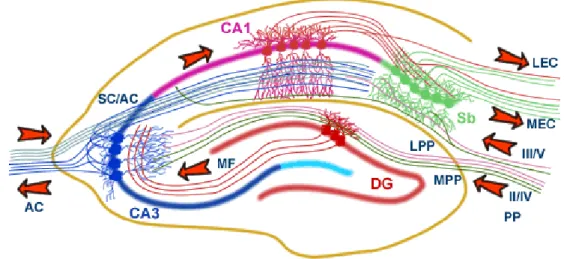
L‟hippocampe est une structure corticale ancienne (archicortex) impliquée dans l‟apprentissage, la mémoire et est affecté dans des désordres neurologiques tels que la maladie d‟Alzheimer, l‟épilepsie et la schizophrénie. L‟hippocampe est constitué de trois subdivision des champs ammoniques (cornu ammonis : CA1, CA2, CA3; Figure 1) formés par des cellules pyramidales (Lorente de Nó, 1934, Andersen et al, 2007). Le gyrus denté (DG) (fascia dentata) formé par des cellules granulaires ainsi que le subiculum, le perisubiculum, le parasubiculum et le cortex entorhinal font aussi partie de la formation hippocampale.
Figure 1 : Organisation anatomique de l‟hippocampe
PP : voie perforante, MF : fibres moussues, SC : collatérales de Schaeffer, Sb : subiculum, LPP : voie perforante latérale, MPP : voie perforante médiale, LEC : cortex entorhinal latéral, MEC : cortex entorhinal médial, AC : voie commissurale associationnelle [Modifiée de MRC Centre for Synaptic Plasticity, (2003)]
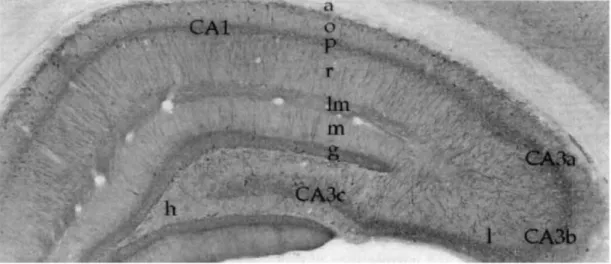
L‟une des caractéristiques majeures de l‟hippocampe réside dans la disposition régulière laminaire de ses cellules. Les éléments cellulaires de l‟hippocampe sont organisés en cinq couches parallèles (Figure 2): stratum lacunosum-moléculare (str. L/M), stratum
radiatum (str. RAD), stratum pyramidale (str. PYR), stratum oriens (str. O) et stratum alveus (str. A) (Andersen et al, 2007).
Figure 2 : Section coronale de l‟hippocampe
a, stratum alveus; o, stratum oriens; p, stratum pyramidale; r, stratum radiatum; lm,
stratum lacunosum-moleculare; m, stratum moleculare; g, stratum granulosum; h, hilius proper [Modifiée de (Freund et Buzsaki, 1996)]
L‟information est transmise à l‟hippocampe à partir du cortex entorhinal. La première jonction synaptique s‟effectue entre le cortex entorhinal et le DG par la voie perforante (Figure 1). La deuxième jonction synaptique se forme entre le DG et la région CA3 par des axones des cellules granulaires - des fibres moussues. Finalement, les axones des cellules pyramidales du CA3, nommés les collatéraux de Schaeffer, se projettent vers les cellules pyramidales du CA1 qui forment la voie de sortie de l‟hippocampe vers le cortex entorhinal (Andersen et al, 1971).
1.2 Organisation cellulaire de l‟hippocampe
Les neurones pyramidaux sont les cellules principales de l‟hippocampe. Ils se caractérisent par leur forme en triangle, leur arbre dendritique basal qui s‟étend jusqu‟au
3 str. O/A et leur arbre dendritique apical qui s‟étend jusqu‟au str. L/M et à la fissure de l‟hippocampe. Leur axone se projette à travers le str. oriens pour se rendre au str. alveus (Figure 3) (Amaral et al, 1991).
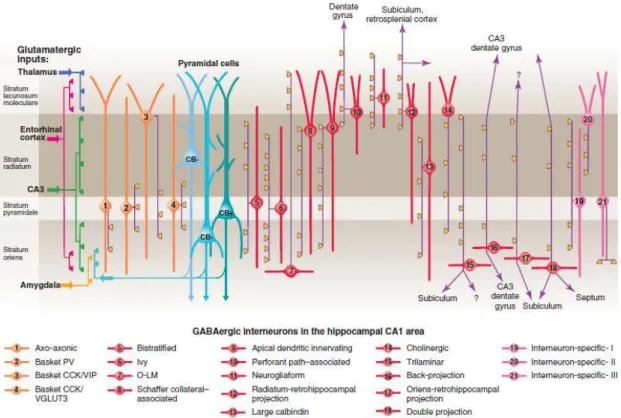
Figure 3 : Différents types cellulaires dans la région CA1 de l‟hippocampe
(PV, parvalbumine; CCK, cholecystokinine; VIP, peptide vasoactif intestinale; VGLUT3, transporteur du glutamate type 3. Modifiée de (Klausberger et Somogyi, 2008))
La régulation de l‟excitabilité des populations neuronales de l‟hippocampe dépend en grande partie du réseau d‟interneurones inhibiteurs de cette structure (Freund et Buzsaki,
1996). Les interneurones sont beaucoup plus hétérogènes que les neurones pyramidaux.
Selon leur structure anatomique (position du corps cellulaire et arborisation axonal), il est possible d‟observer : les cellules en panier, les cellules axo-axoniques, les cellules bistratifiées, les cellules LM, les cellules O-LM (se localisant dans le str. oriens avec une arborisation axonal s‟étendant dans le stratum lacunosum moleculare, Figure 3) et les cellules ISIs : interneurones spécifiques aux interneurones (Figure 3; (Klausberger et
Les interneurones sont aussi classifiés selon l‟expression de différentes protéines liant le calcium (tel que le parvalbumine, la calrétinine ou le calbindin) ou de neuropeptide (tel que le neuropeptide Y, la somatostatine, le peptide vasoactif intestinale (VIP) ou la cholecystokinine (CCK)) (Kosaka et al, 1985, Sloviter et Nilaver, 1987, Gulyas et al, 1991,
Rogers, 1992, Freund et Buzsaki, 1996). Finalement, ces cellules sont aussi classées par
leur rôle physiologique. Les interneurones peuvent soit pourvoir à l‟inhibition dendritique en envoyant leur axone au niveau des dendrites de la cellule cible, ou pourvoir à l‟inhibition périsomatique en innervant la région près du corps cellulaire. Ces cellules peuvent aussi inhiber les cellules cibles de manière directe (sans intermédiaire; feedforward) ou indirecte (rétro-inhibition; feedback) (Freund et Buzsaki, 1996).
1.3 L‟inhibition dans l‟hippocampe
Tous les interneurones de l‟hippocampe sont GABAergiques, c‟est-à-dire que l‟acide γ-amino-butyrique (GABA) y est synthétisé et est libéré dans ses synapses inhibitrices en tant que neurotransmetteur (Andersen et al, 2007). La concentration du GABA dans la fissure synaptique est de l‟ordre des millimoles (Mody et al, 1994) comparativement au nombre de récepteurs qui est de dix à quelques centaines (Edwards et al, 1990, Mody et al, 1994,
Nusser et al, 1997). Le GABA, principal neurotransmetteur inhibiteur du système nerveux
central, peut activer trois types de récepteurs postsynaptiques : GABAA, GABAB et
GABAC (Bormann, 2000). Les récepteurs GABAA et GABAC sont ionotropiques, car les
canaux ioniques qui leurs sont associés deviennent perméables au Cl- (HCO3- en plus faible
quantité) ce qui hyperpolarise la cellule (Bormann, 1988, Macdonald et Olsen, 1994,
Purves et al, 2004). Le récepteur GABAB, quant à lui, est métabotropique, car l‟inhibition
qu‟il procure est due à l‟activation des protéines G et des seconds messagers, se qui affecte des canaux K+ ou les canaux Ca2+ (Bormann, 1988, Bowery, 1989, Purves et al, 2004). Tandis que les récepteurs GABAA et GABAB sont omniprésents, le récepteur GABAC est
exprimé principalement dans la rétine de l‟œil (Feigenspan et al, 1993, Bormann, 2000). Il existe deux types d‟inhibition; l‟inhibition phasique et l‟inhibition tonique (Mody,
5 donc au niveau de la communication synaptique. La cinétique de cette inhibition va dépendre de la grosseur des vésicules et de leur contenu en GABA, de la nature de la fusion de vésicules, de la géométrie de la fissure synaptique, du nombre et de l‟arrangement spatial des transporteurs de GABA et du nombre de récepteurs postsynaptiques en relation au site de relâchement du neurotransmetteur. Le rôle principal de l‟inhibition phasique est de fournir une hyperpolarisation transitoire (de quelques millisecondes) à un neurone postsynaptique. Dans ce cas, le GABA extracellulaire peut activer les récepteurs péri- et extra-synaptiques. Cette forme d‟inhibition contribue grandement dans la génération des activités rythmiques (ex : oscillations du réseau de type thêta ou gamma) (Cobb et al, 1995,
Jonas et al, 2004, Somogyi et Klausberger, 2005) et peut subir des modifications dans le
temps (plasticité synaptique, voir plus bas).
L‟inhibition tonique, quant à elle, est un signal plus lent qui se produit à l‟extérieur des synapses. Les récepteurs sont très dispersés et peuvent se retrouver partout sur la cellule. Chez l‟embryon, ce type d‟inhibition se produit avant que les synapses aient le temps de se former (Valeyev et al, 1993, Owens et al, 1999). La concentration du GABA dans l‟espace extracellulaire n‟est pas seulement due à l‟activité et au nombre d‟élément que relâche le GABA mais aussi à l‟action des transporteurs du GABA. Ce type d‟inhibition réduit l‟excitabilité d‟une cellule, ce qui diminue la probabilité de produire un potentiel d‟action.
Tandis que la majorité des interneurones forment des synapses inhibitrices principalement sur les cellules pyramidales, les interneurones eux-mêmes sont aussi connectés les uns avec les autres par des synapses inhibitrices (Acsady et al, 1996b, Gulyas
et al, 1996). De plus, les projections inhibitrices extrinsèques provenant du septum se
terminent sur différents types d‟interneurones (Freund et Buzsaki, 1996, Toth et al, 1997). Il a été rapporté par des études antérieures que les courants postsynaptiques inhibiteurs dans les interneurones diffèrent de ceux enregistrés dans les cellules pyramidales par leurs propriétés cinétiques, leur coefficient de variation, leur relation courant-voltage et leur capacité de modification suite à une stimulation répétitive (Hajos et Mody, 1997,
inhibitrices formées par des voies inhibitrices distinctes sur différentes cibles neuronales, incluant les interneurones, restent largement inconnus.
Les propriétés cinétiques (ex : temps de monté, taux d‟affaiblissement) des courants postsynaptiques inhibiteurs (CPSIs) peuvent être déterminées par des éléments présynaptiques tels que le profil de concentration à travers le temps de GABA dans la fissure synaptique qui est influencé par le niveau de synchronisme de relâchement de GABA et de ses transporteurs (Overstreet et Westbrook, 2003, Hefft et Jonas, 2005, Keros
et Hablitz, 2005), ou par des éléments postsynaptiques tels que la présence périsynaptique
de récepteurs GABAA (Wei et al, 2003), la composition en sous-unité du récepteur GABAA
(Barberis et al, 2007) et l‟état de phosphorylation des sous-unités du GABAAR (Jones et
Westbrook, 1997, Houston et al, 2008). De plus, différentes concentrations de chlore
intracellulaire affectent aussi le taux d‟affaiblissement des CPSIs (Houston et al, 2009).
1.4 La transmission inhibitrice ionotropique: mécanismes et régulation 1.4.1 Le récepteur GABAA (GABAAR)
Le récepteur GABAA est le principal récepteur présent au niveau des synapses dans
l‟hippocampe. Il est membre de la famille des récepteurs-canaux ioniques. C‟est une glycoprotéine transmembranaire (pour sa structure schématique, voir Figure 4) qui résulte de l‟assemblage de 5 sous-unités (Sieghart, 1995). Il est sensible au muscimol (agoniste), à la bicuculline et à la picrotoxine (antagonistes). La fixation du GABA sur son site de reconnaissance provoque l‟ouverture d‟un canal perméable aux ions chlore (Cl
-), et aux ions bicarbonate (HCO3-) dans une plus faible mesure, produisant une hyperpolarisation ou
une dépolarisation (dépendamment de la différence de concentration des ions à l‟intérieur et à l‟extérieur de la cellule) de la membrane de la cellule cible.
7
Figure 4: Représentation schématique du récepteur GABAA
[Modifiée de (Mihic et Harris, 1997)].
Il existe plusieurs types de récepteurs GABAA, différents entre eux par leur
composition en sous-unités. On distingue actuellement 21 sous-unités : α1-6, β1-3, γ1-3, δ, ρ1-3, π, θ1-3, et ε (Macdonald et Olsen, 1994, Barnard et al, 1998, Mohler et al, 2002,
Sieghart et Sperk, 2002, Simon et al, 2004, Farrant et Nusser, 2005). Dans le cerveau, on
retrouve habituellement un assemblage α, β et γ à un ratio de 2 :2 :1 (Baumann et al, 2001,
Klausberger et al, 2001, Sieghart et Sperk, 2002). Dans la région CA1 de l‟hippocampe, les
différentes sous-unités du récepteur GABAA principalement présentes sont les suivantes :
α1, α2, α5, β1, β2, β3, et γ2 (Sperk et al, 1997, Pirker et al, 2000, Patenaude et al, 2001). Ceci entraîne non seulement une grande hétérogénéité de structure, mais aussi une hétérogénéité fonctionnelle et pharmacologique, dont les conséquences sont encore mal connues (Fritschy et Mohler, 1995, Hajos et Mody, 1997, Sperk et al, 1997, Hevers et
Luddens, 1998, Pirker et al, 2000, Sieghart, 2000, Patenaude et al, 2001).
Les sous-unités β seraient responsables de l‟insertion correcte du récepteur dans la membrane plasmique, la sous-unité γ2 adjacente à une sous-unité α1, α2, α3 ou α5 forme le site de reconnaissance du benzodiazépine (qui a comme effet d‟augmenter l‟effet inhibiteur en augmentant l‟affinité du récepteur pour le GABA) et la sous-unité α détermine le profil pharmacologique (Ali et Thomson, 2008).
Les courants inhibiteurs enregistrés dans des synapses ayant la sous-unité α1 et/ou α2 sont reportés comme ayant une cinétique rapide comparativement à celles ayant la sous-unité α5 (Prenosil et al, 2006). La sous-sous-unité α5 s‟associe préférentiellement à la sous-sous-unité β3 (Sur et al, 1998) et peut aussi s‟associer à une sous-unité α1 (Fritschy et Mohler, 1995). Entre le jour 10 et le jour 30 du développement post-natal de la souris, l‟expression des sous-unités α2 et α5 est en augmentation tandis que celle de la sous-unité α1 est en diminution dans le cortex ainsi que dans l‟hippocampe (Yu et al, 2006).
La sous-unité α5 du récepteur GABAA serait particulièrement exprimée dans la
région CA1 de l‟hippocampe et serait inclue dans près de 25% des récepteurs GABAA
(Wisden et al, 1992, Sieghart, 1995, Sur et al, 1998, Pirker et al, 2000). Cette sous-unité est exprimée principalement de manière extrasynaptique (Fritschy et al, 1998, Brunig et al,
2002, Christie et al, 2002, Crestani et al, 2002) et confère donc une inhibition dite tonique
(Pirker et al, 2000, Caraiscos et al, 2004, Glykys et Mody, 2006, Serwanski et al, 2006). La sous-unité α5 peut aussi se retrouver au niveau des synapses et donc contribuer à l‟inhibition phasique des interneurones (Mody et Pearce, 2004, Serwanski et al, 2006, Ali et
Thomson, 2008, Zarnowska et al, 2009) mais pas chez les cellules pyramidales (Glykys et al, 2008). Lorsqu‟exprimée au niveau des synapses, cette sous-unité est impliquée dans une
forme d‟inhibition phasique, mais à cinétique plus lente, localisée dans les dendrites de neurones du CA1 qui est appelé GABAA,lent (Pearce, 1993, Caraiscos et al, 2004, Glykys et
Mody, 2006, Prenosil et al, 2006) mais ne serait pas impliquée dans l‟inhibition phasique à
cinétique plus rapide, GABAA,rapide (Zarnowska et al, 2009).
La sous-unité α5 jouerait un rôle dans l‟apprentissage dépendant de l‟hippocampe (Crestani et al, 2002, Chambers et al, 2004, Yee et al, 2004, Dawson et al, 2006) et dans le contrôle de l‟excitabilité du réseau de l‟hippocampe (Houser et Esclapez, 2003, Scimemi et
al, 2005, Glykys et Mody, 2006, Bonin et al, 2007). Des souris dont le gène de la sous-unité
α5 a été invalidé, Gabra5
KO (de l‟anglais Knock-Out), ainsi que l‟utilisation de l‟agoniste inverse de cette sous-unité, L-655,708, ont démontré une meilleure performance dans l‟apprentissage et la formation de la mémoire (ex : une meilleure performance lors du test de labyrinthe de Morris) (Chambers et al, 2002, Collinson et al, 2002, Bonin et al,
9 taux d‟acquisition de nouvelles mémoires d‟association et un taux d‟extinction plus lent lors des tâches d‟apprentissage relié à l‟hippocampe, c‟est-à-dire qu‟il y a une plus grande quantité de nouvelles mémoires d‟associations qui sont formées et que lors de l‟apprentissage de nouvelles tâches, l‟hippocampe est présente moins de courant excitateur (Collinson et al, 2002, Chambers et al, 2004). Il a été suggéré que le développement de pharmacologie ciblant l‟inhibition provenant de α5GABAAR pourrait devenir un traitement
pour augmenter la formation de la mémoire (Brunig et al, 2002, Caraiscos et al, 2004). 1.4.2 La plasticité aux synapses inhibitrices
La plasticité synaptique désigne des changements fonctionnels ou structuraux au niveau des synapses. Il existe 2 types de plasticité synaptique, celle à long terme et celle à court terme. Pour celle à long terme, il existe la dépression (diminution de la transmission du signal) à long terme (DLT) et la potentialisation (augmentation de la transmission du signal) à long terme (PLT). Ces deux types de plasticité peuvent durer des heures comparativement à la plasticité à court terme qui ne dure que quelques secondes ou minutes
(Andersen et al, 2007). Pour la PLT et la DLT, il est possible d‟induire ce genre de
plasticité à l‟aide de la stimulation à haute fréquence, par stimulation de type thêta et par dépolarisation postsynaptique (Patenaude et al, 2005).
La LTP jouerait un rôle dans la formation de nouvelles mémoires. Ce genre de plasticité peut être spécifique à la voie présynaptique, persistant, cooperatif (c‟est à dire induit par la somation de plusieurs signaux plus faibles) et associatif (c'est-à-dire que la stimulation d‟une voie peut induire une autre voie) (Abraham, 2003, McNaughton, 2003). Dans un même ordre d‟idée, la LTD jouerait un rôle dans l‟apprentissage moteur. Ce genre de plasticité est habituellement réservé au synapses ayant été stimulé à basse frequence (Escobar et Derrick, 2007).
Il existe trois mécanismes de la plasticité au niveau des synapses inhibitrices; il y a les modifications dans le nombre ou dans les propriétés des récepteurs au niveau de la synapse fonctionnelle, les modifications dans la probabilité de relâchement du neurotransmetteur et les modifications dans le nombre de synapses fonctionnelles (Gaiarsa, 2004). Plusieurs mécanismes intracellulaires de la plasticité aux synapses inhibitrices existent. Parmi
ceux-ci, il y a la protéine kinase Ca2+-calmoduline dépendante (CAMKII) qui phosphoryle des protéines cibles lorsqu‟elle est activée par une entrée massive de Ca2+ dans la cellule. La CAMKII a une grande capacité d‟autophosphorylation, ce qui lui permet de survivre à la diminution de CA2+ intracellulaire qui est nécessaire pour l‟activer. Cette propriété est importante pour la plasticité synaptique (Lisman, 1985). Un autre mécanisme est celui de l‟adénosine monophosphate cyclique (AMPc) qui agit en tant que second messager en activant la protéine kinase (PKA) composé de 4 unités, 2 unités actives et 2 sous-unités inhibitrices. Ceci a comme effet le relâchement des sous-sous-unités actives de cette enzyme qui vont à leur tour phosphoryler des sérine et des thréonine de divers protéines cibles (Purves et al, 2004).
1.5 Hypothèse
L‟inhibition est cruciale pour contrôler l‟activité des cellules individuelles ainsi que celle du réseau (Lytton et Sejnowski, 1991, Buzsaki et al, 1992, Ylinen et al, 1995a, Ylinen
et al, 1995b). Les synapses inhibitrices agissant sur des interneurones démontrent des
caractéristiques uniques. D‟autres laboratoires ont rapporté que la cinétique des CPSIs ainsi que la composition en sous-unités du récepteur GABAA peuvent être spécifiques aux
différents types d‟interneurones (Fritschy et Mohler, 1995, Nusser et al, 1995, Bartos et al,
2001, Patenaude et al, 2001). De plus, la transmission inhibitrice sur les interneurones
démontre différentes capacités pour la plasticité dépendante à l‟activité (Patenaude et al,
2005).
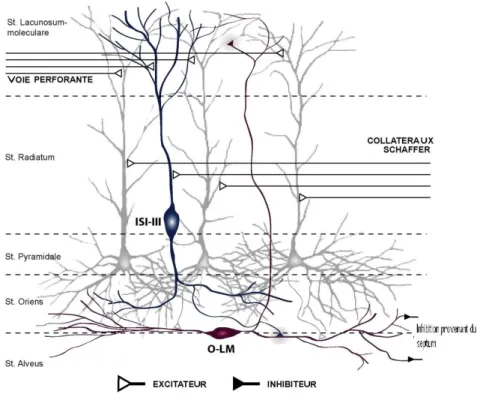
Parmi les interneurones de l‟hippocampe, ceux du str. O/A jouent un rôle critique dans la rétro-inhibition des cellules pyramidales de CA1 (c'est-à-dire l‟inhibition des cellules pyramidale par les interneurones suite a une activation des interneurones par les cellules pyramidales elles-mêmes) (Lacaille et al, 1987). Les interneurones de O/A semblent recevoir une seule projection inhibitrice intrinsèque à partir des interneurones spécifiques aux interneurones de type III (ISIs-III;(Acsady et al, 1996a, Acsady et al,
1996b), mais pourraient être innervés par des terminaisons GABAergiques provenant du
11 sur les cellules O/A ont été étudiées par analyse des courants inhibiteurs totaux (CPSIs spontanés) (Hajos et Mody, 1997) ou les CPSIs évoqués par macrostimulation (Morin et al,
1996). Cependant, les synapses formées par des terminaisons inhibitrices distinctes peuvent
présenter des propriétés divergentes et doivent donc être étudiées de manière isolée. De plus, le profil fonctionnel et pharmacologique des synapses formées par des voies inhibitrices distinctes sur les interneurones de O/A demeure inconnus.
Figure 5 : Représentation schématique de la position des cellules pyramidales, ISIs-III et des interneurones O-LM dans le circuit de la région CA1 de l‟hippocampe
Donc, dans cette étude, j‟ai testé l‟hypothèse que les synapses inhibitrices, formées
sur les interneurones du O/A par différentes afférences GABAergiques, présentent des propriétés spécifiques et sont prédisposées à différentes formes de modifications plastiques pendant l'activité synaptique réitérée.
1.6 Objectifs spécifiques
Les deux objectifs suivants étaient nécessaires afin de tester l‟hypothèse : 1) étudier les propriétés biophysiques, telles que l‟amplitude et les propriétés cinétiques de courants
postsynaptiques inhibiteurs (CPSIs), de synapses inhibitrices formées sur les interneurones de O/A par les projections GABAergiques provenant des ISIs-III et du septum; et 2) évaluer la régulation fonctionnelle de ces synapses durant l‟activité synaptique répétitive.
1.7 Importance des travaux
Les interneurones inhibiteurs de l‟hippocampe jouent un rôle important dans le fonctionnement normal de l‟hippocampe lors de la formation de nouvelles mémoires ainsi que lors de l‟apprentissage. Plusieurs désordres neurologiques sont associés avec un disfonctionnement des interneurones tel que l‟épilepsie, la maladie d‟Alzheimer, la dépression et la schizophrénie. Il est donc important de comprendre le fonctionnement normal des interneurones dans l‟hippocampe afin de pouvoir comprendre comment corriger ces troubles neurologiques.
Par ailleurs, le profil pharmacologique que peuvent présenter les synapses inhibitrices formées sur différents types d‟interneurones ainsi que la spécificité des sous-unités impliquées pourraient être intéressants pour les pharmacologistes. Ces connaissances pourraient être appliquées à l‟élaboration de nouvelles thérapies. Plus spécifiquement, la sous-unité α5 pourrait s‟avérer être une cible de choix lors de traitement de désordres cognitifs.
13 2 MATÉRIEL ET MÉTHODES
2.1 Préparation des tranches
Des tranches transversales d‟hippocampe ou septo-hippocampales ont été obtenues de souris C57J6/B6 (Charles River, St Laurent, Québec, Canada) et de souris Gabra5-/- (provenant de I. Mody et de Merck, Sharp and Dohme, Harlow, UK) de 18 à 41 jours. Ces animaux ont été anesthésiés avec de l‟isoflurane. Après leur décapitation, leur cerveau a été enlevé rapidement et placé dans une solution (de tranchage) refroidie (0 à +4 °C) et oxygénée contenant, en mM : 250 sucrose, 2 KCl, 1.25 NaH2PO4, 26 NaHCO3, 7 MgSO4,
0.5 CaCl2, et 10 glucose, pH 7.4, 320-340 mOsm. Pour les tranches septo-hippocampales
(SH), les cerveaux ont été disséqués comme décrit précédemment (Toth et al, 1997). En bref, une première coupe parasagittale a été effectuée dans la ligne médiale d‟un hémisphère afin de séparer le cerveau en deux parties. Une deuxième coupe parasagittale a été effectuée latéralement à environ 2 mm de la ligne médiale de l‟autre hémisphère, s‟étendant du pôle rostral jusqu'à un site près du fimbria. Ensuite une troisième coupe à partir de ce point à un angle de 120° par rapport au plan sagittal a été effectuée. Les plans, définis par la deuxième et la troisième coupe ont été collé sur la platine du vibratome, se qui a permis d‟aplatir les projections SH.
Les tranches, ayant 300 µm d‟épaisseur, ont été coupées à l‟aide d‟un vibratome (Leica VT1000S; Leitz, Wetzlar, Allemagne) et ont ensuite été transférées dans une autre solution (de récupération) oxygénée chauffée (35ºC) contenant, en mM : 124 NaCl, 2.5 KCl, 1.25 NaH2PO4, 26 NaHCO3, 3 MgSO4, 1 CaCl2, et 10 de glucose. Cette solution a été
ensuite laissée à la température de la pièce pendant le reste de l‟expérience. Les tranches ont ensuite récupérées dans cette solution pendant au moins 1h.
2.2 Enregistrement et analyse des CPSIs.
Pendant les expériences, des tranches de l‟hippocampe ont été perfusées continuellement (2.5 ml/min) avec du liquide cérébro-spinal artificiel (LCSa) contenant, en mM : 124 NaCl, 2.5 KCl, 1.25 NaH2PO4, 26 NaHCO3, 2 MgSO4, 2 CaCl2, et 10 de glucose
(pH 7.3; 300 mOsm), oxygéné avec un mélange de 95% O2 et 5% CO2 et chauffé
(30-32ºC).
Des interneurones du st. O/A du CA1 ont été identifiés à l‟aide d‟une caméra infrarouge (70 Series; Dage-MTI, Michigan City, IN) montée sur un microscope droit (Axioscope 2FS; Carl Zeiss, Kirkland, Québec, Canada) équipé avec un objectif à longue portée à immersion à l‟eau. Des enregistrements « patch-clamp » en configuration cellule entière ont été effectuée à l‟aide d‟un amplificateur MultiClamp 700B (Molecular Devices, Sunnyvale, Califonie, États-Unis). Les pipettes servant à l‟enregistrement étaient faites de capillaire de verre en borosilicate (1B100F-4; World Precision Instruments Inc.,Sarasota, FL,USA), étaient étirées avec un « Flaming/Brown-type micropipette puller » (P-97; Sutter instruments, Novato, CA, USA) et avaient une résistance de 3.5-6MΩ. Ces pipettes étaient remplies d‟une solution (patch) contenant, en mM : 130 KMeSO3, 2 MgCl2, 10
diNa-phosphocreatine, 10 HEPES, 2 ATPTris, 0.4 GTPTris.
Les courants postsynaptiques inhibiteurs (CPSIs) ont été évoqué à 0.1 Hz par stimulation minimale des projections inhibitrices locales de l‟hippocampe via une électrode positionné à la frontière entre le stratum radiatum (RAD) et le stratum pyramidale (PYR) de la région CA1, ou par stimulation minimale des projections GABAergiques SH dans le fimbria au niveau des tranches SH. Une pipette de stimulation (2-3 MΩ) a été remplie de LCSa et connectée à une unité d‟isolation de courant constant (A360LA; World Precision Instruments Inc.) contrôlée par un système d‟acquisition de données (Digidata1440; Molecular Devices) et le logiciel Clampex 10.2 (Molecular Devices). Les cellules ont été enregistrées en configuration cellule entière à un voltage imposé de -40mV en présence des antagonistes de récepteurs de glutamate DL-AP5 et NBQX (Ascent Scientific) pour bloquer les récepteurs NMDA et d'AMPA/kaïnate, respectivement. L‟agoniste inverse de la sous-unité α5 du récepteur GABAA, le L-655,708, a été utilisé dans quelques expériences. La
plasticité synaptique a été induite par stimulation répétitive à 10 Hz pour 2 secondes, trois fois, à 30 secondes d‟intervalle.
La résistance en série (8.5-23 MΩ) a été surveillée pendant toute la durée des expériences en appliquant une petite hyperpolarisation (-5mV). Les enregistrements étaient arrêtés si la résistance en séries changeait de plus de 15%. L‟acquisition des données
15 (filtrées à 2-3 kHz, digitalisés à 10 kHz) a été effectuée en utilisant Clampex 10.2 (Molecular Devices). Les données ont été analysées en utilisant Clampfit 10.2 (Molecular Devices) et Igor Pro (WaveMetrics, Lake Oswego, OR, USA).
2.3 Analyse des données
L‟amplitude des CPSIs a été mesurée au sommet de la réponse et les données du groupe ont été normalisées en fonction de l‟amplitude moyenne obtenue pendant la période de contrôle (premières 5 minutes). Les données des groupes sont présentées en moyenne ± écart type, et analysées par un test de t en paire de Student. Pour toutes les expériences, dans lesquelles le paired-pulse ratio (PPR) a été examiné, les deux réponses ont été évoquées à 50 ms d‟intervalle à stimulation minimale à une fréquence de 0.1 Hz. Le PPR a été calculé comme étant de ratio entre la moyenne de l‟amplitude de la deuxième réponse et la moyenne de l‟amplitude de la première réponse (Figure 7). Le coefficient de variation (CV) des CPSIs a été calculé comme un ratio entre la déviation standard de l‟amplitude du courant et la moyenne de l‟amplitude du courant. Le temps de monté et le taux d‟affaiblissement ont été mesurés par ajustements monoexponentiels de 20-80% et de 80-20% de la réponse, respectivement. La différence statistique entre les groupes a été déterminée avec un test de t non pairé ou un test Mann-Whitney.
2.4 Immunohistochimie
Du biocytin (0.15-0.2%) (Sigma) a été ajoutée à la solution du patch pour marquer la cellule pendant l‟enregistrement. Les tranches d‟hippocampe avec des cellules enregistrées ont été fixées en utilisant du paraformaldéhyde (4%) durant 24 heures. Ensuite, les tranches ont été rincées avec du tampon phosphate-sodium (PBS) 0.1M et gardées à 4°C jusqu‟au moment de révélation. Pour révéler le biocytin, les tranches ont été rincées plusieurs fois avec du tampon Tris-sodium (TBS; pH = 7.4, t = 25 °C), traitées avec du peroxyde d‟hydrogène (0.3 %) pour 30 minutes, à nouveau rincées au TBS puis perméabilisées avec du triton (3%) dans du TBS (Glickfeld et Scanziani, 2006) pendant 1 heure. Afin de réduire
le bruit non-spécifique, les tranches ont été incubées pendant 30 minutes dans du TBS contenant 10% de sérum d‟âne normal (NDS) et 0.5% de sérum d‟albumine bovin (BSA). Finalement, les tranches ont été incubées toute la nuit avec l‟Alexa-546-Streptavidin (1:200) dans du TBS contenant 1% de NDS et 0.5% de BSA. Le lendemain, les tranches ont été rincées avec du TBS et montées sur lame avec du médium à fluorescence Dako (Dako Canada Inc, Missisauga, ON, Canada). Les images confocales des interneurones enregistrés ont été obtenues à l‟aide de système d‟imagerie Leica TCS SP5 couplé à un laser HeNe 543 nm. Les « Z-stacks » des interneurones ont été acquis à intervalles de 1µm, et ont été reconstruits dans le logiciel Neurolucida 8.26.2 (MBF Bioscience, Williston, VT, USA).
17 3 RÉSULTATS
3.1 Propriétés des synapses inhibitrices des interneurones du O/A
Les interneurones du O/A reçoivent des projections GABAergiques à la fois du septum (SH) et des interneurones spécifiques aux interneurones (Freund et Antal, 1988,
Eyre et al, 2007). Il a donc été important de savoir s‟il existe une différence au niveau des
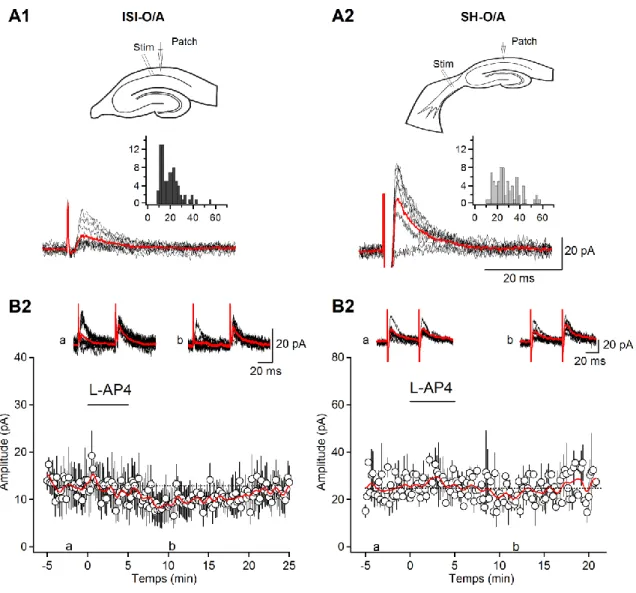
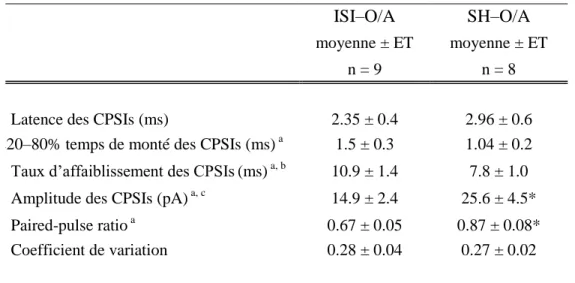
propriétés fonctionnelles entre ces deux types de synapses. Cette première partie d‟étude était effectuée sur les animaux jeunes (15 < P < 24). Les courants postsynaptiques inhibiteurs (CPSIs) évoqués par stimulation minimale provenant des deux types de synapses ont été analysés. Les CPSIs des deux types de synapses démontraient des propriétés cinétiques et une latence similaire mais différaient quant à l‟amplitude (voir Tableau 1; Figure 6). L‟amplitude des CPSIs provenant du septum était presque deux fois plus élevée que celles des ISI-III (ISI-O/A : 14.9 ± 2.4 pA vs SH–O/A: 25.6 ± 4.5 pA; Figure 6, Tableau 1).
Étant donné que les terminaisons axonales des ISI-III expriment le récepteur métabotropique du glutamate de type 7 (mGluR7a) au niveau de leurs zones présynaptiques actives (Somogyi et al., 1993), la sensibilité des CPSIs à l‟agoniste des récepteur métabotropique du glutamate (mGluR) du groupe III, le L-AP4, a été testée. Les données ont démontrées qu‟à haute concentration (500 µM), ciblant préférentiellement les mGluR7, L-AP4 évoquait une dépression réversible des CPSIs (de 70.7 ± 3.6 % comparativement au contrôle, n = 5, P < 0.01; Figure 6) ce qui confirme qu‟ils tirent leurs origines bel et bien des ISIs-III. Cependant, les CPSIs des projections SH ne démontraient aucune sensibilité à cet agent pharmacologique (de 91.0 ± 12 % comparativement à la condition contrôle, n = 4, P > 0.05; Figure 6). Ensemble, ces données montrent que l‟activation des mGluR du groupe III était spécifique au niveau des synapses ISIs-III-O/A. Ainsi, le L-AP4 en haute concentration peut être utilisé comme outil pharmacologique dans la différenciation entre ces deux types de synapses.
Figure 6 : Propriétés des synapses inhibitrices sur des INs du O/A.
A, Schéma de la configuration d‟enregistrement et de stimulation pour des tranches
hippocampales (A1) et septo-hippocampales (A2) et exemples de tracés de CPSIs (10 tracés consécutifs avec leur moyenne en rouge) évoqués dans des interneurones O/A par stimulation minimale locale du stratum pyramidale adjacent au stratum radiatum (A1, bas, ISI-O/A) et par stimulation minimale des projection inhibitrices septo-hippocampales (A2, bas, SH-O/A). Les inserts montrent des histogrammes de distribution de l‟amplitude des CPSIs. B, Tracés représentatifs (10 tracés consécutifs) obtenus aux temps indiqués, et diagramme de distribution de l‟amplitude de CPSI par rapport au temps, illustrant l‟effet du L-AP4 aux deux types de synapses (n = 5, ISI-O/A; n = 4, SH-O/A). Le L-AP4 a été appliqué pendant une période de 5 minutes au temps indiqué par la barre horizontale. Il est à noter que le L-AP4 a induit une dépression à court terme des CPSIs aux synapses ISI-O/A mais avait aucun effet aux synapses SH-O/A. Les barres d‟erreurs représentent l‟erreur-type.
19
Tableau 1 : Sommaire des propriétés des CPSIs aux synapses ISI-O/A et SH-O/A
ISI–O/A SH–O/A
moyenne ± ET moyenne ± ET
n = 9 n = 8
Latence des CPSIs (ms) 2.35 ± 0.4 2.96 ± 0.6 220–80% temps de monté des CPSIs (ms) a 1.5 ± 0.3 1.04 ± 0.2 Taux d‟affaiblissement des CPSIs(ms) a, b 10.9 ± 1.4 7.8 ± 1.0 Amplitude des CPSIs (pA) a, c 14.9 ± 2.4 25.6 ± 4.5* Paired-pulse ratio a 0.67 ± 0.05 0.87 ± 0.08* Coefficient de variation 0.28 ± 0.04 0.27 ± 0.02
a Valeurs déterminées à l‟aide de CPSIs moyens.
b Basé sur des critères visuels, l‟ajustement monoexponentiel a été jugée adéquat c
Excluant les échecs. * P < 0.05
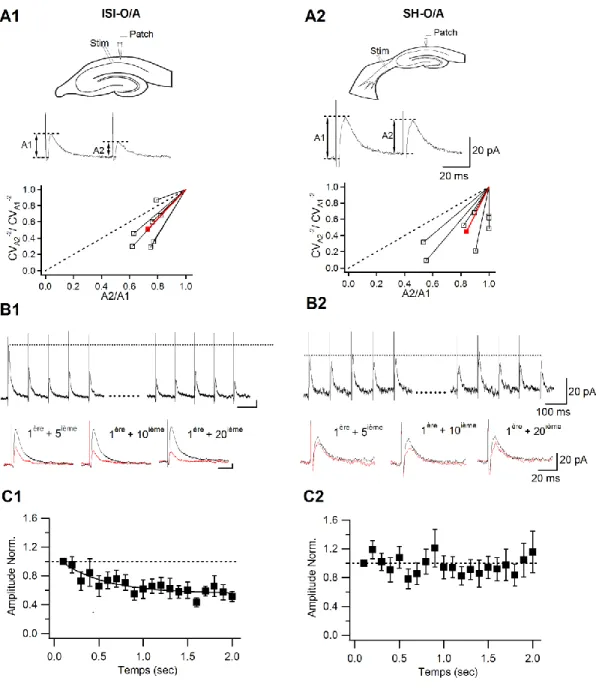
Suite à ces résultats, la dynamique de transmission aux synapses ISI-O/A et SH-O/A pendant l‟activité synaptique répétitive a été examinée (Figure 7) afin de déterminer les propriétés de relâchement du neurotransmetteur (dans ce cas si, le GABA) (Manabe et al,
1993, Debanne et al, 1996, Dobrunz et Stevens, 1997). Malgré que ces deux types de
synapses démontrent une dépression du paired-pulse (PPD; 50 ms d‟intervalle), la dépression de la seconde réponse était moins significative au niveau des synapses SH-O/A (ISI–O/A PPR: 0.67 ± 0.05 vs SH–O/A PPR: 0.87 ± 0.08, P < 0.05; Figure 7). Afin de déterminer si la dépression était exprimée des facteurs présynaptiques [tel que la diminution du nombre de vésicule de neurotransmetteur disponible (Stevens et Tsujimoto,
1995)] ou postsynaptiques [tel que la désensibilisation du récepteur (Jones et Westbrook, 1995)], une analyse du coefficient de variation (variation dans l‟amplitude par rapport à la
moyenne pour 30 tracé; CV) a été effectuée (Faber et Korn, 1991). L‟inverse du CV au carré de la deuxième réponse par rapport à son amplitude a été analysé graphiquement, et les deux valeurs ont été normalisées par rapport à la première réponse. Au niveau des deux
types de synapses, les valeurs se situent en dessous de la ligne d‟identité (Figure 7), ce qui suggère que la dépression observée a été générée au niveau présynaptique et non par des mécanismes postsynaptiques [tel que la désensibilisation du récepteur GABAA]. Étant
donné que la PPD est de plus petite amplitude au niveau des synapses SH-O/A, il est possible de dire qu‟elles ont un mécanisme de relâchement plus fiable que celui présent aux synapses ISI-O/A. De plus, la plasticité à court terme des CPSIs induite par une stimulation répétitive de 10 Hz, qui imite le rythme endogène de type « thêta » dans l‟hippocampe, est aussi différente pour les deux types de synapses. En effet, les CPSIs ont démontré une dépression significative avec un taux d‟affaiblissement de 0.505 secondes aux synapses ISI-O/A mais n‟a produit aucun changement aux synapses SH-O/A (Figure 7). Après cinq stimuli, l‟amplitude des CPSIs était de 66.7 ± 14% comparativement à la condition contrôle (P < 0.05, n = 9; Figure 7) pour les synapses ISI-O/A et n‟a montré aucun changement pour les synapses SH-O/A (108 ±15%; P > 0.05, n = 6; Figure 7). Il est aussi possible de dire que cette dépression à court terme est exprimée au niveau présynaptique puisque le CV de l‟amplitude des CPSIs était en augmentation entre la première réponse (0.22 ± 0.08) et la vingtième (0.33 ± 0.09; P < 0.05, n = 6). Ensemble, ces résultats montrent que les projections SH procurent une inhibition plus forte et plus persistante comparativement aux interneurones spécifiques aux interneurones de type III, ce qui suggère que les projections GABAergiques provenant du septum sont une source primaire d‟inhibition sur les interneurones du O/A dans le circuit in vivo.
21
Figure 7 : Dynamiques distinctes de l‟inhibition aux synapses ISI-O/A et SH-O/A
A, Tracés représentatifs de CPSIs (moyenne de 10 tracés) évoqués par une stimulation en
paire aux synapses ISI-O/A et SH-O/A (haut) et le graphique de l‟analyse du coefficient de variation des CPSIs aux deux types de synapses. Graphique de l‟inverse du CV au carré de la deuxième réponse (CVA2-2) en fonction de l‟amplitude moyenne; les données ont été
normalisées selon le CVA1-2 et l‟amplitude moyenne de la première réponse,
respectivement. La ligne rouge indique la moyenne. L‟intervalle de temps entre les deux stimulations était de 50 ms. B-C, Plasticité à court terme des CPSIs aux deux synapses pendant la stimulation répétitive à 10 Hz. B, CPSIs évoqués par les cinq premières stimulations (droite) et les cinq dernières (gauche) d‟un tracé de 20 stimuli (haut) et une superposition de la première et la cinquième (bas gauche), de la première et la dixième (bas
milieu) et de la première et la vingtième (bas droite) réponse lors du tracé (moyenne de 3 tracés). C, Amplitude normalisée par rapport au temps pendant la stimulation à 10 Hz. La courbe d‟ajustement en C1 représente un ajustement exponentiel simple aux données, avec τ = 0.505 s. Il est important de noter qu‟il y a présence de dépression significative aux synapses ISI-O/A (n=9) mais aucun changement aux synapses SH-O/A (n=8). Les barres d‟erreurs représentent l‟erreur-type.
3.2 Plasticité à long terme aux synapses inhibitrices sur les interneurones du O/A.
La petite amplitude et la dépression rapide des CPSIs aux synapses ISI-O/A démontrent une contribution très transitoire de l‟inhibition provenant des ISIs-III putatifs pendant l‟activité répétitive. D‟un autre côté, il a été assumé que l‟activité répétitive au niveau de ces synapses peut induire des modifications plastiques résultant dans l‟amplification ou une dépression sélective de l‟inhibition provenant des ISIs. Afin de vérifier cette hypothèse, la possibilité qu‟une forme de plasticité à long terme puisse être présente a été testée. Pour ce faire, l‟amplitude des CPSIs a été analysée avant et après la stimulation répétitive à 10 Hz (trois fois pendant 2 secondes à trente secondes d‟intervalle). Les données n‟indiquent aucun changement dans l‟amplitude des CPSIs. En effet, avec la stimulation à 10 Hz, seulement deux des six cellules ont démontré une potentialisation à long terme (PLT) des CPSIs à 20 minutes post-tétanisation et les quatre autres neurones n‟ont démontré aucun changement. Ensemble, ces résultats montrent un changement total de l‟amplitude des CPSIs de 111.1 ± 16.2% du contrôle (n = 6, P > 0.05; Figure 8).
23
Figure 8 : Absence de plasticité à long terme aux synapses ISI-O/A
A, Graphique d‟amplitude de CPSIs en fonction du temps d‟un interneurone représentatif et exemple de tracés de CPSIs (moyenne de 30 tracés) obtenue avant (a) et après (b) une stimulation synaptique de 10 Hz (A) et moyenne d‟amplitude normalisée de CPSI (B; n = 6), montrant une absence de plasticité à long terme suite à une tétanisation de 10 Hz des synapses ISI-O/A. Les barres d‟erreurs représentent l‟erreur-type.
Cette grande variabilité de plasticité aux synapses ISI-O/A pourrait être expliquée par l‟hétérogénéité des interneurones du O/A. En effet, au moins huit sous-types distincts d‟interneurones à orientation horizontale ont été décrient dans cette région (Maccaferri,
2005, Jinno et al, 2007, Klausberger et Somogyi, 2008). Afin de déterminer si cette PLT
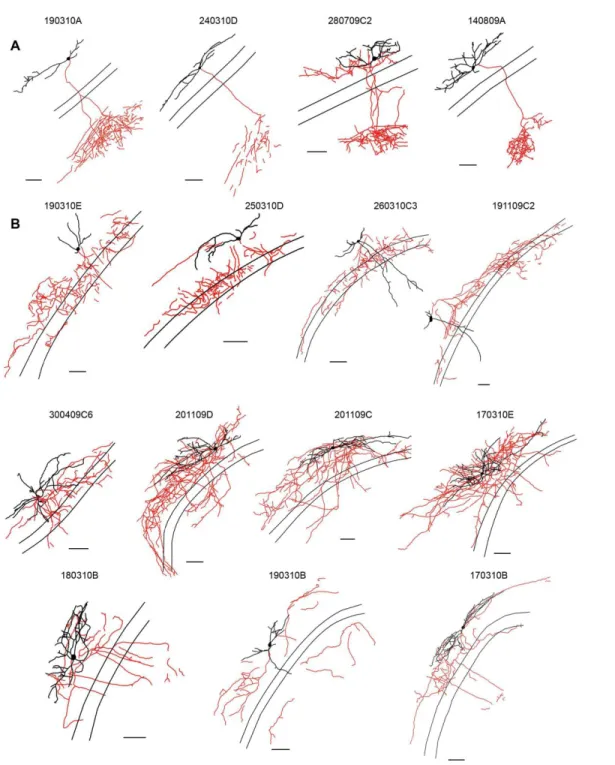
des CPSIs était due à la variabilité des sous-types d‟interneurones, toutes les cellules ont été remplies de biocytin lors des enregistrements et ont été reconstruites afin de vérifier leur anatomie (Figure 9). Des cinq interneurones reconstruits, quatre ont été identifié comme étant des O-LMs avec un corps cellulaire localisé à la frontière entre le stratum oriens et le stratum alveus, des dendrites orientés horizontalement et contenant des épines et un axone projetant au stratum lacunosum-moleculare. La cellule restante avait un axone à embranchement local dans le O/A et PYR, et correspondait donc à une cellule en panier putative. La Figure 9 illustre deux exemples d‟interneurones O/A reconstruits à l‟aide du logiciel Neurolucida. Tous les enregistrements d‟interneurones O-LM et d‟une cellule en panier putative montrent que ces cellules ne présentent aucune plasticité aux synapses d‟ISIs. Ensemble, ces résultats suggèrent que, indépendamment du type cellulaire, les synapses ISI-O/A ne démontrent aucune forme de plasticité à long terme.
Il était ensuite nécessaire de vérifier si les synapses SH-O/A, qui fournissent une source d‟inhibition plus grande et plus fiable, subissent des modifications plastiques à long terme (Figure 10). Contrairement aux synapses ISI-O/A, la tétanisation à 10 Hz a augmenté l‟amplitude des CPSIs significativement aux synapses SH-O/A (136.5 ± 0.3% du contrôle, n = 4, P < 0.01; Figure 10), et cette potentialisation durait au moins 25 minutes. Une potentialisation significative a été observée dans les quatre cellules. La potentialisation à long terme n‟a pas été associée avec des changements du CV ou du PPR (PPR contrôle : 0.89 ± 0.13, PPR après 0.98 ± 0.09; CV contrôle : 0.26 ± 0.02, CV après : 0.27 ± 0.04; Figure 10C), ce qui suggère que le locus d‟expression pour cette potentialisation était postsynaptique. Ces résultats démontrent une potentialisation de la transmission GABAergique à long terme induite par une stimulation rythmique à fréquence thêta spécifiquement aux synapses SH-O/A.
25
Figure 9 : Différents types cellulaires enregistrés au stratum oriens/alveus
Reconstruction à l‟aide du logiciel Neurolucida de deux interneurones O/A (cellules O-LMs (A) et autres types cellulaires (B)) remplits de biocytin. Le corps cellulaire et les dendrites sont en noir tandis que l‟axone est en rouge.
Figure 10 : Plasticité à long terme aux synapses SH-O/A
A, Graphique d‟amplitude de CPSIs en fonction du temps d‟un interneurone représentatif et
exemples de tracés de CPSIs (moyenne de 30 tracés) obtenus avant (a) et après (b) une stimulation synaptique de 10 Hz. B, Moyenne d‟amplitude normalisée de CPSI (n = 4), montrant une potentialisation à long terme suite à une tétanisation de 10 Hz des synapses SH-O/A. C, Données du groupe en B démontrant un changement dans l‟amplitude, le paired pulse ratio (PPR) et le coefficient de variation (CV) des CSPIs obtenus après 25 minutes suivant la tétanisation. Les données sont exprimées en pourcentage de changement comparativement au contrôle, soit avant la stimulation à 10 Hz. Les barres d‟erreurs représentent l‟erreur-type.
27 3.3 Propriétés cinétiques des CPSIs dans des interneurones O-LM
Étant donné que les différentes synapses peuvent montrer des propriétés distinctes de la transmission inhibitrice et que cette différence pourrait être due à l‟hétérogénéité des interneurones, dans la deuxième partie de cette étude je me suis concentrée sur les interneurones qui avaient un soma et leurs dendrites dans le str. O/A et un axone projetant à LM (les interneurones O-LMs). Les CPSIs enregistrés dans les O-LMs ont été induits par stimulation minimale des projections GABAergiques locales (voir Figure 6, A1) afin de pouvoir analyser ceux provenant des synapses ISI-O-LM.
Tout d‟abord, les CPSIs enregistrés dans les O-LMs avaient un potentiel de réversion de -71.9 ± 1.2 mV et étaient de petite amplitude (12.93 ± 1.02 pA, n = 24). L‟analyse du coefficient de variation a indiquée une dépression du paired-pulse au niveau présynaptique (1/CV2 = 0.48 ± 0.05, PPR = 0.65 ± 0.04, n = 24). La latence, quant à elle, était de courte durée (2.97 ± 0.22 ms, n = 22) ce qui suggère que les CPSIs étaient monosynaptiques. Cependant, le temps de monté (2.64 ± 0.26 ms, n = 24) et le taux d‟affaiblissement (16.73 ± 1.64 ms, n = 24) étaient assez variables (Figure 11A). Cette variabilité n‟était pas due à l‟atténuation dendritique (phénomène où le signal est atténué dans le temps et dans l‟espace par les dendrites dues à leur forme et à leur localisation de sorte a ce que le potentiel soit beaucoup plus petit une fois rendu au soma) car aucune relation linéaire entre l‟amplitude et le temps de monté ou le taux d‟affaiblissement des CPSIs n‟a été observée (Figure 11, B1-2). Des études antérieures ont démontrées que des CPSIs enregistrés dans des interneurones provenant de différents groupes d‟âges d‟animaux peuvent avoir différentes propriétés cinétiques (Kobayashi et al, 2008). En effet, lorsque le temps de monté était mis en fonction du taux d‟affaiblissement, il a été possible de remarquer qu‟une différence existe entre le groupe d‟âge juvénile (P18-23) et adulte (P26-40, Figure 11, B3).
Suite à ces observations, les différents paramètres des CPSIs entre les O-LMs de deux groupes d‟âges ont été comparés. L‟amplitude ne démontrait aucune différence significative entre les deux groupes d‟âges (juvénile : 12.28 ± 1.38 pA, n = 11; adulte : 13.48 ± 1.53 pA, n = 13; P > 0.05). Par contre, une différence significative a été observée pour le temps de monté (juvénile : 1.69 ± 0.18 ms, n = 11; adulte : 3.44 ± 0.32 ms, n = 13;
P < 0.0001), le taux d‟affaiblissement (juvénile : 11.66 ± 0.95 ms, n = 11; adulte : 21.01 ± 2.34 ms, n = 13; P < 0.005) et donc au niveau de l‟aire sous la courbe des CPSIs (juvénile 189.82 ± 27.5 ms, n = 11; adulte 292.73 ± 32.6 ms, n = 13; P < 0.05, Figure 11C). Ensemble, ces données suggèrent que les CPSIs dans les interneurones O-LM subissent des modifications en cinétique lors de la maturation post-natale.
29 A, Latence, amplitude, temps de monté et taux d‟affaiblissement de CPSIs d‟interneurones O-LM (n = 24). B, Graphique du temps de monté (B1) et du taux d‟affaiblissement (B2) en fonction de l‟amplitude. B3, Temps de monté en fonction du taux d‟affaiblissement de CPSI enregistré chez des animaux juvéniles (n = 11) et adultes (n = 13). C, Exemples de tracés (haut) et graphiques (bas) résumant les propriétés des CPSIs chez des animaux juvéniles (blanc) et adultes (noir), démontrant une modification significative des propriétés cinétiques des CPSIs chez les animaux plus âgés.
3.4 Rôle de la sous-unité α5 du GABAAR dans la transmission inhibitrice sur les O-LMs
La différence au niveau des propriétés cinétiques des CPSIs sur les O-LMs entre les différents groupes d‟âges peut être expliquée par la différence en composition de sous-unité du GABAAR. En effet, il a été rapporté que la sous-unité α5 du récepteur GABAA
démontrait des CPSIs à cinétique plus lente dans des cellules pyramidales de souris (Caraiscos et al, 2004, Glykys et Mody, 2006, Prenosil et al, 2006, Ali et Thomson, 2008) et n‟était pas impliquée dans des cinétiques rapides (Zarnowska et al, 2009). Aussi, cette sous-unité est présente dans le str. O/A de l‟hippocampe (Sperk et al, 1997) et son expression augmente pendant la maturation jusqu‟au jour 30 (Yu et al, 2006).
Afin de déterminer si la sous-unité α5 est impliquée dans le changement dans les propriétés cinétiques, le L-655,708 (l‟agoniste inverse de la sous-unité α5, qui agit en tant qu'antagoniste) a été utilisé. Cet agent pharmacologique, à de faible concentration (50 nM), est très spécifique, se liant préférentiellement à la sous-unité α5 plus de cinquante fois par rapport aux autres sous-unités du GABAAR (Quirk et al, 1996, Casula et al, 2001). Il est
possible de voir que le L-655,708 était efficace en réduisant l‟amplitude des CPSIs dans les interneurones des animaux plus âgés que P26 (61.4 ± 13.0 % du contrôle, n = 5, P < 0.05, Figure 12B), mais pas dans les interneurones des animaux juvéniles (18 < P < 24, 107.8 ± 15.3 % du contrôle, n = 6, P > 0.05, Figure 12A). Étant donné qu‟aucun changement significatif du PPR (juvénile : 120.5 ± 13.9 % du contrôle, n = 6, P > 0.05; adulte : 130.7 ± 14.4 % du contrôle, n = 5; P > 0.05) et du CV (juvénile : 99.7 ± 9.0 % du contrôle, n = 6, P > 0.05; adulte : 97.4 ± 6.5 % du contrôle, n = 5; P > 0.05) n‟a été observé dans l‟ensemble des cellules, il est donc possible de dire que l‟effet du L-655,708 était du côté postsynaptique (Figure 12C). [Il est à noté ici qu‟étant donnée que quelques cellules ont démontré un effet lors de l‟application du L-655,708, tel qu‟observé par la grande valeur de
l‟erreur type du PPR, certaines synapses peuvent présenter la sous-unité α5 au niveau présynaptique.] L‟effet de cet agent était associé avec le temps de monté : de sorte à ce que plus le temps de monté était lent, plus l‟effet du L-655,708 était prononcé. Donc, la diminution de l‟amplitude des CPSIs en présence du L-655,708 était plus proéminente chez les animaux adultes (juvénile : temps de monté : 2.11 ± 0.28 ms, effet de L-655,708 : 7.8 ± 15.3 % du contrôle, n = 6; adulte : temps de monté : 4.55 ± 0.72 ms, effet de L-655,708 : 38.6 ± 13.0 % du contrôle, n = 5). Le L-655,708 n‟agissait pas sur la sous-unité α5 exprimée au niveau extrasynaptique car le courant auquel la cellule était maintenue (courant imposé ou « holding current ») et le bruit synaptique n'étaient pas modifiés après l‟application de l‟agent (courant imposé : 106.4 ± 12.6 % du contrôle; bruit synaptique : 100.8 ± 23.7% du contrôle; n = 5; P > 0.05, Figure 12E). IL est a noter ici qu‟étant donnée la grande vlauer de „erreur type, l‟effet de l‟agent pharmacologique était variable et peut être assicié a une augmentation ou une diminution du bruit synaptique dans différentes cellules. Cependant, glogallement, il n‟y avait pas de changement dans le bruit synaptique. Ces données démontrent ainsi une absence d‟inhibition tonique impliquant la sous-unité α5 dans majorité des interneurones O-LM dans les conditions de bases (un effet a été observé dans un nombre insuffisant de cellules). Afin de vérifier si une forme d‟inhibition tonique serait induite dans les O-LMs par la concentration ambiante de GABA, le GABA (5 µM, imitant une concentration ambiante) a été appliqué dans le bain et le courant imposé et le bruit synaptique ont été analysés. Les données ont montré que le GABA ne produit aucun changement significatif dans ces deux paramètres (différence en courant imposé entre la condition contrôle et après l‟application du GABA : -11.8 ± 7.8 pA; bruit synaptique : contrôle : 5.1 ± 0.3 pA, après l‟application du GABA : 7.1 ± 0.5; n = 4, P > 0.05), ce qui indique que les O-LMs ne subissent pas d‟inhibition tonique. Ces résultats peuvent suggérer que la sous-unité α5 du récepteur GABAA devrait être exprimée spécifiquement
aux synapses inhibitrices des interneurons O-LM plus tard lors de la maturation post-natale. Dans le but de valider les effets observés lors de l‟application du L-655,708, des CPSIs dans les O-LMs ont été enregistrés dans une lignée de souris transgéniques n‟exprimant pas la sous-unité α5 du GABAAR, les Gabra5-/-. Les données ont montré que,
par rapport aux souris sauvages (WT), les CPSIs enregistrés dans des interneurones O-LM de souris Gabra5-/- ne démontrent pas de différence au niveau des propriétés cinétiques lors
31 de la maturation des animaux (Figure 13, A et B). En effet, ni l‟amplitude (juvénile : 15.6 ± 3.11 pA, n = 7; adulte : 12.4 ± 2.2 pA, n = 6; P > 0.05), le temps de monté (juvénile : 1.6 ± 0.3 ms, n = 7; adulte : 2.3 ± 0.45 ms, n = 6; P > 0.05), le taux d‟affaiblissement (juvénile : 13.3 ± 3.1 ms, n = 7; adulte : 16.6 ± 2.3 ms, n = 6; P > 0.05), et donc l‟aire sous la courbe (juvénile : 232.6 ± 51.3 pA x ms, n = 7; adulte : 209.0 ± 37.3 pA x ms, n = 6; P > 0.05) n‟ont montré de différence significative entre les deux groupes d‟âges (Figure 13C). Ensemble, ces données démontrent que la sous-unité α5 du GABAAR est responsable du
Figure 12 : Effet du L-655,708 sur les CPSIs des interneurones O-LM.
A-B, Graphique de l‟amplitude de CPSIs en fonction du temps d‟un exemple représentatif (A1, B1) et de la moyenne des groupes (A2, B2 ; normalisé ; à partir des cinq premières minutes d'enregistrements) obtenues à partir de souris juvéniles (A, n=6) et adultes (B, n=5)
33 illustrant l'effet de l‟application du L-655,708. Les tracés au-dessus sont la moyenne de 30 tracés consécutifs de CPSIs obtenues au temps indiqué. C, L'effet du L-655,708 dans des animaux P18-23 (blanc) et P26-40 (noir). D, Graphique résumant l'effet du L-655,708 dans des animaux P18-23 (blanc) et P26-40 (noir) par rapport au temps de monté. E, L'effet du L-655,708 sur le courant imposé et le bruit synaptique enregistrés dans les tranches d‟animaux adultes.
Figure 13 : Propriétés cinétiques des CPSIs des interneurones O-LM des souris Gabra5-/-. A, Exemples représentatifs de CPSIs enregistrés dans deux groupes d‟âges de souris sauvages et Gabra5-/-. B, Représentation graphique du temps de monté en fonction du taux d‟affaiblissement de tranches de souris Gabra5-/- comparé aux souris sauvages, démontrant aucune différence significative entre les deux groupes d‟âges Gabra5
-/-. C, Propriétés des CPSIs chez les souris Gabra5-/- juvéniles et adultes, démontrant une perte de modification dans la cinétique des CPSIs lors de la maturation en absence de la sous-unité α5 du
3.5 La plasticité à long terme de synapses inhibitrices dans les O-LMs
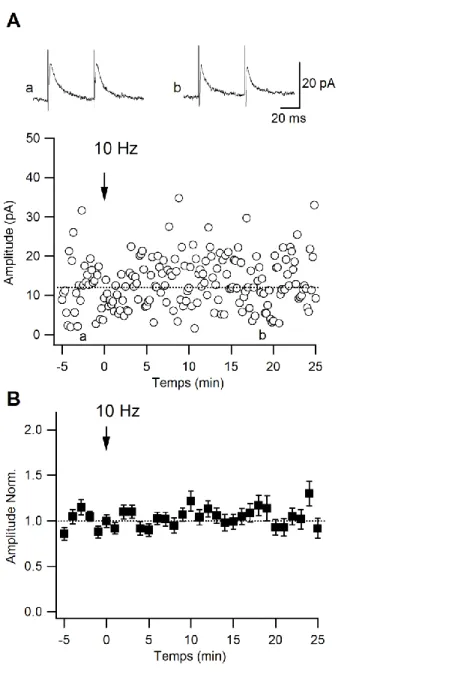
Étant donné qu‟aucune forme de plasticité à long terme dans les synapses ISI-O/A, incluant les ISI-O-LM, n‟avait été observée dans le groupe juvénile (voir Figure 8), il était nécessaire de vérifier s'il existe une forme de plasticité au niveau de ces synapses sur les O-LMs du groupe adulte. Les cellules ont été stimulées à une fréquence de 10-Hz (imitant le rythme endogène « thêta ») et l‟amplitude des CPSIs a été analysée avant et jusqu‟à 30 minutes après la stimulation. Les résultats ont indiqué que les CPSIs des O-LMs des animaux adultes présentaient une potentialisation de l‟amplitude à long terme (125.6 ± 9.0 % du contrôle, n = 5; P < 0.05, Figure 14, A et B), et ce, du côté postsynaptique car aucun changement du PPR (104.8 ± 14.9 % du contrôle, n = 5; P > 0.05) et du CV (107.6 ± 16.1 % du contrôle, n = 5; P > 0.05, Figure 14C) n‟a été observé. Collectivement, ces données suggèrent qu‟il y aurait donc un gain de plasticité aux synapses inhibitrices lors de la maturation dans les interneurones O-LM.
Finalement, j‟ai testé l‟implication de la sous-unité α5 dans la potentialisation à long terme qui a été observée dans les synapses inhibitrices du groupe adulte en utilisant le L-655,708 ou le modèle animal transgénique, les souris Gabra5-/-. Les données ont montré que, dans ces deux séries d‟expériences, l‟induction de la potentialisation à long terme a été bloquée. En effet, lorsque la sous-unité α5 est inhibée par le L-655,708, aucune potentialisation à long terme des CSPIs n‟a été observée (amplitude : 112.6 ± 14.3 % du contrôle, PPR : 82.8 ± 13.9 % du contrôle; CV : 103.2 ± 21.7 % du contrôle; n = 6; P > 0.05, Figure 15A), tout comme dans les souris Gabra5-/- (amplitude : 72.3 ± 2.5% du contrôle; PPR : 95.1 ± 8.4 % du contrôle; CV : 115.6 ± 29.3 % du contrôle; n = 3, Figure 15B). Ces données montrent que la sous-unité α5 du récepteur GABAA, exprimée plus tard
lors du développement aux synapses inhibitrices des O-LMs, joue un rôle critique dans la potentialisation à long terme de la transmission inhibitrice sur ces cellules.
35
Figure 14 : Plasticité synaptique à long terme dans les synapses inhibitrices sur les interneurones O-LM suite à une stimulation de 10-Hz
A-B, Enregistrements représentatifs (A) et données normalisées de groupe (B) d'amplitude de CPSIs obtenus à partir de souris P26-40 (B, n=6), montrant une potentialisation à long terme induite par stimulation 10-Hz chez les animaux adultes. C, Changements dans l'amplitude maximale de CPSIs, PPR et 1/CV2 suite à une stimulation de 10-Hz chez des animaux adultes.
Figure 15 : Implication de la sous-unité α5 du récepteur GABAA dans la plasticité à long
terme dans les synapses inhibitrices sur les interneurones O-LM
A, Enregistrements représentatifs (A1, B1) et données normalisées de groupe (A2, B2) d'amplitude de CPSIs obtenus à partir de souris sauvages (P26-40) en présence de L-655,708 (n = 6, A) et de souris Gabra5-/- (n = 3, B), montrant aucun effet significatif d‟une stimulation à 10-Hz en absence de la sous-unité α5 fonctionnelle. A3-B3, Changements dans l'amplitude des CPSIs, PPR et 1/CV2 suite à une stimulation de 10-Hz chez des animaux adultes de type sauvage en présence du L-655,708 (A3) et chez des animaux adultes Gabra5-/- (B3).
![Figure 4: Représentation schématique du récepteur GABA A [Modifiée de (Mihic et Harris, 1997)]](https://thumb-eu.123doks.com/thumbv2/123doknet/6266827.163422/14.918.363.597.109.400/figure-représentation-schématique-récepteur-gaba-modifiée-mihic-harris.webp)