Université de Sherbrooke
La distribution des sous-classes de HDL au cours du vieillissement et sa régulation par l’huile d’olive extra vierge
Par Roua Walha
Programmes de recherche en sciences de la santé
Mémoire présenté à la Faculté de médecine et des sciences de la santé en vue de l’obtention du grade de maitre ès sciences (M. Sc.)
en sciences de la santé
Sherbrooke, Québec, Canada Juin, 2017
Membres du jury d’évaluation
Abdelouhahed Khalil, Ph. D., directeur de recherche, Programmes de recherche en sciences de la santé
Alain Cohen, Ph. D., évaluateur interne, Programmes de recherche en sciences de la santé Ahmed Chraïbi, Ph. D., évaluateur externe, Programmes de physiologie
S
OMMAIRELa distribution des sous-classes de HDL au cours du vieillissement et sa régulation par l’huile d’olive extra vierge
Par Roua Walha
Programmes de recherche en sciences de la santé
Mémoire présenté à la Faculté de médecine et des sciences de la santé en vue de l’obtention du diplôme de maitre ès sciences (M.Sc.) en sciences de la santé, Faculté de médecine et des sciences de la santé, Université de Sherbrooke, Sherbrooke, Québec, Canada, J1H 5N4 Les maladies cardiovasculaires (MCV) représentent la principale cause de mortalité chez les personnes âgées. La diminution des niveaux plasmatiques (la quantité) du cholestérol HDL (HDL-C) est un facteur de risque indépendant pour les MCV. Cependant, les études récentes ont montré que l’augmentation du HDL-C par des moyens pharmacologiques n’apporte pas des effets bénéfiques sur le système cardiovasculaire. Ces résultats ont soulevé des doutes en ce qui concerne la relation causale entre les niveaux de HDL-C et les MCV suggérant ainsi, qu’il serait plus pertinent de cibler la qualité des HDL en plus de leur quantité afin de réduire le risque cardiovasculaire. Les effets bénéfiques de l’huile d’olive extra vierge (EVOO) sur les facteurs de risque traditionnels des MCV sont bien établis dans la littérature. Cependant, peu de données existent concernant l’effet de l’EVOO sur la qualité des HDL ou de la distribution des sous-classes de ces lipoprotéines chez les personnes âgées. Nos objectifs de recherche visent à déterminer l’effet du vieillissement sur la distribution des sous-classes de HDL et sa régulation avec une supplémentation en EVOO. Ce projet fait partie de l’étude LIPAGE qui est une étude quasi expérimentale avec un devis avant-après. Les participants en bonne santé ont été inclus et répartis dans deux groupes d’âge. Tous les participants ont été invités à enrichir leur diète avec l’huile d’olive d’EVOO pendant 12 semaines. La distribution des différentes sous-classes de HDL a été déterminée par le système Quantimetrix® Lipoprint. Nos résultats ont montré que bien que le niveau de HDL-C n’ait pas été significativement différent entre les deux groupes d’âge, le pourcentage des HDL de petite taille (HDL-P) était significativement plus élevé tandis que le pourcentage des HDL de grande taille (HDL-L) était significativement plus faible chez les personnes âgées. La supplémentation en EVOO a permis de baisser significativement la tension artérielle (TA) et les niveaux de triglycérides (TG) dans le groupe âgé. De plus, et sans avoir modifié le niveau de HDL-C, la supplémentation en EVOO a permis de diminuer significativement le pourcentage de HDL-P chez les personnes âgées en ramenant ainsi, le profil de distribution des sous-classes de leurs HDL à un profil moins athérogène et comparable à celui des jeunes. Nos résultats suggèrent de nouvelles voies mécanistiques par lesquelles l’EVOO peut apporter son effet bénéfique sur le système cardiovasculaire. Mots clés : maladies cardiovasculaires, athérosclérose, vieillissement, sous-classes de HDL, fonctionnalité des HDL.
S
UMMARYHDL subclasses distribution during aging and its regulation by extra virgin olive oil By
Roua Walha Health sciences Program
Thesis presented at the Faculty of medicine and health sciences for the obtention of Master degree diploma maitre ès sciences (M.Sc.) in Health sciences, Faculty of medicine and
health sciences, Université de Sherbrooke, Sherbrooke, Québec, Canada, J1H 5N4 Cardiovascular diseases (CVD) are still the leading cause of death in Canada and worldwide especially among the elderly. Although the inverse relationship between plasma levels of high-density lipoprotein (HDL-C) and cardiovascular disease has been largely demonstrated, new pharmacological interventions have yield to disappointing results about the benefits of raising HDL-C levels. These findings suggested that HDL quality is a more relevant target than their quantity for protection against CVD. Extra virgin olive oil (EVOO) has shown its beneficial effects on traditional cardiovascular risk factors. However, data on EVOO effects on HDL quality or subclasses distribution in elderly are scarce. Objective: We aimed in this study to assess the effect of aging on HDL subclasses distribution and its regulation by EVOO supplementation. This study was performed on subsample of healthy participants from the LIPAGE study that utilised a pretest-posttest quasi-experimental design. Participants were regrouped in two age groups. All the participants were asked to enrich their diets with olive oil (raw EVOO) during 12 weeks. HDL quality was determined by measuring the distribution of different HDL subclasses using the Quantimetrix® Lipoprint system. Our results show that age has no impact on HDL-C level. Nevertheless, the percent of small HDL (HDL-S) was significantly higher while the percent of large HDL (HDL-L) was significant lower in older subjects compared to young subjects. EVOO supplementation reduced significantly blood pressure (BP) and triglycerides (TG) levels. Moreover, EVOO supplementation improved HDL subclasses profile in the elderly group by decreasing significantly the percent of HDL-S without changing plasma HDL-C levels. Thus, HDL subclasses distribution profile (quality) in elderly became less atherogenic and comparable to that of young subjects. EVOO consumption improves the HDL quality related properties such HDL subclasses distribution that seems to be impaired during aging. These findings suggest a new pathway by which olive oil may exert its beneficial effect on cardiovascular system.
Keywords: cardiovascular diseases, atherosclerosis, aging, HDL subclasses, HDL functionality.
TABLE DES MATIÈRES
Sommaire ... ii
Summary ... iii
Table des matières ... iv
Liste des figures ... vi
Liste des tableaux ... vii
Liste des abréviations ... viii
Remerciement ... x
Premier chapitre : Introduction ... 1
1.1 Introduction générale : ... 1
1.2 Recension des écrits : ... 3
1.2.1 Athérosclérose : ... 3 1.2.1.1 Définition : ... 3 1.2.1.2 Épidémiologie : ... 3 1.2.1.3 Facteurs de risque : ... 4 1.2.1.4 Physiopathologie : ... 6 1.2.2 Les lipoprotéines : ... 10 1.2.2.1 Définition : ... 10
1.2.2.2 Types des lipoprotéines : ... 10
1.2.2.3 Les lipoprotéines et le transport des lipides : ... 11
1.2.2.4 Métabolisme général des lipoprotéines : ... 12
1.2.3 Les HDL ... 12
1.2.3.1 Structure et composition des HDL : ... 13
1.2.3.2 Formation et métabolisme des HDL : ... 13
1.2.3.3 Les sous-classes de HDL : ... 16
1.2.3.4 Rôle des HDL dans l’athérosclérose : (Quantité versus Qualité) ... 18
1.2.4 Vieillissement, maladies cardiovasculaires et HDL : ... 27
1.2.4.1 Vieillissement et maladies cardiovasculaires : ... 27
1.2.4.2 Vieillissement et HDL : ... 28
1.2.5 L’huile d’olive extra vierge (EVOO) : ... 29
1.2.5.1 Types de l’huile d’olive : ... 30
1.2.5.2 Composition chimique de l’huile d’olive : ... 31
1.2.5.4 L’effet de l’EVOO sur les HDL : ... 32
1.3 Projet de recherche : ... 34
Problématique : ... 34
Hypothèse : ... 35
Objectifs : ... 36
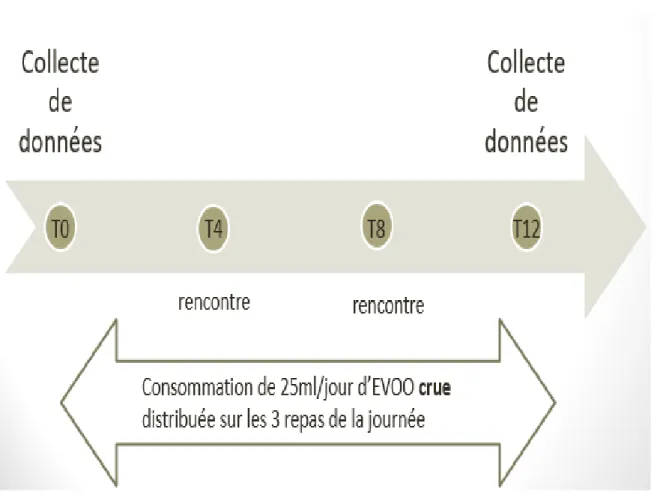
2 Deuxième chapitre : Matériels et Méthodes ... 36
2.1.1 Devis de recherche : ... 36 2.1.2 Population de l’étude : ... 36 2.1.3 Critères d’admissibilité : ... 37 2.1.4 Recrutement : ... 38 2.1.5 Déroulement de l’étude : ... 38 2.1.6 Variables de l’étude : ... 40 2.1.6.1 Variable indépendante : ... 40
2.1.6.2 Variables dépendantes et instrument de mesure : ... 40
2.1.7 Taille d’échantillon et analyses statistiques : ... 43
2.1.7.1 Taille d’échantillon : ... 43
2.1.7.2 Analyses statistiques : ... 44
2.1.8 Considérations éthiques : ... 45
3 Troisième chapitre : Résultats ... 46
3.1 Description de l’ensemble des participants : ... 46
3.2 Description des participants dans chaque groupe : ... 46
3.3 L’effet du vieillissement sur la distribution des HDL : ... 47
3.4 Effet de la supplémentation en EVOO sur les paramètres biochimiques chez les personnes jeunes et âgées : ... 50
3.5 Effet de la supplémentation en EVOO sur la distribution des sous-classes de HDL chez les personnes jeunes et âgées : ... 50
4 Quatrième chapitre : Discussion ... 51
4.1 Discussion des résultats : ... 51
4.2 Forces et limites : ... 59
5 Cinquième chapitre : Conclusion ... 61
Perspectives : ... 62
Références ... 64
L
ISTE DES FIGURESFigure 1 : Anatomie de la paroi artérielle ... 7 Figure 2 : Structure de la paroi artérielle (adaptée de« FEDECARDIO | Les artères et les veines ») ... 8 Figure 3 : Voies d’efflux du cholestérol des macrophages vers les HDL ... 22 Figure 4 : Déroulement de l’étude ... 39 Figure 5 : Résultat final du test Lipoprint pour la distribution des HDL pour un participant ... 42 Figure 6 : Distribution des HDL dans l’ensemble des participants, dans le groupe jeune et dans le groupe âgé à T0 ... Erreur ! Signet non défini. Figure 7 : Comparaison de la distribution des HDL entre les jeunes et les âgés à T0
... Erreur ! Signet non défini. Figure 8 : Effet de la supplémentation en EVOO sur la distribution des HDL dans le groupe des jeunes ... Erreur ! Signet non défini. Figure 9 : Effet de la supplémentation en EVOO sur la distribution des HDL dans le groupe des âgés ... Erreur ! Signet non défini. Figure 10 : Comparaison de la distribution des HDL entre les jeunes et les âgés à T12 ... Erreur ! Signet non défini.
L
ISTE DES TABLEAUXTableau 1 : Propriétés physicochimiques et rôles des lipoprotéines ... 11 Tableau 2 : Les différentes techniques et sous-classes de HDL ... 17 Tableau 3 : Critères d'inclusion et d’exclusion ... 37 Tableau 4 : Données anthropométriques et biochimiques de participants lors du
recrutement (à l’état basal ou T0) ... Erreur ! Signet non défini. Tableau 5 : Distribution des 10 différentes sous-classes de HDL chez les jeunes et les âgés à T0 ... Erreur ! Signet non défini. Tableau 6 : Corrélation entre l'âge et les HDL-L, HDL-I et HDL-P à T0 .... Erreur ! Signet non défini.
Tableau 7 Paramètres biochimiques des participants avant et après la supplémentation en EVOO ... Erreur ! Signet non défini. Tableau 8 Effet de la supplémentation en EVOO sur la distribution des HDL dans le
groupe des jeunes ... Erreur ! Signet non défini. Tableau 9 : Effet de la supplémentation en EVOO sur la distribution des HDL dans le groupe des âgés ... Erreur ! Signet non défini.
L
ISTE DES ABREVIATIONSABCA1 ATP-binding cassette tranporter sub-family A member 1 ABCG1 ATP-binding cassette tranporter sub-family G member 1
ADN Acide Désoxyribonucléique
AG Acide gras
Apo Apolipoprotéine
ATP III Adult Treatment Panel III
AVC Accident vasculaire cérebral
CDRV Centre de recherche sur le vieillissement CETP Colesterol Esterase Trasfert Protein
CHUS Centre hospitalier universitaire de Sherbrooke
CL Cholestérol libre
CT Cholestérol total
DM Diète méditerranéenne
EC Esters de cholestérol
ECG Électrocardiogramme
eNOS Endothelial nitric oxide synthase
EPIC European Prospective Investigation into cancer and Nutrition EROs Espèces réactives de l’oxygène
EVOO Extra virgin olive oil
FDA Food and drugs administration
HDL Lipoprotéine de haute densité
HDL-C HDL-cholestérol
HDL-I HDL de taille intermédiaire
HDL-L HDL de grande taille
HDL-P HDL de petite taille
HDL-TL HDL de très grande taille HDL-TP HDL de très petite taille
HO-PP Huile d’olive enrichie avec les polyphénols
HTA Hypertension artérielle
ICAM1 Molécule d’adhésion intercellulaire-1 IDL Lipoprotéine de densité intermédiaire
IMC Indice de masse corporelle
LCAT Lecithin cholesterol acyltransferase LDL Lipoprotéine de faible densité
LDL-C LDL-cholestérol
LDLR Récepteur des LDL
LIPAGE Lipides-Âge
MCV Maladie cardiovasculaire
NO Monoxyde d’azote
O2•- Anion superoxide
OH• Radical hydroxyl
OMS Organisation mondiale de la santé
ONOO Peroxynitrite
Ox-LDL LDL oxydée
PAF-AH Platelet activating factor-acetylhydrolase
PL Phospholipide
PLTP Phospholipid transfer protein
PP Polyphénols
PON1 Paraoxonase 1
PREDIMED Primary Prevention of Cardiovascular Disease with Mediterranean Diet
RL Radical libre
SAA Serum amyloid A
SR-B1 Récepteur scavenger-B1
TA Tension artérielle
TG Triglycérides
TIC Transport inverse du cholestérol
VCAM1 Molécule d’adhésion des cellules vasculaires 1 VLDL Lipoprotéine de très faible densité
Remerciement
Je tiens à adresser mes profonds remerciements et ma profonde reconnaissance en tout premier lieu au Professeur Abdelouahed Khalil mon directeur de recherche pour son appui, ses précieux conseils et son orientation ficelée depuis le tout premier jour jusqu’à la fin de la maîtrise. Ainsi que pour sa patience et sa confiance qui ont constitué un apport considérable sans lequel, ce travail n’aurait jamais pu être mené au bon port.
Je tiens à adresser mes remerciements les plus chaleureux aux chers membres du jury, Professeur Ahmed Chraibi et Professeur Alan Cohen, pour l’intérêt qu’ils ont porté à ma recherche en acceptant d’examiner ce travail et de l’enrichir par leurs précieuses propositions.
Mes vifs remerciements vont également au corps professoral et administratif de la Faculté de médecine et des sciences de la santé pour la qualité et la richesse de leur enseignement et pour les efforts qu’ils mettent pour nous garantir la continuité et l’aboutissement de ce programme de Maîtrise.
Qu’il me soit enfin permis de remercier ma famille et mes amis pour leurs encouragements et leur soutien constants.
Premier chapitre : Introduction
1.1 Introduction générale :
Aujourd’hui, selon l’OMS, partout dans le monde, l’espérance de vie atteint et dépasse 60 ans. Par conséquence, le nombre des personnes ayant 60 ans et plus ne cesse d’augmenter. On parle aujourd’hui du vieillissement de la population mondiale et le nombre de personne ayant 60 ans devrait doubler d’ici à 2050 (« OMS | Rapport mondial sur le vieillissement et la santé », 2015).
Le vieillissement est sur le plan biologique, le produit de l’accumulation d’un vaste éventail de dommages moléculaire et cellulaire au fil du temps. Ceci entraîne une dégradation progressive des capacités physiques et mentales, une majoration du risque de maladies et, enfin le décès (« OMS | Vieillissement et santé », 2015).
Les maladies cardiovasculaires (MCV) entre autres, définies comme l’ensemble de pathologies qui affectent le cœur et les vaisseaux sanguins, sont fortement associées au vieillissement et constituent une des principales causes de mortalité au Canada et dans le monde. De ce fait, le vieillissement de la population pèse lourd tant pour la société, sur le plan économique, que pour les individus en matière de qualité de vie.
Les MCV sont dans la majorité des cas les manifestations cliniques de l’athérosclérose. Celle-ci correspond à l’accumulation de lipides oxydés notamment des lipoprotéines de faible densité (LDL) oxydées dans les artères entraînant ainsi leur obstruction partielle ou totale.
Contrairement aux LDL, les lipoprotéines de Haute densité (HDL), ont de multiples fonctions antiathérogènes dont la principale fonction est le transport de l’excédent de cholestérol des cellules périphériques vers le foie où il va être éliminé. De ce fait, l’augmentation de la concentration plasmatique du cholestérol LDL ou (LDL-C), représente un facteur de risque pour les MCV alors que l’élévation des niveaux du
cholestérol HDL ou (HDL-C) est considérée comme un facteur protecteur. Par conséquent, le premier pas vers la gestion du risque cardiovasculaire constitue la diminution des
niveaux de LDL-C par les statines, des hypolipémiant qui sont couramment prescrits pour la prise en charge de la dyslipidémie et ainsi, pour la prévention des MCV. Les statines ont permis une réduction de 30 % du risque cardiovasculaire. Cependant, les MCV constituent toujours l’une des premières causes de mortalité dans le monde. Ainsi, les études
pharmacologiques se sont intéressées de plus en plus à l’augmentation des niveaux de HDL-C afin de réduire davantage le niveau de risque cardiovasculaire. Ces études ont montré que certaines interventions pharmacologiques ont permis d’augmenter
considérablement les taux de HDL-C. Toutefois, sur le plan clinique, les résultats ont été très décevants. Non seulement il n’y avait pas d’effets bénéfiques sur la santé mais il y avait aussi une augmentation des taux de mortalité associée à ces interventions
pharmacologiques. Ces résultats ont remis en question la pertinence de l’augmentation de la quantité des HDL (HDL-C) tout en mettant l’accent sur leur qualité. Cette dernière est définie par la capacité des HDL à assurer leurs fonctions antiathérogènes. Toutefois, il importe de savoir qu’il existe différentes sous-classes de HDL qui, en raison de leurs différences compositionnelles et structurales, n’ont pas la même capacité antiathérogène. En effet, plusieurs études ont montré qu’alors que les HDL de grande taille sont
inversement associées au risque cardiovasculaire, les HDL de petite taille sont positivement corrélées au risque de développement de MCV (Woudberg et al., 2016, Zhang, Li, Xu, Guo, et al., 2015). De ce fait, la distribution des sous-classes de HDL représente aujourd’hui, un nouveau biomarqueur pertinent tant pour évaluer le risque cardiovasculaire que pour évaluer les effets des interventions ou des stratégies de prévention sur la modulation du risque cardiovasculaire.
En termes de prévention, l’adoption d’un mode de vie sain et notamment de bonnes habitudes alimentaires constitue une première étape à entreprendre pour réduire le risque cardiovasculaire. En lien avec cela, nombreuses sont les études qui ont montré l’intérêt de la diète méditerranéenne dans la diminution de l’incidence des MCV. L’effet bénéfique de cette diète a été attribué en partie, à sa richesse en huile d’olive extra vierge (EVOO) qui est non seulement une source d’acides gras monoinsaturés mais présente aussi une haute teneur en antioxydants notamment en polyphénols. L’effet de l’huile d’olive sur les biomarqueurs de risque habituels comme la tension artérielle et la dyslipidémie a été bien établi dans la littérature (Fitó et al., 2005, Hohmann et al., 2015, Oliveras-López et al.,
2013, Covas et al., 2006). Mais son effet sur la qualité ou la distribution des sous-classes de HDL surtout chez les personnes âgées reste à explorer.
Ce projet vise à comprendre et à déterminer l’effet de l’âge sur la distribution des sous-classes de HDL et l’effet de l’EVOO sur sa régulation au cours du vieillissement.
1.2 Recension des écrits :
1.2.1 Athérosclérose : 1.2.1.1 Définition :
L’athérosclérose est une pathologie chronique qui touche les artères de grand et de moyen calibre et qui correspond à l’accumulation des lipides et d’éléments fibreux sous forme de plaques dans la paroi artérielle (Fruchart & Duriez, 2008).L’athérosclérose est définie selon l’OMS comme étant « une association variable de remaniements de l'intima des artères de gros et moyens calibres, consistant en une accumulation focale de lipides, de glucides complexes, de sang et de produits sanguins, de tissu fibreux et de dépôts calcaires, le tout s'accompagnant de modifications de la média » (OMS, 1954). Les premières lésions athérosclérotiques apparaissent dès l’enfance mais restent sans conséquences cliniques. En vieillissant, beaucoup de facteurs s’intriguent et entrent en jeux pour que ces lésions évoluent et s’aggravent entraînant ultimement, le blocage (ou sténose) partiel ou total des artères qui irriguent le cœur et le cerveau. Ce blocage résulte ainsi, au développement des maladies cardiovasculaires (MCV) dont les plus courantes sont l’infarctus du myocarde, l’accident vasculaire cérébral (AVC) et l’artériopathie périphérique.
1.2.1.2 Épidémiologie :
Selon statistique Canada, les maladies de cœur et les AVC constituent ensemble la 2ème cause de mortalité au Canada, représentant 25,2 % de tous les décès en 2011 (« Le portail canadien des pratiques exemplaires – PCPE », 2016).
Sur le plan économique, ces maladies représentent un véritable enjeu que ce soit sur les individus, leurs proches, leurs communautés ou sur le système de soins de santé Canadien. En l’an 2000, les coûts directs et indirects associés aux MCV s’élevaient à environ 22,2
milliards de dollars, soit le deuxième rang au chapitre des coûts juste derrière les troubles musculo-squelettiques (« Le portail canadien des pratiques exemplaires – PCPE », 2016).
1.2.1.3 Facteurs de risque :
L’athérosclérose est une pathologie multifactorielle. Les facteurs de risque qui y sont associés sont nombreux et se classent dans deux catégories soient : les facteurs de risque non modifiables comme l’âge, le sexe et les antécédents familiaux, et les facteurs de risque modifiables tels que les mauvaises habitudes de vie notamment la mauvaise alimentation, l’inactivité physique et le tabagisme qui se traduisent chez les individus par la dyslipidémie, le diabète, l’obésité et l’hypertension artérielle.
• Facteurs de risque non modifiables :
- L’âge : L’âge est un facteur de risque indéniable pour les MCV. Le risque d’atteinte d’une maladie cardiovasculaire augmente en vieillissant. En 2009, le nombre de décès secondaires à une MCV était de 722 décès chez les personnes âgées entre 25 et 45 ans versus 41 634 décès chez les personnes âgée de 65 ans et plus (Statistique Canada, 2015). Il faut souligner que le risque de survenue d’une MCV sur dix ans augmente, à chaque cinq ans, d’un point selon le score de risque Framingham (Dhingra & Vasan, 2012).
- Le sexe : Les hommes âgés de moins de 65 ans sont presque trois fois plus susceptibles de mourir d’une MCV que les femmes du même âge (« Le portail canadien des pratiques exemplaires – PCPE », 2016). En effet, les taux de mortalité associés aux MCV augmentent nettement chez les hommes après l’âge de 45 ans alors que chez les femmes le risque de mortalité augmente après l’âge de 55 ans (« Le portail canadien des pratiques exemplaires – PCPE », 2016).
- Les antécédents familiaux : Le fait d’avoir un parent qui a eu une MVC avant l’âge de 55 ans pour le père et avant 65 ans pour la mère, augmente le risque d’avoir une MCV de 60 à 70 % (Kolber & Scrimshaw, 2014).
- La génétique : La génétique est aussi un facteur prédisposant aux MCV. Cela peut être le résultat d’un polymorphisme qui touche un ou plusieurs gènes du système rénine-angiotensine provoquant ainsi l’hypertension artérielle (Ji-Guang Wang, 2000).
• Facteurs de risque modifiables :
- La dyslipidémie : La dyslipidémie est l’un des principaux facteurs de risque pour les MCV. Elle correspond à l’altération des taux de lipides sanguins notamment, l’augmentation des taux de cholestérol total (CT), du cholestérol LDL (mauvais cholestérol) et des triglycérides (TG) et la diminution des taux du cholestérol HDL (bon cholestérol) (Tomé-Carneiro & Visioli, 2016). Les résultats de l’étude de Framingham ont montré que le risque cardiovasculaire augmente considérablement avec l’augmentation du LDL-C et la diminution du HDL-C soulignant que cette dernière a une plus forte association avec le niveau de risque cardiovasculaire (T. Gordon et al., 1977).
- L’hypertension artérielle (HTA) : est aussi l’un des plus importants facteurs de risque associés aux MCV. Selon les études, l’HTA contribue au développement des maladies du cœur chez 50-60% des patients (Kamran Riaz et al., 2014). De plus, les hommes et les femmes hypertensifs sont deux à trois fois plus à risque de l’insuffisance cardiaque que les personnes ayant une tension artérielle normale (Kamran Riaz et al., 2014).
- L’obésité : L’obésité (IMC >30) pour sa part, elle s’accompagne toujours avec d’autres comorbidités comme l’hypertension, le diabète, l’hyperglycémie et d’hyperlipidémie qui amplifient tous ensemble le risque d’atteinte d’une MCV (Hubert et al., 1983).
- Le diabète : est bien établi comme un facteur de risque majeur pour les MCV du fait qu’il s’accompagne lui aussi avec d’autres comorbidités comme la dyslipidémie, l’obésité et l’hypertension artérielle (Pyörälä et al., 1985, Martín-Timón et al., 2014)
- Le tabagisme : à son tour, est en tête de liste des facteurs de risque. En effet, les fumeurs sont deux fois plus exposés au risque d’un AVC que les non-fumeurs (Shinton & Beevers, 1989).
En terme de prévention, les études observationnelles ont montré qu’adopter de bonnes habitudes de vie comme l’arrêt du tabac, la pratique régulière du sport et l’adoption d’une alimentation saine, réduit le risque de survenue d’évènements cardiovasculaires de 60% à 80 % (Anderson et al., 2016).
1.2.1.4 Physiopathologie :
a. Structure de la paroi artérielle normale :
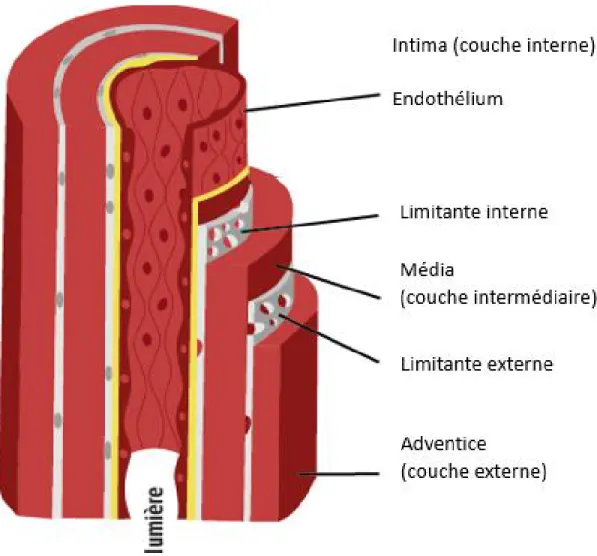
La paroi artérielle est composée de trois couches séparées de deux couches élastiques soient, la limitante interne et la limitante externe (Bonnet, 2005). De l’extérieur vers l’intérieur on trouve :
• L’adventice : c’est la couche externe, qui est composée essentiellement de fibres de collagène, de fibres élastiques et des fibroblastes. L’adventice assure l’ancrage des artères aux structures voisines.
• La media : correspond à la couche intermédiaire. Elle est formée de cellules musculaires lisses et de constituants extracellulaires : collagène, élastine et protéoglycanes. C’est la couche qui définit l’élasticité de l’artère et qui lui permet de changer son calibre.
• L’intima : ou la couche interne, est formée de collagène et recouverte par une couche de cellules endothéliales imperméable appelée l’endothélium qui est en contact direct avec le sang et tous les constituants qu’il transporte (Figure 1).
Figure 1: Anatomie de la paroi artérielle
La paroi artérielle est formée de trois couches : la couche interne ou l’intima, la couche intermédiaire ou la média et la couche externe ou l’adventice. L’intima et la média sont séparées par la limitante élastique interne alors que la média et l’adventice sont séparées par la limitante élastique externe. Empruntée de www.fedecardio.org avec l’autorisation de la Fédération française de cardiologie.
b. Rôle physiologique de l’endothélium :
À l’état physiologique, l’endothélium, activé par les forces de cisaillement générées par le flux du sang sur la paroi artérielle (Raij, 2006), secrète une substance vasoactive ou le monoxyde d’azote (NO). Le NO joue un rôle important dans le maintien de l’intégrité de l’artère. En effet, cette substance stimule la vasodilatation et inhibe l’expression des molécules d’adhésion, l’agrégation plaquettaire et la prolifération des cellules musculaires lisses de la média qui sont toutes des étapes fondamentales du processus athérosclérotique (Galley & Webster, 2004, Félétou, 2011). L’endothélium est donc plus qu’une barrière imperméable. Ainsi, son altération ou la dysfonction endothéliale, aura des conséquences graves sur le système cardiovasculaire (Sandoo et al., 2010).
c. La dysfonction endothéliale :
La dysfonction endothéliale correspond à la diminution de la biodisponibilité du NO qui peut être due soit à une diminution de la production du NO soit à sa réaction avec d’autres espèces réactives de l’oxygène (EROs), pour former le peroxynitrite (ONOO-) (Puissant et al., 2014). Une telle réaction ne se produit que lors d’un état oxydant avancé. La dysfonction endothéliale est aggravée par les facteurs de risque qui ont été décrits précédemment.
d. Le stress oxydant :
Le stress oxydant est un état de déséquilibre entre les antioxydants et les pro-oxydants ou les EROs appelés aussi les radicaux libres (RL)(J. Haleng et al., 2007). Les RL dérivent du métabolisme de l’oxygène dans les mitochondries. En effet, environ 2 % de l’oxygène consommé au niveau des mitochondries sera transformé en RL (Migdal & Serres, 2011). Un RL est une molécule instable qui présente à sa surface un électron libre comme par exemple l’anion superoxyde (O2•-) et le radical hydroxyle (OH•).
Les RL ont un double rôle. En fonction de leur concentration, ils peuvent avoir un rôle bénéfique ou toxique ( Haleng et al., 2007). En effet, à l’état physiologique, les RL sont produits en faible quantité et jouent un rôle important dans la bio-signalisation et la protection de l’organisme contre les organismes pathogènes ( Haleng et al., 2007). Lorsqu’ils sont en excès, les RL présentent un effet néfaste en activant l’expression des molécules d’adhésion et des gènes codants pour des cytokines pro-inflammatoires ( Haleng et al., 2007).
De plus, leur caractère instable favorise leur interaction avec les différents substrats biologiques comme l’ADN, les protéines, les lipides membranaires et les lipoprotéines, et l’induction des altérations oxydatives aboutissant à la dégénérescence et la mort cellulaire. L’accumulation de ces altérations au fils du temps contribue à l’apparition des différentes pathologies liées au vieillissement comme l’athérosclérose et ses manifestations cliniques (Migdal & Serres, 2011). La production des RL augmente considérablement au cours du vieillissement et en présence de facteurs de risque comme le tabagisme, le diabète, l’hypertension, et les mauvaises habitudes de vie (Jacques & Dominique, 2007). Les RL jouent un rôle important dans les différentes étapes de l’athérosclérose (Jacques et al., 2007).
e. Étapes de l’athérosclérose :
Les lipides, notamment le cholestérol et ses transporteurs plasmatiques ou les lipoprotéines LDL et HDL jouent un rôle central dans l’athérosclérose. En effet, la première étape du processus athérosclérotique, correspond à la pénétration et à l’accumulation des LDL dans la paroi artérielle sous l’endothélium. Une fois en contact avec les cellules endothéliales et/ou les cellules musculaires du média et sous l’effet des RL qu’elles produisent, les LDL sont oxydées. Ces LDL oxydées stimulent l’expression des molécules d’adhésion (ICAM1 et VCAM1) sur la surface endothéliale ce qui facilite l’accrochage des cellules inflammatoires comme les monocytes qui pénètrent par la suite sous l’endothélium et à ce niveau, elles se transforment en macrophages (Tedgui & Mallat, 2001). Les macrophages internalisent le cholestérol contenu dans les LDL oxydées contribuant ainsi, à l’épuration du cholestérol accumulé dans la paroi artérielle. Cependant, la captation de ce cholestérol se fait via un récepteur spécifique pour les LDL oxydées qui, à l’inverse du récepteur des LDL normales, n’est pas retro-inhibé par le contenu de cholestérol intracellulaire (De Winther et al., 2000, (Ingueneau, 2010). Comme résultat, les macrophages captent le cholestérol d’une façon excessive et se transforment en cellules spumeuses remplies de cholestérol, qui s’accumulent dans les parois artérielles pour former les stries lipidiques caractéristiques de l’athérosclérose (Tontonoz et al. 1998, (Ingueneau, 2010) Par la suite, en réponse à différents stimuli athérogènes induit par la présence des LDL oxydées et des médiateurs inflammatoires (Coatrieux et al., 2007, Schönbeck et al., 2000), les cellules musculaires de la media migrent,
prolifèrent dans l’intima et synthétisent du collagène formant ainsi la chape fibreuse qui recouvrira les stries lipidiques et ensemble ils forment la plaque d’athérosclérose.
La plaque ainsi formée diminue le diamètre de l’artère mais peut rester « silencieuse » pendant des mois ou des années sans risque majeur pour la santé, ou se compliquer brutalement pour former une thrombose qui se manifeste cliniquement par l’infarctus du myocarde, les AVC et les ischémies aigues des membres inférieurs (Dzau, 1994). La formation du thrombus résulte de l’agrégation plaquettaire à la surface de la plaque activée par la rupture de la plaque d’athérosclérose (Sumi et al., 2010).
1.2.2 Les lipoprotéines : 1.2.2.1 Définition :
Les lipides sanguins, comme le cholestérol, les triglycérides (TG) et les phospholipides constituent une source importante d’énergie et ils sont essentiels pour le métabolisme et le renouvèlement tissulaire. Toutefois, en raison de leur caractère hydrophobe, ces lipides sont délivrés aux cellules dans des macromolécules appelées les lipoprotéines. Celles-ci ont généralement une forme sphérique dont le noyau est formé de TG et d’esters de cholestérol (EC) et la surface est constituée de protéines ou apolipoprotéines (Apo), de phospholipides (PL) et de cholestérol libre (CL).
1.2.2.2 Types des lipoprotéines :
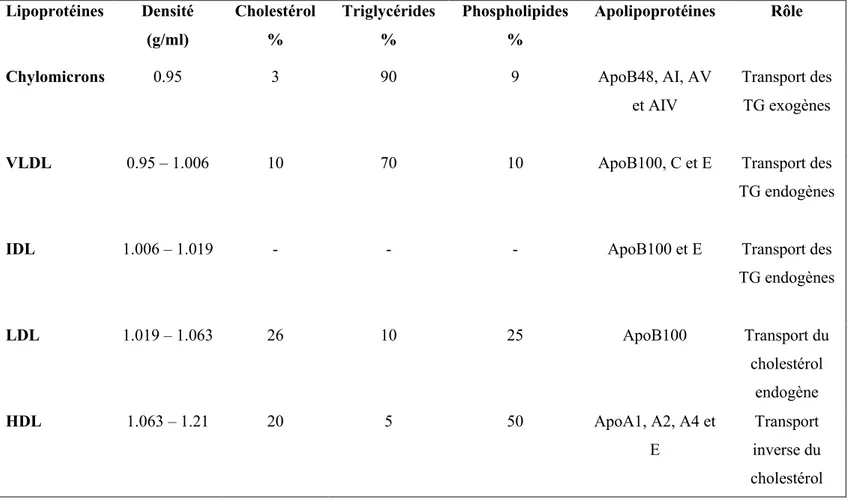
Il existe cinq types de lipoprotéines qui diffèrent par leurs propriétés physicochimiques comme la taille, la densité et leur contenu en lipides et en protéines, et par leurs fonctions. On distingue les chylomicrons, les VLDL, les lipoprotéines de densité intermédiaire (IDL), les lipoprotéines de faible densité (LDL) et les lipoprotéines de haute densité HDL (Tableau 1). Dans ce travail nous nous intéressons particulièrement aux HDL.
Tableau 1 : Propriétés physicochimiques et rôles des lipoprotéines Lipoprotéines Densité (g/ml) Cholestérol % Triglycérides % Phospholipides % Apolipoprotéines Rôle
Chylomicrons 0.95 3 90 9 ApoB48, AI, AV
et AIV
Transport des TG exogènes
VLDL 0.95 – 1.006 10 70 10 ApoB100, C et E Transport des
TG endogènes
IDL 1.006 – 1.019 - - - ApoB100 et E Transport des
TG endogènes LDL 1.019 – 1.063 26 10 25 ApoB100 Transport du cholestérol endogène HDL 1.063 – 1.21 20 5 50 ApoA1, A2, A4 et E Transport inverse du cholestérol
VLDL : lipoprotéines de très faible densité, IDL : lipoprotéines de densité intermédiaire, LDL : lipoprotéines de faible densité, HDL : lipoprotéines de haute densité. (Cox & García-Palmieri, 1990, Feingold & Grunfeld, 2000)
1.2.2.3 Les lipoprotéines et le transport des lipides :
Le rôle principal des lipoprotéines est le transport de lipides dans le sang. On distingue trois voies de transport de lipides :
- La voie exogène : qui est assurée par les chylomicrons et elle correspond au transport des lipides exogènes provenant de l’alimentation, essentiellement les TG, de l’intestin vers le foie.
- La voie endogène : elle représente le transport des lipides endogènes (TG et cholestérol), du foie vers les tissus périphériques. Les VLDL et LDL sont les lipoprotéines qui sont responsables du transport endogène des lipides.
- La voie de retour : appelée aussi le transport inverse du cholestérol (TIC) correspond au transport du cholestérol excédentaire des tissus périphériques vers le foie afin d’être éliminé. Le TIC est assuré par les HDL et constitue leur principale fonction anti-athérosclérotique.
1.2.2.4 Métabolisme général des lipoprotéines :
Les acides gras (AG) provenant de l’hydrolyse des lipides alimentaires, entrent dans les cellules intestinales via les transporteurs des AG. À ce niveau, ils sont assemblés en TG qui ensemble avec les esters de cholestérol et l’apoB48, forment les chylomicrons. Une fois formés, les chylomicrons sont secrétés dans la circulation sanguine et à ce niveau, leur contenu en TG est hydrolysé par la lipase des lipoprotéines (LPL) en AG afin d’être utilisés par les cellules périphériques en tant que source d’énergie, ou d’être stockés dans les adipocytes. Les chylomicrons rémanents appauvris en TG, sont reconnus et captés au niveau du foie par le récepteur des LDL.
Dans les cellules hépatiques, les TG sont assemblées avec les esters de cholestérol et l’apoB100 pour former les VLDL. Les TG contenus dans les VLDL sont hydrolysés en AG par la LPL et les résidus des VLDL (IDL) sont hydrolysés à leur tour par la lipase hépatique (LH) donnant finalement les LDL. Les LDL sont caractérisées par leur richesse en cholestérol. Contrairement aux HDL, les LDL jouent un rôle important dans la pathogénèse de l’athérosclérose d’où leur appellation du « mauvais Cholestérol ».
1.2.3 Les HDL
Comme il a été mentionné en introduction, dans ce mémoire nous nous intéressons aux HDL. Ainsi, leur structure, composition, métabolisme et fonctions vont être détaillés dans ce qui suit.
1.2.3.1 Structure et composition des HDL :
Les HDL sont les plus denses et les plus petites lipoprotéines et leur haute densité revient à leur richesse en protéines. En effet, les HDL sont composées de 2-10 % de cholestérol libre, 15-30 % d’esters de cholestérol (EC), 26-46% de phospholipides (PL), 3-15 % de TG et de 55 % de protéines qui sont principalement :
- Des apolipoprotéines (Apo) : les Apo majoritaires des HDL sont essentiellement l’apoA-1 et l’apoA-2 qui représentent 70 % et 20 % du contenu de HDL en protéines respectivement. En troisième et quatrième rangs on trouve, l’apoA-4 et l’ApoE.
- Des enzymes : comme la Lecethin cholesterol acyltrasferase (LCAT), la Paroxonase1 (PON1) et la Platelet-activating factor hydrolase (PAF-AH) ;
- Des transporteurs de lipides : tels que la Phospholipid Transfer Protein (PLTP) et la Cholestero Ester Transfer Protein (CETP) ;
- Des protéines dites mineures.
Ces protéines ont un rôle fondamental et permettent aux HDL d’assurer leurs fonctions antiathérogènes.
1.2.3.2 Formation et métabolisme des HDL :
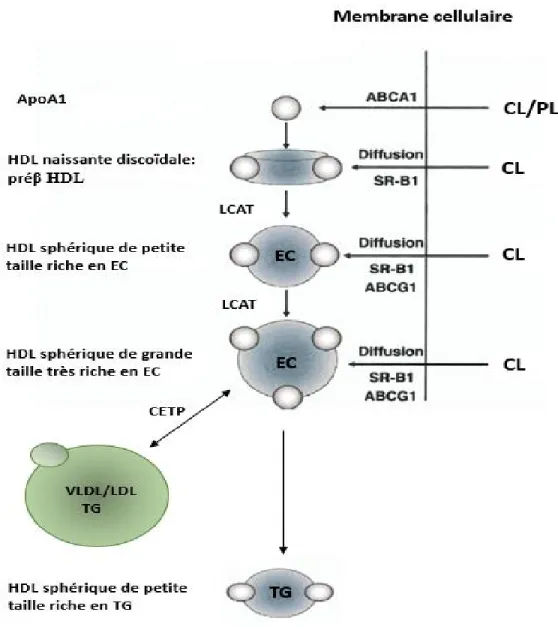
La formation des HDL matures nécessite la succession de plusieurs étapes. La première étape consiste en la sécrétion de l’apoA-1 par l’intestin ou par le foie (Feingold & Grunfeld, 2000). Une fois secrétée, l’apoA-1 interagi avec les hépatocytes et les entérocytes via le transporteur ATP-Binding Cassette Transporter sub-family A member 1 (ABCA1) pour acquérir du cholestérol et des phospholipides, formant ensemble les HDL naissantes ou préβ-HDL. Ces HDL naissantes interagissent avec les autres tissus périphériques comme les muscles, les adipocytes et toute autres cellules qui expriment à leurs surfaces l’ABCA1. Ainsi, les HDL naissantes s’enrichissent en cholestérol et augmentent de taille. Par la suite, sous l’effet de la LCAT, une enzyme liée aux HDL, leur cholestérol de surface est estérifié et migre vers le noyau résultant en la formation de HDL matures de forme sphérique qui peuvent communiquer à leur tour avec les cellules périphériques et acquérir plus de cholestérol via le Scavenger receptor class B (SR-B1) et/ou le ATP-binding cassette sub-family G member 1 (ABCG1). Aussi, ces HDL matures communiquent avec les autres types de lipoprotéines comme les VLDL et les LDL via la CETP, en échangeant leurs contenus en EC contre les
TG. Cet échange de lipides diminuera à la fois la taille des HDL et aussi leur concentration plasmatique (Feingold & Grunfeld, 2000) (Figure 2).
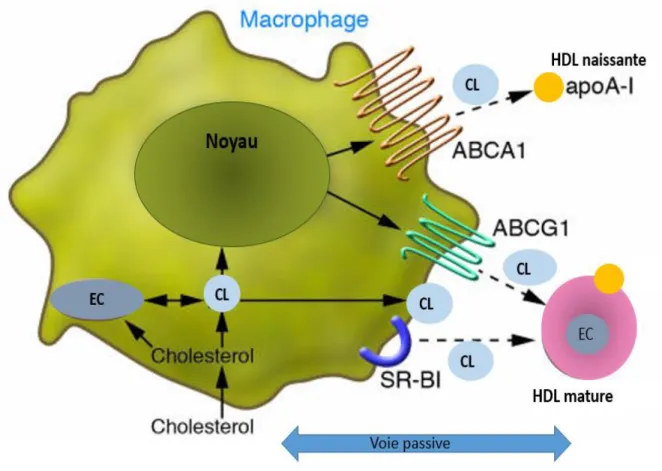
Figure 2 : Métabolisme des HDL
L’apoA1 secrétée par l’intestin ou par le foie interagi avec les cellules périphériques via le transporteur ABCA1 pour acquérir du CL et des PL et forment ensembles les HDL naissantes de forme discoïdale (préβ HDL). Par la suite CL de surface de ces HDL naissantes estérifier via la LCAT et migre vers le noyau des particules résultant à la formation de HDL matures de forme sphérique qui peuvent communiquer et acquérir du cholestérol depuis les cellules périphériques via SR-B1 et/ou ABCG1. Les HDL matures communiquent aussi avec les LDL et les VLDL via la CETP en échangeant leur contenu en EC contre des TG et ainsi, leur taille diminue.
CL : cholestérol libre; EC : esters de cholestérol; PL : phospholipides; ABCA1: ATP-binding cassette-class A1, SR-B1: scavenger receptor class B1; ABCG1: ATP-binding cassette class G1; ApoA1: apoliporotéine A1. Empruntée et adaptée de (Link, Rohatgi, & de Lemos, 2007) avec l’autorisation de Elsevier et Copyright clearance Center.
1.2.3.3 Les sous-classes de HDL :
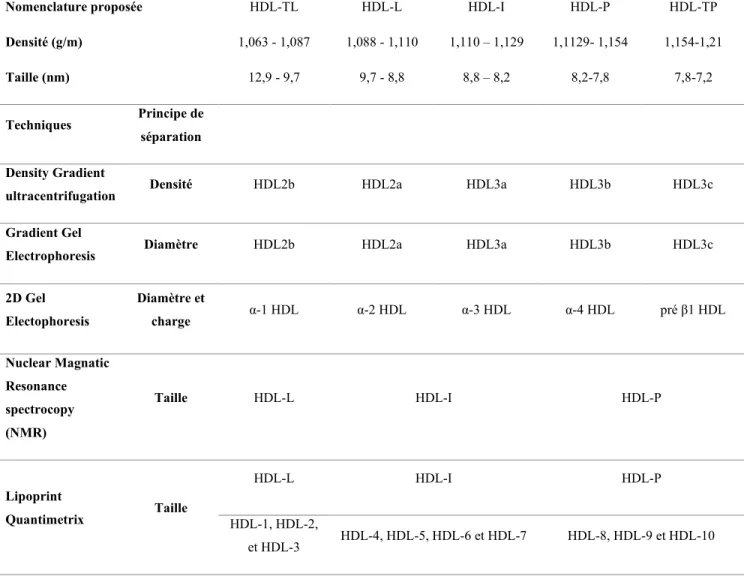
Le métabolisme complexe des HDL résulte en la formation de différentes sous-classes de HDL qui diffèrent aussi bien par leurs propriétés physicochimiques (taille, densité, charge, contenu en lipides (cholestérol et TG) et en protéines (Apo), que par leur capacité à assurer leurs fonctions biologiques (Eren et al., 2012). Généralement, les HDL sont groupées en deux classes soient, les HDL2 et les HDL3 (Salonen et al., 1991, Eren et al., 2012). Les HDL2 sont plus grandes et moins denses que les HDL3 (Salonen et al., 1991a). Ces deux principales classes de HDL peuvent elles-mêmes être fractionnées en différentes sous-classes et différentes méthodes sont utilisées pour les identifier :
- L’ultracentrifugation : est le premier outil qui a été utilisé, elle permet de différencier cinq différentes sous classe de HDL et ce, en fonction de leurs densités. Des moins aux plus denses on trouve, les HDL2b, HDL2a, HDL3a HDL3b et HDL3c (Camont et al., 2011, Rosenson et al., 2011).
- L’électrophorèse sur gel 2D : classifie les HDL en cinq différentes sous classes en fonction de leurs charges (α ou β) et de leurs diamètres. Des plus grandes aux plus petites sont : les préβ1 HDL (très petite, de forme discoïdale et de mobilité β), les α-4 HDL (très petites, de forme discoïdale et de mobilité α), les α-3 HDL (petites, de forme sphérique et de mobilité α), les α-2 HDL (de taille intermédiaire avec une forme sphérique et de mobilité α), les α-1 HDL (de grande taille avec une forme sphérique et de mobilité α) (Camont et al., 2011).
- La Résonance Magnétique Nucléaire (NMR) : permet quant à elle d’identifier trois sous-classes de HDL en fonction de leur taille soient, les HDL-Larges, les HDL-intermédiaires et les HDL-petites (Camont et al., 2011).
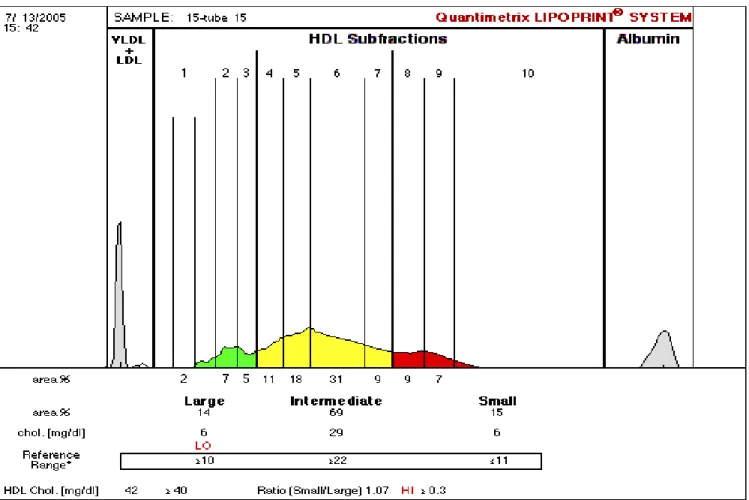
- Le Système Lipoprint Quantimetrix : est la technique la plus récente. Elle permet de déterminer jusqu’à dix différentes sous-classes de HDL en fonction de leurs tailles et de les regrouper en Large (1 à 3), Intermédiaire (4 à 7) et HDL-Petite (HDL-8 à 10) (Oravec et al., 2011).
Tableau 2 : Les différentes techniques et sous-classes de HDL Les différentes classes des HDL
Nomenclature proposée Densité (g/m) Taille (nm) HDL-TL 1,063 - 1,087 12,9 - 9,7 HDL-L 1,088 - 1,110 9,7 - 8,8 HDL-I 1,110 – 1,129 8,8 – 8,2 HDL-P 1,1129- 1,154 8,2-7,8 HDL-TP 1,154-1,21 7,8-7,2 Techniques Principe de séparation Density Gradient
ultracentrifugation Densité HDL2b HDL2a HDL3a HDL3b HDL3c
Gradient Gel
Electrophoresis Diamètre HDL2b HDL2a HDL3a HDL3b HDL3c
2D Gel Electophoresis Diamètre et charge α-1 HDL α-2 HDL α-3 HDL α-4 HDL pré β1 HDL Nuclear Magnatic Resonance spectrocopy (NMR) Taille HDL-L HDL-I HDL-P Lipoprint Quantimetrix Taille HDL-L HDL-I HDL-P HDL-1, HDL-2, et HDL-3 HDL-4, HDL-5, HDL-6 et HDL-7 HDL-8, HDL-9 et HDL-10
HDL très large TL), HDL large L), HDL intermédiaires I), HDL petites (HDL-P), HDL très petites (HDL-TP) (Hafiane & Genest, 2015)
1.2.3.4 Rôle des HDL dans l’athérosclérose : (Quantité versus Qualité)
Il importe de distinguer deux caractéristiques concernant les HDL ; 1) La quantité des HDL qui revient à la concentration plasmatique du cholestérol HDL circulant (HDL-C) et 2) la qualité des HDL qui correspond à la capacité des HDL à assurer leurs fonctions antiathérogènes (Eren et al., 2012).
a. Association entre la quantité des HDL et les maladies cardiovasculaires :
Plusieurs études épidémiologiques et cliniques ont démontré l’association inverse entre les niveaux de HDL-C et le niveau de risque cardiovasculaire (Movva & Rader, 2008). L’étude Framingham est la première à confirmer que la diminution des niveaux de HDL-C en bas de la valeur physiologique (1.034 mmol/L) permet de prédire la survenue d’évènements cardiovasculaires indépendamment des autres facteurs de risque comme l’augmentation des niveaux de CT, des TG et de LDL-C (Castelli et al., 1986). D’autres études ont montré que chez les personnes ayant des niveaux de HDL-C < 0.9 mmol/L, l’incidence des MCV est huit fois plus élevée que chez les personnes qui ont un HDL-C > 1.68 mmol/L (Assmann et al., 1996, Goldbourt et al., 1997). De même, les résultats d’une méta-analyse incluant quatre grandes études, ont montré qu’une augmentation de 0.026 mmol/L de HDL-C est associée à une réduction de 1,9 à 2,3 % du risque de développement de MCV chez les hommes et de 3,2 % chez les femmes (Gordon et al., 1989). Toutefois, certains syndromes génétiques comme par exemple la déficience en LCAT connue sous le nom de Fish-eye disease ou Maladie de Norum, bien qu’elle entraîne une diminution importante du HDL-C (<0.39 mmol/L), elle n’était pas associée à l’augmentation du risque cardiovasculaire chez les personnes qui en sont atteintes (Shah, 2011, Eren et al., 2012). Aussi, dans ce même sens, les études pharmacologiques récentes ont montré des résultats décourageants concernant l’intérêt de l’augmentation des niveaux de HDL-C dans la diminution du niveau de risque cardiovasculaire. Une des stratégies qui permettent l’augmentation du HDL-C est l’inhibition de la CETP (Joy & Hegele, 2008).
La CETP est une enzyme associée aux HDL qui leur permet d’échanger leurs contenus en cholestérol contre les TG contenues dans les VLDL et les LDL, résultant à la formation de HDL riches en TG. Ces dernières sont facilement hydrolysées par la lipase hépatique et éliminées de la circulation, diminuant ainsi, les niveaux de HDL-C (Parini & Rudel, 2003).
En plus de cet échange hétérotopique, la CETP permet un transfert homotypique de cholestérol entre les sous classes de HDL, notamment entre les HDL 2, les HDL 3 et les pré β HDL.
Il a été démontré que la déficience en CETP entraîne l’augmentation du HDL-C, la diminution du LDL-C et le ralentissement dans le développent de l’athérosclérose (Parini & Rudel, 2003). De ce fait l’inhibition de la CETP représentait une stratégie prometteuse pour la réduction du risque de développement de MCV.
Le Torcetrapib fut le premier inhibiteur de la CETP à être développé. Cette molécule se lie à la CETP en inhibant complètement son activité incluant le transfert hétérotopique et homotypique des lipides (Mohammadpour & Akhlaghi, 2013). Le Torcetrapib représente l’un des exemples pour l’échec des inhibiteurs de la CETP dans la réduction du risque cardiovasculaires. Dans l’ILLUMINATE, une des plus larges études incluant près de 15,000 participants, l’administration du Torcetrapib chez des patients à haut risque cardiovasculaire traités par les statines, a permis une augmentation de 72 % des niveaux plasmatiques de HDL-C (Barter et al., 2007). Cependant, cette augmentation a été paradoxalement associée à une élévation des taux de mortalité et de morbidité dans le groupe traité au Torcetrapib ce qui a mené à l’interruption prématurée de l’étude (Barter et al., 2007).
Le Dalcetrapib, est un autre inhibiteur de la CETP. Ce médicament entraîne un changement de conformation de la CETP et inhibe partiellement son activité en bloquant l’échange de lipides entre les HDL, les LDL et les VLDL et en maintenant le transfert des esters de cholestérol entre les différentes sous classes de HDL (Mohammadpour & Akhlaghi, 2013). Le Dalcetrapib a permis lui aussi l’augmentation du niveau de HDL-C dans différents essais cliniques. Son administration aux patients n’a pas montré des effets indésirables mais encore moins d’effets bénéfiques sur le risque d’incidence des MCV. De ce fait, le développement du Dalcetrapib a été interrompu en 2012 (Pirillo et al., 2013).
Une étude plus récente évaluant deux autres inhibiteurs de la CETP notamment l’Anacetrapib et l’Evacetrapib qui ont le même mécanisme que le Torcetrapib (Mohammadpour & Akhlaghi, 2013), a montré aussi des résultats décourageants comme l’induction de la dysfonction endothéliale chez les souris (Simic et al., 2017). Les résultats de cette dernière études devraient confirmer ainsi, l’impertinence de cette stratégie thérapeutique (Simic et al., 2017).
En résumé, l’échec des inhibiteurs de la CETP dans la réduction du risque cardiovasculaire a montré que l’augmentation drastique du niveau de HDL-C ne serait pas suffisante à elle seule pour réduire le risque cardiovasculaire suggérant qu’il serait plus pertinent de cibler et d’améliorer la qualité ou la fonctionnalité des HDL en plus de leur quantité en vue de prévenir le risque de développement de MCV (Pirillo et al., 2013).
b. Association entre la qualité des HDL est les maladies cardiovasculaires :
❖ Les fonctions biologiques des HDL :
Les HDL ont de nombreuses fonctions antiathérogènes qui leur permettent d’intervenir à plusieurs étapes de l’athérosclérose pour empêcher ainsi, l’initiation, la progression de la plaque athérosclérotique. Ces fonctions sont principalement :
• Le transport inverse du cholestérol (TIC); • La fonction anti-oxydante;
• La fonction anti-inflammatoire; • La fonction anti-thrombotique; • La fonction vasodilatatrice.
En plus de ces fonctions, les HDL ont également un rôle anti-infectieux et un rôle dans la modulation du système immunitaire (Eren et al., 2012, Pirillo et al., 2013).
• Transport inverse du Cholestérol (TIC) :
Le TIC est la principale fonction anti-athérosclérotique des HDL. En effet, bien que certains types de cellules puissent éliminer leur contenu en cholestérol en le convertissant en hormones stéroïdiennes, la plupart des cellules périphériques de l’organisme ont tendance à accumuler le cholestérol qui leur est délivré par les VLDL et LDL circulantes et doivent donc s’en débarrasser (Feingold & Grunfeld, 2000). Dans ce cas, le TIC assuré par les HDL est essentiel pour empêcher l’accumulation du cholestérol au niveau cellulaire, notamment au niveau des macrophages et prévenir ainsi, la formation des cellules spumeuses et donc l’initiation du processus athérosclérotique (Feingold & Grunfeld, 2000).
La première étape du TIC est l’efflux du cholestérol des cellules (des macrophages) vers les HDL. Cet efflux du cholestérol se fait via quatre voies (Figure 3) :
- Voie du transporteur ABCA1 : Ce transporteur permet l’efflux du cholestérol vers l’ApoA-1 délipidée ou pauvre en lipides contribuant ainsi, à la formation des HDL naissantes (ou pré-β HDL).
- Voie du transporteur ABCG1 : l’ABCG1 assure quant à lui, le transfert du cholestérol vers les HDL matures de grande taille.
La voie du transporteur ABCA1 suivie par celle du transporteur ABCG1 sont les plus importantes voies qui assurent l’efflux du cholestérol (Phillips, 2014). Le transfert du cholestérol via ces deux voies, se fait de façon unidirectionnelle à savoir, depuis les cellules périphériques vers les HDL.
- Voie du récepteur SR-B1 : Ce récepteur permet un transfert bidirectionnel du cholestérol : 1) des cellules périphériques vers les HDL matures de grande taille et 2) des HDL vers les cellules hépatiques.
- Voie du transport passif : cette voie n’implique pas l’action de transporteurs ou de récepteurs cellulaires. Le transfert du cholestérol vers les HDL se fait simplement selon un gradient de concentration.
Figure 3 : Voies d’efflux du cholestérol des macrophages vers les HDL
L’efflux du cholestérol ou le transfert du cholestérol des macrophages vers les HDL se fait par quatre voies. La première phase de l’efflux est assurée par l’ABCA1 qui se lie avec l’ApoA-1 conduisant ainsi à la formation des HDL naissantes ou pré β HDL. Le récepteur SR-B1 assure l’efflux du cholestérol vers les HDL matures. Le transporteur ABCG1 quant à lui permet l’efflux du cholestérol vers les HDL matures. L’efflux de cholestérol peut aussi se faire par voie passive qui n’implique pas l’action de transporteurs ou de récepteurs cellulaires.
ABCA1: binding cassette-class A1, SR-B1: scavenger receptor class B1; ABCG1: ATP-binding cassette class G1; HDL: High density lipoprotein; CL: cholesterol libre; ApoA-1: apoliporotéine A1. Empruntée et adaptée de (Rader, 2006) avec l’autorisation de Copyright Clearance Center.
• Fonction anti-inflammatoire :
L’inflammation locale et chronique est la caractéristique principale de l’athérosclérose. Les HDL ont la capacité d’inhiber le processus inflammatoire dans ses différentes phases. En effet, les HDL sont capables 1) d’inhiber l’expression des molécules d’adhésion, 2) d’inhiber l’adhésion des monocytes à l’endothélium, 3) d’agir directement sur les monocytes et de bloquer leur expression de cytokines pro-inflammatoires et finalement 4) de réduire l’activation des neutrophiles (Yvan-Charvet et al., 2010, Nicholls et al., 2005).
• Fonction anti-oxydante :
Grâce à leur contenu en apoA-1 et à une enzyme qui leur est associée notamment la paraoxonase 1 (PON1), les HDL ont la capacité d’inhiber l’oxydation des LDL qui constitue une étape fondamentale dans la pathogénèse de l’athérosclérose (Camont et al., 2011b). Premièrement, les HDL extraient les lipides oxydés contenus dans les LDL ce qui représente la première étape de la protection contre les dommages oxydatifs (Kontush & Chapman, 2010, (Camont et al., 2011b). Deuxièmement, les HDL, grâce à la PON1 qui leur est associée et qui joue un rôle antioxydant important, elles sont capables de bloquer les EROs avant de s’attaquer aux LDL (Litvinov et al., 2012), et d’hydrolyser les lipides oxydés empêchant ainsi leur accumulation dans les LDL (Soran et al., 2015). De plus, il a été démontré que les HDL inhibent la pénétration des LDL oxydées dans la paroi artérielle (Galle et al., 1994).
• Fonction anti-thrombotique :
Comme il a été mentionné précédemment, l’agrégation plaquettaire est impliquée dans la progression et la rupture de la plaque d’athérosclérose (Nofer et al., 2010). Il a été démontré que le taux de HDL-C et celui des plaquettes, sont inversement corrélés (Mineo & Shaul, 2012). Cela suggère l’effet anti-thrombotique que possèderaient les HDL(Mineo & Shaul, 2012). En effet, les HDL stimulent la sécrétion du monoxyde d’azote (NO) par les cellules endothéliales qui inhibe à son tour l’agrégation plaquettaire (Nofer et al., 2010, (Camont et al., 2011b). De plus, il a été démontré que les HDL inhibent les facteurs tissulaires responsables de la coagulation sanguine comme le facteur X (Viswambharan et al., 2004).
• Fonction vasodilatatrice :
À l’état physiologique, l’endothélium secrète le NO qui a un rôle important dans la maintenance de l’intégrité de l’artère. À l’inverse, la dysfonction endothéliale correspond à la diminution de la biodisponibilité ou l’inactivation du NO sous l’effet des EROs. La dysfonction endothéliale joue un rôle pivot dans le développement, la progression et la complication des plaques d’athérosclérose (Camont et al., 2011b). Les HDL sont la capables de contrarier la dysfonction endothéliale en stimulant la production du NO par les cellules endothéliales (Calabresi et al, 2003) et peuvent contribuer aussi au blocage des EROs (Litvinov et al., 2012) et à la diminution de leur production en stimulant la formation de la synthase endothéliale du NO (eNOs) (Yang et al., 2009, Terasaka et al., 2008).
• Fonction anti-apoptotique :
L’apoptose ou la mort des cellules de la paroi artérielles incluant les macrophages résulte à l’accumulation des lipides oxydés et/ou non oxydés drivant des LDL (Camont et al., 2011b). Il a été démontré que les HDL protègent les cellules endothéliales et les macrophages contre l’apoptose (Negre-Salvayre et al., 2006). Les HDL contribuent à cette protection par plusieurs mécanismes, 1) en assurant l’efflux du cholestérol, 2) en diminuant la production du EROs, 3) en préservant l’intégrité des mitochondries et 4) en stimulant la sécrétion du NO (Camont et al., 2011b). L’apoA-1 et la PON1 sont les majeurs composants qui permettent aux HDL d’assurer leur effet anti-apoptotique (de Souza et al., 2010, Fuhrman et al, 2010).
• Autres fonctions :
En plus des fonctions biologiques qui ont été décrites, les HDL ont un rôle anti-infectieux qui correspond à leur liaison et neutralisation des lipopolysaccharides qui sont des composantes essentielles de la membrane externe des bactéries (Murch et al., 2007). Ainsi, elles inhibent la libération des endotoxines qui sont responsables de l’activation des cellules immunitaires (Murch et al., 2007). De surcroît, les HDL jouent un rôle dans la modulation du système immunitaire en inhibant l’expression des médiateurs pro-inflammatoires par les macrophages (Norata et al., 2012), et dans la modulation du métabolisme du glucose en stimulant la sécrétion de l’insuline et en augmentant l’absorption du glucose par les muscles (Drew et al., 2012).
❖ La dysfonction des HDL :
Le concept de la dysfonction des HDL correspond à l’incapacité des HDL à assurer correctement leurs fonctions biologiques (Smith, 2010). De nombreuses études ont montré que dans des conditions pathologiques associées à l’inflammation, comme dans le cas de l’athérosclérose, les HDL subissent des altérations de leur structure et de leur composition chimique affectant ainsi leur qualité et résultent en leur transformation en des particules HDL dysfonctionnelles ou avec des fonctions antiathérogènes réduites (Khovidhunkit et al., 2004). Ce fait peut expliquer, en partie, le fait qu’environ la moitié des personnes qui développent une MCV, ont tout de même des niveaux de HDL-C à des valeurs physiologiques (Eren et al., 2012). Parmi les possibles altérations qui peuvent toucher les HDL sont :
- La diminution de l’activité de l’apoA-1 : l’apoA-1 est une protéine liée aux HDL et joue un rôle important dans le TIC. Les études ont montré que sous l’effet de l’inflammation comme dans le cas de diabète de type 2 par exemple, l’activité de l’apoA-1 diminue empêchant ainsi, l’efflux du cholestérol des cellules périphériques vers les HDL (Hoang et al., 2007).
- L’inactivation de la PON1 : la PON1 est une enzyme associée exclusivement aux HDL et elle est responsable de leur effet antioxydant. Cette enzyme est capable d’hydrolyser les lipides oxydés et protège les HDL elles même contre l’oxydation (Mineo & Shaul, 2011). Ainsi, la diminution de l’activité de PON1 transforme les HDL en particules dysfonctionnelles incapables d’inhiber les dommages oxydatifs ce qui favorise le développement de l’athérosclérose (Mineo & Shaul, 2011). D’ailleurs, les études ont montré que les HDL isolées chez les patients ayant une maladie coronarienne, contrairement aux HDL isolées chez les contrôles en bonne santé, sont incapables d’inhiber l’oxydation des LDL (Navab et al., 2000).
- La diminution de l’activité de la LCAT dans les conditions d’inflammation (Otocka-Kmiecik et al., 2012) ce qui empêche la maturation des HDL et résulte en la formation des HDL de petite taille ayant une capacité antiathérogène diminuée.
- L’augmentation de l’activité de la CETP : ceci aboutit à la formation de HDL riches en TG, pauvres en EC et de petite taille qui sont plus susceptibles au catabolisme par le foie (Rashid et al., 2015, Kontush & Chapman, 2006). En effet, il a été démontré que l’activité
de la CETP augmente chez les personnes ayant une manifestation cardiovasculaire de l’athérosclérose (Rashid et al., 2015).
Toutes ces altération transforment les HDL en particules pro-inflammatoires qui jouent ainsi un rôle dans la progression du processus athérosclérotique (Pirillo et al., 2013).
En somme, un bon fonctionnement des HDL dépend de plusieurs facteurs entre autres, leur composition chimique et les activités des protéines et des enzymes qui leur sont associées. Tous ces facteurs déterminent la forme et la taille des HDL qui se reflètent à leur tour, dans la distribution des sous-classes de ces lipoprotéines. En effet, comme il a été mentionné précédemment, les HDL sont une famille de lipoprotéines très hétérogènes et il existe différentes sous classes de HDL et plusieurs études ont montré que ces différentes sous-classes n’ont pas la même relation avec le niveau de risque cardiovasculaire (Sarzynski et al., 2015).
❖ Relation entre les sous-classes de HDL et le risque cardiovasculaire :
Les HDL sont généralement classées en HDL2 ou de grande taille et en HDL3 ou de petite taille (Berglund et al., 1999). Les HDL de grande taille contiennent plus d’apoA-1 (Tian & Fu, 2010) et par conséquent elles ont une meilleure capacité à interagir avec les cellules périphériques et à assurer l’efflux du cholestérol vers les HDL. En effet, plusieurs études ont montré que la proportion des HDL de petites tailles (HDL-P) augmentent chez les personnes ayant un risque cardiovasculaire élevé ou ayant une MCV alors que la proportion de HDL de grande taille (HDL-L) diminue. Cela a été démontré dans l’étude de Woudberg et al. qui ont comparé la distribution des sous-classes de HDL entre des femmes ayant un poids normal et des femmes obèses (Woudberg et al., 2016). Le même résultat a été obtenu dans l’étude de Zhang et al. en comparant les personnes normo-tendues aux patients hypertendus (Zhang, Li, Xu, Guo, et al., 2015). De même, Gao et al. ont montré dans leur étude incluant 337 patients ayant une maladie coronarienne et 190 contrôles en bonne santé, que le taux de HDL-C et la proportion de HDL-L étaient significativement diminués alors que la proportion des HDL-P était significativement plus élevée chez les patients en comparaison avec les contrôles (Gao et al., 2016). Aussi, de nombreuses autres études ont montré que les HDL de grandes tailles sont inversement corrélées au niveau de risque cardiovasculaire et aux différents marqueurs de l’inflammation comme les taux de globules blancs, de fibrinogènes
et les taux de sédimentation des érythrocytes (Kontush, 2015, Zhang, Li, Xu, Zhu, et al., 2015).
D’autres travaux au contraire, ont montré une relation inverse entre le niveau de HDL3 de petite taille et le risque cardiovasculaire comme l’étude de Tiozzo et al. qui a montré que les HDL3 étaient inversement associées à l’épaisseur de la paroi artérielle (Tiozzo et al., 2014). Cette controverse dans la littérature peut être expliquée par les différences entre les populations d’études ainsi que par les différentes méthodes qui permet de déterminer la distribution des sous-classes de HDL (Yang et al., 2009).
En résumé, l’altération de la distribution des sous-classes de HDL est au-delà d’une simple altération des proportions mais elle constitue un biomarqueur qui peut évoquer une détérioration dans le métabolisme et/ou les fonctions des HDL (Pirillo et al., 2013). De ce fait, malgré les différents résultats et les différentes méthodes utilisées, il semble que la mesure de la distribution des différentes sous-classes de HDL serait plus pertinente que la simple mesure des niveau plasmatiques de HDL-C et donc, elle devrait être prise en considération dans l’investigation du risque cardiovasculaire et dans l’évaluation des interventions thérapeutiques ou diététiques visant à prévenir les MCV (Camont et al., 2011).
1.2.4 Vieillissement, maladies cardiovasculaires et HDL : 1.2.4.1 Vieillissement et maladies cardiovasculaires :
Selon l’OMS, le vieillissement, de point de vue biologique, est le produit de l’accumulation de dommages moléculaires et cellulaires au fil temps. Ceci, s’associe avec une altération progressive des capacités physiques et mentales, une majoration du risque de maladie et, enfin, le décès (« OMS | Vieillissement et santé », 2015).
Aujourd’hui, partout dans le monde, le vieillissement de la population est bien plus rapide que dans le passé (« OMS | Vieillissement et santé », 2015). Le nombre de personnes âgées de 60 ans et plus atteindra 2 milliards de personnes en 2050 contre 900 millions en 2015 (Government of Canada, 2015).
Le Canada est aussi concerné par le vieillissement de la population. En effet, les estimations de 2015 montrent que le pourcentage de personnes âgées de 65 ans et plus, atteindra 20,1 % en 2024 contre 16,1 % en 2015 (Government of Canada, 2015) . À cause de cette évolution
démographique, de plus en plus de personnes seront exposées aux maladies liées au vieillissement comme les MCV sachant que, 50 % des diagnostic de MCV et 90 % des mortalités secondaires à une MCV sont observés chez les personnes âgées de 70 ans et plus (Strait & Lakatta, 2012).
Le lien étroit entre le vieillissement et les pathologies qui y sont associées a été expliqué par nombreuses théories, génétiques (vieillissement programmé) ou non génétiques notamment oxydatives et de glycation (dommages cumulatifs) comme la théorie des radicaux libres qui a été proposée par Harman en 1956 (Harman, 1956, de Jaeger & Cherin, 2011, Jin, 2010). Cette théorie stipule que les maladies liées au vieillissement sont le résultat de l’accumulation des dommages radicalaires causés par les radicaux libres comme l’anion superoxyde (O2•-) dont la production augmente en vieillissant (Afanas’ev, 2005), tandis que, le système défensif antioxydant diminue ( Haleng et al., 2007). Comme résultat de ce déséquilibre entre les antioxydants et les pro-oxydants, des dommages radicalaires touchent les différentes composantes de la cellule comme l’ADN, les mitochondries, les protéines et les lipides entrainant ainsi la dégénérescence et la mort cellulaire Haleng et al., 2007).
L’oxydation des LDL illustre bien le lien entre les dommages radicalaires et les MCV (Trpkovic et al., 2015). D’ailleurs, l’augmentation des taux des LDL oxydées (ox-LDL) a été corrélée avec l’âge indépendamment d’autres facteurs de risque (Gradinaru et al., 2015). De plus, le niveau de ox-LDL est considéré comme un biomarqueur pertinent pour le vieillissement cardiovasculaire (Gradinaru et al., 2015).
1.2.4.2 Vieillissement et HDL :
Les HDL, ne sont malheureusement pas à l’abri des dommages induits par le vieillissement. Les résultats de l’étude de Holzer et al. ont montré que, bien que la concentration plasmatique en HDL-C ne soit pas différente chez les personnes âgées en comparaison avec les jeunes, la composition des HDL de personnes âgées est significativement altérée (Holzer et al., 2013). Les HDL isolées chez les personnes âgées présentent une diminution de leur contenu en cholestérol, en PON1 et une augmentation de leur contenu en sérum amyloïde (SAA) qui joue un rôle dans la stimulation de la production des cytokines pro-inflammatoires et dans l’expression des molécules d’adhésion (Holzer et al., 2013, Weichhart et al., 2012). D’autres études ont démontré une réduction des niveaux et de l’activité de l’apoA-1 chez les personnes