Potentiel d’entreposage à long terme de la carotte après
une induction de la résistance naturelle aux maladies
par la lumière UV-C
Thèse
Niankan Kouassi
Doctorat en microbiologie agroalimentaire
Philosophiae doctor (Ph.D.)
Québec, Canada
Résumé
L’intensification des défenses naturelles par la lumière UV-C à des doses hormétiques, l’hormèse étant la stimulation d’effets bénéfiques à faibles doses par des stress potentiellement dangereux à fortes doses, est une méthode prometteuse comme alternative aux fongicides pour une meilleure conservation des carottes. L’objectif général de ce travail était de développer un traitement préentreposage avec la lumière UV-C pour augmenter la durée d’entreposage des carottes. Les objectifs spécifiques étaient : (1) Déterminer la dose hormétique pour l’induction de la résistance aux maladies postrécoltes ; (2) Évaluer l’effet de la température d’entreposage sur la résistance naturelle des carottes pré-traitées avec la dose hormétique UV-C ; (3) Évaluer l’effet de l’âge physiologique des carottes après la récolte sur la résistance induite par la dose hormétique UV-C et le maintien de la résistance aux maladies dans les carottes pré-traitées aux UV-UV-C sur la durée de l’entreposage long-terme. Les variables mesurées au cours des différentes expérimentations étaient l’agressivité des maladies et les infections naturelles, la phytoalexine 6-méthoxymélléine (6-MM), les protéines PR-2 (β-1,3-glucanases) et PR-3 (chitinases), et les repousses racinaires et foliaires. Les résultats ont montré que la dose hormétique de lumière UV-C pour l’induction de la résistance aux maladies est de 5,4 kJ.m-2, et que cette résistance est fortement liée à l’accumulation de la phytoalexine 6-MM, mais celle-ci est dégradée quand elle atteint des niveaux toxiques dans les cellules. Les UV-C ont entraîné une augmentation significative de la synthèse des PR-2 (β-1,3-glucanases de 38 kDa) et le maintien des niveaux constitutifs initiaux des PR-2 et PR-3 (chitinases) détectées. Les carottes traitées immédiatement après la récolte développent et maintiennent des réactions de défense plus fortes que les carottes non traitées. L’entreposage long-terme a montré que les traitements UV-C améliorent la durée de vie des carottes, car celles-ci développent moins d’infections naturelles, de repousses racinaires et de repousses foliaires. Cette étude a montré que le traitement pré-entreposage UV-C peut être utilisé pour l’induction et le maintien de la résistance des carottes dans le but ultime d’augmenter la durée d’entreposage et de vie commerciale des carottes.
Résumé long
En absence de fongicides postrécoltes pour la conservation des fruits et légumes en général et des carottes en particulier, les racines sont soumises à des agents pathogènes responsables de pourritures, qui raccourcissent la durée de vie et diminuent la qualité commerciale du produit. L’hormèse induite par la lumière UV-C, qui est la stimulation d'effets bénéfiques à de faibles doses de ce facteur de stress potentiellement dangereux à des doses élevées, est considérée comme l'une des alternatives les plus prometteuses à l’utilisation des fongicides pour la conservation long terme des carottes. L'objectif global de ce travail était de développer un traitement de pré- entreposage par la lumière UV -C pour induire une résistance aux maladies dans les carottes et augmenter leur durée de conservation. La méthodologie comprenait la détermination de la dose hormétique (optimale) permettant d'induire une résistance des carottes à Botrytis cinerea, Sclerotinia sclerotiorum, Rhizoctonia carotae et Pythium sulcatum; l'évaluation de l’effet de la température d’entreposage après traitement UV-C sur la résistance de la carotte; et l'évaluation de l’effet de l’âge physiologique des carottes avant le traitement UV-C et de la persistance de la résistance induite par les UV-C dans les carottes pendant l’entreposage à long terme . La résistance induite a été évaluée par l'agressivité des agents pathogènes et des infections naturelles, l'accumulation de la phytoalexine 6-methoxymelléine (6-MM), des polyacétylènes falcarinol et falcarindiol, de la myristicine et de l'induction de protéines de défense PR- 2 (β-1,3-glucanases) et PR-3 (chitinases). La progression de la sénescence a été évaluée par l’incidence et la sévérité des repousses foliaires et des repousses racinaires.
Les résultats ont montré un effet quadratique significatif entre la dose du traitement UV-C et la réponse de résitance des carottes aux maladies causées par B. cinerea, S. sclerotiorum, R. carotae, et P. sulcatum. La résistance des carottes aux maladies augmentait progressivement avec les doses jusqu'à une dose optimale d'environ 5,4 kJ.m-2. A cette dose hormétique, un maximum d'environ 55 % d'inhibition de la croissance des agents de pourritures inoculés a été observé, et au-delà de cette dose la résistance aux maladies a diminué. La température d’entreposage des carottes après le traitement hormétique a eu également un impact sur l'inhibition de la croissance de B. cinerea sur les carottes, et cette inhibition était supérieure sur les racines traitées et entreposées à 4 °C. En outre, le traitement hormétique UV-C a considérablement amélioré la résistance à long terme des carottes contre des infections naturelles. De plus, la sénescence des racines traitées, telle qu’observée par les repousses racinaires et foliaires, a été ralentie et décalée d’un maximum de deux mois par rapport aux carottes non traitées.
vi
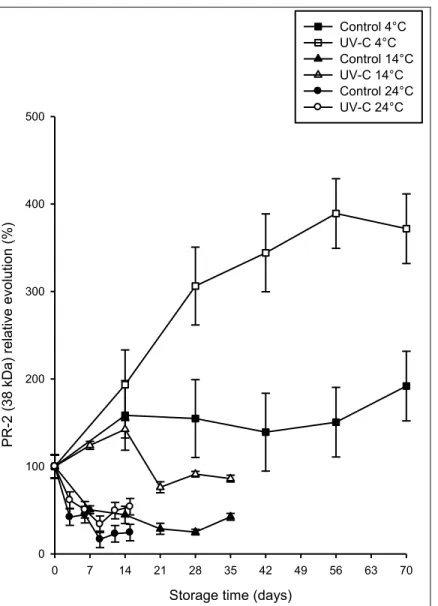
L’accumulation de la phytoalexine 6-méthoxymélléine (6-MM) dans la pelure des carottes a été induite par le traitement UV-C et la production maximale de ce composé a été observée aux environs de la dose UV-C de 5,4 kJ.m-2. Quelle que soit la température d’entreposage après le traitement hormétique, le profil d’accumulation de la 6-MM était le même, c’est-à-dire que les quantités de ce composé atteignaient un certain maximum, suivie d'une diminution, et d’une stabilisation. Il semble que les cellules de carotte aient été plus sensibles à la 6-MM à 24 °C, et à cette température, elles accumulaient et dégradaient cette molécule le plus rapidement, en supportaient des plus bassses quantités maximales, et la stabilisaient à des valeurs d'équilibre plus bassses. Entreposées à 4 °C après le traitement hormétique UV-C, les carottes produisaient des quantités maximales les plus élevées de 6-MM (autour de 120 μg.g-1 de poids frais (PF)), et contenaient au bout de 7 mois d’entreposage des valeurs d'environ 45 μg.g-1 PF de cette molécule. Selon la dose léthale de 6-MM (DL50) pour l’inhibition de la croissance de B. cinerea (environ 20 μg.g-1 PF), il est raisonnable de penser que cette phytoalexine joue un rôle important dans la résistance induite à long terme des carottes contre les pourritures postrécoltes.
Il y a une accumulation de myristicine dans les carottes après un traitement à la lumière UV-C. Cependant, le rôle de cette molécule dans les réactions de défense des carottes est très peu connu.
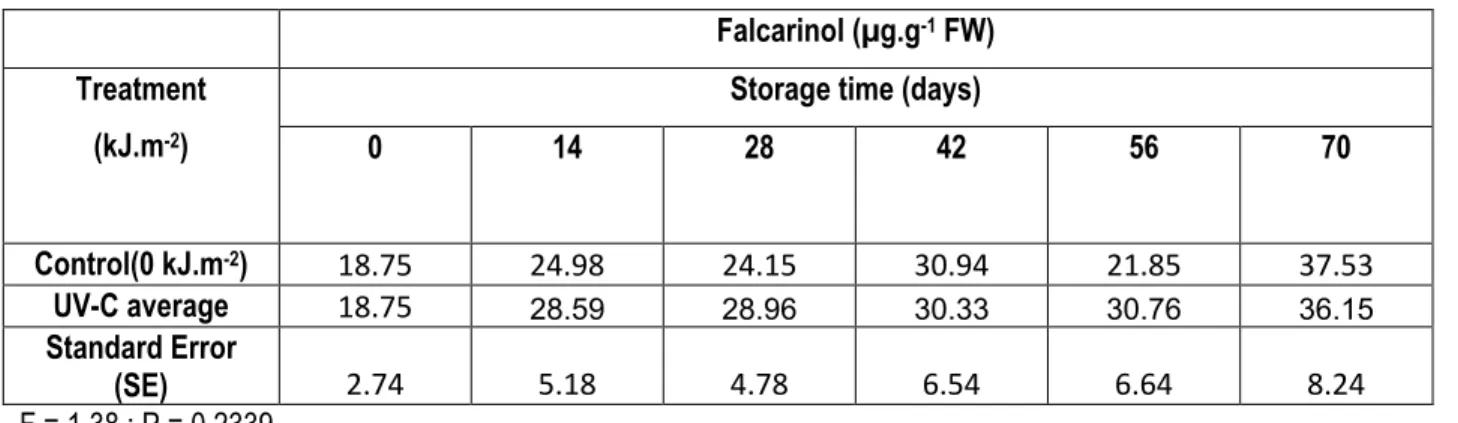
Le traitement hormétique préentreposage UV-C n'a pas eu d'effets sur l’accumulation du falcarindiol et du falcarinol quelle que soit la température d’entreopsage. La lumière UV-C n’a pas semblé affecter l'accumulation de falcarinol et falcarindiol, ce qui renforce l’idée du fait que ces composés soient préformés et fassent partie des défenses constitutives des carottes.
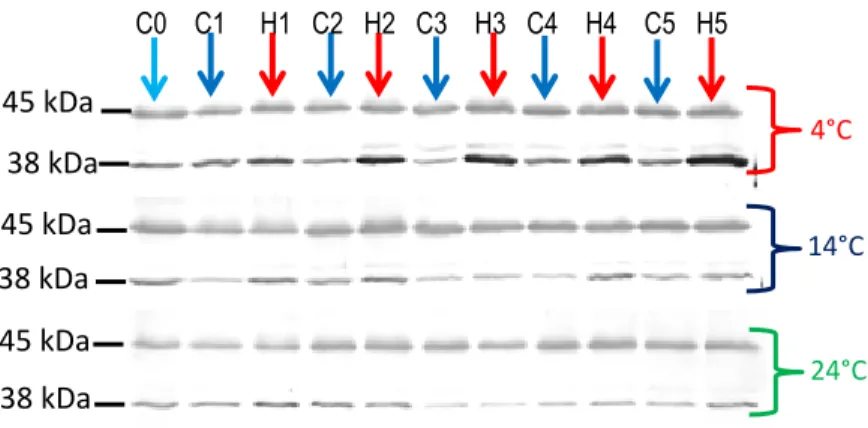
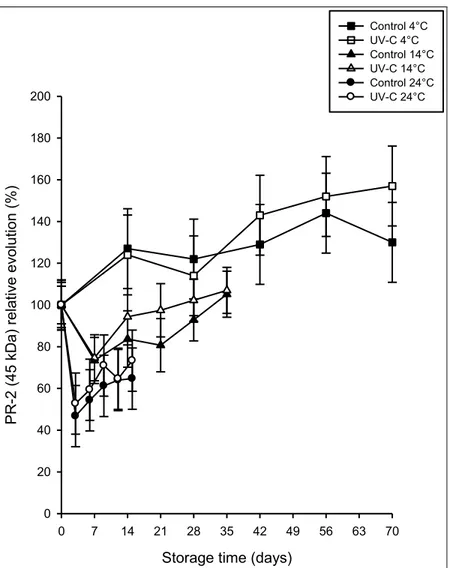
Des analyses de type Western blot ont révélé deux bandes constitutives de 38 kDa et de 45 kDa pour chacune de protéines PR-2 (β-1,3-glucanases) et PR-3 (chitinases) testées. Le traitement hormétique UV-C a induit une augmentation progressive des quantités de PR-2 de 38 kDa (3 à 4 fois relativement à leur niveau initial) dans les carottes entrposées à long terme à basse température (4 °C). Les autres protéines PR détectées sont restées stables, autour de leur valeur initiale dans les carottes traitées aux UV-C et entreposées à 4 °C. Cependant, toutes les protéines PR détectées ont connu une diminution à des taux variables de leurs quantités initiales quand les racines étaient entreposées à 14 °C et 24 °C, traitées ou non. Cela nous suggère que les protéines PR font partie intégrante de la résistance induite aux UV-C des carottes en entreposage long terme.
Nos données suggèrent, en somme, qu’un traitement aux UV-C pourrait être une technologie utile dans la gestion intégrée des maladies pour le stockage à long terme des carottes.
Extended abstract
As there is no fungicide currently registered for postharvest application on carrot, the long-term storage of this crop is limited because of the postharvest decay, which shortens the storability. UV-C hormesis is the stimulation of beneficial effects at low doses of this potentially harmful stressor at high doses, and is considered as one of the most promising alternatives to fungicides for preservation and long-term storage of carrots. The overall objective of this study was to develop a prestorage treatment with UV-C to induce disease resistance in carrots and increase their storage life. The methodology included the determination of the hormetic (optimum) dose to induce disease resistance in carrots against Botrytis cinerea, Sclerotinia sclerotiorum, Rhizoctonia carotae and Pythium sulcatum; the evaluation of time delay after harvest before UV-C treatment and storage temperature on carrot resistance; and the evaluation of the persistence of UV-UV-C induced resistance in carrots during the long-term storage. The induced resistance was evaluated by challenge inoculation with pathogens and natural infections of the treated carrots, and defenswe mechanisms such as the accumulation of the phytoalexin, 6-methoxymellein (6-MM), the polyacetylenes falcarinol and falcarindiol, myristicin and the induction of defense proteins, PR-2 (β-1,3-glucanases) and PR-3 (chitinases). The progress of senescence was evaluated by the severity of sprouting and rooting.
There was a significant quadratic dose-response relationship between UV-C dose and resistance to B. cinerea or S. sclerotiorum, R. carotae, and P. sulcatum. Carrot resistance to diseases progressively increased compared with control roots, up to a dose of about 5.4 kJ.m-2. At the hormetic dose, a maximum of about 55% reduction in growth of the challenged organisms was observed and beyond that dose, disease resistance decreased. Storage temperature had also an impact on the inhibition of the B. cinerea growth on carrots, and the inhibition was greater on the treated carrots and stored at 4 °C during 70 days. In addition, during 7 months of the long-term storage, the naturally occurring infections, as well as the senescence indicators such as sprouting and rooting were delayed by about two months on treated carrots compared with the non-treated roots.
Prestorage treatment with the hormetic UV-C dose elicited the production the phytoalexin 6-MM in carrot peel with maximum accumulation level of about 120 µg.g-1 FW with the hormetic UV-C dose. Regardless of the storage temperature, the level of 6-MM reached a certain maximum, followed by a decrease, and thereafter, it remained steady. At 4°C, 6-MM reached the highest maximum value (120 µg.g-1 FW), and decreased gradualy with storage time to reach a level of about 45 µg.g-1 FW after seven months. It is likely that this carrot phytoalexin plays an important role in the roots long-term induced resistance, since it is known that the ED50 of
viii
6-MM inhibitory for the growth of decay agents is 20 µg.g-1. At the storage temperature of 24 °C, it appears that 6-MM accumulates at the fastest rate, but also degrades at the fastest rate resulting in lowest maximum as well as steady state level, presumably due to high sensitivity of carrot tissue at higher storage temperatures
The polyacetylenes falcarinol and falcarindiol were present in untreated carrots and they are likely to be preformed antimicrobial compounds. The prestorage UV-C treatment did not have any impact on falcarindiol and falcarinol at any storage temperature. UV-C treatment does not seem to affect falcarinol and falcarindiol accumulation; hence those compounds tend to be preformed.
There was an accumulation of myristicin in carrots treated by UV-C. However, the role of this compound in disease resistance and its fungistatic effects remain unclear.
Immunoblotting analysis revealed two constitutive bands at 38 kDa and 45 kDa for both PR-2 (β-1,3-glucanases) and PR-3 (chitinases) proteins. There was a progressive and significant enhancement of 38 kDa of PR-2 (3 to 4 folds the initial level) in carrots treated with UV-C hormetic dose and stored at low temperature during long term storage, while the other PR-proteins detected did not exhibit any changes during storage at 4 °C. However, all PR-proteins degraded at various rate in roots stored at higher temperatures (14 °C and 24 °C), which suggests that PR-proteins are an integral part of long-term resistance in UV-C hormesis treated carrots.
Our data suggest, overall, that UV-C treatment could be a beneficial technology in the integrated management of diseases for long-term storage of carrots.
Table des matières
RÉSUMÉ ... III
RÉSUMÉ LONG ... V
EXTENDED ABSTRACT ... VII
TABLE DES MATIÈRES ... IX
LISTE DES TABLEAUX ... XV
LISTE DES FIGURES ... XVII
REMERCIEMENTS ... XIX
AVANT-PROPOS ... XXI
INTRODUCTION GÉNÉRALE ... 1
CHAPTER 1 : REVUE DE LITTÉRATURE ... 5
1.1 Carotte ... 5
1.1.1 Généralités ... 5
1.1.2 Facteurs de conservation de la carotte à l’état frais ... 5
1.1.2.1 Respiration ... 6
1.1.2.2 Transpiration ... 7
1.1.2.3 Facteurs liés à la sénescence ... 8
1.1.2.4 Désordres physiologiques de la carotte ... 9
1.1.2.5 Maladies d’entreposage de la carotte ... 10
1.2 Interactions plante-agent pathogène ... 11
1.2.1 Arsenal d’attaque des agents pathogènes ... 11
1.2.2 Barrières des organismes végétaux ... 13
1.2.3 Interaction entre les éliciteurs et l’hôte ... 14
1.2.4 Mécanismes de réaction de défenses naturelles des plantes ... 16
1.3. Maladies majeures de la carotte entreposée au Québec ... 19
1.3.1. Moisissure grise causée par B. cinerea ... 19
1.3.1.1. Étiologie ... 19
1.3.1.2 Symptomatologie et épidémiologie ... 19
x
1.3.2.1 Étiologie ... 20
1.3.2.2 Symptomatologie et épidémiologie ... 20
1.3.3 Rhizoctone (crater rot) causé par Rhizoctonia carotae ... 21
1.3.3.1 Étiologie ... 21
1.3.3.2 Symptomatologie et épidémiologie ... 22
1.3.4 Cavité pythienne causée par Pythium spp. ... 22
1.3.4.1 Étiologie ... 22
1.3.4.2 Symptomatologie et épidémiologie ... 23
1.4 Défenses naturelles de la carotte ... 24
1.4.1 Défenses structurales ... 24
1.4.2 Défenses biochimiques : les protéines de défense ... 25
1.4.3 Défenses phytochimiques ... 26
1.4.3.1 Les polyacétylènes ... 26
1.4.3.2 La myristicine ... 29
1.4.3.3 Les phytoalexines ... 32
1.4.4 Phytoalexine de la carotte : la 6-méthoxymélléine (6-MM) ... 32
1.4.4.1 Biosynthèse de la 6-MM ... 32
1.4.4.2 Élicitation de la 6-MM ... 34
1.4.4.3 Activité biologique et rôle dans la résistance de la 6-MM aux agents pathogènes ... 34
1.4.5 Autres composés phytochimiques antimicrobiens chez la carotte ... 35
1.5 Lutte contre les maladies postrécoltes de la carotte ... 36
1.5.1 Le préentreposage ... 36 1.5.1.1 Opérations prérécolte ... 36 1.5.1.2 Opérations à la récolte ... 37 1.5.2 La lutte chimique ... 38 1.5.3 La lutte physique ... 38 1.5.3.1 Traitements de chaleur ... 38
1.5.3.2 Atmosphères contrôlées et modifiées (CA/MA) ... 39
1.5.3.3 Les irradiations gamma et UV ... 41
1.4.3.4 L’ozone ... 42
1.5.4 La lutte biologique ... 43
1.5.4.1 Les microorganismes antagonistes ... 43
1.5.4.2 Composés GRAS (generally recognized as safe) ... 45
1.5.4.3 Le chitosane ... 47
1.5.4.4 La lutte génétique ... 48
1.5.5 Maintenance et induction des défenses naturelles ... 49
1.5.6 La lutte intégrée ... 51
1.6 La lumière UV ... 52
1.6.1 La radiation UV bioactive ... 52
1.6.2 Effets des UV-C au niveau cellulaire et hormèse ... 53
1.6.3 Effets hormétiques des UV-C sur les fruits et légumes ... 54
1.6.4 Effet des UV-C sur la résistance induite chez la carotte ... 55
1.8 Hypothèses et objectifs de recherche ... 57
1.8.1 Hypothèses de recherche ... 57
1.8.2 Objectifs de recherche ... 57
1.9 Références bibliographiques ... 59
CHAPTER 2 : POSTHARVEST HORMETIC DOSE OF UV-C FOR INDUCTION OF
RESISTANCE TO BOTRYTIS CINEREA, SCLEROTINIA SCLEROTIORUM, RHIZOCTONIA
CAROTAE AND PYTHIUM SULCATUM DECAY IN CARROTS (DAUCUS CAROTA L.) .. 89
2.1 Abstract ... 89
2.2 Introduction ... 90
2.3 Materials and Methods ... 92
2.3.1 Carrots ... 92
2.3.2 Pretreatments with UV-C doses, pathogen inoculations and carrot sampling ... 92
2.3.3 UV-C Treatment ... 93
2.3.4 Fungal cultures... 93
2.3.5 Compounds purification and extraction ... 94
2.3.5.1 Isolation of falcarinol, falcarindiol, and myristicin ... 94
2.3.5.2 Isolation of 6-methoxymellein (6-MM) ... 94
2.3.5.3 Compounds extraction, identification and quantification in carrot peel ... 95
2.3.6 Statistical analysis ... 96
2.4 Results ... 96
2.4.1 Hormetic effect of UV-C on induced resistance of carrot to pathogens ... 96
2.4.2 Phytochemicals assay ... 97
2.5 Discussion ... 103
2.6 Conclusion ... 107
2.7 References ... 108
CHAPTER 3 : EFFECT OF STORAGE TEMPERATURE ON INDUCED RESISTANCE BY
UV-C HORMETIC DOSE IN CARROTS (DAUCUS CAROTA L.) ... 115
3.1 Abstract ... 115
3.2 Introduction ... 116
3.3 Materials and methods ... 118
3.3.1 Carrots ... 118
3.3.2 Experimental methodology ... 118
xii
3.3.4 Fungal cultures ... 119
3.3.5 Compounds extraction, identification and quantification in carrot peel ... 120
3.3.6 β-1,3-glucanases (PR-2) and Chitinases (PR-3) immunoblotting and quantification ... 120
3.3.7 Statistical analysis ... 120
3.4 Results ... 121
3.4.1 Induced resistance to B. cinerea ... 121
3.4.2 Accumulation of 6-MM ... 121
3.4.3 β-1,3-glucanases (PR-2) and chitinases (PR-3) ... 122
3.5 Discussion ... 132
3.6 Conclusion ... 135
3.7 References ... 136
CHAPTER 4 : EFFECT OF UV-C HORMETIC DOSE ON POSTHARVEST DELAYED
TREATMENT AND ITS APPLICABILITY TO LONG-TERM PRESERVATION OF
CARROTS ... 141
4.1 Abstract ... 141
4.2 Introduction ... 142
4.3 Materials and methods ... 143
4.3.1 Carrots ... 143
4.3.2 Experimental methodology ... 143
4.3.2.1 Natural infection measurement ... 144
4.3.2.2 Sprouting and rooting evaluation ... 145
4.3.3 UV-C Treatment ... 145
4.3.4 Fungal cultures ... 145
4.3.5 Compounds extraction, identification and quantification in carrot peel ... 145
4.3.6 Statistical analysis ... 146
4.4 Results ... 146
4.4.1 Treatment delay effect ... 146
4.4.2 Long-term storage ... 147
4.5 Discussion ... 170
4.6 Conclusion ... 174
4.7 References ... 175
CHAPTER 5 : CONCLUSION GÉNÉRALE ... 181
5.2 Perspectives ... 184
Annexes ... 187
Annexe 1 : Communications des résultats de la thèse ... 187
Liste des tableaux
TABLE 2.1 : EFFECT OF UV-C TREATMENT ON FALCARINOL CONCENTRATION IN CARROT PEEL ... 102
TABLE 2.2 : EFFECT OF UV-C TREATMENT ON FALCARINDIOL CONCENTRATION IN CARROT PEEL ... 102
TABLE 2.3 : EFFECT OF UV-C TREATMENT ON MYRISTICIN CONCENTRATION IN CARROT PEEL ... 102
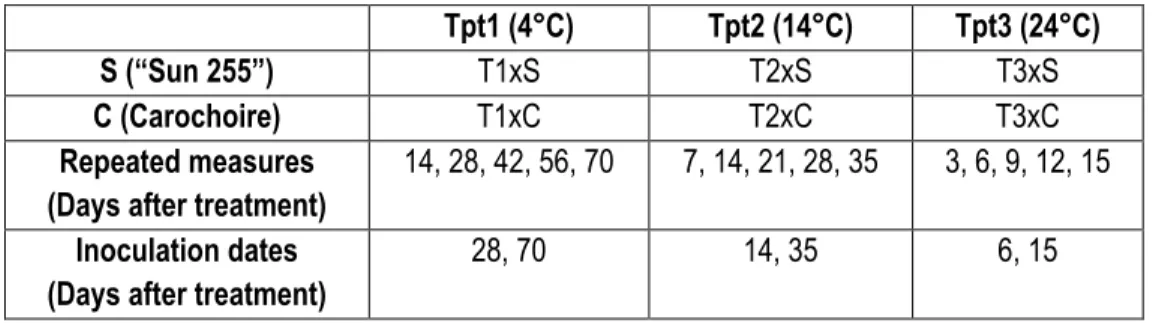
TABLE 3.1 : FACTORIAL COMBINATION OF THE EXPERIMENTAL DESIGN ON STORAGE TEMPERATURE... 119
TABLE 4.1 : FACTORIAL COMBINATION OF THE EXPERIMENTAL DESIGN ON CARROTS PHYSIOLOGICAL AGE ... 144
Liste des Figures
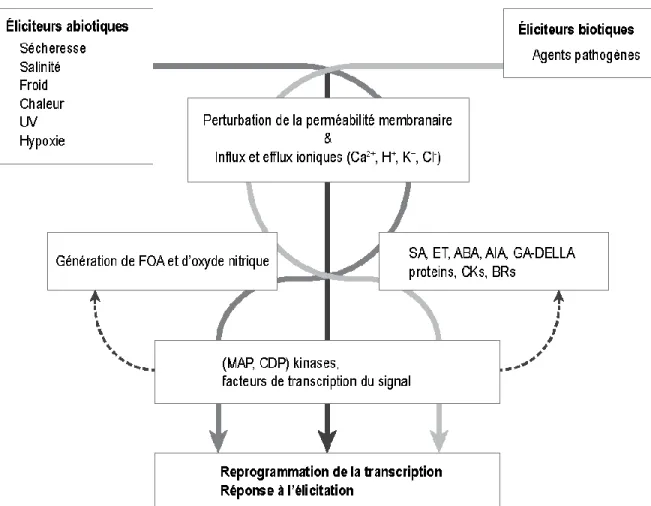
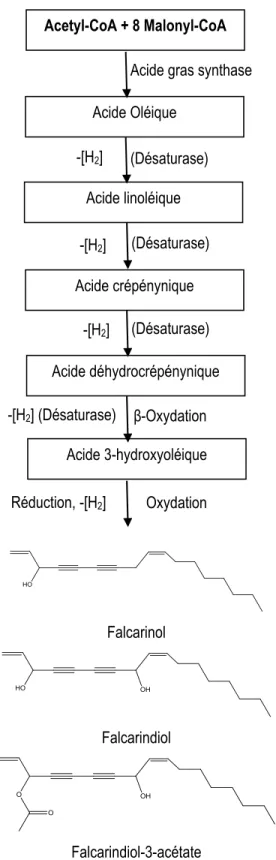
FIGURE 1.1 : SÉQUENCE GÉNÉRALE DE SIGNALISATION SUIVANT UNE ÉLICITAION DE RÉACTION DE DÉFENSES NATURELLES CHEZ LES PLANTES (MODIFIÉE DE BOSTOCK ET AL., 2014). ... 18 FIGURE 1.2 : BIOSYNTHÈSE DES ACIDES GRAS ET DES POLYACÉTYLÈNES PAR LA VOIE DE L’ACIDE
CRÉPÉNINIQUE (MINTO ET BLACKLOCK, 2008 ; TIWARI ET CUMMINS, 2013) ... 28 FIGURE 1.3 : BIOSYNTHÈSE DE LA LIGNINE, DES LIGNANES ET DE LA MYRISTICINE (ADAPTÉ DE DEWICK, 2002)
... 31 FIGURE 1.4 : BIOSYNTHÈSE DE LA 6-MÉTHOXYMÉLLÉINE (ADAPTÉE DE CAPSI ET AL., 2010) ... 33 FIGURE 1.5 : SPECTRE ÉLECTROMAGNÉTIQUE (ADAPTÉE DE GUERRERO-BELTRÁN ET BARBOSA-CÁNOVAS,
2004) ... 42 FIGURE 1.6 : MÉCANISMES DE TRANSDUCTION DU SIGNAL INITIÉ PAR LES ÉLICITEURS (ADAPTÉE DE
KUROSAKI, 2012) ... 50 FIGURE 2.1 EFFECT OF UV-C DOSES ON THE INDUCED RESISTANCE OF CARROTS INOCULATED BY MAJOR
POSTHARVEST PATHOGENS. ... 99 FIGURE 2.2 : EFFECT OF UV-C DOSES ON 6-METHOXYMELLEIN (6-MM) CONCENTRATION IN CARROTS PEEL.
... 101 FIGURE 3.1 EFFECT OF STORAGE TEMPERATURE ON CARROTS INDUCED RESISTANCE AGAINST B. CINEREA BY PRESTORAGE UV-C HORMETIC (5.4 KJ.M-2) TREATMENT. (A) CV. “SUN 255”; (B) CV. CAROCHOICE ... 124 FIGURE 3.2 TIME COURSE ACCUMULATION OF 6-METHOXYMELLEIN AS A FUNCTION OF STORAGE TIME AT
SPECIFIED STORAGE TEMPERATURE AFTER UV-C HORMETIC (5.4 KJ.M-2) TREATMENT. (A) CV. “SUN 255”; (B) CV. CAROCHOICE. ... 126 FIGURE 3.3 : EFFECT OF STORAGE TEMPERATURE ON PR-2 (Β-1,3-GLUCANASES) AND PR-3 (CHITINASES)
PROTEINS ACCUMULATION IN CARROT PEELS, CV. “SUN 255”. ... 127 FIGURE 3.4 : PR-2 (Β-1,3-GLUCANASES, 38 KDA) ACCUMULATION IN CARROT (CV. “SUN 255”) PEELS,
RELATIVE TO THE INITIAL LEVEL BEFORE TREATMENT AS A FUNCTION OF STORAGE TIME AT SPECIFIED POST-TREATMENT STORAGE TEMPERATURE AFTER PRESTORAGE UV-C HORMETIC TREATMENT (5.4 KJ.M-2). ... 128 FIGURE 3.5 : PR-2(Β-1,3-GLUCANASES, 45 KDA) ACCUMULATION IN CARROT (CV. “SUN 255”) PEELS,
RELATIVE TO THE INITIAL LEVEL BEFORE TREATMENT AS A FUNCTION OF STORAGE TIME AT SPECIFIED POST-TREATMENT STORAGE TEMPERATURE AFTER PRESTORAGE UV-C HORMETIC TREATMENT (5.4 KJ.M-2). ... 129 FIGURE 3.6 : PR-3 (CHITINASES, 38 KDA) ACCUMULATION IN CARROT (CV. “SUN 255”) PEELS, RELATIVE TO
THE INITIAL LEVEL BEFORE TREATMENT AS A FUNCTION OF STORAGE TIME AT SPECIFIED POST-TREATMENT STORAGE TEMPERATURE AFTER PRESTORAGE UV-C HORMETIC POST-TREATMENT (5.4 KJ.M-2). ... 130 FIGURE 3.7 : PR-3 (CHITINASES, 45 KDA) ACCUMULATION IN CARROT (CV. “SUN 255”) PEELS RELATIVELY TO
THE INITIAL LEVEL BEFORE TREATMENT AS A FUNCTION OF STORAGE TIME AT SPECIFIED POST-TREATMENT STORAGE TEMPERATURE AFTER PRESTORAGE UV-C HORMETIC POST-TREATMENT (5.4 KJ.M-2). ... 131 FIGURE 4.1 EFFECT OF POSTHARVEST DELAY BEFORE UV-C HORMETIC DOSE (5.4 KJ.M-2) TREATMENT ON
CARROT INDUCED RESISTANCE TO B. CINEREA . (A) CULTIVAR “SUN 255”; (B) CULTIVAR CAROCHOICE. ... 149 FIGURE 4.2 : EFFECT OF POSTHARVEST DELAY BEFORE UV-C HORMETIC DOSE (5.4 KJ.M-2) TREATMENT ON
xviii
FIGURE 4.3 : LONG TERM STORAGE ACCUMULATION OF 6-METHOXYMELLEIN (6-MM) IN CARROT (CV. “SUN 255”) PEELS AFTER PRESTORAGE TREATMENT WITH UV-C HORMETIC DOSE (5.4 KJ.M-2). ... 152 FIGURE 4.4 : LONG-TERM STORAGE (LABORATORY CONDITIONS) ACCUMULATION OF PR-2
(Β-1,3-GLUCANASES) (A) AND PR-3 (CHITINASES) (B) PROTEINS IN CARROT (CV. “SUN 255”) PEELS AFTER PRESTORAGE TREATMENT WITH UV-C HORMETIC DOSE (5.4 KJ.M-2). ... 153 FIGURE 4.5 : LONG TERM STORAGE (LABORATORY CONDITIONS) RELATIVE ACCUMUKLATION OF PR-2
(Β-1,3-GLUCANASES) PROTEINS IN CARROT (CV. “SUN 255”) PEELS AFTER PRESTORAGE TREATMENT WITH UV-C HORMETIC DOSE (5.4 KJ.M-2). (A) PR-2 (38 KDA); (B) PR-2 (45 KDA)... 155 FIGURE 4.6 : LONG TERM STORAGE RELATIVE ACCUMULATION OF PR-3 (CHITINASES) PROTEINS IN CARROTS
(CV. “SUN 255”) PEEL AFTER PRESTORAGE TREATMENT WITH UV-C HORMETIC DOSE (5.4 KJ.M-2). (A) PR-2 (38 KDA); (B) PR-2 (45 KDA). ... 157 FIGURE 4.7 : LONG-TERM LABORATORY STORAGE PROGRESSION OF NATURAL INFECTIONS INCIDENCE AND
SEVERITY ON CARROT (CV. “SUN 255”) AFTER PRESTORAGE TREATMENT WITH UV-C HORMETIC DOSE (5.4 KJ.M-2). (A) DISEASE INCIDENCE; (B) DISEASE SEVERITY. ... 159 FIGURE 4.8 : LONG-TERM COMMERCIAL STORAGE PROGRESSION OF NATURAL INFECTIONS INCIDENCE AND
SEVERITY ON CARROT (CV. “SUN 255”) AFTER PRESTORAGE TREATMENT WITH UV-C HORMETIC DOSE (5.4 KJ.M-2). (A) DISEASE INCIDENCE; (B) DISEASE SEVERITY. ... 161 FIGURE 4.9 : LONG-TERM LABORATORY STORAGE PROGRESSION OF SPROUTING INCIDENCE AND SEVERITY
ON CARROT (CV. “SUN 255”) AFTER PRESTORAGE TREATMENT WITH UV-C HORMETIC DOSE (5.4 KJ.M -2). (A) SPROUTING INCIDENCE; (B) SPROUTING SEVERITY. ... 163 FIGURE 4.10 : LONG TERM COMMERCIAL STORAGE PROGRESSION OF SPROUTING INCIDENCE AND SEVERITY ON CARROT (CV. “SUN 255”) AFTER PRESTORAGE TREATMENT WITH UV-C HORMETIC DOSE (5.4 KJ.M -2). (A) SPROUTING INCIDENCE; (B) SPROUTING SEVERITY. ... 165 FIGURE 4.11 : LONG-TERM LABORATORY STORAGE PROGRESSION OF ROOTING INCIDENCE AND SEVERITY
ON CARROT (CV. “SUN 255”) AFTER PRESTORAGE TREATMENT WITH UV-C HORMETIC DOSE (5.4 KJ.M -2). (A) ROOTING INCIDENCE; (B) ROOTING SEVERITY. ... 167 FIGURE 4.12 : LONG TERM COMMERCIAL STORAGE PROGRESSION OF ROOTING INCIDENCE AND SEVERITY
ON CARROT (CV. “SUN 255”) AFTER PRESTORAGE TREATMENT WITH UV-C HORMETIC DOSE (5.4 KJ.M -2). (A) ROOTING INCIDENCE; (B) ROOTING SEVERITY. ... 169
Remerciements
Je remercie le Dr Joseph Arul, mon directeur de thèse, pour avoir accepté de me recevoir dans son laboratoire et pour la qualité du projet sur lequel j’ai eu à travailler, car m’accrocher à ce projet m’a permis de garder comme objectif l’obtention du doctorat. Je remercie également mon co-directeur, le Dr Russell Tweddell pour ses conseils et son aide. Sons sens de la précision m’a permis d’améliorer mes présentations de séminaire et de thèse. Un gros merci au Dr Dominique Michaud, pour avoir accepté de me recevoir dans son laboratoire pour une partie de mes travaux de recherche, pour avoir accepté de faire la prélecture de ma thèse et pour l’avoir améliorée par ses recommandations. Je le remercie également pour sa disponibilité et son partage de l’observation du côté positif des choses. Je remercie le Dr Joseph Makhlouf pour avoir accepté de faire partie du comité d’évaluation de ma thèse. Merci au Dr Marie-Thérèse Charles pour avoir bien voulu en être l’évaluatrice externe depuis ma présentation de séminaire. Je remercie également tous les responsables de l’administration de l’Université Laval, en particulier de la faculté des sciences de l’agriculture et de l’alimentation pour leur soutien et leur encouragement : Le Dr Julie Jean, directrice de programme, le Dr Pierre-Mathieu Charest, Vice-Doyen et le Dr Jean-Claude Dufour, Doyen.
Je remercie Ronan Corcuff, professionnel de recherche, qui m’a accompagné tout le long des travaux menant à ma thèse, m’a initié et formé à de nombreuses techniques de laboratoire, et m’a fait les premières observations pour améliorer ma thèse. Je remercie mon ami le Dr Arturo Duarte-Sierra qui a été mon collègue étudiant au doctorat et mon ami David Claveau qui m’a appris à faire de la bière et de l’hydromel. Je remercie Françoise Nadeau pour son aide dans la purification des molécules standards, ainsi que le Dr Paul Angers pour ses conseils en chimie. Je remercie également Audrey Robert, Gayathri Haridas, Laetitia Angers et Dimitri Bois, qui ont eu à travailler avec moi sur le projet. Je remercie également le Dr Tyler Avis pour son aide dans la collecte des agents pathogènes utilisés dans mes travaux et pour son appui au début de la thèse. Merci à Marie-Claire Goulet, professionnel de recherche, au Dr Moustapha Khalf et à mon amie le Dr Stéphanie Robert pour leur aide. Je remercie également tous les professionnels de recherche du pavillon Comtois et de l’environtron qui m’ont accordé leur aide.
Je remercie mon père Niankan Kouassi et ma mère Ewui Beya d’avoir posé les bases de ce que je suis aujourd’hui et de m’avoir transmis le repect, le courage et la persévérance. À mes sœurs Nadège, Mariette et Marie-Paule et à tous les membres de ma famille élargie pour leur soutien et leurs prières. Un gros merci à tous mes amis, sans qui ma vie d’étudiant au doctorat n’aurait pas eu la même saveur agréable. D’où qu’ils se
xx
trouvent à travers le monde, que cette marque de reconnaissance les rejoigne et les honore pour leur soutien spirituel, moral, matériel et financier. Il me faudrait plus d’une page pour citer tous les noms. Merci chaleureux à ma chérie Valérie Bouchard : tu as rempli mon cœur d’amour depuis plus de trois ans et m’a toujours soutenu et encouragé ; j’espère que Dieu te comblera d’une longue et belle vie pleine de santé, de joie et de bonheur après t’avoir permis de vaincre ce cancer.
Avant-propos
Cette thèse de doctorat initiée dans le cadre du Programme de doctorat en Microbiologie agroalimentaire de l’Université Laval comporte une introduction générale, un chapitre de revue de littérature rédigé en français, trois chapitres de résultats rédigés en anglais sous la forme d’articles scientifiques, et un chapitre de conclusion générale rédigée en français faisant le sommaire des trois chapitres précédents et une ouverture sur les perspectives de ces travaux. Ce projet s’inscrit dans le cadre du Programme de soutien à l’innovation en agroalimentaire institué par le Ministère de l’Agriculture, des Pêcheries et de l’Alimentation du Québec (MAPAQ). Il avait pour responsable scientifique le Dr Joseph Arul. J’étais responsable de l’établissement des protocoles de recherche, sous les conseils du Dr. Joseph Arul et du professionnel de recherche Ronan Corcuff. Les prélèvements et l’analyse des échantillons ont été effectués par mes soins, avec l’aide d’Audrey Robert, de Gayathri Haridas et de Dimitri Bois, alors stagiaires, respectivement durant trois années successives, au laboratoire du Dr. Joseph Arul. Les protocoles de purification des standards de molécules détectées et quantifiées dans cette thèse ont été établis avec l’aide précieuse de Françoise Nadeau, étudiante à la maîtrise en Sciences et Technologies des Aliments (STA), sous les conseils du Dr. Paul Angers. Cette thèse, que j’ai rédigée en intégralité, a intégré les observations de Ronan Corcuff avant la prélecture, et celles du Dr. Dominique Michaud et du Dr. Joseph Arul après la prélecture. Sommairement, cette thèse se présente comme suit :
Introduction générale
Chapitre 1. Revue de littérature
Chapitre 2. Postharvest hormetic dose of UV-C for induction of resistance to Botrytis cinerea, Sclerotinia
sclerotiorum, Rhizoctonia carotae and Pythium sulcatum decay in carrots (Daucus carota L.)
Chapitre 3. Effect of storage temperature on induced resistance by UV-C hormetic dose in carrots (Daucus
carota L.)
Chapitre 4. Effect of UV-C hormetic dose on postharvest delayed treatment and its applicability to long-term preservation of carrots
Introduction générale
La carotte (Daucus carota L., de la famille des Apiacées) est un produit de saison froide cultivée à priori en zone tempérée. Cependant, la capacité d’adaptation des cultivars pour les régions subtropicales donne à ce produit une distribution presque mondiale. La carotte est cultivée par l’homme pour sa haute valeur nutritive, son goût, sa flaveur et sa polyvalence. Elle est d’une importance économique non négligeable au Canada. En 2011, la production canadienne commercialisée de carottes s’élevait à 464 562 tonnes, pour une valeur à la ferme de 95 millions de dollars. Le Québec est la deuxième province productrice de carottes au Canada avec environ 23 % de la production nationale, ce qui représente une production de 109 953 tonnes pour une valeur à la ferme de 32 millions de dollars (Statistique Canada, 2012). Les pertes postrécoltes des fruits et légumes peuvent s’élever au tiers de la récolte dans les pays développés et approchent des échelles catastrophiques dans les pays en voie de développement, à cause de conditions inadéquates de transport et d’entreposage des produits (El Ghaouth, 1997 ; El Ghaouth et al., 2002 ; Kader, 2002a ; Sharma et al., 2009).
Comme tous les légumes frais, la carotte est soumise à plusieurs facteurs pouvant réduire sa qualité et sa durée de vie en période postrécolte. Les facteurs principaux en cause sont la sénescence et le vieillissement, la dessiccation par transpiration et les maladies postrécoltes. La sénescence est définie comme la période pendant laquelle les activités biochimiques cataboliques (dégradatives) surpassent les activités anaboliques, conduisant au vieillissement des tissus (Bruinsma, 1983 ; Lee et al., 1995). La transpiration est le transfert de masse de la vapeur d’eau de la surface du produit vers l’air ambiant, dû à une différence de pression de vapeur entre ces deux entités ; elle conduit à la perte d’humidité, de turgescence et à la sénescence du produit (Ben-Yehoshua, 1987). À basse température (entre 0°C et 1°C), l’activité métabolique de la carotte est réduite, ce qui permet de ralentir le processus irréversible de sénescence (Kader, 1987, 2002a). De même, une humidité relative proche de la saturation (entre 98 et 100%) permet de réduire les pertes d’eau par transpiration (Van den Berg et Lentz, 1966 ; Apeland et Baugerød, 1971).
Cependant, il subsiste le troisième facteur de perte postrécolte, et de loin le plus important à savoir que les maladies postrécoltes de la carotte sont causées par des agents pathogènes psychro-tolérants qui se développent bien à basse température et dans les conditions d’humidité sus-définies. De plus, leur développement est accentué par les facteurs qui accélèrent la sénescence, par l’abondance de portes d’entrée causées par les blessures mécaniques et par différents désordres physiologiques (Arul, 1994).
Les agents pathogènes majeurs affectant les carottes lors de l’entreposage à basse température dans la région de Québec sont Botrytis cinerea, Sclerotinia sclerotiorum, Rhizoctonia carotae et Pythium spp. (Mercier
2
et al., 1993a ; Howard et al., 1994 ; Gilbert, 2001 ; Allain-Boulé et al., 2002 ; Davis et Raid, 2002). Jusqu’à récemment, les fongicides synthétiques constituaient le premier moyen de lutte contre ces maladies, contrôlées plus ou moins efficacement par l’application postrécolte de bénomyl, jusqu’à ce que ce dernier ne soit plus homologué en Amérique du Nord. L’interdiction d’utiliser ce pesticide est liée à la protection de la population par rapport à la présence de résidus dans les aliments consommés et dans l’environnement, et à l’apparition de souches de pathogènes tolérantes aux fongicides (Eckert, 1978 ; Eckert et Ogawa, 1988 ; Arul et al., 2001 ; Leroux, 2007). L’entreposage de la carotte incluant l’application du pesticide, permettait d’atteindre une conservation d’environ 6 – 8 mois. Depuis, cette capacité à conserver la carotte est devenue plus limitée, et la durée d’entreposage a été réduite à 3 – 4 mois, ne donnant pas aux agriculteurs des bénéfices raisonnables de leur culture. Ainsi, les producteurs de carotte ont-ils besoin d’une solution face à ces problèmes d’entreposage.
Plusieurs investigations sur des nouvelles méthodes alternatives à l’utilisation des pesticides pour combattre les agents pathogènes postrécoltes des fruits et légumes ont été menées (El Ghaouth et al., 2002 ; Spadaro et Gullino, 2004 ; Droby et al., 2009 ; Shoresh et al., 2010). Ces méthodes incluent surtout des approches de lutte biologique qui comprend l’intensification des défenses naturelles des produits récoltés, l’utilisation de biocides naturels, l’utilisation d’antagonistes (Janisiewcz et Korsten, 2002 ; Sharma et al., 2009) biologiques ou la transformation génétique. Ces méthodes alternatives comprennent également la lutte physique, c’est-à-dire les traitements de chaleur, les atmosphères contrôlées et/ou modifiées, l’ozone, et les radiations gamma et UV (Ben-Yehoshua et Mercier, 2005). La lutte intégrée consiste enfin en la combinaison d’au moins deux de ces méthodes précédemment énumérées.
La stimulation des défenses naturelles des fruits et légumes en général, et de la carotte en particulier, par l’utilisation des radiations UV-C, s’est révélée être une alternative prometteuse à l’utilisation des fongicides chimiques (Arul et al., 2001 ; Shama et Alderson, 2005 ; Stevens et al., 2006a, b ; Shama, 2007). Les radiations UV-C, utilisées à doses élevées, sont potentiellement dangereuses pour les cellules vivantes. Cependant, lorsqu’elles sont utilisées à des doses plus faibles, ces radiations entraînent des effets bénéfiques, à savoir la résistance aux agents pathogènes des fruits et légumes, la prolongation de leur durée de vie en entreposage, et l’augmentation de leurs qualités nutritionnelles et nutraceutiques (Arul et al., 2001 ; Shama et Alderson, 2005 ; Stevens et al., 2006a, b ; Shama, 2007 ; Cisneros-Zevallos, 2003 ; González-Aguilar et al., 2010). En pratique, l’induction de ces phénomènes a été baptisé hormèse; il consiste à utiliser des traitements potentiellement dangereux pour le produit à des doses sublétales à effets contraires bénéfiques (Calabrese et Baldwin, 1997 ; Mattson et Calabrese, 2010 ; Maharaj et Ayoub, 2012 ; Garzon et Flores, 2013).
Dans notre laboratoire, les études de Mercier et al. (1993a, b, et c) ont montré que le traitement préentreposage par les UV-C induit une résistance à B. cinerea et à S. sclerotiorum chez les carottes traitées et que ces produits paraissent détenir un avantage sur l’agent pathogène pour lutter contre les infections. Dans les carottes traitées aux UV-C, l’accumulation d’une phytoalexine, la 6-méthoxymélléine (6-MM) semble être le mécanisme majeur contribuant à la résistance. Nous avons également montré que la conservation des activités d’enzymes de défense constitutives (β-1,3-glucanases et chitinases) par le traitement UV joue un rôle additionnel dans les mécanismes de résistance induite (Mercier et al., 2000). Il a été conclu que les radiations UV-C peuvent représenter un atout important pour l’induction des défenses naturelles de la carotte afin de leur permettre de se prémunir contre les maladies et de se conserver plus longtemps.
Cependant, plusieurs questions méritent des réponses avant de proposer les radiations UV-C comme alternative fiable et viable à l’utilisation des pesticides. Existe-t-il une dose hormétique (optimale) pour l’induction des défenses naturelles aux différentes maladies dans les carottes ? Si cette dose existe, jusqu’à combien de temps après la récolte, c’est-à-dire à quel stade physiologique des carottes peut-on effectuer efficacement ce traitement ? Quelle est la température adéquate à utiliser après le traitement pour amener tous les indicateurs de la résistance, notamment la synthèse de la phytoalexine 6-MM, au maximum de leur expression ? Quelle est la persistance de cette résistance induite sur le long terme ? Enfin, cette technique est-elle vulgarisable, c’est-à-dire directement applicable en milieu agricole de production et de conservation ? Ces questions déterminent directement l’objectif général et les objectifs spécifiques de notre travail, qui visent à évaluer l’applicabilité concrète de l’utilisation des radiations UV-C dans l’entreposage longue durée des carottes.
Cette thèse comprend quatre chapitres. Le premier chapitre est une revue de littérature sur la carotte, les interactions plantes – pathogènes, les agents pathogènes post-récoltes de la carotte, les mécanismes de défense naturelle des carottes, les méthodes de lutte contre ces agents pathogènes et l’utilisation des UV-C comme stimulateurs de ces mécanismes. Le deuxième chapitre présente l’étude sur la détermination de la ou des dose(s) hormétique(s) permettant aux carottes de résister aux agents pathogènes postrécoltes majeurs. Le troisième chapitre présente l’impact de la température d’entreposage. Enfin, le quatrième chapitre évalue, d’une part l’effet du stade physiologique (délai post-récolte) des carottes après la récolte sur la résistance des carottes traitées aux UV-C, et d’autre part le maintien de la résistance des carottes en entreposage long terme et commercial à la suite d’un tratement pré-entreposage UV-C.
Chapter 1 : Revue de littérature
1.1 Carotte
1.1.1 Généralités
La carotte, Daucus carota L. fait partie de la famille des Apiacées (Ombellifères), au même titre que le persil, le panais, la coriandre ou le céleri. La caractéristique principale de cette famille est le développement d’une inflorescence en forme de parapluie ("umbrellalike"). Habituellement de forme conique, la racine (carotte) peut être cylindrique, ronde, ou intermédiaire, ses dimensions variant de 1 à 10 cm de diamètre et de 5 à 50 cm de longueur (Rubatzky et Yamaguchi, 1997). En coupe longitudinale, on peut observer différentes couches de tissus constituant la racine de l’extérieur vers l’intérieur : l’épiderme, le parenchyme péricyclique, le phloème, le cambium et le xylème. En plus de la racine, de couleur orange (la plus connue), la carotte peut être de couleur blanche, jaune, rouge ou pourpre. L’anthocyanine est responsable de la couleur rouge pourpre ; l’alpha et le bêta-carotène (provitamine A), responsable des couleurs jaune et orange respectivement, sont les constituants majeurs des caroténoïdes ; les lycopènes sont responsables de la couleur rouge.
Les cultivars de carotte sont classifiés en quatre grands types selon la taille et la forme des racines, mais cette classification est en constante évolution (Mazza, 1989 ; Tsao et Lo, 2006 ; Simon et al., 2008) : (1) le type "Danvers", dont les racines sont de taille moyenne et élargies au collet ; (2) le type "Imperator" qui regroupe des carottes de longue taille ; (3) le type "Nantaise", dont les carottes sont de tailles moyennes et cylindriques ; et (4) le type "Chatenay" dont les carottes sont de petite taille avec le collet arrondi. Au Canada, la carotte est plantée de la mi-mars au mois de juin. Sa germination commence entre 6 et 21 jours après semis, et il faut compter 70 à 120 jours pour que les racines arrivent à maturité. La récolte des carottes débute à la mi-juillet par les carottes en bottes et se termine en novembre (Anonyme, 2004).
1.1.2 Facteurs de conservation de la carotte à l’état frais
Après la récolte, une partie de la production de carottes est entreposée. Des conditions d’entreposage entre 0°C et 1°C, et de 98% à 100% sont recommandées pour que les carottes conservent leurs qualités commerciales et que l’incidence des maladies postrécoltes soit réduite (Van den Berg et Yang, 1969 ; Van den
6
Berg et Lentz, 1973, 1974). Dans ces conditions, les activités métaboliques des produits sont ralenties, de même que les effets des facteurs limitant l’entreposage de la carotte, comme la transpiration, les facteurs liés à la sénescence, et les maladies postrécoltes. Certains désordres physiologiques peuvent également être responsables de pertes postrécoltes (Salunkhe et Desai, 1984). Cependant, les maladies postrécoltes de la carotte représentent les plus grands risques, car les agents pathogènes ont la capacité de se développer à basse température et à haute humidité relative.
1.1.2.1 Respiration
La respiration aérobie est le processus physiologique via lequel il y a consommation d’oxygène (O2) et catabolisme du matériel organique stocké (hydrates de carbone, acides organiques, protéines et lipides) débouchant sur la production d’énergie (ATP), de dioxyde de carbone (CO2), d’eau (H2O), de chaleur appelée chaleur vitale et de formes actives d’oxygène (FAO). Dans le cas de la carotte, il est suggéré d’éliminer rapidement la chaleur provenant du champ et la chaleur vitale par un lavage à l’eau froide. Cela sert de prérefroidissement et permet à la carotte d’atteindre rapidement sa température d’entreposage (Pritchard et al., 1992).
La carotte est classée dans les produits à respiration lente, c’est-à-dire dégageant entre 5 et 10 mg CO2/kg-h à 5°C (Kader, 1987). Si on considère les recommandations de plusieurs auteurs (Van den Berg et Lentz, 1966 ; Apeland et Baugerød, 1971) concernant les températures d’entreposage des carottes, c’est-à-dire entre 0 et 1 °C, la respiration de la carotte passe de lente à très lente, ce qui améliore considérablement sa durée de vie. L’estimation de la quantité d’énergie libérée sous forme de chaleur est nécessaire en postrécolte pour la mise en place de la réfrigération et de la ventilation, afin d’assurer une longueur de vie optimum en entreposage (Kader, 2002a). En atmosphère modifiée, la respiration aérobie des carottes est dangereusement entamée par des concentrations d’O2 en dessous de 8-10% et de CO2 au-dessus de 5% (Apeland et Hoftun, 1974). Leshuk et Salveit (1991) ont montré que les cellules des carottes montraient des signes de respiration anaérobie comme la production de lactates et d’éthanol à des concentrations d’O2 inférieures ou égales à 8%.
1.1.2.2 Transpiration
La transpiration est le transfert de masse de la vapeur d’eau de la surface de l’organe à l’air ambiant, dû à la différence de pression de vapeur, qui elle est affectée par l’humidité relative et la température. La transpiration induit un stress hydrique qui accélère la sénescence des fruits et légumes, ce qui se traduit par une désintégration plus rapide de la membrane plasmique et une fuite cellulaire plus rapide (Ben-Yehoshua, 1987). L’évaluation des effets de la transpiration peut être faite par une mesure de la texture, qui en plus du potentiel hydrique cellulaire, dépend des propriétés élastiques et de la fermeté des tissus (Herppich et al., 2003, 2005). La perte d’eau due à la transpiration peut entraîner la dessiccation, et augmenter les risques d’attaques par les agents pathogènes postrécoltes. Il a été montré que la carotte perdait sa valeur commerciale après une perte d’eau de 8% (Goodlife et Heale, 1977) à cause de la perte de rigidité du produit, mais aussi de la couleur qui décroît en brillance (Van den Berg et Lentz, 1973, 1974). Thorne (1972) expliquait l’augmentation de la susceptibilité aux maladies des carottes par le fait qu’elles deviennent légèrement flasques à cause de l’accroissement des espaces intercellulaires à partir de 8% de perte d’eau.
La différence variétale, la fuite relative des électrolytes et la pression osmotique sont fortement liées au ratio surface/volume dans le cadre de l’estimation du coefficient de transpiration des carottes (Shibairo et al., 1997). La perte d’eau par unité de surface des carottes augmente avec la diminution de la taille de la carotte et est fonction de la forme des carottes, particulièrement pour les plus petites et celles de forme conique (Apeland et BaugerØd, 1971 ; Corrêa et al., 2010, 2012). La perte d’eau des carottes peut être prévenue en prérécolte par
une forte fertilisation potassique (jusqu’à 1 mM K) des sols au champ, ce qui entraîne un gain de poids des carottes, une augmentation de la concentration en potassium, une diminution du potentiel osmotique et de la fuite relative des électrolytes (Shibairo et al., 1998a).
La perte d’eau des carottes peut être comblée par rechargement (réhydratation par immersion dans l’eau). Lentz (1966) a montré que les carottes ayant perdu 7% à 8% de leur eau pouvaient en recouvrer jusqu’à 2,6% après immersion dans de l’eau glacée pendant 24 h et 3% après une semaine d’entreposage dans un mélange glace/eau. Shibairo et al. (1998b) ont montré en plus que la température de l’eau était importante dans le processus de regain d’eau des carottes. Les carottes rechargées dans de l’eau à des températures de 13 et 26°C avaient regagné presque la totalité de leur eau perdue, alors que celles immergées dans l’eau à 0°C en avaient seulement regagné la moitié.
8
1.1.2.3 Facteurs liés à la sénescence
Les facteurs liés à la sénescence sont représentés par les activités métaboliques qui utilisent les ressources accumulées pendant la croissance et la maturation du produit. La sénescence est donc ce processus naturel lié au vieillissement pendant lequel la dégradation des substances du produit est irréversible (Burton, 1982 ; Bruinsma, 1983). Ainsi, la sénescence ne peut être arrêtée, elle peut seulement être ralentie (Lee et al., 1995).
Au fur et à mesure que les fruits et légumes vieillissent, les liaisons entre les substances pectiques des parois cellulaires sont rompues, rendant ces substances plus solubles et enlevant aux tissus leur rigidité. Il en résulte la perte progressive des capacités biosynthétiques des carottes à produire des composés de défense pour se prémunir des maladies (Goodlife et Heale, 1977 ; Heale et Sharman, 1977 ; Eckert, 1978 ; Solomos, 1983).
Au niveau cellulaire, les produits de la respiration aérobie, tels les FAO, s’attaquent aux constituants de la membrane cytoplasmique, notamment les protéines, les acides gras insaturés; de même qu’aux acides nucléiques, aux enzymes et aux parois pecto-cellulosiques (Møller et al., 2007 ; Taiz et Zeiger, 2010). Cela entraîne une accélération du processus de sénescence et le ramollissement des tissus, et dans le cas de la carotte, une perte de la fermeté, et donc de la valeur commerciale et de la durée de vie (Lee et al., 1995).
D’autres facteurs accélérateurs de la sénescence sont les repousses des feuilles au collet et des racines secondaires. Ces phénomènes entraînent la perte de matière sèche, une augmentation du ratio surface/volume du produit, et par conséquent une hausse de la transpiration (Afek et Kays, 2004). Selon les travaux de Halloran et al. (2004, 2005), la variation postrécolte des taux de phytohormones à l’intérieur de la carotte prédéterminerait la différentiation des repousses racinaires et foliares et mettrait donc fin à une courte période de dormance. En bref, cette dernière prendrait fin après une diminution des taux d’acide abscissique (ABA), d’éthylène (ET) et de gibbérellines (GA3) dans les tissus, et une augmentation des niveaux de cytokinines (CK) et d’auxines (AIA).
La carotte est un produit pseudoclimactérique, c’est-à-dire qu’elle ne produit pas d’éthylène autocatalytique, mais qu’elle est sensible à la présence d’éthylène exogène. L’éthylène est l’hormone principale impliquée dans l’accélération du phénomène de sénescence par sa capacité à induire la synthèse de novo d’enzymes, notamment les enzymes de dégradation de la paroi cellulaire, et aussi par l’induction de la synthèse de composés phénoliques contribuant au goût amer du produit par la stimulation de l’activité de la phénylalanine ammonia-lyase (Bruinsma, 1983 ; Lafuente et al., 1996 ; Sarkar et Phan, 1974a, b, 1975, 1979). D’un point de vue pratique, il est conseillé de ne pas entreposer les produits climactériques dans la même enceinte que les
carottes (Phan et al., 1973). Dans le cas où le risque de contact entre l’éthylène et les carottes en entreposage est présent, un traitement préalable au 1-méthylcyclopropène permet d’inhiber les effets de l’éthylène sur les carottes (Fan et Mattheis, 2000 ; Fan et al., 2000 ; Kramer et al., 2012a).
1.1.2.4 Désordres physiologiques de la carotte
Les désordres physiologiques sont des maladies non parasitaires auxquelles on attribue plusieurs causes possibles. Leur nombre s’est vu réduit par la découverte de causes parasitaires attribuées à certaines d’entre elles. Ce fut le cas par exemple du "cavity spot" aujourd’hui attribué à Pythium spp. (Messiaen et al., 1991).
La présence dans la récolte de carottes fourchues, cordelées ou difformes peut être due à des conditions climatiques de culture défavorables, principalement des températures froides, de mauvaises conditions de culture telles que la surfertilisation en phosphore et en azote, ou une forte pression d’agents pathogènes tels que Pythium (Messiaen et al., 1991 ; Vigneault et al., 2008).
L’éclatement des carottes, ou fentes longitudinales, est attribué à des irrégularités dans la disponibilité en eau au champ et à une condensation de l’eau à la surface des carottes en entreposage. Ces changements de la teneur en eau disponible autour de la racine provoquent une augmentation de la turgescence des carottes, résultant en un éclatement des tissus. Il existe une différence de sensibilité des cultivars à ce phénomène. Les fentes longitudinales non seulement déprécient-elles la valeur commerciale du produit, mais représentent également des portes d’entrée pour les agents pathogènes en période postrécolte (Messiaen et al., 1991 ; Howard et al., 1994 ; Vigneault et al., 2008).
La décoloration du collet des carottes peut être attribuée à la synthèse de chlorophylle à la surface des carottes exposées au soleil pendant la culture, occasionnant un verdissement des tissus. Certains cultivars, particulièrement les carottes du type "nantaise", subissent plus fréquemment ce phénomène en raison de la faible densité de leur feuillage. L’exposition des tissus des carottes à de basses températures peut également occasionner un rougissement des tissus, en raison de la synthèse d’anthocyanines. Le rougissement peut se dérouler en combinaison avec le verdissement du collet des carottes, les tissus étant exposés au soleil en journée et aux basses températures la nuit. La décoloration du collet occasionne également une diminution de la valeur commerciale des carottes, spécialement au niveau de l’industrie de la transformation, les tissus affectés devant être éliminés à cause de leur goût amer (Davis et Raid, 2002 ; Vigneault et al., 2008).
10
1.1.2.5 Maladies d’entreposage de la carotte
Plusieurs agents pathogènes peuvent causer des maladies sur les carottes en postrécolte. Il s’agit très souvent de mycoses et, quelquefois, de bactérioses. La contamination peut avoir lieu au champ, les agents pathogènes demeurant dans une période de latence, jusqu’à ce que les conditions d’entreposage et de vieillissement du produit leur permettent de se développer et de provoquer la maladie. La contamination peut aussi avoir lieu lors de la récolte, du transport, ou de la manipulation. Enfin, les racines qui développent les maladies peuvent contaminer les autres par contact ou en portant les propagules aériennes de l’agent pathogène (Messiaen et al., 1991 ; Howard et al., 1994 ; David et Raid, 2002 ; Sommer et al., 2002 ; Davis et Nuñez, 2007 ; Vigneault et al., 2008).
La bactériose la plus importante est la pourriture molle bactérienne causée par Pectobacterium carotovorum subsp. carotovorum (Jones) Hauben et al. Des bactérioses moins fréquentes sont la gale commune causée par Streptomyces scabies (Thaxt.) Waksman & Henrici, et la tumeur du collet causée par Agrobacterium tumefasciens (Smith & Townsend) Conn.
Les mycoses les plus importantes sont la pourriture grise causée par B. cinerea et la pourriture à sclérotes ou pourriture blanche causée par Sclerotinia sclerotiorum. D’autres maladies fongiques courantes sont le rhizoctone (Rhizoctonia carotae), le rhizoctone commun (R. solani), le rhizoctone violet (R. crocorum Pers., syn. R. violaceae Tul. & C. Tul.), la pourriture noire du collet et de la pointe (Mycocentrospora acerina Hartig, syn. Centrospora acerina), la pourriture noire (Alternaria radicina Meier, Drechs. & E. D. Eddy, syn. Stemphylium radicinum), la pourriture noire des racines (Chalara elegans Nag Raj & Kendrick, syn. Thielaviopsis basicola Berk. & Broome), la cavité pythienne (Pythium sulcatum Pratt & Mitchell, P. ultimum Trow, P. intermedium de Bary, P. sylvaticum W. A. Campbell & J. W. Hendrix, P. violae Chesters & C. J. Hickman, P. irregulare Buisman), la pourriture sèche fusarienne (Fusarium solani (Mart.) Sacc.), et la maladie de la bague (Phytophthora megasperma).
La pourriture grise (B. cinerea), la pourriture blanche (S. sclerotiorum), le rhizoctone (R. carotae) et la cavité pythienne (Pythium sulcatum) sont les maladies postrécoltes majeures de la carotte au Québec (Mercier et al., 1993a ; Howard et al., 1994 ; Gilbert, 2001 ; Allain-Boulé et al., 2002 ; Davis et Raid, 2002).
1.2 Interactions plante-agent pathogène
Il existe deux issues suite à l’établissement d’un contact entre un agent potentiellement pathogène et une plante : (1) la relation incompatible, pour laquelle il n’existe soit aucune interaction entre les deux entités de la relation non-hôte, soit qu’elle-ci existe, mais se traduit par la résistance de la plante; et (2) la relation compatible qui aboutit à la multiplication active de l’agent pathogène et à une colonisation de l’hôte ou l’une de ses parties (Hahlbrock et Scheel, 1987; Prusky, 1998; Lepoivre, 2003; Agrios, 2005). Dans la relation compatible (développée brièvement plus bas pour chaque agent pathogène majeur de la carotte), les armes utilisées par l’agent pathogène se définissent biochimiquement soit par l’interaction avec les parois pecto-cellulosiques de l’hôte, soit par l’action des toxines, soit par l’effet de régulateurs de croissance. Dans le cas de la relation incompatible, la résistance des plantes se traduit par le déclenchement de nombreux mécanismes de défense qui peuvent être classés en trois catégories : les moyens de défense structuraux qui agissent comme barrières physiques ralentissant la croissance de l’agent pathogène; les protéines de défense incluant les enzymes, et la production de substances toxiques contre l’agent pathogène, comme les phytoalexines dérivées du métabolisme secondaire (Elad, 1997 ; Benhamou et Picard, 2000 ; Benhamou, 2009).
1.2.1 Arsenal d’attaque des agents pathogènes
La pathogénicité se définit comme la capacité des agents potentiellement pathogènes à provoquer une maladie en interférant avec une ou plusieurs fonctions essentielles dans la plante. Une maladie correspond à tout dysfonctionnement des cellules et tissus végétaux résultant de l’action des agents pathogènes aboutissant au développement de symptômes (Agrios, 2005). Selon leur mode de vie, les agents pathogènes peuvent être classés en plusieurs catégories et sous-catégories (Schumann et D’Arcy, 2010). Les biotrophes sont des organismes capables de se nourrir, de se développer et de se reproduire sur les cellules vivantes de l’hôte. Ils incluent les virus, les viroïdes, certaines bactéries, des nématodes, des protozoaires, des champignons et des Oomycètes responsables de rouille, midiou et oïdium. Parmi les biotrophes, ceux qui ne peuvent vivre que sur des hôtes vivants sont qualifiés de parasites obligatoires. Les agents pathogènes qui peuvent vivre sur les hotes vivants et parfois morts, sur des milieux de cultures ou sur de la matière organique morte, sont des parasites non obligatoires ou hémibiotrophes. Les champignons pathogènes hémibiotrophes peuvent être qualifiés soit de saprophytes facultatifs soit de parasites facultatifs, dépendamment de leur mode de vie privilégié (parasite ou saprophyte).
12
Les agents pathogènes qui attaquent les plantes produisent les enzymes nécessaires pour briser les barrières qui s’opposent à eux. Ainsi, après la production de cutinases pour franchir la cuticule, les agents pathogènes secrètent des enzymes pectolytiques (les polygalacturonases (PG), les pectate lyases (PL), les pectine lyases (PNL) et les pectine-methylestérases (PME)) capables de dégrader la pectine qui est le composé principal de la lamelle mitoyenne séparant deux cellules végétales adjacentes et un composé secondaire des parois pectocellulosiques de ces cellules (Lepoivre, 2003). Les pectinases provoquent une perte de cohésion entre les cellules entrainant un aspect superficiel aqueux, symptômatique de la macération. En plus des enzymes pectolytiques, les agents pathogènes sécrètent d’autres enzymes comme des cellulases, des xylanases, des protéases, des lipases et des phospholipases capables de dégrader les autres constituants des parois et des membranes cellulaires végétales (Corbaz, 1990). Pour attaquer les cellules végétales, en plus des enzymes, les agents pathogènes secrètent des toxines (concomitamment, ou les unes après les autres). Les toxines sont majoritarement produites par les nécrotrophes et représentent un élément important de la pathogénicité de ces derniers, tandis que les biotrophes en secrètent très peu ou pas du tout. Les toxines sont de structures chimiques diverses : peptides, glycoprotéines, polysaccharides, acides organiques, acides gras et leurs dérivés, polypeptides et terpènes. Les modes d’action connus des toxines vont de la modification de la perméabilité membranaire des cellules à l’inactivation ou l’inhibition des enzymes, interrompant ainsi des réactions enzymatiques essentielles aux cellules hôtes. Certaines toxines entraînent l’inhibition ou l’interruption des réactions de défense de l’hôte. Par exemple, l’acide oxalique produit par les champignons phytopathogènes des genres Sclerotium et Sclerotinia, se lie aux ions Ca2+ des pectates, ce qui a pour conséquence d’augmenter la perméabilité de la lamelle mitoyenne et d’accélérer la macération (Corbaz, 1990). Ce composé est produit aussi par les agents pathogènes du genre Corticium pour abaisser le pH de la pulpe de la tomate et annule l’action fongicide de la tomatine, composé préformé antimicrobien de la tomate. La toxine est qualifiée de non spécifique ou de spécifique, respectivement, selon que le spectre de plantes sensibles est plus étendu que sa gamme de plantes-hôtes ou non. Les toxines non spécifiques ne sont pas déterminantes pour la pathogénicité de l’agent pathogène, mais contribuent à augmenter la sévérité des maladies provoquées par ceux-ci. Les toxines produites par les bactéries comme la phaséolotoxine et la tabtoxine, celles produites par le genre Fusarium, l’acide fumarique, l’acide oxalique et la fusicoccine sont des exemples de toxines non spécifiques. Les toxines produites par le genre Cochliobolus (Bipolaris) telles que la victorine (Hv-toxine) ou la HC toxine, ainsi que celles produites par Alternaria alternata sur différentes plantes hôtes, telles la AK toxine, la AAL toxine et la AM toxine sont des exemples de toxines spécifiques. Les agents pathogènes peuvent également interférer sur la teneur en hormones (auxines, cytokinines, gibbéréllines, éthylène, etc.), en les produisant directement ou en induisant leur production par les cellules hôtes (Corbaz, 1990 ; Lepoivre, 2003). Par la modification de la croissance et du développement de la plante hôte, les agents pathogènes augmentent leur approvisionnement en nutriments et modulent leur milieu de vie. Des symptômes
courants de la modification des régulateurs de croissance sont le nanisme ou l’hypercroissance, la formation de galles, et l’élongation des entrenoeuds, etc. Plusieurs agents pathogènes comptent dans leur arsenal d’attaque la capacité de détoxifier les molécules antimicrobiennes produites par les cellules hôtes. C’est le cas des saponines, telles l’avenacine et la tomatine, qui sont détoxifiées par l’avenacinase et la tomatinase, respectivement. Enfin, certains agents pathogènes possèdent comme facteur de pathogénicité, la capacité de supprimer des réactions de défenses initiées par les plantes attaquées. Ces suppresseurs (effecteurs) peuvent intervenir à plusieurs niveaux, par exemple en inhibant l’activité de la phenylanaline ammonialyase (PAL), en réduisant l’activité des ATPases des pompes à protons, ou en réduisant les formes actives d’oxygènes produites par les cellules hôtes (Agrios, 2005).
1.2.2 Barrières des organismes végétaux
La faculté qu’ont les plantes à n’être que peu ou pas infectées lorqu’elles sont en présence d’un agent potentiellement pathogène dans des conditions favorables à l’infection se définit comme la résistance (Agrios, 2005). Face aux moyens d’attaques développés par les agents pathogènes, les plantes opposent plusieurs lignes de défenses, qui peuvent être, soit constitutives (passives), soit induites (actives). Les barrières mises en place sont, soit structurales et ont pour rôle d’empêcher et d’inhiber physiquement l’entrée ou la progression de l’agent pathogène; soit chimiques ou biochimiques et représentent des substances toxiques pour les microbes ou des inhibiteurs de leur croissance dans les tissus hôtes (Corbaz, 1990; Benhamou et Picard, 2000; Lepoivre, 2003; Agrios, 2005, Benhamou, 2009; Schumann et D’Arcy, 2010). La résistance constitutive structurale comprend l’écorce, les poils, les épines, la cire et la cuticule qui recouvrent les cellules épidermiques; elle est liée aussi à la forme et au positionnement des stomates et des lenticelles (à la surface inférieure des feuilles). Elle comprend également des tissus constitués de cellules à parois pectocellulosiques épaisses, souvent par la mise en commun de deux ou plusieurs composants de défense comme la callose, les composés phénoliques, la silice, le calcium, la subérine et la lignine, et la couche externe subérisée des bulbes et des tubercules. Les défenses constitutives chimiques sont un ensemble de composés connus sous le nom de phytoanticipines; elles rassemblent des composés de structures chimiques diverses comme les terpènes, les composés phénoliques et les composés cyanogènes. Parmi les composés chimiques préformés les plus cités, il y a le catéchol et l’acide protocatéchuique dans la pelure d’oignon, et les saponines telles l’avenacine dans l’avoine et la tomatine dans la tomate. La résistance biochimique passive implique plusieurs types de protéines : certaines sont des inhibitrices de protéinases telles les phytocystatines; d’autres comme les lectines de la paroi cellulaire, se lient spécifiquement à certains sucres des bactéries ou servent de récepeteur pour l’induction de réactions de défenses; enfin les enzymes hydrolytiques, telles les chitinases et les glucanases, peuvent attaquer la paroi de certains agents pathogènes. Les défenses structurales induites