ﺎﻨﺘﻤﻠﻋ ﺎﻣ ﻻﺇ ﺎﻨﻟ ﻢﻠﻋ ﻻ ﻚﻧﺎﺤﺒﺳ
ﻢﻴﻜﳊﺍ ﻢﻴﻠﻌﻟﺍ ﺖﻧﺃ ﻚﻧﺇ
ﺔﻳﻵﺍ :ﺓﺮﻘﺒﻟﺍ ﺓﺭﻮﺳ
31
MOHAMMED V DE RABAT
FACULTE DE MEDECINE ET DE PHARMACIE - RABAT
DOYENS HONORAIRES :
1962 – 1969 : Professeur Abdelmalek FARAJ 1969 – 1974 : Professeur Abdellatif BERBICH 1974 – 1981 : Professeur Bachir LAZRAK 1981 – 1989 : Professeur Taieb CHKILI
1989 – 1997 : Professeur Mohamed Tahar ALAOUI 1997 – 2003 : Professeur Abdelmajid BELMAHI 2003 - 2013 : Professeur Najia HAJJAJ – HASSOUNI
ADMINISTRATION :
DoyenProfesseur Mohamed ADNAOUI
Vice-Doyen chargé des Affaires Académiques et estudiantines
Professeur Brahim LEKEHAL
Vice-Doyen chargé de la Recherche et de la Coopération
Professeur Toufiq DAKKA
Vice-Doyen chargé des Affaires Spécifiques à la Pharmacie
Professeur Jamal TAOUFIK
Secrétaire Général
1 - ENSEIGNANTS-CHERCHEURS MEDECINS ET PHARMACIENS
PROFESSEURS :
DECEMBRE 1984
Pr. MAAOUNI Abdelaziz Médecine Interne – Clinique Royale
Pr. MAAZOUZI Ahmed Wajdi Anesthésie -Réanimation Pr. SETTAF Abdellatif Pathologie Chirurgicale NOVEMBRE ET DECEMBRE 1985
Pr. BENSAID Younes Pathologie Chirurgicale
JANVIER, FEVRIER ET DECEMBRE 1987
Pr. LACHKAR Hassan Médecine Interne
Pr. YAHYAOUI Mohamed Neurologie
DECEMBRE 1989
Pr. ADNAOUI Mohamed Médecine Interne –Doyen de la FMPR
Pr. OUAZZANI Taïbi Mohamed Réda Neurologie
JANVIER ET NOVEMBRE 1990
Pr. HACHIM Mohammed* Médecine-Interne
Pr. KHARBACH Aîcha Gynécologie -Obstétrique
Pr. TAZI Saoud Anas Anesthésie Réanimation
FEVRIER AVRIL JUILLET ET DECEMBRE 1991 Pr. AZZOUZI Abderrahim Anesthésie Réanimation- Doyen de FMPO
Pr. BAYAHIA Rabéa Néphrologie
DECEMBRE 1992
Pr. AHALLAT Mohamed Chirurgie Générale Doyen de FMPT
Pr. BENSOUDA Adil Anesthésie Réanimation
Pr. CHAHED OUAZZANI Laaziza Gastro-Entérologie
Pr. CHRAIBI Chafiq Gynécologie Obstétrique
Pr. EL OUAHABI Abdessamad Neurochirurgie
Pr. FELLAT Rokaya Cardiologie
Pr. GHAFIR Driss* Médecine Interne
Pr. JIDDANE Mohamed Anatomie
Pr. TAGHY Ahmed Chirurgie Générale
Pr. ZOUHDI Mimoun Microbiologie
MARS 1994
Pr. BENJAAFAR Noureddine Radiothérapie
Pr. BEN RAIS Nozha Biophysique
Pr. CAOUI Malika Biophysique
Pr. CHRAIBI Abdelmjid
Endocrinologie et Maladies Métaboliques Doyen de la
FMPA
Pr. EL AMRANI Sabah Gynécologie Obstétrique Pr. EL BARDOUNI Ahmed Traumato-Orthopédie Pr. EL HASSANI My Rachid Radiologie
Pr. ERROUGANI Abdelkader Chirurgie Générale – Directeur du CHIS-Rabat
Pr. ESSAKALI Malika Immunologie
Pr. ETTAYEBI Fouad Chirurgie Pédiatrique
Pr. HASSAM Badredine Dermatologie
Pr. IFRINE Lahssan Chirurgie Générale
Pr. MAHFOUD Mustapha Traumatologie – Orthopédie Pr. RHRAB Brahim Gynécologie –Obstétrique
Pr. SENOUCI Karima Dermatologie
MARS 1994
Pr. ABBAR Mohamed* Urologie Directeur Hôpital My Ismail Meknès Pr. ABDELHAK M’barek Chirurgie – Pédiatrique
Pr. BENTAHILA Abdelali Pédiatrie
Pr. BENYAHIA Mohammed Ali Gynécologie – Obstétrique Pr. BERRADA Mohamed Saleh Traumatologie – Orthopédie Pr. CHERKAOUI Lalla Ouafae Ophtalmologie
Pr. LAKHDAR Amina Gynécologie Obstétrique
Pr. MOUANE Nezha Pédiatrie
MARS 1995
Pr. ABOUQUAL Redouane Réanimation Médicale
Pr. AMRAOUI Mohamed Chirurgie Générale Pr. BAIDADA Abdelaziz Gynécologie Obstétrique
Pr. BARGACH Samir Gynécologie Obstétrique Pr. DRISSI KAMILI Med Nordine* Anesthésie Réanimation Pr. EL MESNAOUI Abbes Chirurgie Générale Pr. ESSAKALI HOUSSYNI Leila Oto-Rhino-Laryngologie
Pr. HDA Abdelhamid* Cardiologie Inspecteur du Service de Santé des FAR Pr. IBEN ATTYA ANDALOUSSI Ahmed Urologie
Pr. OUAZZANI CHAHDI Bahia Ophtalmologie
Pr. SEFIANI Abdelaziz Génétique
Pr. ZEGGWAGH Amine Ali Réanimation Médicale DECEMBRE 1996
Pr. AMIL Touriya* Radiologie
Pr. BELKACEM Rachid Chirurgie Pédiatrie Pr. BOULANOUAR Abdelkrim Ophtalmologie Pr. EL ALAMI EL FARICHA EL Hassan Chirurgie Générale
Pr. GAOUZI Ahmed Pédiatrie
Pr. MAHFOUDI M’barek* Radiologie
Pr. OUZEDDOUN Naima Néphrologie
Pr. ZBIR EL Mehdi* Cardiologie DirecteurHôp.Mil. d’Instruction Med V Rabat NOVEMBRE 1997
Pr. ALAMI Mohamed Hassan Gynécologie-Obstétrique
Pr. BEN SLIMANE Lounis Urologie
Pr. BIROUK Nazha Neurologie
Pr. ERREIMI Naima Pédiatrie
Pr. FELLAT Nadia Cardiologie
Pr. KADDOURI Noureddine Chirurgie Pédiatrique
Pr. KOUTANI Abdellatif Urologie
Pr. LAHLOU Mohamed Khalid Chirurgie Générale
Pr. MAHRAOUI CHAFIQ Pédiatrie
Pr. TOUFIQ Jallal Psychiatrie Directeur Hôp.Ar-razi Salé
Pr. YOUSFI MALKI Mounia Gynécologie Obstétrique NOVEMBRE 1998
Pr. ECHARRAB El Mahjoub Chirurgie Générale Pr. EL FTOUH Mustapha Pneumo-phtisiologie
Pr. EL MOSTARCHID Brahim* Neurochirurgie
Pr. MAHMOUDI Abdelkrim* Anesthésie-Réanimation Pr. TACHINANTE Rajae Anesthésie-Réanimation Pr. TAZI MEZALEK Zoubida Médecine Interne NOVEMBRE 2000
Pr. AIDI Saadia Neurologie
Pr. AJANA Fatima Zohra Gastro-Entérologie
Pr. BENAMR Said Chirurgie Générale
Pr. CHERTI Mohammed Cardiologie
Pr. ECH-CHERIF EL KETTANI Selma Anesthésie-Réanimation
Pr. EL HASSANI Amine Pédiatrie - Directeur Hôp.Cheikh Zaid
Pr. EL KHADER Khalid Urologie
Pr. EL MAGHRAOUI Abdellah* Rhumatologie
Pr. GHARBI Mohamed El Hassan Endocrinologie et Maladies Métaboliques
Pr. MDAGHRI ALAOUI Asmae Pédiatrie
Pr. ROUIMI Abdelhadi* Neurologie
DECEMBRE 2000
Pr.ZOHAIR ABDELLAH * ORL
Pr. BALKHI Hicham* Anesthésie-Réanimation
Pr. BENABDELJLIL Maria Neurologie
Pr. BENAMAR Loubna Néphrologie
Pr. BENAMOR Jouda Pneumo-phtisiologie
Pr. BENELBARHDADI Imane Gastro-Entérologie
Pr. BENNANI Rajae Cardiologie
Pr. BENOUACHANE Thami Pédiatrie
Pr. BEZZA Ahmed* Rhumatologie
Pr. BOUCHIKHI IDRISSI Med Larbi Anatomie Pr. BOUMDIN El Hassane* Radiologie
Pr. CHAT Latifa Radiologie
Pr. DAALI Mustapha* Chirurgie Générale Pr. DRISSI Sidi Mourad* Radiologie
Pr. EL HIJRI Ahmed Anesthésie-Réanimation Pr. EL MAAQILI Moulay Rachid Neuro-Chirurgie Pr. EL MADHI Tarik Chirurgie-Pédiatrique Pr. EL OUNANI Mohamed Chirurgie Générale
Pr. ETTAIR Said Pédiatrie - Directeur Hôp. d’EnfantsRabat
Pr. GAZZAZ Miloudi* Neuro-Chirurgie
Pr. HRORA Abdelmalek Chirurgie Générale
Pr. KABIRI EL Hassane* Chirurgie Thoracique Pr. LAMRANI Moulay Omar Traumatologie Orthopédie
Pr. LEKEHAL Brahim Chirurgie Vasculaire Périphérique Pr. MAHASSIN Fattouma* Médecine Interne
Pr. MEDARHRI Jalil Chirurgie Générale Pr. MIKDAME Mohammed* Hématologie Clinique
Pr. MOHSINE Raouf Chirurgie Générale
Pr. NOUINI Yassine Urologie - Directeur Hôpital Ibn Sina
Pr. SABBAH Farid Chirurgie Générale
Pr. SEFIANI Yasser Chirurgie Vasculaire Périphérique Pr. TAOUFIQ BENCHEKROUN Soumia Pédiatrie
DECEMBRE 2002
Pr. AL BOUZIDI Abderrahmane* Anatomie Pathologique
Pr. AMEUR Ahmed * Urologie
Pr. AMRI Rachida Cardiologie
Pr. AOURARH Aziz* Gastro-Entérologie
Pr. BAMOU Youssef * Biochimie-Chimie
Pr. BELMEJDOUB Ghizlene* Endocrinologie et Maladies Métaboliques
Pr. BENZEKRI Laila Dermatologie
Pr. BENZZOUBEIR Nadia Gastro-Entérologie Pr. BERNOUSSI Zakiya Anatomie Pathologique Pr. BICHRA Mohamed Zakariya* Psychiatrie
Pr. CHOHO Abdelkrim * Chirurgie Générale
Pr. CHKIRATE Bouchra Pédiatrie
Pr. EL ALAMI EL Fellous Sidi Zouhair Chirurgie Pédiatrique Pr. EL HAOURI Mohamed * Dermatologie
Pr. FILALI ADIB Abdelhai Gynécologie Obstétrique
Pr. HAJJI Zakia Ophtalmologie
Pr. IKEN Ali Urologie
Pr. JAAFAR Abdeloihab* Traumatologie Orthopédie
Pr. KRIOUILE Yamina Pédiatrie
JANVIER 2004
Pr. ABDELLAH El Hassan Ophtalmologie
Pr. AMRANI Mariam Anatomie Pathologique
Pr. BENBOUZID Mohammed Anas Oto-Rhino-Laryngologie Pr. BENKIRANE Ahmed* Gastro-Entérologie
Pr. BOULAADAS Malik Stomatologie et Chirurgie Maxillo-faciale
Pr. BOURAZZA Ahmed* Neurologie
Pr. CHAGAR Belkacem* Traumatologie Orthopédie
Pr. CHERRADI Nadia Anatomie Pathologique
Pr. EL FENNI Jamal* Radiologie
Pr. EL HANCHI ZAKI Gynécologie Obstétrique Pr. EL KHORASSANI Mohamed Pédiatrie
Pr. EL YOUNASSI Badreddine* Cardiologie
Pr. HACHI Hafid Chirurgie Générale
Pr. JABOUIRIK Fatima Pédiatrie
Pr. KHARMAZ Mohamed Traumatologie Orthopédie Pr. MOUGHIL Said Chirurgie Cardio-Vasculaire Pr. OUBAAZ Abdelbarre * Ophtalmologie
Pr. TARIB Abdelilah* Pharmacie Clinique
Pr. TIJAMI Fouad Chirurgie Générale
Pr. ZARZUR Jamila Cardiologie
JANVIER 2005
Pr. ABBASSI Abdellah Chirurgie Réparatrice et Plastique Pr. AL KANDRY Sif Eddine* Chirurgie Générale
Pr. ALLALI Fadoua Rhumatologie
Pr. AMAZOUZI Abdellah Ophtalmologie
Pr. AZIZ Noureddine* Radiologie
Pr. BAHIRI Rachid Rhumatologie Directeur Hôp. Al Ayachi Salé
Pr. BARKAT Amina Pédiatrie
Pr. BENYASS Aatif Cardiologie
Pr. DOUDOUH Abderrahim* Biophysique Pr. EL HAMZAOUI Sakina * Microbiologie
Pr. HAJJI Leila Cardiologie (mise en disponibilité
Pr. HESSISSEN Leila Pédiatrie
Pr. JIDAL Mohamed* Radiologie
Pr. LAAROUSSI Mohamed Chirurgie Cardio-vasculaire Pr. LYAGOUBI Mohammed Parasitologie
Pr. RAGALA Abdelhak Gynécologie Obstétrique
Pr. SBIHI Souad Histo-Embryologie Cytogénétique Pr. ZERAIDI Najia Gynécologie Obstétrique
AVRIL 2006
Pr. ACHEMLAL Lahsen* Rhumatologie
Pr. AKJOUJ Said* Radiologie
Pr. BELMEKKI Abdelkader* Hématologie
Pr. BENCHEIKH Razika O.R.L
Pr. BIYI Abdelhamid* Biophysique
Pr. BOUHAFS Mohamed El Amine Chirurgie - Pédiatrique
Pr. BOULAHYA Abdellatif* Chirurgie Cardio – Vasculaire. Pr. CHENGUETI ANSARI Anas Gynécologie Obstétrique
Pr. DOGHMI Nawal Cardiologie
Pr. FELLAT Ibtissam Cardiologie
Pr. FAROUDY Mamoun Anesthésie Réanimation Pr. HARMOUCHE Hicham Médecine Interne Pr. HANAFI Sidi Mohamed* Anesthésie Réanimation Pr. IDRISS LAHLOU Amine* Microbiologie
Pr. JROUNDI Laila Radiologie
Pr. KARMOUNI Tariq Urologie
Pr. KILI Amina Pédiatrie
Pr. KISRA Hassan Psychiatrie
Pr. KISRA Mounir Chirurgie – Pédiatrique Pr. LAATIRIS Abdelkader* Pharmacie Galénique Pr. LMIMOUNI Badreddine* Parasitologie
Pr. MANSOURI Hamid* Radiothérapie
Pr. OUANASS Abderrazzak Psychiatrie
Pr. SAFI Soumaya* Endocrinologie
Pr. SEKKAT Fatima Zahra Psychiatrie
Pr. SOUALHI Mouna Pneumo – Phtisiologie
Pr. TELLAL Saida* Biochimie
Pr. ZAHRAOUI Rachida Pneumo – Phtisiologie DECEMBRE 2006
Pr. BOUTIMZINE Nourdine Ophtalmologie Pr. CHERKAOUI Naoual * Pharmacie galénique Pr. EHIRCHIOU Abdelkader * Chirurgie générale
Pr. EL BEKKALI Youssef * Chirurgie cardio-vasculaire Pr. EL ABSI Mohamed Chirurgie générale
Pr. EL MOUSSAOUI Rachid Anesthésie réanimation Pr. EL OMARI Fatima Psychiatrie
Pr. GHARIB Noureddine Chirurgie plastique et réparatrice Pr. HADADI Khalid * Radiothérapie
Pr. ICHOU Mohamed * Oncologie médicale
Pr. ISMAILI Nadia Dermatologie
Pr. KEBDANI Tayeb Radiothérapie
Pr. LALAOUI SALIM Jaafar * Anesthésie réanimation Pr. LOUZI Lhoussain * Microbiologie
Pr. MADANI Naoufel Réanimation médicale
Pr. MAHI Mohamed * Radiologie
Pr. MARC Karima Pneumo phtisiologie
Pr. MASRAR Azlarab Hématologie biologique
Pr. MRANI Saad * Virologie
Pr. OUZZIF Ez zohra * Biochimie-chimie
Pr. RABHI Monsef * Médecine interne
Pr. RADOUANE Bouchaib* Radiologie Pr. SEFFAR Myriame Microbiologie Pr. SEKHSOKH Yessine * Microbiologie
Pr. SIFAT Hassan * Radiothérapie
Pr. TABERKANET Mustafa * Chirurgie vasculaire périphérique
Pr. TACHFOUTI Samira Ophtalmologie
Pr. TAJDINE Mohammed Tariq* Chirurgie générale Pr. TANANE Mansour * Traumatologie-orthopédie
Pr. TLIGUI Houssain Parasitologie
Pr. TOUATI Zakia Cardiologie
DECEMBRE 2008
Pr TAHIRI My El Hassan* Chirurgie Générale MARS 2009
Pr. ABOUZAHIR Ali * Médecine interne
Pr. AGADR Aomar * Pédiatrie
Pr. AIT ALI Abdelmounaim * Chirurgie Générale Pr. AIT BENHADDOU El Hachmia Neurologie
Pr. AKHADDAR Ali * Neuro-chirurgie
Pr. ALLALI Nazik Radiologie
Pr. ARKHA Yassir Neuro-chirurgie Directeur Hôp.des Spécialités Pr. BELYAMANI Lahcen* Anesthésie Réanimation
Pr. BJIJOU Younes Anatomie
Pr. BOUHSAIN Sanae * Biochimie-chimie
Pr. BOUI Mohammed * Dermatologie
Pr. BOUNAIM Ahmed * Chirurgie Générale Pr. BOUSSOUGA Mostapha * Traumatologie-orthopédie
Pr. CHTATA Hassan Toufik * Chirurgie Vasculaire Périphérique Pr. DOGHMI Kamal * Hématologie clinique
Pr. EL MALKI Hadj Omar Chirurgie Générale Pr. EL OUENNASS Mostapha* Microbiologie
Pr. ENNIBI Khalid * Médecine interne
Pr. FATHI Khalid Gynécologie obstétrique
Pr. HASSIKOU Hasna * Rhumatologie
Pr. KABBAJ Nawal Gastro-entérologie
Pr. KABIRI Meryem Pédiatrie
Pr. KARBOUBI Lamya Pédiatrie
Pr. LAMSAOURI Jamal * Chimie Thérapeutique Pr. MARMADE Lahcen Chirurgie Cardio-vasculaire
Pr. MESKINI Toufik Pédiatrie
Pr. MESSAOUDI Nezha * Hématologie biologique
Pr. MSSROURI Rahal Chirurgie Générale
Pr. NASSAR Ittimade Radiologie
Pr. OUKERRAJ Latifa Cardiologie
Pr. RHORFI Ismail Abderrahmani * Pneumo-Phtisiologie OCTOBRE 2010
Pr. ALILOU Mustapha Anesthésie réanimation Pr. AMEZIANE Taoufiq* Médecine Interne Pr. BELAGUID Abdelaziz Physiologie
Pr. CHADLI Mariama* Microbiologie
Pr. CHEMSI Mohamed* Médecine Aéronautique
Pr. DAMI Abdellah* Biochimie- Chimie
Pr. DARBI Abdellatif* Radiologie
DECEMBRE 2010
Pr.ZNATI Kaoutar Anatomie Pathologique
MAI 2012
Pr. AMRANI Abdelouahed Chirurgie pédiatrique Pr. ABOUELALAA Khalil * Anesthésie Réanimation Pr. BENCHEBBA Driss * Traumatologie-orthopédie Pr. DRISSI Mohamed * Anesthésie Réanimation Pr. EL ALAOUI MHAMDI Mouna Chirurgie Générale Pr. EL KHATTABI Abdessadek * Médecine Interne Pr. EL OUAZZANI Hanane * Pneumophtisiologie Pr. ER-RAJI Mounir Chirurgie Pédiatrique
Pr. JAHID Ahmed Anatomie Pathologique
Pr. MEHSSANI Jamal * Psychiatrie
Pr. RAISSOUNI Maha * Cardiologie
* Enseignants Militaires FEVRIER 2013
Pr.AHID Samir Pharmacologie
Pr.AIT EL CADI Mina Toxicologie
Pr.AMRANI HANCHI Laila Gastro-Entérologie
Pr.AMOR Mourad Anesthésie Réanimation
Pr.AWAB Almahdi Anesthésie Réanimation
Pr.BELAYACHI Jihane Réanimation Médicale Pr.BELKHADIR Zakaria Houssain Anesthésie Réanimation
Pr.BENCHEKROUN Laila Biochimie-Chimie
Pr.BENKIRANE Souad Hématologie
Pr.BENNANA Ahmed* Informatique Pharmaceutique Pr.BENSGHIR Mustapha * Anesthésie Réanimation Pr.BENYAHIA Mohammed * Néphrologie
Pr.BOUATIA Mustapha Chimie Analytique et Bromatologie Pr.BOUABID Ahmed Salim* Traumatologie orthopédie
Pr BOUTARBOUCH Mahjouba Anatomie
Pr.CHAIB Ali * Cardiologie
Pr.DENDANE Tarek Réanimation Médicale
Pr.DINI Nouzha * Pédiatrie
Pr.ECH-CHERIF EL KETTANI Mohamed Ali Anesthésie Réanimation Pr.ECH-CHERIF EL KETTANI Najwa Radiologie
Pr.EL FATEMI NIZARE Neuro-chirurgie Pr.EL GUERROUJ Hasnae Médecine Nucléaire Pr.EL HARTI Jaouad Chimie Thérapeutique
Pr.EL JAOUDI Rachid * Toxicologie
Pr.EL KABABRI Maria Pédiatrie
Pr.EL KHANNOUSSI Basma Anatomie Pathologique
Pr.EL KHLOUFI Samir Anatomie
Pr.EL KORAICHI Alae Anesthésie Réanimation
Pr.EN-NOUALI Hassane * Radiologie
Pr.ERRGUIG Laila Physiologie
Pr.FIKRI Meryem Radiologie
Pr.GHFIR Imade Médecine Nucléaire
Pr.IMANE Zineb Pédiatrie
Pr.IRAQI Hind Endocrinologie et maladies métaboliques
Pr.KABBAJ Hakima Microbiologie
Pr.KADIRI Mohamed * Psychiatrie
Pr.MAAMAR Mouna Fatima Zahra Médecine Interne
Pr.MEDDAH Bouchra Pharmacologie
Pr.MELHAOUI Adyl Neuro-chirurgie
Pr.MRABTI Hind Oncologie Médicale
Pr.NEJJARI Rachid Pharmacognosie
Pr.OUBEJJA Houda Chirugie Pédiatrique
Pr.OUKABLI Mohamed * Anatomie Pathologique
Pr.RAHALI Younes Pharmacie Galénique
Pr.RATBI Ilham Génétique
Pr.RAHMANI Mounia Neurologie
Pr.REDA Karim * Ophtalmologie
Pr.REGRAGUI Wafa Neurologie
Pr.RKAIN Hanan Physiologie
Pr.ROSTOM Samira Rhumatologie
Pr.ROUAS Lamiaa Anatomie Pathologique Pr.ROUIBAA Fedoua * Gastro-Entérologie
Pr SALIHOUN Mouna Gastro-Entérologie
Pr.SAYAH Rochde Chirurgie Cardio-Vasculaire
AVRIL 2013
Pr.EL KHATIB MOHAMED KARIM * Stomatologie et Chirurgie Maxillo-faciale MAI 2013
Pr.BOUSLIMAN Yassir Toxicologie
MARS 2014
Pr. ACHIR Abdellah Chirurgie Thoracique
Pr.BENCHAKROUN Mohammed * Traumatologie- Orthopédie
Pr.BOUCHIKH Mohammed Chirurgie Thoracique
Pr. EL KABBAJ Driss * Néphrologie
Pr. EL MACHTANI IDRISSI Samira * Biochimie-Chimie
Pr. HARDIZI Houyam Histologie- Embryologie-Cytogénétique
Pr. HASSANI Amale * Pédiatrie
Pr. HERRAK Laila Pneumologie
Pr. JANANE Abdellah * Urologie
Pr. JEAIDI Anass * Hématologie Biologique
Pr. KOUACH Jaouad* Gynécologie-Obstétrique
Pr. LEMNOUER Abdelhay* Microbiologie
Pr. MAKRAM Sanaa * Pharmacologie
Pr. OULAHYANE Rachid* Chirurgie Pédiatrique
Pr. RHISSASSI Mohamed Jaafar CCV
Pr. SABRY Mohamed* Cardiologie
Pr. SEKKACH Youssef* Médecine Interne
Pr. TAZI MOUKHA Zakia Gynécologie-Obstétrique
AVRIL 2014
PROFESSEURS AGREGES : DECEMBRE 2014
Pr. ABILKASSEM Rachid* Pédiatrie
Pr. AIT BOUGHIMA Fadila Médecine Légale
Pr. BEKKALI Hicham * Anesthésie-Réanimation
Pr. BENAZZOU Salma Chirurgie Maxillo-Faciale
Pr. BOUABDELLAH Mounya Biochimie-Chimie
Pr. BOUCHRIK Mourad* Parasitologie
Pr. DERRAJI Soufiane* Pharmacie Clinique
Pr. DOBLALI Taoufik* Microbiologie
Pr. EL AYOUBI EL IDRISSI Ali Anatomie
Pr. EL GHADBANE Abdedaim Hatim* Anesthésie-Réanimation
Pr. EL MARJANY Mohammed* Radiothérapie
Pr. FEJJAL Nawfal Chirurgie Réparatrice et Plastique
Pr. JAHIDI Mohamed* O.R.L
Pr. LAKHAL Zouhair* Cardiologie
Pr. OUDGHIRI NEZHA Anesthésie-Réanimation
Pr. RAMI Mohamed Chirurgie Pédiatrique
Pr. SABIR Maria Psychiatrie
Pr. SBAI IDRISSI Karim* Médecine préventive, santé publique et Hyg. AOUT 2015
Pr. MEZIANE Meryem Dermatologie
Pr. TAHRI Latifa Rhumatologie
JANVIER 2016
Pr. BENKABBOU Amine Chirurgie Générale
Pr. EL ASRI Fouad* Ophtalmologie
Pr. ERRAMI Noureddine* O.R.L
2 - ENSEIGNANTS-CHERCHEURS SCIENTIFIQUES
PROFESSEURS/Prs. HABILITES
Pr. ABOUDRAR Saadia Physiologie
Pr. ALAMI OUHABI Naima Biochimie-chimie
Pr. ALAOUI KATIM Pharmacologie
Pr. ALAOUI SLIMANI Lalla Naïma Histologie-Embryologie
Pr. ANSAR M’hammed Chimie Organique et Pharmacie Chimique
Pr .BARKIYOU Malika Histologie-Embryologie
Pr. BOUHOUCHE Ahmed Génétique Humaine
Pr. BOUKLOUZE Abdelaziz Applications Pharmaceutiques Pr. CHAHED OUAZZANI Lalla Chadia Biochimie-chimie
Pr. DAKKA Taoufiq Physiologie
Pr. FAOUZI Moulay El Abbes Pharmacologie
Pr. IBRAHIMI Azeddine Biologie moléculaire/Biotechnologie
Pr. KHANFRI Jamal Eddine Biologie
Pr. OULAD BOUYAHYA IDRISSI Med Chimie Organique
Pr. REDHA Ahlam Chimie
Pr. TOUATI Driss Pharmacognosie
Pr. ZAHIDI Ahmed Pharmacologie
Mise à jour le 10/10/2018 Khaled Abdellah
A ALLAH
Au Bon DIEU tout puissant
Qui m’a inspirée
Qui m’a guidé dans le bon chemin
Je vous dois ce que je suis devenue
Louanges et remerciements
Pour votre clémence et miséricorde.
A Mes très chers parents
Je reviens à mes années d'études où vous ne cessiez de m'apporter le soutien
nécessaire, de m'offrir les conditions adéquates pour réussir mon parcours, et
de me faire ressentir l'affection parentale.
Aucun merci ne saurait exprimer mon amour, et ma forte reconnaissance!
Vous faites certainement partie de ce travail!
A Ma très chère sœur Fatima, et son mari.
Ta préoccupation était toujours celle d'une grande sœur.
Merci ma très chère sœur pour ton affection! Merci pour ta présence à
chaque fois que j'en avais besoin!
Je te souhaite un grand bonheur dans ta vie conjugale ainsi que dans ton
lien maternel.
A Mes chers frères, et leurs femmes
En témoignage de toute l'affection et des profonds sentiments fraternels que
je vous porte et de l'attachement qui nous unit.
A mon très cher oncle Massir et à son épouse Aicha .A mes chères cousines
Imane et Mounia et à mon cher cousin Yahya
Votre soutien, votre dévouement et votre amour ont été une grande source
de motivation pour moi.
Votre aide m’a toujours été précieux. Je vous souhaite tout le bonheur que
vous méritez.
A la mémoire de mes grands parents paternels,
Et à mes grands parents maternels
Je vous remercie pour tout ce que vous avez fait pour moi, je vous en serais
à jamais reconnaissant.
A ma deuxième famille mi Rqia, Fatoum, Ibrahim et leurs filles Fatima
Ezzahra et Dounia
Vous nous avez accueillis chez vous, vous nous avez soutenus et aidé dans
les moments difficiles.
Je vous en serai toujours reconnaissante et soyez assurés de mon estime et
mon profond respect.
A mes cher(e)s Zahra, Fatima Ezzahra, Fatima, Kaltoum, Jamaa
Vous étiez toujours présent(e)s pour me soutenir, m’écouter et me gâter
durant ce long et difficile parcours. Vous m’avez beaucoup aidée, je vous en
A tous mes amis (es)
Je ne peux trouver les mots justes et sincères pour vous exprimer mon
affection et mes pensées, vous êtes pour moi des frères et sœurs et des amis
sur qui je peux compter.
Je vous souhaite une vie pleine de santé et de bonheur.
A tous mes maîtres de l’enseignement primaire, de l’enseignement
secondaire, et de l’enseignement supérieur
En témoignage de mon affection et respect
A toute personne qui a contribué de près ou de loin à la réalisation de ce
travail
A Notre Maître et Président de Thèse
Monsieur ANSAR M’hammed
Professeur de chimie organique
L'honneur que vous nous accordez en présidant ce travail, n'a d'égal que
notre profonde gratitude et reconnaissance.
Veuillez trouver ici, Monsieur, l'expression de notre haute estime et notre
grand respect.
A Notre Maître et Rapporteur de Thèse
Monsieur Jaouad El HARTI
Professeur de chimie thérapeutique
En acceptant d'encadrer ce travail, vous nous avez fait un grand honneur,
Vous nous avez toujours accueilli avec bienveillance et aidé à mener à bien
cette thèse.
Veuillez, Monsieur, accepter l'expression de notre dévouement, notre
profond respect et notre reconnaissance.
A Notre Maître et Juge de Thèse
Monsieur NEJJARI Rachid
Professeur de pharmacognosie
Nous avons l’honneur de vous compter parmi les membres du jury de notre
thèse.
Veuillez trouver dans ce travail, l’expression de notre profond respect et nos
vifs remerciements.
A Notre Maître et Juge de Thèse
Monsieur OULAD BOUYAHYA IDRISSI Mohammed
Professeur de chimie analytique
C’est pour nous un immense plaisir de vous voir siéger parmi le jury de notre
thèse.
Vos qualités humaines et professionnelles sont exemplaires.
Nous vous prions de croire en l’expression de notre respect et reconnaissance
d’avoir accepté de juger ce travail.
LISTE
Abréviations
AELE : Association Européenne de Libre-Echange
AFSSAPS : Agence Française de Sécurité Sanitaire des Produits de Santé
AMM : Autorisation de Mise sur Marché
ASMR : Amélioration du Service Médical Rendu
AUR/ ASC : Area Under the Curve / Aire Sous la Courbe CDER : Centre of Drug Evaluation and Research
CIP : Cahn-Ingold-Prelog
CPAC : Conseil Central des Affaires Pharmaceutiques CPMP : Committee for Proprietary Medicinal Products
CSP : Chiral stationnary phase
DC : Dichroïsme Circulaire
EC : Enzyme Commission
EE : Excès Enantiomérique
EEE : Espace Economique Européen
EMEA : Agence Européenne pour l’Evaluation des Médicaments
FDA : Food and Drug Administration
HPLC : High Performance Liquid Chromatography
ICH : International Council for Harmonisation
INESSS : Institut National d'Excellence en Santé et Services Sociaux IPP : Inhibiteur de la Pompe à Proton
IUPAC : International Union of Pure and Applied Chemistry
NDA : Nouvelles Directives d’Application
OE : Œsophagite Erosive
PSMB : Pharmaceutical and Medical Safety Bureau
RGO : Reflux Gastro-Œsophagien
LISTE
Liste des figures
Figure 1: Le carbone asymétrique selon la convention de CRAM et HAMMOND ... 7 Figure 2: Exemple de molécule chirale ... 8 Figure 3: Exemple des molécules avec différents centres d’asymétrie ... 8 Figure 4: Diastéréoisomère et énantiomères de l’éphedrine. ... 10 Figure 5: Exemple de l’acide méso-tartrique ... 11 Figure 6: Exemple de l’isomère cis-trans ... 11 Figure 7: Représentation shématique des différentes formes cristallines d’un mélange
racémique contenant un nombre égal d’énantiomères opposés : A=R, et A*=S. ... 12
Figure 8: La configuration absolue de D-glycéraldéhyde et règle de projection de Fischer. .. 14 Figure 9: (a) (R)-bromochloroiodométhane, (b) (S)-bromochloroiodométhane. ... 15 Figure 10: A) Cis- et trans- stéréoisomères du flupentixol. Dans cette molécule, une
orientation relative du groupe CF3 par rapport au fragment contenant la pipérazine détermine la configuration. L'isomère cis-(Z) est commercialisé comme antipsychotique. (B) isomères cis et trans du 1,4 dichlorocyclohexane. ... 16
Figure 11: A : type de molécules ayant une chiralité axiale, B : Détermination de la
stéréochimie dans les atropisomères où le substituant A a la priorité sur le substituant B. ... 17
Figure 17: Modèle de localisation en quatre points pour la stéréosélectivité d'une protéine. . 27 Figure 18: Méthode de préparation d’un énantiomère pur ... 34 Figure 19: (A) analyse rétrosynthétique de la morphine, (B) analyse rétrosynthétique
d’oleandamycine ... 36
Figure 20: (A) synthése de valsartan, (B) synthèse de valaciclovir ... 37 Figure 21: Synthèse du peroxyde de cardamome ... 38 Figure 22: Synthèse du chlorhydrate de (+) –méthylphénidate par Novartis ... 42 Figure 23: Synthèse asymétrique de prégabaline par alkylation de l’oxazolidinone ... 43 Figure 24: Le principe de la catalyse asymétrique ... 45 Figure 25: Synthèse de R-ester éthylique d’indole par catalyse asymétrique... 47 Figure 26: Synthèse de S-Duloxétine par alcool déshydrogènase ... 48 Figure 27: Synthèse totale de thiamphénicol et florphénicol (108). ... 49 Figure 28: Synthèse de L-DOPA par hydrogènation catalytique ... 50 Figure 29: A : réaction d’hydroxulation de Sharpless. B : synthèse de naproxène . ... 51 Figure 30: (A) principe de l’addition conjugué, (B) synthèse de warfarine (coumarine) ... 53 Figure 31: Principe de la résolution par formation de sels diastéreoisomères . ... 55 Figure 32: Cheminement idéal de la cristallisation préférentielle isotherme ensemencée.
En noir : isotherme à Tf ; en gris : isotherme à haute température (Th). (Représentation en coordonnées de Jänecke). ... 58
Figure 33: Principe de la résolution chromatographique en phase stationnaire chiral (132). .. 60 Figure 34: Principe de la préparation du polymère à empeinte moléculaires ... 64 Figure 35: (A) Structures chimiques et propriétés physiques du prothioconazole et du
prothioconazole-desthio, (B) structures chimiques des phases stationnaires chirales (CSP) dans les différentes colonnes chirales ... 65
Figure 36: Le circuit du développement d’un médicament ... 68 Figure 37 : Structure chimique du (A) dexlansoprazole (R-lansoprazole) et (B) le
lansoprazole. ... 80
Figure 38 : Profils plasmatiques moyens de gastrine au jour 1 et au jour 5 après
l’administration de dexlansoprazole MR et de lansoprazole. ... 83
Figure 39: Profils de la concentration plasmatique moyenne dans le temps du
dexlansoprazole et du lansoprazole (jour 5) ... 86
Figure 40: Structure chimique de R-lévocétirizine et S-dextrocétirizine ... 91 Figure 41: Comparaison de l’efficacité de la cétirizine et lévocétirizine ... 92
Liste des tableaux
Tableau I: Chronologie de la synthèse asymétrique. ... 40 Tableau II: Quelque exemple des hydrolases utiles dans la synthèse organique. EC: est
une classification numérique des enzymes, basée sur la réaction chimique qu'elles catalysent, les hydrolases forment le groupe 3 ... 46
Tableau III: Exemples de préparation de médicaments par résolution avec l’agent de
résolution utilisé ... 56
Tableau IV: Résultats de la résolution du lysinate d'ibuprofène. ... 59 Tableau V: Application de différentes CSP à base de polysaccharides ... 62 Tableau VI: Exemple de séparation par CSP de type Pirkle ... 63 Tableau VII: Les avantages et les inconvénients des méthodes de synthèse et de
séparation des énantiomères... 65
Tableau VIII: Dexlansoprazole et lévocétirizine ... 69 Tableau IX: Résumé des exigences concernant le développement des médicaments
chiraux. ... 78
Tableau X: Modification du pH intragastrique moyenne ± écart type. Valeur P :
représentent la comparaison entre les cinq groupes ... 81
Tableau XI: Variation du pourcentage de temps avec un pH intragastrique ≥ 4,0 (moyenne
± écart type). ... 82
Tableau XII: Comparaisons de l’effet de la guérison complète à 8 semaines de
l’œsophagite érosive - stades A, B, C et D de LA ... 85
Tableau XIII: Les paramètres pharmacocinétiques plasmatiques du dexlansoprazole ou du
lansoprazole (jours 1 et 5) ... 87 Tableau XIV: Les 10 effets indésirables les plus fréquemment signalés au cours de l’étude .. 89
Tableau XV: comparaison des paramètres pharmacocinétiques de la lévocétirizine et de la
cétirizine. ... 93
Tableau XVI: Le coût mensuel des IPP selon l’INESSS. ... 96 Tableau XVII: Prix de vente de cétirizine et lévocétirizine ... 97
INTRODUCTION GENERALE ...1 PREMIERE CHAPITRE : LA STEREOCHIMIE ...4
1 Histoire de la stéréochimie ...5 1.1 La découverte du pouvoir rotatoire et de l’énantiomorphisme ...5 1.2 La première résolution racémique...6 1.3 Le carbone tétrahédrique ...6 2. Le concept de la stéreoisomèrie ...7 2.1 Le carbone asymétrique ...7 2.2 Chiralité ...7 2.3 Stéréoisomère...9 2.3.1 Enantiomère ...9 2.3.2 Diastéreoisomère ... 10 2.3.3 Mélange racémique ... 11 3. La nomenclature ... 13 3.1 Projection de Fischer (isomérie D / L) ... 13 3.2 Cahn-Ingold-Prelog: CIP (isomérie R / S) ... 14 3.3 Cis_trans isomère (isomérie E / Z) ... 15 3.4 Chiralité axiale ... 16 3.5 Chiralité Planaire... 18 4 Les propriétés des énantiomères... 19 4.1 Le pouvoir rotatoire... 19 4.2 Le dichroïsme circulaire ... 20 5 La pureté des énantiomères ... 22 5.1 La pureté optique ... 22
5.2 L’excès énantiomérique ... 22 6 Chiralité et la biologie ... 24 6.1 Homochiralité naturelle ... 24 6.2 La reconnaissance chirale ... 25 7 Chiralité et médicament ... 29 7.1 Médicaments ayant un centre de chiralité ... 29 7.1.1 Énantiomères présentant qualitativement et quantitativement la même activité ... 29 7.1.2 Énantiomères possédant qualitativement le même type d’activité mais d’intensités différentes ... 29 7.1.3 Un des deux énantiomères est l’eutomère tandis que l’autre est inactif ... 30 7.1.4 Un des deux énantiomères est l’eutomère tandis que l’autre est toxique ... 30 7.1.5 Un énantiomère antagonisant les effets de l’autre énantiomère ... 31 7.2 Médicaments ayant plus d’un centre de chiralité ... 31
DEUXIEME CHAPITRE : SEPARATION, ET FABRICATION DES ENANTIOMERES PURS ... 33
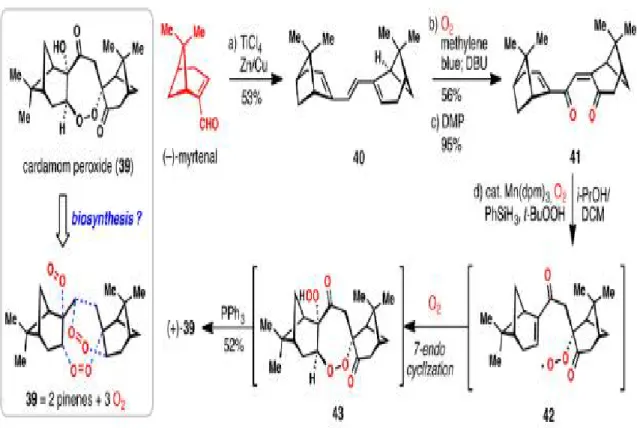
1. Introduction ... 34 2 La synthèse en pool chiral ... 35 3 Obtention d’un énantiomère pur par synthèse énantiosélective ... 40 3.1 Synthèse asymétrique stoechiométrique ... 41
3.2.1.3 Les lyases ... 48 3.2.1.4 Les transférases ... 49 3.2.1.5 Les isomérases ... 49 3.2.2 Catalyseurs chimiques ... 50 3.2.2.1 Réaction d’hydrogénation asymétrique, et réaction de réduction ... 50 3.2.2.2 Réaction d’oxydation asymétrique ... 51 3.2.2.3 Formation asymétrique de liaison carbone-carbone ... 52 4. Résolution racémique ... 54 4.1 La cristallisation ... 54 4.1.1 Séparation par formation de sel de diastéreoisomère : énantioséparation chimique 54 4.1.2 Séparation par cristallisation préferentielle ... 57 4.2 La chromatographie énantiosélective en phase stationnaire chirale ... 59 4.2.1 La phase stationnaire chirale ... 61 4.2.1.1 Les polymères chiraux organiques (Type I) ... 61 4.2.1.2 Les sorbants chiraux (type II) ... 63 4.2.1.3 Polymères à empreintes moléculaires (type III) ... 64 4.2.2 La chromatographie liquide à haute performance ... 64
TROISIEME CHAPITRE : LES ENANTIOMERES DANS L’INDUSTRIE
PHARMACEUTIQUE ... 66
Introduction ... 67 1 La réglementation du développement de nouveaux médicaments stéreoisomère ... 69 1.1 Exigence de l’Union Européen ... 70 1.1.1 Aspect chimique et pharmaceutique ... 70 1.1.2 Synthèse de la substance active ... 71 1.1.3 Qualité de la substance active ... 72
1.1.4 Le développement chimique ... 72 1.1.5 Le produit final ... 72 1.1.6 L’etude pré-clinique et clinique... 73 1.1.6.1 Synthèse de l’énantiomère pur ... 73 1.1.6.2 Synthèse du racémique ... 73 1.1.6.3 Substitution d’un racémique par l’énantiomère pur ... 74 1.2 Exigences des Etats-Unis ... 74 1.2.1 Politique général ... 74 1.2.2 Chimie, fabrication et contrôles ... 75 1.2.2.1 Méthodes et spécifications ... 75 1.2.2.2 La stabilité ... 76 1.2.2.3 Les impurties ... 76 1.2.2.4 Pharmacologie et toxicologie ... 76 1.2.2.5 Développement d'un seul énantiomère après étude d'un racémate ... 76 1.3 Exigences Japonnaises ... 77 2 La stratégie industrielle de séparer les énantiomères ... 79 2.1 Pharmacologie ... 79 2.1.1 Etude comparative dexlansoprazole/ lansoprazole ... 80 2.1.1.1 Comparaison pharmacodynamique ... 80
2.1.1.3 Comparaison toxicologique ... 88 2.1.1.3.1 Sécurité et tolérance ... 88 2.1.1.3.2 Les intéractions médicamenteuses ... 89 2.1.2 Etude comparative de la lévocétirizine / cétirizine ... 90 2.1.2.1 Comparaison pharmacodynamique ... 90 2.1.2.1.1 Site et mécanisme d’action ... 91 2.1.2.1.2 Comparaison de l’effet thérapeutique ... 91 2.1.2.2 Comparaison pharmacocinétique ... 93 2.1.2.2.1 Absortption et distribution... 93 2.1.2.2.2 Métabolisme et élimination ... 93 2.1.2.3 Comparaison toxicologique ... 94 2.1.2.3.1 Sécurité et tolérance ... 94 2.2 Analyse médico-économique ... 94 2.2.1 Evaluation du service médical rendu et fixation du prix ... 94 2.2.1.1 Le service médical rendu ... 95 2.2.1.2 L’amélioration du service médical rendu ... 95 2.2.2 Fixation du prix de vente ... 96 2.2.3 Cas de dexlansoprazole ... 96 2.2.4 Cas de lévocétirizine ... 96 2.3 Examen de la brevetabilité des énantiomères dans l'industrie pharmaceutique ... 98 2.3.1 Cas de lévocétirizine / cétirizine... 99
CONCLUSION ... 100 RESUMES... 102 REFERENCES BIBLIOGRAPHIQUES ... 106
INTRODUCTION
GENERALE
2
Un médicament chiral est un médicament optiquement actif. C'est-à-dire qu’il possède un ou plusieurs centres stéréogéniques, ce qui génère deux molécules image l’une de l’autre dans un miroir, non superposables. Ces deux molécules présentent dans l’organisme des effets biologiques différents. En effet, la chiralité des médicaments influence significativement leurs effets pharmacologiques. Ce thème est d’un intérêt majeur dans le développement et la commercialisation de nouveaux médicaments. Cela revient à l’évènement dramatique lié à l’utilisation de la thalidomide. Ce dernier est commercialisé par la société pharmaceutique allemande Chemie Grunenthal en 1950 en tant que sédatif non barbiturique. Il a été utilisé pour soulager les nausées chez les femmes enceintes. Lenz et McBride ont signalé en 1961que la thalidomide provoque des malformations congénitales graves. Ceci fait que la thalidomide est retirée du marché (1). Après, des études ont montré que la thalidomide est un mélange racémique dont l’énantiomère S est la source de l’effet tératogène, alors que l’énantiomère R est doté de l’effet sédatif (2).
Statiquement, en 1984 Simonyi (3) estime en se basant sur un manuel suédois de médicament utilisé par les médecins en exercice que parmi 666 de médicaments utilisés, 174 ont une composition racémique, et 181 sont à base d’un énantiomère unique. Ces chiffres montrent que la moitié des médicaments chirals sont constitués d’un seul énantiomère, et l’autre moitié était sous forme racémique. Aujourd’hui le nombre de médicaments énantiomériquement pur augmente considérablement, notamment avec l’apparition de nouvelles méthodes de synthèse, de séparation, et d’analyse des énantiomères purs des racémiques déjà commercialisés.
La connaissance grandissante des propriétés biologiques des énantiomères d’un médicament racémique a crée un nouvel enjeu autant pour les autorités réglementaires que pour les industries pharmaceutiques quand à savoir si un seul énantiomère pur doit être accepté et commercialisé. Si cela le cas, quelles sont les démarches réglementaires à suivre ainsi que les preuves justificatives pour obtenir l’autorisation de mise sur le marché (AMM) de l’énantiomère pur ? D’autre part, quel est l’intérêt des laboratoires pharmaceutiques pour le développement des énantiomères uniques malgré que dans certains cas le racémique et l’énantiomère présentent la même efficacité thérapeutique ?
Dans le cadre de réponse à ces questions, nous commencerons tout d'abord dans le premier chapitre par une présentation de la stéréochimie : son histoire, son concept général, et ses incidences biologiques et thérapeutiques. Le deuxième chapitre sera consacré à l’étude des différentes méthodes de séparation et de fabrication des énantiomères purs. Le troisième chapitre sera dédié à une étude comparative du " racémique contre l'énantiomère unique " sur le plan pharmacologique, réglementaire, et économique.
4
PREMIER CHAPITRE :
LA STEREOCHIMIE
La stéréochimie est l’étude de la structure tridimensionnelle des molécules. Les isomères qui résultent ne se différent que par l’arrangement spatial de leurs atomes.
1 Histoire de la stéréochimie
« Qui veut lire dans l’avenir doit feuilleter dans le passé » Georges André Malraux (1901–1976) écrivain, homme politique et intellectuel français.
L’histoire de la stéréochimie passe par trois périodes qui sont fortement liées à l’optique, la cristallographie et la chimie.
1.1 La découverte du pouvoir rotatoire et de l’énantiomorphisme
Le début c’était en 1669 (4), quand Erasmus Bartholin découvre que les images transmises par un cristal du spath d’Islande (calcite) sont doublées. En 1808, Étienne-Louis Malus (5), vient de découvrir la polarisation de la lumière par réflexion, cela grâce aux rayons de soleil réfléchis par les fenêtres vitrées du palais du Luxembourg. Cette lumière réfléchis possède une polarisation, dont la direction dépend de la double réfraction du cristal calcite (4). Arago en (1811) a réalisé une étude qualitative (6) qui lui a permis de conclure que les lames de quartz provoquent la rotation du plan de polarisation d’une lumière polarisée. Ensuite, Jean Babtiste Biot, l’inventeur du polarimètre a mentionné dans une mémoire en 1812 que certains quartzs dévient la lumière vers la droite et d’autres vers la gauche (7), ainsi pendant la période de 1815 à 1818, il a remarqué que plusieurs huiles naturelles sont optiquement actives tel que l’huile de la térébenthine. Il en va de même pour les composés organiques naturels à l’état non cristallin, tel que le saccharose, le camphre, l’albumine et l’acide tartrique. Biot a déduit
6
1.2 La première résolution racémique:
Une dizaine d’années après, précisément en 1844 Mitscherlich a signalé que de l’acide tartrique (TA), et l’acide paratartrique (PAT) se ressemblent en ce qui concerne la composition chimique, la forme cristalline, la densité et la double réfraction, cependant leur pouvoir rotatoire est différent. Autrement dit, TA fait dévier le plan de la lumière polarisée vers la droite, alors que PAT est dépourvu d’une activité optique (11). De ce fait, Louis Pasteur venait d’étudier la structure microscopique, ainsi que l’activité optique, du (TA), (PAT) et leurs sels. En effet, Pasteur a découvert que TA et ses sels ont une structure hémiédrique ce qui les rend asymétrique, cela d’un côté. D’autre coté, le sel d’ammonium sodique du PAT donne deux types de cristaux (11). En faisant recours à une dissolution des deux formes de sel d’ammonium sodique de paratartrate, Pasteur a trouvé qu’ils dévient le plan de la lumière polarisée d’une valeur égale, mais en direction opposées. De plus, l’un de ces sels de PAT est identique en tout point à TA (12). Le PAT est alors un racémique des deux énantiomères de TA. En fait, Pasteur a donné lieu à la première séparation d’un composé racémique grâce à trois méthodes. La première méthode est manuelle, consiste à l’utilisation d’une lentille et une pince à épiler pour séparer les deux sels de paratartrate en deux piles. La deuxième est chimique, basée sur la formation des diastéréoisomères à l’aide des alcaloïdes optiquement actives tel que la quinidine ou cinchonidine. La dernière est biologique se fonde sur le principe de la fermentation (13).
1.3 Le carbone tétrahédrique
Il a fallu attendre jusqu’à l’année 1874 lorsque Van't Hoff et Lebel ont suggéré que les quatre liaisons de l’atome de carbone forment une structure tridimensionnelle, c’est pourquoi il l’a nommé carbone tétrahédre. Ainsi, ce carbone tétrahédre est la source de l’asymétrie et de l’activité optique de la molécule (13). Par ailleurs, il est utilisé pour déterminer le nombre des stéréoisomères que ce soit énantiomères ou autre forme isomérique (14).
2. Le concept de la stéréoisomérie
2.1 Le carbone asymétrique
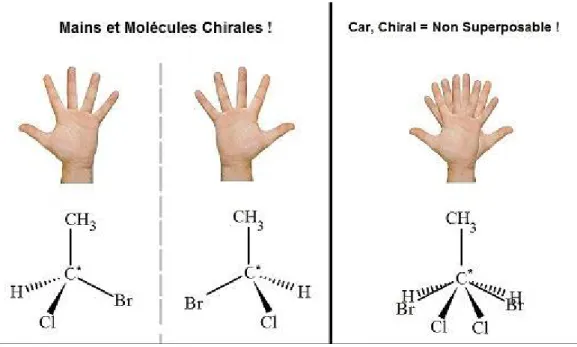
Le « International Union of Pure and Applied Chemistry » (15) définit le carbone asymétrique comme étant un carbone tétraédrique qui se lie à quatre substituants différents (Cabcd). Le carbone asymétrique est repéré par une étoile C*, et l’arrangement spatial de ses
substituants est représenté par des tirets et des coins, cette représentation tridimensionnelle a été proposée par CRAM et HAMMOND en 1956 (16) (fig 1).
Figure 1: Le carbone asymétrique selon la convention de CRAM et HAMMOND
Le carbone asymétrique est appelé également centre stéréogène ou centre chiral ; ses quatre liaisons ont subi une libre rotation qui permet de donner deux stéréoisomères non superposables, de ce fait la molécule est chirale. Le nombre de stéréoisomères augmente de façon exponentielle avec le nombre de C*. Pour n carbones une molécule donnera 2n stéréoisomères.
8
Figure 2: Exemple de molécule chirale
Le carbone asymétrique n’est pas toujours le centre chiral. En effet, La chiralité peut être dûe d’une part aux autres atomes tels que le silinium, le plomb, le phosphore, l’azote…etc, et d’autre part à la présence d’un axe ou plan stéréogène, on parle de chiralité axiale ou planaire. (Fig 3)
Figure 3: Exemple des molécules avec différents centres d’asymétrie
Dans la figure ci-dessus, le méthaqualone qui appartient à la famille des psycholeptiques (hypnotique et sédatif), possède dans sa structure un axe chiral entre l’azote N1 et le carbone C1. La chiralité de méthaqualone revient à l’encombrement stérique des
Un autre exemple, c’était celui de la base de Tröger dont le centre chiral est l’azote. Généralement, L’azote tertiaire est très facilement inversé à température ambiante, cela est dû à l’existence du doublet libre non liée, rendant les énantiomères indétectables et inséparables. Or, la base de Tröger possède une structure très rigide, dont l’azote est engagé dans un cycle. Cette structure rend l’inversion impossible, la molécule est donc chirale (4).
2.3 Stéréoisomère
On dit que les molécules sont stéréoisomères lorsqu’ayant la même formule brute, la même formule développée plane, tandis qu’elles différent par la disposition spatiale de leurs atomes. On distingue deux types d’isomères : énantiomère et diastéreoisomère.
2.3.1 Enantiomère
L’énantiomère est la forme chirale la plus répandue, il est l’ image l’un à l’autre dans un miroir et non superposables. Le terme énantiomère vient du mot grec enantiomorph qui signifie forme opposite (enantio = opposite, morph= forme) (19). D’ailleurs, ils sont identiques par leurs propriétés chimiques et propriétés physiques, hormis leurs rotations optiques qui sont différentes. L’énantiomère qui dévie le plan de polarisation de la lumière polarisée vers la gauche d’un observateur est appelé lévogyre (du latin laevus= gauche,
gyrar= tourne) et est indiqué par (-), alors que celui qui la tourne vers la droite est dénommé
dextrogyre (dexter= droit), et il est noté (+) (20,21). Si on prend en compte la disposition géométrique de la molécule, les énantiomères sont dénommés R et S, qui signifie respectivement droit (restus en latin), et gauche (sinister en latin) (22).
10
(R,R) provoque une névrite optique. De même, la lévodopa est un isomère lévogyre du dopa, elle est prévue pour traiter la maladie de Parkinson. La forme dextrogyre de dopa provoque des effets indésirables graves tel que la granulocytopénie (23).
2.3.2 Diastéreoisomère
Les diastéréoisomères sont deux molécules stéréogènes, qui ne sont pas image l’un de l’autre et non superposable. A l’opposé des énantiomères, les diastéréoisomères ont des propriétés physiques et chimiques différentes.
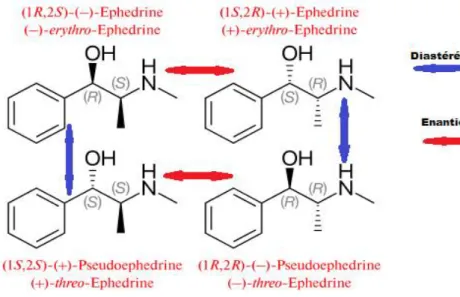
Lorsqu’une molécule possède deux carbones asymétriques génère quatre stéréoisomères : (R, R), (S, R), (R, S), et (S, S). Le couple (R, R) ; (S, S) et le couple (R, S) ; (S, R) sont des énantiomères, tandis que (R, R) et (R, S) ainsi que (S, S) et (S, R) constituent des diastéréoisomères. C’est le cas de l’éphédrine et pseudoéphédrine (24).
Figure 4: Diastéréoisomère et énantiomères de l’éphédrine.
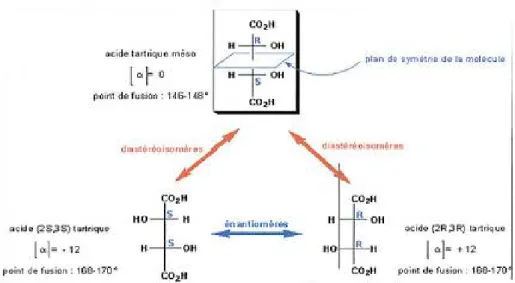
Une molécule à deux carbones asymétriques, qui portent chaqu’un d’eux les mêmes substituants, et qui forment un plan de symétrie, est dénommée méso diastéréoisomères, c’est le cas de l’acides tartrique. Les deux carbones asymétriques de l’acide tartriques sont liés aux mêmes groupes : H, OH, et COOH, donnant deux énantiomères (R, R et S, S), mais le troisième isomère est achiral en raison qu’il possède un plan de symétrie interne et que R est l’image de S.
Figure 5: Exemple de l’acide méso-tartrique
Les diastéréoisomères peuvent se présenter également sous forme d’isomère cis-trans quand la molécule porte une double liaison. Ce type d’isomère est dépourvu d’activité optique, donc il n’est pas chiral, comme le cas de l’acide butènedioïque.
Figure 6: Exemple de l’isomère cis-trans (24).
2.3.3 Mélange racémique
12
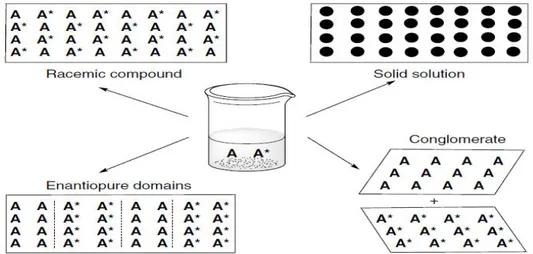
Le mélange racémique peut être sous forme gazeuse, liquide ou solide, et ces énantiomères sont arrangés soit en ordre soit en désordre (26). A l’état solide ou cristallin, le mélange racémique existe sous quatre formes, à savoir : composé racémique (ou véritable racémique), conglomérat, domaine énantiopur et/ou solution solide (ou pseudoracémique) (27) (Fig 7). Chaque cristal du véritable racémique contient les mêmes quantités en énantiomères lévogyres et dextrogyres liés entre eux avec forte affinité en formant un arrangement régulier. Comme le véritable racémique, le conglomérat est un mélange équimolaire des deux énantiomères opposés, mais qui s’organisent de telle façon à avoir un seul énantiomère pour chaque cristal (R) ou(S).Cet arrangement moléculaire facilite la séparation physique du mélange racémique (résolution chiral). Le domaine énantiopur est caractérisé par un cristal divisé en zones, chaque zone renferme un énantiomère unique dont l’affinité entre eux est très importante (R¨¨R) ou (S¨¨S). Si l’auto-résolution de cette forme est effectuée, un conglomérat se forme. Le pseudoracémique est constitué des deux énantiomères R et S formant un arrangement aléatoire au sein d’un cristal. Les énergies d’attractions entre les énantiomères identiques (R¨¨R, ou S¨¨S) du pseudoracémique, sont les mêmes que celle des énantiomères opposés (R¨¨S) ce qui rend la discrimination énantiomérique difficile. Les véritables racémiques sont les plus stables parmi les formes cristallines du mélange racémique. Statiquement 90% à 95% des mélanges racémiques sont sous forme de véritable racémique, 5% à 10% sont des conglomérats, tandis que moins de 1% existe en tant que pseudoracémiques (28).
Figure 7: Représentation schématique des différentes formes cristallines d’un mélange racémique contenant un nombre égal d’énantiomères opposés : A=R, et A*=S.
3. La nomenclature
Nous avons vu que les molécules possédant un centre stéréogène produisant deux énantiomères dont l’activité optique est opposées en direction. Avant, la dénomination des énantiomères était basée sur le signe de leurs activités optiques. Ceci néanmoins ne décrits pas l’arrangement spatiale des atomes autour du centre stéréogène, c'est-à-dire la configuration absolue. Plusieurs stéréodescripteurs sont utilisés actuellement selon le type du centre chiral. La projection Fischer (D/L) et Cahn-Ingold-Prelog (R/S) sont attribués au carbone asymétrique. Les isomères cis-trans (E/Z) sont utilisés pour les molécules pourvues d’une double liaison. Alors que la chiralité axiale et planaire dont le centre chiral est un axe ou un plan d’asymétrie respectivement sont décrites par le descripteur M/P.
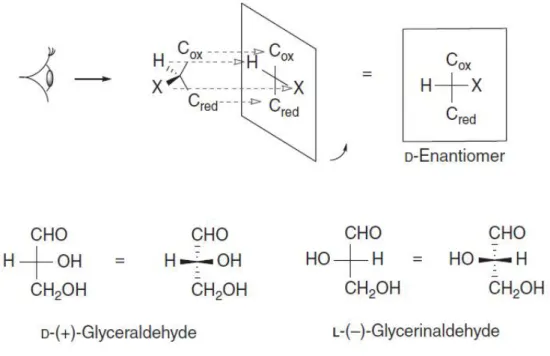
3.1 Projection de Fischer (isomérie D / L)
La projection de Fischer a été découverte par Emil Fischer en 1919 pendant son étude faite sur D-glycéraldéhyde (18). Cette projection est une représentation plane (bidimensionnelle) d’une molécule tridimensionnelle. Le descripteur D et L est utilisé pour décrire les acides aminés et les oses. Un sucre est désigné D ou L selon le carbone asymétrique ayant le numéro le plus grand, c'est-à-dire le carbone le plus bas de la chaine.
Dans la représentation de Fischer, la fonction la plus oxydée est placée en haut, la moins oxydée est placée en bas, alors que les autres substituants sont placés sur le côté. De ce fait, les lignes horizontales représentent les liaisons au-dessus du plan, et les lignes verticales représentent les liaisons au-dessous du plan (Fig 8) (29). Il suffit de tourner la chaine carbonée pour changer la configuration absolue de la molécule.
14
Figure 8: La configuration absolue de D-glycéraldéhyde et règle de projection de Fischer.
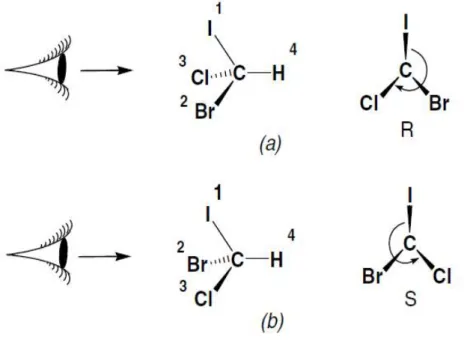
3.2 Cahn-Ingold-Prelog: CIP (isomèrie R / S)
En 1966 Cahn, Ingold, et Prelog ont décrit la configuration absolue d’un carbone asymétrique substitué en trois dimensions (30). Le descripteur CIP permet d’établir la configuration absolue selon la règle de priorité. La priorité est basée sur le numéro atomique des atomes liés au carbone asymétrique. Autrement dit, l’atome dont le numéro atomique (Z) est plus élevé est classé en premier, et ainsi de suite, donc on numérote de façon décroissante chacun des quatre atomes. Si deux ou plusieurs atomes liés au C* sont identiques, on compare entre eux par les atomes qui leur sont attachés (molécules de deuxième rang).Pour les liaisons multiples, on les considère comme des liaisons simples ; chaque atome engagé dans une liaison multiple est répété autant de fois qu’elle est lié dans cette liaison (31). Voici la liste de certains atomes en ordre décroissant de leurs numéro atomiques : I>Br>Cl>SO2R>SOR>SR>SH>F>OCOR>OR>OH>NO2>NO>NHCO > NR2> NHR >NH2>CX3(X=halogène) >COX >CO2R>CO2H>CONH2>COR>CHO>CR2OH>CH(OH)R >CH2OH>C(R)=CR2>C6H5>CR3>CH(C2H5)2>CH=CH2>CH(CH3)2>CH2R>CH3>D>H >doublet (32).
En se basant sur la règle de priorité de CIP, si l’arrangement des atomes de priorité 1,2, et 3 suit le sens des aiguilles d’une montre, la configuration du carbone asymétrique sera R (Rectus= droit), et pour l’arrangement inverse la configuration sera S (sinister= gauche) (33).
Figure 9: (a) (R)-bromochloroiodométhane, (b) (S)-bromochloroiodométhane.
Le descripteur CIP est utilisé pour dénommer les molécules médicamenteuses et leur métabolite. De plus, il est numérisé par les systèmes informatiques, qui peuvent décrire la configuration absolue des centres stéréogéniques. Par exemple, LHASA (Logic and Heuristics Applied to Synthetic Analysis) est un programme informatique qui permet aux chimistes de planifier à la synthèse de molécules organique. Ce programme affiche la structure organique des molécules en se basant sur le descripteur CIP. Il peut identifier les centres stéréogéniques
16
Le descripteur cis-trans devient équivoque lorsque les molécules portent quatre substitutions différentes. Dans ce cas on fait appel à la règle de priorité CIP, et les termes cis et trans sont remplacés par Z (du mot allemand Zusammen qui signifie ensemble) et E (du mot allemand Entgegen qui signifie opposé) respectivement (18).
Figure 10 (18): A) Cis- et trans- stéréoisomères du flupentixol. Dans cette molécule, une orientation relative du groupe CF3 par rapport au fragment contenant la pipérazine détermine la configuration. L'isomère cis-(Z) est commercialisé comme antipsychotique. (B) isomères cis et
trans du 1,4 dichlorocyclohexane.
3.4 Chiralité axiale
Selon IUPAC (15) la chiralité axiale résulte de l’existence d’un axe de chiralité qui divise les quatre substituants d’une molécule en paires. C’est le cas des allènes CnH4
(abC=C=Ccd ou abC=C=Cab), dont les substituants situés au bout des doubles liaisons sont dans les deux plans perpendiculaires. Ce type de stéréoisomère présente également pour les topoisomères dont la rotation autour d’une simple liaison est bloquée (Fig 11).
La chiralité axiale est représentée par le descripteur Ra et Sa ou P et M. La configuration
est déterminée en regardant la molécule le long de l’axe de l’hélice et en identifiant la priorité des substituants liés aux extrémités « proche » et « loin » en se basant sur la règle de priorité de CIP. Si le substituant d’ordre supérieur de l’extrémité « loin » est situé dans le sens des aiguilles de la montre par rapport au substituant de l’ordre supérieur de l’autre extrémité, la configuration sera P (plus) ou Sa, la configuration est notée M (moins) ou Ra si le sens est
18
3.5 Chiralité Planaire
La chiralité planaire est pareille à la chiralité axiale du fait qu’elles ne mettent pas en jeu un centre stéréogène. La chiralité planaire est définit par IUPAC (15) comme étant une molécule possédant un groupe d’atomes dans le plan chiral et l’autre groupe hors plan ; ce qui est le cas pour la cyclooctène dont le plan chiral est la double liaison et les atomes liés, et pour le paracyclophane monosubstitué, le plan de chiralité est le cycle substitué.
La chiralité planaire est décrite par le descripteur Rp et Sp ou P et M respectivement
(contrairement à la chiralité axiale dont Ra=M et Sa=P). La configuration de la molécule est
déterminée en identifiant l’atome de carbone le plus proche au plan et qui n’y appartient, ce carbone est appelé « carbone pilote (P) ». Si il y’a plusieurs atomes de carbone on fait appel à la régle de priorité CIP. Trois atomes suivant le carbone pilote et situant dans le plan chiral sont identifiés après a, b et c. Si la séquence a→b→c suit le sens des aiguilles d’une montre, la configuration sera Rp ou P. Sp ou M sera la configuration du sens antihoraire (35) (Fig 12).
4
Les propriétés des énantiomères
Les énantiomères ne se différent que par leur arrangement spatiale autour d’un centre d’asymétrie. Or, Ils ont les mêmes propriétés physico-chimiques (Point de fusion, solubilité, densité…etc.), c’est pourquoi ils donnent les mêmes spectres RMN (résonance magnétique nucléaire), UV, et le même profil chromatographique. Donc, ils ne peuvent pas être séparés, et ils exigent des méthodes qui se basent sur d’autres propriétés telles que le pouvoir rotatoire, et le dichroïsme circulaire.
4.1 Le pouvoir rotatoire
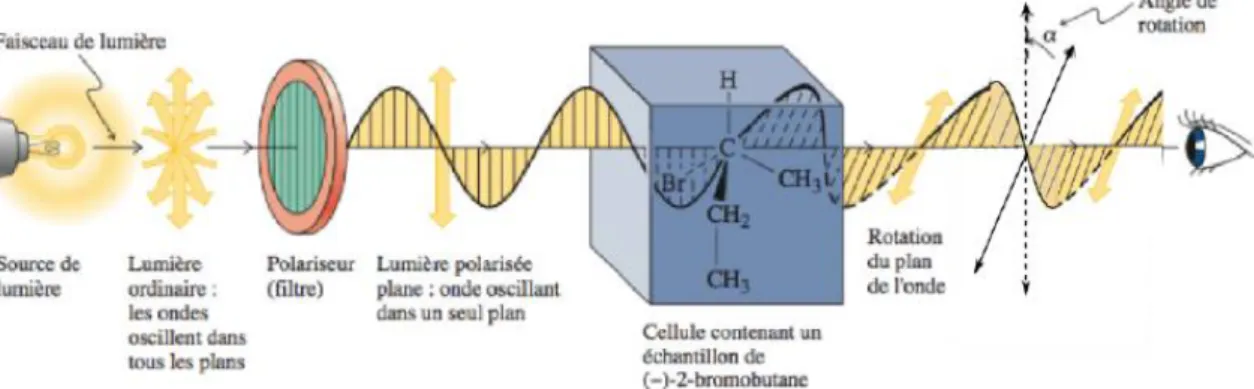
Le pouvoir rotatoire est la propriété physique qui permet de distinguer entre les énantiomères. C’est la capacité d’un milieu contenant une molécule chirale de faire dévier le plan de polarisation d’une lumière polarisée rectilignement. Il est dû à la différence des indices de réfraction de la lumière circulaire polarisée gauche et droite (lumière dont le plan de polarisation tourne constamment dans le même sens droit ou gauche autour de l’axe de propagation du faisceau) (36).
Le pouvoir rotatoire est mesuré par un polarimètre. Ce dernier permet de polariser la lumière monochromatique. En d’autre terme, la lumière monochromatique est émise en créant un champ électrique et un champ magnétique vibrant dans tous les plans et perpendiculaire à la direction de propagation. Le polarimètre ne fait passer que les composantes des ondes vibrant dans un seul plan, la lumière est donc polarisée. Par la suite, cette lumière polarisée traverse une cellule contenant une molécule chirale en solution, le plan de polarisation est dévié avec un angle α (Fig 13). Cet angle dépend de la longueur d’onde λ et de la température
20
Figure 13: Schéma d’un polarimètre
4.2 Le dichroïsme circulaire
Les deux énantiomères d’une solution optiquement active n’absorbent pas de la même façon la lumière polarisée circulairement à droite et à gauche. Le détecteur dichroïsme circulaire mesure la différence d’absorbance entre la lumière polarisée circulaire à droit Ad et
la lumière polarisée circulaire à gauche Ag en fonction de la longueur d’onde : ΔA= Ag - Ad
(36)(Figure 14). Les molécules analysées doivent posséder des chromophores (des groupes fonctionnels tels que les doubles liaisons). Le signal du dichroïsme circulaire est produit par l’excitation d’un électron de l’orbital à l’état fondamentale vers l’orbital de l’état excité (37).
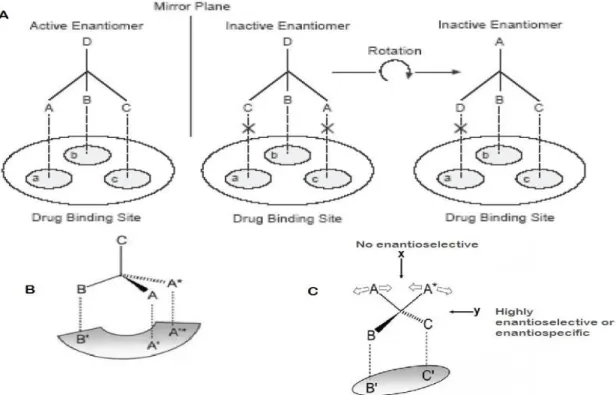
Les détecteurs basés sur le pouvoir rotatoire et le dichroïsme circulaire appelés également détecteur chiroptique (techniques optiques utilisées pour l’étude de la chiralité des molécules) ont une forte sélectivité par rapport aux simples détecteurs d’absorption. Cette sélectivité facilite la lecture des profils chromatographiques, et par conséquence une détermination fiable de la composition énantiomèrique. A titre d’exemple, le profil de (R, S) -7-chloro-1,3-dihydro-3- i-propyld-phényl-2H-l, 4 benzodiazépine-2-one présente deux pics ; un positif et l’autre négatif en utilisant le DC, permettant de bien différencier entre les deux énantiomères R et S. Alors que le détecteur d’absorption simple génère quatre pics positifs, ce qui rend la distinction entre les énantiomère difficile (38) (Figure 15).
22
5
La pureté des énantiomères
5.1 La pureté optique
La pureté optique est le rapport entre le pouvoir rotatoire d’une solution contenant les deux énantiomères (dextrogyre et lévogyre) dans des conditions déterminées (longueur d’onde, concentration, et température) et le pouvoir rotatoire [α0 de la solution
énantiomériquement pure (contient un seul énantiomère) mesuré dans les mêmes conditions (39) :
Popt=
Il existe une autre méthode pour déterminer la pureté des énantiomères ; c’est la « pureté énantiomérique ». Il a été démontré que sa valeur est égale à celle de la pureté optique. Pourtant sa signification reste ambigüe et son utilisation est peu fréquent (29). Ainsi, la pureté optique comme la pureté énantiomèrique sont peu fiable, par le fait de l’interférence des impuretés dans leurs mesures. De ce fait, il est nécessaire d’utiliser une autre méthode qui ne fait pas recours à la rotation optique (40) .
5.2 L’excès énantiomérique
Pour un mélange non racémique contenant les énantiomères R et S, l’excès énantiomèrique (ee) est définit comme la différence absolue de la fraction molaire des deux énantiomères FR et FS (15) :