31
1962 – 1969 : Professeur Abdelmalek FARAJ 1969 – 1974 : Professeur Abdellatif BERBICH
1974 – 1981 : Professeur Bachir LAZRAK 1981 – 1989 : Professeur Taieb CHKILI
1989 – 1997 : Professeur Mohamed Tahar ALAOUI 1997 – 2003 : Professeur Abdelmajid BELMAHI
2003 – 2013 : Professeur Najia HAJJAJ - HASSOUNI
ADMINISTRATION :
Doyen : Professeur Mohamed ADNAOUI
Vice Doyen chargé des Affaires Académiques et estudiantines
Professeur Mohammed AHALLAT
Vice Doyen chargé de la Recherche et de la Coopération
Professeur Taoufiq DAKKA
Vice Doyen chargé des Affaires Spécifiques à la Pharmacie
Professeur Jamal TAOUFIK
Secrétaire Général : Mr. El Hassane AHALLAT
1- ENSEIGNANTS-CHERCHEURS MEDECINS ET PHARMACIENS PROFESSEURS : Mai et Octobre 1981
Pr. MAAZOUZI Ahmed Wajih Chirurgie Cardio-Vasculaire Pr. TAOBANE Hamid* Chirurgie Thoracique
Mai et Novembre 1982
Pr. BENOSMAN Abdellatif Chirurgie Thoracique
Novembre 1983
Pr. HAJJAJ Najia ép. HASSOUNI Rhumatologie
Décembre 1984
Pr. MAAOUNI Abdelaziz Médecine Interne – Clinique Royale Pr. MAAZOUZI Ahmed Wajdi Anesthésie -Réanimation
Pr. SETTAF Abdellatif pathologie Chirurgicale
Novembre et Décembre 1985
Pr. CHAHED OUAZZANI Houria Gastro-Entérologie Pr. EL YAACOUBI Moradh Traumatologie Orthopédie Pr. ESSAID EL FEYDI Abdellah Gastro-Entérologie
Pr. LACHKAR Hassan Médecine Interne
Pr. YAHYAOUI Mohamed Neurologie
Décembre 1988
Pr. BENHAMAMOUCH Mohamed Najib Chirurgie Pédiatrique
Pr. DAFIRI Rachida Radiologie
Pr. HERMAS Mohamed Traumatologie Orthopédie
Décembre 1989
Pr. ADNAOUI Mohamed Médecine Interne –Doyen de la FMPR Pr. BOUKILI MAKHOUKHI Abdelali* Cardiologie
Pr. CHAD Bouziane Pathologie Chirurgicale Pr. OUAZZANI Taïbi Mohamed Réda Neurologie
Janvier et Novembre 1990
Pr. CHKOFF Rachid Pathologie Chirurgicale Pr. HACHIM Mohammed* Médecine-Interne
Pr. KHARBACH Aîcha Gynécologie -Obstétrique Pr. MANSOURI Fatima Anatomie-Pathologique Pr. TAZI Saoud Anas Anesthésie Réanimation
Février Avril Juillet et Décembre 1991
Pr. AL HAMANY Zaîtounia Anatomie-Pathologique
Pr. AZZOUZI Abderrahim Anesthésie Réanimation –Doyen de la FMPO
Pr. BAYAHIA Rabéa Néphrologie
Pr. BELKOUCHI Abdelkader Chirurgie Générale Pr. BENCHEKROUN Belabbes Abdellatif Chirurgie Générale Pr. BENSOUDA Yahia Pharmacie galénique
Pr. BERRAHO Amina Ophtalmologie
Pr. BEZZAD Rachid Gynécologie Obstétrique Pr. CHABRAOUI Layachi Biochimie et Chimie
Pr. CHERRAH Yahia Pharmacologie
Pr. CHOKAIRI Omar Histologie Embryologie
Pr. KHATTAB Mohamed Pédiatrie
Pr. SOULAYMANI Rachida Pharmacologie – Dir. du Centre National PV Pr. TAOUFIK Jamal Chimie thérapeutique
Décembre 1992
Pr. AHALLAT Mohamed Chirurgie Générale Pr. BENSOUDA Adil Anesthésie Réanimation Pr. BOUJIDA Mohamed Najib Radiologie
Pr. GHAFIR Driss* Médecine Interne
Pr. JIDDANE Mohamed Anatomie
Pr. TAGHY Ahmed Chirurgie Générale
Pr. ZOUHDI Mimoun Microbiologie
Mars 1994
Pr. BENJAAFAR Noureddine Radiothérapie
Pr. BEN RAIS Nozha Biophysique
Pr. CAOUI Malika Biophysique
Pr. CHRAIBI Abdelmjid Endocrinologie et Maladies Métaboliques Pr. EL AMRANI Sabah Gynécologie Obstétrique
Pr. EL AOUAD Rajae Immunologie
Pr. EL BARDOUNI Ahmed Traumato-Orthopédie Pr. EL HASSANI My Rachid Radiologie
Pr. ERROUGANI Abdelkader Chirurgie Générale- Directeur CHIS Pr. ESSAKALI Malika Immunologie
Pr. ETTAYEBI Fouad Chirurgie Pédiatrique
Pr. HADRI Larbi* Médecine Interne
Pr. HASSAM Badredine Dermatologie Pr. IFRINE Lahssan Chirurgie Générale
Pr. JELTHI Ahmed Anatomie Pathologique
Pr. MAHFOUD Mustapha Traumatologie – Orthopédie
Pr. MOUDENE Ahmed* Traumatologie- Orthopédie Inspecteur du SS Pr. RHRAB Brahim Gynécologie –Obstétrique
Pr. SENOUCI Karima Dermatologie
Mars 1994
Pr. ABBAR Mohamed* Urologie
Pr. ABDELHAK M’barek Chirurgie – Pédiatrique
Pr. BELAIDI Halima Neurologie
Pr. BRAHMI Rida Slimane Gynécologie Obstétrique Pr. BENTAHILA Abdelali Pédiatrie
Pr. BENYAHIA Mohammed Ali Gynécologie – Obstétrique Pr. BERRADA Mohamed Saleh Traumatologie – Orthopédie
Pr. CHAMI Ilham Radiologie
Pr. CHERKAOUI Lalla Ouafae Ophtalmologie Pr. EL ABBADI Najia Neurochirurgie
Pr. HANINE Ahmed* Radiologie
Pr. AMRAOUI Mohamed Chirurgie Générale Pr. BAIDADA Abdelaziz Gynécologie Obstétrique Pr. BARGACH Samir Gynécologie Obstétrique
Pr. CHAARI Jilali* Médecine Interne
Pr. DIMOU M’barek* Anesthésie Réanimation – Dir. HMIM Pr. DRISSI KAMILI Med Nordine* Anesthésie Réanimation
Pr. EL MESNAOUI Abbes Chirurgie Générale Pr. ESSAKALI HOUSSYNI Leila Oto-Rhino-Laryngologie Pr. HDA Abdelhamid* Cardiologie - Directeur ERSM Pr. IBEN ATTYA ANDALOUSSI Ahmed Urologie
Pr. OUAZZANI CHAHDI Bahia Ophtalmologie Pr. SEFIANI Abdelaziz Génétique
Pr. ZEGGWAGH Amine Ali Réanimation Médicale
Décembre 1996
Pr. AMIL Touriya* Radiologie
Pr. BELKACEM Rachid Chirurgie Pédiatrie Pr. BOULANOUAR Abdelkrim Ophtalmologie Pr. EL ALAMI EL FARICHA EL Hassan Chirurgie Générale
Pr. GAOUZI Ahmed Pédiatrie
Pr. MAHFOUDI M’barek* Radiologie Pr. MOHAMMADI Mohamed Médecine Interne
Pr. OUADGHIRI Mohamed Traumatologie-Orthopédie
Pr. OUZEDDOUN Naima Néphrologie
Pr. ZBIR EL Mehdi* Cardiologie
Novembre 1997
Pr. ALAMI Mohamed Hassan Gynécologie-Obstétrique Pr. BEN SLIMANE Lounis Urologie
Pr. BIROUK Nazha Neurologie
Pr. CHAOUIR Souad* Radiologie
Pr. ERREIMI Naima Pédiatrie
Pr. FELLAT Nadia Cardiologie
Pr. HAIMEUR Charki* Anesthésie Réanimation Pr. KADDOURI Noureddine Chirurgie Pédiatrique Pr. KOUTANI Abdellatif Urologie
Pr. LAHLOU Mohamed Khalid Chirurgie Générale
Pr. MAHRAOUI CHAFIQ Pédiatrie
Pr. OUAHABI Hamid* Neurologie
Pr. TAOUFIQ Jallal Psychiatrie
Pr. YOUSFI MALKI Mounia Gynécologie Obstétrique
Novembre 1998
Pr. AFIFI RAJAA Gastro-Entérologie
Pr. KHATOURI ALI* Cardiologie
Pr. LABRAIMI Ahmed* Anatomie Pathologique
Janvier 2000
Pr. ABID Ahmed* Pneumophtisiologie
Pr. AIT OUMAR Hassan Pédiatrie Pr. BENJELLOUN Dakhama Badr.Sououd Pédiatrie
Pr. BOURKADI Jamal-Eddine Pneumo-phtisiologie Pr. CHARIF CHEFCHAOUNI Al Montacer Chirurgie Générale Pr. ECHARRAB El Mahjoub Chirurgie Générale Pr. EL FTOUH Mustapha Pneumo-phtisiologie Pr. EL MOSTARCHID Brahim* Neurochirurgie
Pr. ISMAILI Hassane* Traumatologie Orthopédie Pr. MAHMOUDI Abdelkrim* Anesthésie-Réanimation Pr. TACHINANTE Rajae Anesthésie-Réanimation Pr. TAZI MEZALEK Zoubida Médecine Interne
Novembre 2000
Pr. AIDI Saadia Neurologie
Pr. AIT OURHROUI Mohamed Dermatologie Pr. AJANA Fatima Zohra Gastro-Entérologie
Pr. BENAMR Said Chirurgie Générale
Pr. CHERTI Mohammed Cardiologie
Pr. ECH-CHERIF EL KETTANI Selma Anesthésie-Réanimation Pr. EL HASSANI Amine Pédiatrie
Pr. EL KHADER Khalid Urologie
Pr. EL MAGHRAOUI Abdellah* Rhumatologie
Pr. GHARBI Mohamed El Hassan Endocrinologie et Maladies Métaboliques Pr. HSSAIDA Rachid* Anesthésie-Réanimation
Pr. LAHLOU Abdou Traumatologie Orthopédie Pr. MAFTAH Mohamed* Neurochirurgie
Pr. MAHASSINI Najat Anatomie Pathologique Pr. MDAGHRI ALAOUI Asmae Pédiatrie
Pr. NASSIH Mohamed* Stomatologie Et Chirurgie Maxillo-Faciale Pr. ROUIMI Abdelhadi* Neurologie
Décembre 2000
Pr. BENAMOR Jouda Pneumo-phtisiologie Pr. BENELBARHDADI Imane Gastro-Entérologie
Pr. BENNANI Rajae Cardiologie
Pr. BENOUACHANE Thami Pédiatrie
Pr. BEZZA Ahmed* Rhumatologie
Pr. BOUCHIKHI IDRISSI Med Larbi Anatomie Pr. BOUMDIN El Hassane* Radiologie
Pr. CHAT Latifa Radiologie
Pr. DAALI Mustapha* Chirurgie Générale Pr. DRISSI Sidi Mourad* Radiologie
Pr. EL HIJRI Ahmed Anesthésie-Réanimation Pr. EL MAAQILI Moulay Rachid Neuro-Chirurgie
Pr. EL MADHI Tarik Chirurgie-Pédiatrique Pr. EL OUNANI Mohamed Chirurgie Générale
Pr. ETTAIR Said Pédiatrie
Pr. GAZZAZ Miloudi* Neuro-Chirurgie Pr. HRORA Abdelmalek Chirurgie Générale
Pr. KABBAJ Saad Anesthésie-Réanimation
Pr. KABIRI EL Hassane* Chirurgie Thoracique Pr. LAMRANI Moulay Omar Traumatologie Orthopédie
Pr. LEKEHAL Brahim Chirurgie Vasculaire Périphérique Pr. MAHASSIN Fattouma* Médecine Interne
Pr. MEDARHRI Jalil Chirurgie Générale Pr. MIKDAME Mohammed* Hématologie Clinique Pr. MOHSINE Raouf Chirurgie Générale
Pr. NOUINI Yassine Urologie
Pr. SABBAH Farid Chirurgie Générale
Pr. SEFIANI Yasser Chirurgie Vasculaire Périphérique Pr. TAOUFIQ BENCHEKROUN Soumia Pédiatrie
Décembre 2002
Pr. AL BOUZIDI Abderrahmane* Anatomie Pathologique
Pr. AMEUR Ahmed * Urologie
Pr. AMRI Rachida Cardiologie
Pr. AOURARH Aziz* Gastro-Entérologie Pr. BAMOU Youssef * Biochimie-Chimie
Pr. BELMEJDOUB Ghizlene* Endocrinologie et Maladies Métaboliques
Pr. BENZEKRI Laila Dermatologie
Pr. BENZZOUBEIR Nadia Gastro-Entérologie Pr. BERNOUSSI Zakiya Anatomie Pathologique
Pr. EL MANSARI Omar* Chirurgie Générale Pr. FILALI ADIB Abdelhai Gynécologie Obstétrique
Pr. HAJJI Zakia Ophtalmologie
Pr. IKEN Ali Urologie
Pr. JAAFAR Abdeloihab* Traumatologie Orthopédie Pr. KRIOUILE Yamina Pédiatrie
Pr. LAGHMARI Mina Ophtalmologie
Pr. MABROUK Hfid* Traumatologie Orthopédie Pr. MOUSSAOUI RAHALI Driss* Gynécologie Obstétrique Pr. MOUSTAGHFIR Abdelhamid* Cardiologie
Pr. NAITLHO Abdelhamid* Médecine Interne
Pr. OUJILAL Abdelilah Oto-Rhino-Laryngologie Pr. RACHID Khalid * Traumatologie Orthopédie Pr. RAISS Mohamed Chirurgie Générale
Pr. RGUIBI IDRISSI Sidi Mustapha* Pneumophtisiologie
Pr. RHOU Hakima Néphrologie
Pr. SIAH Samir * Anesthésie Réanimation
Pr. THIMOU Amal Pédiatrie
Pr. ZENTAR Aziz* Chirurgie Générale
Janvier 2004
Pr. ABDELLAH El Hassan Ophtalmologie
Pr. AMRANI Mariam Anatomie Pathologique Pr. BENBOUZID Mohammed Anas Oto-Rhino-Laryngologie Pr. BENKIRANE Ahmed* Gastro-Entérologie Pr. BOUGHALEM Mohamed* Anesthésie Réanimation
Pr. BOULAADAS Malik Stomatologie et Chirurgie Maxillo-faciale Pr. BOURAZZA Ahmed* Neurologie
Pr. CHAGAR Belkacem* Traumatologie Orthopédie Pr. CHERRADI Nadia Anatomie Pathologique
Pr. EL FENNI Jamal* Radiologie
Pr. EL HANCHI ZAKI Gynécologie Obstétrique Pr. EL KHORASSANI Mohamed Pédiatrie
Pr. EL YOUNASSI Badreddine* Cardiologie Pr. HACHI Hafid Chirurgie Générale Pr. JABOUIRIK Fatima Pédiatrie
Pr. KHABOUZE Samira Gynécologie Obstétrique Pr. KHARMAZ Mohamed Traumatologie Orthopédie
Pr. LEZREK Mohammed* Urologie
Janvier 2005
Pr. ABBASSI Abdellah Chirurgie Réparatrice et Plastique Pr. AL KANDRY Sif Eddine* Chirurgie Générale
Pr. ALAOUI Ahmed Essaid Microbiologie
Pr. ALLALI Fadoua Rhumatologie
Pr. AMAZOUZI Abdellah Ophtalmologie
Pr. AZIZ Noureddine* Radiologie
Pr. BAHIRI Rachid Rhumatologie
Pr. BARKAT Amina Pédiatrie
Pr. BENHALIMA Hanane Stomatologie et Chirurgie Maxillo Faciale
Pr. BENYASS Aatif Cardiologie
Pr. BERNOUSSI Abdelghani Ophtalmologie Pr. CHARIF CHEFCHAOUNI Mohamed Ophtalmologie Pr. DOUDOUH Abderrahim* Biophysique Pr. EL HAMZAOUI Sakina* Microbiologie
Pr. HAJJI Leila Cardiologie (mise en disponibilité)
Pr. HESSISSEN Leila Pédiatrie
Pr. JIDAL Mohamed* Radiologie
Pr. LAAROUSSI Mohamed Chirurgie Cardio-vasculaire Pr. LYAGOUBI Mohammed Parasitologie
Pr. NIAMANE Radouane* Rhumatologie
Pr. RAGALA Abdelhak Gynécologie Obstétrique
Pr. SBIHI Souad Histo-Embryologie Cytogénétique Pr. ZERAIDI Najia Gynécologie Obstétrique
Décembre 2005
Pr. CHANI Mohamed Anesthésie Réanimation
Avril 2006
Pr. ACHEMLAL Lahsen* Rhumatologie
Pr. AKJOUJ Said* Radiologie
Pr. BELMEKKI Abdelkader* Hématologie
Pr. BENCHEIKH Razika O.R.L
Pr. BIYI Abdelhamid* Biophysique
Pr. BOUHAFS Mohamed El Amine Chirurgie - Pédiatrique Pr. BOULAHYA Abdellatif* Chirurgie Cardio – Vasculaire Pr. CHENGUETI ANSARI Anas Gynécologie Obstétrique
Pr. HARMOUCHE Hicham Médecine Interne Pr. HANAFI Sidi Mohamed* Anesthésie Réanimation Pr. IDRISS LAHLOU Amine* Microbiologie
Pr. JROUNDI Laila Radiologie
Pr. KARMOUNI Tariq Urologie
Pr. KILI Amina Pédiatrie
Pr. KISRA Hassan Psychiatrie
Pr. KISRA Mounir Chirurgie – Pédiatrique Pr. LAATIRIS Abdelkader* Pharmacie Galénique Pr. LMIMOUNI Badreddine* Parasitologie
Pr. MANSOURI Hamid* Radiothérapie Pr. OUANASS Abderrazzak Psychiatrie
Pr. SAFI Soumaya* Endocrinologie
Pr. SEKKAT Fatima Zahra Psychiatrie
Pr. SOUALHI Mouna Pneumo – Phtisiologie
Pr. TELLAL Saida* Biochimie
Pr. ZAHRAOUI Rachida Pneumo – Phtisiologie
Octobre 2007
Pr. ABIDI Khalid Réanimation médicale Pr. ACHACHI Leila Pneumo phtisiologie Pr. ACHOUR Abdessamad* Chirurgie générale
Pr. AIT HOUSSA Mahdi* Chirurgie cardio vasculaire Pr. AMHAJJI Larbi* Traumatologie orthopédie
Pr. AMMAR Haddou* ORL
Pr. AOUFI Sarra Parasitologie
Pr. BAITE Abdelouahed* Anesthésie réanimation Pr. BALOUCH Lhousaine* Biochimie-chimie Pr. BENZIANE Hamid* Pharmacie clinique Pr. BOUTIMZINE Nourdine Ophtalmologie Pr. CHARKAOUI Naoual* Pharmacie galénique Pr. EHIRCHIOU Abdelkader* Chirurgie générale Pr. ELABSI Mohamed Chirurgie générale Pr. EL MOUSSAOUI Rachid Anesthésie réanimation Pr. EL OMARI Fatima Psychiatrie
Pr. GANA Rachid Neuro chirurgie
Pr. GHARIB Noureddine Chirurgie plastique et réparatrice
Pr. HADADI Khalid* Radiothérapie
Pr. ICHOU Mohamed* Oncologie médicale
Pr. MAHI Mohamed* Radiologie
Pr. MARC Karima Pneumo phtisiologie
Pr. MASRAR Azlarab Hématologique
Pr. MOUTAJ Redouane * Parasitologie
Pr. MRABET Mustapha* Médecine préventive santé publique et hygiène
Pr. MRANI Saad* Virologie
Pr. OUZZIF Ez zohra* Biochimie-chimie
Pr. RABHI Monsef* Médecine interne
Pr. RADOUANE Bouchaib* Radiologie
Pr. SEFFAR Myriame Microbiologie
Pr. SEKHSOKH Yessine* Microbiologie
Pr. SIFAT Hassan* Radiothérapie
Pr. TABERKANET Mustafa* Chirurgie vasculaire périphérique Pr. TACHFOUTI Samira Ophtalmologie
Pr. TAJDINE Mohammed Tariq* Chirurgie générale
Pr. TANANE Mansour* Traumatologie orthopédie Pr. TLIGUI Houssain Parasitologie
Pr. TOUATI Zakia Cardiologie
Décembre 2007
Pr. DOUHAL ABDERRAHMAN Ophtalmologie
Décembre 2008
Pr ZOUBIR Mohamed* Anesthésie Réanimation Pr TAHIRI My El Hassan* Chirurgie Générale
Mars 2009
Pr. ABOUZAHIR Ali* Médecine interne
Pr. AGDR Aomar* Pédiatre
Pr. AIT ALI Abdelmounaim* Chirurgie Générale Pr. AIT BENHADDOU El hachmia Neurologie
Pr. AKHADDAR Ali* Neuro-chirurgie
Pr. ALLALI Nazik Radiologie
Pr. AMAHZOUNE Brahim* Chirurgie Cardio-vasculaire
Pr. AMINE Bouchra Rhumatologie
Pr. ARKHA Yassir Neuro-chirurgie
Pr. AZENDOUR Hicham* Anesthésie Réanimation Pr. BELYAMANI Lahcen* Anesthésie Réanimation
Pr. CHAKOUR Mohammed * Hématologie biologique
Pr. CHTATA Hassan Toufik* Chirurgie vasculaire périphérique Pr. DOGHMI Kamal* Hématologie clinique
Pr. EL MALKI Hadj Omar Chirurgie Générale Pr. EL OUENNASS Mostapha* Microbiologie
Pr. ENNIBI Khalid* Médecine interne
Pr. FATHI Khalid Gynécologie obstétrique Pr. HASSIKOU Hasna * Rhumatologie
Pr. KABBAJ Nawal Gastro-entérologie
Pr. KABIRI Meryem Pédiatrie
Pr. KARBOUBI Lamya Pédiatrie
Pr. L’KASSIMI Hachemi* Microbiologie
Pr. LAMSAOURI Jamal* Chimie Thérapeutique Pr. MARMADE Lahcen Chirurgie Cardio-vasculaire
Pr. MESKINI Toufik Pédiatrie
Pr. MESSAOUDI Nezha * Hématologie biologique Pr. MSSROURI Rahal Chirurgie Générale
Pr. NASSAR Ittimade Radiologie
Pr. OUKERRAJ Latifa Cardiologie
Pr. RHORFI Ismail Abderrahmani * Pneumo-phtisiologie
Pr. ZOUHAIR Said* Microbiologie
PROFESSEURS AGREGES :
Octobre 2010
Pr. ALILOU Mustapha Anesthésie réanimation Pr. AMEZIANE Taoufiq* Médecine interne Pr. BELAGUID Abdelaziz Physiologie
Pr. BOUAITY Brahim* ORL
Pr. CHADLI Mariama* Microbiologie
Pr. CHEMSI Mohamed* Médecine aéronautique
Pr. DAMI Abdellah* Biochimie chimie
Pr. DARBI Abdellatif* Radiologie Pr. DENDANE Mohammed Anouar Réanimation Pr. MOUJAHID Mountassir* Chirurgie générale
Pr. NAZIH Mouna* Hématologie
Pr. ZOUAIDIA Fouad Anatomie pathologique
Mai 2012
Pr. AMRANI Abdelouahed Chirurgie Pédiatrique Pr. ABOUELALAA Khalil* Anesthésie Réanimation
Pr. EL KHATTABI Abdessadek* Médecine Interne Pr. EL OUAZZANI Hanane* Pneumophtisiologie
Pr. ER-RAJI Mounir Chirurgie Pédiatrique
Pr. JAHID Ahmed Anatomie pathologique
Pr. MEHSSANI Jamal* Psychiatrie
Pr. RAISSOUNI Maha* Cardiologie
Février 2013
Pr. AHID Samir Pharmacologie – Chimie
Pr. AIT EL CADI Mina Toxicologie
Pr. AMRANI HANCHI Laila Gastro-Entérologie
Pr. AMOUR Mourad Anesthésie Réanimation
Pr. AWAB Almahdi Anesthésie Réanimation
Pr. BELAYACHI Jihane Réanimation Médicale Pr. BELKHADIR Zakaria Houssain Anesthésie Réanimation
Pr. BENCHEKROUN Laila Biochimie-Chimie
Pr. BENKIRANE Souad Hématologie
Pr. BENNANA Ahmed* Informatique Pharmaceutique
Pr. BENSEFFAJ Nadia Immunologie
Pr. BENSGHIR Mustapha* Anesthésie Réanimation Pr. BENYAHIA Mohammed* Néphrologie
Pr. BOUATIA Mustapha Chimie Analytique
Pr. BOUABID Ahmed Salim* Traumatologie Orthopédie
Pr. BOUTARBOUCH Mahjouba Anatomie
Pr. CHAIB Ali* Cardiologie
Pr. DENDANE Tarek Réanimation Médicale
Pr. DINI Nouzha* Pédiatrie
ECH-CHERIF EL KETTANI Mohamed Ali Anesthésie Réanimation Pr. ECH-CHERIF EL KETTANI Najwa Radiologie
Pr. ELFATEMI Nizare Neuro-Chirurgie
Pr. EL GUERROUJ Hasnae Médecine Nucléaire Pr. EL HARTI Jaouad Chimie Thérapeutique
Pr. EL JOUDI Rachid* Toxicologie
Pr. EL KABABRI Maria Pédiatrie
Pr. EL KHANNOUSSI Basma Anatomie Pathologie
Pr. EL KHLOUFI Samir Anatomie
Pr. EL KORAICHI Alae Anesthésie Réanimation
Pr. EN-NOUALI Hassane* Radiologie
Pr. KABBAJ Hakima Microbiologie
Pr. KADIRI Mohamed* Psychiatrie
Pr. LATIB Rachida Radiologie
Pr. MAAMAR Mouna Fatima Zahra Médecine Interne
Pr. MEDDAH Bouchra Pharmacologie
Pr. MELHAOUI Adyl Neuro-chirurgie
Pr. MRABTI Hind Oncologie Médicale
Pr. NEJJARI Rachid Pharmacognosie
Pr. OUBEJJA Houda Chirurgie Pédiatrique
Pr. OUKABLI Mohamed* Anatomie Pathologique
Pr. RAHALI Younes Pharmacie Galénique
Pr. RATBI Ilham Génétique
Pr. RAHMANI Mounia Neurologie
Pr. REDA Karim* Ophtalmologie
Pr. REGRAGUI Wafa Neurologie
Pr. RKAIN Hanan Physiologie
Pr. ROSTOM Samira Rhumatologie
Pr. ROUAS Lamiaa Anatomie Pathologique
Pr. ROUIBAA Fedoua* Gastro-Entérologie
Pr. SALIHOUN Mouna Gastro-Entérologie
Pr. SAYAH Rochde Chirurgie Cardio-Vasculaire
Pr. SEDDIK Hassan* Gastro-Entérologie
Pr. ZERHOUNI Hicham Chirurgie Pédiatrique
Pr. ZINE Ali* Traumatologie Orthopédie
Avril 2013
Pr. EL KHATIB Mohamed Karim* Stomatologie et Chirurgie Maxillo-faciale
Pr. GHOUNDALE Omar* Urologie
Pr. ZYANI Mohammad* Médecine Interne
Pr. ABOUDRAR Saadia Physiologie
Pr. ALAMI OUHABI Naima Biochimie – chimie
Pr. ALAOUI KATIM Pharmacologie
Pr. ALAOUI SLIMANI Lalla Naïma Histologie-Embryologie
Pr. ANSAR M’hammed Chimie Organique et Pharmacie Chimique Pr. BOUHOUCHE Ahmed Génétique Humaine
Pr. BOUKLOUZE Abdelaziz Applications Pharmaceutiques Pr. BOURJOUANE Mohamed Microbiologie
Pr. BARKYOU Malika Histologie-Embryologie Pr. CHAHED OUAZZANI Lalla Chadia Biochimie – chimie
Pr. DAKKA Taoufiq Physiologie
Pr. DRAOUI Mustapha Chimie Analytique Pr. EL GUESSABI Lahcen Pharmacognosie Pr. ETTAIB Abdelkader Zootechnie Pr. FAOUZI Moulay El Abbes Pharmacologie
Pr. HAMZAOUI Laila Biophysique
Pr. HMAMOUCHI Mohamed Chimie Organique Pr. IBRAHIMI Azeddine Biologie moléculaire Pr. KHANFRI Jamal Eddine Biologie
Pr. OULAD BOUYAHYA IDRISSI Med Chimie Organique
Pr. REDHA Ahlam Chimie
Pr. TOUATI Driss Pharmacognosie
Pr. ZAHIDI Ahmed Pharmacologie
Pr. ZELLOU Amina Chimie Organique
Mise à jour le 09/01/2015 par le Service des Ressources Humaines
A mes très chers parents
Aucun mot ne pourrait décrire tout l’amour et toute
la gratitude que je porte à votre égard.
Quoique je fasse, je ne vous remercierai jamais assez pour votre
amour, vos prières, vos encouragements, votre générosité, pour
votre soutien constant et inconditionnel et pour tous les
sacrifices que vous avez consentis pour mon éducation et mon
bien-être.
Vous êtes les piliers de ma vie.
Je vous exprime ici toute ma gratitude et ma reconnaissance.
Que cette thèse vous apporte la joie de voir aboutir vos efforts
et espère avoir été à la hauteur de vos attentes.
Puisse Dieu, le tout puissant, vous préserver et vous accorder
santé, longue vie et bonheur.
A ma très chère sœur Nisrine, à son mari Youssef ,
mon petit neveu Adam et à mon frère Mehdi
A toi, ma sœur bien-aimée, ma confidente de toujours, ma
meilleure amie, je ne saurais jamais te remercier pour le soutien
que tu m’as apporté durant ces longues années.
Mon parcours n’aurait pas été le même sans ton humour et ta
générosité. Merci de m’avoir supporté inlassablement.
Je te dédie ce travail en témoignage de tout l’amour que je te
porte.
Merci à toi aussi, Youssef, pour ta joie et ta bonne humeur
contagieuses. Tu es le frère que la vie m‘a offert.
A mon petit neveu Adam, notre petit rayon de soleil.
Puisse Dieu te protéger, ainsi que tes parents, et t’offrir une
vie pleine de bonheur.
A Mehdi, je ne risque pas d’oublier ta présence à mes côtés
depuis notre plus tendre enfance. Je te souhaite une vie pleine
A ma grand-mère maternelle
Merci pour tes prières et tes encouragements,
merci d’avoir toujours cru en moi.
Puisse Dieu t’accorder santé et longue vie.
A la mémoire de mes regrettés grand parents
paternels et grand-père maternel
J’aurais tant aimé vous avoir à mes côtés.
Que Dieu vous accorde sa miséricorde.
A mes oncles, tantes, cousins et cousines
Je vous remercie toutes et tous
pour votre soutien et pour votre présence.
A mes très chers (chères) ami(e)s
A Soukayna, Hind et Laïna. A nos fous rires et nos stress,
à nos périodes de préparations, à nos folies et à tous les bons
moments passés ensemble…
Merci d’avoir toujours été là pour moi, vous tenez une place
particulière dans mon cœur.
A Hanae et Dounia, mes amies de toujours.
Merci de m’avoir accompagnée depuis le tout début de mon
parcours, merci pour votre soutien et générosité.
A tous mes ami(e)s, je vous dédie ce travail en témoignage
de mon amitié et vous souhaite un avenir plein de joie et de
succès.
A tous ceux qui ont contribué de loin
ou de près à l’élaboration de ce travail
A notre maître et président de thèse
Monsieur le Professeur Ait Ouamar Hassan
Professeur de pédiatrie
Nous apprécions la spontanéité avec laquelle
vous avez accepté de présider notre jury de thèse.
Votre sérieux, votre compétence et votre sens
du devoir nous ont énormément marqués.
Veuillez trouver à travers ce travail l’expression sincère
de notre respect et le témoignage de notre profonde
A notre honorable maître et rapporteur de thèse
Monsieur le professeur Bouhafs Mohammed El Amine
Professeur de chirurgie pédiatrique
C’est un grand honneur que vous nous avez fait
en nous confiant la réalisation de ce travail.
Vous nous avez toujours réservé le meilleur accueil,
malgré vos obligations professionnelles. Vos encouragements
inlassables, votre amabilité, votre gentillesse méritent toute
admiration.
Veuillez trouver ici le témoignage de notre profonde
reconnaissance
A notre maître et juge de thèse
Madame le Professeur Kriouile Yamina
Professeur de pédiatrie
Je vous remercie pour l’amabilité avec laquelle
vous avez accepté de siéger parmi mon jury de thèse.
En acceptant de juger ce travail, vous m’accordez un grand
honneur.
Veuillez accepter l’expression de ma considération la plus
distinguée.
A notre maître et juge de thèse
Madame le professeur Chat Latifa
Professeur de radiologie
C’est pour moi un grand honneur que vous acceptiez
de siéger parmi mon honorable jury.
Votre modestie, votre sérieux et votre compétence
professionnelle seront pour moi un exemple
à suivre dans l’exercice de ma profession.
Permettez-moi de vous présenter dans ce travail,
A notre maître et juge de thèse
Madame le professeur Lamalmi Najat
Professeur d’anatomie pathologique
Nous sommes particulièrement touchés
par la spontanéité et la gentillesse avec laquelle
vous avez bien voulu accepter de juger ce travail.
Veuillez trouver ici l’expression de notre estime et notre
INTRODUCTION ... 1 HISTORIQUE ... 4 RAPPELS EMBRYOLOGIQUES DU REIN ... 7 HISTOLOGIE ... 11
1. Structure histologique des différents segments du néphron ... 12 1.1. Le glomérule rénal de Malpighi ... 12 1.2. Les systèmes tubulaires du néphron ... 13 1.2.1. Le tube rénal proximal ... 13 1.2.2. L’anse de Henlé ... 14 1.2.3. Le tube distal ... 14 1.2.4. Le tube collecteur ou tube de Bellini ... 15
ANATOMOPATHOLOGIE DE L’ANGIOMYOLIPOME RENAL ... 16
1. AML CLASSIQUE ... 17 2. L’AML EPITHELIOÏDE ... 20
ETIOPATHOGENIE ... 22
I- LA FORME ASSOCIEE A LA SCLEROSE TUBEREUSE DE
BOURNEVILLE ... 23 A-L’aspect génétique ... 23 B- Le diagnostic de la STB ... 25 1- Manifestations cliniques ... 25 a- Manifestation cutanées ... 25 b- Manifestations neurologiques ... 30
f- Manifestations pulmonaires ... 37 g- Autres manifestations ... 38 2- Diagnostic positif ... 39 3- Conseil génétique ... 42 II- LA FORME SPORADIQUE ... 44
MATERIELS ET METHODES ... 46 DISCUSSION ... 54
I.EPIDEMIOLOGIE ... 55 II.DIAGNOSTIC DE L’ANGIOMYOLIPOME RENAL ... 59 1- Biologie ... 64 2- Imagerie ... 64 a- L’échographie abdominale/rénale ... 66 b- La tomodensitométrie (TDM) ... 68 c- L’imagerie par résonnance magnétique ... 70 d- L’angiographie ... 72 e- L’urographie intra-veineuse ... 73 III.BIOPSIE PERCUTANEE ... 75 IV. TRAITEMENT ... 76 1 - Surveillance ... 78 2 - Traitement chirurgical ... 81 a- La néphrectomie totale à ciel ouvert ... 81
4 - Autres modalités ... 89 a- La cryoablation ... 89 b- Radiofréquence ... 92 c- Traitement par les inhibiteurs de mTOR ... 94 V. EVOLUTION ET PRONOSTIC ... 100
CONCLUSION... 103 RESUMES ... 105 BIBLIOGRAPHIE ... 109
RAML = angiomyolipome rénal
AMLeR = angiomyolipome rénal épithélioïde STB = sclérose tubéreuse de Bourneville SAE = EAS = embolisation artérielle sélective TCP = tube contourné proximal
TDM = tomodensitométrie PC = produit de contraste
IRM = imagerie par résonance magnétique LAM = lymphangioléiomyomatose
DPN = diagnostic prénatal
PECome = tumeurs des cellules épithélioïdes périvasculaires ECBU = examen cytobactériologique des urines
CCR = carcinome à cellules rénales UIV = urographie intra-veineuse LCA = cryablation laparoscopique mTor = mammalian target of rapamycin
L'angiomyolipome rénal est une tumeur rénale rare généralement bénigne qui représente 1 à 3% des tumeurs solides du rein [1]. Elle est composée, dans des proportions variables, d'un contingent graisseux, souvent le plus abondant, d'un contingent de cellules musculaires lisses et d'un contingent d'origine vasculaire.
Deux types d’AML ont été décrits, le premier, retrouvé dans 80% des cas, est sporadique et à la caractéristique d’être isolé et unilatéral [2]. Le second, plus rare (20% des cas), s’inscrit dans le cadre de la Sclérose Tubéreuse de Bourneville (STB), qui est une maladie autosomique dominante à pénétrance variable. L'atteinte rénale est alors multiple et bilatérale dans 50 à 80% des cas [1].
Malgré que la majorité des AML soient asymptomatiques, des symptômes apparaissent dans 68% à 80% des cas quand taille de la tumeur est ≥4cm, dominés par des douleurs lombaires et hématurie. Le mode de révélation peut dans certains cas être bruyant et peut aller jusqu’à l’état de choc en rapport avec une rupture hémorragique, complication redoutable de l’AML [3].
Le diagnostic de l’AML repose principalement sur l’imagerie médicale, où l’échographie montre une masse bien limitée, hyperéchogène et où la tomodensitométrie met en évidence une composante graisseuse de densité négative au sein de la masse rénale.
Le traitement de l’AML est fonction de la taille tumorale. Lorsqu’une lésion de moins de 4 cm de diamètre est découverte l’attitude thérapeutique classique reste la surveillance. En revanche, devant une tumeur de plus de 4 cm
de diamètre à haut risque hémorragique, un traitement chirurgical sous forme de néphrectomie, partielle ou totale, est de principe et doit être le plus conservateur possible [1].
Cependant, l’Embolisation Artérielle Sélective (EAS) constitue une alternative thérapeutique permettant la conservation de l’unité rénale. D’autres techniques ont également prouvé leur efficacité dans la réduction de la taille tumorale, notamment la cryoablation rénale laparoscopique [2].
Nous rapportons dans cette étude le cas d’une patiente de 14 ans porteuse d’un AML rénal associé à une STB, colligé dans le service de chirurgie pédiatrique (A) de l’Hôpital d’Enfants de Rabat (HER). A la lumière de notre observation et des données de la littérature, nous essayerons de dresser un profil épidémiologique, clinique et paraclinique de cette pathologie rare ainsi que sur les particularités thérapeutiques et pronostiques.
La première description de l’angiomyolipome rénal ainsi que celle de la Sclérose Tubéreuse de Bourneville (STB), est attribuée à Désiré Magloire Bourneville en 1880 (figure 1). Sur un rapport d’autopsie d’une jeune fille de 15 ans atteinte d’épilepsie, d’hémiplégie et de retard mental, il a décrit un durcissement semblable à une tubéreuse des gyrus cérébraux hypertrophiques et leur attribua la dénomination de « Sclérose tubéreuse des circonvolutions cérébrales ». Il a également décrit les lésions trouvées au niveau des reins comme étant des lésions hamartomateuses plutôt que des lésions tumorales malignes.
C’est à Bourneville que revient le mérite d’avoir cité pour la première fois l’association des lésions rénales à cette affection [4, 5, 6].
En 1908, Vogt était le premier à évoquer la triade caractéristique de la STB regroupant : épilepsie, retard mental et angiofibromes de la face (adénomes sébacés). Il mentionna aussi que l’atteinte cardiaque et rénale pourraient faire partie de la maladie [4, 5, 7].
En 1951, Morgan et al donnaient pour la première fois la dénomination d’angiomyolipome rénal afin de décrire cette tumeur constituée de trois composantes : cellules adipeuses matures, cellules musculaires lisses et d’une composante vasculaire [8].
Les critères de diagnostic précis de la sclérose tubéreuse de Bourneville (critères majeurs et critères mineurs) n’ont été établis qu’en 1988 par Gomez. L’angiomyolipome rénal fait partie des critères majeurs de la sclérose tubéreuse de Bourneville [5, 7].
En 1992, la nature génétique de la maladie (STB) avait été déterminée avec identification de deux locus impliqués, situés sur les chromosomes 9 et 16. Ce dernier gène fut isolé en 1993 [5].
En 1998, Pea et al décrivaient pour la première fois la variante épithélioïde de l’AML rénal, et concluaient qu’elle était composée purement de cellules épithélioïdes fusiformes, avec absence de la composante adipeuse et vasculaire. Au cours de la dernière décennie plusieurs auteurs décrivaient la variante de l’AML épithélioïde comme étant à potentiel malin avec métastase viscérale et lymphatique [9].
Rappels embryologiques
du rein
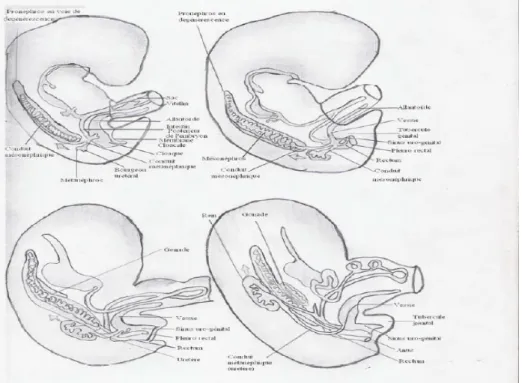
Les malformations congénitales du système uro-génital sont multiples et complexes. Le rappel du développement embryonnaire normal est indispensable à la bonne compréhension des anomalies qui peuvent survenir pendant la vie fœtale. Le développement du système urinaire est entièrement intégré à celui du système génital aussi bien chez la femme que chez l’homme. Tous les deux se développent au dépend du mésoblaste qui prolifère le long de la paroi postérieure de la cavité abdominale (figure 2). En effet, le mésoblaste apparaît au cours de la gastrulation qui se différencie en trois portions : Le mésoblaste para axiale, le mésoblaste intermédiaire et le mésoblaste latéral. [10]
Le mésoblaste intermédiaire se met en place le 17ème jour de la vie intra utérine entre les deux autres portions du mésoblaste entièrement à l’origine de l’appareil uro-génital. A partir de ce mésoblaste intermédiaire, trois structures rénales se mettent en place suivant une succession crânio-caudale. Ce sont respectivement : le pronéphros, le mésonéphros, et le métanéphros.
1. Le pronéphros ou rein primitif : ou rein intermédiaire, apparaît à la
fin de la 3ème semaine de la vie intra utérine. Il représente 7 à 10 amas cellulaires pleins ou tubulaires. Ces néphrotomes régressent dans l’ordre de leur apparition et disparaissent tous à la fin de la 4ème semaine. Le pronéphros est donc transitoire et non fonctionnel.
2. Le mésonéphros ou corps de Wolff : apparaît au cours de la 4ème
semaine de la vie embryonnaire au niveau thoracique. En effet au cours de la régression de l’appareil pronéphrotique, les néphrotomes se creusent en vésicules et s’allongent pour former les premiers tubules du mésonéphros. Ces tubules s’allongent rapidement et un glomérule
interne se forme en leur extrémité médiale alors qu’à l’extrémité opposée, il pénètre dans le canal pronéphrotique. On parle en ce moment du canal mésonéphrotique ou canal Wolff. A la fin de la 4eme semaine, le canal de Wolff creuse une lumière et rejoint le cloaque. Le bourgeon urétéral apparaît dans la partie caudale du canal de Wolff. A La fin du 2ème mois, seuls persistent encore un petit nombre de tubule et de glomérule mésonéphrotique, le reste ayant régressé. Le devenir du canal de Wolff est déterminé par le sexe de l’embryon. Il dégénère dans le sexe féminin. Chez l’homme, il donne avec les tubules mésonéphrotiques les conduits génitaux : le canal déférent, le canal éjaculateur et la vésicule séminale. Les gonades proviennent de la crête génitale apparue à la 4ème semaine entre le mésonéphros et le mésentère dorsal.
3. Le métanéphros ou rein définitif : En même temps qu’a lieu la
régression de l’appareil mésonéphrotique, le métanéphros apparaît d’abord lombosacré, puis devient lombaire para vertébral par la suite. Le bourgeon urétéral apparu à la fin de la 4ème semaine se développe en direction dorso crânial et pénètre dans le blastème métanéphrogène. L’extrémité distale du bourgeon enveloppé par le blastème metanephrogene se divise en deux branches qui sont les futurs grands calices. Au même moment s’individualise au niveau du cloaque, en avant de l’éperon périnéal qui est apparu en même temps que le bourgeon urétéral le sinus uro-génital primitif. A la fin de la 6ème semaine, un autre canal se forme parallèlement au canal de Wolff :
c’est le canal de Muller ou canal para néphrotique. Il descend comme le canal de Wolff et s’abouche dans le cloaque. Il disparaît totalement dans l’embryon du sexe masculin. Les grands calices du tissu metanephrogene subissent d’autres transformations et le bourgeon urétéral donne naissance à l’uretère, au bassinet, aux calices et aux tubules rénaux. Quant au sinus uro génital on lui distingue trois portions : la 1ère portion située dans la partie haute donnera naissance à la vessie, la 2ème portion qui est pelvienne donnera l’urètre postérieur chez l’homme, la 3ème portion ou partie pénienne du sinus uro génital donnera l’urètre postérieur chez le garçon et chez la fille une petite portion de l’urètre et le vestibule.
Figure 2. Développement embryologique du système urinaire
L’AML rénal a longtemps été considéré comme un hamartome rénal qui correspond à une malformation tissulaire d’aspect tumoral composée d’un mélange anormal d’éléments normalement présents au niveau du rein [15]. Cette hypothèse a cependant été bouleversée, notamment par l’étude de Bonetti et Al, suggérant que l’AML proviendrait des cellules périvasculaires [16].
Un rappel histologique des différents segments du néphron est donc nécessaire afin de pouvoir différencier l’AML rénal des tumeurs à cellules rénales, principalement représentées par le carcinome à cellules claire.
1. Structure histologique des différents segments du néphron
[17 – 19] (figure 3)
1.1. Le glomérule rénal de Malpighi :
Le glomérule est une sphère mesurant de 150 à 250 microns, possédant un pôle urinaire où s’insère le tube contourné proximal, et un pôle vasculaire dans lequel pénètre l’artériole afférente. Entre ces deux pôles se situe la barrière de filtration.
Le pôle vasculaire : à ce niveau l’artériole se divise en 4 à 8 branches. Chacune de ces branches donne naissance à des capillaires anastomosés constituant un lobule. Les capillaires sont disposés autour d’un axe parfois ramifié, la tige mésangiale. Les différents lobules se réunissent pour former l’artériole efférente.
Le pôle urinaire : correspond à la capsule de Bowman, qui est constituée de cellules épithéliales pariétales reposant sur une membrane basale épaisse
La barrière de filtration : située entre les deux pôles sus-cités, elle se compose de :
Cellules endothéliales : avec une partie épaisse contenant le noyau habituellement adossée au mésangium et sur lequel elle repose sans interposition de la membrane basale glomérulaire, et une partie dite lamina fenestrata, perforée de fenêtres de 70 à 100 nm de diamètre permettant un contact direct entre membrane basale et le plasma.
Une membrane basale glomérulaire : sépare les podocytes d s cellules endothéliales et du mésangium, elle permet le passage de molécules inférieures à un certain poids moléculaire
Podocytes : volumineuses cellules n forme de pieuvre qui entourent les capillaires et s’enchevêtrent par leurs expansions cytoplasmiques (dites pieds de 1er ordre) en pièces de puzzle. Elles reposent sur la membrane basale par l’intermédiaire d’expansions membranaires cytoplasmique ou pédicelles (pieds de 2ème ordre).
1.2. Les systèmes tubulaires du néphron
Le filtrat glomérulaire après avoir quitté la chambre glomérulaire, au pôle tubulaire du glomérule, suit un cheminement complexe. Il emprunte le tube proximal, puis l’anse de Henlé, pour rejoindre le tube collecteur après avoir suivi un trajet dans le tube distal.
1.2.1. Le tube rénal proximal :
cortex, et une portion droite ou pars recta, qui se termine dans la médullaire. Les cellules du tube proximal sont aisément reconnaissables en microscopie optique du fait de la bordure en brosse de leur partie luminale. Cette bordure spécialisée est faite de microvillosités, qui contiennent un riche équipement enzymatique
1.2.2. L’anse de Henlé
L’anse de Henlé est une portion en forme de U dont les parties hautes larges sont réunies par une portion basse grêle.
Portions larges (ou épaisses) : Portions descendante e ascendante, diamètre de 30 à 40 m, épithélium cubique simple, leur structure est proche de celles des tubes droits qui leur sont contigus.
Portion grêle : C’est la partie active de l’anse. Diamètre de 12 à 15 m, épithélium pavimenteux simple, 2 à 3 cellules très aplaties avec un noyau ovalaire faisant saillie dans la lumière, le cytoplasme est pauvre en organites, nombreux complexes de jonction et quelques microvillosités courtes au pôle apical. Elle est située dans la partie interne des pyramides de Malpighi (avec les tubes collecteurs), forme un virage en épingle à cheveux et remonte + ou – haut selon les néphrons.
L’anse de Henlé des néphrons juxta-médullaires est longue, elle descend jusqu’au sommet des pyramides de Malpighi, alors que l’anse des néphrons centro-corticaux est courte, elle n’entre que partiellement dans la médullaire.
1.2.3. Le tube distal :
Au niveau du tube contourné distal les cellules épithéliales sont cubiques et possèdent peu de microvillosités au pôle apical (pas de bordure en brosse) ; au
pôle basal les invaginations de la membrane plasmique qui contiennent aussi des mitochondries sont toutefois moins développées qu’au niveau du tube contourné proximal. Au niveau du pôle vasculaire, l’épithélium du tube contourné distal se différencie et présente une « macula densa ».
1.2.4. Le tube collecteur ou tube de Bellini :
Les tubes collecteurs débutent dans les irradiations médullaires et descendent jusqu’au sommet des pyramides de Malpighi. Ils sont bordés par un épithélium cubique formé de deux types de cellules, dont les contours sont bien visibles : a- des cellules claires, les plus nombreuses, ayant à leur face apicale de rares et courtes microvillosités sont pauvres en organites – b- des cellules intercalaires (ou cellules alpha), sombres, moins nombreuses, sont reconnaissables en ME et présentent à leur pôle apical des microvillosités et au pôle basal des replis de la membrane plasmique avec des mitochondries. Elles renferment de nombreux ribosomes et des vacuoles.
Anatomopathologie
1.
AML CLASSIQUE :
L’angiomyolipome rénal est une tumeur rénale bénigne qui représente 1 à 3% des tumeurs solides du rein. Cette lésion est composée, à des proportions variables, d’un contingent graisseux souvent le plus abondant, d’un contingent de cellules musculaires lisses et d’un contingent d’origine vasculaire. Les cellules musculaires de l’AML peuvent être fusiformes ou épithélioïdes. Lorsque la composante épithélioïde est prédominante on parle d’AML épithélioïde, à distinguer de l’AML classique vu son potentiel malin. [1]
Macroscopiquement : (Figures 4,5) [20]
L’AML se présente macroscopiquement comme une masse rénale expansive, non infiltrante, bien circonscrite mais non encapsulée. A la coupe, il existe habituellement des plages jaunâtres, lobulaires, plus ou moins importantes correspondant au contingent adipeux de la masse. La distribution des trois composantes de l'angiomyolipome est variable. Lorsque le contingent musculaire lisse prédomine, la tumeur apparaît comme une masse solide régulière donnant à la coupe l'apparence d'un léiomyome. Il n'existe habituellement pas au sein d'un angiomyolipome de nécrose, ni de calcification du parenchyme rénal.
Figure 4 : Aspect macroscopique de l’AML rénal [21]
Figure 5 : Aspect macroscopique de l’AML rénal - a- AML friable dans parenchyme
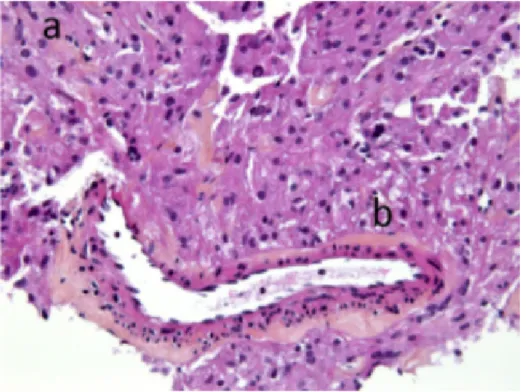
Microscopiquement : (figure 6) [15, 20, 22]L’angiomyolipome classique est composé de cellules adipeuses matures, de tissu vasculaire et de muscle lisse. La composante adipeuse est d’apparence normale sans atypies cytologiques avec des adipocytes matures entremêlés aux cellules musculaires. Les vaisseaux sont typiquement excentrés, à paroi épaisse et pauvre en élastine par rapport aux vaisseaux normaux leur donnant un aspect histologique de veines artérialisées, semblable aux malformations artério-veineuses et aux shunts. Ces malformations prédisposent à la formation d'anévrismes et expliquent le caractère fortement hémorragique de ces derniers. Les vaisseaux sont également entourés par des cellules musculaires lisses d’aspect normal.
Figure 6 : Aspect histologique de l’angiomyolipome rénal montrant ses trois composantes :
2.
L’AML EPITHELIOÏDE:
L’angiomyolipome épithélioïde rénal (AMLeR) est une tumeur mésenchymateuse à potentiel malin, caractérisée par la prolifération de cellules principalement épithélioïdes. Cette tumeur peut être bénigne, potentiellement agressive ou maligne. Appartenant à la famille des Pecomes (perivascular epithelioid cells), les AML épithélioïdes peuvent également se rencontrer dans le foie, le rétropéritoine, les ganglions, l’utérus ou l’os. [23, 24]
Macroscopiquement:
Les AML épithélioïdes rénaux sont plus volumineux et multifocaux que les formes conventionnelles et sont blanc grisâtres, mal limités avec des remaniements hémorragiques. Devant l’absence de tissu adipeux reconnaissable on évoque plus un carcinome rénal qu’un AML. La tumeur peut être largement extériorisée par rapport au rein et ne lui être reliée que par un fin pédicule. On retrouve fréquemment des foyers d’hémorragie intratumorale ainsi que des zones de nécrose [23, 25, 26].
Microscopiquement: (figure 7)
Le diagnostic de l’AML épithélioïde rénal (AMLeR) est histologique sur pièce de néphrectomie totale, partielle ou sur biopsie à l’aiguille fine. Dans l’AMLeR, il y a un contingent de cellules épithélioïdes et périvasculaires et un contingent adipocytaire souvent réduit voire absent. Il se caractérise par la présence de cellules mononuclées épithélioïdes à cytoplasme clair présentant souvent des atypies cytonucléaires plus ou moins marquées et parfois un contingent de cellules multinucléées. Il peut être confondu microscopiquement avec un carcinome à cellules rénales mais l’immunohistochimie redresse le diagnostic. [20, 27]
Figure 7 : Coupe histologique d’angiomyolipome épithélioïde rénal à partir
de biopsies à l’aiguille fine. a- angiomyolipome triphasique : cellules musculaires lisses, adipocytes, vaisseaux. b- contingent épithélioïde : cellule
I- LA FORME ASSOCIEE A LA SCLEROSE TUBEREUSE DE
BOURNEVILLE
A- L’aspect génétique :
La sclérose tubéreuse de Bourneville est une maladie héréditaire de transmission autosomique dominante, avec une pénétrance variable et un taux de mutation estimé entre 66 et 86 % [38], son incidence est de 1/5800 à 1/10000 naissances.
Les études génétiques ont identifié deux gènes majeurs de la sclérose tubéreuse de Bourneville: le gène TSC1 situé sur le chromosome 9q34 et le gène TSC2 situé sur le chromosome 16p13 [77, 78]. La pénétrance et l’expressivité sont variables, ce qui explique l’extrême variabilité des tableaux cliniques même au sein d'une famille. En effet les apparentés de certains sujets asymptomatiques peuvent présenter d'importantes manifestations systémiques [79, 80].
Le locus TSC1 a été identifié pour la première fois en 1987 [81], mais il a fallu encore 10 ans pour identifier le gène TSC1, codant pour une protéine de 130 kDa nommée l'hamartine, contenant 1164 acides aminés. Le gène TSC 1 est composé de 23 exons et transcrit en un acide ribonucléique messager de 8600 paires de bases (8.6-kb).
Le gène TSC2 a été découvert en 1993 [78], il contient 41 exons répartis sur 44 Kbp de l’ADN génomique et code pour une protéine de 200 kDa, la tubérine, contenant 1807 acides aminés avec un domaine GTP-ase activating protéine(GAP). Le long du TSC2, les mutations sont distribuées de façon homogène et tous les types sont représentés : délétions, insertions, duplications, non-sens, faux sens [82].
Plusieurs études ont suggéré que les mutations du gène TSC1 sont beaucoup plus présentes dans les formes familiales (37% des mutations retrouvées) que dans les formes sporadiques (8%), et que les mutations pathogènes du gène TSC2 étaient retrouvées plus dans des cas sporadiques (70%). Le mosaïsme somatique, signalé chez certaines personnes ayant des mutations au niveau TSC1 ou TSC2, représenterait une forme atténuée de la maladie [44, 45].
L’apparition des tumeurs hamartomateuses est liée à une perte d’hétérozygotie (LOH). Selon l’étude de Knudson [83]: une première mutation germinale survient dans un premier temps laissant en place une seule copie fonctionnelle du gène TSC avec réduction de 50 % de l'activité du taux de la protéine sécrétée. Dans un deuxième temps survient une deuxième mutation qui emporte l'allèle normal du gène. Cette deuxième mutation somatique n'intéresserait que les cellules précurseurs des cellules musculaires, vasculaires et adipeuses. Cette perte d'hétérozygotie expliquerait surtout la survenue de tumeurs rénales, d'angiofibromes et de rhabdomyomes mais ne serait pas nécessaire et ne concernerait pas les manifestations du système nerveux central.
Sur le plan tumoral, l’hamartine et la tubérine, deux protéines codées respectivement par les gènes TSC1 et TSC2, interagissent ensemble pour former un complexe protéique qui régule la croissance et la prolifération cellulaire ce qui fait de lui un inhibiteur sélectif de la kinase mTOR (mammalian target of rapamycin), protéine clé dans la cascade contrôlant la croissance cellulaire. La perte fonctionnelle de ce complexe entraîne une activation permanente de cette voie de signalisation, ce qui pourrait être à l’origine du développement des tumeurs hamartomateuses.
B- Le diagnostic de la STB : [38]
1- Manifestations cliniques : a- Manifestation cutanées :
96% des patients porteurs de STB ont une atteinte cutanée. La survenue de ces lésions cutanées évolue en fonction de l’âge des patients. Les macules hypopigmentées sont en général les manifestations les plus précoces, suivies des plaques fibreuses du front. Les angiofibromes faciaux et les fibromes périunguéaux ne surviennent que plus tardivement.
Macules hypopigmentées : détectées dans 90 à 98 % des STB, mais ne sont pas spécifiques de la maladie. Elles sont le plus souvent présentes à la naissance ou peuvent survenir lors des premières années de vie, généralement avant 5 ans. On constate un pic de fréquence à l’adolescence puis la fréquence diminue avec l’âge. Ces macules hypopigmentées, mesurant de un à plusieurs centimètres de diamètre, sont blanches mais rougissent au frottement, ce qui les distingue des naevi achromiques. Leur forme est ovalaire ou polygonale, classiquement en « feuille de sorbier », souvent asymétrique (figure 8).
Elles peuvent siéger sur tout le tégument avec une prédilection pour le tronc et les fesses. Lorsqu’elles sont localisées au niveau du cuir chevelu, les cheveux en regard peuvent être dépigmentés. Parfois, elles peuvent prendre l’aspect d’une myriade de macules blanches de très petite taille (1-3 mm) : hypopigmentation en « confetti » ; elles sont alors le plus souvent disposées de façon symétrique au niveau des membres. Histologiquement, il existe, au niveau de ces macules hypopigmentées, un nombre normal de mélanocytes mais un nombre restreint de mélanosomes de petite taille.
Angiofibromes : ils sont pathognomoniques de la STB. Les angiofibromes papulonodulaires typiques sont retrouvés dans près de 70 à 75 % des STB. Ils se présentent sous la forme d’élevures de couleur rose à rouge avec une surface lisse et brillante, mesurant de 1 à 10 mm. Ils sont distribués de manière bilatérale et symétrique au niveau médiofacial et principalement au niveau des sillons nasogéniens. Ils peuvent s’étendre au niveau du front et des paupières. Le nombre de lésions est variable : de quelques papules à peine visibles à de larges nodules. (figures 10, 18)
Figure 10 : angiofibromes faciaux, formes sévères [38]
Histologiquement, il s’agit d’une prolifération vasculaire et fibromateuse. Ces lésions apparaissent le plus souvent après 5 ans (71 %). On note une augmentation de taille lente et progressive de ces angiofibromes avec l’âge, principalement au moment de la puberté et des grossesses puis une stabilisation. Il existe un type particulier d’angiofibrome facial : la plaque fibreuse du front qui est retrouvée chez 20 % des patients. Il s’agit d’une plaque brun jaunâtre, légèrement surélevée, de consistance variable. Histologiquement, cette lésion est similaire aux angiofibromes mais avec une composante vasculaire moins importante.
Plaque « peau de chagrin » : Cette plaque apparaît en général entre 2 et 5 ans. À l’examen, elle est retrouvée chez environ 48 % des patients souffrant de STB. La lésion se présente comme une plaque unique, discrètement surélevée de surface fripée, granitée. Elle siège préférentiellement dans la région
Figure 11 : « plaque de chagrin » lombosacrée [38]
Fibromes périunguéaux : encore appellés « tumeurs de Koënen », ils sont caractéristiques de la STB et retrouvés chez 15 % des patients atteints de STB. Ils apparaissent rarement avant 10 ans, plus souvent à l’adolescence ensuite leur fréquence augmente avec l’âge, ils sont alors souvent uniques. Chez l’adulte, ils sont le plus souvent multiples (75 %). Ils sont localisés autour ou sous les ongles des doigts (56 %) et des orteils (90 %), plus fréquemment au niveau du premier orteil. Ils se présentent sous forme de petites proliférations oblongues, charnues, en « grain de blé », grises ou rosées, fermes. Ils se détachent à la partie proximale du sillon périunguéal et poussent parallèlement à l’ongle, qu’ils dépriment parfois en gouttière longitudinale. Ils apparaissent le plus souvent vers 10 ans. Leur prévalence augmente avec l’âge et ils peuvent être la seule manifestation de la ST. (figure 12)
Figure 12 : fibrome péri-unguéal [38]
Molluscum pendulum : ces lésions pédiculées, souples, localisées le plus souvent au niveau du cou, sont observées chez environ un patient sur cinq.
Tache café au lait : Leur fréquence est variable en fonction des études (de 15 à 28 %) mais ne semble pas plus élevée que dans la population générale. Elles ne sont donc plus considérées comme un critère diagnostique de la STB.
Lésions buccales : Les gencives, le voile du palais, la langue peuvent être le siège de petits éléments miliaires en semis ou de nodules fibreux. Les fibromes gingivaux sont retrouvés dans 36 % des cas. Les dents de lait ou définitives peuvent présenter des défauts de l’émail : « pits » dentaires.
b- Manifestations neurologiques :
Les anomalies neurologiques au cours de la STB constituent la première cause de morbimortalité et sont en rapport avec la présence d’hamartomes cérébraux. Le système nerveux central est le plus fréquemment atteint, le cervelet n’est atteint que dans 15 % des cas et l’atteinte du système nerveux périphérique est extrêmement rare. Les hamartomes cérébraux sont de trois types :
• Les tubers corticaux : se développent pendant la vie fœtale et sont présents chez 95 % des patients atteints de STB. Ils sont situés au niveau de la substance blanche corticale ou sous-corticale et correspondent à des régions de désorganisation corticale avec perte de différenciation entre substance blanche et substance grise. (figure 13)
Figure 13 : TDM : tubers corticaux, aspect hypodense non rehaussés
• les nodules sous-épendymaires (figure 14): retrouvés chez 95 % des
sujets atteints de STB, ces lésions sont situées à la surface des ventricules latéraux, plus rarement au niveau de l’aqueduc de Sylvius ou du 4e ventricule. Ils augmentent en nombre et en taille jusqu’à l’âge de 10 ans puis se stabilisent. Ils peuvent être responsables d’une obstruction du système ventriculaire entraînant une hypertension intracrânienne. Une transformation maligne est possible ;
Figure 14 : TDM : calcifications sous épendymaires bilatérales
• les astrocytomes à cellules géantes (figure 15): ils sont présents chez 6 à 14 % des patients. Ils sont situés au niveau des parois des ventricules latéraux, notamment en regard des trous de Monroe, exposant au risque d’hydrocéphalie par obstruction de la sortie du 3e ventricule. Ces lésions augmentent progressivement de volume tout au long de la vie (contrairement aux deux autres lésions), mais sont accessibles au traitement neurochirurgical.
Figure 15 : TDM cérébrale avant et après injection de PC: processus péri-ventriculaire
L’imagerie cérébrale permet d’explorer ces anomalies. Le scanner cérébral est utile pour détecter les nodules sous-épendymaires calcifiés, qui sont pathognomoniques, mais l’imagerie par résonance magnétique (IRM) cérébrale est plus adaptée pour préciser le nombre et la localisation des lésions cérébrales hamartomateuses, qui apparaissent sous forme d’hypersignaux, typiquement au niveau cortical ou souscortical.
L’IRM et le scanner cérébral peuvent être normaux pendant l’enfance et les lésions peuvent apparaître secondairement. L’imagerie cérébrale reste normale chez 5 % des adultes atteints, même chez ceux qui présentent des crises d’épilepsie.
Épilepsie : elle survient dans 70 à 90 % des cas quel que soit l’âge et peut être isolée ou associée à d’autres manifestations neurologiques. Le type le plus précoce et le plus caractéristique est le syndrome de West (spasmes infantiles), révélateur de la STB dans 70 % des cas. Ce syndrome de West est plus fréquent chez le garçon et débute le plus souvent entre 3 et 12 mois. Il correspond à la triade : spasmes en flexion, régression psychomotrice et hypsarythmie à l’électroencéphalogramme (EEG). Le pronostic est généralement sombre. Avec la maturation corticale et sous-corticale, les spasmes se résolvent parfois spontanément mais sont souvent remplacés par d’autres crises convulsives partielles ou généralisées.
Retard mental : il est constaté chez 50 à 60 % des patients atteints de STB mais est de profondeur variable. Il est plus fréquemment présent chez les enfants ayant des spasmes infantiles persistants ou d’autres types de convulsions. La survenue d’un retard mental semble corrélée au nombre de tubers corticaux (plus de cinq) et à leur localisation (dans les régions frontales et occipitales).
Autisme : sa fréquence est évaluée entre 17 et 68 % dans la STB. Le retard mental et l’épilepsie constituent des facteurs de risques pour développer cet autisme. Par ailleurs, il a été montré, chez les sujets ayant une STB avec autisme et/ou retard mental, un nombre plus important de tubers corticaux par rapport aux sujets sans retard mental et une localisation des tubers au niveau temporal.
Difficultés d’apprentissage : décrites même chez les sujets ayant une intelligence normale. Les tests psychomoteurs permettent de mettre en évidence des faiblesses de mémorisation, un retard de langage, une dyscalculie, des difficultés visuospatiales, une apraxie. Les antécédents d’épilepsie sont prédictifs de ces difficultés d’apprentissage.
Autres problèmes neuropsychiatriques : une hyperactivité a été notée chez 59 à 86 % des patients. Des troubles du sommeil sont retrouvés chez 60 % des patients atteints de STB.
c- Manifestations rénales :
Elles sont détectées chez 94 % des patients atteints de STB. Elles constituent la deuxième cause de mortalité après l’atteinte neurologique. L’atteinte peut se manifester sous trois formes : l’angiomyolipome, les kystes rénaux et le cancer du rein. Les manifestations cliniques sont variées. L’hématurie est la plus fréquente, souvent révélatrice d’un angiomyolipome. Les autres symptômes peuvent être des douleurs abdominales, des lombalgies ou une masse palpable à l’examen clinique, mais les lésions peuvent rester asymptomatiques.
Angiomyolipome : c’est l’atteinte rénale la plus fréquente : 75 à 80 % des lésions rénales au cours de la STB. Il s’agit d’une tumeur bénigne hamartomateuse non encapsulée, composée de cellules musculaires lisses, de tissu adipeux et de vaisseaux sanguins anormaux. On différencie la forme sporadique (80 % des cas, tumeur de petite taille, asymptomatique, le plus souvent chez la femme à partir de 40 ans) et la forme associée à la STB (20 % des cas, généralement multiples, bilatéraux, augmentant de taille avec l’âge). Dans la plupart des cas, ces tumeurs sont asymptomatiques et découvertes de façon fortuite. Ces lésions sont néanmoins caractérisées par leur risque hémorragique (5 à 25 % des cas), responsable d’hématurie et de rupture spontanée dans le rétropéritoine. L’importance de la symptomatologie clinique est corrélée au volume tumoral. En effet, 90 % des tumeurs symptomatiques ont un volume supérieur ou égal à 4 cm. Le diagnostic d’angiomyolipome est le plus souvent fait sur l’échographie abdominale. La combinaison de l’échographie et du scanner permet d’affirmer le diagnostic. L’IRM reste l’examen le plus sensible, mais elle est réservée aux cas douteux. Dans le cas des petites tumeurs, la surveillance radiologique est préconisée. Pour les tumeurs de grande taille (supérieures à 3,5 cm), on peut proposer une embolisation artérielle préventive par angiographie. Une néphrectomie est indiquée en cas d’hémorragie massive ou de lésions de plus de 4 cm.
Kystes rénaux : il s’agit généralement de kystes simples des reins et seule une minorité de patients (2 %) présente une polykystose rénale vraie.

![Figure 3 : Schéma montrant la structure du néphron [108]](https://thumb-eu.123doks.com/thumbv2/123doknet/15037722.690742/46.892.177.770.685.980/figure-schéma-montrant-structure-néphron.webp)


![Figure 11 : « plaque de chagrin » lombosacrée [38]](https://thumb-eu.123doks.com/thumbv2/123doknet/15037722.690742/59.892.217.677.197.496/figure-plaque-de-chagrin-lombosacrée.webp)
![Figure 13 : TDM : tubers corticaux, aspect hypodense non rehaussés après injection de produit de contraste [107]](https://thumb-eu.123doks.com/thumbv2/123doknet/15037722.690742/61.892.188.749.563.944/figure-tubers-corticaux-hypodense-rehaussés-injection-produit-contraste.webp)
![Figure 14 : TDM : calcifications sous épendymaires bilatérales en rapport avec des nodules sous épendymaires [107]](https://thumb-eu.123doks.com/thumbv2/123doknet/15037722.690742/62.892.205.686.502.954/figure-tdm-calcifications-épendymaires-bilatérales-rapport-nodules-épendymaires.webp)
![Figure 15 : TDM cérébrale avant et après injection de PC: processus péri-ventriculaire (astrocytomes à cellules géantes) rehaussé de façon intense responsable d’hydrocéphalie [107]](https://thumb-eu.123doks.com/thumbv2/123doknet/15037722.690742/63.892.110.787.420.797/cérébrale-injection-processus-ventriculaire-astrocytomes-rehaussé-responsable-hydrocéphalie.webp)