REPUBLIQUE ALGERIENNE DEMOCRATIQUE ET POPULAIRE
MINISTERE DE L’ENSEIGNEMENT SUPERIEUR
ET DE LA RECHERCHE SCIENTIFIQUE
Université Constantine 1
Faculté des Sciences de la Nature et de la Vie Département de Biologie Animale
N° d’ordre : 26/D3C/2014 N° de série : 03/BA/2014
Thèse en co-tutelle entre l’Université Constantine 1 et Aix Marseille Université
En vue d’obtenir le grade de Docteur troisième cycle LMD d’Université Constantine
1 et Aix Marseille Université
Discipline : Sciences Biologiques /option : Immuno-Oncologie (UC1, Algérie) Pathologie humaine / option : oncologie (AMU, France)
Présentée par
Yahiaoui-Bentounsi Ouardia Imene
Le 11/12/2014
Membres du Jury :
Présidente de jury : SATTA Dalila. Professeur à l’Université Constantine 1, Algérie.
Directeur de thèse : XERRI Luc. Professeur à Aix Marseille Université, Institut Paoli Calmettes,
Marseille, France.
Co-directrice de thèse : NAIMI Dalila. Directrice de recherche à l’Université Constantine 1, Algérie.
Professeur à l’Ecole Nationale Supérieure de Biotechnologie - Université Constantine 3, Algérie.
Examinateurs :
MOLINA Thierry. Professeur à l’Hôpital Universitaire Necker Enfants Malades, Paris, France. DJIDJIK Réda. Professeur à l’Université d’Alger 1, service d’immunologie, CHU Beni-Messous, Algérie.
DUBREUIL Patrice. Directeur de recherche, INSERM, CRCM, France.
FILALI Taha. Professeur Service d’oncologie - CHU Benbadis / Université Constantine 3, Algérie.
Année universitaire 2014/2015
ANALYSE DE L’ACTIVATION DE LA VOIE PI3K/AKT DANS LE
LYMPHOME FOLLICULAIRE
Remerciements
Au terme de ce travail, il m’est très agréable d’exprimer ma gratitude envers toutes les personnes qui m’ont aidé, soutenu et supporté.
A M. le Professeur Daniel Olive, de m’avoir accueilli au sein du laboratoire de recherche
«Immunité et cancer» qu’il dirige, ainsi que pour son support avant et durant la thèse. Veuillez
trouver ici mes sincères remerciements et mon profond respect.
A M. le Professeur Xerri Luc, mon co-directeur de thèse, de m’avoir accueilli au sein de son équipe de recherche « Microenvironnement des lymphoproliférations et système immunitaire », d’avoir assuré l’encadrement scientifique de la thèse, et de m’avoir permis de mener à terme mes travaux. Veuillez trouver ici mes sincères remerciements et profond respect.
A Madame le Professeur Satta Dalila, qui m’a fait l’honneur de présider le jury de ma thèse de doctorat, et d’avoir accepté l’évaluation de ce travail. Veuillez trouver l’expression de ma profonde gratitude.
A Madame le Professeur Naimi Dalila, ma co-directrice de thèse, pour l’intérêt qu’elle a porté pour ce travail. A Messieurs le Professeur Molina Thierry et le Docteur Dubreuil Patrice d’avoir accepté de participer à mon jury de thèse en tant que examinateurs, et d’avoir consacré du temps pour examiner mon travail. Veuillez trouver ici l'expression de ma reconnaissance et profond respect.
A M. le Docteur Nunès Jacques, pour sa disponibilité, son aide, et ses conseils scientifiques pour l’aboutissement de ce travail. Veuillez trouver ici mes sincères remerciements et profond respect.
J’adresse mes vifs remerciements à Barbarat Bernadette, pour son aide, sa gentillesse, et sympathie. Je voudrais également remercier Philipe et Sylvaine pour leurs conseils techniques, gentillesse et sympathie. Merci à tous les membres de l’équipe Cyril, Eloïse, Florence, Françoise Mallet, Françoise.Gondois-Rey et Ivan pour leur sympathie et la bonne ambiance au sein du laboratoire.
Bien évidemment, je tiens à remercier l’ensemble des collègues du laboratoire et mes amis Anne Sophie, Aude, Audrey, Besma, Céline, Christine, Hassnae, Javier, Kahina, Manel, Mignane, Ruzena, Suong et Ying pour leur sympathie et bonne humeur.
J’exprime mes plus sincères remerciements à mes amies et collègues de l’UC1 Wissem et Meriem pour leur aide, soutien, et sympathie tout au long de cette aventure.
Je tiens également à remercier tous les membres de la plate-forme Génétique Somatique, en particulier Aurélie, et Arnaud, ainsi que toutes les techniciennes du laboratoire de bio-pathologie Christine, Francine et Jeannine.
Mes remerciements vont également au programme Averroès Erasmus Mundus, pour l’octroi de la bourse qui m’a permis de poursuivre mes études supérieures en France. J’aimerai aussi remercier tous les responsables du bureau Téthys : Michel Autric, Chrystelle Roux, Merina Ait Abbas, Sandrine Kilman et Lauriane gros pour leur aide et soutien.
Je dédie cette thèse :
A mes parents, mes deux soeurs, mes beaux-parents, mon beau-frère et ma belle-soeur, que j’aime beaucoup. Merci de m’avoir supporté et soutenu tout au long de ma thèse.
Et finalement, à mon mari Mehdi, pour son soutien, son écoute, ses encouragements. Merci de m’avoir accompagné dans cette aventure et supporté mes humeurs, ça n’a pas été facile pour moi autant que pour toi.
Résumé
La voie PI3K/AKT est impliquée dans la croissance et la progression de divers cancers humains, et semble jouer un rôle majeur dans le développement de tumeurs lymphoïdes. Elle pourrait être impliquée dans la pathogénie du lymphome folliculaire (LF) par certains mécanismes non identifiés.
Les travaux de thèse portent sur l’étude des anomalies de la voie PI3K/AKT dans le lymphome folliculaire, dans le but d’apporter une nouvelle cible thérapeutique.
38 biopsies tissulaires de LF humain ont été étudiées pour une analyse mutationnelle du gène PIK3CA dans les exons 9 et 20 par le séquençage selon la méthode de Sanger. Les mêmes échantillons ont été analysés par western blot et immunohistochimie pour détecter l'expression des protéines AKT, AKT phosphorylée (pAKT), et PTEN. Deux cas de lymphadénite ont été utilisés comme témoins.
Les résultats obtenus montrent que l’expression d’AKT était présente dans tous les cas de LF et lymphadénite, et 14/38 (37%) échantillons de LF et 2/2 cas de lymphadénite exprimaient phospho-AKT. 9/38 (24%) échantillons de LF ont montré un niveau élevé d’expression de phospho-AKT, alors que 5/38 (13%) cas de LF, et 2/2 échantillons de lymphadénite montraient un faible niveau d’expression de phospho-AKT. L’expression de PTEN a été observée dans 30/38 (79%) cas de LF et 2/2 cas de lymphadénite, tandis que 8/38 (21%) cas ont montré une perte d'expression de PTEN. En outre, 3 cas qui expriment phospho-AKT montrent une perte d’expression de PTEN. Aucune mutation du gène PIK3CA n’a été détectée dans les échantillons étudiés.
Ces données suggèrent que la voie PI3K/AKT peut être activée dans certains cas de LF, soit en raison de la phosphorylation d’AKT, soit en raison d’une perte d’expression de PTEN, en absence de mutations de PIK3CA.
Abstract
The phosphoinositide 3- kinase (PI3K) pathway is involved in the growth of various human cancers, including lymphoid malignancies. However its role in the pathogenesis of follicular lymphoma (FL) has not been yet described.
The PhD work focuses on the study of alterations in the PI3K/AKT pathway in follicular lymphoma, in order to provide a new therapeutic target.
To clarify this point, biopsy tissue samples from 38 human FL cases were investigated for
PIK3CA somatic mutations in exons 9 and 20 using Sanger sequencing. The same samples
were analyzed using western blotting and immunohistochemistry to detect expression of AKT, phosphorylated AKT (pAKT), and PTEN proteins. Two cases of benign lymphadenitis were used as controls.
AKT expression was present in all FL and lymphadenitis cases. 14/38 (37%) FL and 2/2 lymphadenitis cases expressed pAKT. 9/38 (24%) FL samples showed high level of pAKT, whereas 5/38 (13%) FL cases and 2/2 benign lymphadenitis samples expressed pAKT at low level. PTEN expression was observed in 30/38 (79%) FL and 2/2 benign lymphadenitis cases, whereas 8/38 (21%) of FL cases showed loss of PTEN expression. In addition, 3 cases with positive pAKT did not express PTEN. PIK3CA mutations were not detected in any sample. These data suggest that the PI3K/AKT signaling pathway could be activated in a subset of FL cases, due to either AKT phosphorylation or PTEN downregulation, in the absence of
PIK3CA mutations.
صخلملا
كساشَ ساسَىا PI3K/AKT ٍف ىَ ّ فيرخٍ خاّ اطشسىا ،حَششثىا اَ ت ٍف لىر ًا سولأا حثُثخىا حَوافَيىا . ِ نى ٓسود ٍف ةثسرىا ٍف ُ اطشس دذغىا حَوافَُيىا ٍ ثَشجىا ٍِ ه لا ضعت خاُ ىِا ٍرىا ٌى ٌرَ اهفصو ذحى ُ ِ ا . ٍِ وجأ فذه شُفىذ ،ٍثَ شجىااٍ ىفَ ُ يىاٍف PI3K /AKTساسَىاخلالاخإحساسدًي عزمشذٓاسىرمدحىاسسو ٍجلا ذَذج . حُ ضىرى ٓزه ،حطقْىا ٌذ قُ قحرىا ٍف خاْ ُ ع خاعز خى حجسّلأا و ٍرىا دىعذ ه 33 حىاح ُ اطشسى دذغىا حَوافَيىا ٍثَ شجىا ٌش شثىا ، و لىر ءاشجإت وُ يحذ خاشفطى حثسىَيى PIK3CA ٍف خاّ ىسملإا 9 و 20 ًا ذخرسات وسيسذ شجّاس . ذقو ٌذ وُ يحذ سفّ خ اُْ عىا ًا ذخرسات Western blot و Immunohistochimie فشنيى ِع شُثعذ خا ْ ُ ذوشثىا AKT ، AKT شفسفٍ ( pAKT )، و PTEN . و ذق دٍ ذخرسإ ِ ُ رىاح ٍِ خلااح باهرىا ذقعىا حَوافَيىا جذَُ حىا دىهشم . دْ ُ ت جئارْىا ِ ُ ذوشثىاشُثعذ ُ أ AKT ُ ام اشضاح ٍف عُ َ ج خلااح ُ اطشس دذغىا حَوافَُيىا ٍثَ شجىا باهرىا و ذقعىا حَوافَيىا جذَُ حىا ، اَ م دتشعأ 14 / 33 ( 33 )٪ ٍِ خاْ ُ ع ُ اطشس دذغىا حَوافَُيىا ٍثَ شجىا و 2 / 2 ٍِ خلااح باهرىا ذقعىا حَوافَيىا جذَُ حىا ِع شُثعذ ِ ُ ذوشثىا شفسفَ ىا pAKT ، ثُ ح خشهظأ 9 / 33 ( 24 )٪ ٍِ خ اْ ُ ع ُ اطشس دذغىا حَوافَُيىا ٍثَ شجىا يىرسٍ ه اع ٍِ شُثعذ ِ ُ ذوشثىا شفسفَىا pAKT . ٍف ِ ُ ح خشهظأ 5 / 33 ( 13 )٪ ٍِ خاْ ُ ع ُ اطشس دذغىا حَوافَُيىا و ٍثَ شجىا 2 / 2 ٍِ خلااح باهرىا ذقعىا حَوافَيىا جذَُ حىا يىرسٍ ِ ٍ ضفخٍْ شُثعذ ِ ُ ذوشثىا pAKT . عحىى ِ ُ ذوشثىا شُثعذ PTEN ٍف 30 / 33 ( 39 )٪ ٍِ خ اُْ ع ُ اطشس دذغىا حَوافَُيىا ٍثَ شجىا و 2 / 2 ٍِ خلااح باهرىا ذقعىا حَوافَيىا جذَُ حىا ، اَ ْ ُ ت 3 / 33 ( 21 )٪ ٍِ خلااحىا حُّ اطشسىا خشهظأ ُ اذقف ِ ُ ذوشثىا شُثعذ PTEN . حفاضلإات ً ىإ ،لىر ُ إف 3 خلااح حُّ اطشس ٍرىا شثعذ ِع ِ ُ ذوشثىا pAKT ُ اذقف شهظذ شُثعرىا ِ ُ ذوشثيى PTEN . ٌى ٌ رَ فشنىا ِع خاشفط ةثروملا PIK3CA ٍف ِ ٍ ٌأ خاْ ُ عىا حسوسذَىا . شُشذ ٓزه خاّ اُثىا ًى إ ساسَىا ُ أ PI3K /AKT ِ نَ َ ُأ ُ ىنَ طُ شّ ٍف حعىَ جٍ حُعشف ٍِ خلااح ُ اطشس دذغىا حَوافَُيىا ٍثَ شجىا ، اٍ إ ةثست جشفسف ِ ُ ذوشثىا AKT وأ ةثست ُ اذقف ِ ُ ذوشثىا شُثعذ PTEN ، ٍف باُ غ خ اشفط حثسىَىا .PIK3CA تاملك ثحبلا : ًا سولأا ،حَوافَيىا خاشفط PIK3CA ، pAKT ، PTENTable des matières
Introduction ... 1
Chapitre I : Développement des lymphocytes B et lymphomagenèse……...3
1. Développement des lymphocytes B ... 3
1.1. Maturation des cellules B ... 3
1.1.1. Phase indépendante de l’antigène ... 4
a) Le stade pro B ... 5
b) Le stade pré B ... 6
c) Le stade B immature ... 7
1.1.2. Phase dépendante de l’antigène ... 9
a) Les lymphocytes B de la zone marginale ... 10
b) Les lymphocytes B de la zone folliculaire ... 11
c) Les lymphocytes B anergiques ... 12
d) Les cellules B-B1 ... 13
2. Recombinaison V(D)J des gènes du BCR et mécanisme de translocation chromosomique 15 2.1. Organisation des gènes des immunoglobulines et recombinaison V(D)J ... 16
2.2. Hypermutation somatique ... 20
2.3. Commutation de classe ... 23
3. Lymphomagenèse ... 25
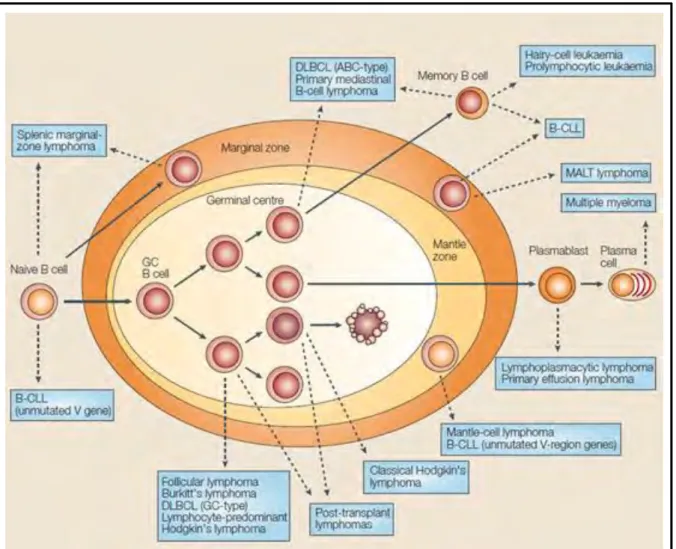
4. Origine cellulaire des lymphomes B ... 27
Chapitre II : Lymphome folliculaire ... 30
1. Généralité sur le lymphome folliculaire... 30
2. Phénotype des cellules folliculaires lymphomateuses ... 31
3. Pathogenèse et mécanisme de la translocation t(14,18) ... 32
4. Traitement ... 37
4.1. Traitement des lymphomes folliculaires localisés ... 37
4.2. Traitement des lymphomes folliculaires disséminés ... 37
Chapitre III : Voie PI3K/AKT et cancer ... 39
1. Les membres de la famille des enzymes PI3Ks ... 39
1.1. PI3K de classe I ... 39
1.1.2. PI3K classe IB ... 40
1.2. PI3K de classe II ... 40
1.3. PI3K de classe III ... 40
2. Mécanisme d’activation de la PI3K de classe I ... 42
3. Phosphatase PTEN ... 44
4. PKB/AKT ... 46
5. Mécanisme d’activation de la voie PI3K/AKT ... 48
6. Conséquences de l’activation de la voie PI3K/AKT ... 50
6.1. Prolifération cellulaire ... 50
6.2. La survie cellulaire ... 50
6.3. Le métabolisme cellulaire ... 51
6.4. La croissance cellulaire ... 51
6.5. L’angiogenèse ... 52
7. Altérations de la voie PI3K/AKT dans les cancers humains ... 54
7.1. AKT ... 55
7.2. PTEN ... 59
7.3. PI3K ... 60
8. Activation de la voie PI3K/AKT dans les tumeurs malignes lymphoïdes ... 62
Chapitre IV : Objectif du projet ... 64
Chapitre V : Méthodologies expérimentales ... 65
1. Patients et échantillons tissulaires tumoraux ... 65
2. Extraction d’ADN, d’ARN, et de protéine ... 65
3. Réaction de polymérisation en chaine (PCR) et analyse mutationnelle des hot spots du gène PIK3CA (exon 9 et 20) ... 69
3.1. PCR ... 69
3.2. Réaction de séquence et analyse des mutations du gène PIK3CA ... 70
4. Western blot ... 72
5. Immunohistochimie ... 74
6. Analyse statistique ... 75
Chapitre VI : Résultats ... 76
Article : Constitutive AKT activation in follicular lymphoma ... 76
1. Absence de mutations activatrices du gène PIK3CA dans le LF ... 77
2. Expression d’AKT, pAKT et PTEN dans le lymphome folliculaire ... 77
Chapitre VII : Discussion et Conclusion ... 90 Références bibliographiques ... 93
Liste des illustrations
Figure 1.Stades de différenciation des cellules B. ... 4
Figure 2. Interaction des cellules stromales de la moelle osseuse avec les progéniteurs des cellules B. ... 5
Figure 3. Genèse de l’expression de l’immunoglobuline membranaire et la chaine légère de substitution au stade pré-B. ... 7
Figure 4. Processus de receptor editing. ... 8
Figure 5. Modèle de l’extravasation des leucocytes. ... 10
Figure 6. Développement des cellules B et sous-population des cellules B. ... 14
Figure 7. Organisation germinales des locus des chaines lourdes et légères d’immunoglobulines dans le génome humain. ... 16
Figure 8. Les séquences signal de recombinaison. ... 17
Figure 9. Mécanisme de recombinaison V(D)J et réparation des cassures double brins de l’ADN. ... 19
Figure 10. Mécanisme de la désamination de l'ADN lors de l’hypermutation somatique. ... 22
Figure 11. Commutation isotypique de l’IgE. ... 24
Figure 12. Les mécanismes moléculaires de réarrangements des gènes de la chaine lourdedes immunoglobulines responsables des cassures d’ADN et les translocations du locus IgH. ... 26
Figure 13. Origine cellulaire des lymphomes B. ... 29
Figure 14. Illustration de la translocation t(14, 18). ... 32
Figure 15. Accumulation des lésions lors de la transformation en lymphome folliculaire. .... 35
Figure 16. Classification des membres de la famille des PI3K. ... 41
Figure 17. Model de l'activation de PI3K de classe I. ... 43
Figure 18. Représentation schématique de la protéine PTEN. ... 44
Figure 19. Caractéristiques cellulaires associées à la présence ou l'absence nucléaire de PTEN. ... 45
Figure 20. Structure des domaines des isoformes de la protéine AKT et modèles des sites de liaison de l'ATP. ... 48
Figure 21. La voie de signalisation PI3K/AKT. ... 53
Figure 22. Distribution de mutation somatique du gène PIK3CA dans les cancers humains. 61 Figure 23. Schéma récapitulatif de l’extraction d’ADN, d’ARN et des protéines par utilisation du kit AllPrep DNA/RNA/Protein (Qiagen). ... 68
Liste des tableaux
Tableau 1. Les lymphomes B humains matures. ... 28
Tableau 2. Altérations génétiques dans le lymphome folliculaire ... 36
Tableau 3. Activation d’AKT dans les cancers humains ... 55
Tableau 4. Séquences des amorces de PCR ... 70
Tableau 5. Anticorps primaires utilisés en western blot ... 73
Liste des abréviations
A
DN Acide désoxyrébonucléiqueAGC c-AMP dependent protein kinase A/ protein kinase G/ protein kinase C AID Activation-Induced cytidine Deaminase
ARN Acide ribonucléique
ATM Ataxia Telangiectasia Mutated
B
ad Bcl2-antagonist of cell death Bcl2 B cell lymphoma 2Bcl6 B cell lymphoma 6
BCR B Cell Recepteur
BER short-patch Base Excision Repair
C
aMKK calcium/calmodulin dependent kinase kinase CD Cluster de DifférenciationCDR Complementary Determining Regions
CHOP Cyclophosphamide Hydroxydaunomycin Oncovin Prednisonel CMH Complexe Majeur d'Histocompatibilité
c-Myb Myeloblastosis
c-Myc Cellular Myelocytomatosis viral oncogene homolog CREB Cyclic AMP Response Element Binding protein CSR Class Switch Recombination
D
DiversitéddNTP Didésoxyribonucléotides
DNA-PK DNA- dependent Protein Kinase dNTP Désoxyribonucléotides
DO Densité Optique
E
BV Epstein Barr Virus EGF Epidermal Growth FactorEGFR Epidermal Growth Factor Receptor eIF4E Eukaryotic Initiation Factor 4 E
ESAM Endothelial Cell Selective Adhesion Molecule
F
AK Focal Adhesion KinaseFLIPI Follicular Lymphoma International Prognostic Index
G
ab1 GRB2 associated binding protein 1GELA Groupe d’Etude des Lymphomes de l’Adulte GLUT Glucose Transporter
Grb2 Growth factor receptor bound protein 2 GSK3β Glycogen Synthase Kinase 3β
H
HeavyHEV High Endothelial Venules HIFα Hypoxia Inducible Factor α HSM Hypermutation Somatique
I
CAM1 Intercellular Adhesion Molecule 1 IFNγ Interféron γIg Immunoglobuline
IHC Immunohistochimie
IL Interleukine
ILK Integrin Linked Kinase IRS Insulin Receptor Substrate
J
JonctionJak Janus kinase
JAM Junctional Adhesion Molecule
k
Da Kilo DaltonL
LightLDH Lactate déshydrogénase LF Lymphome Folliculaire
LFA-1 Lymphocyte Function Associated Antigen 1 LNH Lymphome Non Hodgkinien
LPS Lipopolysaccharide
M
AC1 Macrophage Antigen 1MADCAM1 Mucosal Vascular Addressin Cell Adhesion Molecule 1 MAPK APK2 Mitogen Activated Protein Kinase Activated Kinase 2 MBR Major Breakpoint Region
MCR Minor Cluster Region Mdm2 Murine double minute 2
MMAC Mutated in Multiple Advanced Cancer
MMR Mismatch Repair
mTOR mammalian Target Of Rapamycin mTORC 1 mTOR/rictor complex 1
mTORC 2 mTOR/rictor complex 2
N
Fkβ Nuclear Factor kappa β NHED Non Homologus End JoingO
LS Organes Lymphoides Secondairesp
70S6K p70 ribosomal protein S6 kinasepAKT phospho-AKT
PALS Periarteriolar Lymphoid Sheaths PBMC Peripheral Blood Mononuclear Cell
PCR Polymerase Chain Reaction pdb paires de bases
PDGF Platelet Derived Growth Factor
PDK1 3’-Phosphoinositide Dependent Kinase 1 PDK2 3’-Phosphoinositide Dependent Kinase 2 PECAM1 Platelet Endothelial Cell Adhesion Molecule 1
PH Plekstrin Homology
PI3K Phosphoinositide-3 Kinase
PIP2 Phosphatidylinositol 4, 5-bisphosphate PKB Protein Kinase B
PKC Protein Kinase C
PKCbII Protein Kinase C bII
PSGL1 P-Selectin Glycoprotein Ligand 1 PtdIns Phosphatidylinositol PtdIns(3,4)P2 Phosphatidylinositol-3,4-diphosphate PtdIns(3,4,5)P3 Phosphatidylinositol-3,4,5-triphosphate PtdIns(4,5)P2 Phosphatidylinositol-4,5-diphosphate PtdIns3P Phosphatidylinositol-3-phosphate PtdIns4P Phosphatidylinositol-4-phosphate
PTEN Phosphatase and Tensin Homologue deleted chromosome 10 PTK Protéine Tyrosine Kinase
R
AC Related to protein kinase A and C RAG Recombination Activating GenesRas Rat sarcoma
RCPG Récepteur Couplé aux Protéines G Rheb Ras homolog enriched in brain RSS Recombination Signal Sequence RTK Récepteur à activité Tyrosine Kinase
S
SwitchSCF Stem Cell Factor
SH Src Homology
SHC Src homology 2 domain containing protein SHM Somatic Hypermutation
Src Sarcoma
T
CR T Cell ReceptorTdT Terminal deoxynucleotidyl Transferase
TGF-β Transforming Growth Factor β
Th T helper
TNF Tumor Necrosis Factor
TRADD TNF Receptor type 1 Associated Death Domain TRAIL TNF Related Apoptosis Inducing Ligand
TSC1 Tuberous Sclerosis Complex 1 TSC2 Tuberous Sclerosis Complex 2
V
VariableVCAM-1 Vascular Cell Adhesion Molecule 1 VEGF Vascular Endothelial Growth Factor
VEGFR Vascular Endothelial Growth Factor Receptor VLA-4 Very Late Antigen 4
Vps34 Vacuolar protein sorting defective 34
W
B Western blotX
LF XRCC4 Like FactorXRCC4 X ray Repair Cross Complementing protein 4
Introduction
1
e lymphome folliculaire (LF) est le second type le plus fréquemment rencontré des lymphomes non hodgkiniens à faible degré de malignité. Il dérive des néoplasies développées à partir des lymphocytes B du centre germinatif.
Sur le plan moléculaire, le LF est caractérisé par la translocation t(14, 18) (q32; q21), ce qui se traduit par la juxtaposition du gène BCL2 situé sur le chromosome 18 aux gènes
promoteurs des chaînes lourdes d’immunoglobuline situés sur le chromosome 14. Cela conduit à la surexpression de la protéine anti-apoptotique Bcl-2, ce qui fournit un signal
de survie constitutive dans les cellules du LF.
L'évolution clinique du LF est généralement indolente. Bien qu’il soit sensible à certains agents chimiothérapeutiques, il est caractérisé par de multiples rechutes qui peuvent se produire après le traitement. La plupart des cas peuvent résister aux traitements habituels ou se transformer en lymphomes diffus agressifs à grandes cellules B. Il y a donc un besoin de thérapies plus efficaces, et la recherche d'autres cibles impliquées dans la pathogenèse du LF pourrait offrir de nouvelles opportunités dans l’amélioration des thérapeutiques actuelles, et de là une amélioration de la prise en charge des patients.
La voie PI3K/AKT joue un rôle crucial dans la survie et la prolifération cellulaire, et elle est souvent activée dans de nombreux cancers humains. Cette voie semble être impliquée dans le phénomène de résistance aux thérapies anti-tumorales, à savoir le Trastuzumab (anticorps anti-HER2) dans le cancer du sein, l'Erlotinib ou le Gefitinib (inhibiteur de la tyrosine kinase du récepteur du facteur de croissance épidermique humain EGFR) dans le cancer du poumon, et le Temozolomide (agent alkylant cytotoxique) dans le glioblastome [1].
L’origine de l’activation aberrante de cette voie dans les cancers humains provient de mutation des oncogènes PTEN, AKT ou de l’enzyme PI3K.
La caractérisation des anomalies affectant la voie PI3K/AKT dans le LF constitue l’objectif principal de la problématique que je propose de développer dans la présente thèse afin de mieux comprendre les mécanismes moléculaires impliqués dans cette voie et essentiellement leurs dysfonctionnements dans la pathogenèse du LF. Ceci pourrait aboutir à une nouvelle piste de recherche de molécules thérapeutiques d’efficacité potentielle contre les cellules cancéreuses du LF.
Introduction
2
Pour introduire ce travail, le développement normal des lymphocytes B sera décrit dans le premier chapitre du manuscrit, dans le but de dévoiler les altérations des remaniements géniques intervenant au cours de la maturation des cellules B, qui induisent un développement pathologique des lymphocytes B, et l’émergence de lymphome.
Dans le deuxième chapitre, seront évoqués les mécanismes moléculaires impliqués dans la pathogenèse du LF. En troisième chapitre, seront décrits la voie PI3K/AKT ainsi que les molécules membres de cette voie, leurs mécanismes d’activation, la cascade de signalisation de la voie, et essentiellement les dysfonctionnements de cette voie conduisant au développement de cancers, notamment les tumeurs lymphoïdes. Pour finir, le travail réalisé et les résultats obtenus seront présentés et discutés.
Chapitre I : Développement des
lymphocytes B et lymphomagenèse
Chapitre I : Développement des lymphocytes B et lymphomagenèse
3
I
.Développement des lymphocytes B et lymphomagenèse
1.
Développement des lymphocytes B
Les lymphocytes B font partie du système immunitaire adaptatif et constituent des éléments centraux de la réponse immune humorale. Ils sont responsables de la production des anticorps spécifiques contre une variété d’antigènes, qui se lient par l'intermédiaire du récepteur de lymphocytes B (BCR). Des anomalies survenant lors du développement, sélection, et activation des cellules B conduisent à l’auto-immunité, à la malignité, à l’immunodéficience, ou à l’allergie.
Le processus de développement qui aboutit à la production de plasmocytes et cellules B mémoires se produit en plusieurs étapes:
Développement des cellules B matures immunocompétentes.
Activation des cellules B lorsqu’elles entrent en contact avec l’antigène.
Différenciation en plasmocytes secrétant des anticorps ou en cellules B mémoires, et chaque étape comprend des réarrangements génétiques aux loci d’anticorps.
1.1. Maturation des cellules B
Au cours de la vie embryonnaire, le sac vitellin, le foi fœtal, et la moelle fœtale sont les principaux sites de maturation des cellules B [2]. Chez les mammifères, le développement des cellules B s’effectue dans la moelle osseuse à partir de précurseurs hématopoïétiques. Les étapes de différenciation se divisent en deux phases principales; indépendante ou dépendante de l’antigène. La phase indépendante de l’antigène qui a lieu dans la moelle osseuse implique la différenciation de cellules souches hématopoïétiques en cellules B immatures exprimant une immunoglobuline de surface capable de reconnaître un antigène. Elle comprend des étapes successives de réarrangements des gènes d’immunoglobulines, appelées recombinaison V(D)J. Ce processus permet la synthèse des chaines lourdes et légères du récepteur spécifique de la cellule B mature, le BCR. Ces réarrangements séquentiels se produisent au cours de divers stades de maturation : les progéniteurs pro-B, les précurseurs pré-B, les cellules B immatures (Figure 1).
Chapitre I : Développement des lymphocytes B et lymphomagenèse
4
La seconde phase est dépendante de l’antigène, se produit dans les organes lymphoïdes secondaires, où la cellule entreprend une expansion clonale et une différenciation, lesquelles aboutissent à une population de plasmocytes et de cellules B mémoires.
1.1.1. Phase indépendante de l’antigène
Le développement des cellules B commence lorsque les cellules souches hématopoïétiques s'engagent dans le lignage B. Cela se passe par une multitude de stades de différenciation et de points de contrôle qui garantissent le bon fonctionnement de l’un des acteurs principaux de l’immunité qui est le lymphocyte B.
Figure 1. Stades de différenciation des cellules B. Le schéma décrit le processus et
caractéristiques d’expression d’IgM, IgD, marqueur de surface, les enzymes, et les facteurs de transcriptions impliqués dans la maturation des lymphocytes B. D’après [2].
Chapitre I : Développement des lymphocytes B et lymphomagenèse
5 a) Le stade pro B
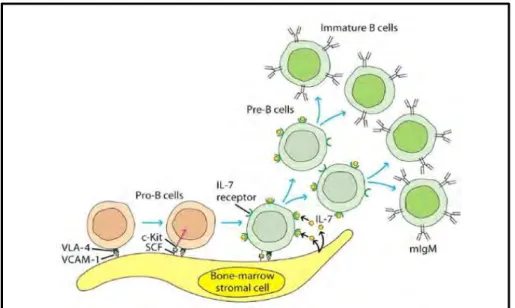
Les cellules pro-B sont dérivées des cellules souches hématopoïétiques pluripotentes et possèdent une capacité d’autorenouvellement. Les cellules pro-B prolifèrent à l'intérieur de la moelle osseuse et remplissent les espaces extravasculaires entre les sinusoïdes. Elles expriment une tyrosine phosphatase transmembranaire appelée CD45R.La différenciation des cellules pro-B en cellules pré-B nécessite un microenvironnement fourni par les cellules stromales de la moelle osseuse. Ces dernières jouent un rôle important en interagissant directement avec les cellules pro-B et pré-B, et en secrétant diverses cytokines, en particulier l’IL-7 qui favorise le processus développemental. Les cellules pro-B se lient aux cellules stromales par l’intermédiaire des molécules d’adhésion cellulaire, y compris le VLA-4 exprimé sur la cellule pro-B, et son ligand le VCAM-1 exprimé à la surface de la cellule stromale (Figure 2). Cette interaction favorise la liaison de la protéine c-Kit des cellules pro-B au facteur de croissance des cellules souches (SCF) de la cellule stromale. Cette interaction déclenche un signal médié par l’activité tyrosine kinase du récepteur c-Kit, qui stimule l’expression du récepteur de l’IL-7 par la cellule pro-B. l’IL-7 libérée par les cellules stromales se lie ensuite aux récepteurs de l’IL-7 ce qui induit la maturation de la cellule pro-B en cellule pré-B, et conduit à une diminution de l'expression des molécules d'adhésion sur les cellules pré-B, de telle façon que les cellules proliférantes puissent se détacher des cellules stromales, et continuer leur différenciation sous la stimulation de l’IL-7 [2].
Figure 2. Interaction des cellules stromales de la moelle osseuse avec les progéniteurs des cellules B. D’après [2].
Chapitre I : Développement des lymphocytes B et lymphomagenèse
6
A ce stade, le réarrangement du locus des chaînes lourdes d’immunoglobulines commence à se mettre en place : la jonction DH à JH au stade précoce de la cellule pro-B. Ces
premiers réarrangements sont suivis dans les cellules pro-B au stade tardif par l'assemblage de
la jonction VH à DJH. Seuls les segments VHDHJH en phase de lecture correcte et sans codon
stop codent pour une région variable fonctionnelle et permettent la synthèse d'une chaîne lourde µ intracytoplasmique [3].
Les cellules pro-B sont caractérisées par l’expression membranaire des antigènes CD19 et CD10. La molécule CD19 qui apparaît à partir de ce stade est un marqueur Pan-B. En revanche, l’expression du CD10 est transitoire et s’éteint après cette étape. Les protéines de transduction du signal intracellulaire, Igα (CD79a) et Igβ (CD79b), sont exprimées faiblement à la surface des cellules pro-B en association avec la calnexine [4].
Les cellules pro-B expriment à leurs surfaces une pseudo chaîne légère composée des polypeptides Vpré-B et λ5 [5]. Elles expriment également une enzyme nucléaire TdT (Terminal deoxynucleotidyl Transferase) qui catalyse l’insertion des nucléotides au niveau des jonctions codantes des segments réarrangés, augmentant ainsi la diversité des immunoglobulines. Les complexes enzymatiques de la recombinaison, RAG1 et RAG2 (Recombinaison Activating Genes) intervenant lors du réarrangement des gènes des immunoglobulines, sont exprimés au cours des stades cellulaires pro-B et pré-B.
b) Le stade pré B
A ce stade la cellule pré-B exprime à sa surface la chaîne lourde qui a été précédemment réarrangée, en combinaison avec la pseudo chaîne légère qui est constituée de deux polypeptide Vpré-B et λ5 liés de façon non covalente. Ce complexe s’associe à l’hétérodimère CD79a (Igα) et CD79b (Igβ), pour former le récepteur de la cellule B (BCR). Le pré-BCR permet à la cellule de passer au stade ultérieur de la différenciation et conduit ainsi à l’exclusion allélique en induisant une diminution transitoire de l'expression des gènes RAG, pour empêcher un réarrangement ultérieur des gènes VHDHJH de l’autre allèle de la chaine
lourde, et entreprendre le réarrangement des gènes VLJL pour synthétiser une seule chaîne
Chapitre I : Développement des lymphocytes B et lymphomagenèse
7 c) Le stade B immature
Le développement d'une cellule pré-B en lymphocyte B immature nécessite la production d’une chaine légère classique qui remplace la pseudo chaine légère et donne naissance à une IgM de surface conférant à la cellule une spécificité de reconnaissance de l’antigène. Comme les lymphocytes B immatures sont produits dans la moelle osseuse, ils subissent un processus de sélection négative, où les cellules B immatures possédant les immunoglobulines membranaires réactives contre les antigènes du soi avec une grande affinité sont éliminées par apoptose. Il est possible pour ces cellules de réaliser des réarrangements secondaires au locus de chaînes légères et ainsi de changer la spécificité de leurs récepteurs. Ce phénomène est nommé Receptor editing (Figure 4) [6]. Quatre mécanismes sont impliqués dans l’acquisition
Figure 3. Genèse de l’expression de l’immunoglobuline membranaire et de la chaine légère de substitution au stade pré-B. Le récepteur de la cellule pré-B
contient une chaine légère de substitution constituée de deux polypeptides Vpré-B et λ5 associés de façon non covalente. La cellule B immature n’exprime plus la chaine légère de substitution, mais exprime la chaine légère κ ou λ, ainsi que la chaine lourde µ. D’après [2].
Chapitre I : Développement des lymphocytes B et lymphomagenèse
8
de la tolérance centrale des lymphocytes B : 1) la réédition des récepteurs pour l’antigène, 2) la délétion clonale, 3) l’anergie et 4) l’ignorance clonale.
Figure 4. Processus de receptor editing. (a) l’expression d’un BCR membranaire
qui interagit avec un antigène réactif conduit à l’internalisation du BCR auto-réactif et à l’induction d’un signal qui favorise l'arrêt du développement,
l’activation de la réexpression de RAG1 et RAG2 et la progression de la recombinaison V(D)J. L'édition de la chaîne légère conduit à l'expression d'une nouvelle chaîne légère distincte, générant une immunoglobuline de surface non autoréactive, ayant une nouvelle spécificité. (b) Si la cellule n’arrive pas à activer
une nouvelle recombinaison des gènes de la chaine légère, cela conduit à la perte du récepteur cellulaire. (c) Tandis que l’échec à la correction d’un récepteur
Chapitre I : Développement des lymphocytes B et lymphomagenèse
9
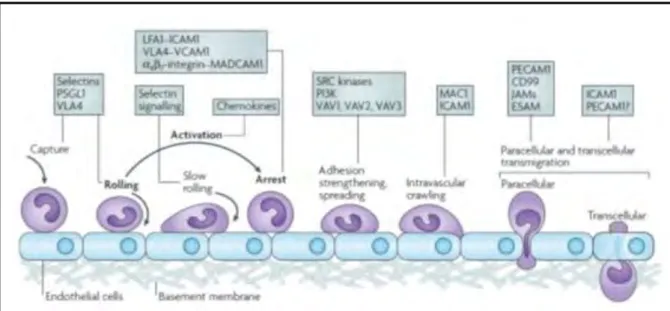
Après avoir subi cette sélection négative, les cellules B immatures qui survivent quittent la moelle osseuse et gagnent les Organes Lymphoïdes Secondaires (OLS) pour suivre les dernières étapes de maturation. Les lymphocytes B immatures naïfs entrent dans les OLS via les veinules à endothélium épais HEV (High Endothelial Venules). La trans-migration des lymphocytes B entre les cellules endothéliales des veinules est constituée d’une succession d’événements coordonnés qui résulte d’un enchaînement de processus d’attachement, de roulement et d’adhésion par l’intermédiaire de molécules d’adhérence et des récepteurs spécifiques de chimiokines [7] (Figure 5).On distingue quatre étapes successives :
une adhésion primaire transitoire, réversible, et un roulement du lymphocyte sur la surface endothéliale. Elle est médiée par les sélectines.
une activation lymphocytaire rapide, dépendante des chimiokines.
une adhésion ferme et stable à la surface endothéliale, contrôlée par les intégrines, prélude à la diapédèse.
une extravasation du lymphocyte à travers l’endothélium vasculaire vers les tissus.
1.1.2. Phase dépendante de l’antigène
Les cellules B immatures transitent de la moelle osseuse vers les OLS et passent à un stade intermédiaire, le stade des cellules B transitionnelles T1 et T2. Les lymphocytes B T1 présentent un phénotype IgMhighIgD-CD21-CD23- [8], et sont localisés dans les manchons
lymphoïdes péri artériolaires PALS (Periarteriolar Lymphoid Sheaths) de la rate.
A ce stade de maturation intervient le processus de tolérance périphérique afin d’éliminer par apoptose les clones autoréactifs, les cellules survivantes se différencient en lymphocytes B T2, et acquièrent l’expression d’IgD en plus de l’IgM par épissage alternatif de l’ARNm et d’autres marqueurs de surface CD21 et CD23 [9] et deviennent des lymphocytes B matures naïves. Au contact de l’antigène, ces cellules B matures peuvent se différencier soit en lymphocytes B de la zone marginale (ZM) qui sont impliqués dans les réponses humorales thymo-indépendantes, soit en lymphocytes B folliculaires conventionnels impliqués dans les réponses humorales dépendantes des lymphocytes T (Figure 6).
Chapitre I : Développement des lymphocytes B et lymphomagenèse
10 a) Les lymphocytes B de la zone marginale
Au niveau de la rate, les cellules B de la ZM sont la première ligne de défense contre les agents pathogènes atteignant le sang. Elles sont de phénotype CD27+IgM+IgDlow CD23-CD21+
CD1c+ et pour la plupart CD5- [10, 11, 12]. Elles représentent entre 10 et 15% du
compartiment B circulant, et sont capables de répondre rapidement aux antigènes thymo-indépendants, sans l’aide des lymphocytes T, entre autres aux polysaccharides capsulaires
Figure 5. Modèle de l’extravasation des leucocytes. L’extravasation comporte quatre
étapes successives: le roulement qui est médiée par les sélectines, l’activation qui est médiée par des chimiokines, l’adhésion qui est médiée par les intégrines (LFA-1,VLA-4), et la diapédèse. Les molécules impliquées dans chaque étape sont indiquée dans les cases. ESAM: Endothelial Cell Selective Adhesion Molecule, ICAM1: Intercellular Adhesion Molecule 1, JAM: Junctional Adhesion Molecule, LFA-1: Lymphocyte Function Associated Antigen-1 (connu également sous le nom αLβ2-integrin), MAC1: Macrophage
Antigen 1, MADCAM1: Mucosal Vascular Addressin Cell Adhesion Molecule 1, PSGL1 : P‑Selectin Glycoprotein Ligand 1, PECAM1 : Platelet Endothelial Cell Adhesion Molecule 1, PI3K: Phosphoinositide 3‑Kinase, VCAM-1 : Vascular Cell Adhesion Molecule-1, VLA-4 : Very Late Antigen-4 (connu également sous le nom α4β1-integrin). D’après [7].
Chapitre I : Développement des lymphocytes B et lymphomagenèse
11
bactériens. Elles se développent en plasmocytes extra-folliculaires secrétant des IgM de faible affinité pour l’antigène [2]. Les cellules B de la ZM humaines expriment une IgM portant
d’hypermutations somatiques des régions variables, et ellessont capables de regagner le flux sanguin [12,13].
b) Les lymphocytes B de la zone folliculaire
Ces lymphocytes B folliculaires circulent dans les OLS (la rate, les ganglions lymphatiques, les plaques de Peyer et les amygdales) à la recherche de leur antigène. S’ils ne le trouvent pas, ils quittent l’OLS et gagnent la circulation sanguine. Par contre, s’ils le rencontrent, ils deviennent activés, et l’expression de leur récepteur CCR7 augmente ce qui favorise leur migration vers la zone T [14], où ils vont interagir avec les lymphocytes T auxilliaires CD4+ et former ainsi un foyer primaire dans les cordons médullaires [3]. Cette
interaction peut induire d’une part la différenciation des lymphocytes B folliculaires en plasmocytes extra-folliculaires de courte durée de vie [15], sécréteurs d’IgM principalement
et d’autre part, la migration de certaines cellules activées forme un centre germinatif grâce à l’expression de Bcl6 (B-cell lymphoma 6). Dans le centre germinatif, les cellules B diminuent l’expression de leur Ig de surface et deviennent dans la zone sombre des centroblastes qui subissent une prolifération intense, et expriment l’enzyme AID (Activation Induced cytidine Deaminase). Elles initieront également le processus de maturation de l’affinité par le mécanisme d’hypermutation somatique des domaines variables des chaînes lourdes et légères
des Ig. Par la suite, la division cellulaire s’arrête, les centroblastes augmentent l’expression de BCR à leur surface et migrent vers la zone claire du centre germinatif. Cela induit la transition vers le stade de centrocytes. Dans la zone claire, les centrocytes vont interagir avec les iccosomes, des complexes immuns présents sur les extensions des cellules dendritiques folliculaires. Les cellules portant des Ig membranaires de forte affinité pour les iccosomes seront activées, et celles qui ont une faible affinité meurent par apoptose. Ensuite, les centrocytes activés interagissent avec les cellules Th (helper) folliculaire par l’interaction CMHII-antigène peptidique et TCR et reçoivent un signal de survie de la part des cellules Th par l’intermédiaire de l’interaction CD40-CD40L. Ceci induit l’activation des Th par un signal de costimulation B7-CD28 et la sécrétion de cytokines, telles qu’IL-2, IL-4, IL-5, IFNγ, TGF-β, amenant ainsi les centrocytes à proliférer et se différencier.
Chapitre I : Développement des lymphocytes B et lymphomagenèse
12
A cette étape, les centrocytes sont soumis au processus de la commutation de classe et gagnent la partie apicale de la zone claire où ils continueront leur différenciation vers le stade des cellules effectrices. Elles se différentient en plasmocytes sécrétant des anticorps d’isotype IgG, IgA, IgE, et en lymphocytes B mémoires qui quittent le centre germinatif et migrent vers différents tissus pour coloniser les sites drainant l’antigène et constituer un pool au niveau de la zone marginale de la rate. Ils sont capables de vivre longtemps, de répondre très rapidement à des pathogènes et d’induire une réponse immune secondaire rapide et efficace en se différenciant en plasmocytes.
Plusieurs sous populations de cellules B mémoires ont été identifiées chez l'homme sur la base de l'expression de CD27 [16]. Il existe des cellules B mémoires «switchées» de phénotype CD27+ IgD- IgG/A/E+ [17] dérivées des réponses thymodépendantes du centre
germinatif et contenant des charges élevées de SHM (Somatic Hypermutation) dans leurs gènes Ig [8], et des cellules B mémoires «non-switchées» qui comprennent les cellules B mémoires CD27+ IgD- IgM+ et les cellules B de la zone marginale [17].
c) Les lymphocytes B anergiques
Durant le développement des lymphocytes B, 75% des cellules B générées sont autoréactives [18]: environ un tiers de ces cellules autoréactives vont subir le processus de receptor editing dans lequel le réarrangement des gènes des Ig se met en place pour produire une nouvelle chaine légère assemblée avec la chaine lourde des Ig existantes pour générer un BCR non autoréactif [19, 20]. A défaut, les cellules B autoréactives sont éliminées par apoptose [21]. Les clones auto-réactifs qui échappent à ces mécanismes seront tolérisés par induction d’une anergiequi les rend insensibles aux stimulations antigéniques [22].
Une population de cellules anergiques a été décrite chez la souris, les cellules B T3 ou An1 de phénotype CD93+CD23+IgMlow. Elles ne sont pas considérées comme une population
intermédiaire entre les cellules B T2 et les cellules B folliculaires matures, et résident dans les ganglions lymphatiques et le sang périphérique [22].
Chez l’homme, elles ont été identifiées comme étant une population de cellules B naïves auto-réactives de phénotype CD19+CD27-CD21-/low, réfractaire à une stimulation antigénique
Chapitre I : Développement des lymphocytes B et lymphomagenèse
13 d) Les cellules B-B1
Il existe une sous-population de cellules B, appelées cellules B-B1 qui représentent environ 5% de l’ensemble des cellules B chez la souris [3]. Elles expriment les Igs de surface IgM, IgD et le marqueur CD5 [2]. Apparaissant pendant le développement fœtal et dérivant des précurseurs de la moelle osseuse [25], elles ont la capacité de s’auto-renouveler et se localisent principalement dans les cavités pleurale et péritonéale, et peu dans la rate et les ganglions lymphatiques.
Les cellules B-B1 ont été subdivisées en deux sous-populations, les B-B1a et les B-B1b : Les lymphocytes B-B1a (B220low CD19high IgMHigh IgDlow CD43+Mac-1+CD5+) [9]
participent à la réponse immune innée en produisant des anticorps naturels de type IgM sans stimulation antigénique [26], mais en présence de stimuli cellulaires de type LPS (Lipopolysaccharides) [27]. Les lymphocytes B-B1b se distinguent des cellules B-B1a par l’absence du marqueur CD5, et semblent être la principale source de réponse adaptative productrice d'anticorps contre les polysaccharides de la paroi cellulaire bactérienne et des Ag Thymo-indépendant de type 2 [28]. Elles peuvent subir les mécanismes de HSM (Hypermutation Somatique) et CSR (Class Switch Recombination), et produire des anticorps d’isotype IgA dans la cavité péritonéale [29].L’existence chez l’homme d’une population B-B 1 est incertaine, et leur équivalent fonctionnel peut être représenté par les lymphocytes B-B mémoire de la ZM [30].
Chapitre I : Développement des lymphocytes B et lymphomagenèse
14 Figure 6. Développement des cellules B et sous-population des cellules B.
Les cellules B se développent dans la moelle osseuse à partir de cellules souches hématopoïétiques. Le locus de la chaine lourde se réarrange en premier. Le réarrangement d’un segment du gène DH avec celui du gène JH se produit au stade
pro-B. Le réarrangement du segment VH a lieu au stade pré-B. Dans les cellules pré-B
CD10+ CD19+, un réarrangement VDJH fonctionnel conduit à l’expression d’une chaine
lourde d’immunoglobuline complète associée aux polypeptides Vpré-B et λ5 composant le récepteur pré-B, qui se trouve principalement dans le cytoplasme. Le pré-BCR induit des signaux inhibant l’expression de RAG, ce qui empêche le réarrangement du second allèle de la chaîne lourde et induit la prolifération. Ensuite, les gènes RAG sont ré-exprimés pour initier le réarrangement des gènes de la chaine légère. Quand les cellules assemblent correctement la chaine légère, elles deviennent des cellules B immatures exprimant l’IgM, une immunoglobuline complète membranaire.
Chapitre I : Développement des lymphocytes B et lymphomagenèse
15
2.
Recombinaison V(D)J des gènes du BCR et mécanisme de translocation
chromosomique
La recombinaison VDJ est un mécanisme génétique utilisé par les cellules immunitaires pour assembler les gènes des récepteurs BCR et TCR à partir des segments géniques des régions variables V, de diversité D, et de jonction J. Ce mécanisme est initié par l’expression des enzymes recombinases RAG1 et RAG2 (Recombination Activating Genes) qui vont cibler les segments VDJ, se fixer dessus, et induire des cassures double brins dans l’ADN entre les segments des gènes et les séquences RSS (Recombination Signal Sequence).
Par la suite, elles contribuent avec le facteur NHED (Non Homologus End Joing) qui consiste à réparer les séquences d’ADN endommagées et à faire la ligation par des complexes protéiques [31].
Cette IgM exprimée par les cellules B immatures modifie le profil d'expression de nombreux gènes et initie leur circulation. Les cellules B immatures entrent dans la rate comme des cellules transitionnelles, où elles reçoivent des signaux de survie et complètent leur développement en cellules B de la zone marginale, ou en cellules B folliculaires, en fonction de la spécificité de leur BCR. Au contact direct avec l'antigène, les cellules B de la zone marginale peuvent se développer en plasmocytes ayant une courte durée de vie. Les cellules B folliculaires sont activées par la reconnaissance d’un antigène, et en collaboration avec les cellules Th dans le centre germinatif se développent alors en cellules B mémoires ou en cellules plasmatiques. L'activation des cellules B induit l’expression de l’enzyme AID et d'autres composantes du processus de SHM, changeant ainsi l'affinité du BCR et l'isotype (IgM à IgG, IgA ou IgE). D’après [13].
Chapitre I : Développement des lymphocytes B et lymphomagenèse
16 2.1. Organisation des gènes des immunoglobulines et recombinaison V(D)J
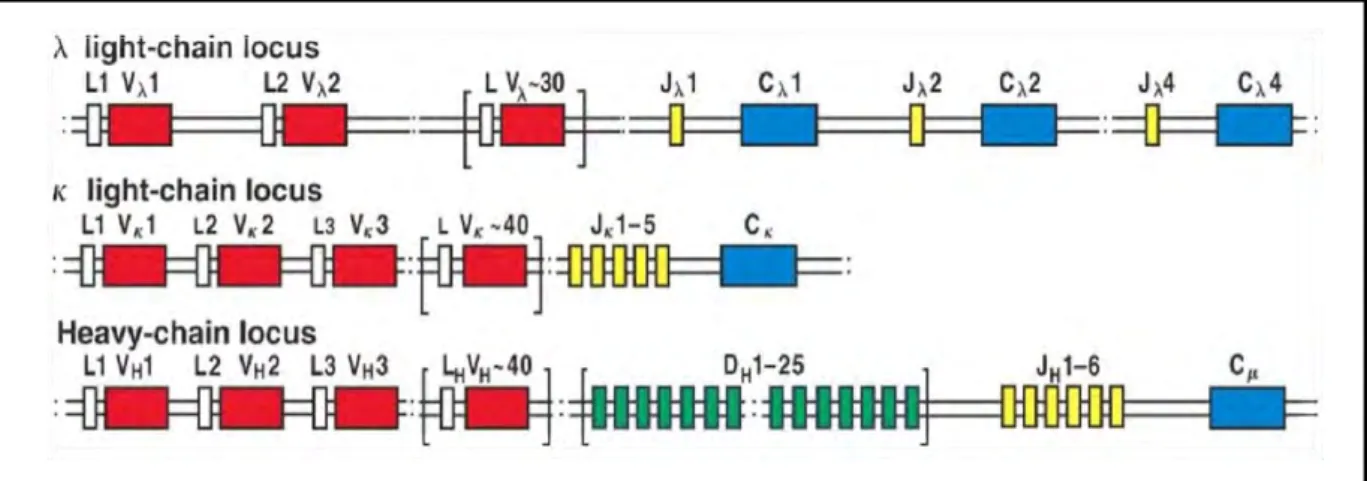
Chez l’homme, les chaines légères et lourdes des immunoglobulines sont codées par des familles multigéniques situées sur des chromosomes différents : le chromosome 14 (14q32) pour le locus de la chaîne lourde H (Heavy), le chromosome 2 (2p12) pour le locus de la chaîne k des chaînes légères L (light) et le chromosome 22 (22q11) pour le locus de la chaîne λ des chaînes légères. Chacune de ces familles multigéniques contient plusieurs séquences codantes, appelées segments géniques, comprenant des copies multiples des segments V, J, D (VDJ pour les chaines lourdes et VJ seulement pour les chaines légères) et la région des gènes constants C séparées par des régions non codantes. Les gènes codant pour les Ig de la chaine L ne possèdent pas de segment D. Au cours du développement des lymphocytes B, ces segments géniques sont réarrangés, et réunis pour former des gènes fonctionnels des Igs (Figure 7).
Figure 7. Organisation germinale des locus des chaines lourdes et légères d’immunoglobulines dans le génome humain. Le locus génétique pour la chaine légère λ
(chromosome 22) comporte environ 30 segments géniques Vλ fonctionnels et quatre paires de
segments Jλ fonctionnels et de gènes Cλ. Le locus κ (chromosome 2) est organisé de la même
façon, avec environ 40 segments géniques Vκ fonctionnels accompagnés par un groupe de cinq segments géniques Jκ et un unique gène Cκ. Le locus de la chaine lourde (chromosome 14) comprend environ 40 segments géniques VH fonctionnels, et un groupe d’environ 25
segments géniques DH situés entre les segments géniques VH et six segments géniques JH. Le
locus de la chaine lourde contient également un groupe de gène CH. Le schéma décrit
Chapitre I : Développement des lymphocytes B et lymphomagenèse
17
La recombinaison V(D) J de gènes des Igs est guidée par des séquences d’ADN non codantes et conservées, adjacentes aux sites de recombinaison appelées RSS, constituées de motifs consensus très conservés comportant un heptamètre, et un nonamère de nucléotides séparés par une séquence espaceur peu conservée de longueur de 12 à 23 pdb. Ces motifs sont présents en 3’ des segments V, en 5’ des régions J et de part et d’autre des segments D [3] (Figure 8).
La combinaison des segments V(D) J qui s’effectue par un clivage de l’ADN au niveau des jonctions des RSS et les séquences codantes, est catalysée par l’enzyme recombinase RAG1 et RAG 2, dans laquelle deux séquences signal RSS et les séquences codantes adjacentes sont amenées à proximité. En effet, Cette coupure de l’ADN double brins produit une boucle d’excision formée par la jonction des séquences RSS qui seront par la suite éliminées. La boucle comprend la séquence d’ADN intermédiaire entre les segments réarrangés. La cassure produit à l’extrémité 3` de l’ADN coupé de chacun des segments un groupement hydroxyle OH entre la fin de la partie codante du segment et l’heptamère de la
Figure 8. Les séquences signal de recombinaison. Deux séquences signal de
recombinaison RSS conservées de l’ADN des chaines légères λ, κ, et lourdes, sont composées d’un heptamère CACAGTG conservé et d’un nonamère ACAAAAACC conservé, séparés par des espaceurs non conservés de 12 ou 23 pdb. Ce motif séquentiel entoure les segments géniques V, D, J des immunoglobulines. D’après [3].
Chapitre I : Développement des lymphocytes B et lymphomagenèse
18
RSS [2]. Ensuite, la recombinase RAG va catalyser une réaction de transestérification: mise en place d’une liaison phosphodiester unissant l’extrémité 3’-OH libre du brin d’ADN des séquences codantes au brin d’ADN opposé formant une structure d’épingle à cheveux aux extrémités codantes des gènes qui réarrangent, et deux extrémités de séquence RSS franches phosphorylées en 5’ [32].
L’étape suivante consiste à former des jonctions des extrémités RSS et des jonctions des extrémités codantes. Cela comprend la voie NHEJ, qui représente la voie ubiquitaire de réparation des cassures double brins de l’ADN. Elle fait intervenir plusieurs facteurs protéiques essentiels, comme Ku70/Ku80 qui se fixe aux extrémités en épingles à cheveux, et recrute la protéine kinase dépendante de l’ADN (DNA-PK). Par la suite le complexe recrute et active le facteur Artémis, qui par son activité endonucléasique ouvre l’épingle à cheveux de l’ADN dans un site aléatoire pour fournir une extrémité libre constituée d’un simple brin d’ADN étendu. Ensuite, la TdT (Terminal désoxynucléotidyl Transférase) rajoute des nucléotides au hasard à l’extrémité des séquences codantes. Finalement, la réparation et la ligation sont assurées par le complexe XRCC4/ADN Ligase IV/XLF, aboutissant à la jonction des séquences codantes et signal [32] (Figure 9).
Chapitre I : Développement des lymphocytes B et lymphomagenèse
19 Figure 9. Mécanisme de recombinaison V(D)J et réparation des cassures double brins de l’ADN. (1) Clivage de l’ADN par RAG 1/2 au niveau des RSS et formation
d’une structure épingle à cheveux aux extrémités codantes, et deux extrémités de séquences franches signal en 5’. (2) Ku70/Ku80 se lie aux extrémités épingles à cheveux. (3) DNA-PKcs facilitent l’ouverture des structures en épingle à cheveux. (3’) XRCC4, Cernunnos et DNA ligase 4 relient les extrémités franches et forment des jonctions signal précises. (4) TdT rajoute des nucléotides au niveau des extrémités codantes, et le complexe XRCC4/ADN Ligase IV/XLF produit des jonctions codantes modifiées. D’après [32].
Chapitre I : Développement des lymphocytes B et lymphomagenèse
20 2.2. Hypermutation somatique
L’hypermutation somatique est un mécanisme de diversification du répertoire des immunoglobulines des lymphocytes B. Elle se développe dans les centres germinatifs des OLS durant la phase d’expansion clonale de cellules B, en introduisant des mutations
ponctuelles dans les régions variables des gènes de la chaine lourde et légère des Igs; ce qui modifie le site de reconnaissance de l’antigène sur le BCR et augmente son affinité. Ce mécanisme se produit à une fréquence de l’ordre de 10-3 par paire de bases et par
génération. Les mutations induites s’installent à environ 150 pb en aval du promoteur des gènes V des Igs, et s'étendent sur une distance de 1 à 2 kb, cela se traduit par la mutation d'un maximum de 20% des nucléotides sur un segment de 1 à 2 kb qui inclut l’exon VDJ [33], avec une diminution de la fréquence des mutations au niveau de l'intron J-C [34] .
L’hypermutation somatique se produit plus fréquemment par mutation de transition que par transversion. Une transition est le remplacement d'une purine par une autre purine ou d'une pyrimidine par une autre pyrimidine. Une transversion est le remplacement d’une base purique par une base pyrimidique ou l’inverse. Toutes les quatre bases peuvent être ciblées pour des mutations. Chez l'homme et la souris, les paires C:G, et A:T sont ciblées approximativement selon la même fréquence [35]. Ces mutations interviennent de façon non aléatoire. De ce fait, il existe des ≪points chauds≫ et des ≪points froids≫ de mutation. La plupart des points chauds mutationnels au niveau des pairs C:G se produisent au sein d'un consensus de WRCY (W = A T, R = A/G, et Y = C/ T) [35]. La majorité de ces motifs sont situés dans les régions hypervariables appelées CDR (Complementary Determining Regions) impliquées dans la liaison à l'antigène et de maturation de l’affinité pour l'antigène [34].
Le mécanisme d’hypermutation somatique est initié par l’enzyme AID, une cytidine-désaminase, qui catalyse la conversion des cytosines (C) en uracile (U) sur un des deux brins de l’ADN, et par conséquent transforme les paires C:G en mésappariement U:G. Suite à la désamination induite par l’AID, le mésappariement U:G sera pris en charge par le système de réparation de mésappariement de l’ADN (Figure 10) [36]:
1) Lors de la réplication de la lésion UG, le résidu uracile U est traité comme un résidu thymine T par les ADN polymérases, ce qui donne lieu à une mutation de transition au niveau des paires CG (C en T et G en A).Cependant, le résidu U peut être reconnu et
Chapitre I : Développement des lymphocytes B et lymphomagenèse
21
excisé par l'uracile-ADN glycosylase (UNG), formant ainsi un site abasique qui sera répliqué. Il en résultera des mutations de transversion au niveau des paires CG (remplacement des paires CG par les paires AT ou, avec GC) et des mutations de transition (remplacement des paires CG par une paire TA). Le site abasique peut être le substrat pour une endonucléase apurinique /apyrimidinique (APE), qui peut cliver l’ADN et permettra la réparation médiée par la voie BER (short-patch Base Excision Repair), qui consiste à remplacer le site excisé par l’ajout de nucléotides par l’intermédiaire de l’ADN‐polymérase error‐prone, ce qui conduit à l’insertion des mutations de transition ou de transversion.
2) Successivement, les lésions U:G peuvent être reconnues par le système de réparation des mésappariements nucléotidiques MMR (Mismatch Repair), qui excise le brin d’ADN contenant l’uracile, et pendant la synthèse d’un nouveau brin d’ADN par l’ADN polymérase error‐prone, que l’insertion des mutations de transition ou de transversion est produite au niveau des bases A:T situées à proximité des base C:G.
Il existe aussi une voie annexe Long-patch BER qui peut être également une source de mutations au niveau des bases A:T. Toutes ces mutations induites dans les régions variables V des Igs permettent de renforcer l’affinité du BCR pour l’antigène.
Chapitre I : Développement des lymphocytes B et lymphomagenèse
22 Figure 10. Mécanisme de la désamination de l'ADN lors de l’hypermutation somatique. La cytidine désaminase (AID) induit la déamination des cytosines (C) en
uracile (U). Le processus de réparation du mésappariement (U) fait intervenir plusieurs voies (réplication infidèle, BER, et MMR), et aboutissant à l’introduction de mutations ponctuelles au niveau des régions variables des Igs. D’après [36].
Chapitre I : Développement des lymphocytes B et lymphomagenèse
23 2.3. Commutation de classe
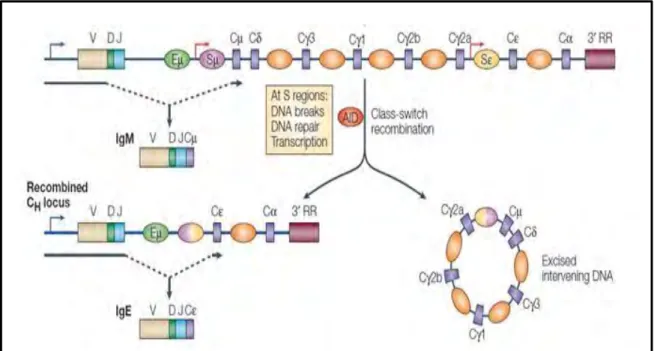
Les immunoglobulines de type IgM produites au cours d'une réponse immunitaire primaire ont presque toujours une faible affinité pour l’antigène, et ne peuvent pas donc accomplir toutes les fonctions effectrices.Aussi, les cellules B doivent produire et sécréter des anticorps d'affinité élevée et de différentes classes pour neutraliser efficacement les agents pathogènes. Suite à une stimulation antigénique, les lymphocytes B entrent en contact avec les lymphocytes Th activés, et sous l’influence des cytokines sécrétées à l’issue du contact intercellulaire par les cellules Th, se mettent à proliférer et se différencier. A ce stade, les gènes de la chaîne lourde d'Ig subissent un mécanisme de remaniement somatique de la partie constante, appelé commutation de classe CSR (Classe Switch Recombination), qui permet aux cellules B à produire des anticorps d’isotypes différents: IgG, IgA ou IgE qui diffèrent par leurs propriétés physico-chimiques, fonctions biologiques, et les propriétés effectrices des Fc des régions constantes, mais gardent la même spécificité antigénique. Ce processus est primordial pour la diversité fonctionnelle des réponses anticorps (immunoglobuline sécrétée).
La partie constante du gène de la chaine lourde d’Ig est divisée en plusieurs segments géniques codant pour les différents isotypes que sont, de 5’ en 3’, Cµ pour l’IgM, Cδ pour l’IgD, Cγ3 pour IgG3, Cγ1 pour IgG1, Cγ2b pour IgG2b, Cγ2a pour IgG2a, Cε pour IgE et Cα pour IgA. La commutation de classe est guidée par des séquences S (switch) qui se trouvent en amont de chaque gène de région constante, à l’exception de Cδ. Les régions S sont constituées de séquences répétées riches en bases G de 10 à 80 pdb et leur taille totale peut varier entre 1kb et 12 kb [37].
Le mécanisme de la commutation de classe implique la recombinaison intrachromosomique qui se traduit par le remplacement de la région constante d’IgH Cµ et Cδ par un autre segment de la région constante située en aval, et l’élimination des autres segments par une boucle d’excision, ce qui conduit à la génération des cassures d’ADN au niveau des séquences S précédant chaque segment de la région constante [38] (Figure 11). Cela est médié par l’enzyme AID qui induit une déamination de C en U, et créant un mésappariement. Ensuite, ce mésappariement sera excisé par la glycosylase UNG de la voie BER, et produisant un site abasique. Alors, intervient l’endonucléase APE qui va cliver l’ADN, et générer des cassures simple brins pour permettre la réparation des sites abasiques. Le mécanisme de réparation de mésappariement prend le relais pour convertir les cassures simple brins en cassures doubles brins, qui implique l’interpellation de la machinerie du
Chapitre I : Développement des lymphocytes B et lymphomagenèse
24
système MMR. Les cassures doubles brins générées seront par la suite réparées par le système NHEJ [39], ce qui aboutit à la ligature des brins d’ADN, et la jonction des séquences S qui précèdent le segment génique de la région constante réarrangée.
Conclusion
Les étapes successives de prolifération et d’expansion clonale de cellules B conduisent à la génération de lymphocytes B matures, exprimant des Igs de surface et sécrétées non autoréactives, possédant de haute affinité avec l’antigène, et ayant subi la recombinaison V(D)J, l’hypermutation somatique, et la commutation de classe. Ces derniers constituent les principaux mécanismes de diversification du répertoire immunitaire, et leurs anomalies
Figure 11. Commutation isotypique de l’IgE. Schéma du locus de la chaine lourde
codant pour une IgM, et initiation de la commutation de classe pour la production d’une IgE. Ceci implique la génération de cassures de l'ADN au niveau des régions switch (S) qui précèdent les gènes de région constante, puis la réparation de l'ADN. Cela conduit au réarrangement du locus CH et la suppression de la séquence
Chapitre I : Développement des lymphocytes B et lymphomagenèse
25
présentent un facteur de risque pour le développement de cellules B altérées favorisant l’évolution de néoplasme; par la genèse des remaniements chromosomiques aberrants comme les translocations chromosomiques qui induisent un développement pathologique de lymphocytes B, et l’émergence de lymphome ou de leucémie.
3. Lymphomagenèse
La différenciation des lymphocytes B normaux est en quelque sorte un désastre imminent car les cellules B mettent l’intégrité de leur génome en danger. Tout d’abord, lors de la formation et la révision de leur récepteur. Un second événement potentiellement dangereux est la réponse à l'antigène, où le mécanisme de recombinaison V(D)J des Igs survient dans la moelle osseuse, et consiste en un processus moléculaire à risque car il implique la génération des cassures double brin de l'ADN qui sont lancées par RAG et réparées par le système NHEJ. Il arrive que ces cassures soient réparées de façon aberrante conduisant à des translocations chromosomiques. Dans le centre germinatif, deux processus moléculaires de réarrangement de l'ADN; l’hypermutation somatique, et la commutation de classe d'immunoglobuline génèrent des cassures de l'ADN, et par conséquent pourraient également prédisposer aux translocations chromosomiques [40].
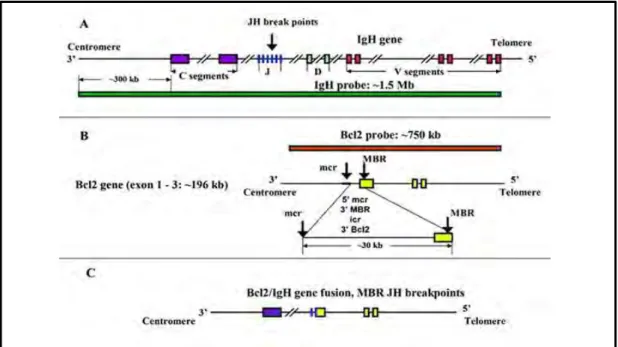
Les translocations chromosomiques réciproques altérant le locus des gènes des Igs et des proto-oncogènes sont l’une des caractéristiques des lymphomes à cellules B matures [41,42], et entraînent habituellement une expression dérégulée du proto-oncogène mis sous le contrôle d’une séquence activatrice (enhancer) des Igs.Trois types de points de cassures d’ADN qui mènent à l’apparition des translocations (Figure 12) [43] peuvent être distingués dans le locus d’Igs :
Des points de cassures qui sont directement adjacents aux segments géniques JH DH
du locus de la chaine lourde (H) et la translocation produite résulte des erreurs de la recombinaison V(D)J au cours du développement des cellules B dans la moelle osseuse [42,44]. Exemple: la translocation Bcl2-IgH, associée au lymphome folliculaire.