INTRODUCTION(2,28,38,114,116)
Helicobacter pylori (H. pylori) est une bactérie spiralée à Gram négatif découverte il y a 20 ans, chef de file du nouveau genre Helicobacter, qui comporte de nombreux micro-organismes infectant le tube digestif de l’homme ou des mammifères.
Helicobacter pylori (H.pylori) est l'agent causal de la gastrite chronique. Cette gastrite peut évoluer vers l'atrophie, la métaplasie, la dysplasie et le cancer.
L'infection à H.pylori, l'une des infections chroniques les plus répandues dans le monde peut donc être associée au cancer de l'estomac, cancer qui vient au second rang mondial et qui tient le premier rang dans les pays en voie de développement. Le but de cette étude est de montrer, après une présentation du germe, la relation entre H.pylori et le cancer gastrique en faisant le point sur les différentes études épidémiologiques réalisées (études écologiques, études cas-témoin, études de cohortes) et en analysant le rôle que peut jouer H.pylori au cours des différentes étapes de l'évolution de la gastrite chronique vers le cancer, puis on abordera les moyens thérapeutiques pour traiter et eradiquer l’helicobacter pylori pour prévenir le cancer gastrique, et on terminera en traitant le coté prophylactique.
HISTORIQUE(12,40,58,82,85,114)
L’historique d’H. Pylori a commencé avant le début de ce siècle, avec l’observation des bactéries spiralées dans l’estomac d’animaux et Krienitz fut le premier à en observer dans l’estomac humain en 1907.
En 1940, Freedberg et Baron(58) retrouvèrent des bactéries spiralées dans 37% des tissus gastriques provenant de résections chez les sujets atteints d’ulcère et de cancer. Longtemps ces observations furent ignorées et les microbiologistes des années 60 et 70 conclurent que les cultures négatives obtenues d’échantillons gastriques signifient que l’estomac était stérile.
De même les travaux de Steer et colin Jones de 1974 sont restés dans l’ombre alors qu’ils ont observé une bactérie associée à une gastrite diffuse chez 80% de sujets ayant subi une résection d’estomac pour ulcère gastrique.
En 1981, en Australie, Barry J Marshall(82) rencontra Robin Warren, anatomopathologiste lors d’un stage en gastro-entérologie. Il travailla sur la bactérie que Warren avait observée dés 1979 après coloration argentique de biopsies gastriques. Ils entreprirent une étude sur des patients pour trouver l’origine de cette bactérie et identifier les syndromes associés.
Entre temps, les bactériologistes ont pu mettre en évidence cette bactérie par coloration de Gram au niveau des muqueuses gastriques, mais n’arrivaient pas encore à la cultiver. C’est en partie par hasard que cette bactérie fut enfin cultivée par Warren et Marshall : toujours sous des conditions d’incubation adéquates, les boites de Pétri sont restées dans l’étuve plus longtemps que d’habitude et, au bout de 5 jours, de nombreuses colonies étaient visibles.
A l’issue de cette étude, les australiens ont montré une corrélation remarquable avec l’anatomopathologie mais beaucoup moins concluante avec les signes cliniques. Warren observa que presque tous les malades infectés par cette bactérie avaient une gastrite alors que ceux qui n’étaient pas infectés avaient une muqueuse normale.
Depuis la première culture en 1982, le nombre de publications a augmenté de façon exponentielle. Après un certain scepticisme de la part des médecins, le rôle pathogène d’H. Pylori dans le développement des maladies gastroduodénales a été reconnu et a conduit à des changements importants dans la prise en charge de ces maladies sur le plan de la santé publique.
I/ Rappel sur Histologie de l’estomac (23,40,46,66,103):
L’estomac est constitué de deux zones, le fundus et l’antre, fondamentalement différentes tant sur le plan morphologique que fonctionnel.
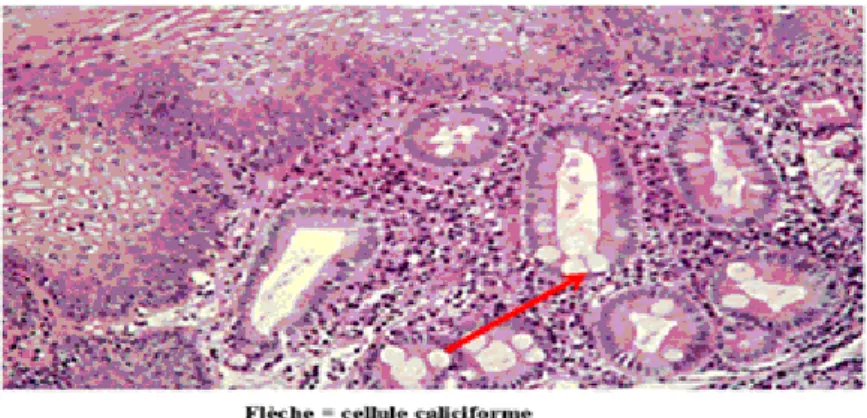
En effet, la muqueuse du fundus est de type glandulaire, elle comporte : (fig.2) (66)
Des cellules à mucus : qui recouvrent tout le tube digestif.
Des cellules principales ou cellules à pepsine : qui occupent la partie profonde des glandes et sécrètent un proferment, le pepsinogène activé en présence d’ion H+
Des cellules pariétales ou bordantes : nombreuses à la partie superficielle des glandes ; celles-ci sécrètent du facteur intrinsèque et surtout de l’HCL qui constitue un maillon indispensable, quoique non exclusif, de l’ulcérogénèse.
Le nombre de cellules pariétales est très important chez l’adulte jeune, environ 109 soit 10% des cellules pariétales fungiques, il diminue ensuite avec l’âge. Ce nombre varie aussi en fonction du sexe : il est plus important chez l’homme que chez la femme et explique dans une certaine mesure, la fréquence de l’ulcère dans le sexe masculin.
La muqueuse de l’antre est également de type glandulaire. Elle se distingue par sa richesse en cellules endocrines parmi lesquelles les plus importantes sont les cellules «G» à gastrine, faisant de cette partie de l’estomac une véritable glande endocrine.
II/ Physiologie de l’estomac (40,103,129)
L’estomac a trois fonctions principales : une fonction motrice, une fonction sécrétoire et une fonction endocrinienne.
La fonction motrice comporte la mise en réserve temporaire des aliments et des liquides, le mélange de substances ingérées avec le suc gastrique et la régulation de la vidange gastrique.
Les principales substances sécrétées dans la lumière de l’estomac sont l’acide chlorhydrique, la pepsine, le mucus, le bicarbonate, le facteur intrinsèque et l’eau.
L’estomac libère deux hormones dans le sang : la gastrine et la somatostatine. Des cellules semblables aux entérochromaffines (ECL entérochromaffine-like) sécrètent la sérotonine et sont aussi présentes dans le fundus et dans l’antre. La gastrine stimule la sécrétion d’acide chlorhydrique et la somatostatine inhibe la libération de gastrine.
Tableau 1 : fonction de l’estomac (103)
Fonctions
Motrice Sécrétoire Endocrinienne
Relâchement de l’estomac brassage et vidange
Acide, pepsine, facteur
intrinsèque, eau, électrolytes.
Gastrine, sérotonine, somatostatine.
1. Motilité gastrique (39,103)
Les fonctions motrices de l’estomac comprennent l’utilisation de l’estomac comme réservoir, le mélange de son contenu, le pétrissage et le brassage des aliments solides et la régulation de l’évacuation de son contenu vers le duodénum. L’estomac sert de réservoir, c’est-à-dire qu’il permet de conserver temporairement les substances ingérées et sécrétées. Au dessus d’un certain seuil, l’estomac est « plein » (que son volume soit grand ou petit ); la pression intragastrique s’accroit très peu, même si d’autre aliments et d’autres liquides viennent s’ajouter, car la paroi de l’estomac se désistent pour mieux les accommoder. L’estomac incorpore aussi les matières solides pour les réduire en particules d’une grosseur inférieure à 1 mm de diamètre. Enfin, il déverse son contenu dans le duodénum, lentement et par petites quantités.
La motilité de l’estomac est sous la dépendance du système nerveux central et ses mécanismes neurohormonaux locaux.
Les facteurs qui influent sur la motilité de l’estomac sont de nature myogène, nerveuse et chimique.
2. Sécrétion gastrique : (16,40,43,66,76,94,103)
Le suc gastrique contient de nombreuse substances, dont les six plus importantes sont l’ion hydrogène, la pepsine, le mucus, le bicarbonate, le facteur intrinsèque et l’eau. L’acide chlorhydrique et l’enzyme pepsine participent à la digestion des protéines. Le mucus lubrifie les matières solides ingérées. Le bicarbonate et le mucus empêchent probablement la muqueuse d’être digérée par l’acide et la pepsine. Le facteur intrinsèque est nécessaire à l’absorption normale de la cobalamine ingéré (vitamine B12).
a. Sécrétion d’acide gastrique :
On considère généralement que l’activation de la sécrétion d’acide se fait par trois voies différentes : la voie nerveuse, la voie hormonale et la voie paracrine (locale). Les principaux médiateurs chimiques sont l’acétylcholine, la gastrine et l’histamine.
Le nerf vague et les branches issues du plexus cœliaque ainsi que les ganglions qui suivent l’artère cœliaque sont les principales voies d’innervation extrinsèque de la portion sécrétoire de l’estomac. Les neurones postganglionnaires des branches du nerf vague qui se terminent dans les glandes fundiques prés des cellules bordantes sont avant tout des neurones cholinergiques. Ils sont rarement en contact avec les cellules bordantes et, par conséquent, l’acétylcholine libérée par ces terminaisons nerveuses doit parcourir une distance relativement longue pour diffuser dans les cellules. La cellule bordante possède deux sites de fixation muscarinique : les récepteurs M1 et les récepteurs M2. La
fixation cholinergique entraîne une sécrétion d’acide liée à la dose, de plus, il peut se trouver des récepteurs muscariniques sur les cellules qui contiennent l’histamine, ce qui se traduit par une stimulation indirecte des cellules paracrines, à cause de la libération d’histamine.
L’histamine exerce une stimulation directe sur les cellules bordantes par l’intermédiaire d’un récepteur H2. Cette stimulation est inhibée de façon
compétitive par un groupe d’analogues de l’histamine (tels que la cimétidine, la ranitidine, la famotidine, la nizatidine) qui agissent de façon particulière H2 pour
La gastrine, l’autre sécrétagogue principal, interagit aussi avec les cellules bordantes par l’intermédiaire d’un récepteur de la gastrine. La faible stimulation que la gastrine exerce sur la production d’acide peut être inhibée de façon compétitive par la proglumide, dérivée de l’acide glutaminique.
La fixation des sécrétagogues aux récepteurs de la cellule bordante est couplée au moins aux deux messagers intracellulaires possibles, l’ion Ca++
et l’adénosine-monophosphate cyclique (AMPc).
b. Sécrétion des pepsinogènes :
Les pepsinogènes sont présentes dans les cellules muqueuses (appelées aussi les cellules à mucus) des glandes du cardia, dans les cellules muqueuses principales, dans les cellules du col des glandes fundiques, dans les cellules muqueuses des glandes duodénales de Brunner. Une fois sécrétées, ces proenzymes sont transformées sous l’action de l’acidité en une forme active. La pepsine peut aussi activer le pepsinogène par autocatalyse.
La muqueuse qui tapisse l’estomac contient quatre groupes distincts de pepsinogènes sur le plan immunologique et dotés du pouvoir de digérer les protéines en présence d’un pH acide. La sécrétion de pepsinogène et d’acide chlorhydrique répond à peu prés aux mêmes stimuli. La stimulation céphalovagale provoque une forte sécrétion de pepsinogène. Les inhibiteurs des récepteurs H2 à histamine diminuent la sécrétion de pepsinogène.
Des taux sérique élevés de pepsinogène du groupe 1 ont été associés avec l’ulcère duodénal et avec les gastrinomes, tandis que des taux faibles ont été associés avec la gastrite atrophique (avec ou sans anémie pernicieuse).
c. Sécrétion du facteur intrinsèque :
Le facteur intrinsèque est une glycoprotéine sécrétée par les cellules fundiques. Il joue un rôle important dans l’absorption de la vitamine B12. Cette
vitamine libérée par des protéines alimentaire par l’acide et la pepsine gastrique, puis elle se fixe sur le facteur intrinsèque et la protéine R sécrétée dans la salive. La vitamine B12 se lie plus fortement à la protéine R en présence d’un pH bas, de
sorte de la plupart du temps elle forme d’abord un complexe avec cette protéine. Dans la partie supérieure de l’intestin grêle, les enzymes pancréatiques scindent les complexes et la vitamine B12 libre se fixe sur le facteur intrinsèque, lequel fini
par se lier à un récepteur idéal spécifique pour être absorbé et transporté vers les tissus par une autre protéine fixatrice de vitamine B12, la transcobalamine II.
Les stimuli de la sécrétion acide agissent aussi sur la sécrétion du facteur intrinsèque. Les protéines qui sécrètent peu d’acide ou qui n’en sécrètent pas sécrètent souvent peu de facteur intrinsèque. La sécrétion continue du facteur intrinsèque est lente mais les quantités peuvent suffire à prévenir une carence en vitamine B12 ainsi qu’une anémie pernicieuse. Il peut arriver, quoique rarement,
qu’il n’y a pas de sécrétion du facteur intrinsèque, même si la sécrétion d’acide est normale. Des anticorps circulants dirigés contre le facteur intrinsèque et contre les cellules fundiques se trouvent chez de nombreux patients souffrant de gastrite atrophique, d’achlorhydrie ou d’hypochlorhydrie et d’anémie pernicieuse.
3. Barrière de la muqueuse gastrique : (41,66,92,103,129)
La muqueuse gastrique saine peut résister à des concentrations intraluminales élevées d’acide chlorhydrique et une forte activité peptique. La base physiologique de cette barrière comporte plusieurs facteurs.
Les jonctions étanches qui unissent les cellules épithéliales de surface bloquent la voie de transport paracellulaire entre les cellules. Le transport peut aussi s’effectuer à travers la membrane de la couche bilipidique formant la surface apicale des cellules épithéliales de la muqueuse. La fluidité de cette membrane est variable et peut influer sur sa perméabilité aux diverses macromolécules. Au moment de transport actif et passif des ions H+, N+, K+, il existe une différence potentielle électrique transmuqueuse. La rupture de la barrière muqueuse entraîne une chute de la différence de potentiel. En présence d’acide dans la lumière, le pH gastro-duodénal s’approche de 2, tandis que l’épithélium immédiatement adjacent peut avoir un pH presque neutre (pH7).
Le mucus renferme à peu prés 95% de glycoprotéines. Il assure la lubrification de particules alimentaires, et sa consistance gélatineuse lui permet de retenir l’eau et le bicarbonate prés de l’épithélium de surface.
Les prostaglandines jouent probablement un rôle important dans la défense de la muqueuse. Ces acides gras oxygénés et saturés sont des dérivés de l’acide chlorhydrique. Ils protégeraient la muqueuse gastrique en y conservant ou en y accroissant l’irrigation sanguine et, par le fait même, en stimulant la production du mucus et de bicarbonate et en augmentant la synthèse des protéines, synthèse nécessaire au maintien et à la régulation des cellules.
Il semble que l’apparition d’une gastrite et d’un ulcère gastrique serait attribuable à des anomalies des mécanismes de défense. Ainsi, la pepsinogène 1, la bile, les sécrétions pancréatiques, une infection à Helicobacter Pylori et des facteurs mécaniques peuvent augmenter la dégradation du mucus.
Des anomalies quantitatives ou qualitatives de la sécrétion du mucus risquent aussi de se produire. Il peut avoir une diminution de la sécrétion de bicarbonates ou une altération de l’irrigation sanguine de la muqueuse ou du métabolisme de la muqueuse, comme cela se produit dans l’ulcère de stress.
4. Sécrétion gastrique endocrine : (51,103)
L’estomac produit des peptides régulateurs comme la gastrine et la somatostatine.
Le film de mucus formé par la polymérisation des glycoprotéines qui le composent entraîne la formation d’une couche d’eau non agitée, permettant de garder emprisonnés les bicarbonates sécrétés par les cellules à mucus, de retarder la pénétration des ion H+ endoluminaux et d’instaurer ainsi, un gradient de pH allant de moins 3 au niveaux de la face luminale de cette couche, à plus de 7 sur la face de la muqueuse.
La gastrine est le peptide le plus important pour la régulation de la sécrétion d’acide gastrique. Dans des conditions physiologiques, elle est libérée continuellement et sa concentration sanguine augmente au moment des repas. La gastrine est une hormone qui accélère la sécrétion des ions H+ dans les cellules bordantes et de pepsinogène dans les cellules principales. Elle accroît la contraction des muscles lisses de l’antre ainsi que le flux sanguin dans la
5. Evaluation de la sécrétion d’acide gastrique : (43,51,66,76,94)
Le débit acide basal (BAO Basal Acide Output) correspond à la quantité d’acide chlorhydrique sécrétée en une heure par l’estomac à jeun, sans excitation mécanique, et il est exprimé en milliéquivalents d’acide chlorhydrique par heure.
Le débit normal se situe entre 1 et 5 mEq d’acide chlorhydrique par heure ; c’est le produit du volume des sucs gastrique (en litres) multiplié par la concentration en ions hydrogène (en milliéquivalents par litre).
Le débit acide maximal (MAO Maximal Acid Output) est le débit acide total sécrété durant l’heure qui suit la stimulation par la pentagastrine (6µg/Kg IM ou SC) ou par l’histamine (40µg/Kg SC). On détermine cette valeur en additionnant les résultats soit de quatre échantillons prélevés à 15 minutes d’intervalle ou de six échantillons prélevés à 10 minutes d’intervalle après la stimulation. Les limites de la normale sont entre 25 et 55 mEq d’acide chlorhydrique par heure.
Le pic d’acide horaire (PAO Peak Acid Output) représente le débit des deux périodes consécutives de 15 minutes où le débit est le plus élevé après la stimulation, multiplié par 2 pour obtenir la valeur du débit en une heure.
La détermination de la sécrétion gastrique peut s’avérer utile si l’on suspecte une hypersécrétion gastrique et si l’on désire évaluer l’efficacité du traitement médical et chirurgical destiné à diminuer le débit d’acide gastrique. Si l’on soupçonne le syndrome de Zollinger-Ellison, une hypersécrétion basale élevée peut orienter le diagnostic. La détermination de la sécrétion d’acide gastrique est habituellement plus utile pour évaluer la réponse thérapeutique à une pharmacothérapie de freinage de la sécrétion d’acide.
I. Caractères bactériologiques d’Helicobacter Pylori:
Helicobacter Pylori fait partie des bactéries adaptées au mucus digestif.
Ce groupe réunit les genres : Campylobacter, Helicobacter, Arcobacter et Wollinella.
Le genre Helicobacter comprend 9 espèces isolées chez l’homme et chez l’animal.
1. Structure chimique : (38,48,67,82,131)
a. Profil protéique d’Helicobacter Pylori :
La structure protéique de la cellule entière, de la membrane externe, de l’extrait acide de la surface protéique, et du lysat cellulaire, a été étudiée par électrophorèse sur gel de polyacrylamide en présence de dodecyl sulfate de sodium. Ainsi du point de vue protéique, l’espèce Helicobacter Pylori apparait comme bien homogène.
b. Composition en acide gras de la paroi cellulaire :
La richesse en acide gras et le profil protéique étudié en électrophorèse permettent de penser que les souches d’Helicobacter Pylori constituent un groupe homogène bien distinct des Campylobacter connus.
c. Le génome :
Toutes les souches étudiées contiennent des plasmides. La plupart des souches portent de 1 à 3 plasmides, chez certaines, jusqu’à 6 plasmides ont été retrouvés.
Il semble qu’un profil type plasmide d’Helicobacter Pylori ne peut être établi.
A part quelques fragments similaires, il existe de grandes variations génomiques d’une souche à l’autre.
2. Morphologie et mobilité (9,23,58,75,98) :
Helicobacter Pylori est une bactérie à Gram négatif spiralée, incurvée ou en forme de ‘’U’’ ou ‘’O’’, de 3 à 5 µm de long et 1 µm de diamètre.
La région terminale de la bactérie est arrondie, contrairement aux autres Campylobacter, elle n’est pas pointue, et ne présente pas une dépression à l’endroit du flagelle.
La bactérie est mobile par 4 à 6 flagelles polaires et engainés, le système flagellaire est bien adapté à son environnement particulier : il semble qu’il y ait un changement dans la conformation du flagelle qui joue sur la l’impulsion produite, et le germe bouge encore quand la viscosité atteint 200 centipoises, de même les gaines mettent à l’abri la structure flagellaire contre l’acidité gastrique.
Helicobacter Pylori perd sa morphologie habituelle quand les conditions du milieu sont défavorables, et se présente sous forme coccoïde.
3. Caractères culturaux et biochimiques : (23,67,75,98,131)
Caractères culturaux :
a. Conditions respiratoires : Microaérophilie
Les bactéries colonisant le mucus ont presque toutes la propriété de Pousser à des tensions faibles en oxygène. Helicobacter Pylori est une bactérie microaérophile pour laquelle l’oxygène est à la fois nécessaire et délétère : elle l’utilise pour tirer son énergie respiratoire, et est tuée par les dérivés de l’oxygène ou l’oxygène lui-même.
Helicobacter Pylori ne peut être cultivé sur des milieux exposés à l’aire, c’est-à-dire sous pression partielle d’oxygène de 21% ; les concentrations optimales sont : 3 à 5% d’oxygène ; 10% de gaz carbonique ; 85% d’azote.
La cause de cette microaérophilie pourrait être due à une insuffisance de production ou d’activité de catalase ou de superoxyde dismutase.
b. Condition de température :
La température idéale de croissance est de 35°C à 37°C ; à 30°C comme à 42°C, les cultures sont pauvres.
c. Le pH :
Le pH optimal se situe entre 6,9 et 8. Bien qu’il s’agisse d’une bactérie de l’estomac, l’acidité gastrique empêche tout développement d’Helicobacter Pylori, mais grâce à son activité uréasique très importante, elle entraine une libération d’ammoniac à partir de l’urée, ceci lui permet d’augmenter le pH à son contact, ce expliquerait qu’il supporte l’acidité de l’estomac.
d. Caractères nutritifs :
Helicobacter Pylori tire son énergie de certains acides aminés ou certains intermédiaires du cycle des acides tricarboxyliques : glutamate, asparatate, serine, cette énergie n’est jamais fournie par les hydrates de carbone. Toutefois des travaux ont montré qu’Helicobacter Pylori serait capable d’utiliser le glucose par la voie des pentoses.
Certains facteurs de croissance interviennent pour contrebalancer la toxicité des tensions très élevés en O2, le CO2 est indispensable pour la croissance, même
à fiable concentration, des agents soufrés réducteurs jouent un rôle nettement faible.
Le sang ou l’hématine permet la synthèse d’enzymes héminiques qui pourraient intervenir dans la destruction des peroxydes.
Buck et Coll démontrent la nécessité d’adjuvants de croissance comme l’amidon, le charbon actif qui peuvent absorber ou inhiber les facteurs toxiques.
Helicobacter Pylori pousse en 5 à 7 jours en milieu gélosé additionné de sang, de sérum ou d’amidon, et sous atmosphère microaérophile, il s’agit des milieux non sélectifs classiques.
Le milieu de Skirow a été le premier milieu sélectif utilisé contenant de la vancomycine, la polymyxine B, du triméthorphane et du kétoconazole.
Caractères biochimiques :
Helicobacter Pylori possède des enzymes qui lui permettent de coloniser la muqueuse gastrique, d’assurer l’équilibre du métabolisme bactérien et d’exercer son pouvoir pathogène, il s’agit de :
a. Uréase :
Cette enzyme extracellulaire et en quantité extrêmement importante, permet d’hydrolyser l’urée normalement présente dans l’estomac en ammoniac qui tamponne le microenvironnement de la cellule bactérienne la protégeant de l’acidité gastrique et lui permettent alors de coloniser l’estomac.
L’uréase aurait une action pro-inflammatoire, et pourrait ainsi jouer également un rôle dans l’altération de la muqueuse gastrique.
b. Catalase :
Cette enzyme hydrolyse l’eau oxygénée produite par les polynucléaires en eau et en oxygène, et contribue à la protection d’Helicobacter Pylori vis-à-vis des défenses de l’hôte.
c. Autre enzymes : amidases, peptidase, phosphatases, phospholipases : Ces enzymes ont également été mises en évidence chez l’Helicobacter Pylori, mais elles ne semblent pas jouer un rôle important dans la pathogénie de ce germe.
TABLEAU N°2
Caractères biochimiques de H.pylori(75)
BIOCHIMIQUES HELICOBACTER PYLORI
Oxydase + Catalase + Urease + y glutamyltransferase + phosphatase alcaline + Nitrate réductase - Production d'H2S - Dnase + leucine aminopeptidase +
4. Diversité des souches pathogènes (25,106,129) :
La variabilité de l’expression du pouvoir pathogène au sein d’une espèce implique l’existence d’une diversité au sein des souches de la même espèce.
Les études menées sur la caractéristique des souches isolées en clinique en relation avec l’une ou l’autre des pathologies des maladies inflammatoires gastro-duodénales permettent de reconnaître l’existence d’une multitude de souches pathogènes d’Helicobacter Pylori. Cette affirmation est en contradiction avec l’extrême conservation des caractères qui servent à l’identification morphologique, bactériologique et biochimique de l’espèce Helicobacter Pylori.
Une des particularités de cette bactérie par rapport à d’autres espèces bactériennes est le contraste entre son homogénéité phénotypique et son extrême diversité génomique qui fait que chaque souche isolée d’un sujet est virtuellement différente de toutes les autres.
5. Taxonomie (11,104,129,131) :
Au moment de sa découverte, en 1982, Helicobacter Pylori a été classé dans le genre Campylobacter sur la base de ses caractéristiques morphologiques, physiologiques et étiologiques.
Des études plus poussées ont cependant montré que certains de ses particularités ne correspondent pas exactement au genre Campylobacter.il s’agit essentiellement de la structure de son acide ribonucléique ribosomal, du flagelle qui n’est pas unique et est gainé et de la possession d’acides gras et de ménaquinones particulières qui ont une valeur taxonomique précieuse.
Le genre Helicobacter a été crée et ainsi Campylobacter Pylori devient Helicobacter Pylori en 1989. Ce genre (Helicobacter) est considéré comme le chef de file d’un nouveau groupe de bactéries, appelées superfamille VI des bacilles Gram négatif. Ce groupe comprend quatre genres : Helicobacter, Campylobacter, Arcobacter et Wollinella.
Le genre Helicobacter comprend 9 espèces différentes, mais Helicobacter Pylori est l’espèce type la plus importante en médecine (voir Tableau 3).
Tableau 3 : espèces du genre Helicobacter (131).
Espèce Niche écologique Site Homologie génétique avec Helicobacter Pylori (%) Références H. Pylori H. cinaedi H. fennelliae H. mustelea H. felis H. muridarum H. nemestrinae H. acinonyx H. heilimaniib Homme Hamster, home Homme Furet Chien, chat Souris Singe macaque Leopard Chien, chat, homme Estomac Intestin Intestin Estomac Estomac Intestine Estomac Estomac Estomac NF NF 93,7 94,7 94 NF 97,5 96 Goodwin 1989 Fennell 1984 Fennell 1984 Fox 1986 Paster 1991 Lee 1992 Bronsdon 1991 Eaton 1993 O’Rourke 1992
Basée sur le séquençage de l’ARN ribosomal 16S. Ex : Gastrospirillum hominis, avec H. felis. NF : non fait.
II. Réservoir et mode de transmission d’Helicobacter pylori
1. Réservoir bactérien (11,40,104) :
Toutes les données actuelles convergent vers le fait que l’homme est le réservoir exclusif de l’ Helicobacter Pylori.
Helicobacter Pylori constituerait ainsi l’espèce d’Helicobacter inféodée à l’homme. Toutefois, à la différence de la plupart des autres Helicobacter gastriques, cette bactérie ne peut être considérée comme un commensal, car sa présence s’accompagne toujours d’une inflammation et elle peut évoluer vers des maladies graves.
L’estomac humain, réservoir naturel dans lequel Helicobacter Pylori survit, persiste et se multiplie de façon extracellulaire, est le siège d’une réponse inflammatoire plus au moins exacerbée à l’origine des lésions de la muqueuse et des dommages génotoxiques infligés aux cellules épithéliales gastriques. Il est aussi le site d’où émergent l’extraordinaire macro et micro-diversité génétique qui caractérisent l’espèce Helicobacter Pylori.
La cavité buccale et notamment la plaque dentaire a été considérée comme un réservoir bactérien. Toutefois, les types de souches d’Helicobacter Pylori dans la salive et la plaque dentaire ne correspondent pas à ceux de l’estomac.
2. Transmission :(9,40,66,104)
A partir de l’estomac, Helicobacter Pylori peut être éliminé par vomissement, se retrouver dans la bouche par régurgitation, et être éliminé dans les selles.
a. Source de contamination :
La transmission interhumaine se fait par l’intermédiaire du liquide gastrique, de la salive et peut-être des selles.
Vomissures :
Différentes études ont monté la présence d’Helicobacter Pylori dans les vomissures.
Les vomissures contiennent du liquide gastrique où Helicobacter Pylori peut être présent du fait du ‘’turn-over’’ de la muqueuse gastrique.
Salive :
La salive est une autre source potentielle de transmission d’Helicobacter Pylori du fait qu’à l’occasion de vomissements ou de régurgitations, le liquide gastrique peut atteindre la bouche.
Selle:
Tout ce qui se trouve dans l’estomac se retrouve un jour dans les selles, et il est donc logique de penser que c’est le cas d’Helicobacter Pylori.
Les selles de sujets infectés sont donc une source potentielle de contamination par Helicobacter Pylori. La survie dans l’environnement est toutefois difficile à imaginer compte tenu de l’adaptation de la bactérie à sa niche écologique.
b. Modalité de transmission :(40,66)
L’estomac humain étant le seul réservoir de la bactérie, la transmission est interhumaine.
L’infection s’acquiert dans la jeune enfance par transmission intrafamiliale et perdue de façon chronique durant toute la vue de l’individu ;
En dehors de la famille, la fréquentation d’une crèche serait un facteur de risque de l’infection. La vie en institution s’accompagne également d’un risque élevé de transmission.
Transmission féco-orale :
Du fait de renouvellement de la muqueuse gastrique, Helicobacter Pylori est trouvé dans le liquide gastrique et éliminé dans les selles.
Dans le cas d’une stase intestinale normale, il semble que la bactérie soit détruite. Sa survie est sans doute possible en cas de transit accéléré.
La transmission à un autre hôte à partir des selles pourrait se faire directement, en cas d’hygiène déficiente notamment, par les mains, comme cela a été montré chez des nourrissons atteints de diarrhée en Afrique, et aux Etats-Unis chez des adultes chez qui la diarrhée avait été induite. Une transmission féco-orale est donc possible mais sans doute rare, tout au moins dans les pays développés car la fréquence des diarrhées est basse, l’hygiène fécal appropriée et les eaux de boissons traitées, par contre, il est probable que ce mode de transmission puisse exister dans les pays en développement où les diarrhées sont fréquentes, l’hygiène fécale souvent mauvaise et l’eau d’adduction insuffisamment traitée.
Transmission oro-orale :
Présent dans le liquide gastrique, Helicobacter Pylori peut en cas de régurgitation venir coloniser la cavité buccale.
A ce jour, le plus plausible est que la cavité buccale ne soit qu’un réservoir transitoire.
Transmission gastro-orale :
Une autre hypothèse est la transmission lors des vomissements. Quand ceux-ci proviennent de sujets infectés, Helicobacter Pylori peut rester variable durant plusieurs heures, ce qui en fait une source possible d’infection. L’hypothèse a été récemment renforcée en induisant des vomissements chez des volontaires adultes. Elle est compatible avec une transmission dans l’enfance.
L’acquisition de l’infection par les endoscopies entre dans ce même cadre.
III. Physiopathologie de l’infection à Hélicobacter pylori :
Helicobacter Pylori très adapté à une niche écologique unique : l’estomac humain. Des facteurs de colonisation sont en partie les responsables de cette adaptation.
1. Défense naturelle (25,41,129) :
La première barrière rencontrée par une bactérie lors de son implantation au niveau digestif, est la couche du mucus. Les mucines sulfatées du mucus sont susceptibles d’inhiber le processus d’attachement d’Helicobacter Pylori sur ces récepteurs. En plus le mucus possède un pouvoir anti-infectieux.
La deuxième ligne de défense comprend le surfactant, le glycocalyx, les cellules épithéliales et les prostaglandines.
2. Facteurs bactériens de virulence (6,11,76,97,114) :
Helicobacter Pylori se fixe sélectivement sur un site spécifique du mucus et un site glycerolipidique membranaire. Une fois établie sur la muqueuse il persiste en dépit d’une réponse immunitaire locale et générale intense, la grande mobilité et la morphologie spiralée de ce genre lui permettent de traverser le mucus beaucoup mieux que d’autres germes, alors que sa puissante uréase tamponne l’acidité du milieu suffisamment longtemps pour permettre à la bactérie de gagner les cellules muqueuse gastriques, là où le pH est voisin de la neutralité.
Helicobacter Pylori possède la particularité d’exprimer des adhesines capables de reconnaitre des récepteurs spécifiques de nature glycolipidique, de cellules à mucus gastrique.
En raison du pH physiologique très acide, il n’y a pas de flore gastrique non pathogène. Ce fait peut être l’un des facteurs favorisant la persistance de l’infection à Helicobacter Pylori en dépit de la réaction de l’hôte. La résistance à la phagocytose et/ou à la bactéricidie a été démontrée et met en œuvre la saturation des anticorps par des antigènes relargués par la bactérie ou la destruction par des protéases bactériennes ou gastriques, d’autre enzymes comme la catalase et les superoxydes dismutases détruisent les substances bactéricides.
3. Influence d’Helicobacter Pylori sur la physiologie gastrique (23,76,106,115,129) :
Helicobacter Pylori induit la dégradation des mucines solubles ce qui favorise le développement de gastrite et d’ulcères gastro-duodénaux.
Le rôle d’Helicobacter Pylori dans la régulation de la sécrétion acide très complexe et entraîne des conséquences différentes selon la topographie de l’infection.
Dans l’ulcère duodénal, la colonisation et l’inflammation qui en résulte prédominent au niveau de l’antre gastrique. La conséquence d’une antrite causée par Helicobacter Pylori est une augmentation de la gastrinémie et une activation excessive des cellules pariétales. Cette activation est indirecte car il s’agit en fait d’une diminution de l’activité frénatrice de la somatostatine sur les cellules G (à gastrine). Cette hypergastrinémie induit une hyperchlorhydrie gastrique, malgré l’inhibition acide due à la capacité uréasique d’Helicobacter Pylori.
Au contraire, dans l’ulcère gastrique, l’inflammation intéresse tout le corps de l’estomac. La fonction des cellules pariétales à gastrine est alors inhibée, engendrant une tendance à l’hypochlorhydrie gastrique.
4. Helicobacter Pylori et inflammation (47,76,129) :
Helicobacter Pylori ne possède ni propriété de pénétration intracellulaire ni capacité de diffusion systémique, il induit une réaction inflammatoire aigue résultant de l’afflux de nombreux polynucléaires (à côté des lymphocytes et des plasmocytes), qui migrent à la surface de la muqueuse et viennent phagocyter les bactéries. Ce faisant, ils libèrent des substances toxiques contribuant à l’entretien des lésions de la muqueuse, et en l’absence d’élimination de l’infection survient la deuxième phase caractérisée par une inflammation chronique active.
5. Effet cytotoxique d’ Helicobacter Pylori(3,25,47,75,76129)
Ces dernières années, de nombreux travaux se sont intéressés à la caractérisation des facteurs de virulence de H. pylori et à leurs implications pathogéniques. Trois protéines, CagA, vacA et HP-MP1 ont ainsi été caractérisées.
La protéine CagA (cytotoxin-associated genes A), est exprimée dans 60 % à 70 % des souches de H. pylori, avec des variations selon les zones géographiques. Cette protéine est codée par un gène appartenant à l’îlot de pathogénicité Cag. Lorsqu’il est fonctionnel, l’appareil de sécrétion permet l’induction de la synthèse d’IL-8 (interleukine-8) à partir des cellules épithéliales. Des études cliniques révèlent que la présence de la protéine CagA est corrélée à l’évolutivité de la gastrite, à l’atrophie gastrique et au cancer.
Bien que le gène vacA soit présent dans tous les isolats cliniques, la protéine VacA, une cytotoxine vacuolisante active, est produite dans 50 % à 65 % des souches de H. pylori.
Elle induit la vacuolisation des cellules épithéliales in vitro et in vivo chez l’homme. La forme allélique vacA-s1 semble associée à un risque accru d’ulcère et de cancer gastrique .La toxine VacA induit la formation de pores dans la membrane cellulaire. Ces pores possèdent une sélectivité pour les anions et seraient responsables de la constitution de larges vacuoles via l’augmentation de l’activité de la V-ATPase, une pompe à protons électrogéniques. Le rôle précis de cette protéine dans la carcinogenèse est encore mal connu.
Une protéine membranaire de H. pylori, appelée HP-MP1, est pro-inflammatoire et stimule en particulier la production de TNFα (tumor necrosis factor α), IL-1, IL-8 et MIP1α (mitogen inhibitor peptide α). Son potentiel carcinogène a récemment été suggéré in vitro et in vivo chez la souris.
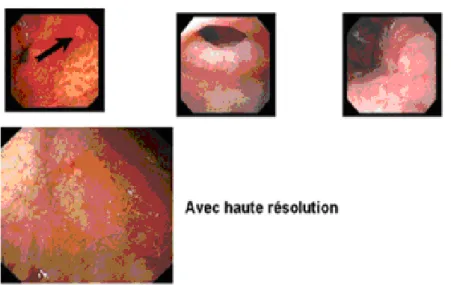
IV. Diagnostic de l’infection à Helicobacter Pylori (4,23,100) :
Actuellement, la recherche d’Helicobacter Pylori repose sur des tests invasifs (directs) c’est-à-dire nécessitant une endoscopie avec biopsie : test rapide à l’uréase, anatomopathologie, culture, amplification génique et des tests non invasifs (indirects) : sérologie, test respiratoire au carbone 13.
En principe, il ne faut rechercher Helicobacter Pylori que lorsque l’on a l’intention de l’éradiquer. Helicobacter Pylori ne doit pas être recherché que face à un ulcère gastrique, un ulcère duodénal voire un lymphome. Dans d’autres cas (comme les dyspepsies notamment), il n’est pas encore prouvé que la disparition du germe améliore la symptomatologie. Il est donc important de mesurer bénéfices et inconvénients de l’éradication.
1. Choix des méthodes (4,45) :
Le diagnostic de l’infection à Helicobacter Pylori fait appel à de nombreuses méthodes, tout assorties d’excellentes performances. Le choix d’une méthode est affaire de contexte. En matière de recherche épidémiologique, seules les méthodes non invasives ont leur place. En revanche, en présence d’un malade ulcéreux donné, l’endoscopie diagnostic initial demeure impérative et les prélèvements directs de fragments de muqueuse gastrique, portant à la fois sur la muqueuse antrale et la muqueuse corporéale, apporteront la preuve de l’infection.
La sérologie peut éventuellement être utilisée pour l’évaluation de l’efficacité du traitement ainsi que pour la surveillance au long cours. En revanche, les tests respiratoires à l’urée grâce à leur haut niveau de sensibilité autorisent une surveillance précoce fiable du statut de l’infection après traitement antibiotique.
2. Conditions d’analyses (48,99) :
a. Prélèvement :
Pour les biopsies gastriques, le prélèvement doit être effectué à distance (2 semaines) d’un traitement par des antibiotiques, du bismuth ou des inhibiteurs de la pompe à protons. Les règles de désinfections doivent être scrupuleusement suivies.
Les tests respiratoires se font après consommation d’un repas d’épreuve puis un rinçage de la bouche.
Quant-à la sérologie, ce sont les immunoglobulines G qui sont recherchés. Les tests utilisent une relation ELISA (méthode immuno-enzymatique) sur un échantillon de quelques microlitres.
b. Transport :
Les conditions de transport de la biopsie sont extrêmement importantes à respecter : le délai de transport ne doit pas dépasser 4 heures jusqu’à l’ensemencement sur milieu spécifique.
c. Conservation :
Pour les biopsies, la durée de viabilité est d’une semaine environ à 4°C. Elle est plus longue à –20°C (environ 4 semaines).
Le sérum physiologique peut être gardé pour un délai de 4 heures à 4°C.
3. Méthodes diagnostiques directes :
Les tests invasifs sont toujours réalisés à partir de biopsies prélevées lors d’une endoscopie. On connaît 4 types de tests invasifs :
Les tests rapides à l’uréase ;
L’examen anatomopathologique ;
La culture ;
Les techniques d’amplification génique.
a. Test rapides à l’uréase (4,15,27,42,61,99,104) :
Ils sont basés sur la détection de l’activité-uréase positive de Helicobacter Pylori ; la biopsie est écrasée dans un milieu dosé à 2% d’urée. L’uréase secrétée hydrolyse l’urée en gaz carbonique et ammoniac, ce dernier entraîne une augmentation du pH qui va provoquer le changement de couleur d’un indicateur coloré.
Leur sensibilité est évaluée à 80-85% et peut être améliorée en mettant deux biopsies dans un même test. Leur spécificité est bonne (supérieur à 95%).
b. Cytologie et culture (15,23,100,104,124) :
Examen de référence, il permet en outre l’étude de la sensibilité aux antibiotiques et d’appliquer toutes les méthodes de typage moléculaire.
Examen après coloration de Gram :
Il consiste en la mise en évidence de bactéries par une coloration de Gram de l’empreinte de biopsie antrale.
Cette technique est simple, reproductible, relativement sensible, mais non spécifique.
Culture :
La culture à partir des biopsies est réalisée sur un milieu solide gélosé au chocolat sous atmosphère microaérobie et doit durer plus de deux jours. L’identification se fera par les caractères morphologiques et enzymatiques. La spécificité est de 100% et la sensibilité est presque de 100% si les conditions de prélèvement et de transport ont été respectées.
c. Examen anatomo-pathologique (61,104) :
Il permet d’abord d’apprécier l’état de la muqueuse gastrique et de juger de l’état de la gastrite associé à Helicobacter Pylori. Sa faisabilité dépend du nombre des biopsies gastriques pratiquées et de l’expérience de l’anatomopathologiste.
d. Les techniques d’amplification génique (4,23,61,66,100):
L’amplification génique avec l’utilisation des amorces issues du gène de l’uréase ou d’un autre gène spécifique d’Helicobacter Pylori peut être utilisée sur du matériel biopsique ou échantillon de selles. La polymerase chain reaction (PCR) est par définition spécifique et d’une extrême sensibilité.
C’est un essai rapide qui permet la détection de toutes les formes, y compris les formes non cultivables coccoïdes, il ne requiert pas la viabilité des bactéries. L’intérêt est surtout notable pour les contrôles d’éradication quand peu de bactéries sont présentes.
4. Méthodes diagnostiques indirectes :
a. La sérologie (15,23,40,81,104,131) :
La sérologie est le test non invasif le plus simple et le plus disponible. Elle est facilement applicable chez l’enfant, d’où le grand intérêt des pédiatres.
Le principe est fondé sur la mise en évidence des anticorps immunoglobulines G anti-Helicobacter Pylori. C’est un examen sensible (85-95%) et spécifique (85-95%) par le test ELISA standards.
La diminution significative du taux d’anticorps n’est observée que 6 à 8 mois après éradication de la bactérie, ce qui limite son utilisation pour le contrôle précoce de l’éradication. Elle a surtout une place dans les études épidémiologiques.
D’autres techniques que l’ELISA sont utilisées tels que la technique d’immuno-blot, l’agglutination par test au latex et la réaction de dot-blot sur papier filtre.
b. Test respiratoire à l’urée marquée (15,27,98,99,100,131) : Il est fondé sur le dosage dans l’air expiré du C13
du gaz carbonique produit par l’uréase d’ Helicobacter Pylori à partir d’un échantillon d’urée marquée au C13 ingérée par le patient. Ce test a une bonne sensibilité, supérieure à 90% et une spécificité de l’ordre de 95%. Il est considéré comme le test idéal
pour le contrôle de l’éradication d’ Helicobacter Pylori après traitement. Il a l’avantage d’être non invasif mais l’appareillage est coûteux, le test au C14
ne nécessite pas d’équipement lourd, mais présente l’inconvénient d’émettre la radioactivité.
5. Intérêt et comparaison des différents tests (42,45,124,131) :
S’il existe de nombreuses méthodes disponibles, c’est qu’aucune n’est parfaite. Actuellement, la recherche du germe repose en routine sur le test rapide à l’uréase et l’examen anatomopathologique de biopsies antrales et fundiques. La combinaison de ces deux tests améliore la sensibilité et la spécificité. La culture ne s’impose pas de première intension. Elle devient utile en cas de résistance à un premier traitement d’éradication. L’avenir devrait voir se développer l’amplification génique et le test respiratoire.
En revanche, en présence d’un malade ulcéreux donné, l’endoscopie diagnostic initial demeure impérative.
Pour le contrôle de l’éradication, le test respiratoire pourrait être de référence, programmé un mois après la fin du traitement. Pour les études épidémiologiques, la sérologie est l’outil idéal, maintenant que l’on dispose de kits utilisant les antigènes purifiés. Le tableau 4 résume la performance des différents tests.
Tableau 4 : comparaison des différentes méthodes diagnostiques (45)
Méthode Prélèvement Sensibilité Spécificité
Sérologie rapide Sérologie ELISA Test respiratoire Test à l’uréase Histologie Culture PCR Sérum Sérum Air expiré Biopsie gastrique Biopsie gastrique Biopsie gastrique Biopsie/selles 95% 95% 95-98% 90-95% 98% 90-95% 95% 85% 95% 95-98% 98% 98% 100% 95%
6. Détection des antigènes de H. pylori dans les selles (8,61,104)
Bien que la présence de H. pylori viable dans les selles soit rarement vérifiée, il est en revanche habituel d’y rencontrer des antigènes de cette bactérie. Un test appelé Premier Platinum HpSA a été développé .Il consiste en un test Elisa permettant la détection des antigènes de H. pylori dans les selles. Ce test utilise des anticorps polyclonaux anti-H. pylori adsorbés sur les cupules d’une microplaque afin de capturer les antigènes de H. pylori présents dans un échantillon de selles diluées.
Ce test à de bonnes performances diagnostiques, est non invasif, et peut être facilement réalisé dans un laboratoire de routine.
Ce test a en fait été peu utilisé chez la personne âgée à ce jour. La constipation plus fréquente chez la personne âgée peut en altérer la sensibilité. En effet, le temps de passage de la bactérie dans le côlon risque d’être prolongé conduisant à la dégradation des antigènes de H. pylori et diminuant leur
chance de détection. Le test HpSA présente aussi l’inconvénient d’être de réalisation difficile chez la personne âgée pour des raisons pratiques de difficultés de recueil des selles, notamment dans les cas de constipation terminale, de troubles cognitifs, et de perte d’autonomie.
Par ailleurs, comme pour les autres tests (sauf la sérologie), la prise d’inhibiteurs de la pompe à protons diminue les performances de ce test en raison de l’augmentation du pH gastrique.
I. Les études épidémiologiques (29,35,68,77)
Les données épidémiologiques associant l'infection à Helicobacter pylori et un risque accru de cancer de l'estomac doivent être passées en revue.
Trois sortes d'études épidémiologiques ont été faites, par ordre croissant de puissance épidémiologique:
des études écologiques
des études cas témoins
des études de cohortes
Ces études épidémiologiques sont basées sur le dosage des immunoglobulines (IgG anti H.pylori) par une technique radio immunologique, à partir de sérum de patients.
La sensibilité ainsi que la spécificité des tests sérologiques est élevée mais ne permet pas de préjuger de la persistance de H.pylori lors du dosage.
A l'inverse, le grand avantage de ce test est de pouvoir fournir, plusieurs années avant la découverte du cancer, l'information sur le statut immunologique de l'individu vis à vis de H.pylori grâce à la seule analyse sérologique.
Après l'infection, les IgG sériques sont détectables en 10 à 20 jours selon les sujets. Ils atteignent rapidement un maximum et restent stables tant que l'infection persiste. Après l'éradication de l'infection par un traitement antibiotique les taux d'IgG diminuent pour revenir, en 6 mois, comparables à ceux des sujets non infectés.
1. Les études écologiques (24,35,54,64,70,71,73,77,91,122,126,127)
Les études écologiques sont des études de corrélation géographique ; elles ont montré des résultats contradictoires lorsque le taux d'incidence ou le taux de mortalité du cancer gastrique a été corrélé avec les taux de prévalence de l'infection à H.pylort L'une des plus grandes études de ce type a été réalisée en CHINE rurale. Pour examiner l'association géographique entre l'infection à H.pylori et le cancer gastrique, la prévalence des anticorps anti H.pylori a été évaluée dans des échantillons de plasma pris en 1983 de 1882 hommes âgés de 35 à 64 ans dans 46 cantons de la CHINE rurale.
Le taux de mortalité par cancer gastrique dans ces régions en 1973-1975 variait de 3‰ (taux cumulé 0 à 64 ans) à 69‰ quand la proportion de population ayant des anticorps anti H.pylori variait de 28% à 96%. Après correction à cause du nombre limité d'échantillons de sang par région, l'estimation de la corrélation entre la prévalence des anticorps anti H.pylori et la mortalité par cancer gastrique était de 40%.
Aucun autre type de cancer n'a montré une association significative avec H.pylori
Dans une autre étude sur la CHINE(73), pour connaître les raisons de la variation géographique du taux de mortalité par cancer gastrique, les données sur la mortalité par cancer gastrique ont été comparées avec des données diététiques et biochimiques de 65 cantons chinois.
Cette corrélation positive était maintenue après ajustement pour les facteurs diététiques associés au risque de cancer gastrique, mais elle ne restait pas significative après ajustement pour les taux sanguins des micro-nutriments qui protègent du cancer de l'estomac.
Des associations positives ont été trouvées en comparant deux villes colombiennes:
Dans la région de PASTO(68), 93% de la population est infectée par H.pylori et la prévalence du cancer est approximativement de 150 pour 105 habitants; alors qu'à CALI où seul 63% de la population est infectée par H.pylori la prévalence du cancer est estimée à 75 pour 105 habitants.
Aux USA, dans la région de NEW ORLEANS(24), la prévalence du cancer de l'estomac dans la population noire, infectée à 70% par H.pylori est de 24 pour 105 habitants. Ceci contraste avec la prévalence du cancer dans la population blanche (10 pour 105 habitants) dans lequel seul 43% sont porteurs de H.pylori
Cette étude montre aussi que les conditions socio-économiques influencent le risque de cancer gastrique.
Des associations positives ont été trouvées également dans une étude récente faite dans 17 populations provenant de 13 pays différents. Un échantillon de 100 personnes constitué de 50 hommes et 50 femmes a été sélectionné dans chaque centre.
Pour chacune des tranches d'âge, et dans toutes les populations, il existait une corrélation linéaire entre la sérologie de H.pylori et l'incidence du cancer de l'estomac et la mortalité. Les auteurs de cette étude ont conclu à un risque relatif de survenue du cancer de l'estomac multiplié par 6 dans les populations dans lesquelles l'infection par H.pylori touchait 100% des sujets.
Mais cette corrélation n'était plus significative(54) si le JAPON et les ETATS-UNIS (ajoutés un peu plus tard pour étendre l'éventail des taux d'incidence du cancer gastrique de 1 à 10), représentant les deux populations correspondant aux valeurs extrêmes étaient retirés de l'étude.
En revanche, aucune corrélation positive ne fut trouvée, en étudiant les taux de prévalence des anticorps anti H.pylori chez des enfants et adolescents de deux régions du COSTA-RICA où l'incidence du cancer gastrique était deux fois et demi plus grande dans l'une que dans l'autre.
De même pour une étude faite en Italie(91) où deux régions à incidence élevée de cancer gastrique étaient comparées à deux autres d'incidence trois fois plus faible, aucune corrélation ne fut trouvée.
Au JAPON(122), dans cinq régions ayant une variation de la mortalité d'un facteur 2.5, la corrélation entre la prévalence des anticorps anti H.pylori et le taux cumulé de mortalité par cancer gastrique n'était pas significative.
2. Les études cas-témoin
Dans ces études, la prévalence des anticorps anti H.pylori chez des malades atteints d'un cancer de l'estomac est comparée à celle estimée d'un groupe témoin. Les anticorps sont titrés dans des sérums prélevés chez les malades après que le cancer ait été diagnostiqué.
a. Etudes menées dans des pays à faible risque de cancer de 1'estomac (7,31,32,60,63,74,105,107,118,120):
Cinq études de ce type ont été réalisées dans des pays à bas risque de cancer de l'estomac: aux Etats-Unis en FINLANDE en SUEDE aux PAYS-BAS (HOLLANDE) et la France.
Une association significative a été montrée seulement dans les études entreprises aux ETATS-UNIS, en FINLANDE et en SUEDE.
Dans l'étude de TALLEY(118) réalisée aux ETATS-UNIS les échantillons de sérum de 69 patients ayant un cancer gastrique confirmé histologiquement (32 cancers du cardia et 37 cancers en dehors du cardia) ont été comparés avec les échantillons de sérum de 252 témoins comprenant 76 volontaires asymptomatiques et 176 personnes avec des désordres non malins.
Des anticorps anti H.pylori furent détectés chez 65% des malades ayant un cancer gastrique autre que du cardia mais chez seulement 38% des patients avec un cancer gastrique localisé au niveau du cardia.
Une association significative ne fut trouvée qu'entre l'infection à H.pylori et le cancer gastrique autre que du cardia avec un risque relatif de 2,7.
Dans l'étude de SIPPONEN(107) réalisée en FINLANDE, les anticorps anti H.pylori ont été recherchés chez 54 patients ayant un cancer gastrique et chez 83 témoins : 35 avec une tumeur gastro-intestinale en dehors de l'estomac et 48 avec une "malignité" en dehors du tractus gastro-intestinal. 70% des malades ayant un cancer gastrique avaient des anticorps anti H.pylori dans leur sérum; cette prévalence était significativement plus élevée que chez les témoins (49% seulement avaient des anticorps anti H.pylori). Le risque relatif était de 2.2.
Dans l'étude de HANSSON(63) en 1993, au SUEDE, des sérums furent collectés de 112 malades ayant un cancer gastrique et de 103 témoins ayant des maladies en dehors du tractus gastro-intestinal.
La prévalence des anticorps anti H.pylori était significativement plus élevée parmi les patients (80%) par rapport aux témoins (61%) avec un risque relatif de 2,7.
Dans l'étude de KUIPERS(74) réalisée aux PAYS-BAS (HOLLANDE) où aucune différence significative ne fut trouvée, les sérums de 116 patients ayant un cancer gastrique et de 116 témoins ont été comparés.
La prévalence de l'infection chez les malades ayant un cancer gastrique était de 77% mais était plus élevée chez les témoins: 79%.
Mais les témoins ont été sélectionnés parmi des malades subissant une gastroscopie, bien que les patients ayant un ulcère peptique, une atrophie gastrique, une métaplasie intestinale ou une dysplasie ont été exclus, un certain nombre d'entre-eux pouvait souffrir d'une gastrite chronique non atrophique associée à une infection à H.pylori.
La France(7) est également un pays à incidence relativement faible avec des chiffres de 11,1 pour 10 5 hommes et de 4,5 pour 10 5 femmes en 2000, soit 7987 cas incidents, c'est-à-dire le 8ème cancer. Les disparités d'incidence observées entre pays peuvent se retrouver entre différentes régions d'un même pays. Ainsi, en France, le risque relatif estimé en 1992 par région par rapport au risque national variait de 0,7 à 1,5 chez les hommes et de 0,6 à 1,5 chez les femmes .L'incidence du cancer gastrique, comme celle d'autres cancers, est étroitement corrélée à l'âge.
b. Etudes cas témoin menées dans des pays à risque élevé (21,22,70,123):
Deux études récentes publiées dans l'année 2001 montrent que le risque de cancer lié à l'infection à H.pylori a en fait été très sous estimé. L'étude Japonaise de UEMURA et coll(21) est la première étude prospective de suivi dont le but était la détection précoce du cancer gastrique chez des sujets infectés et des sujets non infectés. Parmi 1526 sujets suivis pendant 7,8 ans en moyenne par endoscopie tous les 1 à 3 ans, 36 ont eu un cancer gastrique. Tous étaient infectés par H.pylori alors qu’aucun cancer n'est survenu chez les sujets non infectés.
La deuxième étude d’EKSTRÖM et coll (21) a comparé en Suède, deux diagnostics sérologiques chez 298 sujets atteints de cancer gastrique et 244 témoins appariés pour l'âge et le sexe. Il s'agissait d'une sérologie Elisa détectant les immunoglobulines contre plusieurs antigènes de surface d'H.pylori et une sérologie immunoblott détectant les anticorps anti-CagA. La prévalence des anticorps détectés par la seule méthode Elisa était de 72 % chez les malades atteints de cancer versus 55 % chez les témoins alors que lorsqu'était prise en compte la positivité de l'une ou l'autre sérologie, la séroprévalence était de 93 % chez les sujets avec cancer versus 59 % chez les témoins.
Ces deux études convergent pour attribuer à l'infection à H.pylori un risque relatif de cancer 10 fois plus élevé que dans les études précédemment publiées, supérieur à 20 dans l'étude suédoise et jusqu'à 34 en cas de gastrite fundique prédominante dans l'étude japonaise.
3. Etudes cas-témoin à l'intérieur de cohortes (17,21,31,35)
Trois études de ce type ont été réalisées et ont apporté des résultats positifs et cohérents. Dans ces études, les titres anticorps anti H.pylori ont été mesurés dans des sérums prélevés plusieurs années avant le diagnostic du cancer.
Dans l'étude menée au Royaume-Uni(35), 29 cas de cancer gastrique ont été diagnostiqués dans une cohorte de 22 000 hommes dont l'âge était compris entre 35 et 64 ans; ces 29 cas furent comparés à 116 témoins appariés pour la date de naissance et la date du prélèvement du sérum.
La durée moyenne entre le prélèvement du sérum et le diagnostic de cancer était de 6 ans et le risque relatif d'un cancer gastrique parmi les porteurs anticorps anti H.pylori était de 2,8.
Cette étude a donc été réalisée avec un petit nombre de cas.
L'étude californienne(35) comportait parmi les 186 cas 109 cas de cancer de l'estomac, 27 carcinomes de la jonction gastrooesophagienne et 11 lymphomes gastriques diagnostiqués dans une cohorte de près de 129 000 personnes. Ces cas furent comparés à un nombre égal de témoins appariés pour l'âge au moment du don du sang, ou le sexe, le groupe ethnique, la date de collecte du sérum et le lieu de recrutement.
La durée moyenne entre le prélèvement du sérum et le diagnostic du cancer gastrique était de 14,2 années.
Sur les 109 patients ayant un cancer gastrique 84% étaient infectés précédemment par H.pylori contre 61 % chez les témoins.
Les risques relatifs associés à la présence d'anticorps étaient de 3,6 pour le cancer de l'estomac; 0.8 pour les tumeurs de la jonction gastro-oesophagienne et 4 pour les lymphomes gastriques; seuls ceux pour le cancer de l'estomac étaient significatifs. Le risque relatif était plus élevé chez les femmes et dans la population noire et n'était pas affecté par le groupe sanguin ou par l'usage du tabac. Les sujets atteints d'un ulcère peptique avaient un risque plus faible de cancer gastrique.
La troisième étude(35) a été réalisée sur des hommes américains d'origine japonaise vivant à HAWAI. Les 109 cas de carcinome gastrique diagnostiqués dans cette cohorte de 6000 personnes furent comparés à 109 témoins appariés pour l'âge et la date du prélèvement.
L'intervalle moyen entre la prise de sang et le diagnostic du cancer était de 13,5 années.
Parmi les 109 patients ayant un cancer gastrique 94% étaient infectés précédemment par Helicobacter pylori contre 76% chez les témoins.
Le risque relatif de développer un cancer de l'estomac était de 6.
Le risque relatif augmentait avec le titre d'anticorps et avec l'intervalle entre la prise de sang et le diagnostic de cancer.
EN RESUME (35)
AUTEUR CAS TEMOIN RISQUE
RELATIF
Nombre % d'Hp (+) nombre % d'Hp(+)
FORMAN 29 69 116 46.6 2.8
PARSONNET 109 84.4 109 60.6 3.6
II. Conclusion (22,25,31)
Bien que de nombreuses études aient démontré que l'infection à H.pylori était l'une des causes principales des gastrites aiguës et chroniques, ces différentes études épidémiologiques montrent qu'il est difficile d'obtenir une preuve épidémiologique claire de la liaison entre l'infection à H.pylori et le cancer gastrique.
De plus, ces trois types d'études épidémiologiques ont des faiblesses: Les études écologiques montrent que la corrélation est positive quand l'étude porte sur des populations nombreuses et si les taux de cancer gastrique parmi ces populations varient avec une amplitude de dix au moins.
De plus, ce type d'études est difficile à interpréter et ne donne pas de preuve solide d'une association causale, et ces études écologiques sont particulièrement sensibles aux effets des facteurs de confusion.
Ainsi, les corrélations positives entre les taux de prévalence de H.pylori et les taux de cancer gastrique peuvent révéler des associations avec d'autres facteurs associés à la fois à l'infection par H.pylori et au risque de cancer de l'estomac comme l'âge ou le milieu socio-économique.
Les études cas témoins ont une faiblesse commune liée au facteur temps. Puisque le cancer de l'estomac et l'infection à H.pylori sont diagnostiqués en même temps, il est impossible de savoir si l'infection à H.pylori a précédé le diagnostic ou l'a immédiatement suivi.
La preuve définitive de causalité sera obtenue lorsque des études montrera qu'une éradication de longue durée de l'infection à H.pylori est suivie par une
Sur le plan histologique, deux principaux types de cancers gastriques sont observés en pratique : les adénocarcinomes de type intestinal et les adénocarcinomes de type diffus qui correspondent grossièrement aux classiques limites. Les premiers représentent environ 80% des cancers gastriques.
Les cancers diffus se distinguent des cancers de types intestinaux également par un âge de survenue généralement plus jeune et une prédominance féminine.
Enfin, les cancers héréditaires liés à la mutation germinale du gène de la E-cadhérine sont exclusivement de type diffus .En revanche, H.pylori peut favoriser aussi bien la survenue de cancers de types intestinaux que de types diffus.
A. Lésions pré-néoplasiques de l’adénocarcinome intestinal
(17,25,33,62,69)
Cela fait maintenant presque 30 ans que Correa(25) a proposé la cascade d’événements histologiques qui conduit à la survenue du cancer de type intestinal. Cette hypothèse était basée sur l’observation de cohortes de malades dans des régions à forte prévalence de cancers gastriques. Dès cette époque, il était assez clair que les cancers gastriques ne survenaient que chez les patients ayant une gastrite chronique, au terme d’une évolution pouvant excéder 30 ans. Le cancer gastrique était l’évolution terminale d’un processus allant de la gastrite chronique à l’atrophie gastrique et à la métaplasie intestinale.
Il était déjà établi qu’environ 50 % des malades ayant une gastrite chronique évoluaient vers l’atrophie gastrique, que 8 % évoluaient vers la présence de métaplasie intestinale compliquant l’atrophie et qu’enfin 1/100 évoluait vers la dysplasie sévère et le cancer.