HAL Id: tel-01126971
https://tel.archives-ouvertes.fr/tel-01126971
Submitted on 6 Mar 2015
HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Contrôle glycémique informatisé en réanimation
Pierre Kalfon
To cite this version:
Pierre Kalfon. Contrôle glycémique informatisé en réanimation. Physiologie [q-bio.TO]. Université Pierre et Marie Curie - Paris VI, 2014. Français. �NNT : 2014PA066150�. �tel-01126971�
Université Pierre et Marie Curie
Ecole Doctorale Physiologie, Physiopathologie et Thérapeutique (ED394)
Laboratoire UMR INSERM-UPMC 1166Contrôle glycémique informatisé en réanimation
Par Pierre KALFON
Thèse de doctorat
Dirigée par Bruno RIOU
Présentée et soutenue publiquement le 10 juin 2014 Devant un jury composé de :
Karine CLEMENT PU-PH, IHU de Cardiométabolisme et Nutrition (ICAN) et Service de Nutrition, GH Pitié-Salpêtrière, Assistance publique-Hôpitaux de Paris (AP-HP)
Jean CHASTRE, PU-PH, Service de Réanimation médicale, GH Pitié-Salpêtrière, AP-HP Carole ICHAI, PU-PH, Service de réanimation médico-chirurgicale, CHU de Nice
Jean MANTZ, PU-PH, Hôpital Beaujon, Hôpitaux Universitaires Paris Nord Val de Seine, Rapporteur
Eric RENARD, PU-PH, CHRU Montpellier, Rapporteur Michel SORINE, Directeur de recherche INRIA
Bruno RIOU, PU-PH, UMRS INSERM 1166 et Service d'accueil des urgences, GH Pitié-Salpêtrière, AP-HP
R
ESUMEL’hyperglycémie est très souvent présente chez le patient de réanimation, liée à une insulinorésistance et une production accrue de glucose par le foie. La relation entre hyperglycémie en réanimation et pronostic défavorable était déjà établie lorsque Van den Berghe et al montra une réduction de mortalité associée à une insulinothérapie intensive visant à normaliser la glycémie. Du fait de l’impossibilité à reproduire cet effet bénéfique et de la mise en évidence d’une surmortalité associée à un contrôle glycémique strict par rapport à un contrôle visant une glycémie < 10mmol/L (étude NICE-SUGAR), le premier objectif de cette thèse fut de rechercher à l’aide d’une étude multicentrique (étude CGAO-REA) une association entre utilisation d’un logiciel facilitant le contrôle glycémique strict et réduction de mortalité.
Malgré le résultat négatif de l’étude CGAO-REA, l’intérêt d’un système informatisé demeure en raison de la complexité du contrôle glycémique. Sont ainsi discutés les sujets suivants appliqués à la réanimation : aléas du contrôle glycémique, méthodes de mesure de la glycémie, contrôleurs glycémiques, insulinorésistance, variabilité glycémique, impact du statut diabétique et systèmes informatisés.
Le deuxième objectif de cette thèse est de détailler les nouveaux objectifs du contrôle glycémique en réanimation et d’en présenter l’évolution et les perspectives. En s’inspirant des diabétologues engagés dans le développement d’un pancréas artificiel et en généralisant les évaluations in silico, des équipes pluridisciplinaires pourraient construire une station de contrôle informatisée afin d’obtenir un contrôle glycémique optimisé et individualisé en réanimation.
Mots-clés : contrôle glycémique ; réanimation ; insuline ; systèmes informatisés ; essais cliniques multicentriques ; études in silico
A
BSTRACTStress-induced hyperglycemia is common in critically ill patients due to insulin resistance and increased hepatic output of glucose. The relationship between stress hyperglycemia and poor outcome for patients hospitalized in the intensive care unit (ICU) was already established when Van den Berghe et al demonstrated that tight glucose control (TGC) by intensive insulin therapy was associated with decreased mortality and rate of complications in surgical ICU patients. Because further randomized controlled studies have failed to replicate any mortality benefit and have even shown an increased mortality (the NICE -SUGAR study), the primary objective of this thesis was to test the hypothesis that TGC with a computerized decision-support system (CDSS) reduces the mortality in adult critically ill patients as compared to conventional glucose control targeting BG levels to <10 mmol/L (the CGAO-REA study).
We discussed several aspects of glucose control in the ICU (integration in the clinical workflow, confounding issues in BG measurements, insulin resistance, glucose variability, impact of diabetic status) and reviewed existing computerized tools.
Despite the negative result of the CGAO-REA study, the interest for CDSSs remains because meanwhile new therapeutic goals for glucose control in the ICU have emerged. The second objective of this thesis is to present ongoing developments. Based on research programs targeting an artificial pancreas for diabetic patients, in silico trials, multidisciplinary approaches integrating human factors, a computerized glucose control station could be developed to allow clinicians to achieve an optimized, individualized glucose control in the ICU.
Keywords: glucose control . critical care . insulin . computerized decision-support systems . randomized controlled trials . in silico trials
IN MEMORIAM
Je dédie cette thèse au Pr Xavier Leverve, qui avait accepté de participer au comité de surveillance indépendant de l’étude CGAO-REA malgré son agenda si chargé lié à son statut international de Directeur scientifique du secteur Nutrition humaine et sécurité des aliments de l’INRA et ses multiples activités de recherche et d’enseignement.
Il nous a quitté prématurément en novembre 2010 laissant un héritage scientifique majeur après avoir marqué définitivement le monde de la nutrition.
Je me souviens que l’immense scientifique dont j’écoutais les exposés lors des congrès de ma spécialité était, lors de nos réunions et rencontres, un homme très affable, très enthousiaste, attentif à la parole d’autrui, puis prodiguant ses conseils éclairés, à l’esprit étincelant, à l’évidence un grand humaniste et le visionnaire, abattant les frontières, que toutes celles et ceux qui avaient eu la chance de travailler à ses côtés reconnaissaient en lui.
D
EDICACEA Lisl et Walter†
A Daniel, Michaël et Laure A Barbara
R
EMERCIEMENTSEn premier lieu je veux remercier le Pr Bruno Riou, mon directeur de thèse, un modèle de rigueur scientifique, qui m’a toujours impressionné par sa capacité de travail, sa ténacité à conduire de multiples projets jusqu’à leur terme, un modèle pour des générations de médecins issues des disciplines Anesthésie Réanimation, Médecine d’urgence et bien au-delà. J’ai toujours ressenti comme un très grand honneur de pouvoir bénéficier du soutien de ce scientifique au rayonnement international et lui suis particulièrement reconnaissant de s’être montré si disponible et si réactif, malgré ses grandes responsabilités, durant ces cinq années nécessaires à la réalisation de cette thèse.
Mes remerciements vont aussi à tous les membres du jury mais tout d’abord au Pr Carole Ichai, qui m’a accompagné dès les premières heures, en 2007, avec le Pr Bruno Riou (je me souviens d’une réunion à trois au siège de la Société Française d’Anesthésie Réanimation pour transformer un premier draft que je leur soumettais en projet scientifique). Elle est au cœur de ce travail, m’a toujours soutenu, manifesté ses encouragements et s’est remarquablement investie au-delà de toute espérance pour permettre une très importante participation de son service de réanimation du CHU de Nice malgré toutes les difficultés informatiques rencontrées, avant l’ère tant attendue de « l’Hôpital numérique ». Je pense qu’au-delà de son apport scientifique inestimable, j’ai gagné une amie pour la vie.
Je remercie le Pr Jean Chastre, dont je connaissais déjà la très haute valeur scientifique dans le domaine de la réanimation pour avoir notamment participé à des essais cliniques de très grande ampleur qu’il a coordonnés, et qui dès 2008 a accepté de rejoindre le comité de pilotage de l’étude CGAO-REA sans jamais manquer une seule de ses réunions ; j’ai découvert de plus un homme d’une gentillesse, d’une courtoisie et d’une disponibilité jamais mises à défaut, répondant toujours par retour d’e-mail, notamment lors de la phase de rédaction de l’article scientifique au centre de ce travail.
Je remercie M. Michel Sorine, Directeur de recherche à l’Institut National de Recherche en Informatique et Automatique (INRIA), qui a mis ses talents et sa très grande expérience d’automaticien au service de la problématique centrale de cette thèse, nous aidant à concevoir notre système d’aide à la décision informatisée de première génération destiné à la réanimation, et en assurant l’encadrement d’un doctorant M. Alexandre Guerrini jusqu’à sa soutenance de thèse consacrée à l’évaluation des performances de systèmes d’assistance au
M. Michel Sorine, son institution, l’INRIA, qui a supporté financièrement le déploiement dans de nombreux hôpitaux des solutions informatiques nécessaires à la conduite de l’étude multicentrique CGAO-REA. Sont marquées dans mon esprit nos longues conversations, parfois passionnées, et ses réponses par e-mail très structurées et détaillées.
Je remercie le Pr Jean Mantz, une très grande figure de la discipline Anesthésie Réanimation avec lequel j’ai déjà eu la chance de collaborer dans un autre domaine de notre discipline, la mesure et la prévention des inconforts perçus par les patients de réanimation, et qui m’inspire le plus profond respect par sa rigueur scientifique, et le Pr Eric Renard, un leader d’opinion international incontesté, un novateur dans sa discipline Endocrinologie-Diabète-Maladies métaboliques, engagé depuis plusieurs décennies dans le développement d’un pancréas artificiel, et récemment dans celui d’un pancréas bio artificiel ; nul doute que les patients diabétiques de type 1 à travers le monde lui devront des améliorations significatives de leur vie quotidienne grâce à la neutralisation ou du moins l’atténuation des handicaps induits par la maladie diabétique grâce aux prouesses technologiques basées sur sa compréhension de phénomènes physiologiques complexes. Je lui avais présenté l’étude multicentrique CGAO-REA lors d’un de mes visites au CHRU de Montpellier et il m’avait témoigné son soutien et transmis ses conseils précieux. A tous deux, je remercie d’avoir accepté d’être membre de mon jury, d’en être rapporteur, en s’acquittant de leur rapport dans un délai si court.
Je remercie particulièrement le Pr Karine Clément d’avoir accepté la présidence de mon jury de thèse. Je ressens comme un très grand honneur la présence dans ce jury de la Directrice de l’Institut Hospitalo-Universitaire (IHU) de Cardiométabolisme et Nutrition (ICAN) fondé sur les expertises scientifiques et médicales des unités de recherche et des équipes médicales de l’Université Pierre et Marie Curie et de l’hôpital Pitié-Salpêtrière. Grâce à un plateau de recherche translationnelle d’une qualité exceptionnelle, cet IHU relève parfaitement les enjeux de la médecine moderne dans le domaine des maladies cardiométaboliques, et notamment deux enjeux qui me tiennent à cœur, la médecine prédictive grâce au traitement des données et la mise au point de traitements personnalisés. Je remercie tous les membres du comité de pilotage de l’étude CGAO-REA, non encore cités, qui m’ont accompagné dans cette recherche, et pour certains, ont participé directement dans leurs services cliniques à l’inclusion de patients, le Pr Djillalli Annane, Doyen de l’UFR des Sciences de la Santé Simone Veil et chef de service de réanimation du CHU Raymond Poincaré, AP-HP, Garches, le Pr Pierre-François Dequin du CHRU de
Tours, le Pr Hervé Dupont du CHRU d’Amiens, M. Bruno Giraudeau, méthodologiste de l’étude, du Centre d’Investigation Clinique du CHRU de Tours, le Pr Philippe Montravers du CHU Bichat-Claude Bernard, AP-HP, Paris et M. Alexandre Guerrini.
Je remercie tous les investigateurs de l’étude CGAO-REA qui ont accepté la modification en profondeur de leurs pratiques cliniques, le déploiement au lit même du patient dans chaque chambre de réanimation d’ordinateurs ultraportables, et l’utilisation pluriquotidienne de ces nouveaux outils par leurs équipes infirmières, avec une mention particulière, compte tenu du nombre considérable de patients inclus dans l’étude, pour trois co-auteurs, le Dr Nicolas Bréchot du CHU Pitié-Salpêtrière, le Dr Raphael Cinotti du CHRU de Nantes (premier auteur d’une étude ancillaire portant sur un sous-groupe de patients cérébrolésés inclus dans l’étude CGAO-REA, en cours de soumission), et le Dr Béatrice Riu-Poulenc du CHU de Toulouse.
Je remercie la Société Française d’Anesthésie Réanimation(SFAR) qui m’a distingué en 2008 m’accordant le grand prix pour la recherche 2008, sur la base des recommandations d’un jury de sept universitaires, permettant d’assurer la part principale du financement de l’étude multicentrique CGAO-REA, avec une pensée toute particulière pour le Pr Claude Martin, à l’origine de la création de ce prix permettant de faciliter l’émergence de grandes études multicentriques françaises dans la discipline Anesthésie Réanimation, et pour le Pr Pierre Carli et le Pr Dan Benhamou, deux présidents successifs de la SFAR toujours très attentifs à la concrétisation de ce projet ambitieux malgré les aléas rencontrés.
Je remercie M. Gilles Rafalli, mon ami d’enfance, donc ami de bien plus de 30 ans, qui au sein de la société LK2, a su déployer une énergie considérable pour assurer notamment la logistique de l’étude CGAO-REA et la mise à disposition dans de si nombreux services de réanimation répartis sur le territoire national du logiciel CGAO. Je remercie aussi M. Gaëtan Roudillon, toujours au sein de la société LK2, informaticien autodidacte hors pair, sans qui jamais l’étude CGAO-REA n’aurait pu, ne serait-ce que démarrer, grâce à ses compétences informatiques exceptionnelles, sa capacité de travail, sa détermination sans faille à résoudre toutes les difficultés, nombreuses, rencontrées durant le projet, sa rigueur et sa loyauté.
Je remercie le promoteur de l’étude CGAO-REA, mon employeur, le Centre Hospitalier de Chartres, qui m’a permis de conduire cette recherche et a toujours facilité les
meilleures conditions de réalisation, et en particulier Mme Catherine Paul directrice générale lors du démarrage du projet, et son actuel directeur, M. Raoul Pignard.
Je remercie bien évidemment l’ensemble de mes collègues du service de réanimation du CH de Chartres, qui m’ont toujours apporté leur soutien durant la réalisation de cette étude, le Dr Juliette Audibert-Souhaid, le Dr Alexandre Conia, le Dr Olivier Gontier, le Dr Mouldi Hamrouni, le Dr Thierry Lherm, le Dr Guy Monchamps, le Dr Abdelkader Ouchenir mais aussi mes collègues anesthésistes réanimateurs que j’ai eu la chance d’accueillir pour un temps dans le service de réanimation, le Dr Teodora Cirilovic et le Dr Makrem Yaacoubi.
Je remercie particulièrement les trois secrétaires du service de réanimation du Centre Hospitalier de Chartres, Mme Isabelle Tessier, Mme Leslie Leshayes et Mme Emilie Breton, véritables « pièces maîtresses » du dispositif, pour leur professionnalisme, leur sérénité, et leur rigueur dans l’exercice de leurs fonctions principales, tout en m’apportant leur aide indispensable à la conduite de ce projet impliquant tant d’acteurs à l’extérieur de leur hôpital qu’il fallait régulièrement contacter.
Je remercie les attachés de recherche de clinique qui se sont impliqués dans notre étude, Mme Bérangère Bonnel, Mme Cécile Jourdain, M. Patrick Piesvaux, ainsi que le Dr Caroline Touboul alors interne en réanimation.
Je remercie enfin l’ensemble des personnels de réanimation du Centre Hospitalier de Chartres, notre cadre de proximité Mme Martine Perdereau en fonction dans notre service lors du démarrage de l’étude CGAO-REA, tous les infirmières et infirmiers qui furent les premiers utilisateurs de l’outil informatique que nous avons développé et ont contribué à son amélioration, mais aussi tous les aide-soignantes, les aide-soignants et les agents de service hospitaliers.
Sommaire
RESUME... 2 ABSTRACT... 3 IN MEMORIAM... 4 DEDICACE... 5 REMERCIEMENTS... 61. PHYSIOLOGIE ET PHYSIOPATHOLOGIE DE LA REGULATION DE LA GLYCEMIE... 12
1.1. Métabolisme du glucose en situation physiologique... 12
1.2. Les effets de l’insuline : de la cellule à l’organisme... 14
1.3. Hyperglycémie aiguë en réanimation : mécanismes... 17
2. LES ALEAS DU CONTROLE DE LA GLYCEMIE EN REANIMATION... 20
2.1. Effets délétères de l’hyperglycémie des patients de réanimation... 20
2.2. Le concept d’insulinothérapie intensive en réanimation : la première étude de Louvain et son impact sur les pratiques des réanimateurs... 23
2.3. Limites de la première étude de Louvain... 27
2.4 . Le concept de contrôle glycémique strict : la deuxième étude de Louvain... 28
2.5. Les autres études contrôlées randomisées portant sur le contrôle glycémique strict... 30
2.6. Remise en cause du concept de contrôle glycémique strict : l’étude NICE-SUGAR... 32
2.7. Recommandations des sociétés savantes relatives au contrôle glycémique en anesthésie et réanimation et méta-analyses... 36
3. LES METHODES DE MESURE DE LA GLYCEMIE EN REANIMATION... 39
3.1. Mesures discontinues de la glycémie... 41
3.2. Mesures continues et semi-continues... 48
4. CONTROLEURS GLYCEMIQUES... 50
4.1. Les différents types de contrôleurs... 50
4.1.1 Protocoles tabulés 51 4.1.2 Contrôleurs de type Proportionnel-Integral-Dérivé 55 4.1.3 Contrôleurs à commande prédictive ou MPC (Model-base Predictive Controller) 57 4.1.4 Contrôleurs adaptatifs par modèle de référence ou MRAC (Model-Reference Adaptative Controller) 61 4.1.5 Modélisation 62 4.2. Essais précliniques et simulation... 71
5. INSULINORESISTANCE DU PATIENT DE REANIMATION... 72
5.1. Méthodes d’évaluation de l’insulinoresistance en dehors de la réanimation... 72
5.1.1 Le clamp euglycémique hyperinsulinémique 72 5.1.2 Autres méthodes d’évaluation biologique de la sensibilité à l’insuline 73 5.2. Applications aux patients de réanimation... 75
6. VARIABILITE GLYCEMIQUE EN REANIMATION... 77
7.1. Le patient diabétique en réanimation... 79
7.2. Cibles glycémiques pour le patient diabétique en réanimation... 79
7.3. Variabilité glycémique du patient diabétique en réanimation... 80
8. LE CONTROLE GLYCEMIQUE INFORMATISE EN REANIMATION... 80
8.1. Protocoles et algorithmes de contrôle glycémique... 80
8.2. Performance, sécurité et impact sur la charge de travail des protocoles de contrôle glycémique... 85
9. RESULTATS : L’ETUDE MULTICENTRIQUE CGAO-REA... 88
9.1. Objectifs de la recherche et retombées attendues... 89
9.1.1 Objectif principal 89 9.1.2 Objectifs secondaires 90 9.1.3 Retombées attendues 90 9.2. Méthodologie... 91
9.2.1 Sélection, exclusion des sujets, et procédure d’inclusion 91 9.2.2 Déroulement de l’étude 93 9.2.3 Evaluation et collecte des données 96 9.2.4 Mesure des critères de jugement 98 9.2.5 Analyses statistiques 99 9.3. Résultats... 103
9.3.1 Patients 103 9.3.2 Insulinothérapie et effets sur le contrôle glycémique 109 9.3.3 Impact sur le pronostic 111 9.4. Discussion... 113
9.5. Etude ancillaire : impact du logiciel CGAO chez les patients cérébro-lésés... 119
10. LES NOUVEAUX OBJECTIFS DU CONTROLE GLYCEMIQUE EN REANIMATION... 121
10.1. Détermination d’une cible glycémique individualisée... 121
10.2. Réduction de la variabilité glycémique... 122
10.3. Prévention des hypoglycémies... 125
10.4. Evaluation de la Complexité du signal glycémique... 128
11. EVOLUTION ET PERSPECTIVES... 129
11.1. Vers une station de contrôle glycémique multiparamétrique... 129
11.2. Ce que les diabétologues peuvent apprendre aux réanimateurs... 134
11.3. Utilisation en réseaux, big data et partage des connaissances... 139
11.4. Conclusion... 142
12. ANNEXES... 145
12.1. Eléments descriptifs de développement et de validation du programme informatique CGAO... 145
12.2. Abstracts relatifs au logiciel CGAO d’aide au contrôle glycémique en réanimation... 149
13. BIBLIOGRAPHIE... 154
14. BIOGRAPHIE... 178
1.
P
HYSIOLOGIE ET PHYSIOPATHOLOGIE DE LA REGULATION DE LA GLYCEMIE1.1. METABOLISME DU GLUCOSE EN SITUATION PHYSIOLOGIQUE
Chez le sujet sain, la régulation de la glycémie s’effectue selon deux types de mécanismes complexes 1 : un mécanisme hormonal consistant en une balance entre l’insuline, hormone hypoglycémiante, et les hormones hyperglycémiantes de contre-régulation (glucagon, adrénaline, cortisol, hormone de croissance), et un mécanisme neural consistant en l’activation de messages provenant de capteurs de glucose situés dans différents organes.
Ces mécanismes de régulation permettent de maintenir une concentration de glucose dans le sang relativement stable durant le nycthémère autour d’une valeur de 5,5 mmol/L, malgré l’administration de quantités parfois importantes d’hydrates carbone ou des situations de jeûne plus ou moins prolongées.
Toute modification de glycémie découlera d’un déséquilibre transitoire entre les flux systémiques de glucose (entrées du glucose dans la circulation, quelle que soit l’origine : production par un organe, essentiellement le foie et dans une moindre mesure le rein, ou apports exogènes liés à l’alimentation après absorption de glucose par le tube digestif) et l’utilisation de glucose par les tissus de l’organisme 2.
La production hépatique de glucose provient de deux voies métaboliques distinctes, glycogénolyse et néoglucogenèse, la néoglucogenèse hépatique (mais aussi rénale) devenant prédominante voire exclusive en situation de jeûne prolongé.
L’utilisation du glucose par les tissus de l’organisme est très variable selon les diverses conditions physiologiques : à jeun cette utilisation est constante dans les tissus nécessitant obligatoirement ce substrat pour leur fonctionnement habituel, tel le cerveau ; après prise alimentaire ce sont essentiellement les tissus insulino-sensibles tels le muscle squelettique et le tissu adipeux qui captent le glucose ; lors de l’exercice, le glucose est capté de manière indépendante de l’insuline dans le muscle squelettique. Après transport du glucose dans le cellule, celui-ci est soit stocké sous forme de glycogène ou métabolisé en pyruvate par la voie de la glycolyse.
Le transport du glucose dans les cellules dépend de différents transporteurs, protéines transmembranaires, dont les caractéristiques déterminent une régulation du glucose spécifique
le nombre de transporteurs présents à la surface des cellules, induisent un métabolisme du glucose spécifique d’organe. Quatre transporteurs ont essentiellement été décrits : GLUT-1, GLUT-2, GLUT-3 et GLUT-4.
Dans le cerveau sont présents de manière prédominante GLUT-1 (dont le Km est faible de l’ordre de 2 mmol/L) 5, mais aussi GLUT-3 (Km de l’ordre de 9 mmol/L) 6. GLUT-1 est aussi exprimé dans les érythrocytes, les cellules impliquées dans l’immunité, le tissu inflammatoire, la médullaire rénale, le placenta, les tissus fœtaux. Ces transporteurs permettent une entrée de glucose dans la cellule indépendante de l’insuline, et maximale pour l’ensemble des valeurs physiologiques de la glycémie – l’entrée de glucose dans les cellules exprimant sur leur membrane les transporteurs GLUT-1 ne diminuant qu’en situation d’hypoglycémie sévère.
GLUT-2 est exprimé dans le foie et les cellules beta du pancréas, et se caractérise par un Km élevé (de l’ordre de 66 mol/L) : l’entrée de glucose dans la cellule, indépendante de l’insuline, sera proportionnelle à la concentration de glucose extracellulaire, conférant à ces cellules le rôle d’un senseur glycémique modulant la production d’insuline proportionnellement à la glycémie extracellulaire. Ce transporteur est aussi présent dans certaines cellules de l’hypothalamus, de la muqueuse de l’intestin grêle et dans les cellules tubulaires rénales.
GLUT-4 est le transporteur dont le fonctionnement présente la particularité d’être modifié par l’insuline. Il est exprimé principalement dans les tissus considérés ainsi insulinodépendants, le muscle squelettique, le tissu adipeux, le muscle cardiaque, et certaines cellules du système nerveux central. Ce fonctionnement particulier est lié au fait que GLUT-4 est présent, en l’absence de stimulation par l’insuline, sur la membrane de vésicules intracytoplasmiques, ne permettant pas l’entrée de glucose dans la cellule ; en présence d’insuline, les cellules présentent un phénomène de translocation, c’est-à-dire une fusion des vésicules intracellulaires avec la membrane plasmique, ce qui entraîne une augmentation importante des transporteurs du glucose à la surface de la cellule, et donc une entrée de glucose dans la cellule compte tenu du Km relativement faible de GLUT-4 (de l’ordre de 5 mol/L).
L’utilisation de glucose par les tissus peut donc se répartir en utilisation indépendante de l’insuline (sous la détermination directe du gradient entre concentration de glucose dans le flux sanguin et concentration de glucose intracellulaire) et utilisation (essentiellement dans le muscle squelettique et le tissu adipeux) dépendante de l’insuline,
celle-ci ne représentant en situation normale que 10 à 20 % de l’utilisation totale de glucose par les tissus.
1.2. LES EFFETS DE L’INSULINE : DE LA CELLULE A L’ORGANISME
La molécule d’insuline biologiquement active est un peptide constitué d’une chaîne A de 21 aminoacides et d’une chaîne B de30 aminoacides reliés par deux ponts disulfure 7, 8. L’insuline est produite par les cellules β des îlots de Langerhans du pancréas, tout d’abord sous forme d’un peptide signal, puis au sein du réticulum endoplasmique sous forme de proinsuline, gagnant l’appareil de Golgi à l’origine de granules β où a lieu la formation d’insuline par élimination du peptide C et sa conservation avant son excrétion sous forme d’hexamère.
L’insuline est une hormone essentielle à l’homéostasie du glucose mais intervient aussi dans le métabolisme des lipides, des protides, des hydrates de carbone et exerce d’autres effets grâce à sa liaison avec des récepteurs spécifiques.
Non seulement l’insuline augmente l’utilisation du glucose par les tissus insulinodépendants, mais elle stimule l’induction de la synthèse de l’enzyme impliquée dans la production de glycogène, ainsi que celle de plusieurs enzymes de la glycolyse, tout en bloquant la synthèse de plusieurs enzymes impliquées dans la néoglucogenèse. L’insuline favorise aussi la synthèse des lipides à partir du glucose, notamment par activation de l’actéyl-CoA, et inhibe la dégradation des acides gras.
Le principal régulateur de la sécrétion d’insuline est le glucose ; néanmoins, la sécrétion d’insuline par les cellules β des îlots de Langerhans du pancréas est aussi stimulée par des hormones gastro-intestinales, les incrétines, dont la sécrétion est elle-même stimulée par les apports alimentaires ingérés, indépendamment du niveau de glycémie.
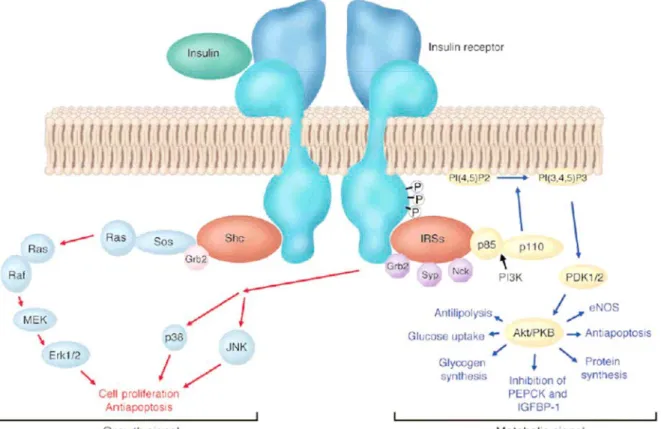
Les actions moléculaires de l’insuline se déduisent de la compréhension de ses voies de signalisation. Le récepteur à l’insuline (IR) est une protéine se composant de sous-unités α extra-membranaires et 2 unités β transmembranaires. La liaison de l’insuline à la sous-unité α provoque le changement de conformation des sous-sous-unités β, déclenchant l’activité tyrosine kinase et l’activation de deux voies de signalisation intracellulaire. La première voie de signalisation est la cascade MAPK (Mitogen-activated protein kinase), appelée communément signal de croissance, l’association du récepteur à l’insuline avec les protéines Shc et Grb2 provoquant une cascade de phosphorylations aboutissant aux molécules Erk1/2, p38 et JNK impliquées dans la prolifération cellulaire et l’apoptose ; la deuxième voie de signalisation est la cascade IRS (Insulin Receptor Substrates), appelée communément signal
métabolique, conduisant en aval à la production d’une enzyme clé dans le métabolisme de l’insuline, PI3K, à l’origine de phospholipides seconds messagers aboutissant à l’activation d’une enzyme Akt jouant un rôle central dans le métabolisme tissulaire et notamment la translocation de GLUT-4 du compartiment cytoplasmique vers la membrane plasmique mais aussi les effets de synthèse protéique et anti lipolyse 9 (Figure 1).
Modèle simplifié de la signalisation de l’insuline. La liaison de l’insuline à la partie extra-membranaire du récepteur à l’insuline provoque un changement de conformation. Deux principales voies sont activées par l’insuline : voie de la signalisation MAPK (signal de croissance en raison des effets anti-apoptotiques et de prolifération cellulaire induits) et voie de l’IRS conduisant à Akt/PKB modulant les activités enzymatiques qui contrôlent notamment le métabolisme du glucose, des lipides et protéines. PI(4,5)P2, phosphoinositide 4,5 diphosphate ; PI(3,4,5)P3, phosphoinositide 3,4,5 triphosphate ; PDK1, phosphoinositide kinase 1-dépendante
Fig. 1 extrait de : Van den Berghe G. How does blood glucose control with insulin save lives in intensive care? J Clin Invest. Nov 2004;114(9):1187-1195.
L’insuline exerce des effets anti-inflammatoires notamment par plusieurs mécanismes : réduction de la voie de signalisation NFκB (réduisant ainsi la production de TNF-α, de MIF - Macrophage migration-Inhibitory factor), augmentation de IκB dans les cellules mononulées, diminution du stress oxydatif et de la production de superoxyde, diminution de molécules de l’inflammation (mannose-binding lectine, CRP), augmentation de
la production de eNOS (endothelial Nitric Oxyde Synthase) et de cytokines anti-inflammatoires. L’insuline pourrait aussi influencer l’immunité cellulaire en favorisant un phénotype lymphocytaire Th2 en cas d’agression.
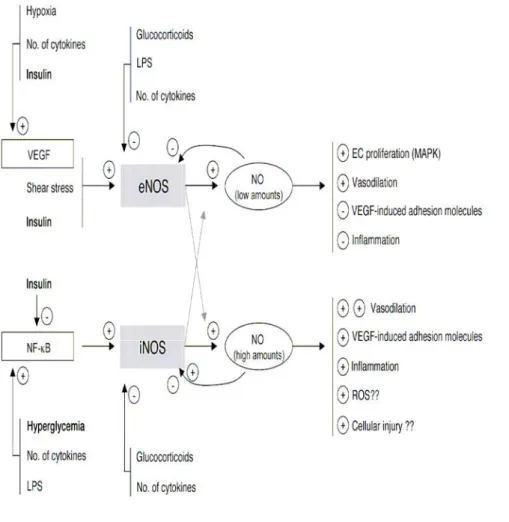
Via la voie d’activation PI3K et Akt, l’insuline possède donc un potentiel d’activation de l’eNOS et de restauration d’une vasodilatation dans les territoires ischémiques, que ce soit au niveau cérébral qu’au niveau cardiaque par exemple. Néanmoins ces effets potentiellement bénéfiques de l’insuline sur l’endothélium sont inhibés en situation d’hyperglycémie 10. En contrôlant l’hyperglycémie qui induit une synthèse accrue de la NO synthase (iNOS), l’insuline contribue à restaurer la balance eNOS/iNOS, dont le déséquilibre conduit à la synthèse de molécules d’adhésion induites par le VEGF (Vascular endotheial
growth factor) (Figure2).
Via la voie d’activation MAPK, l’insuline stimule la sécrétion de l’endothéline 1 (ET1) vaso-constricteur, ainsi que la production de molécules d’adhésion endothéliale, telles l’E-sélectine ou VCAM-1. La production des molécules d’adhésion endothéliales sont aussi favorisées par les protéines de l’inflammation. L’insuline peut donc avoir des actions opposées sur la micro-circulation sous l’influence des rôles comparées de ces deux voies de signalisation. En ce qui concerne la coagulation, l’insuline diminue l’agrégabilité plaquettaire et la diminution de l’activité du PA1 (Plasminogen activitor inhibitor) et du thromboxane qui favorisent les états pro-thrombotiques. Les effets de l’insuline sur le foie sont marqués par l’inhibition de la production de glucose en diminuant la glycogénolyse. L’insuline diminue aussi la production hépatique de glucose par des mécanismes indirects comme l’inhibition de la lipolyse, l’inhibition de la sécrétion de glucagon par les cellules α du pancréas, ou en raison de ses effets sur l’hypothalamus. En conclusion, l’insuline possède donc de nombreux effets distincts de la régulation glycémique, et agit notamment sur la réponse immunitaire, l’inflammation et l’endothélium.
Fig. 2 extrait de : Langouche L, Vanhorebeek I, Vlasselaers D, et al. Intensive insulin therapy protects the endothelium of critically ill patients. J Clin Invest. Aug
2005;115(8):2277-2286.
1.3. HYPERGLYCEMIE AIGUË EN REANIMATION : MECANISMES
Dès 1878, Claude Bernard décrivit l’hyperglycémie durant le choc hémorragique. Il est maintenant bien connu que toutes les situations aigues peuvent conduire, indépendamment du statut diabétique antérieur, à une hyperglycémie, une résistance à l’insuline et une intolérance glucidique, l’ensemble étant communément dénommée hyperglycémie de stress.
Bien que partageant certaines similitudes, les mécanismes pathogéniques du diabète de type 2 et de l’hyperglycémie de stress sont différents. Lors du diabète de type 2, l’origine de l’hyperglycémie est l’association d’une insulinorésistance et d’un défaut de sécrétion d’insuline par les cellules β des îlots pancréatiques de Langerhans. Lors des situations d’agression aiguë, les interactions complexes entre les hormones de contre-régulation (catécholamines, hormone de croissance, cortisol) et les cytokines (essentiellement TNF α,
IL-1, IL-6) conduisent à une production hépatique excessive de glucose et à une insulinorésistance périphérique. Il est aussi très important de noter que ces interactions entre les différents systèmes de régulation et par conséquent leurs conséquences sur le métabolisme du glucose sont hautement variables au cours du temps et de l’évolution de la situation d’agression aiguë.
En effet, lors de la réponse au stress interviennent l’axe hypothalamo-hypopyso-adrénergique et le système sympatho-hypothalamo-hypopyso-adrénergique, de manière graduée selon le niveau de stress. Les concentrations de cortisol et de catécholamines sont corrélées avec le type de chirurgie, la sévérité des lésions, le score de Glasgow, les scores de gravité tels l’APACHE : le cortisol plasmatique peut être multiplié par 10 lors des situations de stress les plus sévères (représentant environ l’administration de 300 mg d’hydrocortisone par jour). Chez les patients en état de choc, les concentrations plasmatiques d’adrénaline et de noradrénaline atteignent des valeurs respectivement supérieures à 50 et 10 fois les valeurs en situation normale, en raison de la production accrue par la médullo-surrénale (la surrénalectomie supprimant la réponse adrénergique et atténuant la réponse noradrénergique au choc hémorragique).
L’augmentation de la production hépatique de glucose résulte de la néoglucogenèse, et à un moindre degré, de la glycogénolyse. La néoglucogenèse est déclenchée davantage par le glucagon que par les catécholamines ou le cortisol, tandis que la glycogénolyse est déclenchée initialement par les catécholamines puis maintenue par l’adrénaline et le cortisol. TNF α favorise la néoglucogenèse hépatique en stimulant la production de glucagon 11.
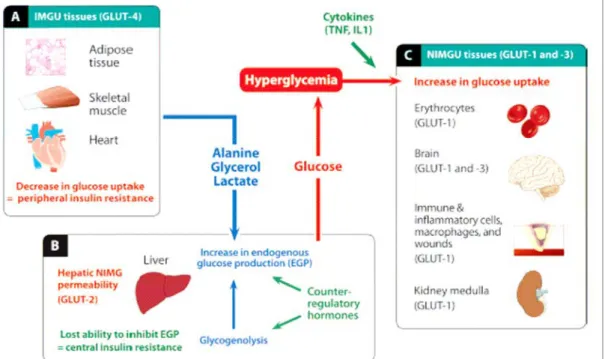
L’augmentation de l’insulinorésistance périphérique est principalement caractérisée par l’insuffisance de captation de glucose par le muscle squelettique et les adipocytes, en lien avec des modifications des voies de signalisation de l’insuline en situation de stress conduisant à une réduction de l’expression du transporteur du glucose GLUT-4 sur les membranes cellulaires. L’insulinorésistance centrale, définie comme une réduction de la capacité de l’insuline à supprimer la production hépatique de glucose, semble jouer un rôle moindre que l’insulinorésistance périphérique en situation de stress (Figure 3).
Représentation schématique de l’hyperglycémie de stress. (A) Dans les conditions de stress, les tissus qui absorbent le glucose sous l’influence de l’insuline (insulin-mediated glucose-uptake [IMGU]) deviennent résistants aux effets de l’insuline (insulinorésistance périphérique). En conséquence, le glucose est dérivé des tissus dits IMGU et les substrats impliqués dans la néoglucogenèse (alanine, glycérol, et lactate) sont libérés et utilisés par le foie. (B) Dans le foie, la production de glucose endogène provient de la glycogenolyse et de la néoglucogenèse, les deux phénomènes étant stimulés par les hormones de contre-régulation et moins inhibables par le glucose circulant (insulinoréistance centrale). (C) L’hyperglycémie qui en résulte conduit à une augmentation de l’absobtion du glucose dans les tissus dits NIMGU (non insulin-mediated glucose-uptake) sous l’influence des cytokines proinflammatoires. EGP, production de glucose endogène ; GLUT, transporteurs du glucose ; IL, interleukine ; TNF, facteur de nécrose tumorale.
Fig. 3 extrait de : Lena D, Kalfon P, Preiser JC, Ichai C. Glycemic control in the intensive care unit and during the postoperative period. Anesthesiology. Feb 2011;114(2):438-444.
Durant la période péri-opératoire, l’augmentation de la réabsorption rénale de glucose (ou réduction de la clairance rénale du glucose) a été décrite et pourrait aussi contribuer à l’hyperglycémie aiguë. Néanmoins le stress chirurgical lui-même est le facteur déclenchant le plus important via l’insulinorésistance provoquée par les cytokines et les hormones de contre-régulation. Le degré d’insulinorésistance a été corrélé à l’amplitude et à la durée du stress chirurgical, de même qu’au risque de complications postopératoires en chirurgie cardiaque ou en chirurgie abdominale lourde, indépendamment du statut diabétique du patient.
2.
L
ES ALEAS DU CONTROLE DE LA GLYCEMIE EN REANIMATION2.1. EFFETS DELETERES DE L’HYPERGLYCEMIE DES PATIENTS DE REANIMATION
Deux phénomènes se conjuguent pour expliquer les effets délétères de l’hyperglycémie aiguë des patients de réanimation : la surcharge cellulaire en glucose et les effets secondaires toxiques de la glycolyse et de la phosphorylation oxydative 9.
Le système nerveux central et périphérique, les hépatocytes, l’endothélium, les cellules immunitaires sont des tissus qui captent le glucose indépendamment de l’insuline, via des transporteurs GLUT-1, GLUT-2, GLUT-3. En raison d’un faible Km (de l’ordre de 2 mmol/L), la captation basale de glucose est virtuellement assurée dans toutes les cellules de l’organisme, sauf en cas d’hypoglycémie sévère. Dans les hépatocytes, les cellules tubulaires rénales, les cellules β des îlots pancréatiques de Langerhans, et la muqueuse gastro-intestinale, le Km élevé et le Vmax de GLUT-2 permettent au glucose d’entrer dans la cellule en équilibre avec la concentration de glucose extracellulaire. L’hyperglycémie induit par ailleurs une contre-régulation de l’expression du transporteur GLUT-1, protégeant ainsi les cellules contre une surcharge glucosée.
Il a été montré par ailleurs que les cytokines, l’angiotensine II, l’endothéline 1, VEGF, TGF β, l’hypoxie jouaient un rôle d’inhibition de cette contre-régulation en favorisant donc l’expression de GLUT-1 et GLUT-3 sur diverses membranes cellulaires telles que les cellules endothéliales, les neurones, les astrocytes, les cellules alvéolaires épithéliales, les cellules musculaires lisses. Cette réponse au stress peut dépasser la protection naturelle des cellules contre l’hyperglycémie. Ainsi, durant les états d’agression où les taux de cytokines et d’hormones de contre-régulation sont les élevés, tous les organes captant le glucose de manière indépendante de l’insuline sont théoriquement exposés à une toxicité directe du glucosé. Par contre, le muscle squelettique et le myocarde, qui nécessitent le transporteur membranaire GLUT-4 pour capter le glucose, sont relativement protégés des effets toxiques potentiels de ces taux élevés de glucose circulant.
La toxicité du glucose peut être aussi liée à la production accrue de dérivés réactifs de l’oxygène (ROS Reactive Oxygen Species) et/ou une diminution des systèmes d’épuration des ROS provoquées par la glycolyse et la phosphorylation oxydative. Le glucose subit dans le cytoplasme une glycolyse et son métabolite, le pyruvate, est transformé en acétyl-CoA avec génération d’ATP (phosphorylation oxydative). De manière concomitante, une petite quantité de superoxyde est produite au niveau de la chaîne respiratoire mitochondriale habituellement
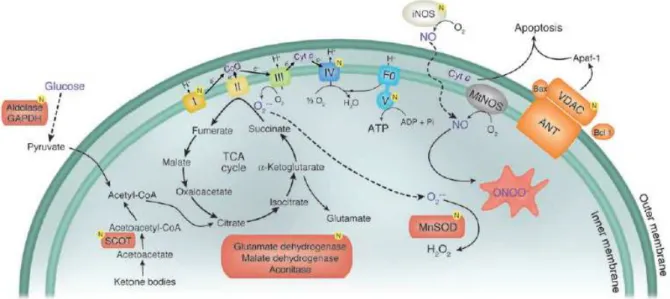
détoxifiée par la manganèse superoxyde dismutase (MnSOD). Dès lors que davantage de glucose pénètre dans la cellule et davantage de pyruvate est utilisé pour la phosphorylation oxydative, davantage de superoxyde est produit, pouvant interagir avec le NO (résultant de l’activation de iNOS en situation d’agression aiguë) pour former du peroxynitrite, à l’origine de la nitration de diverses protéines, telles les complexes mitochondriaux I et IV, MnSOD, GADPH, et VDAC (voltage-dependant anion channel). Ainsi, en cas de surcharge cellulaire de glucose, la production accrue de superoxyde et de peroxynitrite pourrait supprimer l’activité mitochondriale de transfert d’électrons, altérer la détoxification des ROS, dévier le glucose vers des voies métaboliques toxiques, et augmenter l’apoptose cellulaire 9 (Figure 4).
Représentation diaphragmatique de la production d’énergie dans la mitochondrie et génération de peroxynitrite. La glycolyse excessive et la phosphorylation oxydative peuvent résulter en une production accrue de peroxynitrite. La nitration des complexes mitochondriaux I et IV, MnSOD, GAPDH et VDAC peuvent supprimer l’activité de la chaîne mitochondriale de transfert des électrons, altérer la détoxifixation du superoxyde, dévier le glucose vers des voies toxiques et augmenter l’apoptose. Figure adaptée de Aulak KC et al. Dynamics of protein nitration in celles and mitochondria. American Journal of Physiology. Heart and circulatory physiology 12. TCA cycle, cycle de l’acide tricarboxylique ; CoQ, co-enzymze Q ; Cyt c, cytochrome c ; mtNOS, mitochondrial NO synthase ; ANT, adenine nucleotide translocase ; SCOT, succynil-CoA :3-oxacide succynil-CoA-transferase ; ONOO-, peroxynitrite ; FO, fraction de la ATP synthase mitochondriale qui « canalise » les protons à travers la membrane.
Fig. 4 extrait de : Van den Berghe G. How does blood glucose control with insulin save lives in intensive care? J Clin Invest. Nov 2004;114(9):1187-1195.
En conclusion, les concentrations élevées de glucose intracellulaire entraînent des altérations des protéines mitochondriales, la formation de ROS en raison de la déviation de la glycolyse vers des voies métaboliques accessoires (pentoses, hexosamines, polyols), ainsi que
l’exacerbation de cascades de l’inflammation, la réduction d’activité du complément, des modifications du système immunitaire inné, des altérations des fonctions endothéliales et mitochondriales hépatiques, une abolition du pré conditionnement ischémique et des glycosylations protéiques.
Sur le plan clinique, de nombreuses études observationnelles, pour certaines déjà anciennes, étayent ces aspects fondamentaux en démontrant que l’hyperglycémie à l’admission constitue un facteur prédictif indépendant de mortalité et de morbidité dans certaines pathologies, aussi bien chez les patients diabétiques (dont certains avec un diabète méconnu) que les patients non diabétiques 13-16.
Cette relation entre hyperglycémie à l’admission et pronostic défavorable est particulièrement forte chez les patients présentant un infarctus du myocarde, un accident vasculaire cérébral ischémique ou une hémorragie cérébrale. Après chirurgie cardiaque, il a été montré que l’incidence d’un épisode d’hyperglycémie supérieure à 10 mmol/L était significativement et indépendamment associée aussi bien à la survenue de médiastinite qu’à la mortalité 17. Une étude de type avant-après réalisée chez des patients diabétiques a mis en évidence une amélioration du pronostic vital après instauration d’un contrôle glycémique débuté durant l’intervention et poursuivie trois jours en postopératoire 18. A contrario, un « faible » contrôle glycémique en postopératoire après chirurgie cardiaque est associé à un pronostic défavorable. Plus récemment, une étude rétrospective conduite chez des patients non diabétiques de chirurgie cardiaque a montré qu’un contrôle glycémique strict débuté durant l’intervention et poursuivi en postopératoire était associée à une réduction significative de l’altération de la fonction rénale selon les critères RIFLE par rapport à l’absence de contrôle glycémique strict, avec notamment un moindre recours à l’hémodialyse aiguë en postopératoire 19.
Chez les patients polytraumatisés, une étude prospective conduite auprès de 738 patients a mis en évidence que l’hyperglycémie « modérée » (> 11,1 mmol/L selon le seuil retenu à l’époque) mais aussi l’hyperglycémie légère (> 7,5 mmol/L) étaient des facteurs prédictifs de mortalité, d’infection, et de prolongation de l’hospitalisation en réanimation et à l’hôpital. Plus récemment, une étude rétrospective concernant 1003 patients traumatisés consécutifs a mis en évidence une augmentation du risque de mortalité (multiplié par 2,2) dans le groupe de patients présentant une glycémie à l’admission supérieure à 11,1 mmol/L par rapport au groupe de patients dont la glycémie à l’admission était inférieure à 11,1 mmol/L. Enfin, dans une étude rétrospective plus large concernant des patients de réanimation
5234 patients non traumatisés, la relation entre hyperglycémie durant le séjour en réanimation (appréciée par l’index d’hyperglycémie déjà décrit par l’auteur) et mortalité était plus forte chez les patients traumatisés que chez les patients de réanimation chirurgicale non traumatisés.
L’hyperglycémie est donc associée à une prolongation du séjour en réanimation et à l’hôpital. Les explications suivantes ont été avancées : augmentation du risque infectieux en situation d’hyperglycémie prolongée, rôle de l’hyperglycémie dans la genèse de la polyneuropathie de réanimation 20 à l’origine d’une faiblesse des muscles respiratoires gênant ainsi le sevrage de la ventilation mécanique.
D’autres effets délétères de l’hyperglycémie ont été mis en évidence chez des patients non nécessairement hospitalisés en réanimation, pour certains reconnus depuis de nombreuses années, qu’il s’agisse d’une inhibition de la cicatrisation chez le patient diabétique 21, des effets délétères sur le myocarde 22-26, le cerveau ischémique ou traumatisé
27-29
, ou le rein 30-33 ou enfin pour prévenir l’hypercatabolisme des patients sévèrement brûlés
13, 34, 35
.
Il a aussi été démontré une relation entre hyperglycémie à l’admission dans une population générale de patients hospitalisés de manière non programmée et pronostic défavorable : dans une étude rétrospective comparant 223 patients admis avec épisode d’hyperglycémie aigu sans antécédents diabétiques et 1168 patients sans épisode d’hyperglycémie à l’admission, l’hyperglycémie à l’admission (définie par une valeur de glycémie à jeun supérieure à 7 mmol/L ou par deux valeurs supérieures à 11,1 mmol/L) était associée à une augmentation du risque de mortalité hospitalière (le plus souvent en raison de complications infectieuses ou neurologiques), à une prolongation de la durée de séjour à l’hôpital, et à un plus grand recours à une hospitalisation en réanimation. Il faut d’emblée noter que les patients diabétiques avaient dans cette étude un meilleur pronostic que les patients non diabétiques avec épisode d’hyperglycémie aiguë à l’admission.
2.2. LE CONCEPT D’INSULINOTHERAPIE INTENSIVE EN REANIMATION : LA PREMIERE ETUDE DE LOUVAIN ET SON IMPACT SUR LES PRATIQUES DES REANIMATEURS
L’étude publiée en 2001 dans le « New England Journal of Medicine » réalisée par Van den Berghe et al 36 (communément désignée comme première étude de Louvain) portant sur le contrôle strict de la glycémie obtenu à l’aide de doses élevées d’insuline (insulinothérapie intensive) chez les patients de soins intensifs s’est donc inscrite dans la continuité de très nombreuses études cliniques suggérant le rôle bénéfique de
l’insulinothérapie chez le patient non diabétique et de l’optimisation de l’insulinothérapie chez le patient diabétique. Des études expérimentales supportaient déjà l’hypothèse de la participation de l’hyperglycémie à l’intensité de la réaction inflammatoire 37, 38.
Cette étude contrôlée randomisée s’est déroulée de février 2000 à Janvier 2001, période durant laquelle ont été inclus dans un seul centre, le service de réanimation de l’université de Louvain, 1548 patients chirurgicaux (dont près de deux tiers en postopératoire de chirurgie cardiaque) sous ventilation mécanique. Les patients ont été randomisés en deux groupes, le groupe contrôle soumis à un contrôle glycémique conventionnel (insulinothérapie débutée qu’à partir d’une valeur glycémique supérieure à 11,9 mmol/L [215 mg/dL] puis ajustée pour maintenir la glycémie entre 10,0 et 11,1 mmol/L [180 à 200 mg/dL], et le groupe expérimental, soumis à une insulinothérapie intensive (insulinothérapie débutée dès que la glycémie était supérieure à 6,1 mmol/L [110 mg/dL] puis ajustée pour maintenir la glycémie au sein d’une cible considérée stricte, définie par les limites 4,4 et 6.6 mmol/L [80 à 110 mg/dL]. D’emblée, il faut noter la différence importante de traitement entre les deux groupes, tels qu’en témoignent, respectivement dans le groupe contrôle et le groupe expérimental, les pourcentages de patients recevant de l’insuline : 98.7 % vs 39.2 %, P<0,001 ; les doses quotidiennes d’insuline : 71UI/j, IQR [48-100] vs 33 UI/j, IQR [17-56], P<0,001 ; la durée de l’insulinothérapie rapportée à la durée de l’hospitalisation en réanimation : 100% vs 67% UI/j, IQR [40-100], P<0,001 ; et, parmi les patients recevant une insulinothérapie, la glycémie matinale de laboratoire : 5,7±1,0 mmol/L vs 9,6±1,8 mmol/L, P<0,001. Malgré des valeurs glycémiques légèrement inférieures à la cible dans le groupe contrôle (8,5 mmol/L pour l’ensemble des patients de ce groupe), un phénomène constamment observé dans les études suivantes portant sur le contrôle glycémique en réanimation, les deux groupes étaient donc bien séparés quant au niveau glycémique obtenu. Cette étude a montré que l’insulinothérapie intensive ajustée pour viser une cible glycémique stricte était associée, en comparaison avec un traitement conventionnel (selon les pratiques de l’époque), à une réduction de mortalité en réanimation de 8,0 % à 4.6 % (P<0,04) et une réduction de plus d’un tiers de la mortalité hospitalière de 10,9 % à 7,2 % (P=0,01). Ces effets bénéfiques étaient particulièrement importants pour les patients demeurant hospitalisés plus de cinq jours en réanimation, pour lesquels étaient mis en évidence une réduction de mortalité en réanimation de 20,2 % à 10,6% (P=0,005). De tels résultats avaient d’ailleurs conduit, à l’issue de la quatrième analyse intermédiaire trimestrielle, à une interruption prématurée de l’étude durant laquelle il était prévu d’inclure 2500 patients pour mettre en évidence une différence absolue de mortalité de
5% parmi les patients hospitalisés en réanimation plus de cinq jours et de 2% pour l’ensemble des patients.
La première étude de Louvain a mis aussi en évidence une réduction impressionnante de morbidité dans le groupe expérimental : réduction de la durée de séjour en réanimation, diminution du pourcentage de patients nécessitant la ventilation mécanique prolongée de durée supérieure à deux semaines, réduction du pourcentage de patients nécessitant l’épuration extra-rénale, réduction de 46 % des épisodes de septicémie et du pourcentage de patients nécessitant un traitement antibiotique de durée supérieure à dix jours, diminution des marqueurs de l’inflammation, réduction de l’incidence de la polyneuropathie de réanimation, diminution du nombre moyen de concentrés érythrocytaires transfusés par patient, et réduction du pourcentage de patients présentant une hyperbilirubinémie. Cette longue liste met en évidence une diminution des moyens utilisés habituellement en réanimation (ventilation mécanique, épuration extra-rénale, antibiotiques, transfusions) induite par l’insulinothérapie intensive et suggère un impact économique bénéfique majeur d’un tel traitement.
L’étude prospective, randomisée de Van den Berghe et al 36 a suscité un intérêt majeur auprès des réanimateurs et une floraison d’études et d’éditoriaux 39, 40-59, en raison essentiellement de son principal résultat, à savoir la réduction de mortalité obtenue par ce schéma thérapeutique en comparaison à une insulinothérapie « conventionnelle » (Figure 5). Rares en effet étaient les études cliniques concernant les patients de réanimation mettant en évidence une réduction de mortalité : stratégie ventilatoire basée sur une limitation du volume courant pour les patients présentant un syndrome de détresse respiratoire aiguë (SDRA) 60, stratégie orientée vers le contrôle précoce de paramètres hémodynamiques dans le traitement du sepsis sévère ou de l’état de choc septique 61, protéine C activée pour le traitement du sepsis sévère 62.
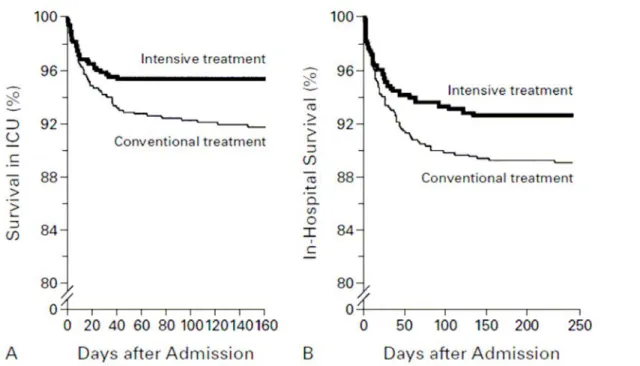
Effets de l’insulinothérapie intensive sur la mortalité en réanimation et la mortalité hospitalière. Courbes de Kaplan-Meier montrant la survie des patients sous insulinothérapie intensive ou traitement conventionnel durant l’hospitalisation en réanimation. (A) Patients vivants à la sortie de réanimation (B) Patients vivants à la sortie de l’hôpital.
Fig. 5 extrait de : van den Berghe G, Wouters P, Weekers F, et al. Intensive insulin therapy in the critically ill patients. N Engl J Med. Nov 8 2001;345(19):1359-1367.
Pour toutes ces raisons, l’étude de Louvain a été à l’origine de modifications des pratiques de la plupart des réanimateurs. Ceux-ci étaient jusqu’alors surtout craintifs de la survenue d’épisodes d’hypoglycémie 63 chez des patients de réanimation souvent sédatés, épisodes qui pouvaient ne pas être détectés et donc non corrigés à temps. Cette crainte relative à l’hypoglycémie a été transmise au personnel soignant et demeure toujours bien ancrée dans leur esprit, si bien qu’avant la publication de la première étude de Louvain, les médecins réanimateurs toléraient ainsi des glycémies plutôt élevées dépassant l0 mmol/L.
Deux années après la publication de l’étude princeps, les mêmes auteurs réalisèrent une analyse post-hoc de régression logistique multivariée des données produites chez ces 1548 patients et mirent en évidence que c’était le contrôle glycémique strict davantage que la dose quotidienne d’insuline qui était associée à la réduction de mortalité, la réduction de l’incidence de la polyneuropathie de réanimation, la réduction des bactériémies et la réduction de la réaction inflammatoire ; seulement pour la prévention de l’insuffisance rénale aiguë, la dose d’insulinothérapie était un facteur prédictif indépendant 64. De plus, les auteurs
montraient dans cette même étude une aggravation du pronostic dans un groupe de patients soumis à un contrôle glycémique intermédiaire (6,1 à 8,3 mmol/L) par rapport à un contrôle glycémique strict. Ces hypothèses relatives aux mécanismes par lesquelles l’insulinothérapie intensive avaient amélioré le pronostic de ces patients de réanimation chirurgicales étaient renforcées par une étude expérimentale réalisée par la même équipe quelques années plus tard : les auteurs ont montré que dans un modèle d’agression aiguë (brûlure) de lapin soumis soit à une normoglycémie-normoinsulinémie, soit une normoglycémie-hyperinsulinémie, soit une hyperglycémie-normoinsulinémie, soit une hyperglycémie-normoinsulinémie, la mortalité était significativement plus faible dans les deux groupes normoglycémiques57. Le maintien de la normoglycémie prévenait la dysfonction endothéliale, de même que les défaillances hépatique ou rénale. Seule l’augmentation de la fonction systolique myocardique nécessitait l’association d’une normoglycémie et d’une hyperinsulinémie ; de même, la résolution partielle de la dysfonction leucocytaire induite par l’hyperglycémie nécessitait une hyperinsulinémie.
Ainsi, progressivement, le concept d’insulinothérapie intensive en réanimation laissait la place à un concept de contrôle glycémique qui, sous l’influence d’une seule équipe, se devait de plus d’être strict.
2.3. LIMITES DE LA PREMIERE ETUDE DE LOUVAIN
La population étudiée dans cet essai clinique ne correspondait pas à une population de patients de réanimation, puisque la mortalité dans le groupe standard y était de 8,6 % bien inférieure à celle observée en réanimation (mortalité de 18 % rapportée par la base CUBREA regroupant 35 services de réanimation d’Ile-de-France, rapport 2006). En effet, comme l’indiquaient les auteurs, les patients étudiés étaient des patients chirurgicaux, pour la plupart en postopératoire de chirurgie cardiaque, et dont la durée de séjour était brève (médiane 3 jours dans les deux groupes) : les résultats obtenus ne pouvaient donc être extrapolés aux patients de réanimation médicale et à ceux présentant d’autres pathologies que celles retrouvées dans la population étudiée.
Une autre limite de l’étude de Louvain résidait dans les difficultés de mise en œuvre du contrôle glycémique strict à l’aide d’une insulinothérapie intensive. Aucun support informatique n’était utilisé, le traitement étant administré en effet sous la responsabilité d’une équipe d’infirmiers spécialisés de réanimation assistée par un médecin, tous non impliqués dans la prise en charge clinique des patients, et parfaitement aptes à appliquer des
recommandations non explicites de type « guidelines », ce qui tendait à montrer que l’intervention testée dans cette étude monocentrique ne peut être exportable dans d’autres services de réanimation.
Mais la principale critique de l’étude de Louvain porte sur les apports glucosés massifs que recevaient les patients, notamment dès le jour de l’admission (200 à 300 g de glucose intraveineux) puis sous forme de nutrition parentérale seule ou en complément de la nutrition entérale si des objectifs caloriques prédeterminés n’étaient pas atteints. Compte tenu des effets potentiellement délétères de cette charge glucosée importante à la phase initiale d’une situation d’agression aiguë, de nombreux auteurs ont par la suite évoqué que le résultat positif de cette première étude de Louvain pouvait être lié davantage à une correction d’une hyperglycémie provoquée par ces apports inadaptés que par le respect d’une cible glycémique stricte. Cette hypothèse fut par la suite corroborée par une méta-analyse mettant en évidence une corrélation entre l’effet positif de l’insulinothérapie intensive et la quantité de glucose administrée en intraveineux 65. Il faut aussi noter que la même équipe de Louvain, une dizaine d’années plus tard, mit en évidence, chez des patients de réanimation non à risque de dénutrition et pour lesquels les objectifs caloriques recommandés ne pouvaient pas être assurés par la seule alimentation entérale, que l’introduction retardée (à partir du huitième jour de réanimation) d’une alimentation parentérale de complément ou exclusive selon les cas, était associée à une diminution du risque de mortalité hospitalière par rapport à une alimentation parentérale débutée dès l’admission 66. La conception de cette étude justement par l’investigateur principal de la première étude de Louvain, et son résultat, accroissent la validité de cette réserve majeure.
Finalement, examiné à distance de sa publication, le principal apport de la première étude de Louvain, est probablement la disqualification définitive de la tolérance prolongée durant une hospitalisation en réanimation de niveaux glycémiques aussi élevés (supérieurs à 11,1 mmol/L [180 mg/dL] tels que ceux pratiqués dans le groupe contrôle.
2.4 . LE CONCEPT DE CONTROLE GLYCEMIQUE STRICT : LA DEUXIEME ETUDE DE LOUVAIN
Pour tenter de répondre à la critique de la première étude de Louvain relative au profil des patients inclus, une deuxième étude a été conduite par la même équipe auprès de patients de réanimation médicale selon un schéma, prospectif randomisé en ouvert, avec comme critère de jugement principal cette fois la mortalité hospitalière, et non plus la mortalité en réanimation 67. Les cibles glycémiques définissant les groupes contrôle et
interventionnel étaient exactement identiques à celles de la première étude de Louvain. Durant cette étude conduite à nouveau dans un seul centre, 1200 patients ont été inclus entre mars 2002 et mai 2005. Les résultats sont plus mitigés puisque aucune différence significative de mortalité hospitalière n’a été mise en évidence entre les deux groupes de patients (40% dans le groupe contrôle vs 37,3 % dans le groupe interventionnel, P=0.33). De plus, l’incidence d’au moins un épisode d’hypoglycémie sévère était nettement supérieure dans le groupe expérimental par rapport au groupe contrôle (18,7 % vs 3,1 %, P<0.001). La consultation du supplément électronique permettait de plus de constater que la différence d’incidence d’hypoglycémie sévère était encore plus marquée dans le sous-groupe de patients hospitalisés trois jours ou plus en réanimation (25,1 % vs. 3,9 %, P<0.001).
Malgré le fait qu’un des critères d’inclusion était l’estimation à l’admission par le médecin en charge du patient d’une nécessité d’hospitalisation en réanimation au moins jusqu’au troisième jour calendaire, 433 patients ont présenté une durée d’hospitalisation inférieure à trois jours et seulement 767, soit moins de deux tiers, sont demeurés hospitalisés en réanimation au moins trois jours, ce que les auteurs ont interprété comme une difficulté à prévoir la durée d’hospitalisation en réanimation lors de l’admission. Il est important de noter que la mortalité dans ce sous-groupe de patients avec une durée d’hospitalisation en réanimation inférieure à 3 jours était plus importante dans le bras insulinothérapie intensive en comparaison avec le bras traitement conventionnel, ce qui a conduit certains experts à proposer une cible glycémique plus élevée lors de la phase initiale de l’hospitalisation en réanimation afin, d’une part, d’éviter d’exposer les patients hospitalisés durant moins de trois jours en réanimation à un contrôle glycémique agressif, et d’autre part, de n’appliquer un contrôle glycémique strict qu’aux patients qui auraient le plus de chances d’en bénéficier.
Les auteurs ont néanmoins conclu aux effets bénéfiques d’un contrôle strict de la glycémie des patients de réanimation médicale durant leur hospitalisation en réanimation, en raison, d’une part, d’une analyse - prévue dans le plan d’analyse statistique initial - chez les patients hospitalisés au moins trois jours mettant en évidence une réduction de mortalité hospitalière dans le groupe « Insulinothérapie intensive » par rapport au groupe contrôle de 52.5 % à 43 %, et d’autre part d’une réduction de morbidité dans le groupe expérimental pour l’ensemble des patients inclus (réduction de l’incidence de la survenue en réanimation d’une insuffisance rénale aiguë, accélération du sevrage de la ventilation mécanique, réduction de la durée de séjour en réanimation et réduction de la durée de séjour à l’hôpital).
Ces conclusions ont été renforcées par les mêmes auteurs qui ont rassemblé les données de leurs deux études contrôlées randomisées 68. Ces analyses post-hoc réalisées dans une population de 2748 patients ont montré qu’indépendamment des apports glucosés parentéraux, l’insulinothérapie intensive par rapport à un traitement conventionnel réduisait la mortalité hospitalière de 23,6 % à 20,4% (P=0,04) pour l’ensemble des patients et de 37,9% à 30,1% (P=0,002) pour les patients avec une hospitalisation en réanimation de durée supérieure ou égal à trois jours, et sans différence de mortalité pour les patients avec hospitalisation en réanimation de durée inférieure à trois jours. De plus les auteurs ont mis en évidence, par rapport à un groupe de patients défini par une glycémie matinale de laboratoire moyenne comprise entre 6,1 et 8,3 mmol/L (110 et 150 mg/dL), une augmentation de mortalité dans le groupe pour lequel la glycémie matinale de laboratoire moyenne était supérieure à 8,3 mmol/L et une diminution de la mortalité dans le groupe pour lequel la glycémie matinale de laboratoire moyenne était inférieure à 6,1 mmol/L.
Ainsi, à la suite de cette deuxième étude de Louvain, malgré un résultat négatif, l’objectif d’une cible glycémique stricte a continué de diffuser dans les services de réanimation.
2.5. LES AUTRES ETUDES CONTROLEES RANDOMISEES PORTANT SUR LE CONTROLE GLYCEMIQUE STRICT
Dès la parution de la première étude de Louvain, d’autres équipes ont souhaité conduire des études, le plus souvent multicentriques, portant sur le contrôle glycémique en réanimation, afin de confirmer ou d’infirmer ces résultats positifs. Si la méthodologie et la population de patients étudiées diffèrent selon les études, notamment en termes de répartition par type de patient, médical ou chirurgical, en termes de sévérité des patients à l’inclusion, en termes de cible glycémique visée dans le groupe contrôle, ou bien en termes de proportion des apports caloriques sous forme intraveineuse, toutes ces études avaient en commun d’appliquer au groupe expérimental la même cible glycémique stricte utilisée durant les deux études de Louvain : 4,4 à 6,1 mmol/L.
La plupart de ces études échouèrent à démontrer l’impact positif du contrôle glycémique strict sur la mortalité 69-72. Parmi celles-ci, il convient d’analyser plus précisément deux études multicentriques européennes, interrompues prématurément pour des raisons différentes et largement citées par la suite, l’étude VISEP 70 et l’étude Glucontrol 72.