HAL Id: tel-01087277
https://tel.archives-ouvertes.fr/tel-01087277
Submitted on 25 Nov 2014HAL is a multi-disciplinary open access
archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Evaluation de l’activité oestrogenique de contaminants
et développement d’un bio-récepteur d’affinité pour la
détection d’une xéno-hormone
Aziza Ibn Hadj Hassine
To cite this version:
Aziza Ibn Hadj Hassine. Evaluation de l’activité oestrogenique de contaminants et développement d’un bio-récepteur d’affinité pour la détection d’une xéno-hormone. Autre. Ecole Nationale Supérieure des Mines de Saint-Etienne, 2014. Français. �NNT : 2014EMSE0740�. �tel-01087277�
NNT :
2014 EMSE 0740
THÈSE
présentée par
Aziza IBN HADJ HASSINE
pour obtenir le grade de
Docteur de l’École Nationale Supérieure des Mines de Saint-Étienne
Spécialité : Sciences et Génie de l’Environnement
EVALUATION DE L’ACTIVITE OESTROGENIQUE DE
CONTAMINANTS ET DEVELOPPEMENT D’UN BIO-RECEPTEUR
D’AFFINITE POUR LA DETECTION D’UNE XENO-HORMONE
soutenue à Alès, le 23 avril 2014 Membres du jury
Président :
Rapporteurs : Loïc BLUM Professeur, Directeur de l'ICBMS, Université de
Lyon I
Jean-Louis MARTY Professeur, Université de Perpignan Via Domitia,
Examinateur(s) : Serge CHIRON Directeur de recherche, Université de Montpellier II
Directeur(s) de thèse : Catherine GONZALEZ Professeur, Ecole des mines d’Alès
Ingrid BAZIN Chargé de recherche, Ecole des mines d’Alès Jacques BOURGOIS Professeur Emérite, Ecole des Mines de
Remerciements
Je tiens à remercier le Professeur Catherine Gonzalez, mon directeur de thèse, de m’avoir accueilli au sein de son équipe pour mon stage de master 2 et ensuite pour ma thèse. Vous avez été toujours présente lors des moments clefs de cette thèse. Merci de votre confiance et votre soutien tant sur le plan professionnel que personnel.
Je tiens à exprimer ma sincère reconnaissance au Dr Ingrid Bazin, Chargé de recherche à l’Ecole des mines d’Alès, qui a également joué un rôle important pendant mon master et durant toute ma thèse. Je tiens à lui exprimer ma profonde gratitude pour sa disponibilité de chaque instant, pour son aide précieuse et ses conseils avisés durant les expérimentations et la rédaction de ce manuscrit. Merci Ingrid !
Je tiens à remercier également le Professeur Miguel Lopez-Ferber, Directeur du LGEI de l’Ecole des mines d’Alès, de m’avoir permis d’effectuer ma thèse au sein de son laboratoire.
J’exprime mes sincères remerciements au Professeur Loïc Blum, Directeur de l'ICBMS, Université de Lyon I et au Professeur Jean-Louis Marty, Laboratoire IMAGES EA, Université de Perpignan Via Domitia, pour avoir accepté d’être rapporteurs de ce manuscrit et d’apporter un éclairage pertinent sur ce travail de recherche. Je souhaite également adresser mes remerciements à Mr Serge Chiron, Directeur de recherche, Laboratoire HSM, Université Montpellier II et à Mr Jacques Bourgois, Professeur Emérite, Centre SPIN-Département GSE, Ecole Nationale Supérieure des Mines de Saint Etienne, pour accepter de juger ce manuscrit et participer au jury de ma soutenance.
Je remercie tout naturellement mes collègues de l’équipe EcoDiag qui m’ont aidé tout au long de cette thèse et sans qui ce travail ne serait pas ce qu’il est. Je remercie particulièrement Sylvie, Roro, Christine et Mumu.
Je remercie également tous les autres collaborateurs avec qui j’ai pu travailler durant ma thèse ainsi que les membres du LGEI que je n’ai pu citer ici.
A Andrey. Tu as été un super collègue et ami tout au long de ce travail de thèse. Chaque jour j’ai pu compter sur ton aide précieuse. Au moment où j’écris ces remerciements, je me remémore tous les moments qu’on a pu passer ensemble depuis l’été 2011. Je te souhaite plein de bonheur et de réussite pour la suite.
A Andrey (toujours le même !), Romain, Imtiaz, Rita et Nibal que j’ai appris à connaître et à apprécier durant ces 3 années de thèse. Merci pour votre aide et votre soutien dans les moments de doute. Le travail au sein du laboratoire m’a permis de faire votre rencontre et je n’oublierai pas les bons moments que nous avons passé ensemble. A bientôt !
A mon Papou. Cette thèse c’est aussi la tienne.
Depuis le début chaque jour, chaque instant tu as été là pour me soutenir. Tu as été là quand le doute s’installait et tu as toujours eu ton oreille attentive pour m’écouter te raconter les derniers résultats du jour. Je n’aurai jamais assez de ces quelques lignes dans ce manuscrit pour te remercier pour ton amour. Je crois savoir que tu es content que tout cela s’achève enfin.
Table des matières
Liste des figures... iv
Liste des Tableaux ... v
Liste d’abréviations ... vi
Introduction ... 1
Chapitre I : Synthèse bibliographique ... 2
I. Contrôle de la qualité de l’eau et des rejets : micropolluants à activité endocrinienne et législation européenne... 6
II. Mécanismes de la perturbation endocrinienne ... 12
A. Fonctionnement du système hormonal ... 12
B. Récepteurs stéroïdiens sexuels ... 14
1) Organisation structurelle ... 14
2) Récepteur aux oestrogènes : ER ... 16
3) Mécanismes d’action du récepteur aux oestrogènes ... 16
III. Définition des perturbateurs endocriniens : un débat d’actualité ... 18
A. Mécanismes de la perturbation endocrinienne ... 19
B. Xéno-hormones et récepteur aux oestrogènes ... 21
C. Cas particulier : les xéno-estrogènes et le récepteur à la dioxine ... 25
D. Action à faible dose et en mélange de perturbateurs endocriniens ... 29
IV. Perturbateurs endocriniens : substances d’origines multiples ... 31
A. Hormones ... 32
1) Hormones naturelles ... 32
2) Hormones synthétiques ... 33
B. Xéno-hormones d’origine naturelle ... 33
1) Phyto-oestrogènes ... 33
2) Myco-oestrogènes ... 33
C. Xéno-hormones d’origine anthropique ... 34
1) Xéno-hormones d’origines industrielles ... 34
2) Produits de consommation courante et d’hygiène corporelle, les parabènes ... 37
V. Evaluation des altérations des écosystèmes en lien avec la présence des perturbateurs endocriniens... 39
A. Effet sur les invertébrés ... 39
B. Poissons/Amphibiens ... 40
D. Observations chez l’Homme ... 43
VI. Perturbateurs endocriniens dans les effluents et les milieux aquatiques ... 44
A. Présences des parabènes ... 45
B. Présence des mycotoxines ... 46
C. Autres perturbateurs endocriniens ... 47
VII. Détection des perturbations endocriniennes et des xéno-hormones. ... 48
A. Détection de la perturbation endocrinienne de contaminants et d’effluents ... 48
1) Bioessais pour détecter la perturbation endocrinienne ... 48
a) Méthodes in vivo ... 48
b) Méthodes in vitro ... 49
b.1. Tests de liaison au récepteur. ... 49
b.2 Tests de prolifération cellulaire. ... 49
b.3 Dosage de l’activité oestrogèno-mimétique; le Yeast Estrogen Screen (YES) et autres tests utilisant le gène rapporteur. ... 50
2) Immunoessais pour détecter la perturbation endocrinienne ... 52
B. Détection des xéno-hormones avérées ... 55
1) Méthodes physico-chimiques ... 55
2) Bioessais, méthodes immunochimiques ... 56
3) Détection de la perturbation oestrogénique dans l’environnement et les eaux usées via le Yeast Estrogen Screen (YES) ... 58
C. Biocapteurs pour le suivi des PE dans l’environnement ... 61
1) Définition... 61
2) Bio-récepteurs d’affinité ... 63
3) Bio-récepteurs métaboliques et cellulaires ... 65
4) Application des biocapteurs pour le contrôle environnemental ... 65
Chapitre II : Résultats et discussions ... 69
I. Observation et détection des effets biologiques des xéno-oestrogènes ... 70
A. Observation des effets biologiques sur les écosystèmes côtiers tunisiens : étude des déformations squelettiques chez Aphanius faciatus. ... 71
B. Détermination de l’activité oestrogénique d’échantillons réels et de contaminants par le Yeast Estrogen Screen (YES) ... 84
1. Activité oestrogénique d’effluents de stations d’épuration du Sahel tunisien et présence de parabènes ... 84
2. Activité oestrogéniques de colorants alimentaires dans le Yeast Estrogen Screen (YES) ... 102
3. Activité oestrogénique de colorants textiles dans le Yeast Estrogen Screen (YES)
110
II. Développement d’un nouveau bio-récepteur d’affinité pour la détection des xéno-oestrogènes 118 Conclusion générale et perspectives ... 126 Références bibliographiques ... 131
Liste des figures
Figure 1 : Système endocrinien chez l’homme ... 12
Figure 2 : Organisation structurelle des récepteurs stéroïdiens ... 15
Figure 3: Différentes voies de signalisation cellulaire du récepteur ER et de l’oestradiol. . ... 17
Figure 4 : Modes d’action des perturbateurs endocriniens ... 20
Figure 5 : Activation illégitime du récepteur des oestrogènes ... 21
Figure 6 : Voies de signalisation des oestrogènes médiées par les récepteurs membranaires et nucléaires. ... 25
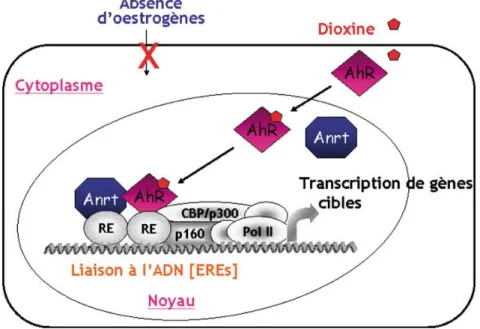
Figure 7: Structure et mécanismes moléculaires du récepteur nucléaire AhR. ... 26
Figure 8 : Intéraction de la signalisation du récepteur AhR ... 27
Figure 9:Activation illégitime de la voie de signalisation du ER (récepteur des oestrogènes) par le récepteur de la dioxine activé AhR. ... 28
Figure 10: Interaction de la signalisation des dioxines avec les oestrogénes. ... 29
Figure 11 : Quelques exemples de xéno-hormones ... 35
Figure 12 : Déformation de la colonne vertébrale chez des médakas âgés de 10 semaines... 42
Figure 13 : Substances à action endocrinienne dans les eaux résiduaires d’une station d’épuration allemande ... 47
Figure 14 : Principe du YES (Yeast Estrogen Screen) ... 51
Figure 15 : Schéma présentant les 3 principes utilisés pour la technique ELISA ... 54
Figure 16 : Schéma du principe de fonctionnement d'un biocapteur ... 61
Figure 17 : Représentation des différents types de bio-récepteurs ... 62
Figure 18 : Localisation géographique des sites d’échantillonnage ... 72
Liste des Tableaux
Tableau 1 : Substances prioritaires de la DCE et leurs effets endocrinniens. ... 9
Tableau 2 : Relation entre les hormones endocrines et les réponses correspondantes ... 13
Tableau 3 : Récepteurs des hormones stéroïdes ... 15
Tableau 4 : Cibles des perturbateurs endocriniens ... 20
Tableau 5 : Structures des trois catégories de ligands du récepteur aux oestrogènes humains. ... 22
Tableau 6 : Classes de perturbateurs endocriniens. Archives des maladies professionnelles et de l’environnement ... 32
Tableau 7 : Sources de perturbateurs endocriniens entrant dans les eaux environnementales ... 45
Tableau 8 : Comparaison des limites de détection, des valeurs de EC50 et des durées des essais pour les différents tests in vitro. ... 52
Tableau 9 : Techniques d'analyse utilisées pour la quantification des différentes classes de perturbateurs endocriniens dans l'environnement aquatique ... 55
Tableau 10 : Exemples de kits commerciaux. ... 57
Tableau 11 : Niveaux des EEQ trouvés dans différentes matrices environnementales analysées dans de nombreux pays en utilisant le test in vitro YES ... 60
Tableau 12 : Biocapteurs électrochimiques pour l'analyse environnementale. ... 63
Tableau 13 : Biocapteurs électrochimiques pour l'analyse environnementale. ... 66
Tableau 14 : Liste des polluants organiques analysés par les systèmes RIANA ou AWACSS ... 68
Tableau 15 : Activité oestrogénique exprimée en équivalent oestradiol (EEQ) ... 87
Liste d’abréviations
Abs : anticorpsAChE : Acétylcholinestérase Ags : antigènes
AhR : récepteur de la dioxine et des hydrocarbures aromatiques AMPc : adénosine mono phosphate cyclique
PAL : phosphatase alcaline AP : Alkylphénols
APCI : Ionisation Chimique à Pression Atmosphérique APE : Alkylphénols Polyéthoxylates
AR : récepteurs des androgènes
Arnt : Aryl hydrocarbon Receptor Nuclear Translocator BaP : Benzo(a)pyrène
BChE : Butyrylcholinesterase
bHLH-PAS : Basic Helix-loop-helix/Per-Arnt-Sim BLYES : Bioluminescent Yeast Assay
BPA : bisphénol A BuP : butyl parabène BzP : benzyl parabène
CEVAM : Centre européen pour la validation de méthodes alternatives CFC : chlorofluocarbones
CIRC : Centre international de recherche sur le cancer CMR : Cancerigène, Mutagène, Reprotoxique
CPRG : chlorophénol rouge-beta-D-galactopyranoside DAD : détection à barrette de diodes
DBD : DNA Binding Domain DCE : Directive Cadre sur l’eau DDD : dichlorodiphényldichloroéthane 4,4’-DDE : 4,4'- Dichlorodiphényldichloroéthane DDT : 4,4'-(2,2,2-trichloroethane-1,1-diyl)bis(chlorobenzene) DES : diéthylstilbestrol DHEA : déhydroépiandrostérone DHT : dihydrotestostérone DON : déoxynivalénol
DRE : éléments de réponse à la dioxine E1 : oestrone
E102 : tartazine E127 : érytrosine B E2 : oestradiol E3 : oestriol
E310 : propyl gallate
EAP : éthoxylates d’alkylphénol
EDSTAC : Agence de protection de l’environnement des USA EE2 : éthinylestradiol
EEQ : Equivalent Estradiol
EFSA : Autorité européenne de sécurité des aliments EGF : epidermal growth factor
ELISA : Enzyme Linked ImmunoSorbent Assay ENP : éthoxylates de nonylphénol
EOP : éthoxylates d’octylphénol
ER α, β et γ : récepteur aux oestrogènes α, β et γ
ER-CALUX : Chemical-Activated LUciferase gene eXpression ceU bioassay system ERE : élément de réponse aux oestrogènes
ESI : Ionisation Electrospray EtP : éthyl parabène
FI-lA : Flow-injection immunoassay GC : chromatographie en phase gazeuse GFP : green fluorescent protein
GR : récepteurs glucocorticoïdes HAP : hydrocarbures polyaromariques hER : récepteur humain des estrogène HRE : Hormone Receptor Element
HRMS : spectrométrie de masse haute résolution IC : chromatographie ionique
IGF-1 : insulin-like growth factor ITP : Inositol triphosphate
IUPAC : International Union of Pure and Applied Chemistry LBD : Ligand Binding Domain
LC : chromatographie en phase liquide LH : hormone lutéinisante
LOD : limite de détection LOQ : limite de quantification
LYES : Lyticase assisted Yeast Estrogen Screen MAP kinase : Mitogen-activated protein kinase MeP : méthyl parabène
MIP : Polymères à Empreinte Moléculaire MPA : medroxyprogesterone acetate MS : spectrométrie de masse
MS/MS : spectrométrie de masse en tandem NLS : localisation nucléaire
NP : nonylphénol
NQE : normes de qualité environnementale OMS : Organisation Mondiale de la Santé OTA : ochratoxine A
PAE : Esters de l’acide phtalique PBDE : Ethers diphényles polybromés PCB : polychlorobiphényles
PCDD : Dibenzo-p dioxines polychlorées PCDF : Dibenzofuranes polychlorés PE : perturbateur endocrinien
POP : polluants organiques persistants
PPSP : produits pharmaceutiques et de soins personnels PR : récepteurs de la progestérone
PrP : propyl parabène
RIA : Radioimmunoasay
RNs : récepteurs nucléaires stéroïdiens RXR : récepteur X des rétinoïdes
SERM : Selective Estrogen Receptor Modulator SPR : Surface plasmon résonance
STEP : Station d'épuration des eaux usées T : testostérone
TBBA :Tetrabromobisphénol A TBT : tributylétain
ThR : récepteur de l'hormone de la thyroïde
TIRF : Total internal reflection fluorescence microscope
UV : ultra-violet Vg : vitellogénine
XRE : éléments de réponse aux xénobiotiques YES : Yeast Estrogen Screen
Introduction
Depuis plusieurs années, les préoccupations concernant les effets de la pollution, générée par les activités anthropiques, sur la santé humaine et animale s’immiscent de plus en plus au cœur des débats politiques et scientifiques. En particulier, la prise de conscience des autorités sanitaires, des gouvernements et du grand public, concernant la présence de substances environnementales susceptibles de perturber le système endocrinien n’a cessé de progresser depuis le début des années 1990. D’origine naturelle ou synthétique, les perturbateurs endocriniens (PE) peuvent altérer le fonctionnement du système hormonal des animaux et des Hommes. Ces substances pourraient donc induire des effets néfastes sur la santé d’un organisme, de sa descendance, ou d’une population, et constituer un danger sanitaire qui est encore aujourd’hui mal évalué.
Même si les effets néfastes des PE sur la santé ne sont que soupçonnés, des programmes de recherche et des groupes de travail ont été mis en place afin d’évaluer l’étendue des problèmes relatifs aux PE, en vue de développer des stratégies de prévention et d’intervention. Ainsi, l’OMS (Organisation Mondiale de la Santé) a chargé l’IPCS (International Programm on Chemical Safety) de préparer un rapport décrivant l’évaluation globale de la littérature scientifique sur les PE. L’US-EPA (Agence de Protection Américaine de l’Environnement) et l’OCDE (Organisation de Coopération et de Développement Economiques) ont également établi des programmes ayant comme objectifs : (i) d’accroître l’échange d’informations et la coordination des activités de recherche relatifs aux PE; (ii) d’élaborer et de réviser les lignes directrices pour les essais visant à détecter les PE; (iii) de développer des tests de criblage robustes, reproductibles et pertinents, capables de détecter les composés ayant une activité œstrogénique, œstrogénique, androgénique ou anti-androgénique; (iv) et d’harmoniser les méthodes de caractérisation des dangers et des risques. De ces travaux sont issues les premières recommandations ("Guidelines") 407 de l’OCDE datant de 1995 qui portent sur l’étude des effets des diverses substances chimiques sur un modèle animal (rongeur). Cependant, ces tests ne sont toujours pas homologués pour détecter les effets des PE du fait de leur complexité d’actions (courbes dose-réponse spécifiques, impact des mélanges).
De ce fait, surveiller les risques liés aux substances chimiques, en particulier les polluants qui provoquent des perturbations endocriniennes, est un des enjeux importants de la
mise en œuvre des réglementations. En témoigne le récent rapport de l'office parlementaire du sénat qui affirme que « Dans tous les cas, l'adoption de tests reconnus est un point fondamental. Il permettra de faire évoluer la législation européenne en la matière et de prendre pleinement en compte l'enjeu des perturbateurs endocriniens pour la santé et l'environnement par les agences compétentes. » ( http://www.senat.fr/rap/r10-765/r10-76519.html). Il est également recommandé de poursuivre la démarche d’investigation sur les effets des xéno-hormones à moyen et long terme.
Aujourd'hui, le sujet des perturbateurs endocriniens reste largement focalisé sur les problèmes de reproduction, notamment chez certaines espèces de poissons, et les problèmes liés à certains cancers chez l’homme. Classiquement, un perturbateur endocrinien est « une substance exogène qui interfère avec la synthèse, la sécrétion, la libération, le transport, le métabolisme, la fixation, l’action ou l’élimination des hormones naturelles du corps responsables de l’homéostasie, de la reproduction et du développement ». Ces substances chimiques d'origine naturelle ou artificielle étrangères à l'organisme, pouvant interférer avec l’organisme, sont dits xéno-hormones. Parmi ces dernières, se retrouvent les xéno-estrogènes qui miment l’effet de l’oestradiol et qui peuvent se lier aux récepteurs cellulaires de la même façon que les oestrogènes. Ces xéno-estrogènes, de nature très variée, peuvent être d’origine naturelle (phyto-oestrogène, myco-estrogène) et d’origine anthropique (pesticides, produits d’origine industrielle, produits pharmaceutiques et de soin corporels,…). Ces substances ont des effets oestrogéniques démontrés via des tests in vitro et in vivo.
Les tests in vitro sont basés sur des cellules de mammifères, des levures génétiquement transformées répondant spécifiquement à une perturbation oestrogénique. Les tests in vitro les plus utilisés sont l’E-screen (cellule MCF7 exprimant le récepteur alpha aux oestrogénes) et le Yeast Estrogen Screen (levure Saccharomyces cerevisiae transfectée avec le gène codant pour le récepteur humain aux œstrogènes). Cependant, un problème majeur, dans l'utilisation de ces tests in vitro pour analyser les échantillons environnementaux, est la présence de composés inhibiteurs/cytotoxiques. Ces échantillons sont, en effet, souvent contaminés par des substances autres que les xéno-estrogènes qui peuvent interférer avec la croissance et la viabilité des cellules animales. En revanche cette cytotoxicité est moindre pour les levures, ce qui leur confère une meilleure fiabilité pour le dosage de l’activité oestrogéno-mimétique des échantillons environnementaux (eaux usées, eaux de surface).
Concernant le dosage de l’activité oestrogénique par des tests in vivo, les modèles vivants utilisés sont principalement des rongeurs (poids des organes génitaux) et des poissons (taux de production de la protéine vitellogénine, biomarqueur de l’activité oestrogénique). Les essais in vivo présentent l’avantage de mesurer l’impact réel de la perturbation (effet additif, synergique, inhibiteur etc..) sur des organismes vivants. Ils permettent d’intégrer le métabolisme et donc d’étudier la dégradation d’un produit actif ou la transformation d’un produit inactif en produit actif. Deux types de tests in vivo existent pour mesurer une activité oestrogénique ou androgénique : le test utérotrophique chez la souris ou la rate et le test de Hershberger chez le rat.
Concernant la préservation de la qualité des milieux aquatiques, la DCE (2000) a fixé un certain nombre de polluants (substances prioritaires) à surveiller en précisant des normes de qualité environnementales en fonction des masses d’eau. Cependant, la DCE ne prend pas en compte la mesure des effets potentiels des substances (notamment l’effet oestrogénique) même si ces substances sont classées CMR (Cancérogènes, Mutagènes et toxiques pour la Reproduction) et PBT (Persistantes, Bio-accumulables et Toxiques).
La détection de ces substances prioritaires s’effectue classiquement par des méthodes d’analyse physico-chimique de laboratoire qui répondent aux exigences des seuils de qualité environnementale mais ne sont pas compatibles avec des systèmes de gestion et d’alerte sur site. Par contre, dans une optique d’anticipation de pollutions accidentelles ou de dégradation du milieu aquatique, des systèmes tels que les biocapteurs sont tout à fait pertinents et peuvent apporter des informations complémentaires aux mesures réalisées en laboratoire. Ces dernières années, les recherches portent sur le développement de biocapteurs pour l’analyse de polluants dans des matrices environnementales (triazines, isoproturon, DDT et ses dérivés, bisphénol A, nonylphénol,…). Ces biocapteurs associent un biorécepteur, espèce biologique permettant la reconnaissance sélective de la molécule cible, et un transducteur permettant de détecter et/ou de quantifier les substances dans les eaux (eaux potables, eaux de surface notamment).
Dans ce contexte, ce travail de thèse aborde plusieurs approches permettant d’évaluer la perturbation oestrogénique (observation in vivo et mesure in vitro avec le YES) et de détecter des xéno-estrogènes spécifiquement (biorécepteur affine). Cette thèse s’articule autour de 3 volets d’étude :
① Un premier volet porte sur l’investigation des effets des xéno-hormones sur les écosystèmes en identifiant, tout d’abord, l’impact des perturbateurs oestrogéniques sur les malformations squelettiques observées chez une espèce de poisson autochtone (aphanius faciatus) du Golfe de Gabes (Tunisie). Parallèlement, les principaux polluants chimiques (métaux, HAP) liés potentiellement à cette perturbation ont été recherchés afin de corréler leur présence aux activités anthropiques (urbaines, agricoles et industrielles) présentes sur le site étudié.
② Un deuxième volet se focalise sur la quantification par HPLC de parabènes, xéno-oestrogènes connus, soupçonnés de provoquer certains cancers, et sur l’évaluation de leurs effets en utilisant le Yeast Estrogen Screen (YES). Le YES permet d’évaluer l’activité oestrogénique des matrices complexes comme les effluents de station d’épuration. La distribution des parabènes entre différents compartiments/fractions (eau, boues, MES) et l’activité oestrogénique au niveau de stations d'épuration tunisiennes ont été analysées en combinant des évaluations chimiques et biologiques.
Dans l’optique de mettre en évidence les effets oestrogéniques de substances d’origines industrielles, d’autres composés (colorants textiles et alimentaires) ont été testés en utilisant le YES. En effet, ces colorants sont susceptibles d’être présents dans des effluents industriels et peuvent impacter le milieu récepteur, notamment pour les pays où l’industrie textile est fortement développée (Pays du Maghreb, Inde,…).
③ Enfin, la dernière partie du manuscrit est consacrée à la mise au point d’un outil bio-analytique de substance spécifique. Cette partie est novatrice car elle porte sur le développement d’un bio-récepteur de nature peptidique pour détecter des myco-oestrogènes, comme l’ochratoxine A. Cette mycotoxine étant difficilement immunogène, il n’existe que de rare anticorps spécifiquement dirigés contre cette molécule. Les (bio)récepteurs alternatifs développés jusqu’à présent sont des aptamères ADN et des MIP (polymère à empreinte moléculaire) qui ont une affinité pour la mycotoxine.
Ce manuscrit est classiquement structuré et comprend :
- Un premier chapitre présentant une synthèse bibliographique qui décrit les mécanismes de la perturbation endocrinienne, les perturbateurs endocriniens (xéno-hormones d’origine naturelle et anthropique), l’état de l’art sur les altérations des écosystèmes dues aux
PE et les différentes méthodes de détection des effets et des xéno-hormones (effets oestrogéniques, biocapteurs). Un focus sur les parabènes, les mycotoxines et les colorants permet d’établir un constat sur leur présence dans les eaux.
- Un second chapitre basé sur 5 publications ouvre sur une discussion à partir des principaux résultats concernant la mesure des effets oestrogéniques in vivo et in vitro et le développement d’un biorécepteur affine pour l’ochratoxine A. Par conséquent, la partie « matériel et méthodes » est incluse dans chacun des articles.
- Une conclusion met en valeur les résultats majeurs et aborde les perspectives de ce travail de thèse.
I.
Contrôle de la qualité de l’eau et des rejets : micropolluants
à activité endocrinienne et législation européenne.
Il est généralement admis qu’un polluant est «un altéragène (c'est-à-dire un composé étranger aux cycles vitaux des organismes ou xénobiotiques) biologique, physique ou chimique, qui au-delà d'un certain seuil, et parfois dans certaines conditions (potentialisation), développe des impacts négatifs sur tout ou partie d'un écosystème ou de l'Environnement en général» (AFNOR). On parlera de micropolluants lorsque ces substances sont retrouvées à des concentrations de l’ordre du microgramme par litre, pouvant diffuser au sein de différents compartiments des écosystèmes et impacter les organismes vivants même à de faibles teneurs.
Les polluants chimiques peuvent se diviser en 2 groupes :
- Les polluants organiques comme les pesticides (organochlorés tel que le DDT), les polychlorobiphényles (PCB), les hydrocarbures polyaromatiques (HAP), les dioxines et furannes, les chlorofluocarbones (CFC) et les phtalates.
- Les polluants inorganiques comme les métaux. Les plus fréquemment rencontrés dans l’environnement sont le cadmium, l’arsenic, le cuivre, le plomb etc…
Les micropolluants présents dans l’eau correspondent à une multitude de composés dont les effets sur les organismes vivants peuvent être toxiques à de très faibles concentrations (inférieures ou de l’ordre du microgramme par litre). La contamination des eaux de surface par ces polluants est due essentiellement à des rejets directs (égouts non raccordés à un système d’épuration, par exemple), à un dysfonctionnement des stations d’épuration, à des rejets industriels ou au ruissellement de l’eau sur des surfaces contaminées. Les eaux souterraines sont, quant à elles, potentiellement contaminées suite à l’infiltration des micropolluants dans le sol et le sous-sol. On distingue les apports ponctuels où les sources de pollution sont clairement identifiées (rejets industriels, pollution accidentelle, rejets des eaux usées domestiques), des sources diffuses liées principalement aux activités agricoles, touristiques et aux retombées atmosphériques. Les effets des micropolluants sur les écosystèmes aquatiques sont très variables, car ils ne dépendent pas uniquement du niveau de concentration dans l’eau, mais également d’autres caractéristiques, comme par exemple, le mode de pénétration dans les organismes, leurs actions sur des systèmes physiologiques etc…
Pour protéger les ressources (eau de surface ou eau souterraine), des actions ont été engagées au travers de la loi sur l’eau du 3 Janvier 1992 (LOI n° 92-3 du 3 janvier 1992 sur l'eau, JORF n°3 du 4 janvier 1992 page 187 http://www.legifrance.gouv.fr) puis plus récemment, la Directive Cadre sur l’eau (DCE) a été élargie à l’échelle européenne un cadre réglementaire pour assurer la préservation des écosystèmes aquatiques et le maintien de la qualité des eaux (2000/60/CE du 23 octobre 2000). Ces différentes actions ciblant au départ une réduction des flux de polluants organiques ont été étendues à la réduction des rejets de substances toxiques et à la limitation d’émission des micropolluants comme les pesticides ou des macropolluants tels que le phosphore ou l’azote jusqu’à aboutir à la DCE établissant un cadre pour atteindre un bon état des eaux en 2015. Ce cadre vise également une réduction progressive des rejets et des émissions de substances prioritaires jusqu’à une suppression de ces substances d’ici 2021. Cette directive établit des normes de qualité environnementale (NQE) et limite la concentration de trente-trois substances et de huit autres polluants dans les eaux de surface (tableau 1). Cette liste comprend onze substances dangereuses prioritaires, qui sont toxiques, persistantes et qui s’accumulent dans les tissus animaux et végétaux. Ces substances présentent un risque à long terme, il s’agit plus particulièrement des métaux lourds, des pesticides et des hydrocarbures.
Cependant, la DCE ne prend pas encore en compte l’effet de ces substances prioritaires sur les écosystèmes et les humains notamment la perturbation endocrinienne. En effet, la perturbation endocrinienne correspond à l’altération de la fonction endocrine par un agent exogène qui interfère avec la production, le métabolisme, le transport, la libération, la liaison, l’action ou l’élimination des ligands naturels responsables du maintien de l’homéostasie et de la régulation du développement de l’organisme. Or, comme présenté tableau 1, certaines substances prioritaires, déjà soumises à des interdictions ou prises en compte dans des réglementations européennes via la législation sur les pesticides, via la Directive Cadre et via la législation REACH (en référence à leur caractère CMR : Cancerigène, Mutagène, Reprotoxique), ont potentiellement des effets sur le système endocrinien. De ce fait, dans le cadre de la «Stratégie communautaire concernant les perturbateurs endocriniens», la Commission Européenne a constitué une liste de 60 substances prioritaires parmi plus de 550 suspectées de perturber le système endocrinien. De la même façon, 21 substances sur les 33 notifiées par la DCE ont été identifiées comme perturbateurs endocriniens potentiels (tableau 1). Mais la question de l’évaluation de l’impact des polluants ayant des effets perturbateurs endocriniens dans l’environnement est soulevée
dans le cadre des réglementations récentes. En effet, lors de la Conférence environnementale de 2012, le gouvernement français s’est engagé à élaborer une stratégie nationale sur les perturbateurs endocriniens et le Parlement Européen « envisage la mise en œuvre d’une nouvelle législation au plus tard en Juin 2015 afin de réexaminer de manière approfondie les règles actuelles relatives aux perturbateurs endocriniens » (Résolution du Parlement européen du 14 mars 2013 sur la protection de la santé publique contre les perturbateurs endocriniens (2012/2066(INI)), http://www.europarl.europa.eu ). Des études complémentaires sont actuellement en cours pour permettre à la Commission d’étudier la prise en compte de ces composés dans les futures règlementations.
Tableau 1 : Substances prioritaires de la DCE et leurs effets endocrinniens.
N°UE (1) N°UE DCE
(2)
Nom de la substance N°CAS (Chermical Abstracts Service)
Effet perturbateur endocrinien Référence
1 Alachlore 15972-60-8 Liaison compétitive aux récepteurs d'oestrogènes et de la progestérone. Interactions avec le récepteur cellulaire
pregnane X, interférant avec la production des enzymes responsables du métabolisme des hormones stéroïdes Mikamo et al., 2003 Cocco et al., 2002
3 2 Anthracène 120-12-7 Liaison avec le récepteur des oestrogènes Schneider et al., 1976
Pasqualini et al., 1990
131 3 Atrazine 1912-24-9 L'inhibition des androgènes avec un faible effet oestrogénique.
Perturbation du contrôle hypothalamique au niveau d'hormones et de la prolactine. Induction de l'activité de l'aromatase
Dommages au niveau des glandes surrénales dommages et réduction du métabolisme des stéroïdes.
Cocco et al., 2002 Cooper et al., 2000 Hayes et al., 2003
7 4 Benzène 71-43-2
5 Pentabromodiphényéther 32534-81-9 Altérations du fonctionnement du système thyroïdien Petrović et al., 2001
12 6 Cadmium et ses
composés 7440-43-9 Le cadmium est un puissant oestrogène et androgène in vivo et in vitro, il interagit directement avec les récepteurs des oestrogènes et des androgènes Takiguchi et al., 2005
7 C 10-13-chloroalcanes 85535-84-8
8 Chlorfenviraphos 470-90-6 Faible effet oestrogénique Vinggaard et al., 1999
9 Chlorpyrifos 2921-88-2 Activité antagoniste aux androgènes. Kang et al., 2004
59 10 1,2-dichluroéthane 101-06-2
62 11 Dichlorométhane 75-09-2 _
Di(2-éthylhexyl)phtalate
(DEHP). I 17-81-7 Induction des niveaux sériques de la testostérone Ge et al., 2007
13 Diuron 330-54-1 Activité inhibitrice des androgènes Thibaut et al., 2004
76 14 Endosulfan 115-29-7 Liaison compétitive aux récepteurs d'androgènes, activité oestrogénique, stimulation de la production du récepteur
des oestrogènes, inhibition de l'activité de l'aromatase Andersen et al., 2002 Lemaire et al., 2004
35 Fluoranthène 206-44-0 Agoniste du récepteur des oestrogènes Plíšková et al., 2005
Vondráček et al., 2002
83 16 Hexachlorobenzène 118-74-1 Altération du récepteur des oestrogènes et du Src/HER1 Peña et al., 2012
84 17 Hexachlorobutadiene 87-68-3 Néphrotoxique Green et al., 2003
85 18 Hexachlorocyclohexane 008-73-1 Réduction du cycle œstral et des concentrations de progestérone. Augmentation des concentrations sériques d'insuline et d'oestradiol, diminution des concentrations de thyroxine. Liaison compétitive aux récepteurs aux androgènes, oestrogènes et progestérone.
Rawlings et al., 1998 Beard et al., 1999
N°UE (1) N°UE DCE
(2)
Nom de la substance N°CAS (Chermical Abstracts Service)
Effet perturbateur endocrinien Référence
19 Isoproturon 34123-59-6 Activation du récepteur cellulaire Pregnane X Lemaire et al., 2006
20 Plomb et ses composés 7439-92,-1 Iavicoli et al., 2009
92 21 Mercure et ses composés 7439-97-6 Interfère avec la spermatogenèse et influence les niveaux des hormones reproductives physiologiques Iavicoli et al., 2009
96 Naphthalène 91-20-3
23 Nickel et ses composés 7440-02-0 Erα agoniste Darbre, 2006
24 Nonylphénols 25154-52-3 Activation du récepteur cellulaire Pregnane X Masuyama et al., 2000
25 Octylphénol 1806-26-4 Xéno-oestrogène Oehlmann et al., 2000
26 Pentachlorobenzène 608-93-5 Inhibe la production des hormones thyroïdes Cocco et al., 2002
101 27 Pentachlorophénol 87-86-5 Faible activité estrogénique et anti-androgénique Cocco et al., 2002
Benzo(a)pyrène 50-32-S Changements dans l'expression des gènes stéroïdogènes des testicules chez les rats à divers stades de développement Liang et al., 2012
Benzo(b)fluoranthène 205-99-2 AhR agoniste Kummer et al., 2001
Benzo(g,h,i)pérylène 207-08-9
Indéno(1,2,3-cd)pyrène 191-24-2
193-39-5
106 29 Simazine 121-34-9 Induction de l'activité de l'aromatase et augmentation de la production des oestrogènes Sanderson et al., 2000 30 Composés du tributylétain M-73-3 Inhibe de façon compétitive la conversion des androgènes en oestrogènes. Inhibe la production de certains androgènes Thibaut et al., 2004 117
118 31 Trichlorobenzènes (tous les isomeres) 1200248-1
23 32 Trichlorométhane 47.66-3
124 33 Trifluraline 1582-09-8 Interagit avec le récepteur cellulaire de pregnane X, interférant avec la production d'enzymes responsables du métabolisme des hormones stéroïdes. Eriko et al., 2003
46 1 DDT total Sans objet Imite l'action des oestrogènes, antagonise l'action des androgènes par liaison compétitive à leurs récepteurs et en inhibant la transcription génétique qu'ils induisent. Favorise la prolifération des cellules sensibles aux androgènes.
Imite les actions des oestrogènes indirectement en stimulant la production de leurs récepteurs
McKinlay et al., 2008
p-p’-DDT 50-29-3
1 2 Aldrine 309-00-2 Antagonise l'action des androgènes par liaison compétitive à leurs récepteurs et en inhibant la transcription génétique qu'ils induisent Lemaire et al., 2004
71 3 Dieldrine 60-57-1 Antagonise l'action des androgènes par liaison compétitive à leurs récepteurs et en inhibant la transcription génétique qu'ils induisent Imite les actions des oestrogènes indirectement en stimulant la production de leurs récepteurs
Lemaire et al., 2004
77 4 Endrine 72-20-8 Antagonise l'action des androgènes par liaison compétitive à leurs récepteurs et en inhibant la transcription génétique qu'ils induisent Lemaire et al., 2004
N°UE (1) N°UE DCE
(2)
Nom de la substance N°CAS (Chermical Abstracts Service)
Effet perturbateur endocrinien Référence
13 6 Tétrachlorure de carbone 56-23-5 Perturbateur endocrinien non listé INERIS
111 7 Tétrachloroéthylène 127-18-4
121 8 Trichloréthylène 79-01-6
(1) N° UE : nombre mentionné correspondant au classement par ordre alphabétique issu de la communication de la Commission européenne au Conseil du 22 juin 1982. (2) N ° UE DCE : nombre mentionné corresponantd au classement issu de l'annexe X de la DCE
Pour mieux comprendre les enjeux qui résident dans l’établissement de critères scientifiques permettant d’identifier les substances dites « perturbateur endocrinien » en vue de leur éventuelle interdiction, il convient d’expliquer succinctement le fonctionnement du système hormonal.
II. Mécanismes de la perturbation endocrinienne
A. Fonctionnement du système hormonal
Les animaux pluricellulaires possèdent deux mécanismes de coordination des activités des tissus et des organes : la communication nerveuse et la communication hormonale. La première sert à coordonner les mouvements grâce à la propagation de signaux électriques entre cellules nerveuses, la seconde, par un transfert de signaux chimiques, permet de réguler l'activité d'un ou plusieurs organes ou organismes en modifiant le comportement et les interactions.
Figure 1 : Système endocrinien chez l’homme
Ces substances chimiques « médiatrices » dites hormones sont sécrétées par les glandes endocrines et sont transportées par le système de circulation générale (le sang) pour exercer une action spécifique sur des cellules cibles. Les glandes endocrines (figure 1), telles que la thyroïde, les gonades, l’hypophyse, les surrénales, le pancréas endocrine, sécrètent des hormones comme la thyroxine, l’oestrogène et la testostérone, l’adrénaline, l’insuline. Ces substances sont des messagers chimiques qui, en se liant à des récepteurs avec une grande affinité, vont induire des réactions spécifiques et réguler la croissance, le métabolisme, le
comportement et le développement, incluant le développement sexuel et la reproduction. Le tableau 2 présente les différentes fonctions nécessitant des hormones pour développer des actions vitales pour l'organisme.
Tableau 2 : Relation entre les hormones endocrines et les réponses correspondantes (Ministère de l’Ecologie et du Développement Durable, Décembre 2003)
Fonctions Hormones Réponses
Reproduction Androgènes, oestrogènes,
progestérone, hormones hypophysaires (LH, FSH, prolactine).
Production de gamètes, facteurs de croissance, lactation,
gestation.
Instauration des caractéristiques secondaires et du comportement sexuel.
Croissance et
développement Hormones de croissance, hormones thyroïdiennes, insuline, glucocorticoïde, androgènes, oestrogènes, progestérone.
Large action sur la croissance.
Maintien de
l'environnement interne Vasopressine aldostérone, hormone parathyroïdienne progestérone.
Contrôle du volume et de la pression. Contrôle de la balance des électrolytes. Contrôle des os, des muscles et de la graisse.
Disponibilité énergétique Insuline, glucagon, hormones
thyroïdiennes. Régulation du métabolisme.
Les organes effecteurs, organes cibles de l’activité hormonale, possèdent, au niveau de leur cellule, des molécules fixant l’hormone (récepteurs spécifiques de l’hormone). Les cellules possèdent différents récepteurs et peuvent donc reconnaître plusieurs types d’hormone.
Ces récepteurs peuvent être présents sur la membrane d'une cellule (récepteurs membranaires). C'est le cas des récepteurs d'hormones peptidiques qui sont souvent des protéines transmembranaires de type récepteurs couplés aux protéines G, récepteurs sensoriels ou récepteurs ionotropes. Ces récepteurs peuvent produire trois types de réponse cellulaire :
a- une réponse électrophysiologique correspondant aux récepteurs canaux-ioniques, b- une réponse métabolique responsable de modifications post-traductionnelles des
protéines,
Généralement ces types de réponse se traduisent par la production d'un ou plusieurs intermédiaires intracellulaires dits messagers secondaires comme l’adénosine monophosphate cyclique ou AMP cyclique (AMPc) ou par l’intermédiaire de cascades de phosphorylations.
Les récepteurs peuvent être des récepteurs nucléaires intervenant dans la modulation de la transcription des gènes impliqués dans la prolifération, la différenciation cellulaire, le développement, l’homéostasie et le métabolisme (Gronemeyer et al 2004). Ce sont des protéines solubles activées par la liaison de la molécule informative. Ils sont normalement localisés dans le noyau. Mais il existe des exceptions comme pour les récepteurs stéroïdiens (récepteurs des glucocorticoïdes, des oestrogènes ou des androgènes) qui sont situés dans le cytosol en absence de ligand et la liaison de ce dernier induit la translocation du récepteur dans le noyau.
B. Récepteurs stéroïdiens sexuels
1) Organisation structurelle
Les stéroïdes participent au développement des vertébrés et à l’accomplissement de plusieurs fonctions physiologiques. Les récepteurs des hormones stéroïdiennes sont des récepteurs nucléaires et sont constitués de trois sections formant les principales régions du récepteur thyroïdien comme illustré figure 2 (Bain et al., 2007) :
- La région N-terminal (A-B) comprend 20 acides aminés pour le récepteur de la vitamine D et 600 acides aminés pour celui des minéralo-corticoïdes. Cette région contient un activateur de la transcription AF1 (Activation Function) agissant de façon constitutive indépendamment du ligand.
- La région C, domaine de liaison à l’ADN, dit le DBD (DNA Binding Domain), comprend 8 cystéines en position stable qui permettent la formation de deux structures en « doigts de zinc ». Ce domaine est essentiel à l'activation de la transcription. La fixation du ligand entraîne un changement dans la configuration du récepteur permettant la liaison à une séquence HRE (Hormone Receptor Element) sur le gène cible. La spécificité de liaison du récepteur à son HRE est déterminée par le premier domaine protéique en « doigt de zinc ». Le second domaine en « doigt de zinc » permet la dimérisation du récepteur.
- La région D, située entre le domaine de liaison à l’ADN et la région E, correspond au domaine de fixation de l'hormone, et permet le contrôle du transit du récepteur à partir du
cytoplasme où il est synthétisé, vers le noyau. Cette région est également un site de rotation permettant des modifications spatiales.
- La région E/F, domaine de liaison à l'hormone, le LBD (Ligand Binding Domain) est située à l'extrémité carbonylée du récepteur. Cette région permet, outre la liaison à l'hormone, la dimérisation des récepteurs et l'activation de la transcription par une zone fonctionnelle appelée AF2. C'est aussi l'endroit de liaison aux protéines chaperonnes. Contrairement à AF1, l'activité de l’AF2 dépend totalement de la fixation de l'hormone au récepteur (Drummond 2006).
Figure 2 : Organisation structurelle des récepteurs stéroïdiens
Les récepteurs stéroïdiens sont divisés en trois groupes (tableau 3) en fonction des hormones qui se lient comme les oestrogènes, la progestérone, la testostérone, les glucocorticoïdes et les minéralo-corticoïdes.
Tableau 3 : Récepteurs des hormones stéroïdes
Sous Famille : Récepteur des hormones stéroïdes
Groupe A : Récepteur des oestrogènes
(hormone sexuelle : oestrogènes) 1- Récepteur des oestrogènes-α (ERα; NR3A1)
2- Récepteur des oestrogènes-β (ERβ; NR3A2)
Groupe B : récepteur liés aux récepteurs des
oestrogènes 1- Récepteur liés aux récepteurs des oestrogènes-α (ERRα; NR3B1) 2- Récepteur liés aux récepteurs des oestrogènes-β (ERRβ; NR3B2)
3- Récepteur liés aux récepteurs des oestrogènes-γ (ERRγ; NR3B3)
Groupe C : Récepteurs des 3-ketostéroïdes 1- Récepteur des glucocorticoïdes (GR; NR3C1)
(Cortisol)
2- Récepteur des minéralocorticoïdes (MR; NR3C2) (Aldostérone)
3- Récepteur de la progestérone (PR; NR3C3) (hormone sexuelle : Progestérone)
4- Récepteur des androgènes (AR; NR3C4) (hormone sexuelle : Testostérone
2) Récepteur aux oestrogènes : ER
Le récepteur aux oestrogènes (ER) est un membre de la famille des récepteurs nucléaires dont la fonction, médiée par l’oestradiol, est l’activation de la transcription de gènes impliqués notamment dans la croissance, la différenciation cellulaire et les fonctions reproductrices. Il existe trois formes de récepteur aux oestrogènes : ERα, ERβ et ERγ (ou ERβa). Les isotypes α et β sont retrouvés chez toutes les espèces alors que l’isotype γ n’a été identifié que chez certaines espèces de poissons (Hawkins et al., 2000; Ma et al., 2000; Menuet et al., 2002). Afin d’assurer sa fonction de facteur de transcription, le récepteur aux oestrogènes, une fois traduit dans le cytoplasme, doit se diriger vers le noyau. Celui-ci met en jeu les importines (transporteurs) présentes au sein des pores nucléaires qui reconnaissent les signaux de localisation nucléaire (NLS : Nuclear Localization Signal) portés par le récepteur. Jusqu’au début des années 1980, le modèle classique d’action des récepteurs aux hormones stéroïdiennes proposait que les récepteurs étaient exclusivement cytoplasmiques en l’absence de ligand et n’étaient dirigés vers le noyau qu’en présence de celui-ci (Jensen et al., 1968). Il est clair aujourd’hui que l’isotype α du récepteur aux oestrogènes est nucléaire et cette localisation est indépendante de la présence de l’hormone (Stenoien et al., 2000 a et b).
3) Mécanismes d’action du récepteur aux oestrogènes
Les récepteurs aux oestrogènes peuvent agir selon deux mécanismes différents. Le premier permet de réguler la transcription des gènes cibles par le biais de la fixation du récepteur intracellulaire à son élément de réponse aux oestrogènes (ERE) au sein du promoteur de gènes cibles ou par des interactions protéine-protéine; ce mécanisme est communément appelé mécanisme génomique. Il existe 3 voies de signalisation génomique (figure 3) :
1- La voie classique ou ERE-dépendant (voie1), 2- La voie ERE-indépendante (voies 2 et 3), 3- La voie ligand-indépendante (voie 4).
Comme présenté figure 3, pour la signalisation classique (voie 1), le récepteur ER liganté à l’oestradiol (E2) se lie sous forme dimérique à une séquence spécifique dite ERE. Dès lors, des coactivateurs sont recrutés ainsi que la machinerie transcriptionnelle et le tout aboutit alors à l’activation de la transcription du gène cible. Concernant les voies
ERE-indépendantes (voies 2 et 3, figure 3), le complexe ER-E2 peut induire la transcription des gènes cibles en se liant directement à des protéines spécifiques Sp1 ou AP-1 (formé des protéines c-Fos et c-Jun) liées respectivement à des domaines nucléotidiques riches en glutamine ou TRE (TPA (12-Otetradecanoylphorbol 13-acetate) Response Element) (Krishnan et al., 2010). La troisième voie de signalisation génomique est ligand-indépendant (voie 4, figure 3). Cette activation est produite principalement par des facteurs de croissance comme l’EGF (Epidermal Growth Factor) et l’IGF-1 (Insulin-like Growth Factor). Ceux-ci phosphorylent le récepteur des oestrogènes au résidu de sérine 118 par l’intermédiaire de la MAP kinase. Le récepteur interagit avec le coactivateur p68 RNA hélicase et active la transcription du gène en interagissant avec l’ERE (Flint et al., 2002; Moore et Faller 2013; Koterba et Rowan 2006; Kallen et al., 2004). Le second mécanisme est non-génomique. Les stéroïdes, agissant par l’intermédiaire de récepteurs membranaires, entraînent une cascade de réactions dont des phosphorylations et modulent des fonctions physiologiques rapides telles que la régulation du flux calcique.
Figure 3: Différentes voies de signalisation cellulaire du récepteur ER et de l’oestradiol. Il existe trois voies de signalisation génomique: Voie 1 : La voie classique ou ERE-dépendant, Voies 2 et 3 : voies ERE-indépendante, Voie 4 : voie ligand-indépendante. Il y a une voie de signalisation non-génomique (Le Grand, thèse de doctorat 2009).
III.
Définition des perturbateurs endocriniens : un débat
d’actualité
Ce terme est apparu dans la littérature scientifique depuis 1993 (Colborn et al., 1993). Pourtant la définition des «perturbateurs endocriniens» ou PE n’est toujours pas arrêtée et fait encore débat (Sénat français, juillet 2011).
Une première définition a été proposée par Kavlock et al., (Kavlock et al., 1996 ) : «Un perturbateur endocrinien est une substance exogène qui interfère avec la synthèse, la sécrétion, la libération, le transport, le métabolisme, la fixation, l’action ou l’élimination des hormones naturelles du corps responsables de l’homéostasie, de la reproduction et du développement». Un perturbateur endocrinien (PE) est défini en 1998 par l’Agence de protection de l’environnement des USA (EDSTAC, 1998) comme un agent exogène (substance chimique d’origine naturelle ou artificielle) ou un mélange de substances exogènes qui agissent sur le système endocrinien et qui ont des effets néfastes au niveau d’un organisme intact, de sa progéniture et/ou des (sous)-populations. Au cours du congrès européen sur les perturbateurs endocriniens (European Commission, 1997), une autre définition a été proposée : «un perturbateur endocrinien est une substance exogène qui provoque des effets néfastes sur un organisme sain ou sa progéniture dus à une modification des fonctions endocrines».
Quoi qu’il en soit, identifier un perturbateur endocrinien revient donc à identifier une molécule pouvant être reliée à une activité hormonale; si elle se lie au récepteur ou si elle modifie l’action de certaines hormones, elle peut être considérée comme un perturbateur endocrinien. Mais pour certaines substances, ayant une activité plus ou moins importante sur le système endocrinien, l’EFSA (Autorité européenne de sécurité des aliments) a proposé de distinguer deux groupes de molécules : celles qui produisent des effets délétères et celles qui suscitent une réponse de l’organisme non problématique ou encore qui produisent des effets adaptatifs (Sénat français, 12 juillet 2011). Cette définition revient à adopter celle établie par l’OMS (Organisation Mondiale de la Santé) en 2002 qui définit les perturbateurs endocriniens comme étant des «substances chimiques d'origine naturelle ou artificielle étrangères à l'organisme qui peuvent interférer avec le fonctionnement du système endocrinien et induire ainsi des effets délétères sur cet organisme ou sur ses descendants» (Sénat français, 12 juillet 2011). De ce fait, une xéno-hormone (ou speudo-hormone) n’est pas une hormone véritable, mais est une substance naturelle ou synthétique qui se comporte comme une hormone. Les
xéno-estrogènes sont des substances qui «miment» l’oestradiol, hormone naturelle, et qui peuvent se lier aux récepteurs cellulaires de la même façon que les oestrogènes.
A.
Mécanismes de la perturbation endocrinienneDe nombreuses molécules de l’environnement ont la capacité de modifier le fonctionnement du système endocrinien. Étant donnée la diversité des fonctions physiologiques impliquant le système endocrinien, les mécanismes par lesquels ces substances peuvent perturber le système endocrinien sont complexes.
En effet, les perturbateurs endocriniens (PE) peuvent agir sur le système endocrinien en interférant à plusieurs niveaux : synthèse, stockage et libération des hormones, transport, métabolisme, ou encore liaison avec les récepteurs nucléaires constituant les cibles naturelles des hormones. Les perturbateurs endocriniens peuvent interférer avec le fonctionnement du système hormonal de différentes façons (figure 4) :
a. Ils peuvent imiter l’action d’une hormone naturelle. Ils se fixent alors sur le récepteur cellulaire et entraînent une réponse normale : effet agoniste.
b. Ils peuvent se lier au récepteur hormonal et empêcher l’émission d’un signal. Ils entravent alors l’action des hormones : effet antagoniste.
Le plus souvent, ces mécanismes d’action des PE résultent d’une combinaison des deux mécanismes agoniste et antagoniste.
Les autres modes d'action des PE peuvent être de perturber la synthèse, le transport, le métabolisme et la sécrétion des hormones, altérant ainsi les concentrations des hormones naturelles dans l'organisme.
Figure 4 : Modes d’action des perturbateurs endocriniens ; Pol II pour ARN Polymérase II
En conséquence, la classification des perturbateurs endocriniens a été effectuée en fonction de leur activité connue ou soupçonnée par rapport aux récepteurs hormonaux, et des mécanismes de perturbation car leurs cibles sont multiples comme l’indique le tableau 4. Il est, en effet, difficile voire impossible de classer les PE en fonction de leur structure chimique.
B.
Xéno-hormones et récepteur aux oestrogènesa. Interaction directe avec les récepteurs hormonaux nucléaires : Action
génomique des perturbateurs endocriniens
Le mécanisme d’action génomique le plus connu est la liaison du perturbateur endocrinien aux récepteurs nucléaires stéroïdiens (RNs) tel un imposteur (xéno-hormone), modifiant l’expression des gènes comme facteurs de transcription. Après fixation des xéno-hormones, les RNs exercent leurs activités génomiques en tant que facteurs de transcription qui reconnaissent des séquences ADN spécifiques, au niveau de promoteurs de leurs gènes cibles, en activant (effet agoniste) ou en inhibant (effet antagoniste) illégitimement l’expression des gènes.
Parmi ces récepteurs stéroïdiens la majeure partie des PE décrits sont les molécules ayant des effets oestrogéniques et sont capables de mimer l’effet biologique du 17 β œstradiol et de cibler les récepteurs aux oestrogènes (ER) (Wilson et al., 2007; Le et al., 2003).
Les xéno-oestrogènes peuvent aussi illégitimement activer le récepteur nucléaire des oestrogènes. Ils agissent comme l’oestradiol, par une voie classique qui suppose la dimérisation du récepteur alpha (ERα) ou du récepteur béta (ERβ), les deux isoformes du récepteur aux oestrogènes. Ce dimère reconnait les éléments de réponse localisés sur les promoteurs de gènes cibles (figure 5) et induit leur transcription.
Figure 5 : Activation illégitime du récepteur des oestrogènes (d’après Massaad et Barouki, 1999) (RE : récepteur des oestrogènes; ERE : Elément de réponse aux oestrogènes)
Les xéno-hormones peuvent être agonistes, antagonistes ou agoniste/antagoniste. En réalité, leur mécanisme d‘action est mieux compris s’il est comparé à celui d’agents pharmacologiques appelés SERM (Selective Estrogen Receptor Modulator) comme le 4-hydroxythamoxifène ou encore l’éthinyloestradiol présentés tableau 5. D’autres molécules sont des antagonistes pures comme L’ICI 182.780 et l’ICI 164.384 (Wakeling et al., 1991; Zhu et al., 2008), ou présentent les deux modes d’action pour le récepteur aux oestrogènes comme le 4-hydroxythamoxifène.
Tableau 5 : Structures des trois catégories de ligands du récepteur aux oestrogènes humains. Agonistes purs
naturels synthétiques
17β-Estradiol Ethynylestradiol Diethylstilbestrol
Agonistes/Antagonistes mixtes
4-Hydroxytamoxiféne Raloxiféne
Antagonistes purs
La grande majorité des xéno-oestrogènes sont des molécules agonistes et ils ont une meilleure affinité pour le récepteur alpha comme le nonyphénol et ses différents isomères (Arukwe et al., 2002; Gabriel et al., 2008), le cadmium (Nesatyy et al., 2006) et certains colorants alimentaires (Axon et al., 2012) .
Certaines molécules ont une meilleure affinité pour le récepteur béta (ERβ). C’est le cas de phyto-oestrogènes comme la génistéine (chez les mammifères), la biochanine A ou la daidzéine, et la benzophénone. Dans une majorité des cas, les xéno-estrogènes ont une affinité pour les deux récepteurs alpha et béta comme le bisphénol A (Kuiper et al., 1998), les parabènes, les écrans UV (Gomez et al., 2005), le diéthylstilbestrol (DES) (exerçant une fonction agoniste et ayant une affinité importante vis-à-vis des deux isotypes du récepteur aux oestrogènes) ou le glyphosate (Thongprakaisang et al., 2013). Enfin, certaines molécules ont une activité agoniste sur le récepteur alpha (ERα) et antagoniste sur le récepteur béta (ERβ). C’est le cas de pesticides comme le méthoxychlore ou le chlordécone (Le Maire et al., 2010). Ceci illustre le fait que de nombreuses molécules potentiellement retrouvées dans l’environnement peuvent avoir des effets complexes sur le système hormonal.
Mais les mécanismes des perturbateurs endocriniens ne se limitent pas à celui-ci. Ils peuvent également cibler le récepteur de l'hormone de la thyroïde (ThR) (Jagnytsch et al., 2006), des récepteurs glucocorticoïdes (GR) (Neel et al., 2013), des récepteurs de la progestérone (PR) (Scippo et al., 2004), le récepteur de la dioxine et des hydrocarbures aromatiques (AhR) (Jeuken et al., 2003). Ces molécules peuvent aussi cibler le récepteur des androgènes (AR) (récepteur des hormones sexuelles mâles comme la testostérone et son métabolite, la dihydrotestostérone). Ce récepteur est principalement exprimé dans le testicule, il est présent dans la prostate, les glandes surrénales, les reins, le cerveau et l’hypophyse. Le rôle du récepteur AR dans les organes mâles est très similaire à celui des récepteurs ER dans les organes femelles. Les plus puissants agonistes connus sont la testostérone et son métabolite, le DHT (dihydrotestostérone) qui se lient plus fortement aux récepteurs aux androgènes et l’acétate de médroxyprogestérone (MPA) (Okamoto et al., 2012; Bianco-Miotto 2014).
b. Action non génomique des perturbateurs endocriniens
Au-delà de la voie de signalisation classique passant par l’activité nucléaire du récepteur, les perturbateurs endocriniens provoquent des effets moins classiques, par l’intermédiaire de certaines voies de signalisation membranaires (notamment calcium
dépendant) suite à l’activation d’un récepteur membranaire. Plusieurs travaux ont permis d’identifier notamment des récepteurs aux stéroïdes localisés dans la membrane cytoplasmique qui sont identiques aux récepteurs nucléaires car ils sont reconnus par les mêmes anticorps (Powell et al., 2001). Les travaux décrits dans la littérature ont montré que, les stéroïdes ou des xéno-hormones, sont capables d’induire une action non génomique via un second messager après leur fixation sur les récepteurs membranaires ou sur leurs isoformes (Falkenstein et al., 2000). En effet, de nombreuses études ont été réalisées sur l’activité non génomique des xéno-oestrogènes notamment pour expliquer leur rôle dans des disfonctionnements physiologiques, métaboliques et dans des déficits fonctionnels à court terme et à long terme au niveau de la cellule et des tissus (tératogenèse et cancer) (Watson et al., 2007; Watson et al., 2013, Hisamoto et al., 2001 ). Il a été montré, par exemple, que l’œstradiol (E2) peut se lier au récepteur ERα membranaire (identique au récepteur ERα nucléaire) et induire une cascade de protéines kinase qui aboutit à la division cellulaire (Falkenstein et al., 2000; Bulayeva et al 2004; Watson et al., 2005). Il est aussi impliqué dans l’activation de la production d’AMPc et d’IP3 (inositol triphosphate) dans certains tissus (Grove et Korach, 1987; Ignar-Trowbridge et al., 1991; Aronica et al., 1994; McEwen et Alves, 1999). Certains xéno-estrogènes comme le diéthylstilbestrol, le coumestrol, le bisphénol A, ou le nonylphénol, induisent des réponses non génomiques par des voies très diverses qui peuvent, par exemple, conduire à l’activation des voies des MAP kinases (Watson et al., 2007; Watson et al 2010). Un schéma simplifié des voies de signalisation contrôlées par le récepteur des oestrogènes membranaire et cytoplasmique est présenté figure 6.
Ces activités non génomiques sont extrêmement rapides, elles se déroulent dans les minutes qui suivent l’activation du récepteur membranaire et ne sont pas affectées par les inhibiteurs de la transcription ou de la synthèse protéique tels que l’actinomycine D ou le cycloheximide (Jagla, 2007). Cependant ces activités restent ligands dépendantes, étant donné que l’administration d’un ligand antagoniste permet leur inhibition. De telles activités ont été, entre autres, décrites pour le AR (Baron et al., 2004) et le PR (Boonyaratanakornkit et al., 2001 ). Ces effets peuvent d'ailleurs avoir des conséquences sur la régulation de gènes.
Figure 6 : Voies de signalisation des oestrogènes médiées par les récepteurs membranaires et nucléaires. Les voies classiques (I et II) dépendent de l’interaction directe de l’oestrogène avec ER. Les voies non-classiques (III et IV) dépendent l’interaction avec un récepteur non-stéroïdien (III) ou avec un ER (IV) membranaire (Lorenzo et al., 2003)
De la même manière, l’interférence des xéno-hormones dans le métabolisme des hormones peut avoir des effets qui s’additionnent à ceux engendrés par leur activité agoniste ou antagoniste. L’activité de presque toutes les enzymes impliquées dans la stéroïdogenèse peut être modifiée par les xéno-hormones (Whitehead et Rice., 2006). Ce qui altère la concentration des hormones naturelles dans l’organisme et induit un dysfonctionnement du système hormonal.
C.
Cas particulier : les xéno-estrogènes et le récepteur à la dioxineLe récepteur aux hydrocarbures aromatiques (AhR) est un facteur de transcription activé par la fixation de ligands. Le récepteur AhR semble intervenir dans le développement des invertébrés. Par exemple, chez Drosophila melanogaster, l’homologue du récepteur AhR intervient dans le développement des segments et des antennes (Emmons et al., 1999) et son ADN complémentaire, connu depuis 1992, révèle des domaines de forte homologie avec les protéines Per (Period) et Sim (Single-Minded) de Drosophila melanogaster. Il fait partie de la famille dite bHLH-PAS (basic Helix-Loop-Helix/Per-AhR-Sim) (Hankinson 1995; Swanson et Bradfield, 1993), distincte des récepteurs nucléaires à laquelle appartient le récepteur aux