FACULTE DES SCIENCES DE LA NATURE ET DE LA VIE ET DES SCIENCES DE LA TERRE DEPARTEMENT DE BIOLOGIE
Réf : ……./UAMOB/F.SNV.ST/DEP.BIO/2019
MEMOIRE DE FIN D’ETUDES
EN VUE DE L’OBTENTION DU DIPLOME MASTER
Domaine : SNV
Filière : Sciences Biologiques
Spécialité : Biodiversité et environnement
Présenté par :
Djedda Hadjer
Thème
Elimination de polluants d’origine pharmaceutique par
adsorption sur une hydroxyapatite préparée à partir d’os
bovin
Soutenu le : 19
/09
/2019
Devant le jury composé de :
Année Universitaire : 2018/2019
Nom et Prénom Grade
Président : Mr. TAFER.M MAA Univ. de Bouira Promoteur : Mr.MOUNI.L PROF Univ. de Bouira Co-promotrice : Melle. CHEIKH.S DOCT Univ. de Bouira Examinateur : Mr.IMESSAOUDENE. A MAA Univ. de Bouira
Remerciements
Tout travail de recherche n’est jamais totalement l’œuvre d’une seule personne, car il met en jeu la participation et l’aide de plusieurs personnes et organismes. Je tiens à exprimer ma profonde gratitude et sincère reconnaissance ainsi que mes vifs remerciements :
À Dieu tout puissant pour m’avoir donné la force et la patience pour mener ce travail jusqu’au bout.
À mon promoteur professeur MOUNI Lotfi qui m’a accueillie au sein de son laboratoire GVRNAQ et qui m’a permis de préparer ce travail dans les meilleures conditions. je le remercie aussi pour la confiance qu’elle m’a accordée et surtout pour ses compétences scientifiques et sa rigueur qui m’ont permis de mener à bien cette étude.
À ma Co-promotrice Melle CHEIKH Sabrina qui a fourni beaucoup d’efforts et qui
m’a vraiment soutenue par ses précieux conseils et encouragements durant de long mois. Je tiens à lui exprimer ma profonde gratitude pour son aide et pour sa disponibilité permanente.
À Mr TAFER Mourad pour l’honneur qu’il me fait de présider le jury de ce mémoire. À Mr IMESSAOUDENE Ali qui a bien voulu consacrer un peu de son précieux temps
pour m’avoir fait l’honneur d’examiner ce travail.
À tous les membres du laboratoire (GVRNAQ) pour leurs aides et leurs orientations. À tous ceux qui ont contribué de prêt ou de loin à la réalisation de ce mémoire.
Dédicace
En témoignage d’affection, d’amour et de grande reconnaissance, aux êtres les plus chers que j’ai dans la vie, qui ont toujours été à mes côtés
et qui m’ont soutenu pendant les moments difficiles et je prie Dieu le tout puissant de les protéger et de leur accorder une longue vie.
…Mes parents,
À mes deux chères sœurs IMEN et MERIEM
À mon seul frère MOHAMEDRIADH
À mon cher neveu ADEM
À toute ma famille, mes cousin(e)s, mes tantes et mes oncles
À mes enseignants et mes ami(e)s d’étude
À tous ceux que j’aime dans le monde
Table des matières
Liste des figures Liste des tableaux Liste des abréviations
Introduction générale ... 1
Chapitre I :Synthèse bibliographique
I.1. Introduction ... 3I.2.La pollution de l’eau ... 3
I.3.Les sources de la pollution ... 3
I.3.1.Source urbaine ... 3
I.3.2. Source industrielle ... 4
I.3.3. Source agricole ... 4
I.3.4. Source naturelle ... 4
I.3.5. Source microbiologique ... 4
I.4. Principaux types de contamination de l’eau ... 4
I.4.1. Les polluants biologiques ... 5
I.4.2. Les polluants physiques ... 5
I.4.3. Les Polluants chimiques ... 6
I.5. Les médicaments ... 6
I.5.1.La pollution par les produits pharmaceutiques ... 7
I.5.2. Classification des médicaments ... 7
I.6.Les antibiotiques ... 9
I.6.1.Classification des antibiotiques ... 9
I.7. Les tétracyclines ... 10
I.7.1. Classification des tétracyclines ... 10
I.7.2.Doxycycline ... 11
I.7.2.1. Les propriétés de la doxycycline ... 12
I.8.Les fluoroquinolones ... 13
I.8.1.Classification des quinolones ... 13
I.8.2. La ciprofloxacine ... 14
I.8.3.Les propriétés de la Ciprofloxacine ... 15
I.9.Concentrations des antibiotiques dans les eaux usées ... 15
I.10.1.Les risques pour l’environnement ... 16
I.10.2. Impact sur les écosystèmes aquatiques et terrestres : ... 17
I.10.3. Les risque pour l’homme ... 17
I.11. Procédés de traitement des eaux contaminées par des polluants médicamenteux ... 18
I.11.1.Les procédés biologiques ... 19
I.11.2.L’incinération ... 19
I.11.3.Les procédés de transformation ... 19
I.11.4.Procédés physiques et physico-chimiques ... 20
I.12. Le Procédé d’adsorption ... 20
I.12.1. Définition de l’adsorption ... 20
I.12.2. Les type d’adsorption ... 21
I.12.3. Description du mécanisme d’adsorption ... 22
I.12.4. Facteurs influençant l’adsorption ... 23
I.12.5. Isothermes d’adsorption ... 24
I.12.5.1.Classification des isothermes d’adsorption ... 24
I.12.5.2.Modélisation des isothermes d’adsorption ... 26
I.12.6. La cinétique d’adsorption ... 28
I.12.6.1.Modèle de la cinétique du pseudo premier ordre (Lagergren) ... 28
I.12.6.2. Modèle de la cinétique du pseudo seconde ordre ... 29
I.12.6.3.Modèle de la diffusion intra-particulaire ... 30
I.12.7. Application de l’adsorption ... 30
I.13.L’hydroxyapatite ... 30
I.13.1.Structure et formule chimique ... 31
I.13.2.Propriétés de L’hydroxyapatite ... 32
I.13.2.1.Stabilité thermique ... 32
I.13.2.2.Stabilité chimique ... 33
I.13.3. Domaines d’applications des HAP ... 33
I.13.3.1. Applications dans le domaine biomédical ... 33
I.13.3.2. Applications dans le domaine de l'industrie ... 33
I.31.3.3. Application dans le domaine environnemental ... 33
Chapitre II : Matériel et Méthodes
II .1. Elaboration de l’hydroxyapatite naturelle (HAPn) ... 34II.2. Caractérisation de l’hydroxyapatite préparée ... 36
II 2.1. Technique et principe de la DRX ... 36
II.2.3. .Analyse par spectroscopie infrarouge (IR) ... 38
II.2.4. Détermination du pH point de charge zéro (pHpzc) ... 38
II.3. Protocol expérimental de l’adsorption des polluants pharmaceutiques ... 39
II.3.1. Préparation des solutions ... 39
II.3.2. Courbes d’étalonnages des composés étudiés ... 41
II.3.3. Mesure du pH des solutions préparées ... 41
II. 4. Tests d’adsorption ... 41
II.4.1. Procédure expérimentale... 41
II.4.2. Dosage des polluants pharmaceutiques par spectrophotométrie UV/Visible ... 42
II.4.3 Calcul des quantités adsorbées ... 43
II.4.4 Pourcentage d’adsorption ... 43
II.5. Etude de l’effet des conditions opératoires sur la capacité d’adsorption ... 43
II.5.1.Effet du rapport solide/liquide sur l’efficacité de sorption des antibiotiques ... 43
II.5.2.Effet du pH initial de la solution ... 44
II.5.3.Effet de la température sur l’efficacité de sorption des antibiotiques ... 44
II.5.4.Effet de la force ionique... 45
Chapitre III : Résultats et interprétations
III. Résultats et discussions ... 46III.1.Préparation de la matière première ... 46
III.1.1. La calcination ... 47
III.1.2. Forme en poudre ... 47
III.2. Caractérisation de l’hydroxyapatite étudiée ... 48
III.2.1. Analyse par diffraction des rayons X (DRX) ... 48
III.2.2.Microscopie Electronique à Balayage (MEB) ... 49
III.2.3.Analyse par spectroscopie infra rouge (IR) ... 50
III.2.4. pH point zero charge (pH pzc) ... 51
III.3. Courbes d’étalonnages des composés étudiés ... 52
III.4. Etude de l’effet des conditions opératoires sur l’adsorption de deux antibiotiques ... 53
III.4.1.Influence du temps de contact adsorbant-adsorbat et de la concentration initiale en adsorbat 53 III.4.2. Influence de la concentration de l’adsorbant ... 55
III.4.3. Influence du pH initial de la solution ... 58
III.4.3.1.1.Influence du pH initialsur l’élimination de la doxycycline ... 59
III.4.3. 2.Influence du pH initial sur l’élimination de la ciprofloxacine ... 60
III.4.4.Influence de la température ... 61
III.4.6.Influence de la taille des particules de l’adsorbant ... 64
III.4.7. Influence de la force ionique ... 65
III.5.Etude de la cinétique ... 67
III.5.1. Modélisation de la cinétique d’adsorption ... 67
III .5.1.1. Modèle cinétique de pseudo-premier ordre ... 67
III.5.1.2. Modèle cinétique de pseudo-second ordre ... 70
III.6. Isothermes d’adsorption ... 72
III.6.1. Modélisation des isothermes d’adsorption ... 75
III .6.1.1.Modèles de Langmuir ... 75
III.6.1.2. Modèles de Freundlich ... 78
Conclusion : ... 80 References bibliographies: ...
Liste des figures
Figure I.1 : Structure chimique de quatre formes de la tétracycline ____________________ 10 Figure I.2 : Structure moléculaire de la tétracycline et les valeurs des pKa ______________ 11 Figure I.3:La structure chimique dedoxycycline ___________________________________ 12 Figure I.4 : La structure chimique de fluoroquinolone ______________________________ 13 Figure I.5 : La structure chimique de la ciprofloxacine _____________________________ 14 Figure I.6 : Diagramme de spéciation de la ciprofloxacine à différents pH ______________ 15 Figure I.7 : Schéma représentant le phénomène d’adsorption ________________________ 20 Figure I.8: Mécanisme du transport d’un adsorbat au sein d’un grain du solide1-diffusion externe ; 2- diffusion interne (dans les pores) ; 3-migration en surface _________________ 23 Figure I.9: illustre la forme de chaque type d’isothermes ___________________________ 25 Figure I.10: Allure de la courbe d’isotherme de Langmuir __________________________ 27 Figure I.11: Allure de la courbe d’isotherme de Freundlich (1/n <1) ___________________ 28 Figure I.12 : La structure chimique de l’hydroxyapatite ____________________________ 32 Figure II.1 : Os du bovin a,b) avant la combustion ;c) âpres la combustion par un tube de chalumeau ________________________________________________________________ 34 15FigureII.2 : Four à moufle utilisé pour la calcination _____________________________ 35 Figure II.3 : HAPn avant la calcination Figure II.4 : HAPn après la calcination_______ 35 Figure II.5 : Tamisage de la poudre de l’HAPn ___________________________________ 36 Figure II.6: Schéma représentant le principe de la diffraction des rayons X par les plans réticulaires d’indices h, k et l _________________________________________________ 37 Figure II.7 : Représentation schématique de l’interaction entre un faisceau d’électron et la surface d’un échantillon. _____________________________________________________ 38 FigureII.9 : Dispositif expérimental de l’effet de la température sur l’adsorption des
antibiotiques ______________________________________________________________ 44 FigureIII.1 : Processus de calcination des os de vache ______________________________ 47 FigureIII.2: Diagramme de diffraction des rayons X de l’HAPn avant l’adsorption _______ 49 Figure III.3 : Image MEB de la poudre HAPn avant l’adsorption. (a) image d’un agglomérat de l’HAPn. (b) grossissement d’une zone de l’agglomérat précédent. __________________ 50 Figure III.4: Spectre IRTF de l’hydroxyapatite naturelle avant l’adsorption ____________ 51 Figure III.5: Le point de charge nulle de la poudre HAPn ___________________________ 52 Figure III.6 : Courbe d’étalonnage de la doxycycline à 275 nm (pH =3.5) ______________ 52 Figure III.7: Courbe d’étalonnage de la ciprofloxacine à 282 nm (pH=6.5) _____________ 53 Figure III.8: Évolution de la quantité de la Doxycycline adsorbée sur l’hydroxyapatite
naturelle en fonction du temps pour différentes concentrations (pH=3.5 ; S /L=0,1g/l ;
T=23±2°C ;W=200 tr/min).___________________________________________________ 55 Figure III.9: Évolution de la quantité de la Ciprofloxacine adsorbée sur l’hydroxyapatite naturelle en fonction du temps pour différentes concentrations (pH=6.5 ; S /L=0,1g/l ;
T=23±2°C ;W=200 tr/min).___________________________________________________ 55 FigureIII.10: Evolution du taux d’adsorption de la doxycycline en fonction de la
Figure III.11: Evolution de la quantité adsorbée de la doxycycline en fonction de la
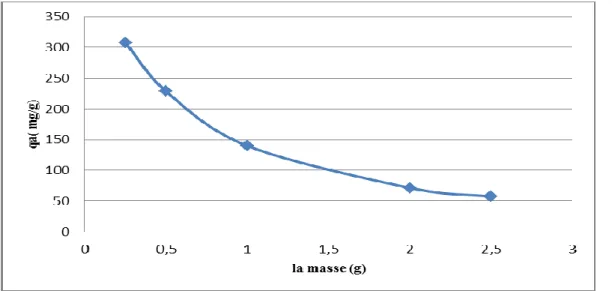
concentration de l’hydroxyapatite (C0=150 mg/l; T =23±2°C ; pH =3.5 ; W=200 tr/min) __ 56 Figure III.12: Evolution du taux d’adsorption de la ciprofloxacine en fonction de
laconcentration de l’hydroxyapatite(C0=150 mg/l; T =23±2°C ; pH =6.5 ;W=200 tr/min) __ 56 Figure III.14: Effet du pH initial sur le taux d’élimination de la doxycycline sur
l’hydroxyapatite naturelle (C0=150 mg/l ; S/L=1 g/L; T =23±2°C ; W=200 tr/min). ______ 58 Figure III.15: Effet du pH initial sur le taux d’élimination de la Ciprofloxacine sur
l’hydroxyapatite naturelle (C0=150 mg/l ; S/L=1 g/L; T =23±2°C ; W=200 tr/min). ______ 58 Figure III.16 : Diagramme de spéciation de la doxycycline à différents pH _____________ 59 Figure III.17 : Diagramme de spéciation de la ciprofloxacine à différents pH ____________ 61 Figure III.18: Effet de la température sur le taux d’élimination de la doxycycline sur
l’hydroxyapatite naturelle (C0=150 mg/l ; S/L=1 g/L; pH=7 ; W=200 tr/min). ___________ 62 FigureIII.19: Effet de la température sur le taux d’élimination de la ciprofloxacine sur
l’hydroxyapatite naturelle (C0=150 mg/l ; S/L=1 g/L; pH=8 ; W=200 tr/min). ___________ 62 Figure III.20:Effet de la vitesse d’agitation sur le taux d’élimination de la doxycycline
(C0=150 mg/l ; S/L=1g/l; pH =3.5; T =23±2°C). __________________________________ 63 Figure III.21: Effet de la vitesse d’agitation sur le taux d’élimination de la ciprofloxacine (S/L=1g/l; pH=6.5; T =23±2°C). ______________________________________________ 63 42Figure III.22 : Effet de la taille des particules de l’adsorbant sur le taux d’élimination de la doxycycline (S/L=1 g/l ; T =23±2°C, pH=3.5 ; W=200 tr/min) _______________________ 64 Figure III.23: Effet de la taille des particules de l’adsorbant sur le taux d’élimination de la ciprofloxacine (S/L=1 g/l ; T =23±2°C, pH=6.5;W=200 tr/min) ______________________ 65 Figure III.24: Effet de la force ionique sur le taux d’élimination de la doxycycline (C0=100 mg/l ; S/L=1g/l; pH =3.5; T =23±2°C ; W=200 tr/min) _____________________________ 66 Figure III.25: Effet de la force ionique sur le taux d’élimination de la Ciprofloxacine
(C0=100 mg/l ; S/L=1g/l; pH =6.5; T =23±2°C ; W=200 tr/min) _____________________ 66 Figure III.26: Représentations linéaires du modèle cinétique du premier ordre pour la
doxycycline (pH=3.5, W=200 t/min, m=1g/l et T= 23±2°C) _________________________ 68 Figure III.27: Représentations linéaires du modèle cinétique du premier ordre pour la
ciprofloxacine (pH=6.5, W=200 t/min, m=1g/l et T= 23±2°C) _______________________ 69 Figure III.28 : Représentations linéaires du modèle cinétique du second ordre pour la
doxycycline (pH=3.5, W=200 t/min, m=1g/l et T= 23±2°C) _________________________ 70 Figure III.29: Représentations linéaires du modèle cinétique du second ordre pour la
ciprofloxacine (pH=6.5, W=200 t/min, m=1g/l et T= 23±2°C) _______________________ 71 Figure III.30 : Isotherme d’adsorption de la doxycycline sur l’hydroxyapatite (S/L=1g/l; T =23±2°C ; pH=3.5) _________________________________________________________ 73 Figure III.31 : Isothermes d’adsorption de la ciprofloxacine sur L’hydroxyapatite (S/L=1g/l; T =23±2°C ; pH=6.5) _________________________________________________________ 73 Figure III.32:Effet de la concentration initiale de la doxyxycline sur le taux d’élimination (S/L=1g/l ; T=23 ±2°C ; pH=3.5) ______________________________________________ 74 FigureIII.33: Effet de la concentration initiale de la ciprofloxacinesur le taux d’élimination (S/L=1g/l ; T=23 ±2°C ; pH=6.5) ______________________________________________ 74 Figure III.34: Représentation linéaire du modèle Langmuir 01 pour la doxycycline (pH=3.5 ; W=200 tr/min ; T=23±2°C ; m=(HAPn)= 1g/L) ___________________________________ 75
Figure III.35: Représentation linéaire du modèle Langmuir 02 pour la doxycycline (pH=3.5 ; W=200 tr/min ; T=23±2°C ; m (HAPn)= 1g/L) ___________________________________ 76 Figure III.36: Représentation linéaire du modèle Langmuir 01 pour la ciprofloxacine (pH=6.5 ; W=200 tr/min ; T=23±2°C ; m (HAPn)= 1g/L) __________________________________ 76 Figure III.37: Représentation linéaire du modèle Langmuir 02 pour la ciprofloxacine (pH=6.5 ; W=200 tr/min ; T=23±2°C ; m (HAPn)= 1g/L) __________________________________ 77 Figure III.38: Représentation linéaire du modèle Freundlich pour la doxycycline (pH=3.5 ; W=200 tr/min ; T=23±2°C ;m(HAPn)= 1g/L) ____________________________________ 78 Figure III.39: Représentation linéaire du modèle Freundlich pour la ciprofloxacine (pH=6.5 ; W=200 tr/min ; T=23±2°C ; m (HAPn)= 1g/L) ___________________________________ 79
Liste des tableaux
Tableau I.2 : Les principales classes d’antibiotiques ________________________________ 9 Tableau I.3 : Les groupements attribués aux différents radicaux de la tétracycline ________ 10 Tableau 1.4 : Formes Ionisées de la tétracycline selon le pH du milieu _________________ 11 TableauI.5 : les propriétés physicochimiques de la doxycycline [Hassan. ______________ 12 Tableau I.6 : Les propriétés physicochimiques de la Ciprofloxacine ___________________ 15 Tableau I.7 : Quelques antibiotiques présents dans les eaux usées ____________________ 16 Tableau I.8 : Distinction entre l’adsorption physique et l’adsorption chimique ___________ 22 Tableau II.1 : Caractéristiques et formule chimique de la doxycycline utilisée ___________ 40 Tableau II.2 : Caractéristiques et formule chimique de la Ciprofloxacine utilisée ________ 40 Figure II.8: Dispositif expérimental ____________________________________________ 42 Tableau III.1 :Formes Ionisées de la doxycycline selon le pH du milieu ________________ 59 Tableau III.2 :Constantes du modèle cinétique de pseudo-premier- ordre pour les systèmes DOX-HAPn et CIP-HAPn ___________________________________________________ 69 Tableau III.3 : Constantes du modèle cinétique de pseudo-second ordre pour les systèmes DOX-HAPn et CIP-HAPn ___________________________________________________ 71 Tableau III.4: Paramètres relatifs aux modèles de Langmuir (1 et 2) pour l’adsorption de la DOX et la CIP sur l’hydroxyapatite naturelle ____________________________________ 77 Tableau III .5: Résultats de la modélisation des isothermes d’adsorption de la DOX et de la CIP sur l’hydroxyapatite par le modèle de Freundlich ______________________________ 79
Liste des abréviations DOX : Doxycycline CIP : Ciprofloxacine
HAP : Hydroxyapatite Phosphocalcique HAPn : Hydroxyapatite naturelle
DRX : Diffraction des Rayons X. UV : Ultra-violet
MEB : Microscopie Electronique à Balayage IR : Infra-Rouge
IRTF : spectres Infrarouges par Transformée de Fourier PHpzc : potentiel d’hydrogène au point de charge zéro. C0 : Concentration initiale d’adsorbat (mg.L-1)
Ce : Concentration d’adsorbat à l’équilibre (mg.L-1)
Ct : Concentration résiduelle à l’instant t de la solution (mg/L) K1 : Constante de vitesse du modèle de Lagergren (min-1)
K2 : Constante de vitesse du modèle du 2eme ordre (g.mg-1.min-1)
KL : Constante de Langmuir (relative a l’énergie d’adsorption) (l.mg-1)
KF : Constante de Frendlich
A : Adsorption
PH : Potentiel d’hydrogène. t : Temps (min)
1
Introduction générale
Depuis plusieurs années, on assiste à une pollution grandissante des eaux superficielles et souterraines. Les pollutions majeures, liées à l’activité humaine, sont constituées de rejets industriels (métaux, colorants, produits chimiques), de phytosanitaires (tensioactifs, produits de traitements agricoles) et produits pharmaceutiques (produits vétérinaires et molécules thérapeutiques comme les antibiotiques, anticancéreux et hormones de synthèse).
L’usage excessif de substances médicamenteuses à usage humain ou vétérinaire dans le monde provoque une source de pollution vis-à-vis de l’environnement qui devient de plus en plus inquiétante à la fois pour les scientifiques et les politiques [Seddik Khodja.B ; 2015]. Depuis les années 80 un certains nombres d’études ont été réalisées sur l’analyse des résidus médicamenteux dans les eaux usées. Ces recherches ont montré la présence de traces de plusieurs composés organiques et inorganiques. Ainsi, la présence de résidus des produits médicamenteux et des métaux lourds dans les eaux usées depuis un certains nombres d’années est parmi les sujets de préoccupation majeurs [Thomas Thiebault; 2015].
La persistance des médicaments dans l’environnement varie en fonction de leurs propriétés physico-chimiques. L’utilisation croissante de ces derniers engendre des apports continus conduisant à leur présence et «persistance» dans les milieux écologiques.
Pour réduire les effets néfastes de ces polluants, plusieurs procédés de traitement des eaux usées, notamment Physicochimiques, sont mis en œuvre, en particulier, la technique de l’adsorption [Nour. H et F.S ; 2016].
Les objectifs de cette étude sont :
La valorisation d’os de bovins en adsorbant (hydroxyapatite).
L’élimination de polluants d’origine pharmaceutique (doxycycline et ciprofloxacine) à partir de solutions aqueuses par adsorption sur l’adsorbant préparé tout en focalisant notre intérêt sur les facteurs qui ont une grande influence sur le phénomène en question pour élucider son mécanisme.
Le travail présenté dans ce manuscrit est organisé en trois chapitres :
Le premier chapitre est destiné à une synthèse bibliographique qui est subdivisée en trois parties : la première porte sur la pollution et ses origines telles que les produits pharmaceutiques. On s’intéresse essentiellement aux antibiotiques tels que la doxycycline et la ciprofloxacine, leur présence et leur effet sur l’environnement. Dans
2
la deuxième partie, nous avons cité les méthodes de dépollutions les plus utilisées et nous avons mis l’accent sur les procédés physicochimiques dont l’adsorption fait partie. La dernière partie a été consacrée au rappel détaillé sur la structure des apatites, leurs propriétés et leurs applications.
Le deuxième chapitre est consacré à la description du matériel et des méthodes expérimentales ayant permis la réalisation pratique de cette étude. Les modes opératoires, les réactifs, les appareils de caractérisation et d’analyse chimique, la méthode de préparation d’adsorbant « hydroxyapatite » et le procédé d’adsorption appliqué y seront présentés.
Dans le dernier chapitre, nous avons présenté les résultats et leurs interprétations concernant l’adsorption de la doxycycline et de la ciprofloxacine en solutions aqueuses par l’hydroxyapatite préparée. L’étude de l’effet de certains paramètres susceptible d’affecter le procédé à savoir ; concentration initial en polluant, le pH initial de la solution, la température, la cinétique et les isothermes d’adsorption y sont présentées et discutées.
Le manuscrit se termine par une conclusion dans laquelle une synthèse des résultats est rapportée suivie de quelques perspectives.
Chapitre I
3
I.1. Introduction
L’eau joue un rôle majeur dans le développement économique et social. De plus, elle est un élément classée comme étant une source de vie et est depuis toujours une richesse irremplaçable. Ainsi, sa gestion de manière durable est devenue aujourd’hui indispensable. La qualité de l’eau est par ailleurs affectée par des applications industrielles, agricoles et domestiques qui ont une immense influence sur la détérioration de cette ressource. En effet, des substances d’origine chimique n’ont cessées d’être émises dans l’environnement et peuvent devenir une menace pour l’équilibre des écosystèmes aquatiques et pour la santé humaine. Par conséquence, pour limiter la pollution, les lois doivent être respectées en fixant des normes pour les substances nocives rejetées dans l’eau [Sohayb.K ; 2015].
I.2.La pollution de l’eau
La pollution ou la contamination de l'eau peut être définie comme la dégradation de celle-ci en modifiant ses propriétés physiques, chimiques et biologiques [Adjroud.K ;2015].La pollution peut nuire aux ressources en eau et aux écosystèmes aquatiques. Les principaux polluants comprennent notamment les matières organiques et minérales et les organismes pathogènes rejetés par les eaux usées, les engrais et les pesticides provenant des terres agricoles. Les pluies acides résultant de la pollution de l'air et les métaux lourds libérés par activités minières et industrielles. Toutes ces activités affectent la qualité de l’eau et provoquent des modifications plus ou moins marquées sur les communautés vivantes, particulièrement les macros invertébrées [Ballouki.K ; 2011].
I.3.Les sources de la pollution I.3.1.Source urbaine
L’origine des eaux résiduaires urbaines est principalement domestique où les populations génèrent les (3/4) des eaux usées. Ces effluents sont un mélange d’eaux contenant des déjections humaines telles que les urines, fèces, eaux de toilette et de nettoyage des sols et des aliments (eaux ménagères). Les eaux usées urbaines peuvent aussi contenir des eaux résiduaires d’origine industrielle, mais normalement, ces dernières doivent avoir subi un prétraitement pour atteindre des caractéristiques comparables à celles des eaux usées domestiques pour permettre un traitement en commun [Khalfaoui.A ; 2012].
4
I.3.2. Source industrielle
Les industries génèrent des polluants très nombreux et de toxicité variable. La pollution industrielle comprend les matières solides en suspension, les sels dissous, les hydrocarbures et les éléments traces ou micropolluants [Ballouki.K ; 2012].
I.3.3. Source agricole
L'agriculture est également une source de pollution commune, car plusieurs millions de tonnes de produits chimiques [Boudjenoun.M ; 2017].et des engrais utilisés excessivement dans l’agriculture, Ils apportent une présence d'azote et de phosphore en grande quantité dans les cours d'eau. Les algues de surface prolifèrent rapidement en entraînant une diminution de la luminosité et surtout une consommation importante d’oxygène dissous dans l'eau. L’oxygène n’est alors plus présentent quantité suffisante pour les organismes supérieurs
[Chabane.H etTighidet.K ; 2016]. I.3.4. Source naturelle
Ce phénomène se retrouve pour toute eau en contact avec l’atmosphère car celle-ci contient du gaz carbonique CO2 qui est soluble dans l’eau pour donner de l’acide carbonique de
formule H2CO3. On comprend ainsi qu’une concentration de CO2 dans l’atmosphère conduit à
une acidification de l’eau à son contact. Ainsi, même avant l’existence des pluies acides d’origine anthropique, les pluies naturelles étaient légèrement acides, ceci étant toujours le cas dans des zones protégées telles que les forêts amazoniennes [Khalfaoui.A ; 2012].
I.3.5. Source microbiologique
Les eaux usées contiennent tous les microorganismes excrétés avec les matières fécales. Cette flore entérique normale est accompagnée à des organismes pathogènes. L'ensemble de ces organismes peut être classé en quatre grands groupes, par ordre croissant de taille : les virus, les bactéries, les protozoaires et les helminthes [Baha.S et Bensari.F ; 2014].
I.4. Principaux types de contamination de l’eau
L’eau, qu’elle soit douce, salée, de l’eau de pluie, de l’eau souterraine ou de l’eau superficielle, peut être souillée par des matières qui peuvent la rendent nocive. Selon l’origine des déchets (industriels, agricoles, urbains...), qui est majoritairement anthropique, Les
5
polluants peuvent être classés, selon leur nature, en trois grandes catégories : chimique, physique et biologique [Baha.S et Bensari.F ; 2014].
I.4.1. Les polluants biologiques
Les humains sont les plus importants pollueurs biologiques de la planète : les contaminants fécaux sont parmi les polluants biologiques des sources d’eau potable ; par conséquence l'homme et les animaux domestiques sont souvent contaminés par des microbes pathogènes. Les bactéries présentes dans la matière organique peuvent avoir des effets néfastes sur la santé humaine et animale. Telles que les streptocoques, Escherichia coli, etc. En autre la pollution virale de la biosphère peut aussi avoir des effets dévastateurs et selon les estimations, il y en a dix fois plus de virus sur la Terre que l’ensemble des cellules vivantes [Gammoun.S ; 2010].
I.4.2. Les polluants physiques
La pollution physique est due essentiellement aux substances en suspension (matières solides) ; [Boyd ; 1970]. Bien que sa forme commune est la pollution thermale [Nsikak ;
2008]. Elle peut englober également plusieurs autres aspects : couleur, transparence, pH dont
on peut citer :
a. Les polluants nucléaires
Résultent des accidents divers ou des rejets des centrales nucléaires, ou dans le pire des cas, à partir d'une explosion nucléaire. Ces polluants sont notamment une série d'éléments et des composés radioactifs y compris les éléments dérivés de l'uranium, le plutonium, le césium, et l'iode [Ballouki.K ; 2012].
b. Les polluants thermiques
peut-être naturelle, dans le cas des sources chaudes ou des étangs peu profonds pendant l’été, ou causée par les humains, par la décharge de l’eau qui a été utilisée pour refroidir les centrales électriques ou autre équipement industriel [Ballouki .K ; 2012].
c. Les matières en suspension
Désignent toutes les matières minérales ou organiques qui ne se solubilisent pas dans l’eau et la troublent [Koller.E ; 2004].
6
I.4.3. Les polluants chimiques
Les industries chimiques continuent à synthétiser des milliers des substances chaque année. Plusieurs de ces produits sont spécifiquement conçus pour être toxiques et persistants
[Anonyme ; 2007]. Cependant, les contaminants les plus nuisibles à la santé sont les produits
chimiques d'origines naturelles qui se trouvent habituellement dans les eaux souterraines
[Roberts et al ; 2007].
a. Les éléments minéraux nutritifs
Nitrates et phosphates : provenant pour l’essentiel de l’agriculture et des efflues domestiques il est à l’origine du phénomène d’eutrophisation c’est-à-dire la prolifération excessive d’algues et plancton dans les milieux aquatiques [Mayet. J ; 1994].
b. Les métaux lourds
Constituent un problème préoccupant lorsqu'ils sont impliqués dans la pollution des ressources en eau. Non seulement leur toxicité peut être fort dommageable pour le milieu aquatique, mais leur accumulation au fil de la chaîne alimentaire pourrait avoir des effets plus ou moins graves sur la santé humaine [Mayet. J ; 1994].
c. L’uranium
Se trouve dans les eaux souterraines, associé aux roches granitiques et aux autres dépôts minéraux [Mayet .J ; 1994].
d. Les produits pharmaceutiques
Plus de 150 produits pharmaceutiques de différentes classes thérapeutiques ont été détectés avec des concentrations atteignant le μg/l dans diverses matrices environnementales [T.
Heberer ; 2002], incluant une grande variété de composés tels les hormones, les régulateurs
de lipides, les antibiotiques, anticancéreux et d’autres cytotoxiques, antiépileptiques, etc [M.
Gros et al ; 2008]. I.5. Les médicaments
L’évolution des connaissances toxicologiques et l’abaissement des seuils de détection des méthodes analytiques amènent de nouvelles questions quant à la présence de polluants, tels que les médicaments ou les perturbateurs endocriniens [F .Zaviska ; 2001].
7
I.5.1.La pollution par les produits pharmaceutiques
Après usage, les produits pharmaceutiques sont excrétés sous leur forme native ou sous forme de métabolites et peuvent accéder aux systèmes aquatiques par différentes voies. Ce sont les eaux usées municipales qui constituent la source principale décontamination de l’environnement par les médicaments à usage humain. Les effluents des hôpitaux et de l’industrie pharmaceutique, ainsi que les lixiviats de décharge des centres d’enfouissement représentent aussi une source non négligeable. Ces produits pharmaceutiques sont plus ou moins éliminés par les stations de traitement de l’eau et se retrouvent dans les rivières, les lacs, les estuaires, voire plus rarement dans les eaux souterraines et l’eau potable. L’épandage de boues d'épuration contaminées peut également entraîner la pollution des sols et des eaux de surface par ruissellement. En outre, les produits pharmaceutiques à usage vétérinaire peuvent entrer dans les systèmes aquatiques à travers l’utilisation de fumier dans les champs, mais aussi directement en aquaculture. Les risques pour l’environnement ne sont pas forcément liés aux volumes de produits pharmaceutiques utilisés, mais à leur persistance et leur activité biologique critique (toxicité élevée, possibilité d’effets sur les fonctions biologiques majeures, comme la reproduction).
I.5.2. Classification des médicaments
On peut définir des classes de médicaments de différentes manières : classes selon leurs origines, leurs compositions ou leurs structures chimiques, classes pharmacologiques selon leurs actions sur l’organisme et classes thérapeutiques selon les pathologies traitées. En fait, aucune classification ne permet de couvrir de manière satisfaisante pour le médecin l’ensemble des médicaments. On a donc recours à un système hétérogène de classes pharmaco thérapeutiques qui allie les mécanismes d’action et l’effet thérapeutique. La plus répandue est la classification ATC (Anatomique, Thérapeutique et Chimique) qui a l’avantage d’être internationale mais qui est loin d’être parfaite [Dirany ; 2010 –Dangaumou ; 2006].
11Tableau I.1 : Quelques classes thérapeutiques de médicaments [Dirany ; 2010].
CLASSE Exemple CLASSE Exemple
-Analgésiques et -Antalgiques -Aspirine -Paracetamol -Phenazone -Tramadol -Anticancéreux -Cyclophosphamide -Ifosfamide -Anticoagulants -Warfarine -Anticonvulsivants -Carbamazépine
8
-Antiarythmiques -Amiodarone -Anti-diabétiques -Metformine
-Anti-asthmatiques -Salbutamol -Antifongiques -Amphotéricine B
Antibiotiques Aminoglycosides -Apramycine -Kanamycine β-Lactamines, Penicillines -Amoxicilline -Ampicilline Cephalosporines -Cefaclor -Cefalexine Sulfonamides -Sulfaméthoxazole Sulfachloropyridazine Fluoroquinolones -Ciprofloxacine -Erythromycine Macrolides -Erythromycine -Tylosine Lincosanides -Clindamycine -Lincomycine Phenicoles -Chloramphénicol Tetracyclines -Chlorotétracycline -Tétracycline Trimethoprim -Bacitracine -Néomycine Antigoutteux Allopurinol -Antihistaminiques -Cimetidine -Anti-hypertenseurs -Propranolol -Anti-inflammatoires -non stéroïdiens -Aspirine -Acide salicylique -Ibuprofène -Antiseptiques -Triclosan -β-bloquants -Atenolol -Bisoprolol -Carazolol -Bronchodilatateurs -Fenoterol -Régulateurs -lipidiques -Fénofibrate et acide Fénofibrique -Stéroïdes et hormones -Progestérone -Testostérone -Stimulants cardiaques -Digoxine -Stimulants système nerveux centrale -Caféine
9
I.6.Les antibiotiques
Les antibiotiques sont des substances anti bactériennes d’activité sélective et non toxique pour l’hôte. Ils ont un site d’actions bien définies et un mécanisme précis permettant leur utilisation dans le traitement de la majorité des infections [ Ayad.A; 2016].
Actuellement, il existe plus de 10 000 molécules d'antibiotiques, mais seulement une centaine (dont un quart sont des pénicillines) sont efficaces et utilisables pour des applications thérapeutiques. Les autres sont trop toxiques, trop instables ou ont une biodisponibilité insuffisante chez l'Homme. La plupart des antibiotiques sont des molécules naturelles, synthétisées par des procaryotes, des champignons, des végétaux supérieurs, des animaux ou des lichens.
I.6.1.Classification des antibiotiques
Dans le tableau(I.2) sont présenté quelques familles d’antibiotiques dont les tétracyclines et les quinolones [M.Touhami ; 2013].
2Tableau I.2 : Les principales classes d’antibiotiques
Familles d’antibiotiques Exemples
Betalactamines Penicilline G Aminosides Streptomycine Phenicoles Chloramphenicol Tetracyclines Doxycycline Macrolides Erythromycine Glycopeptides Vancomycine Polypeptides Colistine Sulfamides Sulfamethizol Quinolones Ciprofloxacine
10
I.7. Les tétracyclines
En raison de leur plus faible coût et leur grande activité antimicrobienne, les tétracyclines sont largement utilisées comme médicament dans la médecine humaine et vétérinaire pour traiter plusieurs maladies infectieuses. Ce groupe d'antibiotiques est également utilisé comme additif alimentaire pour favoriser la croissance des animaux [C.LIU ; 2012-X. Ding ; 2000].
I.7.1. Classification des tétracyclines
La forme générale des tétracyclines est donnée dans la figure (I.1.)
1 Figure I.1 : Structure chimique de quatre formes de la tétracycline
Les radicaux R1, R2, R3 diffèrent d’une forme à une autre, les groupements qui leurs correspondent sont regroupés dans le tableau(I.3) [Joonseonjeong ; 2010].
3Tableau I.3 : Les groupements attribués aux différents radicaux de la tétracycline
[Joonseonjeong ; 2010]. R1 R2 R3 Tétracycline(TC) H OH H Chlorotétracycline(CTC) Cl OH H Oxytetracycline (OTC) H OH OH Doxycycline(DC) H H OH
11
2Figure I.2 : Structure moléculaire de la tétracycline et les valeurs des pKa
[L.Khenniche ; 2015].
Les valeurs du pKa de tétracycline en solution sont aux alentours de 3.3, 7.7 et 9.7
[L.Khenniche ; 2015].Toutes les tétracyclines sont hydrosolubles et non volatiles [S. Thiele Bruhn ; 2003].Les formes de la tétracycline dans différents pH sont regroupées dans le
tableau(I.4)
4Tableau 1.4 : Formes Ionisées de la tétracycline selon le pH du milieu [L.Khenniche ; 2015].
I.7.2.Doxycycline
La doxycycline fait partie du groupe dit des «antibiotiques à large spectre» [J.M.
Bonnetblanc ; 2002], est un membre de la tétracycline [Hassan, S. A. et. Ali, F. J ; 2014]
antibiotiques deuxième génération principalement actif contre les bactéries Gram positif et Gram négatif bactéries aérobies et anaérobies, ainsi que (Mycoplasme, Chlamydia, Rickettsia et Spirochètes). Elle est également utilisée pour le traitement du paludisme. La doxycycline a une position particulière dans le groupe tétracycline en raison des caractéristiques suivantes: •Elle est plus soluble dans les lipides que les autres tétracyclines. Probablement par conséquent, elle a une meilleure biodisponibilité du tractus gastro-intestinal.
pH<pKa1 0, 0, + ionisation globale positive
pKa1 < pH < pKa2 -, 0, + ionisation globale neutre pKa2 < pH < pKa3 -, -, + ionisation globale négative
12
•Elle montre la liaison la plus forte aux protéines plasmatiques.
•Elle est relativement beaucoup plus stable dans une solution aqueuse
•La doxycycline est présentée sous différents sels à savoir : hyclate, poly phosphate, chlorhydrate et monohydrate[E.Goren ; 2011].
La structure chimique de la doxycycline comporte 4 cycles (structure naphtacène)
[Koissi. Joel ; 2008].
3Figure I.3:La structure chimique de la doxycycline [KOISSI. JOEL ; 2008].
I.7.2.1. Les propriétés de la doxycycline
Les propriétés de la doxycycline ont été rassemblées dans le tableau ci-dessus :
5TableauI.5 : les propriétés physicochimiques de la doxycycline [Hassan. A. et Ali ; 2014].
Nom chimique
(4S, 4aR, 5S, 5aR, 6R, 12aS)-4-(diméthylamino)-
3,5,10,12,12a-pentahydroxy-6-méthyl-1,11-dioxo- 1,4,4a,5,5a,6,11,12a-octahydrotétracène-2-carboxamide
Formule brute C22H24N2O8
Masse molaire (g/mol) 444,34
point de fusion (°C) 201
Solubilité Très soluble dans l'eau 2.31g/L
pKa pKa1=3.50 ; pKa2=7.07 ; pKa3=9.13
13
I.8.Les fluoroquinolones
Les quinolones permettent de traiter de nombreuses infections génitales, urinaires, gastro-intestinales et osto-articulaires. Les fluoroquinolones sont des antibiotiques à large spectre bactérien et devenues très utilisées en médecine humaine et vétérinaire par rapport aux autres antibiotiques [A. Karp ;2004].
La structure chimique des fluoroquinolones comporte une fonction cétone (C=O) et une fonction acide (COOH), qui ont une grande tendance à piéger les ions divalents comme les ions Ca2+, Fe2+, Mg2+… Les fluoroquinolones sont des molécules obtenues par synthèse chimique qui dérivent de l’acide carboxylique hétérocycliques diversement substitués. Tous les composés quinolones actuels présentent une structure bi cyclique, avec un atome d’azote en position 1, un carboxylate en position 3, un carbonyle en position 4 et un atome de fluor en position 6. Le groupe R est généralement un groupe pipérazine dérivant de la quinoléine
[A. Karp ; 2004].
4Figure I.4 : La structure chimique de fluoroquinolone [A. Karp ; 2004].
I.8.1.Classification des quinolones
Les quinolones sont habituellement classées en quatre générations basées sur leur activité et leur spectre d’activité [J.P. BRADEN ; 1998].
a. La première génération
Les quinolones de la première génération ont un spectre étroit et limité contre les bactéries et aussi contre les germes de type Gram négatif. Les fluoroquinolones de cette classe incluent (l’acide nalidixique, l’acide pipémidique, l’acide oxolinique, la fluméquine et la cinoxacine).
14
b. La deuxième génération
Les fluoroquinolones de la deuxième génération sont les: Ciprofloxacine, Norfloxacine, Enoxacine, Loméfloxacine, Ofloxacine et Péfloxacine.
c. La troisième génération
La troisième génération contient les composés suivants : La Grépafloxacine, la Sparfloxacine, la Témafloxacine et la Lévofloxacine. Les agents de cette génération ont une activité accrue contre les bactéries et contre les pathogènes atypiques.
d. La quatrième génération
Elle a les mêmes propriétés que les agents de la troisième génération mais avec une couverture anaérobique beaucoup large. Les substances de la quatrième génération sont : la Trovafloxacine, la Moxifloxacine, la Gémifloxacne, la Sitafloxacine, la Clinafloxacine et la Gatifloxacine [J.P. BRADEN ; 1998].
I.8.2. La ciprofloxacine
La ciprofloxacine (CIP) est l’un des antibiotiques de la classe des fluoroquinolones largement utilisés dans le traitement des systèmes urinaire, digestif et respiratoire avec de bons résultats. Jusqu'à présent, les méthodes appliquées pour l'élimination du CIP sont l’ozonation l’oxydation, la coagulation et l’adsorption. Le processus d'adsorption est largement appliqué dans l'industrie pour éliminer les polluants organiques. Les matériaux d'adsorption les plus utilisés sont les charbons actifs en grains, mais ils sont très coûteux et ne seront guère réactivés. Les nanoparticules sont une option appropriée en raison de leur grande surface pour compléter les réactions chimiques et l'adsorption de composés organiques[NAHID .K et
S.A ; 2017].
15
6Figure I.6 : Diagramme de spéciation de la ciprofloxacine à différents pH
[Nevim .Gença ;2013]. I.8.3.Les propriétés de la ciprofloxacine
Les propriétés physicochimiques de la ciprofloxacine sont rassemblées dans le tableau ci-dessous [Seyedeh. Z ; 2018]
6Tableau I.6 : Les propriétés physicochimiques de la ciprofloxacine [Seyedeh. Z ; 2018].
Nom chimique
Acide1-cyclopropyl-6-fluoro-4-oxo-7-piperazin-1-yl-quinoline-3-carboxylique
Formule brute C17H18FN3O3
Masse molaire (g/mol) 331,34
Point de fusion (°C) 257
Solubilité Peu soluble dans l’eau
pka pKa1=5.90 ; pKa2=8.89
Description Poudre cristalline de coloration jaune pâle
I.9.Concentrations des antibiotiques dans les eaux usées
Les concentrations en antibiotiques dans les eaux usées urbaines sont fonction de la consommation d’antibiotiques par les populations, du taux d’excrétion après métabolisme et
16
de la persistance des molécules dans l’environnement. Dans les stations d’épuration urbaines, les concentrations minimales en antibiotiques de la famille des macrolides varient de [0,07-0,45 μg/L], les concentrations médianes entre [0,11-0,63 μg/L] [T. Heberer ; 2002].
Les effluents des industries pharmaceutiques sont beaucoup plus concentrés. Ils peuvent atteindre jusqu’à 30 mg/L. Quant aux effluents hospitaliers, ils sont assez concentrés en antibiotiques. Il s’agit surtout de la famille fluoré-quinolones, dont la concentration peut atteindre 87μg/L et celles des macrolides est de 3,2 μg/L [J.N.Louvet ; 2010]
7Tableau I.7 : Quelques antibiotiques présents dans les eaux usées [Kümmerer ; 2004].
I.10.Risques et impact sur l’environnement I.10.1.Les risques pour l’environnement
Le rejet en continu de médicaments et de leurs métabolites dans le milieu aquatique conduit à leur accumulation due à leur persistance [Fenet et Al ; 2006]. Leur présence dans les milieux aquatique dépend de leurs propriétés physico-chimiques et en particulier de leur hydro solubilité, de la stabilité des molécules, de leur demi-vie.
En ce qui concerne les antibiotiques, plusieurs entre eux ont été détectés dans les effluents industriels, certains de ces antibiotiques étant faiblement dégradés par les Stations d’épurations (STEP).La très large utilisation des antibiotiques en médecine humaine et vétérinaire est à l’origine de leur introduction dans l’environnement. Plusieurs antibiotiques sont excrétés de l’organisme sous forme inchangée et peuvent donc rester actifs et présenter des risques pour l’environnement. Ces antibiotiques peuvent aussi se concentrer dans la chaîne alimentaire.
17
I.10.2. Impact sur les écosystèmes aquatiques et terrestres
La plupart des antibiotiques ont un Facteur de Bioconcentration (FBC) autour de «3» comme dans le cas de l’amoxicilline [Jose Luis ; 2009]. D’après Levi (2006), l’évaluation des risques doit porter sur leurs effets toxiques ou allergisants lorsqu’ils se trouvent à l’état de traces au sein de mélanges complexes de polluants dans les eaux d’égouts et les eaux superficielles et sur la vérification qu’ils ne peuvent franchir les étapes de potabilisation. De plus, les antibiotiques peuvent induire des effets liés à leurs cibles spécifiques, c’est-à-dire influencer les biomasses bactériennes de l’environnement que ce soit dans les sols, les eaux superficielles, les stations d’assainissement ou les réseaux de distribution d’eau potable. Dans ce cas, des perturbations peuvent se produire au sein des cycles épurateurs naturels et des dysfonctionnements peuvent apparaître au sein des systèmes d’assainissement (Levi, 2006). Un autre problème qui doit faire l’objet d’une évaluation est la relation avec la présence de bactéries antibiorésistantes. L’antibiorésistance s’explique par l’existence, chez les bactéries, de gènes leur permettant d’échapper à l’action des antibiotiques. Parmi les sources de transfert à l’homme de ces bactéries résistantes, l’eau n’est qu’un des vecteurs. La présence d’antibiotiques peut également affecter la qualité des sols. Ils agiraient de deux manières: - En perturbant la communauté bactérienne par leurs activités antibiotiques
- En créant des résistances parmi les bactéries environnementales ou en apportant des bactéries résistantes transmises par les fumiers et purins, c’est-à-dire crées dans le tube digestif des animaux traités [Kostich ; 2008].
I.10.3. Les risque pour l’homme
Des études récentes ont démontré que les effets sur la santé humaine sont possibles surtout pour les fœtus et les enfants [Pomatiet et al ; 2006], lorsqu’on considère l'effet combiné des mélanges des pharmaceutiques. Yargeau et ses collaborateurs ont démontré que l’exposition des cellules humaines à des produits de dégradation de l’ozonation de sulfaméthoxazole peut causer des changements de morphologie, indiquant ainsi la possibilité des effets sur la santé humaine par l’ingestion d’eau potable contaminée [Yargeau et al ; 2008]. Ternak [Ternak ;
2005] a aussi proposé une hypothèse d’après laquelle les traces des antibiotiques dans la
nourriture et l’eau potable pourraient agir comme des promoteurs de la croissance et de l’obésité chez les humains, de façon similaire comme il est observé chez les animaux.
18
a. Nocivité directe
Un des risques pour l’homme est l’ingestion de résidus d’antibiotiques par les poissons et les coquillages commercialisés avec le risque d’altérer la flore intestinale normale ce qui augmenterait la sensibilité aux infections bactériennes et le risque de sélection de bactéries antibiorésistantes [Cabello ; 2006 -Al Ahmad et al ; 1999]. Cette ingestion, qui concerne aussi les viandes, peut également générer des problèmes d’allergie et de toxicité qui sont difficiles à diagnostiquer en l’absence d’information préventive. Les mêmes problèmes d’allergie et de toxicité peuvent aussi apparaître chez les ouvriers qui manipulent ces poissons dans les fermes piscicoles où ces antibiotiques sont au contact cutané, intestinal et pulmonaire
[Alderman et Hastings ; 1998 - Cabello ; 2006].L’ingestion d’antibiotiques par l’eau du
robinet est également possible puisqu’une étude italienne à montrer que la tylosine y est présente à des teneurs de 0,6 à 1,7 µg/L [Moubarak et al ; 2003].
b. Nocivité indirecte
Un des problèmes posés est celui de la sécurité alimentaire car il peut se produire une colonisation du tube digestif humain par des bactéries résistantes à certains antibiotiques
[Moubarek et al ; 2003]. Mais le risque le plus important, voir le danger principal
del’utilisation des antibiotiques dans l’alimentation des animaux provient de la sélection de bactéries résistantes susceptibles de se transmettre à l’homme par l’alimentation ou du transfert de gènes de résistance à l’homme [Moubarek et al ; 2003].Au Danemark, deux patients sont morts d’une infection à Salmonella typhimurium DT104 [Moubarek et
al ;2003], cette souche bactérienne provenant d’une viande de porc contaminée. Des
observations similaires ont été faites pour les Campylobacters, même aux Etats-Unis, une augmentation des infections acquises à Campylobacter résistants aux antibiotiques s’est également observée [Smith et al ; 1999]. Il est souhaitable que des contrôles de la qualité des aliments permettent une diminution des expositions humaines à ces antibiotiques. En raison des effets mentionnés ci-dessus, il est clair que les substances médicamenteuses, essentiellement les antibiotiques, ne devrait pas envahir notre environnement. Par conséquent, il est nécessaire de traiter les effluents et les eaux résiduaires chargées de médicaments jusqu’à leur quasi-totale élimination.
I.11. Procédés de traitement des eaux contaminées par des polluants médicamenteux
Pour atteindre la qualité conforme à la réglementation à partir d'une eau brute, il est nécessaire de mettre en place des traitements efficaces et multiples. Ils forment une chaîne de
19
traitements, plus ou moins sophistiquée qui doit être évolutive étant donné que les caractéristiques de l’eau à traiter ainsi que les exigences normatives sont susceptibles d’être modifiées.
I.11.1.Procédés biologiques
Les procédés d’épuration par voie biologique sont communément utilisés pour le traitement des produits pharmaceutiques [Gauthier et al ; 2010]. Ces procédés ne sont pas toujours applicables sur les effluents industriels en raison des fortes concentrations de polluants, de la toxicité ou de latérés faible biodégradabilité. Dans le cas des produits pharmaceutiques non favorables au traitement biologique, il est nécessaire d’utiliser des systèmes réactifs beaucoup plus efficaces que ceux adoptés dans les procédés de purification conventionnels. De plus, ces procédés biologiques génèrent des quantités importantes de boues biologiques à traiter
[Bliefert et Perraud ; 2001]. I.11.2.Incinération
L’incinération est un procédé très efficace mais génère un coût de traitement très élevé. Cette technique est très pratique dans le cas de petits volumes présentant une forte concentration. Cependant, elle est soumise à une réglementation de plus en plus stricte à cause de la possibilité de production de dioxines provenant des fumées d’incinération [M.Ben Ousman ;
2014].Ils ont étudié expérimentalement, en four tubulaire, la Co-incinération de 23
médicaments avec des déchets de soin à 850 °C. Dans ces conditions, 13 de ces médicaments ne sont pas complètement détruits mais le pourcentage de produits résiduels ne dépasse jamais 1,19%.
I.11.3.Procédés de transformation
De nombreux travaux portent sur l’utilisation de techniques de dépollution utilisées plutôt en traitement d’eau potable. Ce sont les traitements d’oxydation par l’ozone, par les systèmes induisant des réactions radicalaires : oxydation avancée – ozone/UV – ozone/eau oxygénée – eau oxygénée/UV – réactions de Fenton : fer ferreux, eau oxygénée. Les traitements de photolyse sont aussi utilisables, photolyse directe comme photolyse catalysée. Ce sont tous des traitements de transformation [Seddik.B ; 2015]. Certains composés résistant à la biodégradation peuvent aussi résister à certains traitements d’oxydation.
20
I.11.4.Procédés physiques et physico-chimiques
Les procédés physico-chimiques regroupent les technologies membranaires, les techniques d’adsorption et en particulier l'adsorption sur charbon actif, l'osmose inverse et les procédés de coagulation et de floculation. Le principe de ces techniques est de séparer et concentrer les polluants pour les éliminer ensuite par l'incinération ou par la mise en décharge. Ces techniques nécessitent de ce fait un traitement ultérieur [ Seddik .B ; 2015].
I.12. Le procédé d’adsorption I.12.1. Définition de l’adsorption
D'une manière générale, l'adsorption est un procédé de séparation par lequel certains composants d'une phase sont fixés à la surface d'un adsorbant solide par des liaisons chimiques ou physiques. L’adsorption peut être classée comme physique ou chimique en fonction de la nature des forces mises en jeu [Bouchelkia .N ; 2015]. II existe cinq types d'interfaces selon la nature des deux phases contiguës (gaz / liquide, gaz/solide, liquide/liquide, liquide/solide, solide/solide) et, pour chacun de ces types d'interfaces, on peut distinguer le cas où ces phases sont pures de celui où elles constituent des mélanges
[Bougdah .N ; 2007].
L’adsorption peut être définie comme l’opération fondamentale de Génie Chimique qui exploite l’aptitude de certains solides à concentrer spécifiquement à leur surface les constituants d’une solution permettant ainsi leur séparation. [Hamdoudi.N et SMAILI. F ;
2016].
7
21
I.12.2. Les type d’adsorption
a. Adsorption physique (physisorption)
Dite physisorption, est un phénomène réversible et rapide due à l'existence des forces d'attractions intermoléculaires entre les solides et la substance adsorbée
[Bougdah.N;2007].Ces forces sont dues au mouvement des électrons à l’intérieur des
molécules qui peuvent engendrer de petits moments dipolaires instantanés. Un petit dipôle local peut induire sur une autre molécule un autre dipôle instantané orienté de sorte que l’interaction entre les deux dipôles soit attractive. Des interactions électrostatiques peuvent aussi se combiner aux forces de Van Der Waals. Ces interactions sont importantes entre molécules polaires ou ioniques. Ce type d’interaction se rencontre dans le cas d’adsorbants qui présentent des groupements de surface ou dans le cas des adsorbants contenant des ions (zéolithes). Les molécules ioniques (cations ou anions) peuvent être spécifiquement ou non spécifiquement adsorbées sur les adsorbants qui présentent des groupements de surface. La distinction entre l’adsorption spécifique et non spécifique est basée sur la nature de la réaction d’adsorption et sur l’existence d’un contact direct ou non entre la molécule adsorbée et la surface absorbante [Nigro. S et al ; 2015].
b.Adsorption chimique (chimisorption)
Dans ce cas, l’adsorption est due à la formation d'une liaison chimique, covalente plus permanente, entre l'adsorbat et la surface de l'adsorbant. Par rapport au premier, l'adsorption chimique se distingue par des énergies d'adsorption plus élevées (2 à 100 Kcal mol-1 contre quelques Kcal mol-1) et par une fixation irréversible de l'adsorbat sur des sites d'adsorption très spécifiques. Elle est aussi favorisée à température élevée dans ce type d'adsorption, le temps de rétention est long et seule la première couche liée à la surface adsorbant est chimiquement adsorbée, les autres couches, dans le cas où elles existent, sont retenues par physisorption. Il est à noter également que le phénomène d'adsorption constitue la première étape des réactions nécessitant l'emploi d'un catalyseur solide. Ce phénomène peut alors jouer un rôle prédominant dans la cinétique de réaction chimique [Hamdoudi.N et Smaili.F ;
2016].
Les majeures caractéristiques des deux types d’adsorption sont résumées dans le tableau suivant [Chitour.C ; 2004].
22
8Tableau I.8 : Distinction entre l’adsorption physique et l’adsorption chimique
Propriétés Adsorption physique Adsorption chimique
Température du processus Relativement basse Plus élevé
Chaleur d’adsorption 5 Kcal/mol environ 10 Kcal/mol environ
Liaison chimique Physique Van der Waals Chimique
Cinétique Rapide, réversible Lente, irréversible
Spécificité Processus non spécifique Processus très spécifique
désorption Facile difficile Facile Difficile
Couches formées Mono ou multicouches Uniquement monocouche
I.12.3. Description du mécanisme d’adsorption
Il s’agit d’un transfert d’une phase liquide ou gaz contenant l’adsorbat vers une phase solide avec rétention des solutés à la surface du l’adsorbant. Ce processus se déroule en trois étapes :
Diffusion externe : elle correspond au transfert du soluté (molécule de la phase liquide) du sein de la solution à la surface externe des particules. le transfert de la matière externe dépend des conditions hydrodynamiques de l’écoulement d’un fluide dans un lit d’adsorbant.
Diffusion interne : les particules de fluide pénètrent dans les pores. elle dépend du gradient de concentration du soluté.
Diffusion de surface : elle correspond à la fixation des molécules à la surface des pores
23
8Figure I.8: Mécanisme du transport d’un adsorbat au sein d’un grain du solide1-diffusion
externe ; 2- diffusion interne (dans les pores) ; 3-migration en surface [Nouacer.S; 2014].
I.12.4. Facteurs influençant l’adsorption
Moins une substance est soluble dans le solvant, mieux elle est adsorbée. Il faut rompre le lien entre les solutés et l’eau pour autoriser l’adsorption. La facilité avec laquelle l’adsorbant fixe l’adsorbât, est fonction de la taille de la molécule et de sa solubilité dans l’eau. L’adsorption des composés ionisés est faible. Un haut poids moléculaire réduit la diffusion de l’étape 3 par conséquent, la fixation. Il devient évident que les substances de caractère hydrophobe, peu affines avec l’eau, sont quantitativement adsorbées [Boukhalfa.N;2014].L’équilibre d’adsorption entre un adsorbant et un adsorbât, dépend de nombreux facteurs dont les principaux sont :
Facteurs liés à l’adsorbant:
La nature des groupements fonctionnels La surface spécifique
La distribution des diamètres des pores La masse de l’adsorbant
Facteurs liés à l’adsorbat:
La solubilité de l’adsorbat La polarité
24
La masse molaire La taille des particules
Facteurs liés aux conditions opératoires:
Le pH (le potentiel hydrique) La température du milieu
La vitesse d’agitation du milieu réactionnel
La compétition entre les espèces présentes dans le milieu Le temps de contact entre l’adsorbat et l’adsorbant La force ionique [Bouchelkia.N;2015].
I.12.5. Isothermes d’adsorption
Les isothermes d’adsorption traduisent l’existence ou non d’un équilibre dynamique qui s’établit, à température fixe, entre la fraction d’adsorbat fixée à la surface d’adsorbant et la fraction restant libre en solution. La connaissance des isothermes d’adsorption des corps purs permet de déterminer la quantité de produit adsorbé tout comme la sélectivité d’un solide vis-à-vis des composés du mélange [Bouchelkia.N ; 2015].
I.12.5.1.Classification des isothermes d’adsorption
Les phénomènes d'adsorption sont décrits par des isothermes d'adsorption, qui sont les représentations de la quantité d'adsorbat retenue par l'adsorbant en fonction de la concentration du même adsorbat en solution à l'équilibre avec l'adsorbat. La forme de ces isothermes peut suggérer le type d'interaction entre l'adsorbat et l’adsorbant [Medjdoub.F ;
2017].Expérimentalement, on distingue quatre classes principales nommées: S(Sigmoïde),
25
9Figure I.9: Illustre la forme de chaque type d’isothermes [Hamoudi.N et Smaili.F ; 2016].
La classe S: Les isothermes de cette classe décrivent la plupart du temps une adsorption
coopérative, dans laquelle l'interaction adsorbat-adsorbat est plus forte que celle entre adsorbant et adsorbat. La courbe est sigmoïde et possède donc un point d'inflexion. Cette isotherme est toujours la conséquence de la compétition entre deux mécanismes opposés. Les molécules adsorbées favorisent l'adsorption ultérieure d'autres molécules. Ceci est dû aux molécules qui s'attirent par des forces de Van Der Waals, et se regroupent en îlots dans lesquels elles se tassent les unes contre les autres [Bouchelkia.N ; 2015].
La classe L : Le rapport entre la concentration retenue sur la phase solide et subsistant en
solution décroît quand la concentration augmente : la courbe est donc concave
(FigureI.5).Ceci suggère une saturation progressive du solide. On distingue généralement
deux sous-groupes (avec ou sans plateau strict de saturation) [Medjdoub. F; 2017].
La classe H : l’isotherme de classe H décrit une interaction forte entre adsorbat et adsorbant
et représente un cas extrême du type-L, où la pente à l'origine est très élevée Figure (I.5). Ce cas a été distingué pour représenter les nombreuses situations où le composé possède une grande affinité pour la phase solide que la pente à l'origine semble être infinie, même si une pente réellement infinie est thermodynamiquement impossible [Medjdoub.F; 2017].
26
La classe C : Cela signifie qu'il y a un partage linéaire du soluté entre la phase liquide et la
phase solide [Hamdoudi.N et Smaili .F ; 2016].
I.12.5.2.Modélisation des isothermes d’adsorption A/ Isotherme d’adsorption de(LANGMUIR)
C’est un modèle conceptuel : on suppose que les molécules adsorbées forment une monocouche et occupent une portion αS de la surface S. La théorie de Langmuir implique en fait :
•Il n'existe qu'un seul type de site d'échange à la surface
•Il ne peut y avoir adsorption que d'une seule molécule par site d'adsorption •L’adsorption est limitée à une seule couche
•L’adsorption est réversible
•L’énergie d’adsorption est constante
•L’absence d'interactions entre les molécules adsorbées [Boukhalfa.N ;2014]. L’équation de l’isotherme de LANGMUIR est la suivante
x/m = a ×b×Ce / (1+ b) ×Ce
Cette équation est linéarisée sous la forme suivante [Azzouz .A ; 2011].
x/m = 1 /a +1 /a b Ce
Où
(a) et (b) : constantes relative à l’énergie d’adsorption déterminer expérimentalement Ce : concentration du soluté en solution à l’équilibre (mg/l)
X : la quantité d’impuretés fixée (mg ou m mol) m : la masse du matériau absorbant
27
10Figure I.10: Allure de la courbe d’isotherme de Langmuir [Azzouz .A ; 2011].
B / Isotherme d’adsorption de (FREUNDLICH)
L’isotherme de Freundlich est l’une des plus anciennes équations décrivant l’adsorption (1906). Cette isotherme empirique décrit avec satisfaction l’adsorption du soluté sur des surfaces énergétiquement hétérogènes (cas de l’adsorption non idéale) et en solutions diluées. Freundlich a supposé que l’énergie de liaison ou la chaleur d’adsorption décroît exponentiellement avec l’augmentation de la saturation de la surface du solide, supposition peut être plus proche de la réalité que le modèle de Langmuir. L’équation du modèle se présente comme suit [NIGRO.S ; 2015] :
x /m = Kf Ce1 /n
Kf : constante de Freundlich qui donne une indication grossière sur la capacité d’adsorption
de l’adsorbant. Lorsque Kf augmente, la capacité d’adsorption augmente.
n : constante indicatrice de l’intensité de l’adsorption.
Avec :
n est compris entre 2 et 10, l’adsorption est facile
n est compris entre 1 et 2, l’adsorption est modérément difficile
n est inférieur à 1, l’adsorption est faible. Dans ce cas, une masse important d’adsorbant est utilisée pour récupérer une fraction appréciable du soluté.

![Figure I.7 : Schéma représentant le phénomène d’adsorption [Hamdoudi.N et S. F ; 2016]](https://thumb-eu.123doks.com/thumbv2/123doknet/13830345.443248/33.892.167.713.810.1075/figure-schéma-représentant-phénomène-adsorption-hamdoudi.webp)