Mémoire de Fin d’Étude
En vue de l’obtention du diplôme de MasterAcadémique en Biologie
Option : Pharmacologie Expérimentale
Thème
Membres de Jury Présenté par:
Présidente : M
meHIRECHE Saliha. ABBAS Meriem
Examinatrice : M
meAZZOUZ Wassila. CHINE Khadidja
Encadreur : Dr BENGUEDOUAR Lamia. SAYOUD Khadidja
Année Universitaire 2016-2017
Numéro d’ordre (bibliographique)………..
ةبيــــــحلا و تـعيبـــطلا مولـــــع تـيلك
نسق
بيجولويب
تيئيزجلا
تيولخلاو
Faculté des Sciences de la Nature
et de laVie
Département de Biologie Moléculaire
et Cellulaire
همجلا
ـ
يرو
ـ
جلا ة
ـ
ئازـ
يرـ
يدلا ة
ـ
قم
ـ
يطار
ـ
شلا ة
ـ
يبع
ــة
عتلا ةرازو
ـيلـ
علا م
ـلاـ
بلا و ي
ـحـ
لعلا ث
ـمـ
ي
République Algérienne Démocratique et Populaire
Ministère de l’Enseignement Supérieur et de la Recherche Scientifique
scientifique
Scientifique
-
لجيج-يحي نب قيدصلا دوحه تعهبج
Université Mohammed Seddik Ben Yahia–Jijel
Effet protecteur de l’huile de fruit de Pistacia lentiscus
contre la toxicité hépatique induite par l’association de la
Tout d’abord nous remercions DIEU, qui nous a donné le courage et la force
pour mener ce modeste travail.
Nous tenons à remercier tous ceux qui nous ont aidé de près ou de loin à
élaborer ce travail en particulier notre encadrant Dr BENGADOUAR Lamia,
qui nous a aidé et nous a suivie dans la réalisation de ce travail
D’avoir accepté de le diriger. Nous sommes très reconnaissantes envers elle
pour son aide, ses conseils, sa compétence et sa présence en tout moment.
Nous adressons nos remerciements aux membres du jury M
meHIRECHE
Saliha et M
meAZZOUZ Wassila qui nous ont fait l’honneur d’avoir accepté de
juger notre mémoire de fin d’étude.
Nous souhaitons exprimer nos sincères et profonds remerciements au
Pr LAHOUEL Mesbah et Mr SEBTI Mohamed. Tous les membres du
laboratoire pour leur aide, leurs encouragements et l’ambiance amicale qu’ils
ont su créer.
Enfin, nous remercions profondément nos précieuses familles et nos chères
amies à la fois pour leur soutien infatigable, leur patience admirable et leur
affection continuelle.
Dédicace
Toutes les lettres ne sauraient trouver les mots qu’il faut, Tous les mots ne sauraient exprimer la gratitude,
L’amour, le respect et la reconnaissance. Aussi, c’est tout simplement que :
A l’aide d’Allah, le tout puissant, j’ai pu réaliser ce travail que je dédie :
A mon cher père «Foudil», le plus cher homme au monde, qui a tout donné sans rien recevoir. (Je le remercie du fond de mon cœur).
A ma très chère mère «Saliha » qui m’a protégé, et encouragé je la remercie pour son éternel et infatigable soutien.
A ma chère sœur : Aida. A mes chers frères : Idriss, Zakaria, en témoignage de mon affection et ma
Reconnaissance pour leurs encouragements.
A mes chères Khadidja et Khadidja
A toutes mes amies qui n’ont cessé de m‘encourager
A tout le groupe de ma promotion
Tous ceux que j’aime, sans lesquels tout ceci n’aurait aucun sens.
Dédicace
Toutes les lettres ne sauraient trouver les mots qu’il faut, Tous les mots ne sauraient exprimer la gratitude,
L’amour, le respect et la reconnaissance. Aussi, c’est tout simplement que :
A l’aide d’Allah, le tout puissant, j’ai pu réaliser ce travail que je dédie :
A mon cher père «Moussa», le plus cher homme au monde, qui a tout donné sans rien recevoir. (Je le remercie du fond de mon cœur).
A ma très chère mère «Salima » qui m’a protégé, et encouragé je la remercie pour son éternel et infatigable soutien.
A mes chères sœurs : Assia, Rabiha, Nawal, Houda, Souad, Ikhlasse.
A mes frères : Bilel, Okba, Amin, en témoignage de mon affection et ma Reconnaissance pour leurs encouragements.
A mes chères Meriem et Khadidja
A toutes mes amies qui n’ont cessé de m‘encourager
A tout le groupe de ma promotion
Tous ceux que j’aime, sans lesquels tout ceci n’aurait aucun sens.
Dédicace
Toutes les lettres ne sauraient trouver les mots qu’il faut, Tous les mots ne sauraient exprimer la gratitude,
L’amour, le respect et la reconnaissance. Aussi, c’est tout simplement que :
A l’aide d’Allah, le tout puissant, j’ai pu réaliser ce travail que je dédie:
A mon cher père «Amar», le plus cher homme au monde, qui a tout donné sans rien recevoir. (Je le remercie du fond de mon cœur).
A ma très chère mère « Fatma » qui m’a protégé, et encouragé je la remercie pour son éternel et infatigable soutien.
A ma famille et surtout mes chers frères et mes chères sœurs « Bardo, Sifoo, Loubna, Dalal, Fadila, Aziza, Soumia, Asma, Aicha, Chaima »
A mon frère Mohamed et sa petite famille «Mona, Meriem, Ayoub» A mes beaux-frères «Yazd, Houssine, Fouad, Zakaria»
Aux enfants «Yahia, Assia, Abdo, et Malak, Najmo» A mes chères Meriem et Khadidja
A toutes mes amies qui n’ont cessé de m‘encourager A mes camarades de promotion
A tous ceux qui me sont chers. Chine Khadidja
Sommaire
Liste des figures……….i
Liste des tableaux……….ii
Liste des Abréviation………..iii
Introduction ………...………..1
PREMIERE PARTIE : ETUDE BIBLIOGRAHIQUE
Chapitre I : Doxorubicine et Docétaxel
I.1. Doxorubicine (Adriamycine®)……….02
I.1.1.Historique et définition……….02
I.1.2. Structure moléculaire de la doxorubicine ………...02
I.1.3.Pharmacocinétique………02
I.1.4.Mécanismes d'action de la doxorubicine………..03
I.2 .Docétaxel (Taxotère®)………...05
I.2.1.Définition de docétaxel ………...05
I.2.2.Pharmacocinétique……….………...06
I.2.3.Mécanismes d'action du docétaxel………....07
I.3. L’association entre la doxorubicine et le docétaxel………07
Chapitre II : Hépatotoxicité de la Doxorubicine et du Docétaxel
II.1. Anatomie et physiologique du foie………..………..………....08
II.1.1.Anatomie du foie……….08
II.1.2.Fonction du foie………...09
II.2.Le stress oxydatif et l’hépatotoxicité………...………...10
II.2.1.Stress oxydatif………...10
II.2.1.1Dommage oxydatif aux lipides, protéines et ADN ………...10
Sommaire
II.2.2.Hépatotoxicité………..11
II.2.2.1.Hépatotoxicité induit par la doxorubicine ………12
II.2.2.2.Principales lésions hépatiques du doxorubicine ………...12
II.2.2.3.Stress et apoptose induit par la doxorubicine ………...13
II.2.2.4.Hépatotoxicité induit par le docétaxel………..14
Chapitre III: Pistacia lentiscus
III.1.Pistacia lentiscus………..………..………..15
III.1.1.Etude et description botanique………..………..15
III.1.2.Répartition géographique………..……….16
III.1.3.Activité pharmacologiques et effets thérapeutiques de Pistacia lentiscus ………....17
III.2. L’huiles essentielles ………..………...18
III.3.Etude chimique de l’espèce Pistacia lentiscus ………..………...18
DEUXIEME PARTIE: PARTIE PRATIQUE
Chapitre IV: Matériel et Méthodes
Etude expérimentale
IV. Matériel et Méthodes………....20
IV.1. Etude phytochimique…..………..20
IV.1.1. Dosage des polyphénols totaux……….…...20
IV.1.2. Dosage des flavonoïdes totaux ……….…...21
IV.1.3. Etude du pouvoir anti-radicalaire ………21
IV.2. Etude de l’effet antioxydant de l’huile fixe de Pistacia lentiscus………...22
IV.2.1. Entretien des animaux………..22
IV.2.2.Traitement des animaux ……….…...22
IV.2.3. Prélèvement du sang………23
IV.2.4. Sacrifice des animaux et prélèvement des organes (foie) ………...23
IV.2.5. Mesure les paramètres de stress oxydatif au niveau du foie ………...23
Sommaire
IV.2.5.2. Mesure de l’activité du (GST)………...24
IV.2.5.3.Mesure de l’activité enzymatique de la catalase (CAT)……….25
IV.2.5.4.Mesure de l’activité enzymatique du (SOD)………..26
IV.2.5.5.Dosage du malondialdéhyde (MDA) tissulaire……….…..26
IV.2.6.Dosage des protéines totale………...………...27
IV.3.Dosage des paramètres sériques………27
IV.3.1.Mesure de l’activité d’aspartate amino-transférase (TGO/ASAT) ………..27
IV.3.2.Mesure de l’activité d’alanine amino transférase (TGP /ALAT)………..28
IV.4.Etude statistique……….………29
Chapitre V : Résultats et Discussion
V.1. Résultats et interprétation……….…..30
V.1.1. Les teneurs des polyphénols et des flavonoïdes de l’huile fixe de Pistacia lentiscus …...30
V.1.1.1.Teneur en polyphénols ……….30
V.1.1.2.Teneur en flavonoïdes………...30
V.1.1.3.
L’effet anti-radicalaire de l’huile essentielle et l’huile fixe de Pistacia lentiscus
……..30
V.1.2. Activité antioxydant de l’huile fixe de fruit de Pistacia lentiscus (in vivo)…………..….31
V.1.3. Evaluation des paramètres sériques………...….35
V.2. Discussion……….…37
V.2.1. Rendements des composants phénoliques et flavonoides de l’huile fixe de Pistacia
lentiscus………37
V .2.2.L’activité anti-oxydante des huiles de fruit de Pistacia lentiscus ………37
V.2.3. L’effet hépatoprotecteur de l’huile fixe de Pistacia lentiscus contre la toxicité induite par
l’association de DOX et DTX………...38
V.2.3.1.L’effet de l’huile fixe sur les marqueurs du stress oxydatif……….38
V.2.3.2.L’effet de l’huile fixe sur les paramètres sériques………...40
Conclusion……….…...42
Références bibliographiques………...43
Liste des annexes
Liste des figures
Figure Titre Page
01 Structure moléculaires de la doxorubicine et daunorubicine. 02
02 Structure du complexe doxorubicine-ADN 04
03 Mécanisme d’action de la topo-isomérase II 04
04 Formule chimique développée du docétaxel et principal métabolite. 05
05 Le diagramme schématique du métabolisme du docétaxel 06
06 Mécanisme d’action de docétaxel 07
07 Organisation structurale du lobule hépatique 08
08 Mécanisme général du stress oxydatif induit par divers facteurs et
maladies du foie 11
09 Schéma des différentes voies enzymatiques menant à la formation des
radicaux libres à partir de la doxorubicine 13
10 Arbusto de Pistacia lentiscus 15
11 Les fruits, feuilles et fleurs de Pistacia lentiscus 16
12 Distribution géographique de genre pistacia 17
13 Protocole expérimental des traitements 23
14 Principe de dosage du glutathion 24
15 Principe de dosage du MDA 26
16 Effet scavenger du radical DPPH° par les huiles essentielle et fixe de laplante P.lentiscus à différentes concentrations en comparaison avec la
vitamine C 30
17 Variation du taux de GSH cytosolique hépatique 31
18 Variations de l’activité enzymatique de la GST cytosolique hépatique 32
19 Variations de l’activité enzymatique de la catalase cytosolique hépatique 33
20 Variations de l’activité enzymatique du SOD cytosolique hépatique 34
Liste des tableaux
Tableau Titre Page
01
Taxonomie de Pistacia lentiscus L 15
02 Effets des traitements sur les activités enzymatiques de TGO et TGP
Liste des Abréviations
ADN : Acide désoxyribonucléique
ALAT : Alanine-amino-transferase
AlCl3: Trichlorure d’aluminium
ASAT : Aspartate-amino-transferase
ATP : Adénosine triphosphate.
BBC : Bleu brillant de coomassie.
BSA : Bovin sérum albumine
CAT : Catalase
CDNB : 1-Chloro, 2.4-di nitrobenzène
DMSO: Diméthylsulfoxyde
DOX : Doxorubicine
DPPH: 2, 2’-diphenyl-1-picyrlhydrazyl.
DTX : Docétaxel
DTNB : 5,5 dithiodis-2-nitrobenzoique.
ERO : Espèces réactive de l’oxygène.
GPX : Glutathion peroxydase.
GSH : Glutathion réduit.
GSSG : Glutathion oxydé
GST : Glutathion S-transférase
HEPL: Huile Essentielle de Pistacia lentiscus
HFPL: Huile Fixe de Pistacia lentiscus
H2O2: Peroxyde d'hydrogène.
IP: Intrapéritonéale
LDH : Lactate déshydrogénase
MDA : Malondialdehyde.
MDH: Malate Dehydrogénase
NAD+:Nicotineamide Adenine Dinucléotide
NADH: Nicotineamide Adenine Dinucléotide
réduit.
NADP+: Nicotineamide Adenine Dinucléotide Phosphate.
NADPH,H: Nicotineamide
Adenine Dinucléotide Phosphate réduit.
NH2: Groupement amine.
NO· : Monoxyde d'azote.
O2•-: Anion superoxide.
1O2 :L’oxygène singulet.
OH·: Radical hydroxyle.
ONOO-:Peroxynitrite.
rmp : Routeur par minute.
ROOH: Radical
hydroperoxyde.
ROS : Reactive oxygen species
SOD: Superoxyde dismutase.
P 450 : Cytochrome P 450
PAL : Phosphatase alcaline
TBA: Acide Thiobarbiturique.
TBARS: Thiobarbituric Acid
Reactive Substances
TCA: Acide thiobarbiturique.
TGO: Transaminase glutamate
Oxaloacétate
TNB: Thionitrobenzoique
Introduction
La chimiothérapie est l'une des principales méthodes de traitement de plusieurs types de cancer, permettant l'utilisation d’une combinaison de différents types de médicaments antinéoplasiques pour augmenter l’efficacité(De Rossi, 2009).
les anthracyclines sont des inhibiteurs efficaces de l'activité de la topoisomérase II ou I (Schimmel et al., 2004). La cytotoxicité des anthracyclines est également associé à la génération des espèces réactives de l’oxygène (ERO) et les espèces réactives d'azote (RNS) (Nicolson et al., 2008). Les taxanes sont des inhibiteurs mitotiques qui anticancéreuse contre les cancers du sein et du poumon (Orr et al., 2003). Malgré de nombreuses études sur les ERO mitochondriales qui sont formées par les taxanes, leur mode d'action reste être élucider (Conklin, 2004;Ozben, 2007). Les combinaisons de taxanes avec doxorubicine sont largement utilisées pour traiter le cancer du sein avancé et métastatique et autres formes tumeurs solides. Ces médicaments sont très efficaces, ne présentent pas la résistance croisée et ont des profils de toxicité différents (Navarro et al., 2006). Comme pour les autres agents antinéoplasiques, ils causent des effets secondaires, et des dommages au niveau du foie provoquées par ces médicaments (Field et al., 2008).
Les flavonoïdes sont des substances naturelles qui acquièrent diverses propriétés pharmacologiques et des applications thérapeutiques, elles sont dues aux structures phénoliques qui ont l'efficacité antioxydant et de limiter les processus médités par les radicaux libres (Brown et al., 2007). Pistacia lentiscus est une plante à fleurs qui pousse dans la région méditerranée. Il est traditionnellement utilisé dans le traitement de plusieurs maladies comme l’eczéma, infections de la gorge, la diarrhée, les calculs rénaux, la jaunisse, l'asthme et l'ulcère gastrique(Duru et al., 2003).
Plusieurs hypothèses physiopathologiques ont été formulées, avec un rôle probablement majeur de la production de radicaux libres de l’oxygène et la peroxydation des lipides membranaires des hépatocytes : Est-ce que la combinaison de la doxorubicine et le docétaxel peuvent provoquée des dommages au niveau du foie ? Est-ce que l’huile fruit de Pistacia lentiscus peut lutter contre les effets toxiques de la combinaison de doxorubicine et le docétaxel ? Et si oui comment protéger le foie contre cette toxicité?
Notre objectif a été basée sur :
-L’étude phytochimique de l’huile essentielle et fixe de Pistacia lentiscus et son activité anti radicalaire.
-L’évaluation de la toxicité hépatique par l’association doxorubicine et docétaxel in vivo. -L’évaluation de l’effet préventif d’huile fixe de Pistacia lentiscus sur cette hépatotoxicité.
Première partie :
Etude
Chapitre I
:
Doxorubicine et
Docétaxel
Chapitre I
Doxorubicine et Docétaxel
I.1 .Doxorubicine (Adriamycine (ADR) ou hydroxy daunorubicine) I.1. 1.Historique et définition
La doxorubicine est un médicament anticancéreux de la famille des anthracyclines produite tout naturellement par des actinobactéries de genre Streptomyces, elle a été isolée pour la première fois en 1963 et approuvée par la Food and Drug Administration en 1974 (Minotti et al., 2004). Depuis, c'est le meilleur antinéoplasique connu et le plus utilisé, entre autres, dans le traitement des cancers tels que les leucémies et les tumeurs solides (Mizutani et al., 2005).
I.1.2. Structure moléculaire
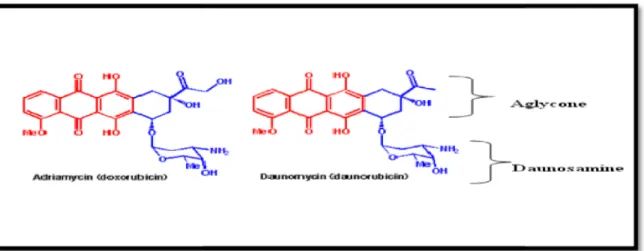
La structure de la doxorubicine comprend deux parties
Une aglycone composée d'un noyau polyaromatique tétracyclique hydrophobe quasi plan portant des fonctions quinones et hydroquinones, qui leur permet de fonctionner comme accepteur et donneur d’électrons (Hortobàgyi, 1997).
Un aminosucre, la daunosamine, lié au carbone C7 de l'aglycone par une liaison glycosidique. La doxorubicine(ou Adriamycine) a une masse moléculaire de 578.98 Da, elle est composée d’un noyau tétracyclique chromophore relié par une liaison glycosidique à un substitut glucosamine (figure 01) (Hortobàgyi, 1997).
Figure 01 : Structure moléculaires de la doxorubicine et daunorubicine (Hortobàgyi, 1997). I.1.3.La pharmacocinétique de la doxorubicine
L'absorption etdistribution
La doxorubicine est injectée par voie intraveineuse. Ce médicament est rapidement distribué aux divers tissus du corps où il est concentré dans les noyaux des cellules, la concentration est élevée dans le foie et le cœur, les poumons, les reins, la rate et l'intestin grêle, tandis qu'une
Chapitre I
Doxorubicine et Docétaxel
I.1 .Doxorubicine (Adriamycine (ADR) ou hydroxy daunorubicine) I.1. 1.Historique et définition
La doxorubicine est un médicament anticancéreux de la famille des anthracyclines produite tout naturellement par des actinobactéries de genre Streptomyces, elle a été isolée pour la première fois en 1963 et approuvée par la Food and Drug Administration en 1974 (Minotti et al., 2004). Depuis, c'est le meilleur antinéoplasique connu et le plus utilisé, entre autres, dans le traitement des cancers tels que les leucémies et les tumeurs solides (Mizutani et al., 2005).
I.1.2. Structure moléculaire
La structure de la doxorubicine comprend deux parties
Une aglycone composée d'un noyau polyaromatique tétracyclique hydrophobe quasi plan portant des fonctions quinones et hydroquinones, qui leur permet de fonctionner comme accepteur et donneur d’électrons (Hortobàgyi, 1997).
Un aminosucre, la daunosamine, lié au carbone C7 de l'aglycone par une liaison glycosidique. La doxorubicine(ou Adriamycine) a une masse moléculaire de 578.98 Da, elle est composée d’un noyau tétracyclique chromophore relié par une liaison glycosidique à un substitut glucosamine (figure 01) (Hortobàgyi, 1997).
Figure 01 : Structure moléculaires de la doxorubicine et daunorubicine (Hortobàgyi, 1997). I.1.3.La pharmacocinétique de la doxorubicine
L'absorption etdistribution
La doxorubicine est injectée par voie intraveineuse. Ce médicament est rapidement distribué aux divers tissus du corps où il est concentré dans les noyaux des cellules, la concentration est élevée dans le foie et le cœur, les poumons, les reins, la rate et l'intestin grêle, tandis qu'une
Chapitre I
Doxorubicine et Docétaxel
I.1 .Doxorubicine (Adriamycine (ADR) ou hydroxy daunorubicine) I.1. 1.Historique et définition
La doxorubicine est un médicament anticancéreux de la famille des anthracyclines produite tout naturellement par des actinobactéries de genre Streptomyces, elle a été isolée pour la première fois en 1963 et approuvée par la Food and Drug Administration en 1974 (Minotti et al., 2004). Depuis, c'est le meilleur antinéoplasique connu et le plus utilisé, entre autres, dans le traitement des cancers tels que les leucémies et les tumeurs solides (Mizutani et al., 2005).
I.1.2. Structure moléculaire
La structure de la doxorubicine comprend deux parties
Une aglycone composée d'un noyau polyaromatique tétracyclique hydrophobe quasi plan portant des fonctions quinones et hydroquinones, qui leur permet de fonctionner comme accepteur et donneur d’électrons (Hortobàgyi, 1997).
Un aminosucre, la daunosamine, lié au carbone C7 de l'aglycone par une liaison glycosidique. La doxorubicine(ou Adriamycine) a une masse moléculaire de 578.98 Da, elle est composée d’un noyau tétracyclique chromophore relié par une liaison glycosidique à un substitut glucosamine (figure 01) (Hortobàgyi, 1997).
Figure 01 : Structure moléculaires de la doxorubicine et daunorubicine (Hortobàgyi, 1997). I.1.3.La pharmacocinétique de la doxorubicine
L'absorption etdistribution
La doxorubicine est injectée par voie intraveineuse. Ce médicament est rapidement distribué aux divers tissus du corps où il est concentré dans les noyaux des cellules, la concentration est élevée dans le foie et le cœur, les poumons, les reins, la rate et l'intestin grêle, tandis qu'une
Chapitre I
Doxorubicine et Docétaxel
faible concentration dans le cerveau est relevée. La demi-vie de distribution initiale d'environ 5
minutes, tandis que son élimination est lente à partir des tissus qui se traduisent par une demi-vie terminale de 20 à 48 heures. La doxorubicine ne traverse pas la barrière hémato-encéphalique (Mross et al., 1990).
Métabolisme
La doxorubicine est métabolisée, au niveau du foie, en doxorubicinol, son métabolite actif principal (Lal et al., 2010). Elle subit un processus d'oxydo-réduction par une C13 aldocétoréductase, présente dans le cœur, mais absente du plasma, qui transforme la doxorubicine en doxorubicinol, métabolite moins actif que la molécule-mère sur le plan tumoral mais plus toxique sur le cœur par son action sur la pompe à calcium du sarcoplasme (Doroshow, 1991). Le métabolisme de la doxorubicine entraine l’apparition des ROS, principalement l’anion superoxyde O2 et le radical hydxyle HO ; ces ROS sont créés par deux voies différentes : la voie enzymatique impliquant la mitochondrie et faisant intervenir les flavines réductases placées au niveau de la membrane mitochondriale et la voie non enzymatique par la réaction d’Haber-Weiss (Petit, 2004).
Élimination
Elle est éliminée principalement par voie biliaire, mais également par voie rénale. En effet, 10 à 15 % de la dose administrée sont retrouvées dans les urines, ce qui explique la coloration rouge de l'urine, quelques jours après le traitement (Tannock et al., 2004).
I.1.4.
Mécanisme d'action antitumorale de la doxorubicine
La doxorubicine est un antibiotique cytotoxique anthracyclinique. Elle exerce ses effets anticancéreux et toxiques selon plusieurs mécanismes dont l’intercalation à l’ADN, l’inhibition de la topoisomérase II et la formation de radicaux libres (Marianne, 2015).
Interaction avec la molécule d'ADN
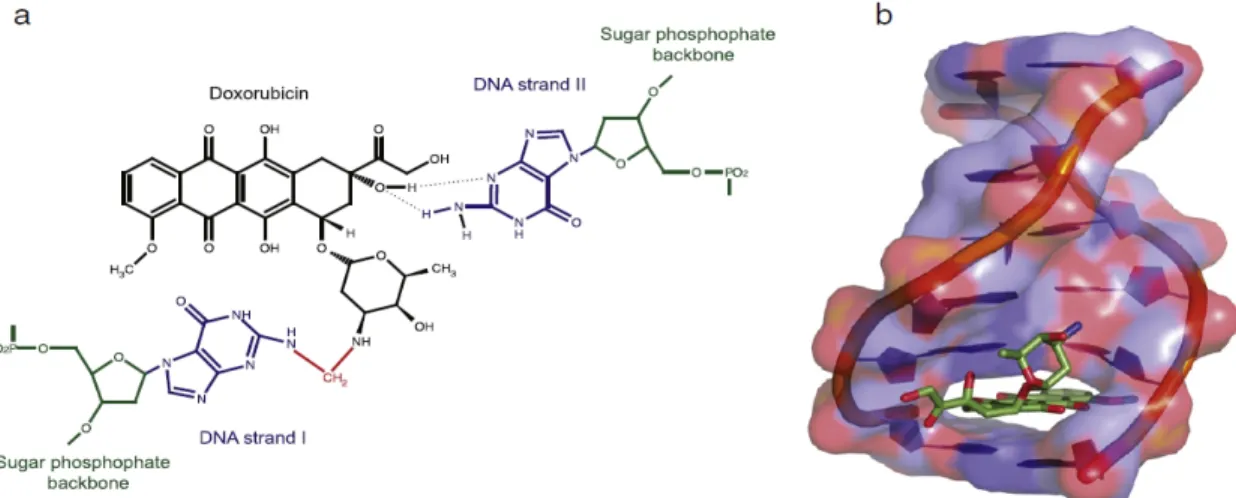
La doxorubicine agirait sur les cellules selon plusieurs modes d'action. Tout d'abord, près de 99.8% de son accumulation se ferait au niveau du noyau chez des cellules sensibles à cause de sa très grande affinité avec l'ADN (Cutts et Phillips, 1995). Sa structure plane (figure 02), lui permettrait de s'insérer entre deux paires de bases azotées au niveau de la guanine du côté S' (S'-GCN) modifiant ainsi la structure de l'ADN (Cutts et Phillips, 1995; Iarussi et al.,2001).
Chapitre I
Doxorubicine et Docétaxel
Figure 02:Structure du complexe doxorubicine-ADN. (a) La doxorubicine forme une liaison
covalente (montrée en rouge) avec de la guanine sur un brin d'ADN médié par le formaldéhyde et l'hydrogène liens avec la guanine sur le brin opposé (b) Une structure d'intercalation de doxorubicine dans l'ADN. La doxorubicine s'impose dans l'ADN et écarte les paires de bases
flanquantes avec le fragment de sucre assis dans la rainure mineure (Cutts et al., 2005.)
Inhibition de l’enzyme topo-isomérase II
Cette modification inhiberait l'action de la topoisomérase II, qui est un enzyme nucléaire chargée de modifier l'ADN lors de la transcription, la réplication et la mitose (Potter et Rabinovitch, 2005). La doxorubicine se relie avec le topo-isomérase II par des liaisons covalentes stables (irréversibles) formant ainsi le complexe topo-isomérase II -ADN-DOXO qui inhibe l’enzyme topo-isomérase II ce qui conduit à la mort cellulaire) (Andrieu et al.,1999).
Figure 03 : Mécanisme d’action de la topo-isomérase II (Rademaker-Lakhai et al., 2004 ; Nowotnik
Chapitre I
Doxorubicine et Docétaxel
Production des radicaux libres
Les composés de dégradation de la doxorubicine entraîneraient la formation de radicaux libres tels que l'anion superoxyde (O2●¯), le peroxyde d'hydrogène (H2O2), et le radical hydroxyle (OH●) (Singal et al., 1997). Ces radicaux libres endommageraient l'ADN, les protéines et les constituants des membranes cellulaires (Iarussi et al., 2001).
I.2.Docétaxel (Taxotère) I.2.1Définition du docétaxel
Le docétaxel ou 3-ter-butoxycarbonylamino-2-hydroxy-3-phenylpropionate de4-acetoxy-2α-berzoyloxy-5β-20-epoxy-1,7β,10β-trihydroxy-9-oxo-tax-11-éné 13αyle, (tri-hydrate) (Florent,2007) est un agent cytotoxique de la famille des taxanes synthétisé à partir d’aiguilles d’if d’Europe (Taxus baccata) par chimie extractive. Ce composé de masse moléculaire de 807,9 g/mole pour la forme anhydre, et 861,9 g/mole pour la forme tri hydratée, est insoluble dans l’eau et soluble dans l’éthanol (100 mg/ml), ce qui nécessite de le diluer dans un solvant hydroalcoolique à 13% en présence de polysorbate 80 avant toute utilisation pour perfusion. Le docétaxel est commercialisé sous le nom de Taxotère®(actuellement par le laboratoire Sanofi-Aventis) en Europe depuis juillet 1995 (Florent, 2007).
Figure04: Formule chimique développée du docétaxel et principal métabolite (Royer et al., 1996). I.2.2.Pharmacocinétique
Le docétaxel est donc administré en clinique en perfusion intraveineuse d’une heure selon des doses allant de 20 mg/m2/semaine jusqu’à 115mg/m2/3 semaines d’après les données de la
Chapitre I
Doxorubicine et Docétaxel
Production des radicaux libres
Les composés de dégradation de la doxorubicine entraîneraient la formation de radicaux libres tels que l'anion superoxyde (O2●¯), le peroxyde d'hydrogène (H2O2), et le radical hydroxyle (OH●) (Singal et al., 1997). Ces radicaux libres endommageraient l'ADN, les protéines et les constituants des membranes cellulaires (Iarussi et al., 2001).
I.2.Docétaxel (Taxotère) I.2.1Définition du docétaxel
Le docétaxel ou 3-ter-butoxycarbonylamino-2-hydroxy-3-phenylpropionate de4-acetoxy-2α-berzoyloxy-5β-20-epoxy-1,7β,10β-trihydroxy-9-oxo-tax-11-éné 13αyle, (tri-hydrate) (Florent,2007) est un agent cytotoxique de la famille des taxanes synthétisé à partir d’aiguilles d’if d’Europe (Taxus baccata) par chimie extractive. Ce composé de masse moléculaire de 807,9 g/mole pour la forme anhydre, et 861,9 g/mole pour la forme tri hydratée, est insoluble dans l’eau et soluble dans l’éthanol (100 mg/ml), ce qui nécessite de le diluer dans un solvant hydroalcoolique à 13% en présence de polysorbate 80 avant toute utilisation pour perfusion. Le docétaxel est commercialisé sous le nom de Taxotère®(actuellement par le laboratoire Sanofi-Aventis) en Europe depuis juillet 1995 (Florent, 2007).
Figure04: Formule chimique développée du docétaxel et principal métabolite (Royer et al., 1996). I.2.2.Pharmacocinétique
Le docétaxel est donc administré en clinique en perfusion intraveineuse d’une heure selon des doses allant de 20 mg/m2/semaine jusqu’à 115mg/m2/3 semaines d’après les données de la
Chapitre I
Doxorubicine et Docétaxel
Production des radicaux libres
Les composés de dégradation de la doxorubicine entraîneraient la formation de radicaux libres tels que l'anion superoxyde (O2●¯), le peroxyde d'hydrogène (H2O2), et le radical hydroxyle (OH●) (Singal et al., 1997). Ces radicaux libres endommageraient l'ADN, les protéines et les constituants des membranes cellulaires (Iarussi et al., 2001).
I.2.Docétaxel (Taxotère) I.2.1Définition du docétaxel
Le docétaxel ou 3-ter-butoxycarbonylamino-2-hydroxy-3-phenylpropionate de4-acetoxy-2α-berzoyloxy-5β-20-epoxy-1,7β,10β-trihydroxy-9-oxo-tax-11-éné 13αyle, (tri-hydrate) (Florent,2007) est un agent cytotoxique de la famille des taxanes synthétisé à partir d’aiguilles d’if d’Europe (Taxus baccata) par chimie extractive. Ce composé de masse moléculaire de 807,9 g/mole pour la forme anhydre, et 861,9 g/mole pour la forme tri hydratée, est insoluble dans l’eau et soluble dans l’éthanol (100 mg/ml), ce qui nécessite de le diluer dans un solvant hydroalcoolique à 13% en présence de polysorbate 80 avant toute utilisation pour perfusion. Le docétaxel est commercialisé sous le nom de Taxotère®(actuellement par le laboratoire Sanofi-Aventis) en Europe depuis juillet 1995 (Florent, 2007).
Figure04: Formule chimique développée du docétaxel et principal métabolite (Royer et al., 1996). I.2.2.Pharmacocinétique
Le docétaxel est donc administré en clinique en perfusion intraveineuse d’une heure selon des doses allant de 20 mg/m2/semaine jusqu’à 115mg/m2/3 semaines d’après les données de la
Chapitre I
Doxorubicine et Docétaxel
littérature (Extra et al., 1993).Le docétaxel est très fortement lié aux protéines plasmatiques (à plus de 92 %), de manière concentration indépendante, notamment à l’alpha-1-glycoprotéine acide (AAG), à l’albumine et aux lipoprotéines (Urien et al., 1996). La pharmacocinétique du docétaxel a été particulièrement étudiée avant sa commercialisation. Une étude de pharmacocinétique de population a montré que l’âge, la surface corporelle, le taux d’alpha-1 glycoprotéine acide (AAG), le taux de transaminases et le taux de phosphatases alcalines semblaient avoir une influence sur l’élimination du docétaxel (Bruno et al.,1996). La clairance d’élimination est diminuée chez les patients âgés ou chez les patients dont le taux d’AAG ou d’enzymes hépatiques sont élevés (Bruno et al.,1996).
Métabolisme et excrétion
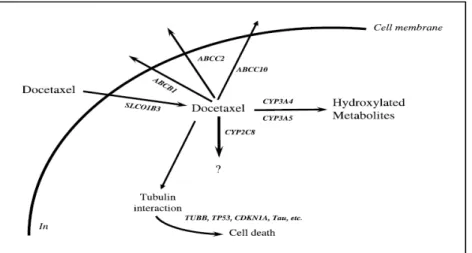
Le docétaxel est éliminé essentiellement par métabolisme hépatique (Clarke et Rivory, 1999), impliquant les isoenzymes CYP3A4 (Marre et al., 1996) et CYP3A5 (Shou et al., 1998) de la sous famille CYP3A du cytochrome P450. Le principal métabolite est l’hydroxy docétaxel par monohydroxylation du groupe tert-butyl de la chaîne latérale en C13 (Royer et al.,1996). Soixante-quinze pour cent du produit administré se retrouve dans les fèces principalement sous forme de métabolites et en faible proportion sous forme inchangée (Clarke et Rivory, 1999). Le docétaxel ainsi que ses métabolites sont sécrétés dans la bile, subissent un cycle entérohépatique et sont aussi sécrétés directement par les entérocytes. Ces phénomènes mettent en jeu un transporteur protéique la P-glycoprotéine (P-gp) (Van Zuylen et al., 2000).
Figure 05 :Le diagramme schématique du métabolisme du docétaxel et le transport.
CYP2C8, CYP3A4, CYP3A5, isoformes 2C8, 3A4 et 3A5 du cytochrome P450; ABCB1, Transporteur de cassette à liaison ATPB1 (glycoprotéine P), ABCC2, cassette ATP binding Transporteur C2 (MRP2, cMOAT); ABCC10, transporteur de cassette à liaison ATP C10 (MRP7); OATP1B3, polypeptide de
Chapitre I
Doxorubicine et Docétaxel
I.2.3.Mécanisme d’action du docétaxel
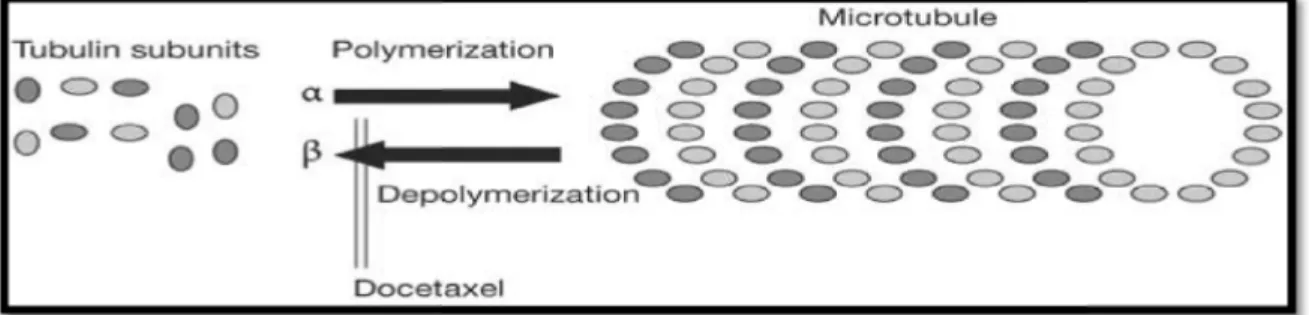
Le docétaxel agit sur les microtubules présents dans l’ensemble des cellules eucaryotes. Les fonctions des microtubules sont multiples, incluant les mouvements deschromosomes lors de la mitose, le maintien de la morphologie cellulaire, la sécrétion d’hormones, le transport de granules, l’accrochage de récepteurs à la membrane et la mobilité cellulaire (Rowinski et al., 1990). Les microtubules sont constitués grâce à la polymérisation de tubuline, protéine de 100 KDa composée de 2 sous unités (α et β). Il existe un équilibre dynamique entre la polymérisation et la dépolymérisation. L’activité globale du docétaxel est de favoriser la polymérisation de la tubuline en microtubules et d’inhiber la dépolymérisation de ces microtubules, ce qui aboutit à la formation de microtubules stables mais non fonctionnels et entraîne l’interruption de la mitose et de la réplication cellulaire (Lavelle et al., 1995).
Figure 06: Mécanisme d’action de docétaxel (Mackler et Pienta, 2005) I.3. L’association entre la doxorubicine et le docétaxel
La combinaison de docétaxel et de doxorubicine a été prouvé efficace dans le traitement de première ligne de métastatique cancer du sein, avec des taux de réponse élevés et acceptable toxicité (Khayat et Antoine, 1999). L'activité clinique prometteuse du docétaxel a également favorisé un intérêt considérable pour combiner ce médicament avec d'autres agents antitumoraux (Zeng et al., 2000). Cependant, d’autres analyses ont été démontrées que la doxorubicine pourrait interférer avec l'effet cytotoxique de le docétaxel à la fois sur l'arrêt mitotique et la mort cellulaire apoptotique (Zeng et al., 2000). De plus, les taxanes augmentent la conversion de la doxorubicine au métabolite le plus toxique doxorubicinol (Minotti et al., 2004) . Malheureusement, il ya aussi un côté sombre de ce thérapie comme des taxanes peut augmenter la toxicité de la doxorubicine, comme la cardiotoxicité, neurotoxicité, hépatotoxicité, néphrotoxicité et d'autres. La combinaison de doxorubicine avec des taxanes sont apparues pour être plus toxique que DOX seul (Colombo et al., 1999).
Chapitre I
Doxorubicine et Docétaxel
I.2.3.Mécanisme d’action du docétaxel
Le docétaxel agit sur les microtubules présents dans l’ensemble des cellules eucaryotes. Les fonctions des microtubules sont multiples, incluant les mouvements deschromosomes lors de la mitose, le maintien de la morphologie cellulaire, la sécrétion d’hormones, le transport de granules, l’accrochage de récepteurs à la membrane et la mobilité cellulaire (Rowinski et al., 1990). Les microtubules sont constitués grâce à la polymérisation de tubuline, protéine de 100 KDa composée de 2 sous unités (α et β). Il existe un équilibre dynamique entre la polymérisation et la dépolymérisation. L’activité globale du docétaxel est de favoriser la polymérisation de la tubuline en microtubules et d’inhiber la dépolymérisation de ces microtubules, ce qui aboutit à la formation de microtubules stables mais non fonctionnels et entraîne l’interruption de la mitose et de la réplication cellulaire (Lavelle et al., 1995).
Figure 06: Mécanisme d’action de docétaxel (Mackler et Pienta, 2005) I.3. L’association entre la doxorubicine et le docétaxel
La combinaison de docétaxel et de doxorubicine a été prouvé efficace dans le traitement de première ligne de métastatique cancer du sein, avec des taux de réponse élevés et acceptable toxicité (Khayat et Antoine, 1999). L'activité clinique prometteuse du docétaxel a également favorisé un intérêt considérable pour combiner ce médicament avec d'autres agents antitumoraux (Zeng et al., 2000). Cependant, d’autres analyses ont été démontrées que la doxorubicine pourrait interférer avec l'effet cytotoxique de le docétaxel à la fois sur l'arrêt mitotique et la mort cellulaire apoptotique (Zeng et al., 2000). De plus, les taxanes augmentent la conversion de la doxorubicine au métabolite le plus toxique doxorubicinol (Minotti et al., 2004) . Malheureusement, il ya aussi un côté sombre de ce thérapie comme des taxanes peut augmenter la toxicité de la doxorubicine, comme la cardiotoxicité, neurotoxicité, hépatotoxicité, néphrotoxicité et d'autres. La combinaison de doxorubicine avec des taxanes sont apparues pour être plus toxique que DOX seul (Colombo et al., 1999).
Chapitre I
Doxorubicine et Docétaxel
I.2.3.Mécanisme d’action du docétaxel
Le docétaxel agit sur les microtubules présents dans l’ensemble des cellules eucaryotes. Les fonctions des microtubules sont multiples, incluant les mouvements deschromosomes lors de la mitose, le maintien de la morphologie cellulaire, la sécrétion d’hormones, le transport de granules, l’accrochage de récepteurs à la membrane et la mobilité cellulaire (Rowinski et al., 1990). Les microtubules sont constitués grâce à la polymérisation de tubuline, protéine de 100 KDa composée de 2 sous unités (α et β). Il existe un équilibre dynamique entre la polymérisation et la dépolymérisation. L’activité globale du docétaxel est de favoriser la polymérisation de la tubuline en microtubules et d’inhiber la dépolymérisation de ces microtubules, ce qui aboutit à la formation de microtubules stables mais non fonctionnels et entraîne l’interruption de la mitose et de la réplication cellulaire (Lavelle et al., 1995).
Figure 06: Mécanisme d’action de docétaxel (Mackler et Pienta, 2005) I.3. L’association entre la doxorubicine et le docétaxel
La combinaison de docétaxel et de doxorubicine a été prouvé efficace dans le traitement de première ligne de métastatique cancer du sein, avec des taux de réponse élevés et acceptable toxicité (Khayat et Antoine, 1999). L'activité clinique prometteuse du docétaxel a également favorisé un intérêt considérable pour combiner ce médicament avec d'autres agents antitumoraux (Zeng et al., 2000). Cependant, d’autres analyses ont été démontrées que la doxorubicine pourrait interférer avec l'effet cytotoxique de le docétaxel à la fois sur l'arrêt mitotique et la mort cellulaire apoptotique (Zeng et al., 2000). De plus, les taxanes augmentent la conversion de la doxorubicine au métabolite le plus toxique doxorubicinol (Minotti et al., 2004) . Malheureusement, il ya aussi un côté sombre de ce thérapie comme des taxanes peut augmenter la toxicité de la doxorubicine, comme la cardiotoxicité, neurotoxicité, hépatotoxicité, néphrotoxicité et d'autres. La combinaison de doxorubicine avec des taxanes sont apparues pour être plus toxique que DOX seul (Colombo et al., 1999).
Chapitre II:
Hépatotoxicité
de la
Doxorubicine et
du Docétaxel
Chapitre II Hépatotoxicité de la Doxorubicine et du Docétaxel
II.1.Anatomie et physiologique du foie II.1.1.Anatomie
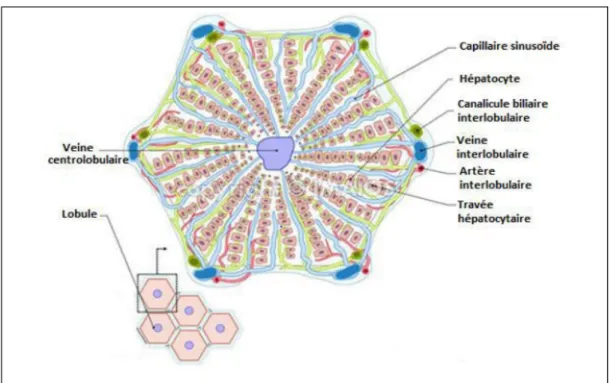
Le foie représente l'organe interne le plus volumineux du corps humain, son poids est de 1400 à 1500g. Il occupe la région de l’hypocondre droit, s’étendant du 5èmeespace intercostal vers le bas, dans l’alignement du centre de la clavicule, jusqu’au rebord costal droit. Il a trois faces : face supérieure ou diaphragmatique, face inférieure ou viscérale : elle est parcourue par trois sillons qui dessinent grossièrement la lettre H et face postérieure. Cet organe est formé de deux lobes principaux, le droit et le gauche, ainsi que de deux petits lobes, à savoir, le lobe caudé à la face postérieure, et le lobe carré à la face inférieure, et chaque lobe se subdivise lui-même en un grand nombre d'unités fonctionnelles appelées lobules. Ces lobules sont formés de cellules hépatiques, les hépatocytes (figure 07) (Shaffer et Myers ,1999).
Figure 07 : Organisation structurale du lobule hépatique (Wallace et Meyer, 2010).
Cellules composant le foie
Cellules parenchymateuses : Les hépatocytes
Les cellules parenchymateuses, ou hépatocytes, sont les plus nombreuses du foie, et environ 80% du volume hépatique (Meeks et al.,1991).
Chapitre II Hépatotoxicité de la Doxorubicine et du Docétaxel
Cellules non parenchymateuses
Bien que le foie s'avère composé majoritairement de cellules parenchymateuses, la paroi descapillaires sinusoïdes comprend 4 autres types cellulaires : les cellules endothéliales, lescellulesde Küpffer, les cellules de Itoet les cellules de Pit(Kmiec, 2001).Ensemble, ces cellules non parenchymateuses représentent environ 40 % de la totalité des cellules du foie mais n'occupent que 6.3 % du volume hépatique total (Thomson et Shaffer, 2005).
II.1.2.Les fonctions du foie II.1.2.1. Fonctions métaboliques
Le foie participe pratiquement à toutes les fonctions métaboliques de l’organisme, à la fois dans l'anabolisme et le catabolisme. Il représente de ce fait, une véritable usine métabolique dont la destruction totale est incompatible avec la vie (Siecar, 2008).
II.1.2.2. Fonction biliaire
Les cellules hépatiques sécrètent quotiennement de 800 à 1000 ml de bile, liquide jaunâtre et légèrement alcalin composé essentiellement d’eau, d’ions, d’acides et de sels biliaires, de cholestérol et de la bilirubine (pigment provenant surtout de la dégradation des hématies) (Jacquemin, 1998). Le surplus de bile est emmagasiné dans la vésicule biliaire. Les sous-produits provenant de la décomposition de drogues ou de substances toxiques transformées par le foie ont acheminés par la bile et éliminés du corps (Highle et franciscus, 2004).
II.1.2.3.Fonction de détoxification
Les systèmes de détoxication assurent une biotransformation des substances étrangères(Xènobiotiques) pour diminuer leur lipophilie, augmenter leur polarité et favoriser leur élimination (Jocelyn, 2011). Les hépatocytes assurent le traitement des déchets toxiques du catabolisme des protéines ;ammoniaque et le convertit en urée, grâce à deux systèmes enzymatiques hépatocytaires impliqués dans son élimination rénale (Ganong et al., 2012).
Chapitre II Hépatotoxicité de la Doxorubicine et du Docétaxel
II.2. Le stress oxydatif et l’hépatotoxicité II.2.1.Stress oxydatif
Le stress oxydant est définit comme un déséquilibre entre les pro-oxydants et les antioxydants. Ce rapport peut être changé par des plus grands niveaux des espèces réactives de l'oxygène (ERO) et/ou des espèces réactives d'azote (ERA), ou une diminution des mécanismes de défense antioxydants (Al-Gubory et al., 2010).
II.2.1.1.Dommage oxydatif aux lipides, protéines et ADN
Oxydation de l’ADN
Les ROS peuvent induire notamment des oxydations, des nitrations ou des méthylations des bases. Parmi les oxydations des bases, la guanine peut être oxydée par le radical hydroxyle en 8-hydroxy-Guanosine (8-OH-G) aboutissant à la formation de 8-hydroxy-2'-deoxyguanosine (8-OH-dG). Ces modifications vont ainsi perturber la transcription et la traduction par la suite, aboutissant à la formation d’une protéine tronquée et/ou non fonctionnelle (Valko et al., 2006).
Oxydation des protéines
L’oxydation des protéines passe par l’ajout d’un groupement carbonyl sur la protéine. Ces groupements carbonyl peuvent être générés soit par oxydation directe des acides aminés, soit par conjugaison avec des produits de peroxydation lipidique ou encore par glycation (Levine, 2002).
Oxydation des lipides
Les acides gras polyinsaturés sont les cibles privilégiées des ROS (Halliwell et Gutteridge, 1999). La peroxydation lipidique induit un mécanisme en chaîne de dégradation des acides gras au sein de la membrane, conduisant à la formation d’hydroperoxydes (ROOH) qui sont eux-mêmes instables et réactifs. D’autres produits sont formés au cours de ce processus d’oxydation lipidique : l'isoprostane, le malondialdéhyde (MDA) et le 4-hydroxynonenal (4-HNE) (Hong et al.,2004).
II.2.1.1.Stress oxydatif dans le foie
Le stress oxydatif est une caractéristique importante dans la physiopathologie des maladies hépatiques aiguë et chronique, telles que les lésions d'ischémie repefusion, les modèles
Chapitre II Hépatotoxicité de la Doxorubicine et du Docétaxel
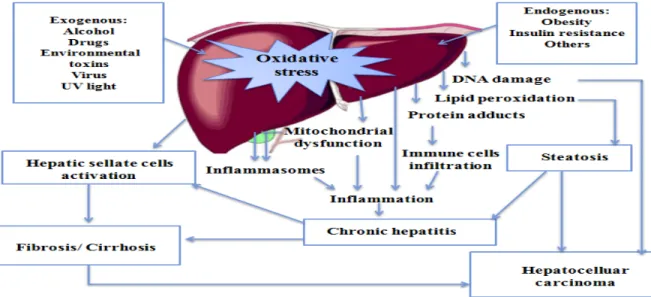
cholestatiques de maladie du foie, les maladies du foie alcoolique et la stéatohépatite non alcoolique (figure 08) (Li et al., 2015).
Les cellules parenchymateuses sont des cellules primaires soumises à un stress oxydatif induit par une blessure dans le foie. Au niveau des hépatocytes ; la mitochondrie, le réticulum endoplasmique, les microsomes et les peroxysomes peuvent produire des ROS (Li et al., 2015).
Figure 08 : Mécanisme général du stress oxydatif induit par divers facteurs et maladies du foie
(Li et al., 2015).
La régénération de ces espèces réactives provoque des dommages dans les cellules de Kupffer, les cellules étoilées du foie et les cellules endothéliales. Une variété de cytokines comme le TNF-α peut être produit dans les cellules de Kupffer suite au stress oxydatif, ce qui pourrait augmenter l’inflammation et l’apoptose. En ce qui concerne les cellules étoilées hépatiques, la synthèse du collagène et la prolifération de ces cellules est déclenchée par la peroxydation lipidique provoquée par le stress oxydatif (Cichoż-Lach et Michalak, 2014; Li et al., 2015 ).
II.2.2.Hépatotoxicité
Est définie comme le pouvoir qu’a une substance (comme les médicaments) de provoquer des dommages au foie. La toxicité du foie se manifeste sous forme d’inflammation (on parlera d’hépatite) ou encore de nécrose (mort des cellules du foie), dans les cas plus sévères. La stéatose hépatique survient lorsqu’il y a accumulation des acides gras dans le foie (Dana et Benichou,1993).
Chapitre II Hépatotoxicité de la Doxorubicine et du Docétaxel
II.2.2.1.Hépatotoxicité induite par la doxorubicine
La structure chimique de base de la doxorubicine est une quinone, son métabolisme hépatique, ainsi que son mécanisme d’action induisent la formation des radicaux libre qui sont à l’origine de l’hépatotoxicité induite par ce médicament. L’induction du stress oxydatif causé par la génération des radicaux libre, provoque un déséquilibre aux niveaux des enzymes antioxydant endogènes (Durak et al., 1998). Cette perturbation dans le système enzymatique (antioxydant), se manifeste par la peroxydation lipidique et l'oxydation des protéines ce qui conduit à une lésion tissulaire hépatique.
II.2.2.2.Principales lésions hépatiques de la doxorubicine
Les lésions hépatiques les plus fréquentes observées suite à l’administration de la doxorubicine sont : la stéatose, la fibrose hépatique (El-sayyad et al.,2009).
La stéatose hépatique est caractérisée par la présence d’un excès de lipides (plus de
5%).L’accumulation de lipides dans le foie peut conduire au blocage de la libération des triglycérides hépatiques dans le plasma (Li et al., 2015). Stéatose hépatiques rapportées et induites par la doxorubicine sont : de type microvésiculaire, des infiltrations cellulaires associée à des cellules nécrosés dans l’espace porte et même une cholestase (Gokcimen et al.,2007). Une dégénération des cellules hépatiques, une dilatation sinusoïdales, une congestion et une hémorragie vasculaire (Viotte et al.,1988 ; Espie et al., 1989) ; plus récemment, il a été également confirmé que les doses thérapeutiques de doxorubicine provoquent une peroxydation lipidique dans les microsomes et des mitochondries du foie en particulier en présence des ions Fe3+(Erdogan et al., 2009).
La fibrose hépatique est définie par l'accumulation excessive de matrice extracellulaire dans le
parenchyme hépatique, elle peut être aussi décrite par l’encapsulation ou le remplacement du tissu lésée (Schuppan et Afdhal, 2008) ; la présence d’une fibrose causée par la doxorubicine (El-sayyad et al.,2009) manifesté par la présence de nombreux spots de lésions focales cellulaires granulomatoses. L’étude histologique révèle un cytoplasme gonflé et cristallisé des hépatocytes, cordes dissociées et la perte des noyaux de certaines cellules. L’accumulation de cellules mononucléaires dans l’espace de kierman en particulier autour des canaux biliaires a été nettement mise en évidence autour des veines centrales (El-sayyad et al., 2009).
Chapitre II Hépatotoxicité de la Doxorubicine et du Docétaxel
II.2.2.3.Stress oxydatif et apoptose induits par la doxorubicine
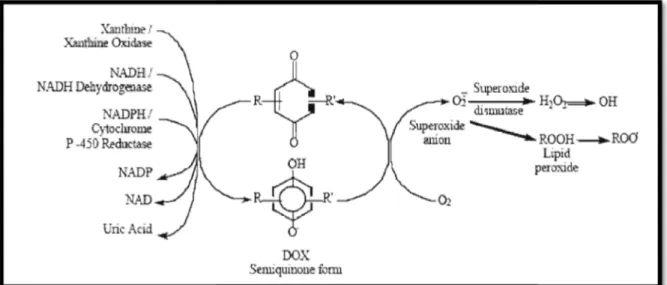
La toxicité de la doxorubicine a été associée aux espèces réactives de l’oxygène (ROS) générés au cours du métabolisme du médicament (Martinez et al., 2009). Les composés de dégradation de la doxorubicine entraîneraient la formation de radicaux libres tels que l'anion superoxyde (O²-), le peroxyde d'hydrogène (H2O2), et le radical hydroxyle ('OH) (figure 09) (Singal
et al., 1997).
La forme quinone est la forme initiale de la doxorubicine et peut être réduite en forme semiquinone par le gain d'un électron. Cette réduction peut être générée par des enzymes réductases telles que la xanthine oxydase, la NADH dehydrogénase et la NADPH cytochrome P-450 réductase (figure 09). L'électron perdu par la semiquinone de la doxorubicine lors de son oxydation peut être transféré à une molécule d'oxygène (O²) pour former l'anion superoxyde (O²-') qui sera également oxydé par le superoxyde dismutase pour former du peroxyde d'hydrogène (H2O2). A ce stade, le H2O2peut entraîner la formation de radicaux hydroxyle ('OH), un des radicaux libres les plus réactifs et destructifs, mais peut aussi être éliminé par la catalase et la glutathion peroxydase (Lauzon, 2008).
Figure 09 :Schéma des différentes voies enzymatiques menant à la formation des radicaux libres à partir de
la doxorubicine(Minotti et al., 1999).
Et en raison de leur solubilité dans les lipides augmentés, les aglycones s’intercalent dans les membranes biologiques et les ROS formés (O²-, H2O2) induisent les cascades de signalisation conduisant à la phosphorylation des protéines cibles, essentielles pour la survie des cellules, ou
Chapitre II Hépatotoxicité de la Doxorubicine et du Docétaxel
II.2.2.3.Stress oxydatif et apoptose induits par la doxorubicine
La toxicité de la doxorubicine a été associée aux espèces réactives de l’oxygène (ROS) générés au cours du métabolisme du médicament (Martinez et al., 2009). Les composés de dégradation de la doxorubicine entraîneraient la formation de radicaux libres tels que l'anion superoxyde (O²-), le peroxyde d'hydrogène (H2O2), et le radical hydroxyle ('OH) (figure 09) (Singal
et al., 1997).
La forme quinone est la forme initiale de la doxorubicine et peut être réduite en forme semiquinone par le gain d'un électron. Cette réduction peut être générée par des enzymes réductases telles que la xanthine oxydase, la NADH dehydrogénase et la NADPH cytochrome P-450 réductase (figure 09). L'électron perdu par la semiquinone de la doxorubicine lors de son oxydation peut être transféré à une molécule d'oxygène (O²) pour former l'anion superoxyde (O²-') qui sera également oxydé par le superoxyde dismutase pour former du peroxyde d'hydrogène (H2O2). A ce stade, le H2O2peut entraîner la formation de radicaux hydroxyle ('OH), un des radicaux libres les plus réactifs et destructifs, mais peut aussi être éliminé par la catalase et la glutathion peroxydase (Lauzon, 2008).
Figure 09 :Schéma des différentes voies enzymatiques menant à la formation des radicaux libres à partir de
la doxorubicine(Minotti et al., 1999).
Et en raison de leur solubilité dans les lipides augmentés, les aglycones s’intercalent dans les membranes biologiques et les ROS formés (O²-, H2O2) induisent les cascades de signalisation conduisant à la phosphorylation des protéines cibles, essentielles pour la survie des cellules, ou
Chapitre II Hépatotoxicité de la Doxorubicine et du Docétaxel
II.2.2.3.Stress oxydatif et apoptose induits par la doxorubicine
La toxicité de la doxorubicine a été associée aux espèces réactives de l’oxygène (ROS) générés au cours du métabolisme du médicament (Martinez et al., 2009). Les composés de dégradation de la doxorubicine entraîneraient la formation de radicaux libres tels que l'anion superoxyde (O²-), le peroxyde d'hydrogène (H2O2), et le radical hydroxyle ('OH) (figure 09) (Singal
et al., 1997).
La forme quinone est la forme initiale de la doxorubicine et peut être réduite en forme semiquinone par le gain d'un électron. Cette réduction peut être générée par des enzymes réductases telles que la xanthine oxydase, la NADH dehydrogénase et la NADPH cytochrome P-450 réductase (figure 09). L'électron perdu par la semiquinone de la doxorubicine lors de son oxydation peut être transféré à une molécule d'oxygène (O²) pour former l'anion superoxyde (O²-') qui sera également oxydé par le superoxyde dismutase pour former du peroxyde d'hydrogène (H2O2). A ce stade, le H2O2peut entraîner la formation de radicaux hydroxyle ('OH), un des radicaux libres les plus réactifs et destructifs, mais peut aussi être éliminé par la catalase et la glutathion peroxydase (Lauzon, 2008).
Figure 09 :Schéma des différentes voies enzymatiques menant à la formation des radicaux libres à partir de
la doxorubicine(Minotti et al., 1999).
Et en raison de leur solubilité dans les lipides augmentés, les aglycones s’intercalent dans les membranes biologiques et les ROS formés (O²-, H2O2) induisent les cascades de signalisation conduisant à la phosphorylation des protéines cibles, essentielles pour la survie des cellules, ou
Chapitre II Hépatotoxicité de la Doxorubicine et du Docétaxel
l’apoptose (Martinez et al., 2009). Les ROS peuvent être produit également par la formation des complexes de fer qui forment un cycle redox en donnant des électrons à l’oxygène
(H2O2+ Fe3+ OH+ + OH + Fe3+). Ces complexes de fer contribuent probablement à l’effet redox de la doxorubicine (Minotti et al., 1999). La doxorubicine serait à l’origine d’un processus apoptotique par une augmentation des ligands recombinant de Fas FasL ou de son récepteur. Chez le rat ou par la voie mitochondriale intrinsèque ou les espèces réactives de l’oxygène (ROS) provoquent l’ouverture du pore mitochondriale ou une diminution de la régulation de Bcl. xL qui bloque normalement la libération du cytochrome C (Minotti et al., 2004).Les répons apoptotiques reflètent plusieurs liens entre le cycle d’oxydo-réduction de la doxorubicine (Lauzon, 2008) :
L’induction de la P53 par O2°et H2O2.
L’activation transcriptionnelle du gène Bax par P53
L’ouverture directe du pore de transition de perméabilité mitochondriale par les mêmes espèces radicalaires
En conséquence les aglycones sont plus puissant sur la perméabilité de la membrane mitochondriale interne associe à la libération du calcium Ca++, l’effondrement du potentiel de la membrane, l’oxydation de NADPH (Minotti et al., 1999).
II.2.2.4.Hépatotoxicité induit par le docétaxel
Le docétaxel est métabolisé exclusivement par le cytochrome 3A4, essentiellement présent dans les microsomes hépatiques, et excrété par voie biliaire (Royer et al., 1996). Bien que la toxicité du docétaxel ne soit pas clairement corrélée aux paramètres pharmacocinétiques, une diminution de la clairance du docétaxel et un risque augmenté de toxicité sévère en cas de métastases hépatiques et d’élévation des enzymes hépatiques (transaminases et phosphatases alcalines) ont été rapportés (Hudis et al., 1996).
Chapitre III
:
Chapitre III Pistacia lentiscus
III.1. Pistacia lentiscus
III.1.1. Etude et description botaniques
Pistacia lentiscus est connu sous l’appellation de : Darou, dherou ou drou en arabe local, lentisque et arbre au mastic en Français et lentisk en Anglais, c’est un arbre spontané qui pousse sur tout le bassin méditerranéen. Il se trouve à l'état sauvage, dans les maquis et les garrigues dans tout type de sols, bien qu’il préfère les terrains siliceux. En Algérie, le lentisque se trouve sur le long du tell et dans les zones forestières (More et White, 2005).
Description
Pistacia lentiscus (Darou), est un arbrisseau de 1 à 3 mètres (figure 10), à odeur résineuse forte. Selon (More et White, 2005) cette espèce est caractérisée par :
Feuilles : persistantes, composées, possédant un nombre pair de folioles (4 à 10) d'un vert
sombre, elliptiques, obtuses, luisantes en dessus, glabres, coriaces et dont le pétiole est bordé d'une aile verte.
Fleurs : unisexuées d’environ 3 mm de large se présentent sous forme de grappe, et très
aromatiques, forment des racèmes de petite taille à l'aisselle des feuilles. Les fleurs femelles sont vert jaunâtre et les fleurs mâles sont rouge foncé.
Fruit : est une baie globuleuse de 2 à 3 mm, monosperme, remplie par nucléole de la
même forme, d’abord rouge, il devient brunâtre à sa maturité en automne.
Figure 10:Arbusto de Pistacia lentiscus (Belfadel, 2009).
Chapitre III Pistacia lentiscus
III.1. Pistacia lentiscus
III.1.1. Etude et description botaniques
Pistacia lentiscus est connu sous l’appellation de : Darou, dherou ou drou en arabe local, lentisque et arbre au mastic en Français et lentisk en Anglais, c’est un arbre spontané qui pousse sur tout le bassin méditerranéen. Il se trouve à l'état sauvage, dans les maquis et les garrigues dans tout type de sols, bien qu’il préfère les terrains siliceux. En Algérie, le lentisque se trouve sur le long du tell et dans les zones forestières (More et White, 2005).
Description
Pistacia lentiscus (Darou), est un arbrisseau de 1 à 3 mètres (figure 10), à odeur résineuse forte. Selon (More et White, 2005) cette espèce est caractérisée par :
Feuilles : persistantes, composées, possédant un nombre pair de folioles (4 à 10) d'un vert
sombre, elliptiques, obtuses, luisantes en dessus, glabres, coriaces et dont le pétiole est bordé d'une aile verte.
Fleurs : unisexuées d’environ 3 mm de large se présentent sous forme de grappe, et très
aromatiques, forment des racèmes de petite taille à l'aisselle des feuilles. Les fleurs femelles sont vert jaunâtre et les fleurs mâles sont rouge foncé.
Fruit : est une baie globuleuse de 2 à 3 mm, monosperme, remplie par nucléole de la
même forme, d’abord rouge, il devient brunâtre à sa maturité en automne.
Figure 10:Arbusto de Pistacia lentiscus (Belfadel, 2009).
Chapitre III Pistacia lentiscus
III.1. Pistacia lentiscus
III.1.1. Etude et description botaniques
Pistacia lentiscus est connu sous l’appellation de : Darou, dherou ou drou en arabe local, lentisque et arbre au mastic en Français et lentisk en Anglais, c’est un arbre spontané qui pousse sur tout le bassin méditerranéen. Il se trouve à l'état sauvage, dans les maquis et les garrigues dans tout type de sols, bien qu’il préfère les terrains siliceux. En Algérie, le lentisque se trouve sur le long du tell et dans les zones forestières (More et White, 2005).
Description
Pistacia lentiscus (Darou), est un arbrisseau de 1 à 3 mètres (figure 10), à odeur résineuse forte. Selon (More et White, 2005) cette espèce est caractérisée par :
Feuilles : persistantes, composées, possédant un nombre pair de folioles (4 à 10) d'un vert
sombre, elliptiques, obtuses, luisantes en dessus, glabres, coriaces et dont le pétiole est bordé d'une aile verte.
Fleurs : unisexuées d’environ 3 mm de large se présentent sous forme de grappe, et très
aromatiques, forment des racèmes de petite taille à l'aisselle des feuilles. Les fleurs femelles sont vert jaunâtre et les fleurs mâles sont rouge foncé.
Fruit : est une baie globuleuse de 2 à 3 mm, monosperme, remplie par nucléole de la
même forme, d’abord rouge, il devient brunâtre à sa maturité en automne.
Chapitre III Pistacia lentiscus
Figure11:Les fruits, feuilles et fleurs de Pistacia lentiscus (Belfadel, 2009).
Systématique du genre Pistacia
Tableau 01: Taxonomie de Pistacia lentiscus L(Quezel et Santa,1963)
Taxonomie Espèce
Règne Végétale
Sous règne Tracheobionata- plantes vasculaires
Embranchement Magnoliophyta ou Spermaphytes
Sous embranchement Angiospermes
Classe Magnoliosida Dicotylédones- Dialypétales, Disciflores
Sous classe Rosidae
Ordre Sapindales (Rutales)
Famille Anacardiacées - térébinthacées
Genre Pistacia
Espèce Pistacia lentiscus L
III.1.2.Répartition géographique
Pistacia lentiscus est un arbrisseau que l'on trouve couramment en sites arides Asie et région méditerranéenne de l’Europe et d'Afrique (Figure 12), jusqu'aux Canaries (Bellakhdar, 2003). Pistacia lentiscus pousse à l'état sauvage dans la garrigue et sur les sols en friche. On le retrouve sur tout type de sol, dans l'Algérie subhumide et semi-aride (Smail, 2002), plus précisément dans le bassin du Soummam en association avec le pin d'Alep, le chêne vert et le chêne liège (Belhadj, 2000).
Chapitre III Pistacia lentiscus
Figure11:Les fruits, feuilles et fleurs de Pistacia lentiscus (Belfadel, 2009).
Systématique du genre Pistacia
Tableau 01: Taxonomie de Pistacia lentiscus L(Quezel et Santa,1963)
Taxonomie Espèce
Règne Végétale
Sous règne Tracheobionata- plantes vasculaires
Embranchement Magnoliophyta ou Spermaphytes
Sous embranchement Angiospermes
Classe Magnoliosida Dicotylédones- Dialypétales, Disciflores
Sous classe Rosidae
Ordre Sapindales (Rutales)
Famille Anacardiacées - térébinthacées
Genre Pistacia
Espèce Pistacia lentiscus L
III.1.2.Répartition géographique
Pistacia lentiscus est un arbrisseau que l'on trouve couramment en sites arides Asie et région méditerranéenne de l’Europe et d'Afrique (Figure 12), jusqu'aux Canaries (Bellakhdar, 2003). Pistacia lentiscus pousse à l'état sauvage dans la garrigue et sur les sols en friche. On le retrouve sur tout type de sol, dans l'Algérie subhumide et semi-aride (Smail, 2002), plus précisément dans le bassin du Soummam en association avec le pin d'Alep, le chêne vert et le chêne liège (Belhadj, 2000).
Chapitre III Pistacia lentiscus
Figure11:Les fruits, feuilles et fleurs de Pistacia lentiscus (Belfadel, 2009).
Systématique du genre Pistacia
Tableau 01: Taxonomie de Pistacia lentiscus L(Quezel et Santa,1963)
Taxonomie Espèce
Règne Végétale
Sous règne Tracheobionata- plantes vasculaires
Embranchement Magnoliophyta ou Spermaphytes
Sous embranchement Angiospermes
Classe Magnoliosida Dicotylédones- Dialypétales, Disciflores
Sous classe Rosidae
Ordre Sapindales (Rutales)
Famille Anacardiacées - térébinthacées
Genre Pistacia
Espèce Pistacia lentiscus L
III.1.2.Répartition géographique
Pistacia lentiscus est un arbrisseau que l'on trouve couramment en sites arides Asie et région méditerranéenne de l’Europe et d'Afrique (Figure 12), jusqu'aux Canaries (Bellakhdar, 2003). Pistacia lentiscus pousse à l'état sauvage dans la garrigue et sur les sols en friche. On le retrouve sur tout type de sol, dans l'Algérie subhumide et semi-aride (Smail, 2002), plus précisément dans le bassin du Soummam en association avec le pin d'Alep, le chêne vert et le chêne liège (Belhadj, 2000).