République Algérienne Démocratique et Populaire
Ministère de l’enseignement supérieur et de la recherche scientifique
Université Mohamed Seddik Ben Yahia - Jijel
Faculté des Sciences Exactes et Informatique
Département de chimie
Mémoire de fin d'Etudes
Présenté pour l’obtention du diplôme de Master
Option: Chimie Pharmaceutique
Intitulé
Réalisé par : Nesrine Boucenna & Karima Zeliche
Soutenu le 22/10/2020
Devant le jury :
Bounar Hania MCB Présidente Université M. Seddik Benyahia – Jijel
Bouhedja Mourad MAA Examinateur Université M. Seddik Benyahia – Jijel
Smail Khelili Pr Encadreur Université M. Seddik Benyahia – Jijel
Année universitaire 2019 /2020
Les dihydropyrimidinones: Un aperçu sur les propriétés
pharmacologiques
Remerciements
Je remercie ALLAH tout puissant de nous avoir accordé
la volonté et le courage pour réaliser notre mémoire.
Nous exprimons d’abord nos profonds remerciements à notre
encadreur le Pr. KHELILI Smail, Professeur à l’université
Mohamed Seddik Ben Yahia à Jijel.
Nous voudrions exprimer toute nos reconnaissances aux membres
de jury qui ont accepté de juger ce travail :
Nous adressons nos sincères remerciements à Mme H.
BOUNAR,
Maitre de conférences à l’Université de Jijel pour avoir accepté de
présider
ce jury.
Nous tenons également à remercier M. BOUHEDJA, maitre assistant
à l’Université de Jijel de nous avoir honorer par sa présence le jury en
qualité de nous membre examinateur.
Sans oublier de remercier Mm Roufaida pour son aide, ses
encouragements, sa patience et pour les efforts qui nous ont permis
d’effectuer notre mémoire.
Nous adressons nos remerciements aux personnes qui nous ont aidé
dans la réalisation de ce mémoire et spécialement le docteur HABILA
Taher, maitre-assistant à l’école supérieure de Bousaada.
Pour finir, nous remercions chaleureusement nos parents
Pour
leur soutien tout au long de ce travail.
Dédicace
Je dédié ce modeste travail aux deux personnes les plus
chères à mon cœur, ma Mère
Fatima
et mon père
Rabia
,
qui ont sacrifié toute leur existante pour bâtir la mienne,
qui par leur précieux conseils m’ont guidée sur la voix de la
réussite.
A mes adorables frères:
Yasser,Khaled,Yassin,Rami et Mohemmed
A mes très chères sœurs
Sara et Meryem
A toute ma famille
Boucenna et Bouskia
A mon fiancé
Salah
et toute sa famille
Boucherit
Je le dédie aussi à ma binôme :
Karima
A
Roufaida
A mes chères amies :
Asma, Sara, Wafa, Layla, Chorouk Widad, Khawla
A tous mes amis ainsi qu’à tous les étudiants de la
promotion 2020, Master 2 de chimie pharmaceutique
Nesrine
Dédicace
Je dédie ce modeste travail à ma famille et aux personnes les plus chères
au monde
A
Mes très chers parents qui ont toujours été là pour moi, et qui m’ont
donné un magnifique model de labeur et de persévérance, de l’amour et
de la force et dont je suis fière et reconnaissante d’avoir comme parent
Mon unique frère
Fouad
Mes tendres sœurs
Abla, Nawel, Chafika, Labiba, Habiba, Aida
Mon binôme
Nesrine
pour tous les moments de joie et de peine qu’on a
passé ensemble, et à sa famille
Tous les étudiants de ma promotion Master 2 de chimie pharmaceutique
(2020)
Liste des figures
Figure I.1. Structure de la 3,4- dihydropyrimidin-2 (1H)-one ... 5
Figure II.1. Structure d’une dihydropyrimidinthione utilisée comme agent de protection de la laine contre les mites ... 51 Figure II.2. Produits de Biginelli à activités antifongique et antimicrobienne ... 51 Figure II.3. Dihydropyridines conçues à partir de la pharmacomodulation de la nifédipine..16
Figure II.4. Structures chimiques de deux dihydropyrimidinones antihypertensives……….19
Figure II.5. Exemples sur de dihydropyrimidinones modifiées, inhibitrices des canaux calciques voltage-dépendants ... 19
Figure II.6. Structure du (S)-Monastrol, une dihydropyrimidinthione, dotée de propriétés anticancéreuses ... 21
Figure II.7. Une dihydropyridine à activité anticancéreuse ... 21
Figure II.8. Structure de deux dihydropyrimidinones, des agents antitumoraux ... 22
Figure II.9. La Batzelladine A et B, comportant le noyau DHPM et possédant des propriétés anti-VIH ... 22
Figure II.10. Structures de dihydropyrimidinones ayant des propriétés anti-VIH, de première et deuxième génération ... 23
Figure II.11. Exemple d’une dihydropyrimidine, dotée d’activité antivirale, le(S) Bay 41-4109 ,dotée d’activité antivirale ... 23
Figure II.12. Exemple d’une dihydropyrimidine, dotée d’activité antivirale ... 24
Figure II.13. Exemples de DHPMs dotés de propriétés anti-inflammatoires ... 24
Figure II.14. Agent à activité anti-inflammatoire ... 25
Figure II.15. Autres dérivés de DHPMs à activité anti-inflammatoire ... 25
Figure II.16. Agent à activité antioxydante ... 25
Figure II.17. Structures de deux dihydropyrimidinones, deux puissants agents antioxydants 26 Figure II.18. Produits de Biginelli antioxydants ... 26
Figure II.19. DHPMs dotées une activité antituberculeuse ... 27
Liste des schémas
Schéma I.1. Préparation de la 3,4- dihydropyrimidinone N-méthylée en position 3 ... 5
Schéma I.2. Synthèse originale de Biginelli ... 6
Schéma I.3. Mécanisme de la réaction de Biginelli ... 7
Schéma I.4. Réaction de Biginelli en présence de Cu(NTf2)n ou de Cu(OTf)n ... 8
Schéma I.5.Réaction de Biginelli en présence de Ce(C12H25SO3)3 ... 9
Schéma I.6. Dihydropyrimidinones préparés sous micro-ondes avec 1400w ... 9
Schéma I.7.Dihydropyrimidinones préparés sous micro-ondes avec des rendements qui atteignent 95% ... 10
Schéma I.8. Synthèse de Biginelli catalysée parBMImBF4 ou BMImBF6, deux liquides ioniques ... 10
Schéma I.9. Réaction de Biginelli sous ultrason ... 11
Schéma I.10. Synthèse de Biginelli catalysée par NH4Cl sous ultrason ... 11
Liste des tableaux
Tableau I.1. Réactions de biginelli d’éthyl acetoacetate, p-anisaldehyde et urée catalysée par
métal triflimides en présence de l’acide de Branchted ... 8
Tableau II.1. Activité antibactérienne de quelques dihydropyrimidinones portant des restes
urées, thiourées et sulfonylurées ... 17
Tableau II.2. Effet des composés 6a-k et 7a-j sur l’activité contractile des anneaux de l’aorte
Liste des abréviations
µM Micro- molaire AcOH Acide acétique
BMImBF4 1-n-butyl-3-méthylimidazolium tétrafluoroborate
BMImBF6 1-n-butyl-3-méthylimidazolium hexafluoroborate
CIP Ciprofloxacine
DHPMs Dihydropyrimidinones Dia Diazoxide
DMSO Diméthylsulfoxyde
DPPH 2 ,2-diphényl-1-picrylhydrazyl
EC50 Concentration nécessaire pour induire 50٪ de relaxation
EtOH Ethanol
g/ml gramme par millilitre KHZ Kilohertz
MCRs Les réactions multicomposant Cu (NTf)n Triflimides de Cuivre
Cu (OTf)n Triflatesde Cuivre
Nif nifédipine
SIDA Syndrome d’immunodéficience acquise T Température
Table des matières Liste des figures
Liste des schémas Liste des tableaux Abréviation
Introduction générale ... 1
Référence bibliographique ... 3
Chapitre I : Synthèse des dihydropyrimidinones I-1-Introduction ... 5
I-2-Méthode de synthèse de dihydropyrimidinone ... 6
I-2-1-La synthèse original de Biginelli ... 6
I-2-2-La synthèse améliorée ... 7
I-2-2-1-Utilisation d’acide de Lewis ... 7
I-2-2-2- Utilisation des microondes ... 9
I-2-2-3- Utilisation liquide ionique ... 10
I-2-2-4-Utilisation ultrason ... 10
I-3-Conclusion... 12
Références bibliographiques ... 13
Chapitre II : Intérêts biologiques des dihydropyrimidinones II-1-Introduction ... 15
II-2-Intérêts biologiques ... 15
II-2-1-Activité antifongique et antimicrobienne ... 15
II-2-2-Activité anti hypertensive et modulateur des canaux calciques voltage-dépendant ... 19
II-2-3-Activités anticancéreuse ... 21
II-2-4-Activité antivirale ... 22
II-2-5-Activité anti-inflammatoire... 24
II-2-6- Activité anti-oxydante ... 25
II-3-Conclusion ... 27 Références bibliographiques ... 28 Conclusion générale ... 31 Résumé
Introduction générale
1
Introduction générale
Les réactions multi-composants ou à composants multiples (MCRs) sont définies comme étant des processus permettant d’assembler en une seule opération au minimum trois réactifs qui sont introduits dans le même pot (réacteur) pour conduire à un seul produit final (ou très majoritaire) incorporant la majorité des atomes des différents substrats de départ. Ainsi, ces réactions constituent un atout majeur en chimie organique et pharmaceutique pour accéder à des substances bioactives. [1]
La combinaison d’un aldéhyde, un β-cétoester et l’urée (ou thiorée) sous catalyse acide a été rapportée pour la première fois en 1893. Cette procédure ayant comme appellation réaction de Biginelli, attire de plus en plus d’attention, et a donné naissance à une nouvelle molécule en l’occurrence la 3,4-dihydropyrimidin-2(1H)-one qui porte l’acronyme DHPM.
[2],[3]
Les 3,4-dihydropyrimidin-2(1H)-ones sont des composés hétérocycliques diazotés, d’une efficacité pharmacologique remarquable.[4],[5] Un large domaine d’activités biologiques
y compris l’activité antivirale, antitumorale, antibactérienne et anti-inflammatoire ont été attribuées à ces dérivés de la pyrimidinone partiellement réduits [6a, 6b]. Plus récemment, les
DHPMs fonctionnalisées sont apparus comme de puissants inhibiteurs calciques, [7a, 7b, 7c]
agents antihypertensifs. [8a, 8b, 8c]
La réaction originale de Biginelli est lente (18 heures), souffre souvent de rendements assez bas, notamment en cas d’aldéhydes aromatiques substitués et aliphatiques, et les groupes fonctionnels sensibles au milieu fortement acide sont souvent perdus au cours de la réaction. Ces problèmes ont mené au développement de stratégies synthétiques en plusieurs étapes qui produisent des rendements relativement plus grands, mais ne valent pas la simplicité du protocole originel de Biginelli.[9] C’est pourquoi, il y a eu une nécessité de développer des protocoles originaux, en une seule étape, en utilisant des catalyseurs efficaces qui mènent aux rendements élevés de dérivés de la dihydropyrimidinone. Dans ce contexte, plusieurs procédures plus douces et plus efficaces ont été rapportées en utilisant comme catalyseurs : les acides de Lewis, les hétéropolyacides etc. [10]
Introduction générale
2
Ainsi, ce travail de recherche bibliographique est une contribution qui met en relief l’importance des dihydropyrimidinones, qui sont issues de la réaction de Biginelli, une des réactions multi composants les plus importantes en chimie organique, tant sur l’aspect de la synthèse que sur l’aspect des propriétés pharmacologiques.
Ce mémoire sera donc organisé en deux chapitres : Le premier chapitre comporte une synthèse bibliographique sur les dihydropyrimidinones (DHPM), incluant un bref aperçu sur la réaction de Biginelli, et les méthodes de synthèse. Le second chapitre comporte une étude bibliographique sur l’intérêt biologique des DHPMs.
Introduction générale
3
Références bibliographiques
[1] Ben Abdessalem, A, 2016, Réactions multicomposant à base d'isonitriles. Thése: Doctorat.
Specialité : Chimie organique. Faculté des Sciences de Bizerte (Tunisie).
[2] Kappe, C. Oliver, 2000, Biologically active dihydropyrimidones of the Biginelli-type-a
literature survey. European journal of medicinal chemistry 35 (12) ,1043-1052
[3] Kappe, C. Oliver, 1998, 4-Aryldihydropyrimidines via the Biginelli condensation:
Aza-analogs of nifedipine-type calcium channel modulators. Molecules 3(1), 1-9.
[4] Bruce, M. A.; Pointdexter, G. S.; Johnson, G, 1998, Preparation of dihydropyrimidones as NPY antagonists.PCT Int. Appl. WO,33,791.
(a) Wong, W. C.; Lagu, B.; Nagarathnam, D.; Marzabadi, M. R.; Gluchowski, C. PCT Int. Appl. WO, 1997, 42, 956 et WO, 1998, 51,311.
(b) Nagarathnam, D.; Wong, W. C.; Miao, S. W.; Patane, M. A.; Gluchowski, C, 1997, PCT Int. Appl. WO, 17, 969.
(c) Slider, D. R.; Larsen, R. D.; Chartrain, M.; Ikemoto, N.; Roberge, C. M.; Taylor, c. S.; Li, W.; Bills, G, F, 1999, PCT Int. WO, 07, 695.
[5] Kappe, C.; Oliver, Dalip Kumar, and Rajender S. Varma, 1999, Microwave-assisted
high-speed parallel synthesis of 4-aryl-3, 4-dihydropyrimidin-2 (1H)-ones using a solventless Biginelli condensation protocol." Synthesis .1799-1803
[6] (a) kappe, C. O, 1993, 100 years of the Biginelli dihydropyrimidine
synthesis. Tetrahedron, 49(32), 6937-6963.
(b) Kappe, C. O, 2000, Recent advances in the Biginelli dihydropyrimidine synthesis. New tricks from an old dog. Accounts of Chemical Research, 33(12), 879-888.
[7] (a) Cho, H.; Ueda, M.; Shima, K.; Mizuno, A.; Hayashimatsu, M.; Ohnaka, Y.; ... & Aisaka, K, 1989, Dihydropyrimidines: novel calcium antagonists with potent and long-lasting vasodilative and anti-hypertensive activity. Journal of medicinal chemistry, 32(10), 2399-2406.
(b) Atwal, K. S.; Rovnyak, G. C.; Kimball, S. D.; Floyd, D. M.; Moreland, S.; Swanson, B. N., ... & Malley, M. F.; 1990, Dihydropyrimidine calcium channel blockers. II. 3-Substituted-4-aryl-1, 4-dihydro-6-methyl-5-pyrimidinecarboxylic acid esters as potent mimics of dihydropyridines. Journal of medicinal chemistry, 33(9), 2629-2635.
(c) Rovnyak, G. C.; Kimball, S. D.; Beyer, B.; Cucinotta, G.; DiMarco, J. D.; Gougoutas, J.; ... & McCarthy, J. P, 1995, Calcium entry blockers and activators: conformational and
Introduction générale
4
structural determinants of dihydropyrimidine calcium channel modulators. Journal of medicinal chemistry, 38(1), 119-129.
[8] (a) Atwal, K. S.; Swanson, B. N.; Unger, S. E.; Floyd, D. M.; Moreland, S.; Hedberg,
A.; & O'Reilly, B. C, 1991, Dihydropyrimidine calcium channel blockers. 3. 3-Carbamoyl-4-aryl-1, 2, 3, 4-tetrahydro-6-methyl-5-pyrimidinecarboxylic acid esters as orally effective antihypertensive agents. Journal of medicinal chemistry, 34(2), 806-811
(b) Rovnyak, G. C.; Atwal, K. S.; Hedberg, A.; Kimball, S. D.; Moreland, S.; Gougoutas, J. Z.Malley, M. F, 1992, Dihydropyrimidine calcium channel blockers. 4. Basic 3-substituted-4-aryl-1, 4-dihydropyrimidine-5-carboxylic acid esters. Potent antihypertensive
agents. Journal of medicinal chemistry, 35(17), 3254-3263.
(c) Grover, G. J.; Dzwonczyk, S.; McMullen, D. M.; Normandin, D. E.; Parham, C. S.; Sleph, P. G.; Moreland, S, 1995, J. Cardiovasc, Pharm, 26, 289.
[9] O'REILLY, B. C.; & Atwal, K. S, 1987, Synthesis of substituted 1, 2, 3,
4-tetrahydro-6-methyl-2-oxo-5-pyrimidinecarboxylic acid esters: The Biginelli condensation revisited. Heterocycles (Sendai), 26(5), 1185-1188.
Chapitre I
Chapitre I Synthèse des dihydropyrimidinones
5
I.1. Introduction
La dihydropyrimidinone est un composé organique hétérocyclique à 6 atomes de formule chimique générale C4H6N2 (Figure I.1). Elle possède uncaractère acide faible et subit à la fois des
réactions de substitution électrophile et nucléophile. Le cycle dihydropyrimidinone possède quatre atomes de carbone et deux atomes d’azote, sur lesquels peuvent se fixer des groupements qui donnent déférents types de structures. Les dérivés de la dihydropyrimidinone, sont dotés d’un potentiel d’électrons élevé, présentant une réactivité considérable et des potentialités pharmacologiques et thérapeutiques confirmées. [1]
NH H
N
O
Figure I.1. Structure de la 3,4- dihydropyrimidin-2 (1H)-one.
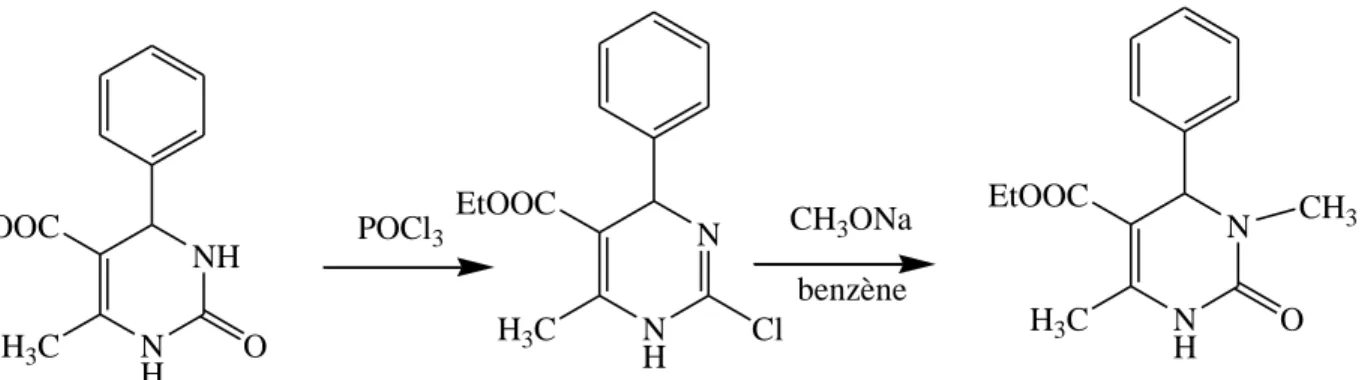
L’équipe de K. Folker’s sont les premiers à étudier la réactivité des dihydropyrimidinones vis-à-vis de l’addition électrophile et de la substitution nucléophile. Ils ont pu préparer la 3,4-dihydropyrimidinone N-méthylée en position 3 (Schéma I.1). [2]
N H NH EtOOC H3C O NH N EtOOC H3C N H N EtOOC H3C O POCl3 CH3ONa Cl benzène CH3
Chapitre I Synthèse des dihydropyrimidinones
6
I.2. Méthodes de synthèse des dihydropyrimidinones
I.2.1. La synthèse originale de BiginelliEn 1893, un chimiste Italien, Pietro Biginelli, de l'Université de Florence, a signalé l'une des réactions multi composants parmi les plus importantes qui permit la synthèse des dihydropyrimidinones et de leurs analogues soufrés pour la première fois, ce qui a donné naissance à cette réaction portant son nom (réaction de Biginelli). Pour réaliser cette réaction, il a cyclo-condensé en milieu catalysée par un acide, dans un seul pot ou réacteur, trois composés, l’acétoacétate d’éthyle (2), un aldéhyde (1) et l'urée (3) (ou la thiourée), en chauffant à reflux le mélange de ces trois composés dissous dans de l'éthanol avec une quantité catalytique de HCl. En refroidissant, il a obtenu un produit cristallin solide, la 3,4-dihydropyrimidin-2 (1H)-one (4) (Schéma I.2). [3] O H + EtO O O + H2N O NH2 1 2 3 20 gouttes HCl N H NH EtOOC 4 O EtOH,à reflux
Schéma I.2. Synthèse originale de Biginelli.
I.2.1.2. Mécanisme de la réaction de Biginelli
Quarante ans après le rapport initial de Biginelli, le premier mécanisme de synthèse des DHPMs (réaction de Biginelli) a été mené par folkers et Johnson en 1933 (Schéma I.3). [4]
Chapitre I Synthèse des dihydropyrimidinones 7 H2N NH2 O + R H O HN NH2 NH2 HN R O O EtO2 CH3 O HN NH2 N H HN R O O OH CH3 CO2Et HN N H HN R O O CH3 CO2Et NH2 -OC(NH2)2 HN H N CH 3 CO2Et R O R=Phényle
Schéma I.3. Mécanisme de la réaction de Biginelli
I.2.2. Synthèses améliorées
I.2.2.1. Utilisat1ion des acides de Lewis
De nombreux acides de Lewis utilisés dans la réaction de Biginelli sont à base de métaux de transition. Des chlorures, des nitrates, des triflates et d’autres sels de ces métaux ont été employés avec succès. [5]
En 2006, I. Suzuki et coll. ont mis au point la condensation du p-anisaldehyde, de l’acétoacétate d’éthyle et de l’urée en présence du triflates et triflimides de différents métaux (Ni, Cu, Zn, Yb) (Tableau I.1). [6]
Chapitre I Synthèse des dihydropyrimidinones
8
Tableau I.1. Réactions de biginelli d’éthyl acetoacetate, p-anisaldehyde et urée catalysée par
métal triflimides en présence de l’acide de Branchteda .
Entrée Acides de Lewis Addition Rendements (%)
1 Ni(NTf2)2 CH3CO2H 84 2 Ni(NTf2)2 CF3CO2H 90 3 Ni(NTf2)2 HNTf2 71 4 Ni(NTf2)2 HCl 71 5 Ni(NTf2)2 CH3SO3H 92 6 Cu(NTf2)2 CF3CO2H >95 7 Cu(NTf2)2 HCl >95 8 Cu(NTf2)2 HNTf2 65 9 Cu(NTf2)2 CH3SO3H >95 10 Yb(NTf2)3 HCl 85 a
les réaction ont été effectuées en présence de p-anisaldehyde (1.0 mmol), éthyl acetoacetate (1.0 mmol), urée (1.5 mmol) et à l’acide de branchted (5 mol %) dans l’eau (1 mL) avec la catalyseur d’acide de Lewis (5 mol %) à température ambiante de 24 h.
Ainsi, un rendement plus 95% en produit de Biginelli est atteint en utilisant l’eau comme solvant et (Cu(NTf2)2, Cu(NTf2)2) comme acides de Lewis à température ambiante durant 24
heures (Schéma I.4). [6]
O H MeO + Me O O OEt + H2N O NH2 N H NH Me O OMe EtO O Cu(NTf2)2 ou Cu(OTf)n H2O,RT,24h 95%
Schéma I.4. Réaction de Biginelli en présence de Cu(NTf2)2ou de Cu(OTf)n.
En 2014, Y. Qiu et coll. ont utilisé le Ce(C12H25SO3)3 dans l’éthanol. Un rendement de 98%
Chapitre I Synthèse des dihydropyrimidinones 9 Ar O H + Me O OEt O + H2N Ce(C12H25SO3)3 Ethanol,80°C 8h NH NH Ar Me O NH2 O EtO O
Schéma I. 5. Réaction de Biginelli en présence de Ce(C12H25SO3)3.
I.2.2.2. Utilisation des micro-ondes
Les micro-ondes sont devenues ces dernières années l’une des techniques les plus utilisées en synthèse organique. En général, cette méthode inclue la formation de produits purs avec des rendements élevés, et des temps de réactions courts, des conditions douces. [8]
L’équipe de Kappe a décrit la condensation d’un aldéhyde aromatique, d’un β-dicarbonylé, et de l'urée en présence d’une quantité catalytique d’un acide de Lewis (FeCl3) (Schéma I.6). La
réaction est effectuée sous micro-ondes à 1400W pendant 10 à 20 min dans un mélange d’acide acétique et d’éthanol avec (v/v = 3:1), conduisant ainsi aux dihydropyrimidinones correspondantes avec des rendements qui atteignent 88%. [9]
X H O + O RO Me O + NH2 O NH2 AcOH/EtOH 3:1,FeCl3 micro-ondes, 10-20 min N H NH O RO Me O X 88%
Schéma I.6. Dihydropyrimidinones préparés sous micro-ondes avec 1400w.
Jetti et coll. ont synthétisé une gamme de DHPMs pourvue de propriétés antihypertensives avec des rendements atteignant 95% (Schéma. I.7). La réaction est réalisée sous micro-ondes à 900W, en présence de l’acide amidosulfonique supporté sur de la silice comme catalyseur. [10]
Chapitre I Synthèse des dihydropyrimidinones 10 H2N X NH2 O RO Me O Ar O H N H NH Ar X Me O EtO X=O,S NHSO3H Si O O O S iO 2
micro-ondes, sans solvant 6-7 min
+
95%.
Schéma I.7. Dihydropyrimidinones préparés sous micro-ondes avec 900W.
I.2.2.3. Utilisation des liquides ioniques
En 2001, Peng et Deng élaborent une méthodologie de chimie verte pour la réaction de Biginelli, utilisant les liquides ioniques comme catalyseurs et en absence de solvant. La réaction se déroule à 100°C en présence d’une quantité catalytique du liquide ionique, en l’occurrence de 1-n-butyl-3-méthylimidazolium tetrafluoroborate (BMImBF4) ou 1-n-butyl-3-méthylimidazolium
hexafluoroborate (BMImBF6). Cette méthodologie présente les avantages suivants : rendements
élevés même avec les aldéhydes aliphatiques et le 2,4-pentadione (85-98%), temps réactionnels relativement courts (30 minutes), une mise en œuvre facile (schéma I.8). [11]
R1 O O Me + R H O H2N H2N O N H NH R O Me O R1 BMImBF4 ou BMImBF6 sans solvant 100°C,0.5h,90-99% R= Ph, 4-(MeO)Ph, 4-(NO2)Ph, 4-ClPh, penthyl R1=OEt, Me
Schéma I.8. Synthèse de Biginelli catalysée parBMImBF4 ou BMImBF6, deux liquides
ioniques.
I.2.2.4. Utilisation des ultrasons
L’équipe de Ji-Taili a utilisé les ultrasons (fréquence : 40.59 KHz, puissance minimale : 250W), dans la synthèse des 3,4-dihydropyrimidin-2-ones, en présence de l’acide
Chapitre I Synthèse des dihydropyrimidinones
11
amidosulfonique, appelé aussi acide sulfamique (NH2SO3H). Les conditions optimales ont été
fixées comme c’est présenté dans le schéma (schéma I.9). [12]
R1 O H + O O + O H2N NH2 N H NH EtO O O R1 NH2SO3H,25-30°C EtOH/ultrason 89-98%/40min EtO
Schéma I.9. Réaction de Biginelli sous ultrason en présence de l’acide amidosulfonique.
Un simple protocole de synthèse a été mené par Stefani et Coll. sur la réaction de Biginelli, en utilisant les ultrasons (Fréquence : 40 KHz, Puissance : 130W, T°=60°C), en présence du chlorure d’ammonium comme catalyseur acide.
Après une purification sur colonne (Hexane/Acétate d’éthyle 7 :3), les produits sont obtenus avec de très bons rendements (Schéma I.10). [13]
R1 O H O O RO X H2N NH2 + + N H NH RO O X R1 U-S NH4Cl 10mmol% MeOH/3-4h
Schéma : I.10. Synthèse de Biginelli catalysée par NH4Cl sous ultrason.
A. M. A Al-Kadasi et G. M. Nazeruddin ont utilisé l’acide chlorosulfonique pour catalyseur la réaction de Biginelli. (HClSO3).C’est une molécule très toxique, dangereuse et très difficile à
manipuler. Ce nouveau protocole, lancé sous ultrasons (fréquence : 36±3KHZ, puissance : 100w) sous atmosphère sec, pour éviter la décomposition du catalyseur, a permis d’obtenir les DHPMs avec de bons rendements (Schéma I.11). [14]
Chapitre I Synthèse des dihydropyrimidinones 12 O R1 H EtO O O X H2N NH2 + + N H NH R1 O EtO X HClSO3 0,2mmol% sans solvant /T° a 5-30min
U-S
Schéma. I.11. Synthèse de Biginelli en présence de HClSO3 comme catalyseur sous ultrasons.
Conclusion
Ce chapitre est un rappel bibliographique englobant les méthodes de synthèses des DHPMs
ont été également rapportées y compris la méthode originale de Biginelli et les méthodes améliorées : L’utilisation de différents types de catalyseurs ainsi que les réactions en phase solide l’utilisation des liquide ionique et l’emploi des irradiations microonde …etc.
Chapitre I Synthèse des dihydropyrimidinones
13
Références bibliographiques
[1] Habila T, 2019, Synthèse et évaluation pharmacologique du
3,4-dihydropyrimidin-2(1H)-ones portant des fonctions urée, thiourée et sulfonylurée. Thése doctorat : Chimie organique : Universite mohemed seddik benyahia -jijel.
[2] K. Folkers, B.T.; Johnson, J, 1933, Researches on pyrimidines. Some reactions and
derivatives of 2-kito-4-phenyl-5-carbethoxy-6-methyl-1,2,3,4-tetrahydropyrimidine. Journal of the American Chemical Society 55.7. 2886-2893.
[3] Jadhav, Vivekanand B.; et al, 2012, Bioactive dihydropyrimidines: An overview. Chem. Sin,
3: 1212.
[4] Phucho, I. T.; Nongpiur, A.; Tumtin, S.; Nongrum, R.; Nongkhlaw, R. L, 2010, Recent
progress in the chemistry of dihydropyrimidinones. ChemInform, 41,662-676.
[5] Khiar C, 2018, Etude de réactions multicomposants sur de nouveaux catalyseurs via la
réaction de Biginelli et par voie radicalaire. Thése : doctorat : Chimie des Matériaux et de l’Environnement. Universite Mouloud Mammeri tizi ouzou.
[6] Suzuki, I.; Suzumura, Y.; Takeda, K, 2006, Metal triflimide as a Lewis acid catalyst for
Biginelli reactions in water. Tetrahedron letters, 47(45), 7861-7864.
[7] Qiu, Y.; Sun, H.; Ma, Z.; Xia, W, 2014, Efficient, stable, and reusable Lewis acid–
surfactant-combined catalyst: One-pot Biginelli and solvent-free esterification reactions. Journal of Molecular Catalysis A: Chemical, 392, 76-82.
[8] Khodja. I, 2015, Etude des effets de quelques catalyseurs sur la preparation des
3,4-dihydropiyrimidinone, des 1,4-dihydropyridines et des pyrano[2,3-c]pyrazoles. Thése doctorat. : Chimie organique. Universite Fréres mentouri-constantine.
[9] Stadler, A.; Yousefi, B. H.; Dallinger, D.; Walla, P.; Van der Eycken, E.; Kaval, N.; &
Kappe, C. O, 2003, Scalability of microwave-assisted organic synthesis. From single-mode to multimode parallel batch reactors. Organic process research & development, 7(5), 707-716.
[10] Jetti, S. R.; Upadhyaya, A.; Jain, S, 2014, 3, 4-Hydropyrimidin-2-(1H) one derivatives:
solid silica-based sulfonic acid catalyzed microwave-assisted synthesis and their biological evaluation as antihypertensive and calcium channel blocking agents. Medicinal Chemistry Research, 23(10), 4356-4366.
Chapitre I Synthèse des dihydropyrimidinones
14
[11] Peng, J.; Deng, Y, 2001, Ionic liquids catalyzed Biginelli reaction under solvent-free
conditions. Tetrahedron Letters, 42(34), 5917-5919.
[12] Li, J. T.; Han, J. F.; Yang, J. H.; Li, T. S, 2003, An efficient synthesis of 3,
4-dihydropyrimidin-2-ones catalyzed by NH2SO3H under ultrasound irradiation. Ultrasonics
Sonochemistry, 10(3), 119-122.
[13] Stefani, H. A.; Oliveira, C. B..; Almeida, R. B.; Pereira, C. M.; Braga, R. C.; Cella, R.;
Nogueira, C. W, 2006, Dihydropyrimidin-(2H)-ones obtained by ultrasound irradiation: a new class of potential antioxidant agents. European journal of medicinal chemistry, 41(4), 513-518.
[14] Amimour M, 2009, Preparation des produits d'intéret biologique : Derives quinoleiques de
type baylis-hillman et developpement de nouvelles voies d'acces aux produits de biginelli. Thése doctorat : Chimie organique. Universite mentouri-constantine.
Chapitre II
Chapitre II Intérêt biologique des dihydropyrimidinone
15
II.1. Introduction
Les composés de Biginelli ont présenté des activités biologiques dans de nombreux domaines. Dans les années 30, un simple dérivé fut breveté comme agent de protection de la laine contre les mites (Figure II.1).
N H NH Cl EtOOC Me S
Figure II.1. Structure d’une dihydropyrimidinthione utilisée comme agent de protection de
la laine contre les mites.
Plus tard, l’intérêt s’est tourné vers des composés principalement antiviraux, antibactériens, anticancéreux, anti hypertensifs, anti-inflammatoires…etc. [1]
II.2.1. Activité antifongique et antimicrobienne
Une série de produits issue de la réaction de Biginelli, a été synthétisée et testée pour son activité antifongique et antimicrobienne par Akhaja et Coll. dont quatre produits ont montré une excellente activité contre tous les microbes et les souches fongiques utilisées (figure II.2). [2] N H N O N N S NH N H Cl O O N H N O N N S NH N H Cl O S N H N O N N S NH N H O O Br N H N O N N S NH N H S O O2N
Chapitre II Intérêt biologique des dihydropyrimidinone
16
Très récemment, de nouvelles dihydropyrimidinones portant des restes urées, thiourées, et sulfonylurées ont été développées en tant que vasodilatateurs et antagonistes calciques et antimicrobinne. [3] Ces dérivés ont été conçus en se basant sur la
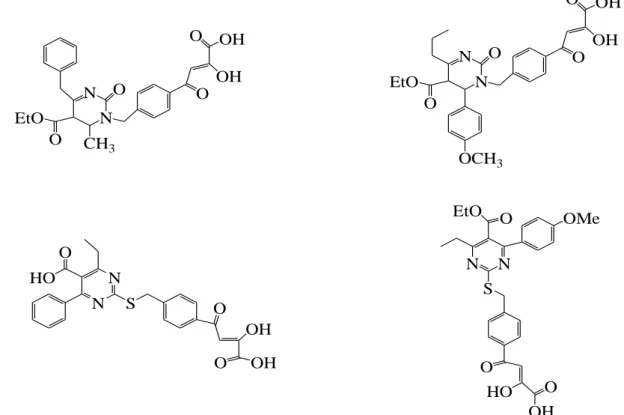
pharmacomodulation de la nifédipine, un médicament anti hypertenseur et antagonistes calcique connu et toujours commercialisé (figure II.3, série 6 et 7, et nifédipine).
Figure II.3. Dihydropyridines conçues à partir de la pharmacomodulation de la nifédipine.
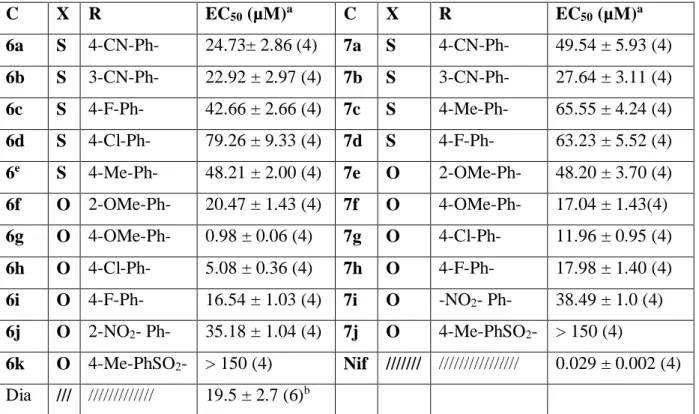
Très récemment, une série de dihydropyrimidinones portant des restes urées, thiourées et sulfonylurées a été décrite, dont certaines avaient montrées une activité antibactérienne très intéressante, mettant en relief des différences d’activités entre les urées, les thiourées et les sulfonylurées (tableau II.1). [4]
Chapitre II Intérêt biologique des dihydropyrimidinone
17
Tableau II.1. Activité antibactérienne de quelques dihydropyrimidinones portant des restes urées, thiourées et sulfonylurées. [4]
comp X R E. Coli ATCC25922 Staphylococconas aureus ATCC25923 Pseudomonas aeruginosa ATCC27853
E. Coli Staphylococcus aureus Pseudomonas aeruginosa
6a S 4-CN-Ph- - - - 6b S 3-CN-Ph- - - - 6c S 4-F-Ph- 10,7±1,15 - - - 10,0±1,0 - - - - - 6d S 4-Cl-Ph- 14,3±0,58 9,0±1,0 11,3±0,58 8,3±1,15 9,3±1,53 - 9,7±0,58 - 12,5±1,15 - 9,3±0,58 - 6e S 4-Me-Ph- - - - 6f O 2-OMe-Ph- 9,7±1,53 - - - 11,7±1,15 - - - - - 6g O 4-OMe-Ph- 12,3±0,58 - - - 13,0±1,0 - - - - - 6h O 4-Cl-Ph- 14,3±1,53 - 12,7±1,53 - 11,3±1,15 - 14,0±2,0 - 13,5±0,58 - 11,0±1,73 - 6i O 4-F-Ph- 9,0±1,00 - 8,7±0,58 - 9,3±1,53 - 12,7±1,15 - - - - - 6j O 2-NO2-Ph- 19,7±1,53 15,3±0,58 14,7±0,58 10,0±1,0 17,3±1,73 11,0±1,0 21,3±1,15 17,7±0,58 12,3±0,58 8,7±1,53 13,3±0,58 8,7±0,58 6k O 4-Me-PhSO2- - - - 6l S 3-Cl-Ph- 15,0±1,0 10,7±1,15 12,3±0,58 8,7±1,15 12,3±1,53 - 13,7±1,53 9,3±0,58 11,0±1.0 - 10,3±0,58 - 6m O 3-Cl-Ph- 17,3±1,53 12,0±1,0 14,7±1,53 9,3±0,58 13,0±1,73 - 12,3±1,15 - 11,37±1,53 - 9,0±1,0 - 6n S 3-OMe-Ph- 10,0±1,0 - - - - 6o O 3-Br-Ph- 11,3±1,15 - - - 10,0±1,73 - 11,7±1,15 - - - 9,7±0,58 - 6p O 4-F-PhSO2- - - - 6q O 4-NO2-Ph- 18,7±1,53 12,7±0,58 14,3±1,15 10,3±0,58 17,0±1,00 12,3±0,58 15,7±1,53 10,3±1.53 13,3±1,15 - 12,3±1,53 - 7a S 4-CN-Ph- - - - 7b S 3-CN-Ph- - - - 7c S 4-Me-Ph- - - - 7d S 4-F-Ph- 11,3±1,53 - - - 10,7±0,58 - - - - - 7e O 2-OMe-Ph- 12,7±1,15 09,3±0,58 - - - - 13,7±1,53 9,0±1,0 - - - - 7f O 4-OMe-Ph- 13,0±1,15 8,3±0,58 - - - - 14,0±2,0 10,3±1,53 - - - - 7g O 4-Cl-Ph- 13,3±0,58 9,3±1,52 13,7±0,58 9,0±1,73 11,3±0,58 - 12,3±0,58 8,3±0,58 - - - - 7h O 4-F-Ph- 11,0±1,0 - - - 9,7±0,58 - - - - - 7i O 2-NO2-Ph- 21,0±2,0 16,7±1,15 16,3±1,53 11,7±0,58 18,7±1,53 12.3±0,58 23,0±1,73 18,3±2,08 14,7±1,15 10,3±0,58 14,7±1,15 10,0±1,0 7j O 4-Me-PhSO2- - - - 7k O 4-NO2-Ph- 19,0±1,75 12,3±1,53 14,7±0,58 10,0±1,0 17,3±2,08 13,3±1,53 15,3±1,53 10,7±0,58 13,3±1,15 - 12,3±0,58 - 7l O 3-Br-Ph- 12,0±1,0 - - - 11,7±0,58 - 12,3±1,53 - - 8,7±0,58 - 7m O 3-Cl-Ph- 17,3±1,53 12,0±1,0 14,7±1,53 9,3±0,58 13,0±1,73 - 12,3±1,15 - 11,37±1,53 - 9,0±1,0 - 7n O 4-F-PhSO2- - - - Nif - - - 12,0±1,0 10,0±0.1 - - - - 11,0±1,0 - - - CIP - - 25,3±1,53 21,0±2,0 22,3±1,53 19,0±1,73 23,3±1,53 22,3±0,58 28,0±1,00 24,00±1,73 22,0±1,73 20,3±0,58 23,7±1,15 20,0±1,0 DMSO - - - -
Chapitre II Intérêt biologique des dihydropyrimidinone
18
En effet, les résultats de l’étude antibactérienne ont montré que les sulfonylurées 6k,
6p, 7j et 7n étaient inactives à 25 µM et 50 µM. Cette inactivité peut être due à leur ionisation
partielle en solution, à cause de leur caractère acide faible. En effet, le groupe NH confiné entre les groupes SO2 et C=O, tous deux fortement électro-attracteur, est très labile. Á 25 µM,
la plupart des thiourées et des urées étaient soi totalement inactives soi peu actives, mais contre une partie seulement des bactéries étudiées, excepté les urées 6j, 6q, 7i et 7k, qui ont montré une activité antibactérienne remarquable (forte ou modérée) contre quasiment toutes les bactéries étudiées. Ils étaient parfois aussi actifs que le composé de référence, la ciprofloxacine. Rappelons que ces quatre composés sont tous des urées qui portent un groupe attracteur (NO2) sur le phényle en position 4. Le groupe nitro occupe la position 2 dans le cas
de 6j, 7i, et la position 4 dans le cas de 6q et 7k. La nifédipine qui a été pris comme modèle dans la conception des composés finaux n’a quasiment montré aucune activité antibactérienne. Remarquons également que les composés peu actifs ou inactifs parmi les urées et les thiourées, portent des groupes électro-donneurs comme le méthoxy ou le méthyle (6e-g, 6n, 7c, 7e, 7f) ou très électroattracteurs comme 6a-c, 7a-d, 7h) qui portent les groupe cyano (CN), ou un atome de fluor. En se référant à l’activité vasodilatatrice obtenue par certains composés on remarque que [3] :
- Que les composés vasodilatateurs les plus actifs, à savoir 6g-i, 7f-h, n’ont montré quasiment aucune activité antibactérienne.
- Que les composés antibactériens les plus puissants, à savoir 6j, 7i (6q et 7k n’ont pas été testés sur le modèle aortique)، n’ont montré qu’une activité vasodilatatrice modérée. En effet, ils étaient environ 36 fois et 39 fois moins actifs que le composé 6g sur le modèle aortique respectivement.
Tout ceci, nous permet de dire qu’il y une réelle possibilité, en étudiants d’avantages de produits, de dissocier l’activité vasodilatatrice de l’activité antibactérienne. C’est-à-dire, avoir des molécules vasodilatatrices très puissantes dépourvues d’activité antibactérienne, ou du moins très faible, et des molécules antibactériennes très puissantes dépourvues d’activité vasodilatatrices, ou du moins très faible. Il sera également très intéressant d’investiguer de nouveaux sulfonylurées N-méthylées, donc non ionisées à pH physiologique, et de nouvelles urées dont le groupe R est une chaine aliphatique.
Chapitre II Intérêt biologique des dihydropyrimidinone
19
II.2.2. Activité anti hypertensive et modulatrice des canaux calciques
voltage-dépendants
Le SQ 32.926 et le SQ 32.547 (Figure II.3) ont montré une activité inhibitrice d’échange de calcium à travers les canaux cellulaires. Cependant cette efficacité est observée exclusivement pour les énantiomères (R) de ces composés. [5]
N H N O O N F H3C S (R) SQ 32547 F3C N H N O NH2 O O H3C i-PrO (R) SQ 32926 NO2
Figure II.4. Structures chimiques de deux dihydropyrimidinones antihypertensives.
D’autres modifications structurelles sur le cycle dihydropyrimidinone ont conduit à des DHPMs portant un groupe ester sur l’azote N3 (Figure II.4) ressemblant ainsi plus étroitement aux dihydropyridines de type nifédipine. [6]
N H MeO2C Me CO2Me O2N nifedipine N N O O N Ph i-PrO2C Me O2N Me N H N i-PrO2C Me S O2N CO2Et
Figure II.5. Exemples sur de dihydropyrimidinones modifiées, inhibitrices des canaux
Chapitre II Intérêt biologique des dihydropyrimidinone
20
Tableau II.2 : Effet des composés 6a-k et 7a-j sur l’activité contractile des anneaux de
l’aorte de rat précontractés par 30mM de KCl.
C X R EC50 (µM)a C X R EC50 (µM)a 6a S 4-CN-Ph- 24.73± 2.86 (4) 7a S 4-CN-Ph- 49.54 ± 5.93 (4) 6b S 3-CN-Ph- 22.92 ± 2.97 (4) 7b S 3-CN-Ph- 27.64 ± 3.11 (4) 6c S 4-F-Ph- 42.66 ± 2.66 (4) 7c S 4-Me-Ph- 65.55 ± 4.24 (4) 6d S 4-Cl-Ph- 79.26 ± 9.33 (4) 7d S 4-F-Ph- 63.23 ± 5.52 (4) 6e S 4-Me-Ph- 48.21 ± 2.00 (4) 7e O 2-OMe-Ph- 48.20 ± 3.70 (4) 6f O 2-OMe-Ph- 20.47 ± 1.43 (4) 7f O 4-OMe-Ph- 17.04 ± 1.43(4) 6g O 4-OMe-Ph- 0.98 ± 0.06 (4) 7g O 4-Cl-Ph- 11.96 ± 0.95 (4) 6h O 4-Cl-Ph- 5.08 ± 0.36 (4) 7h O 4-F-Ph- 17.98 ± 1.40 (4) 6i O 4-F-Ph- 16.54 ± 1.03 (4) 7i O -NO2- Ph- 38.49 ± 1.0 (4) 6j O 2-NO2- Ph- 35.18 ± 1.04 (4) 7j O 4-Me-PhSO2- > 150 (4) 6k O 4-Me-PhSO2- > 150 (4) Nif /////// //////////////// 0.029 ± 0.002 (4) Dia /// ///////////// 19.5 ± 2.7 (6)b
Les résultats sont exprimés sous forme de moyenne ± s.e.m. n se refère au nombre de mesures effectuées.
a EC50 : concentration nécessaire pour induire 50% de relaxation de la contraction initiale induite par 30 mM de KCl. C : composé. Dia: diazoxide. Nif : nifédipine. b Résultats publiés.[7]
Les résultats ont montré que les sulfonylurées 6k (dérivé para) et 7j (dérivé méta) présentaient une très faible activité vasodilatatrice sur les anneaux de l'aorte de rat (EC50 >
150µM) comparées aux urées et thiourées (tableau II.2). Dans la série 6, on peut observer que tous les composés présentaient une activité vasodilatatrice marquée, en particulier les thiourées 6a et 6b et les urées 6f-i. En effet, certains de ces derniers dérivés s’étaient révélés plus actifs que le diazoxide, parmi lesquels le composé 6g (CE50 = 0,983 ± 0,061 µM) était le
plus actif (p<0,05). [6] En termes de relations structure-activité, les groupes à effet mésomère
électro-donneur, occupant la position para du groupe phényluréido, s’étaient montrés les groupes les plus favorables à l'expression d'une activité vasodilatatrice élevée, comme c'était le cas pour 6g et 6h (OCH3 et Cl respectivement). Le transfert du groupe méthoxy (OCH3) en
position ortho a réduit l'activité vasodilatatrice de près de 21 fois par rapport à celle de la position para (6gvs6f). Cette tendance est également observée avec les composés de la série 7.
[3] En effet, les composés les plus actifs de cette série portent un groupe à effet mésomère
donneur d'électrons (OCH3 ou Cl) en position para (7f-h) et sont tous des urées. Cependant,
Chapitre II Intérêt biologique des dihydropyrimidinone
21
actifs (7fvs6g et 7gvs6h), en particulier 6g, qui était 17 fois plus actif que 7f. [3] L’inactivité des sulfonylurées 6k et 7j pourrait être attribuée à leur caractère acide faible, car ils ont un atome d'hydrogène labile appartenant au groupe NH confiné entre les groupes attracteurs d’électron, SO2 et C=O, de la fonction sulfonylurée. Cela signifie qu'ils existent
principalement sous forme d’espèces chargées négativement à pH physiologique et que la forme active doit être neutre. Un tel phénomène a également été observé avec d’autres séries de composés, urée, thiourée et sulfonylurée, où ces derniers composés s’étaient également avérés inactifs sur le même modèle biologique étudié dans ce travail. [8, 9,10]
II.2.3. Activité anticancéreuse
Le Monastrol est une molécule perméable qui a conduit au développement de nouveaux médicaments anticancéreux. Il se fixe sur les branches bipolaires s’opposant à la division cellulaire empêchant ainsi le développement anarchique de la cellule maligne (Figure II.6). [11] N H NH OH O C2H5O H3C S (S)-Monastrol
Figure II.6. Structure du (S)-Monastrol, une dihydropyrimidinthione, dotée de propriétés
anticancéreuses.
En 2015, l’étude de la cyclocondensation de Biginelli combinant la curcumine, des aldéhydes aromatiques substitués et l’urée/thiourée dans l’éthanol et l’acide sulfurique concentré a donné naissance à deux produits possédant une activité anticancéreuse modérée (Figure II.7).[12] HN NH O O HO HO X X=S,O O
Chapitre II Intérêt biologique des dihydropyrimidinone
22
Certaines des pyrimidinones récemment découvertes contenant l'unité arylidine sont classées comme agents anti-tumoraux efficace Figure II. 8(. [13]
Figure II.8. Structure de deux dihydropyrimidinones, des agents antitumoraux
II.2.4. Activité antivirale
Agents anti-VIHLes dérivés de batzelladine A et B, des deux produits naturels comportant le synthon DHPM, ont été obtenus par Ashok D. Patil et al. (Figure II.9). Provenant de sources naturelles marines, ils ont été les premiers produits naturels de faible poids moléculaire rapportés, montrant une activité anti-VIH prometteuse et, par conséquent, sont potentiellement candidats pour le traitement du SIDA. [14]
N NH NH2 O O (CH2)3 H N H2N NH2 (CH2)6 O O N H N N H H H C9H19 Batzelladine B N NH NH2 O O (CH2)3 H N H2N NH2 (CH2)6 O O N H N N H H H C9H19 Batzelladine A
Figure II.9. La Batzelladine A et B, comportant le noyau DHPM et possédant des propriétés
Chapitre II Intérêt biologique des dihydropyrimidinone
23
En 2015, Sari et al. Synthétisés des dérivés de l’acide dihydropyrimidine α,γ dicétobutanoique pour une intégrase du VIH. Ils ont synthétisé 20 nouvelles molécules et évalué leur activité enzymatique contre l’intégrase du VIH (Figure II.10). [15]
N N O EtO O OH OH O O CH3 N N O EtO O OH OH O O OCH3 N N O HO S O OH O OH N N O EtO S O HO O OH OMe
Figure II.10. Structures de dihydropyrimidinones ayant des propriétés anti-VIH, de première
et deuxième génération.
D’autre part, une bonne activité inhibitrice de l’hépatite B a été réalisée par l’emploi d'un composé de synthèse présenté sous le code Bay 41-4109 (Figure II.11). Ce composé présente des propriétés inhibitrices non nucléotidiques de la réplication du virus de l’hépatite B. Il a été démontré également que cette activité est liée exclusivement à l’énantiomère (S) de ce composé. [16] N H N N F Me O MeO F F Cl
Figure II.11. Exemple d’une dihydropyrimidine, le (S) Bay 41-4109, dotée d’activité
Chapitre II Intérêt biologique des dihydropyrimidinone
24
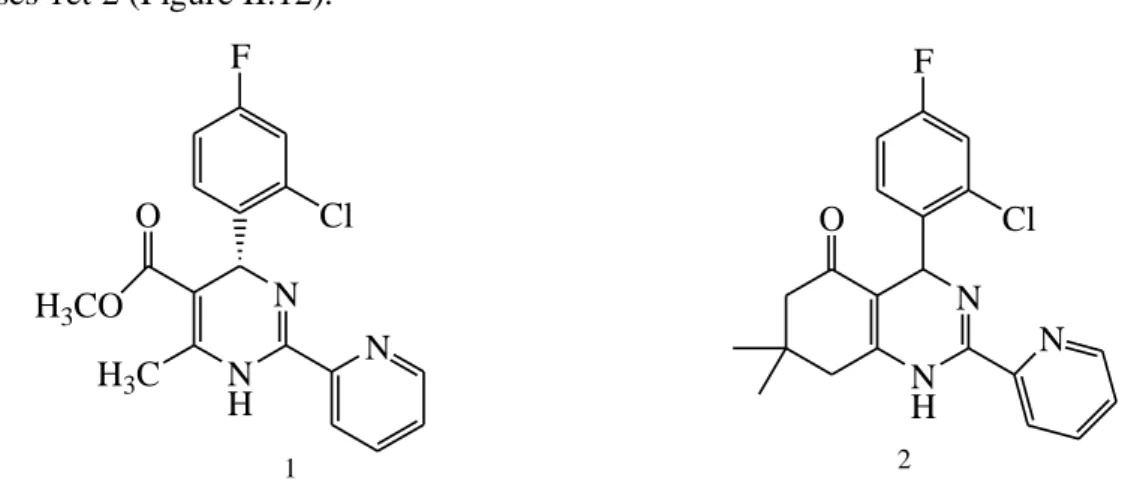
De même, une bonne activité inhibitrice de l’hépatite B a été détectée par l’emploi des composés 1et 2 (Figure II.12). [16]
N H N N H3C O H3CO Cl F N H N N Cl F O 1 2
Figure II.12. Exemple d’une dihydropyrimidine, dotée d’activité antivirale.
II.2.5. Activité anti-inflammatoire
Des séries de dérivés de l’acide 3-(2-thioxo-1, 2, 3,4-tétrahydropyrimidin5-yl-4,6- propénoïques ont été examinés pour leur activité anti-inflammatoire. La plupart de ces composés ont montré une activité anti-inflammatoire significative (Figure II.13). [17]
N H NH S R HOOC OH R=H,OCH3 N H NH S R HOOC O R=H,CH3 N H NH OCH3 O S H3C HOOC O CH3 H3C
Figure II.13. Exemples de DHPMs dotés de propriétés anti-inflammatoires
On a rapporté également que les DHPMs, tel le 2-benzylidène-5-(2-méthoxyphényl)-7-méthyl-3oxo-3,5-dihydro-2H-thiazolo [3,2-a]-pyrimidine-carboxylate d'éthyle et le 6-(2méthoxyphényl)-8-méthyl-2,3,4,6-tetrahydropyrimido[2,1-b]-[1,3]thiazine-7-carboxylate d'éthyle ont prouvé une activité anti-inflammatoire (Figure II.14).[18]
Chapitre II Intérêt biologique des dihydropyrimidinone 25 N N S Ph O Me EtO2C MeO N N Me EtO2C MeO S
Figure II.14. Agent à activité anti-inflammatoire.
De plus, certains dérivés de DHPMs sont munis d’une activité anti-inflammatoire (figure II.15). [19] N H NH O X O O X=S,O N H NH O O O OH Cl
Figure II.15. Autres dérivés de DHPMs à activité anti-inflammatoire.
II.2.6. Activité antioxydante
Les DHPMs sont également dotées d’une activité antioxydante telle que les composés suivants (Figure II.16). [20]
N H NH O N O Ph Ph R O H3C R=H,NO2 N R1 NH X H3C HN R O X=O,S N H NH O Ph O O H3C
Figure II.16. Agent à activité antioxydante.
En 2009, Kumaret et al. Synthétisèrent 32 composés qui ont été évalués pour leur activité antioxydante par la méthode de DPPH (2,2-diphényl-1-picrylhydrazyl). Parmi les 32 composés, les deux dérivés 3 et 4 étaient les plus puissants (Figure II.17). [15]
Chapitre II Intérêt biologique des dihydropyrimidinone 26 N NH O N H Cl NO2 S CN N NH O N H Cl NO2 O CN 3 4
Figure II.17. Structures de deux dihydropyrimidinones, deux puissants agents antioxydants.
L’objectif d’une étude menée par Stefani H.A. et coll. A été d’évaluer le potentiel antioxydant d’une nouvelle série de dihydropyrimidin-(2H)-ones. La procédure décrit un protocole simple et intéressant pour l’obtention des dihydropyrimidin-(2H)-ones avec bon rendements.
En effet, tous les produits sélectionnés sont doués de cette activité. Il a trouvé que les composés (5) et (6) exhibent une forte activité envers la peroxydation des lipides (Figure II.18). [21] N H NH O O R H O N H NH O O R NO2 O R= Ph N Ph 5 6
Figure II.18. Produits de Biginelli antioxydants.
II.2.7. Activité antituberculeuse
Viresh H. Shah et al. Ont synthétisé 30 dihydropyrimidines et évalué leur activité antituberculeuse in vitro contre les mycobactéries de la tuberculose H37Rv. Les deux composés 7 et 8 sont les composés les plus actifs in vitro (Figure II.19).
Zalavadiya et al. Ont synthétisé différentes DHPMs, dont le composé 9 qui présenta une activité contre les mycobactéries de la tuberculose H37Rv (Figure II.19). [22]
Chapitre II Intérêt biologique des dihydropyrimidinone 27 N H NH N N F EtO O O N H NH N N NO2 EtO O O N HN O OEt F Cl NO2 O 7 8 9
Figure II.19. DHPMs dotées une activité antituberculeuse.
D’autres dérivés de la dihydropyrimidinone sont pourvus d’une activité antituberculeuse. Les composés ayant comme substituant le 2,3- diméthylphényl et le 3,4-diméthyl carbamoyl ont montré un effet inhibiteur contre le Mycobacterium tuberculoses H37Rv de 65% et de 63%
respectivement (Figure II.20). [23]
N H NH O N H O CH3 H3C OPh H3C N H NH O N H O H3C NO2 H3C H3C
Figure II.20. Des dihydropyrimidinones, des agents antituberculeux.
Conclusion
Ce chapitre est une synthèse bibliographique de l’intérêt biologique des 3,4- dihydropyrimidinones. En effet, ce type de composés possède des potentialités pharmacologiques et thérapeutiques considérables touchant de nombreux systèmes biologiques et dont certains sont déjà commercialisés, telle que la nifédipine, qui est un bioisostère de la dihydropyridine. Ceci explique l’intérêt considérable suscité par les dihydropyrimidines de la part de la communité scientifique mondiale, chimistes, biologistes et médecins, afin de développer de nouveaux médicaments.
Chapitre II Intérêt biologique des dihydropyrimidinone
28
Références bibliographiques
[1] Tomassoli I.2010, Synthèse et Evaluation de nouveaux dérivés quinoléiques impliqués
dans les maladies neurodégénératives. Thèse de doctorat : Sciences de la vie de la santé : Université de Franche-Comté.
[2] Akhaj T.N.; Raval J.P,2012, Design, synthesis, in vitro evaluation of tetrahydropyrimidine-isatin hybrids as potential antibacterial, antifungal and anti-tubercular agent.Chinese Chemical Letters , 23,446-449.
[3] Tahir Habila, Mebrouk Belghobsi, Mohamed-Zakaria Stiti, Eric Goffin, Pascal de Tullio,
Gilles Faury, Bernard Pirotte, Smail Khelili, 2019, Synthesis and vasodilator activity of 3,4-dihydropyrimidin-2(1H)-ones bearing urea, thiourea, and sulfonylurea moieties, Canadian Journal of Chemistry, 97, 20-28.
[4] HABILA T, 2019, Synthèse et évaluation pharmacologique du
3,4-dihydropyrimidin-2(1H)-ones portant des fonctions urée, thiourée et sulfonylurée. Thése doctorat. Option Chimie organique. Spécialité Chimie. Faculté Des sciences exactes et informatiques. Universite mohemed seddik benyahia -jijel.
[5] Chouguiat L, 2010, Développement de nouvelles méthodes pour les réactions
multicomposants de Hantzsch et de Biginelli: Préparation des 3,4-dihydropyrimidinones et 1,4dihydropyridines.Mém.de Magistère : Chimie organique : Université Mentouri-Constantine.
[6] Kappe.C.O, 2000,Biologically active dihydropyrimidones of the Biginelli-type a literature survey.European Journal of Medicinal Chemistry, 35, 1043-1052.
[7] Pirotte, B.; Ouedraogo, R.; De Tullio, P.; Khelili, S.; Somers, F.; Boverie, S.; Dupont, L.;
Fontaine, J.; Damas, J.; Lebrun, P, 2000, 3-Alkylamino-4 H-pyrido [2, 3-e]-1, 2, 4-thiadiazine 1, 1-dioxides structurally related to diazoxide and pinacidil as potassium channel openers acting on vascular smooth muscle cells: Design, synthesis, and pharmacological evaluation. Journal of medicinal chemistry , 43, 1456-1466.
[8] Bouider, N.; Fhayli, W.; Ghandour, Z.; Boyer, M.; Harrouche, K.; Florence, X.; Pirotte,
B.; Lebrun, P.; Faury, G.; Khelili, S, 2015, Design and synthesis of new potassium channel activators derived from the ring opening of diazoxide: Study of their vasodilatory effect, stimulation of elastin synthesis and inhibitory effect on insulin release. Bioorganic & medicinal chemistry, 23, 1735-1746.
Chapitre II Intérêt biologique des dihydropyrimidinone
29
[9] Bouhedja, M.; Peres, B.; Fhayli, W.; Ghandour, Z.; Boumendjel, A.; Faury, G.; Khelili,
S, 2018, Design, synthesis and biological evaluation of novel ring-opened cromakalim analogues with relaxant effects on vascular and respiratory smooth muscles and as stimulators of elastin synthesis. European journal of medicinal chemistry, 144, 774-796.
[10] Harrouche, K.; Renard, J.-F.; Bouider, N.; De Tullio, P.; Goffin, E.; Lebrun, P.; Faury,
G.; Pirotte, B.; Khelili, S, 2016, Synthesis, characterization and biological evaluation of benzothiazoles and tetrahydrobenzothiazoles bearing urea or thiourea moieties as vasorelaxants and inhibitors of the insulin releasing process. European journal of medicinal chemistry, 115, 352-360.
[11] Boumoud B, 2008, Développement de nouvelles voies de la réaction de Biginelli et la
synthèse de nouvelles structures du type quinoléine dihydropyrimidinone. Thèse de Doctorat : Chimie Organique : Université Mentouri-Constantine.
[12] Sharma, R.; Jadav, S. S.; Yasmin, S.; Bhatia, S.; Khalilullah, H.; & Ahsan, M. J, 2015,
Simple, efficient, and improved synthesis of Biginelli-type compounds of curcumin as anticancer agents. Medicinal Chemistry Research, 24, 636-644.
[13] Deres, K.; Schröder, C. H.; Paessens, A.; Goldmann, S.; Hacker, H. J.; Weber, O.;
Kraemer,T.; Niewoehner,U.; Pleiss,U.; Stoltefuss,J.; Graef, E.; Koletzki, D.; Masantschek, R.N.A.; Reimann, A.,Jaeger, R.; .; Gro,R.; Beckermann, B.; Schlemmer, K.; H.; Haebich, D.,Ruebsman-Waigmann,H, 2003, Inhibition of hepatitis B virus replication by drug-induced depletion of nucleocapsids. Science, 299, 893-896.
[14] Ashok D. Patil et al, 1995, Novel Alkaloids from the Sponge Batzella sp : Inhibitors of
HIV gpl2O-Human CD4 Binding.J. Org. Chem, 60, 1182-1188.
[15] Kaur, R.; Chaudhary, S.; Kumar, K.; Gupta, M. K.; & Rawal, R. K, 2017,Recent
synthetic and medicinal perspectives of dihydropyrimidinones: A review. European journal of medicinal chemistry, 132, 108-134.
[16] Amine khodja I, 2015, Etude des effets de quelques catalyseurs sur la préparation des
3,4-dihydropyrimidinones, des 1,4-dihydropyridines et des pyrano[2,3-c]pyrazoles. Thèse de Doctorat : Chimie Organique : Université Frères Mentouri-Constantine.
[17] Rajanarendar E. et al, 2010, Synthesis, antimicrobial, and mosquito larvicidal activity of
1-aryl-4-methyl-3,6-bis-(5-methylisoxazol-3-yl)-2-thioxo-2,3,6,10b-tetrahydro-1H-pyrimido[5,4-c]quinolin-5-ones.Bioorg. Med. Chem. Lett, 20, 6052–6055.
[18] Cohen, F.; Collins, S. K.; Overman, L. E, 2003, Assembling polycyclic bisguanidine
motifs resembling batzelladine alkaloids by double tethered Biginelli condensations. Organic letters, 5, 4485-4488.
Chapitre II Intérêt biologique des dihydropyrimidinone
30
[19] Kwon, O. W., Moon, E., Chari, M. A., Kim, T. W., Kim, A. J., Lee, P., ... & Kim, S. Y. 2012, A substituted 3, 4-dihydropyrimidinone derivative (compound D22) prevents
inflammation mediated neurotoxicity; role in microglial activation in BV-2 cells. Bioorganic & medicinal chemistry letters, 22, 5199-5203.
[20]Prabahar,K.J.,Ramakrishnan,V.T.,Sastikumar,D.,Selladurai,S.,Masilamani,V.A,1991,new
classoflaserdyesfrom the acridinedione derivatives. Indian J.PureAppl.Phys., 29, 382.
[21] Skkiou H.2016.Incorporation du cuivre dans les matériaux mésoporeux. Applications à
la synthèse des tentioactifs et réaction de Biginelli. Thèse de doctorat : chimie des matériaux : Université d’Oran.
[22]Jadhav, V.B., Holla, H.V., Tekale, S.U.,Pawar, R.P, 2012, Bioactive dihydropyrimidines: An overview. Chem. Sin, 3, 1213-1228.
[23] Timpe, H.J., Ulrich,S.,Decker,C.;Fouassier,J.P,1993, Photoinitiatedpolymerizationof
acrylates andmethacrylateswithdecahydroacridine-1,8-dione=onium saltinitiatorsys- tems. Macromolecules, 26, 4560-4566.
Conclusion générale
31
Conclusion générale
De nos jours, la synthèse organique et la catalyse sont deux domaines en évolution constante. Dans ce contexte, les réactions à composants multiples (one pot) catalysées constituent un outil de choix pour la synthèse de molécules hétérocycliques complexes avec un maximum de respect de l’environnement car elles demandent peu d’étapes, donc elles consomment moins d’énergie, avec une économie de temps et la formation d’un minimum de produits secondaires. Parmi ces réactions, figurent celles de Biginelli aboutissant aux 3,4-dihydropyrimidinones, de Hantzsch aboutissant aux 1,4-dihydropyridines et la synthèse des pyranopyrazoles. Grace à leur large spectre d’intérêts biologiques, ces composés ont attiré l’attention des chercheurs et un grand nombre de publications leur est attribué chaque année. Dans ce mémoire, nous avons donné un rappel bibliographique englobant l’intérêt biologique des 3,4- dihydropyrimidinones en tant qu’agents bloqueurs de canaux calciques, et comme agent antihypertensifs. Autres effets biologiques des DHPMs comme les activités antivirales, anti-tumorales, antibactériennes et anti-inflammatoires ont été décrites.
Les méthodes de synthèse ont été également rapportées, et la réaction multi composants de Biginelli est cependant la méthode la plus significative car elle donne accès à ces molécules avec des rendements acceptables. Les versions améliorées de cette condensation utilisant divers catalyseurs sous des conditions réactionnelles optimisées l’ont rendue plus efficace et très attirable. En effet, elle a permis une diversité de structures obtenus préditant également une diversité dans les propriétés pharmacologiques et thérapeutiques, comme on l’a vu dans ce mémoire.
Résumé
Les réactions multicomposantes constituent l’un des outils les plus importants de la synthèse organique car des structures complexes sont rapidement obtenues à partir de substrats très simples. Parmi ces réactions on trouve la condensation de Biginelli qui permet l’accès à des hétérocycles azoté de type 3,4-dihydropyrimidinones connus pour leurs diverses activités biologiques. Nous avons mis en relief l’intérêt des dihydropyrimidinones pour l’obtention de nouvelles structures hétérocycliques efficace, et la diversité des propriétés pharmacologiques et thérapeutiques engendrées par cette diversité structurale.
Les mots clés : Dihydropyrimidinone, réaction multicomposants, réaction de Biginelli,
propriétés biologiques.
Abstract
Multicomponent reactions are one of the most important tools in organic synthesis because complex structures are quickly obtained from very simple substrates. Among these reactions is the Biginelli condensation, which allows access to nitrogenous heterocycles of the 3,4-dihydropyrimidinone type known for their various biological activities. We have highlighted the interest of dihydropyrimidinones for obtaining new efficiently heterocyclic structures, and the diversity of pharmacological and therapeutic properties generated by this structural diversity.
Keywords: Dihydropirimidinone, multicomponent reaction, Biginelli reaction, biological
properties.