E
Ellaabboorrééppaarr::
Docteur Jihad RAOUI
S
Soouussllaaddiirreeccttiioonndduu
Professeur Rajae BENANI
Année Universitaire : 2019 – 2020
M
M
é
é
m
m
o
o
i
i
r
r
e
e
d
d
e
e
f
f
i
i
n
n
d
d
’
’
é
é
t
t
u
u
d
d
e
e
s
s
Pour L’obtention du Diplôme National de Spécialité
en
Cardiologie
I
I
n
n
t
t
i
i
t
t
u
u
l
l
é
é
ROYAUME DU MAROC
Université Mohammed V - Rabat Faculté de Médecine et de Pharmacie
RABAT
D
D
I
I
L
L
A
A
T
T
A
A
T
T
I
I
O
O
N
N
M
M
I
I
T
T
R
R
A
A
L
L
E
E
P
P
E
E
R
R
C
C
U
U
T
T
A
A
N
N
E
E
E
E
A
A
U
U
C
C
O
O
U
U
R
R
S
S
D
D
E
E
L
L
A
A
G
G
R
R
O
O
S
S
S
S
E
E
S
S
S
S
E
E
(
(
A
A
P
P
R
R
O
O
P
P
O
O
S
S
D
D
E
E
2
2
4
4
6
6
C
C
A
A
S
S
)
)
INDRODUCTION ... 1
I/ PREREQUIS ... 4
A) Rappel sur le rétrécissement mitral ... 4
a) Epidémiologie ... 4
b) Physiopathologie du rétrécissement mitral ... 5
c) Etiologies du Rétrécissement mitral ... 7
d) Diagnostic clinique du rétrécissement mitral ... 8
e) Complications du rétrécissement mitral ... 19
f) Traitement du rétrécissement mitral ... 20
B) Modifications physiologiques au cours de la grossesse ... 29
a) Pendant la grossesse ... 29
b) Pendant l’accouchement ... 35
c) Post Partum ... 35
d) Physiopathologie du RMau cours de la grossesse ... 36
II/ MATERIEL ET METHODES ... 38
A) Patientes ... 38 B) Critères d’inclusion ... 38 C) Critères d’exclusion ... 38 D) Modalités d’analyse ... 38 E) Description de la procédure ... 39 F) Etude statistique ... 40
III/ RESULTATS ... 42
A) Caractéristiques des patientes : ... 42
B) Procédure ... 43
C) Résultats immédiats de la DMP ... 44
D) Traitement médical ... 45
E) Accouchement et devenir des bébés ... 45
IV/ DISCUSSION ... 47
A) Prise en charge du RM pendant la grossesse ... 47
a) SCHEMA GLOBAL DE PRISE EN CHARGE ... 47
B) Dilatation mitrale percutanée : souvent ... 49
C) Dilatation mitrale percutanee et grossesse ... 50
a) A quel moment ? ... 50
b) Résultats immédiats... 51
c) Résultats à long terme... 53
d) Elargissement des indications de la DMP pendant la grossesse ... 55
D) Pronostic materno-fœtal et sténose mitrale ... 57
a) Pronostic maternel ... 57
b) Pronostic fœtal ... 58
CONCLUSION... 60
Que tous mes maîtres trouvent ici le témoignage de ma grande
estime, de ma haute considération, de mon profond respect, ainsi que
ma grande reconnaissance pour leur enseignement et leur
dévouement.
Un remerciement particulier à mon Professeur et encadrant de ce
mémoire, Professeur Rajae Benani
Un grand remerciement à mon Professeur El Haitam Naima et à
Dr Bendagha Nessma ; ainsi qu’au personnel médical
et paramédical du service de la cardiologie A de l’hôpital Avicenne,
qui ont contribué à la réalisation de ce travail.
Objectif :
L’objectif de ce travail est d’étudier les indications, les résultats immédiats et à long terme de la dilatation mitrale percutanée pendant la grossesse.
Méthodes :
Il s’agit d’une étude rétrospective portant sur 246 patientes dilatées pendant la grossesse au service de Cardiologie ’’A’’ du CHU IBN SINA de Rabat de 1997 à 2018. On a analysé les données cliniques échographiques et hémodynamiques avant et après la DMP.
Résultats :
L’âge moyen de nos patientes était de 28 ± 5,2 ans et l’âge gestationnel de 28,1 ± 4 semaines d’aménorrhée.
Le RM a été découverte pendant la grossesse dans 40 % des cas.
Sur le plan fonctionnel, 94 % des patients étaient au stade III ou IV de la NYHA. La majorité des patientes étaient en rythme sinusal (85 %).
A l’échocardiographie 80 % des patientes avaient un score de Wilkins à 8 ou 9, le RM était serré avec une SM à 0,8 cm² en moyenne (85 % des cas : SM ≤ 1 cm²). Le gradient transmitral moyen était élevé (21,4 mmHg) et la majorité des patientes étaient en hypertension pulmonaire (PAPS = 71 mmHg en moyenne).
Le taux de succès de la procédure était de 98 % avec une régression immédiate des symptômes (95 % : stade I ou II de la NYHA).
Les résultats échographiques et hémodynamiques sont résumés dans le tableau suivant :
Avant DMP Après DMP
SM (cm²) 0,8 [0,7 – 1] 2 [1,8 – 2,3] < 0,001
GMMoy (mmHg) 21 [17 – 25] 7 [4 – 8] < 0,001
PAPS (mmHg) 71 [58 – 91] 40 [30 – 46] < 0,001
Après la DMP, la grossesse a été menée à terme dans 95 % des cas avec une morbimortalité fœtale faible et un accouchement dans de bonnes conditions le plus souvent par voie basse (85 % des cas).
Conclusion :
La DMP est le traitement de choix du rétrécissement mitral serré symptomatique pendant la grossesse avec d’excellents résultats et très peu de complications.
Elle permet une nette régression des symptômes, une amélioration des paramètres hémodynamiques et des conditions de la grossesse et de l’accouchement.
Enfin, elle doit être réalisée, lorsqu’elle est indiquée, dans un centre de référence.
Mots clés : rétrécissement mitral – grossesse – Dilatation mitrale percutanée.
Abréviations
ACFA Arythmie Complète par Fibrillation Auriculaire AVCI Accident Vasculaire Cérébral Ischémique
BB BétaBloquant
IC Inhibiteur Calcique
CCF Commissurotomie à Cœur Fermé
CCO Commissurotomie à Cœur Ouvert
CMP Commissurotomie Mitrale Percutanée
DC Débit Cardiaque
DMP Dilatation Mitrale Percutanée
ETO Echocardiographie Transoesophagienne
ETT Echocardiographie Transthoracique
FC Fréquence Cardiaque
GMMoy Gradient Mitral Moyen
IM Insuffisance Mitrale
OAP Œdème Aigu du Poumon
OG Oreillette Gauche
PAPS Pression Artérielle Pulmonaire Systolique
POG Pression de l'Oreille Gauche
RM Rétrécissement Mitral
RVM Remplacement Valvulaire Mitral
SM Surface Mitrale
TP Taux de Prothombine
Liste des tableaux
Tableau 1: Résultats échographiques et hémodynamiques de la DMP ... 8
Tableau 2 : Score de Wilkins... 17
Tableau 3 : Score de cormier ... 19
Tableau 4 : complications et contre-indications de la DMP ... 27
Tableau 5 : Indications de DMP en cas de RM avec SM ≤1.5cm2 ... 29
Tableau 6 : Résultats échographiques et hémodynamiques de la DMP ... 44
Tableau 7 : Résultats échographiques et hémodynamiques de la DMP ... 45
Tableau 8 : Comparaison du pronostic maternel entre DMP et chirurgie ... 50
Tableau 9 : Efficacité et sécurité de la DMP dans les différentes séries de la littérature. ... 52
Tableau 10 : Complications fœtales en fonction de la sévérité de la sténose mitrale ... 58
Liste des figures
Figure 1: Silhouette des chambres cardiaques dans la sténose mitrale ... 10 Figure 2 : Radiographie de thorax de face caractérisant le rétrécissement mitral. (Notez la saillie de l’arc moyen gauche). ... 12 Figure 3: Planimétrie de la surface d’ouverture d’une sténose mitrale serrée. .. 14 Figure 4: Résumé schématique des caractéristiques échocardiographiques de la sténose mitrale sévère. ... 16 Figure 5: Ballon d’INOUE et ses accessoires ... 22 Figure 6 : Etapes d’inflation du ballon d’INOUE ... 22 Figure 7 : Mesure hémodynamique du gradient mitral(en haut : ECG en bas : Gradient OG-VG) ... 24 Figure 8 : image illustrant la DMP par technique d’INOUE ... 26 Figure 9 : Variation du débit cardiaque pendant la grossesse (0-40 : semaines d’aménorrhée ; PP : post-partum). ... 30 Figure 10 : Variation du volume d'éjection pendant la grossesse (0-40 : semaines d’aménorrhée ; PP : post-partum). ... 31 Figure 11 : Variation de la fréquence cardiaque pendant la grossesse ... 31 Figure 12 : Compression de la veine cave inférieure et sa prévention par le décubitus latéral gauche ... 32 Figure 13: Effet de la position sur le débit cardiaque, chez la femme enceinte 33 Figure 14 : Modifications physiologiques du système cardiovasculaire pendant la grossesse. ... 35 Figure 15 : Classe de la NYHA avant DMP ... 42 Figure 16 : Classe de la NYHA avant et après DMP ... 44
Figure 17 : Survie sans évènements des patientes dilatés pendant et en dehors de la grossesse ... 54 Figure 18 : Indications de la DMP pendant la grossesse. ... 56 Figure 19 : Pronostic maternel et fœtal en fonction de la sévérité de la sténose mitrale ... 57
Dans les pays en développement, les pathologies rhumatismales sont à l’origine de la moitié des complications cardiaques pendant la grossesse et le rétrécissement mitral en est le chef de file (75 % des cas) [1].
La sténose mitrale est également la valvulopathie la plus fréquemment diagnostiquée per grossesse (90 %) [2], elle est mal tolérée et s’accompagne de nombreuses complications materno-fœtales.
La prise en charge du rétrécissement mitral (RM) chez la femme enceinte doit être pluridisciplinaire (cardiologues, anesthésistes, réanimateurs et obstétriciens) afin de choisir la meilleure option thérapeutique permettant une grossesse et un accouchement dans de bonnes conditions.
On évite autant que possible de devoir procéder à un remplacement valvulaire en CEC pendant la grossesse, car les risques sont élevés pour le fœtus (mortalité fœtale 20-30%). [3]
La dilatation mitrale percutanée (DMP) est au centre de cette prise en charge et doit être effectuée, lorsqu’elle est indiquée, dans un centre de référence.
Nous étudierons à travers une série rétrospective de 246 femmes enceintes porteuses de rétrécissement mitral serré hospitalisées au sein du service de cardiologie A à Avicenne, les manifestations cliniques de cette valvulopathie au cours de la grossesse, les moyens de diagnostic ainsi que les particularités hémodynamiques du rétrécissement mitral chez la femme enceinte.
Nous étudierons aussi la prise en charge thérapeutique médicamenteuse et interventionnelle par la réalisation de la DMP pendant la grossesse, ses particularités, ses indications et aussi ses résultats immédiats et à long terme.
I/
PREREQUIS
A) Rappel sur le rétrécissement mitral
a) Epidémiologie :La cardiopathie rhumatismale est encore épidémique dans les pays en voie de développement, notamment au Maroc.
La diminution de l'incidence des cardiopathies rhumatismales dans les pays développés avait déjà commencé en 1910 et n'est pas inférieure à 1,0 pour 100 000.
Par ailleurs, le taux de survenue de cardiopathies rhumatismales dans les pays en développement reste considérable. Comme la prévalence de la fièvre rhumatismale dans les pays industrialisés a commencé à décliner avant même l'ère de la pénicilline et était donc liée à l'amélioration du niveau de vie, la prévalence persistante de la cardiopathie rhumatismale dans les pays en développement est liée non seulement à la disponibilité limitée de la pénicilline mais à leur statut socio-économique (surpopulation, pauvreté et accès difficile aux soins médicaux).
Selon le rapport annuel du WORLD HEART FEDERATION, environ 12 millions de personnes dans le monde sont actuellement atteintes de rhumatisme articulaire aigu et de cardiopathies rhumatismales, et des taux d'incidence élevés sont signalés dans les îles du Pacifique Sud. Plusieurs études ont été menées sur la prévalence des cardiopathies rhumatismales, rapportant 0,14 / 1000 au Japon, 1,86 / 1000 en Chine, 0,5 / 1000 en Corée, 4,54 / 1000 en Inde, et 1.3 / 1000 au Bangladesh.[4]
Dans une étude menée en Amérique du Sud sur 88 femmes atteintes de sténose mitrale rhumatismale (dont 54 avaient une sténose mitrale modérée àsévère), huit décès maternels sont survenus à la suite d'une insuffisance cardiaque.
En Afrique subsaharienne, une étude de 50 grossesses chez des femmes atteintes de cardiopathie, dont la plupart avaient une sténose mitrale rhumatismale, le taux de mortalité maternelle était élevé à 32%.
b) Physiopathologie du rétrécissement mitral :
Lorsque la surface mitrale diminue, la POG augmente progressivement, ce qui dilate l’oreillette ; cette dilatation permet de freiner l’élévation de pression par augmentation de la compliance auriculaire.
La formule de GORLIN utilisée en cathétérisme montre que le débit et le gradient de pression à travers un orifice sont liés de manière géométrique [3-4]: SVM (cm2) = K • DC / √ΔPM où : DC = débit cardiaque (L/min), ΔPM = gradient de pression moyen (mmHg) et K = constante
On en déduit que le gradient de pression transvalvulaire est fonction du carré de la vitesse du flux (ΔP ≈V2), quelle que soit la surface de la valve. C’est ce que démontre également l’équation de Bernoulli : ΔP = 4 (Vmax)2. Doubler le débit cardiaque quadruple donc le gradient de pression, et augmente d’autant la POG. Une sténose mitrale asymptomatique au repos devient ainsi rapidement limitante à l’effort. L’exercice, le stress, l’hypervolémie, la grossesse ou l’hyperthyroïdisme sont responsables d’une ascension brutale de la POG, qui induit une fuite liquidienne interstitielle pulmonaire, d’où dyspnée aiguë et risque d’œdème pulmonaire.
Comme la tachycardie raccourcit la diastole davantage que la systole, l’accélération du rythme cardiaque diminue le temps à disposition pour faire passer le volume de chaque cycle cardiaque à travers la valve mitrale dont le débit est très restreint ; le flux doit accélérer, donc le gradient augmente géométriquement. Il s’ensuit une hypertension dans l’oreillette gauche, qui retentit sur les veines pulmonaires et induit une stase pulmonaire.
D’autre part, le faible remplissage et la petite taille du VG limitent le volume systolique, qui ne peut guère augmenter lorsque la fréquence ralentit. Le débit cardiaque est ainsi doublement limité par rapport à la fréquence :
La tachycardie diminue le remplissage diastolique, qui est très lent ; La bradycardie diminue le débit, parce que le volume systolique est
fixe.
Le remplissage du VG est moins dépendant de la contraction auriculaire que lors d’un défaut de compliance ventriculaire [4-5].
C’est l’accélération du rythme ventriculaire global qui décompense l’hémodynamique lors du passage en fibrillation auriculaire. Même s’il est un avantage électrique, le rythme sinusal n’est pas forcément efficace. En effet, l’immense oreillette de la sténose mitrale, dont la paroi dilatée est fine, n’est pas capable de générer une pression susceptible de franchir l’obstacle de la valve. Cette dissociation électromécanique peut s’objectiver à l’écho Doppler : malgré le rythme sinusal, on ne voit aucun flux A de contraction auriculaire en télé-diastole à travers la mitrale. Dans la cavité de l’OG, qui peut atteindre 350 ml, le flux est extrêmement lent. A l’échocardiographie, on voit en général un lent tournoiement de la masse sanguine ressemblant à des volutes de fumée (contraste spontané). Le risque de thrombus mural est élevé, particulièrement dans l’appendice auriculaire (AAG) où la stase est marquée.
Le VG est en général de petites dimensions en cas de sténose mitrale pure, mais sa fonction systolique est conservée ; la FE est normale dans 75% des patients [52]. La masse ventriculaire est normale ou réduite. Des altérations de la cinétique segmentaire apparaissent fréquemment à la base du VG, parce que la rigidité de la valve mitrale empêche une contraction normale des segments sous-jacents [6]. La fonction peut être réduite par une myocardite d’accompagnement propre au RAA, qui est présente dans 20% des cas.
Malgré une fonction contractile conservée, le ventricule gauche ne peut guère modifier son débit car son remplissage est limité. Il fonctionne à volume diastolique bas et fixe, et se trouve dans l’impossibilité d’augmenter sa fréquence : s’il accélère, le remplissage diastolique devient insuffisant. Il ne dispose d’aucune réserve de précharge pour modifier sa position sur la courbe de Starling et améliorer sa performance systolique à l’effort : le volume systolique reste lui aussi bas et fixe. Le VG ne peut pas non plus compenser une vasodilatation artérielle ou une hypovolémie par une tachycardie.
c) Etiologies du Rétrécissement mitral : RM acquis : RAA+++ : 90% des RM,
Le RM est parmi les atteintes valvulaires rhumatismales les plus fréquentes. 65% d’entre elles comportent une lésion sténosante de la valve mitrale, soit pure (25%) soit associée à une régurgitation mitrale (40%).
La lésion anatomique primitive est une fusion de commissures
Ensuite : un remaniement des 2 valves (aspect rigide ou figé) et de l’appareil sous valvulaire
+ calcifications + rétraction et épaississement des cordages : aspect en « museau de tanche » ou en « bouton de chemise » de l’orifice mitral.
Autres causes : RM congénital :
Rare (2%), symptomatique chez le Nourrisson et le jeune enfant
Peut être associé à d’autres malformations cardiaques : RM+CIA= Syndrome de Lutembacher
RM post radique : irradiation thoracique le + souvent dans la maladied’hodgkin. VMA épaissie et rigide, sténose Aortique souvent associée pas de fusion commissurale
Fibrose end myocardique
Maladies inflammatoires : LES, PR Maladies de surcharge : amylose
RM dans le Syndrome carcinoïde ou en cas de toxicité médicamenteuse d) Diagnostic clinique du rétrécissement mitral:
Signes fonctionnels :
La sténose est une maladie d’évolution très lente. Les symptômes se manifestent 20 à 40 ans après l’atteinte initiale du RAA, et il faut encore une dizaine d’années pour qu’ils deviennent gênants. Ils se manifestent sous forme de dyspnée, apparue souvent de manière brusque à l’occasion d’un effort, d’une grossesse, ou de toute condition nécessitant une augmentation du débit et/ou de la fréquence cardiaques, telle la thyréotoxicose, l’anémie ou le passage en FA.
Par la suite, la fatigabilité, l’orthopnée et l’hémoptysie traduisent le bas débit et la stase gauche. Ces manifestations de l’insuffisance gauche sont progressivement complétées par celles d’une stase droite (œdèmespériphériques, ascite) au fur et à mesure que l’hypertension pulmonaire induit une dilatation droite et une insuffisance tricuspidienne secondaire.
La présentation est alors typique : faciès mitral, extrémités œdématiées, froides et cyanosées, jugulaires dilatées et pulsatiles, ascite, pouls artériel pincé et irrégulier. La dilatation et la fibrillation auriculaires peuvent survenir chez des malades par ailleurs asymptomatiques et occasionner des thrombo-embolies dans 14% des cas [7].
Sans traitement, la survie à 10 ans est de > 80% en l’absence de symptômes, et de 50-60% chez les patients symptomatiques. Mais lorsque l’effort n’est plus possible (classe NYHA III-IV), elle n’est plus que de 0-15% [8].
Signes physiques :
Inspection : Peu d'intérêt en dehors du faciès mitral (érythrose et du visage, prédominant aux pommettes), chez les patients âgés avec RM évoluant depuis 20 ou 30 ans : nanisme mitral (retentissement staturo-pondéral du RM sévère de l'enfant dans les pays à haut risque de RAA).
Palpation : à la pointe frémissement diastolique (ou cataire) se renforçant parfois en pré-systole, équivalent palpatoire du roulement diastolique (sensation de roulement sous la paume), la fermeture mitrale, palpable à l'apex, sauf en cas de calcification massive de la grande valve, la vibration d'ouverture mitrale traduisant le claquement d'ouverture mitrale.
Au creux épigastrique : signe de HARZER (palpation du ventricule droit au creux épigastrique) au bord parasternal gauche, vibration de fermeture des valves pulmonaires en cas d'HTAP.
Auscultation : C’est l’étape essentielle du diagnostic clinique. Elle s'effectue chez un patient en décubitus latéral gauche, au besoin après effort.
On décrit la triade de DUROZIER :
L'éclat du 1er bruit correspondant à la fermeture mitrale suivi d'une systole ventriculaire libre et B2 (fermeture aortique) normal
Claquement d'ouverture mitrale (COM), bruit bref surajouté, bien perçu à l'ENDAPEX, d'autant plus proche de B2 que la sténose est serrée
Roulement diastolique bien localisé à la pointe, il débute immédiatement après le claquement d'ouverture mitrale, se poursuit jusqu'à B1 dont il est séparé en cas de rythme sinusal par le renforcement pré-systolique.
Le renforcement pré-systolique traduction de la systole auriculaire. L'éclat de BI, le claquement d'ouverture, le roulement diastolique et le renforcement pré-systolique réalisent la classique onomatopée de DUROZIER.
En cas d'HTAP, l'auscultation pulmonaire permet d'entendre un éclat de B2 au foyer pulmonaire.
L'auscultation peut être particulièrement difficile en cas d'AC/FA ou de fréquence cardiaque rapide. La silhouette cardiaque de la sténose mitrale pure est typique ; à elle seule, elle résume toute la pathologie
Figure 1: Silhouette des chambres cardiaques dans la sténose mitrale
A : le VG est petit et l’OG est dilatée, les feuillets de la valve et l’appareil
sous-valvulaires sont épaissis et rétractés.
B : la stase d’amont a induit une hypertension pulmonaire postcapillaire qui est
responsable d’une dilatation du VD ; une insuffisance tricuspidienne (IT) secondaire est presque toujours présente. Le septum interventriculaire bombe dans le VG (flèche) et en diminue encore le remplissage diastolique. Ce déplacement du septum survient à un moindre degré en l’absence d’hypertension pulmonaire, parce que le remplissage du VG est plus rapide que celui du VD. En cas d’insuffisance mitrale ou aortique associée, le VG conserve une taille plus proche de la norme, voire subit une certaine dilatation.
Signes électrocardiographiques :
L'ECG peut rester normal ou présenter des modifications telles une hypertrophie auriculaire gauche (onde P large > 0.12 s, bifide en D2, diphasique à négativité terminale en V1), une hypertrophie ventriculaire droite avec déviation axiale droite du QRS, aspect S1 Q3, grande onde R V1, bloc incomplet droit.
En cours d'évolution, le passage en AC/FA intervient fréquemment, précédé par des extrasystoles auriculaires ou des accès d'AC/FA paroxystiques.
Signes radiologiques :
Classiquement Le bilan radiologique du RM comporte quatre incidences thoraciques : face, oblique antérieure droite et gauche, profil gauche.
Ce schéma peut être complété par l'opacification barytée de l'œsophage, montrant en OAD un refoulement de la colonne barytée œsophagienne par l'oreillette gauche dilatée et éventuellement une saillie à convexité antérieure correspondant à la dilatation de l'infundibulum pulmonaire.
En profil gauche, le comblement de l’espace clair rétro-sternal traduit l'hypertrophie-dilatation des cavités droites.
L'examen radioscopique permet d'apprécier la cinétique cardiaque et de rechercher les calcifications valvulaires mitrales. En pratique, seule l'incidence face et profil gauche sont réalisées.
La silhouette cardiaque a un aspect triangulaire avec à gauche, arc supérieur normal, arc moyen rectiligne ou saillant (tronc pulmonaire élargi, auricule gauche dilatée), arc inférieur normal.
A droite, l'arc inférieur est modifié avec apparition d'un double contour traduisant l'hypertrophie auriculaire gauche s'inscrivant en dedans ou en dehors du bord droit de l’oreillette droite.
Les artères pulmonaires sont élargies, avec opacités floues dans les régions péri-hilaires, aspect réticulo ou micronodulaire aux bases réalisant l'aspect de poumon mitral (exsudation alvéolaire), redistribution vasculaire pulmonaire plus riche vers les sommets, des lignes de KERLEY (opacités fines linéaires horizontales) rechercher au-dessus des culs-de-sac pleuraux, traduisant l'épaississement des septa inter-alvéolaires.
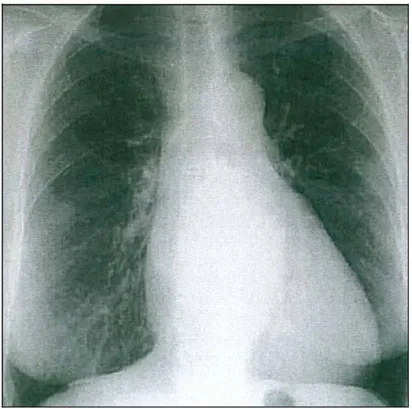
Figure 2 : Radiographie de thorax de face caractérisant le rétrécissement mitral. (Notez la
Signes écho cardiographiques :
A. Echocardiographie transthoracique : examen principal, permet Le Dg + (lésions anatomiques) et étiologique
L’évaluation de la gravité du RM, son retentissement, les lésions associées
Les critères anatomiques d’accessibilité à une DMPC La surveillance
1. Dg positif et étiologique : multiplier les incidences et les ≠ coupes [5-6]. Mode 2D : apprécier l’état anatomique du RM
En cas de RM Rhumatismal : [8]
Epaississement des feuillets valvulaires, parfois calcifiés - ouverture limitée (aspect diastolique en dôme).
GVM donnant un aspect en genou ; PVM généralement rétractée rigide. Fusion ou symphyse commissurale.
Remaniement de l’appareilsous valvulaire mitral associant :fusion, raccourcissement et rétraction des cordages.
Mode TM: Epaississement de la GVM : aspect en créneau pdt diastole. Doppler couleur : aspect en bec de bunsen au nv de l’extrémité de l’entonnoir mitral = zone de convergence hémisphérique.
Doppler pulsé : flux accéléré, élargissement de l’enveloppe spectrale, décroissance lente
Figure 3: Planimétrie de la surface d’ouverture d’une sténose mitrale serrée.
A : en vue bidimensionnelle court-axe Trans gastrique 0° ; la surface mesurée est de 0.976 cm2. B : en vue tridimensionnelle depuis le ventricule gauche. Comme la valve a une forme conique, il n’est jamais sûr que la coupe bidimensionnelle mesure effectivement l’endroit le plus étroit ; elle peut se trouver au milieu du cône et surestimer la dimension de la valve. L’imagerie 3D évite ce piège puisqu’elle reconstruit l’ensemble des feuillets et permet de faire la mesure à l’endroit exact qui est le plus étroit. La reconstruction 3D est actuellement considérée comme la mesure étalon de la surface d’ouverture de la valve lors de sténose mitrale.
2. Evaluation de la sévérité du RM :
Repose sur 2 paramètres : la SM et le gradient transmitral Mode 2D : la SM peut être évaluée par :
L’écart inter-valvaire : EE’<10mm en faveur d’un RM serré.
La planimétrie+++ : la méthode de référence. En PSPA + zoomcinéloop
Mesure en proto-diastole en balayant l’orifice mitral de l’apex à la base et en se plaçant au sommet de l’entonnoir mitral
Moyenner au moins 3 mesures si RRS, 5 mesures si FA
RM serré si SM <1,5 cm² (0,9--‐1cm²/m²), très serré si < 1cm²
Limites : opérateur, mauvaise échogénicité, calcifications importantes, FA rapide
Doppler continu :
Mesure du gradient moyen transmitral : RM serré si GMmoy> 10mmHg.
PHT : Pressure Half Time :
- temps de demi-pression est le temps correspondant à la ↓ de moitié du gradient auriculo-ventriculaire à partir de sa valeur max.
- la SM est obtenue par la formule de HATLE :SM=220/PHT. RM serré si PHT > 150 ms.
SM par :
- Équation de continuité (EC) : SM = π D²x ITVssAo/ ITVm
Limites de l’EC : FA, IA, IM, mesure du D de la chambre de chasse.
- Méthode de convergence : PISA
SM= 2π r² x Vax (α/180) / Vmax; Va= 20--‐30 cm/s Vmax= vitesse max antérograde mitrale en protodiastole ;
r= rayon de convergence
o Méthode assez complexe mais peut être utilisée si FA, rythme irrégulier, IM, IAo ou discordance entre les autres méthodes.
3. Apprécier le retentissement et les lésions associées :
L’OG, les cavités droites et la mesure de la PAPS sont des éléments important à considérer :
Un diamètre de l’OG > 50mm : TTT ATC même en l’absence d’ATCD de FA ou d’accident TE
Dilatation des cavités droites et IT fonctionnelle sont fréquemment associées
Une PAPS de repos >50mmHg : retentissement significatif : CMP ou chirurgie même si asymptomatique
Fonction VG
Valvulopathies associées : IM, IA, RA, IT, RT, IP, RP
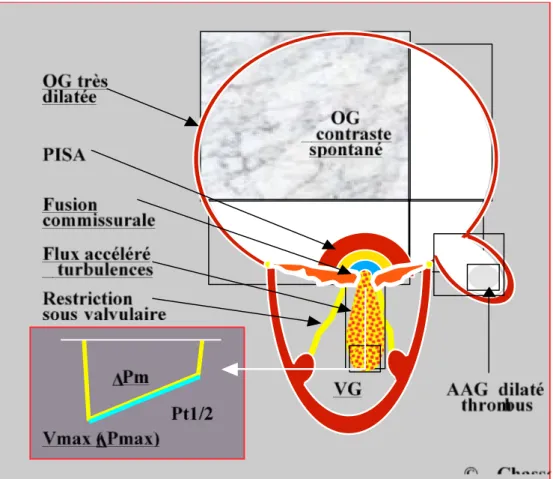
Figure 4: Résumé schématique des caractéristiques échocardiographiques de la sténose
La silhouette est caractéristique : immense OG avec contraste spontané, appendice auriculaire gauche (AAG) dilaté, abritant fréquemment un thrombus en cas de FA, petit VG, feuillets mitraux déformés et restrictifs avec fusion commissurale, appareils sous-valvulaire restrictif, épaissi et raccourci.
Au Doppler, zone d’accélération concentrique côté auriculaire (PISA) en diastole, flux transmitral accéléré (Vmax 2 m/s) et zone tourbillonnaire intraventriculaire, gradient moyen élevé (≥ 12 mmHg), temps de demi-pression (Pt1/2) > 250 ms.
4. Evaluer la compatibilité de l’anatomie avec une CMP : Score de Wilkins+++
Tableau 2 : Score de Wilkins
B. Echocardiographie Trans-Œsophagienne :
Indiquée avant la DMP ou Si mauvaise échogénicité
Intérêt : Bilan lésionnel précis ; élimination d’une CI à DMPC. L’anatomie valvulaire et l’app sous valvulaire
Présence de thrombus dans l’OG au niveau de l’auricule gauche Fonction de l’auricule gauche : vitesse de vidange et de remplissage
Si IM associée : quantification + mécanisme Morphologie et cinétique du SIA.
C. Echo d’effort
Si discordance entre les symptômes et la sévérité du RM ++
Soit RM serré asymptomatique +++
Permet d’apprécier de façon objective la symptomatologie fonctionnelle et le niveau d’effort obtenu pour l’apparition des symptômes
Si ↑ G moy>15mmHg ou ↑ PAPS >60mmHg RM serré
D. Echo 3D /ETO 3D : intéressante pour l’étude morphologique du RM
Renseignements qualitatifs importants pour la prédiction des résultats de la valvuloplastie
Mesure de la surface par planimétrie avec une meilleure résolution spatiale
Une fois la sévérité du RM établie, il faut répondre à1 question : L’anatomie est-elle compatible avec une CMP ?
La compatibilité de la CMP repose sur l’appréciation de l’anatomie valvulaire selon ≠ scores :
Score de Wilkins+++ :
le + connu, 4 paramètres cotés de 1 à 4 par gravité croissante.
Mobilité valvulaire, appareil sous valvulaire, épaississement valvulaire, calcifications
Score de Cormier : moins utilisé mais + simple, 3classes
Tableau 3 : Score de cormier
e) Complications du rétrécissement mitral: 1/Insuffisance cardiaque droite : cpc tardive 2/Troubles du rythme auriculaires :
ESA, flutter (rares) FA fréquente :
Conséquences HD : ↓ la tolérance fonctionnelle / ↑ Le risque TE 3/Accidents emboliques systémiques
Révélateurs d’un RM dans 20% des cas par migration d’un thrombus
Localisation cérébrale (AVC/ AIT) : 60 % ; Autres localisations : ischémie aigüe des MI, mésentérique, rénale, coronaire, rétinienne…
Embolie pulmonaire paradoxale par FOP
4/Endocardite infectieuse : très rare dans le RM isolé. 5/Complications pulmonaires : Poumon mitral :
Hémosidérose avec hémoptysies et un risque de surinfections bronchiques à répétition et infarctus pulmonaire.
f) Traitement du rétrécissement mitral: A. Buts :
Améliorer les symptômes.
Eviter la mortalité et les complications dues au RM. B. Moyens :
1. TTT symptomatique :
MHD : Régime hyposodé + réduire les efforts
La prévention d’osler.
Diurétiques améliorent transitoirement la dyspnée en ↓ la P°capillairepulmonaire
BB – et IC bradycardisants : allongent le tps de remplissage et améliorent les symptômes
Les digitaliques : ralentissent la FA, en plus des BB
Traitement anticoagulant est indispensable si : FA paroxystique ou permanente
Rythme régulier sinusal avec :
thrombus /ATCD d’accident embolique / contraste spontané intra OG important
OG>50mm et volume OG >60ml/m² 2. TTT curatif
a. La commissurotomie mitrale percutanée = dilatation mitrale
A l’heure actuelle, la dilatation percutanée par ballonnet constitue l’intérêt principal de l’étude du RM dont elle a radicalement transformé le traitement.
En 1984, le japonais kanji INOUE 28 a été le premier à avoir utilisé la dilatation par ballon. Les bons résultats obtenus à court et moyen termes ont conduit à la diffusion mondiale de cette technique et en ont fait la seconde, en importance, dans le domaine de cardiologie interventionnelle.
Mécanismes d’action :
Différents travaux anatomiques, échographiques et radiologiques ont montré que la dilatation par ballonnet agit comme la commissurotomie chirurgicale en ouvrant les commissures symphysées et, aussi dans une moindre mesure, en fracturant certains dépôts calcaires dans les formes calcifiées.
Techniques :Différentes techniques ont été proposées. Voie d’abord :
La voie d’abord la plus utilisée est la voie trans-veineuse antérograde combinée au cathétérisme trans-septal qui donne accès à l’oreillette gauche, à partir de l’oreillette droite par ponction de septum inter auriculaire. Elle permet, après dilatation du septum d’amener le ballon dans l’orifice mitral par voie trans-veineuse antérograde.
La voie artérielle rétrograde combinée ou non au cathétérisme trans-septal, est plus compliquée et moins répandue. Elle réduit les risques de shunt inter auriculaire, mais majore celui des complications artérielles.
Type de ballons :
Les ballons utilisés sont de plusieurs types, mais les principaux sont le double ballon et le ballon D’INOUE (figure 5).
Figure 5: Ballon d’INOUE et ses accessoires
Le ballon d’INOUE est d’un usage de plus en plus répandu. Il comporte trois parties distinctes, d’élasticité différente, qui se gonflent de façon séquentielle. Sa conception originale facilite son positionnement et permet des dilatations progressives. La surface effective du ballon
La comparaison entre la technique du double ballon et celle d’INOUE a donné lieu à des études rétrospectives, mais très peu d’études prospectives. Il n’y a pas de différence significative d’efficacité entre les deux méthodes, malgré une tendance à l’obtention de surface légèrement supérieure avec le double ballon. Leurs résultats à distance son équivalents.
Le risque de perforation ventriculaire est plus faible avec le ballon d’Inoué. En effet, il ne nécessite pas la mise en place d’un guide dans leventricule.
De même, le risque de fuite mitrale iatrogène est également diminué à condition de procéder à des dilatations progressives.
D’autres techniques ont été proposées. Il s’agit du double ballon sur guide unique et de la commissurotomie à lames métalliques.
Le choix de la taille du ballon est très important. Il doit concilier deux impératifs contradictoires, c’est-à-dire l’obtention d’une ouverture large de la sténose, ce qui incite à augmenter la taille du ballon au prix d’un risque faible d’insuffisance mitrale traumatique.
Le choix de la taille du ballon dépend de la taille et de la surface corporelle du patient, et du diamètre de l’anneau mitral.
Déroulement et contrôle de la procédure :
Les données hémodynamiques ou échographiques permettent d’apprécier les résultats de la dilatation au cours de la procédure.
Les données hémodynamiques permettent d’apprécier les résultats de la dilatation au cours de la procédure.
La surveillance des dilatations progressives avec le ballon d’INOUE, la détection précoce des complications et l’appréciation du degré d’ouverture commissurale et de la surface orificielle sont suivies par l’échographie.
Les critères d’arrêt de la procédure reposent, entre autres, sur une surface supérieure à 1,5 cm2/m2 de surface corporelle, sur l’ouverture totale d’au moins une commissure et sur l’apparition ou la majoration de la régurgitation mitrale.L’avantage du Doppler couleur est de permettre l’estimation de la régurgitation et du shunt inter auriculaire résiduel.
Résultats immédiats :
Caractéristiques hémodynamiques :
Le gain de surface passe du simple (avant commissurotomie mitrale percutanée) au double (après) selon la littérature.
La pression auriculaire gauche et le gradient transmitral diminuent alors que le débit cardiaque augmente légèrement.
En général, les pressions et les résistances artérielles diminuent rapidement. L’aptitude à l’effort est améliorée après dilatation.
Dans certains cas, la réussite de la dilatation peut être limitée par la persistance d’anomalies de compliance pariétale du ventricule gauche.
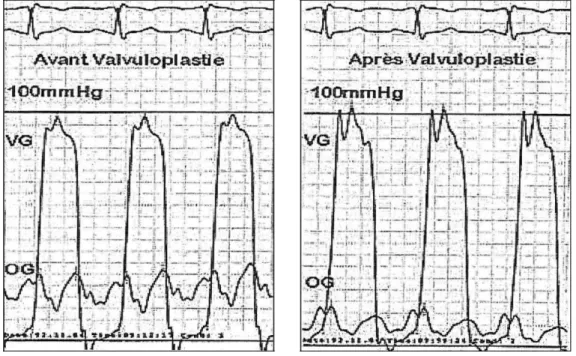
Figure 7 : Mesure hémodynamique du gradient mitral(en haut : ECG en bas : Gradient
Complications :
Les échecs varient, dans l’ensemble, de 1 à 17%. Facteurs prédictifs :
L’état anatomique de l’appareil valvulaire et sous valvulaire apprécié par le score échographique (les patients ayant un score final inférieur ou égal à 8 sont les meilleurs candidats à la dilatation mitrale percutanée), a été initialement considéré comme principal facteur prédictif.
Les principaux facteurs de risque de mauvais résultat immédiat sont : une anatomie valvulaire défavorable, un âge avancé, une sténose mitrale très serrée <1 cm2. L’antécédent de commissurotomie chirurgicale n’est un facteur prédictif de mauvais résultat que chez les patients de plus de 50 ans et surtout de 70 ans.
Les facteurs associés à détérioration tardive sont un âge avancé, une anatomie défavorable, ainsi que des variables témoignant du caractère évolué de la cardiopathie, c’est-à-dire une classe fonctionnelle NYHA III ou IV, et la présence d’une fibrillation auriculaire avant la CMP. Le résultat à long terme est d’autant meilleur que la surface poste CMP est élevée et que le gradient moyen est faible.
Il est donc nécessaire de prendre en compte l’ensemble des caractéristiques cliniques et para cliniques des patients dans la discussion de la technique la plus appropriée pour traiter un rétrécissement mitral.
La caractérisation de ces facteurs a nécessité l’élaboration des modèles prédictifs. Toutefois, il semble difficile de prévoir de manière fiable les mauvais résultats comme l’apparition d’une insuffisance mitrale.
Indications de la dilatation percutanée :
La commissurotomie mitrale percutanée semble s’imposer pour le rétrécissement mitral pur, serré, à valves souples et appareil sous valvulaire non ou peu remanié, non associé à une thrombose intra auriculaire gauche, et même en présence d’une insuffisance mitrale ( ≤ à grade II), et en cas de contre-indication formelle à la chirurgie.
La possibilité d’obtenir des résultats excellents par la commissurotomie mitrale percutanée incite à commencer par elle, quitte à recourir, éventuellement, à la chirurgie en cas d’échec.
Complications Contre-indications - IM sévère - Hémopéricarde - CIA persistante - Resténose mitrale à distance - Embolie systémique - Décès. - Thrombus de l’OG
- IM plus que modérée (>2/4) - Calcifications importantes
- Absence de fusion commissurale
- Valvulopathie Aortique sévère ou maladie tricuspide sévère.
- Coronaropathie concomitante
chirurgicale
Tableau 4 : complications et contre-indications de la DMP
b. La chirurgie : Chirurgie conservatrice :
o CMCF : a disparu, L’abord se fait, le plus souvent, par voie gauche par thoracotomie antérolatérale ou latérale, l’introduction de l’index à travers l’auricule gauche à cœur battant permet, dans un premier temps, d’explorer l’appareil mitral puis de pratiquer la commissurotomie. o CMCO : * rarement utilisées, elle permet une correction plus complète
des lésions : ouverture large des commissures et si besoin exérèse de nodules calcaires, réfection des piliers pour redonner de la mobilité aux valves.
Le RVM :
-Mortalité opératoire 3à 10%
-Indiqué si lésions anatomiques sévères, calcifications, CI ou échec de commissurotomie percutanée ou chirurgicale.
-Par prothèse mécanique : Nécessité d’une anticoagulation orale à vie avec un INR cible en fonction des facteurs de risque du patient et de la thrombogénicité de la prothèse
-Par bioprothèse (hétérogreffe) :
o Indications : Si>70ans, ♀ désireuse de grossesse, contre-indication formelle aux ATC
o Durée de vie moins longue,
o ATC orale pendant les 3premiers mois Caractéristiques anatomiques défavorables : o Score de Wilkins>8, score de Cormier à3 o RM très serré,
o IT sévère
o Calcifications mitrales quelques soit leur importance o Caractéristiques cliniques défavorables :
-Age ↑
-ATCD de commissurotomie -NYHA IV
C. Indications :
Tableau 5 : Indications de DMP en cas de RM avec SM ≤1.5cm2
B) Modifications physiologiques au cours de la grossesse
a) Pendant la grossesseGlobalement il y a une augmentation du travail cardiaque.
La caractéristique essentielle de l’adaptation cardiovasculaire de la femme enceinte est l’installation d’une vasodilatation artérielle très précoce qui pourrait expliquer l’augmentation du débit cardiaque et précéderait l’activation du système rénine-angiotensine-aldostérone.
L’autre caractéristique est l’hypervolémie qui est l’expression de la rétention hydrosodée due aux œstrogènes et de l’augmentation de la sécrétion d’aldostérone. Il en résulte une augmentation du volume plasmatique.
La volémie diminue progressivement pendant les 3 premiers jours du post-partum et le retour à la normale se fait en 4 à 6 semaines.
Les œstrogènes augmentent la fréquence et le débit cardiaque ainsi que les débits circulatoires et la contractilité du myocarde.
En parallèle, la progestérone permet l’adaptation vasculaire à cette hypervolémie par un relâchement des parois veineuses et des sphincters capillaires en augmentant la capacité du lit vasculaire.
Le débit cardiaque croît de 30 à 50 % environ. Il dépend de 2 facteurs : La fréquence cardiaque qui augmente de 15 % (15 à 20 bpm à terme),
Le volume d’éjection systolique qui augmente de 30 % (+ 10 à 15 ml).
Figure 9 : Variation du débit cardiaque pendant la grossesse (0-40 :semaines d’aménorrhée ; PP : post-partum).
Figure 10 : Variation du volume d'éjection pendant la grossesse (0-40 : semaines
d’aménorrhée ; PP : post-partum).
Il dépend de la position maternelle. Dès la 24ème SA, en décubitus dorsal, une compression de la veine cave inférieure par l’utérus gravide peut réduire le retour veineux et de ce fait, le volume d’éjection systolique entrainant une hypotension maternelle, une diminution de la perfusion utéro-placentaire, qui à son tour peut entraîner et un ralentissement du rythme cardiaque fœtal [11].
Il est plus élevé en décubitus latéral gauche car la veine cave est moins compressée par l’utérus qui est en dextro-rotation.
Figure 12 : Compression de la veine cave inférieure et sa prévention par le décubitus latéral
Figure 13: Effet de la position sur le débit cardiaque, chez la femme enceinte
Lat G : décubitus latéral gauche ; Lat D : décubitus latéral droit ; DD : décubitus dorsal ; Ass : assis ; Deb : debout ; GP : genu-pectoral.
La pression artérielle est fonction du débit cardiaque et des résistances périphériques. En dépit de l’augmentation du débit cardiaque, la pression artérielle baisse d’environ 20 à 30 % de façon proportionnelle à la baisse des résistances périphériques de 7 SA jusqu’à environ 24-28 SA.
Puis, le shunt artério-veineux créé par l’unité fœto-placentaire et les effets vasomoteurs des hormones entraînent une augmentation des résistances périphériques et donc une remontée de la pression artérielle qui revient en fin de grossesse à un niveau égal à celui d’avant la grossesse.
Lapression veineuse reste inchangée aux membres supérieurs ; par contre, elle augmente beaucoup aux membres inférieurs. Ceci est dû à la compression des gros vaisseaux et de la veine cave inférieure par l’utérus gravide, particulièrement en décubitus dorsal.
Cette augmentation de pression favorise l’apparition d’œdèmes et de varices.
L’irrigation périphérique augmente essentiellement aux niveaux rénal, pulmonaire et cutané. Le flux sanguin double au niveau des seins. Il est également très important au niveau des mains (x 6). [12]
Tous ces phénomènes adaptatifs modifient l’examen clinique et paraclinique :
La fréquence cardiaque est augmentée de 10 à 15 bpm ;
L’auscultation cardiaque est modifiée avec une augmentation de B1, un dédoublement de B2 et l’apparition d’un B3 par augmentation du débit sanguin auriculo-ventriculaire chez 80 à 90 % des femmes enceintes à partir de 20 SA ;
Le changement de position du cœur entraîne une déviation gauche de l’axe QRS à l’ECG ;
A la radiographie pulmonaire (indication à discuter ++ du fait du risque d’irradiation fœtale), la silhouette du cœur est augmentée non pas du fait d’une cardiomégalie mais du fait de l’horizontalisation du cœur due à la surélévation des coupoles diaphragmatiques. Le cœur est refoulé vers le haut et il effectue une rotation en avant sur son axe transversal ; A l’échographie cardiaque, dès 12 SA, on retrouve une hypertrophie du
ventricule gauche qui peut atteindre 50 % à terme. L’hypertrophie auriculaire droite et gauche est très nette à 30 SA ;
Une insuffisance tricuspidienne et pulmonaire adaptative est retrouvée chez 94 % des femmes à terme et ainsi qu’une insuffisance mitrale dans 25 % des cas.
b) Pendant l’accouchement
La première phase du travail s’accompagne d’une élévation de 15% du débit cardiaque.
Pendant la deuxième phase, le débit cardiaque augmente en moyenne de 50% à la fois par autotransfusion (300 à 500 ml reversés dans la circulation à chaque contraction) et par stimulation sympathique (douleur et anxiété) [3].
c) Post Partum
Le Débit cardiaque augmente également de manière brutale immédiatement après la délivrance par élévation du retour veineux, secondaire au phénomène d’autotransfusion et à la décompression de la veine cave inférieure.
d) Physiopathologie du RMau cours de la grossesse
Le rétrécissement mitral s’accompagne d’un gradient de pression OG – VG qui dépend de la sévérité de la sténose et du volume sanguin.Ainsi les modifications physiologiques observées au cours de la grossesse à savoir l’augmentation du volume sanguin et de la fréquence cardiaque entrainent automatiquement une augmentation du gradient de pression OG – VG (et une altération du remplissage diastolique) dans le RM.
Cette élévation du gradient transmitral s’accompagne d’une augmentation de la pression de l’OG et donc de la pression veineuse pulmonaire expliquant les symptômes.
Comme nous l’avons dit précédemment, l’augmentation du DC est maximale à la fin du 2ème trimestre expliquant une majoration des symptômes à cette période.
Les symptômes les plus fréquents sont la dyspnée, l’intolérance à l’exercice, l’orthopnée et la dyspnée paroxystique [5]. Les formes sévères s’accompagnent d’OAP et parfois de signes d’insuffisance cardiaque droite (secondaire à la surcharge ventriculaire droite par élévation des pressions artérielles pulmonaires). La fréquence de l'OAP est d'environ 40% des cas dans la sténose modérée (S = 1.5 cm2) et de 60% dans la sténose sévère (S<1.0cm2) ; le taux de FA est respectivement de 15% et 30% [6].
L’accouchement et le post partum immédiat constituent la période la plus à risque de complications ( FC + brutale du retour veineux) justifiant une surveillance armée et une prise en charge adéquate.
Certains facteurs aggravants doivent être systématiquement recherchés et traités : L’anémie et la fièvre, l’arythmie qui peut précipiter vers l’OAP, qui favorise la formation de thrombus et augmente le risque d’embolie périphérique (en particulier cérébrale) [6].
II/ MATERIEL ET METHODES
A) Patientes
Au service de cardiologie A du CHU IBN SINA de Rabat, 4790 dilatations mitrales percutanées ont été réalisées de 1986 à 2018.
Notre étude rétrospective porte sur 246 dilatations mitrales effectuées pendant la grossesse de 1998 à 2018.
B) Critères d’inclusion
Femmes enceintes ayant un RM serré Symptomatiques sous traitement médical Après la 20ème semaine d’aménorrhée
C) Critères d’exclusion
Insuffisance mitrale grade III ou IV Volumineux thrombus de l’OG
D) Modalités d’analyse
Caractéristiques des patients : Age
Age gestationnel Données cliniques :
Découverte du RM pendant la grossesse Classe fonctionnelle de la NYHA
Présence de signes d’OAP
ECG : Rythme sinusal ou en FA Données échocardiographies.
ETT : avant la dilatation, en per procédure au besoin et 24h après le geste
Appréciation de l’anatomie valvaire avec calcul du score de Wilkins Mesure de la surface mitrale par planimétrie
Mesure du gradient transmitral moyen (doppler continu en 4 cavités) Recherche et quantification d’une fuite mitrale associée
Mesure de la taille de l’OG (diamètre antéropostérieur en PSGA) Evaluation de la PAPS sur le flux de l’IT
ETO : systématiquement avant la procédure pour éliminer un thrombus de l’OG
Données hémodynamiques Pression moyenne de l’OG Pression aortique
Pression télé diastolique du VG (quand c’est possible)
E) Description de la procédure
Les patientes sont hospitalisées 24 heures avant la dilatation et doivent être à jeun le jour du geste
Le TP doit être supérieur à 40% et l’INR inférieur à 2
Le cathétérisme est réalisé sous anesthésie locale par ponction percutanée de la veine et de l’artère fémorales droites
Une sonde pigtail est placée au niveau de l’aorte ascendante pour repérer le point de ponction transeptale. L’abord artériel permet également la surveillance de la pression artérielle sanglante durant la procédure
La veine fémorale droite est la voie principale permettant la ponction transeptale
La procédure est parfois réalisée en décubitus latéral gauche surtout en fin de grossesse (pour décomprimer la veine inférieure)
Chez la femme enceinte, pour diminuer l’irradiation fœtale on place systématiquement un tablier plombé sur l’abdomen de la patiente et on limite la scopie (en l’utilisant uniquement pendant la transeptale et les inflations du ballon), la graphie étant proscrite.
Après avoir placé le ballon dans l’orifice mitral, on effectue des inflations progressives de mm en mm à basse pression jusqu’à ouverture angiographique de l’une ou des 2 commissures
La procédure est interrompue dès qu’un résultat satisfaisant est obtenu : o Ouverture commissurale angiographique
o Baisse de la POG
Un contrôle échographique est souvent réalisé per procédure pour vérifier l’ouverture commissurale et guetter l’apparition ou l’aggravation d’une fuite mitrale
A noter que chez la femme enceinte un résultat sous optimal peut être accepté, le but de la dilatation étant une amélioration hémodynamique permettant la poursuite de la grossesse et l’accouchement dans de bonnes conditions en évitant les complications.
F) Etude statistique
III/
RESULTATS
A) Caractéristiques des patientes :
Age moyen : 28 ± 5,2 ans Age gestationnel moyen : 28,1 ± 4 semaines d’aménorrhée Découverte du RM pendant la grossesse : 40 % des patientes Critères cliniques : classe de la NYHA
Classe II : 6 % Classe III : 70 % Classe IV : 24 %
6 patientes en OAP réfractaire au traitement médical
Figure 15 : Classe de la NYHA avant DMP
I II
III
Critères électriques Rythme sinusal : 85 % ACFA : 15 %
Critères échographiques
Score de Wilkins : compris entre 6 et 11 Score à 8 : 1/3 des patientes
Score à 9 : 1/2 des cas Surface mitrale
SM = 0,8 cm² en moyenne 84 % : ≤ 1 cm²
17 % des cas : RM très serré (SM ≤ 0, 6 cm²) Gradient transmitral moyen : 21,4 mmHg Diamètre de l’OG ≥50 mm : 65 % des cas Pression artérielle pulmonaire systolique :
PAPS = 71 mmHg en moyenne 78 % patientes : PAPS > 50 mmHg
19 % en HTP majeure (PAPS > 100 mmHg)
B) Procédure
Durée moyenne de la procédure : 57,3 ± 9 minutes (intervalles de 30 à 75 minutes).
C) Résultats immédiats de la DMP
Taux de succès : 98 % Cliniques
95 % des patientes étaient en classe I ou II de la NYHA
Figure 16 : Classe de la NYHA avant et après DMP
Echographiques et hémodynamiques
Avant DMP Après DMP
SM (cm²) 0,8 [0,7 – 1] 2 [1,8 – 2,3] < 0,001
GMMoy (mmHg) 21 [17 – 25] 7 [4 – 8] < 0,001
PAPS (mmHg) 71 [58 – 91] 40 [30 – 46] < 0,001
Complications (1,8 %)
Mortalité maternelle : 2 patientes (0,9 %) AVCI grave
IM sévère : 1 patiente (0,4 %) Césarienne puis remplacement valvulaire mitral en post partum.
1 tamponnade : (0,4%) ponction péricardique
D) Traitement médical
Avant la DMP Après la DMP B bloquants 85 % 95 % Diurétiques 100 % 55 % Digitaliques 27 % 24 % Anticoagulants 43 % 20 %Tableau 7 : Résultats échographiques et hémodynamiques de la DMP
E) Accouchement et devenir des bébés
Accouchement Voie basse : 85 %
Césarienne : 15 % (principalement pour cause obstétricale). Morbimortalité fœtale
Mortalité fœtale : 1 % Prématurité : 5 % Hypotrophie : 6 %
IV/
DISCUSSION
A) Prise en charge du RM pendant la grossesse
a) SCHEMA GLOBAL DE PRISE EN CHARGE Traitement pharmacologique : toujoursIl vise principalement la baisse de la fréquence cardiaque et la diminution de la pression de l’OG.
Pour se faire, il est d’abord conseillé aux femmes enceintes avec sténose mitrale de restreindre leur activité physique et d’adopter un régime pauvre en sel [12].
Les bloquants
C’est le traitement de choix et de première intention.
Ils réduisent la fréquence cardiaque et améliorent le remplissage ventriculaire gauche. Pendant la grossesse, l’augmentation de l’activité sympathique conduit à utiliser des doses plus élevées de bétabloquants pour obtenir une réduction significative de la FC [13].
L’usage des bétabloquants avec sélectivité B1 est privilégié : le métoprolol est donc préféré à l’aténolol (celui-ci induisant plus souvent un retard de croissance intra utérin [17].
Dans notre expérience le propranolol est le bétabloquant le plus utilisé avec l’efficacité escomptée et une excellente tolérance (90 % de nos patientes)
Les diurétiques
Ils sont indiqués pour diminuer la congestion pulmonaire et systémique. Ils doivent être prescrits à dose minimale efficace pour éviter l’hypovolémie et la réduction de la perfusion utéro placentaire [12].
Le furosémide, bien toléré pendant la grossesse est le diurétique le plus utilisé [12].
La digoxine
La grossesse est un terrain favorisant le développement d’arythmies par l’action des hormones gestationnelles et la sensibilité accrue aux catécholamines [13].
La digoxine est parfois utilisée (en association avec les bétabloquants) pour un meilleur contrôle de la fréquence cardiaque (27% de nos patients).
Les anticoagulants
Les agents anti-vitamine K (AVK) passent la barrière placentaire et sont tératogènes pendant le premier trimestre ; ils sont donc contre-indiqués en début de grossesse (taux d’embryopathie : 6%). Pendant les deuxième et troisième trimestres, ils sont associés à des abortus de manière proportionnelle au dosage nécessaire à obtenir l'INR désiré. En cas d'accouchement par voie basse, il existe un risque prononcé d'hémorragie cérébrale chez le nouveau-né.
Il est donc préférable d'y renoncer globalement. Toutefois, il est possible de continuer l'AVK jusqu'à la 36ème semaine si la dose nécessaire à maintenir l'INR recherché reste basse (acénocoumarol < 2 mg, phenprocoumone< 3 mg, warfarine< 5 mg). L'accouchement par voie basse est contreindiqué sous AVK à cause du risque d'hémorragie intracrânienne chez le nouveau-né .Alors qu'elle renverse l'effet des AVK chez la mère, la vitamine K n'a pas d'action prouvée chez le fœtus.
Les héparines ne passent pas la barrière placentaire et ne sont associées à aucune pathologie fœtale. Un régime thérapeutique d'héparine à bas poids moléculaire (HBPM) est le traitement recommandé chez la femme enceinte, en visant un taux d'activité anti-Xa de 0.8-1.2 UI/mL au pic d'activité et ≥ 0.5 d’UI/mL au nadir (dosage en fonction du poids corporel). Un test de coagulation est pratiqué une fois par semaine. L'héparine non-fractionnée (HNF) impose une perfusion continue et n'est pas plus efficace.
Il est systématiquement indiqué chez les patientes en ACFA ou avec des antécédents de complications thromboemboliques [13].
Etant donné l’état d’hypercoagulabilité lié à la grossesse et la fréquence des passages en FA, un traitement anticoagulant prophylactique peut être indiqué chez les patientes avec sténose mitrale serrée et OG dilatée (même en rythme sinusal) [14].
Ainsi dans notre série, seules 15% de nos patientes étaient en ACFA alors que près de la moitié (43%) était sous anticoagulants.
Anti-arythmiques :
Adénosine (Krénosin®), procaïnamide (Pronestyl®), flécaïnide (Tambocor®), lidocaïne ne sont pas tératogènes. Amiodarone (Cordarone®) : peut induire un hypothyroïdisme néonatal, une dysfonction rénale et différentes anomalies neurologiques ; elle n'est utilisable qu'en cas d'arythmie réfractaire aux autres thérapies ou en réanimation. Disopyramide (Isorythm®, Rythmodan®) : peut causer des contractions utérines.
Agents inotropes :
Les catécholamines provoquent une tachycardie chez le fœtus ; leur effet alpha, dont seule la dobutamine est dépourvue, provoque une vasoconstriction utéro-placentaire et diminue le débit sanguin pour le fœtus. Le levosimendan (Simdax®) est une option efficace et sans risque pour la grossesse.
B) Dilatation mitrale percutanée : souvent
Elle est indiquée chez les patientes symptomatiques (stade III – IV de la NYHA) ou en hypertension pulmonaire importante (Indication de classe IIaC) [15-16].
Nous reviendrons plus en détail sur :
Ses résultats à court et à long terme L’élargissement de ses indications. Place de la chirurgie ?
La supériorité de la DMP comparée à la chirurgie, en terme de sécurité et de pronostic materno fœtal est aujourd’hui largement démontrée (cf tableau 4) [17].
Mortalité maternelle Mortalité fœtale
CMP 0% 0 – 4%
CCF 3% 0 – 12%
CCO 5% 15 - 33%
RVM 9% 29%
Tableau 8 : Comparaison du pronostic maternel entre DMP et chirurgie
Les indications de la chirurgie dans la sténose mitrale pendant la grossesse sont devenues exceptionnelles.
La chirurgie est indiquée uniquement chez les patientes en insuffisance cardiaque réfractaire (avec des contres indications absolues à la dilatation mitrale : IM importante, thrombose massive de l’OG).
C) Dilatation mitrale percutanee et grossesse
a) A quel moment ?La dilatation mitrale chez la femme enceinte doit être réalisée, quant elle est indiquée à partir du 2ème trimestre de grossesse (une fois l’organogénèse terminée) [16].