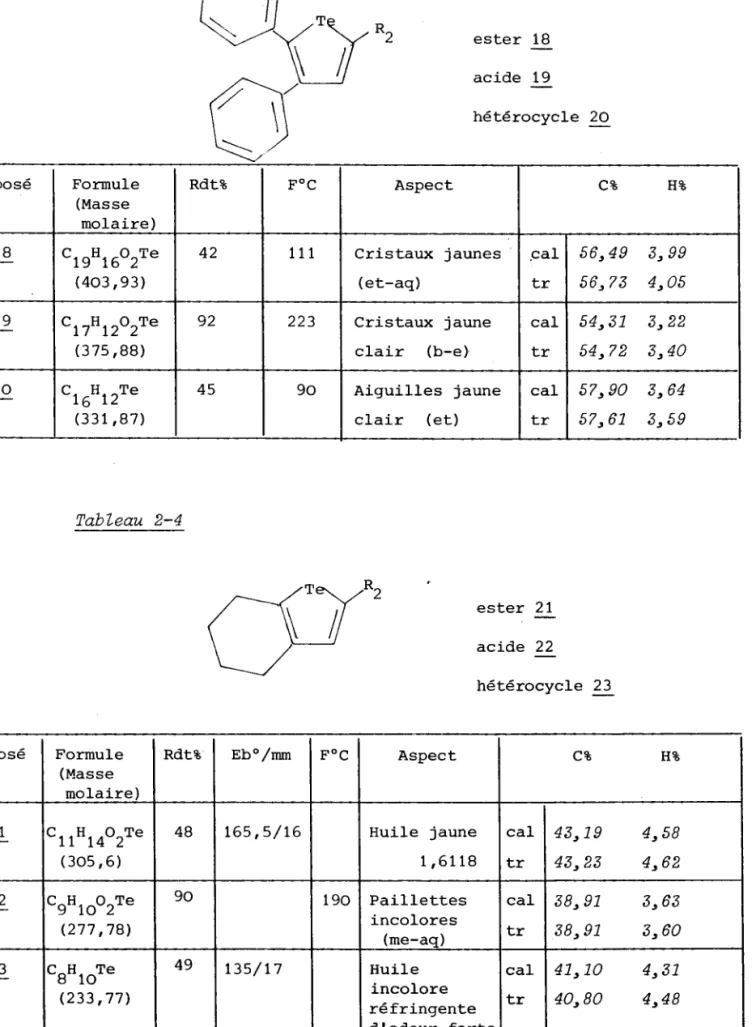
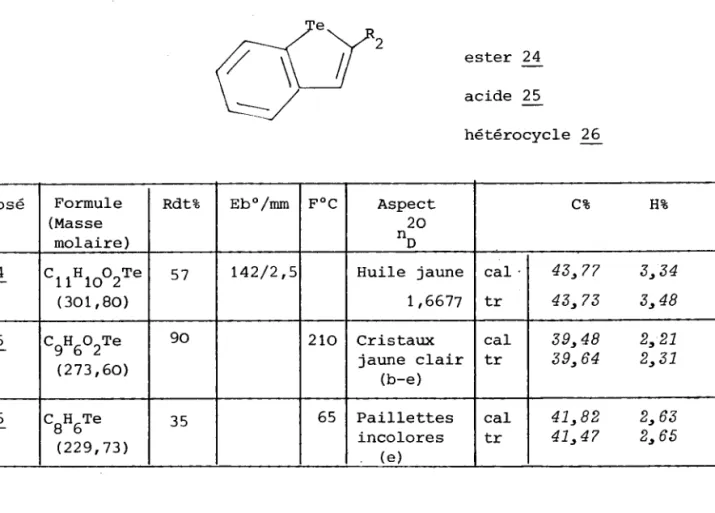
HAL Id: tel-01775586
https://hal.univ-lorraine.fr/tel-01775586
Submitted on 24 Apr 2018
HAL is a multi-disciplinary open access
archive for the deposit and dissemination of
sci-entific research documents, whether they are
pub-lished or not. The documents may come from
teaching and research institutions in France or
abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est
destinée au dépôt et à la diffusion de documents
scientifiques de niveau recherche, publiés ou non,
émanant des établissements d’enseignement et de
recherche français ou étrangers, des laboratoires
publics ou privés.
Roger Close
To cite this version:
Roger Close. Contribution à l’étude des hétérocycles tellurés. Chimie organique. Université Paul
Verlaine - Metz, 1977. Français. �NNT : 1977METZ001S�. �tel-01775586�
AVERTISSEMENT
Ce document est le fruit d'un long travail approuvé par le jury de
soutenance et mis à disposition de l'ensemble de la
communauté universitaire élargie.
Il est soumis à la propriété intellectuelle de l'auteur. Ceci
implique une obligation de citation et de référencement lors de
l’utilisation de ce document.
D'autre part, toute contrefaçon, plagiat, reproduction illicite
encourt une poursuite pénale.
Contact : ddoc-theses-contact@univ-lorraine.fr
LIENS
Code de la Propriété Intellectuelle. articles L 122. 4
Code de la Propriété Intellectuelle. articles L 335.2- L 335.10
http://www.cfcopies.com/V2/leg/leg_droi.php
-
frfr-/ frfr-/
THÈSE
présentée
A L'U.E.R.
"SCIENCES
EXACTES
ET NATURELLES'
DE L'UNIVERSITÊ
DE METZ
pour obtenir le grade de
DocrEUR DE spÉclnLltÉ 0ll= cyclE)
Mention Chimie Organique
par
Roger CTOSE
Maître ès-Sciences
Diplomé
Chimiste
de l'Université
de Dtjon
Contribution
à l'Êtude
des Hétérocycles
Tellures
Soutenue
le 24 mars 1977 devant la commission
d'examen
Présidente:
Mme D. CAGNIANT,
professeur
Examinateurs:
M. P. FALLER,
Maltre de Çonférences
M. Y. MOLLIER,
p rofesseur
: ,
M. M. RENSON,
professeur
477+oo4
S
P r é s i d e n t : M . F E R R A R I P i e r r e U . E . R . . . S C I E N C E S E X A C T E S E T N A T U R E L L E S ' ' D i r e c t e u r : I ! . R H I N G e o r q e s PROFESSEURS M. LONCHAMP M. BARO I,Tne CAGNIANT M. LERAY M. BLOCH IvT. KLEIM M. CHARLIER M. TAVARD M. WENDLING T4. BAUDELET J e a n - P i e r r e Ralzmond D e n i s e Joseph J e a n - M i c h e l RoIand Alphonse Claude Edgar Bernard T . T . P . T . T . T . P . P . S . C . T . P . S . C . P . S . C . p q r . P . S . C . D e r . Physique Mécanique Physique Chimie l4athématiques Mathématiques Mathématiques Mathématiques Physique Physique Mathématiques Physique Physique Chimie Physique C h i m i e Physique Physique Physique Chimie Physique MAITRES DE CONFERENCES M . C E R T T E R M . W E B E R I\4. CARABATOS M. FALLER M . R H I N Mme SEC M. DAX M . S C H M I T T M. PLUVINAGE M. HEIZMANN M. ROUX M i c h e l J e a n - D a n i e l C o n s t a n t i n P i e r r e Georges A n t o i n e t t e J e a n - P i e r r e Bruno Guy J e a n - J u l i e n André
Professeur, et de Monsieur P. CAGNTANT, Maître de recherche au cNRs. Q u r i l m e s o i t p e r m i s d e l e s r e m e r c i e r d e I ' a i d e e t d e s c o n s e i l s q u r i l s m r o n t t o u j o u r s p r o d i g u é s . J e s a i s g r é à M o n s j - e u r M . R E N S O N , P r o f e s s e u r à I ' U n i v e r s i t é d e L i è g e , . à M o n s i e u r Y . M O L L T E R , P r o f e s s e u r à r ' u n i v e r s i t é d e c a e n , e t à M o n s i e u r P . F A L L E R , M a î t r e d e C o n f é r e n c e s à l r U n i v e r s i t é d e M e t z , q u i o n t b i e n a c c e l r [ é d e j u g e r c e t r a v a i l . A m e s r e m e r c i e m e n t s , j t a s s o c i e M o n s i e u r Y . M O L L I E R e t s o n é q u i p e ( M o n s i e u r G. LE COUSTUMER e t M o n s i e u r C . c . A N D R I E U d e l r U n i v e r s i t é de Caen) pour leur collaboration à une partie d.e ce travail.
Que tous mes camarades chercheurs et techniciens, trouvent ici l r e x p r e s s i o n d e m o n a m i t i é s i n c è r e .
AVANT-PROPOS
Nqtre étude est consacrée à la synthèse de quelques hétérocycles t e l l u r é s s i m p l e s e t p l u s o u m o i n s c o m p l e x e s . C ' e s t a i n s i q u e n o u s a v o n s m i s a u p o i n t u n e m é t h o d e d r a c c è s a u x d é r i v é s s u b s t i t u é s d u t e l l u r o p h è n e d e s t r u c t u r e g é n é r a l e c i - d e s s o u s '
- û . '
R 2 = - H , - C H 3 , - C O 2 E L , - C O C H 3 ' - C H O-*oz
R 4 = - u , - c 6 H 5
* 5 = - t c 4 H 9 ' - c 6 n 5
R 4 , R 5 : - ( c H 2 ) n - a v e c n = 4 , 5
N o u s e n a v o n s e n v i s a g é I ' e x t e n s i o n à l a s y n t h è s e d ' h é t é r o c y c l e s plus complexes dans lesquels Ie noyau tellurophénique est condensé à un système polycyclique ouhétérocyclique-/1-Û'
\-..-1t-..,>
R 2 = - H , - C O 2 F , L , - C O 2 H X = O r S e L a m é t h o d e u t i l i s é e e s t b a s é e s u r I a r é a c t i v i t é d ' a l d é h y d e s v i n y l i q u e s p - c h t o r é s v i s à v i s d r h a l o c o m p o s é s d e t y p e Y - C H 2 - R 2 e n p r é s e n c e d e N a r T e a v e c Y : - B r , - C I R Z : - C O r E t , - C O C H 3 ' - C H O , - N O 2 R,4U n e r é a c t i o n s e c o n d a i r e a p e r m i s 1 ' a c c è s à u n e a u t r e s é r j - e h é t é r o c y c l i q u e , à s q u e l e È t e i s o t e l l u r o x a n t h é n i q u e ( X = T e ) .
L e s p a r t i c u l a r i t é s s t r u c t u r a l e s d e c e c o m p o s é n o u s o n t i n c i t é s à e n comparer les propriétés physicochimiques avec celles de ses anafogues sulfuré e t s é l é n i é . N o u s a v o n s a i n s i p u m o n t , r e r l t é v o l u t i o n d e l a n a t u r e d e l a
" l i a i s o n " X . . . O e n f o n c t i o n d e X ( X : S r S e , T e ) e t p r o u v e r I ' e x i s t e n c e d ' u n e " l i a i s o n p a r t i e l l e " d a n s l e c a s o ù X = T e .
I , - Index bibliographique
I^ - Comparaison du développement actuel z
d e s é t u d e s e n s é r i e h é t é r o c y c l i q u e
o x y g é n é e , s u l f u r é e , s é I é n i é e e t t e l l u r é e 1 3 - E t a t a c t u e l d e l a c h i m i e < l e s h é t é r o c y c l e s
I , - fndex Bibliographique
L e l e c t e u r t r o u v e r a l e s p r i n c i p a l e s r é f é r e n c e s d e l a c h i m i e d e s h é t é r o c y c l e s t e l l u r é s d a n s l e s o u v r a g e s s u i v a n t s :
- K.J. IRGOLIC "The Organic Chemistry of Tellurium" G o r d o n a n d B r e a c h , N e w - Y o r k , 1 9 7 4 . C e l i v r e r e l a t e t o u t e s L e s p u b l i e a t i o n s d e L 8 4 0
( s y n t h è s e du premier composé organique telluré p a r r ù o ë h l e r ) à 1 9 2 L . L e c o m p l é m e n t j u s q u r e n 1 9 7 4 f i g u r e d a n s l a m i s e a u p o i n t s u i v a n t e :
- K.J. IRGOLIC' J. Organometal. Chem. "Tellurium l i t e r a t u r e s u r v e y c o v e r i n g t h e y e a r s l g 7 T - l g Z 4 , , , I g 7 5 , L O 3 , 9 I - 1 9 6 .
- J.L. PIETTE : "Synthèses et étude des propriétés d e s d é r i v é s t e l l u r é s o r g a n i q u e s a r o m a t i q u e s e t d ' h é t é r o c y c l e s t e l l u r é s " ( T h è s e de D o c t o r a t U n i v e r s i t é d e L i è g e . A n n é e A c a d ë m i q u e 7 9 6 8 - L 9 6 g ) .
- Les volumes 1, 2,3 " O r g a n i c C o m p o u n d s o f S u l p h u r , S e l e n i u m a n d Tellurium" (The Chemical Society Burlington House, London vùlvoBN) couvrant I a b i b l i o g r a p h i e d t A u r i l 7 9 6 9 à M a r s 7 9 7 4 .
Le volume 4 est en préparation : - Chemica Scripta Vol. 8A, L975,
C e f a s c i c u l e p u b l i e l e s c o n f é r e n c e s e t c o m m u n i c a t i o n s a y a n t f a i t l r o b j e t d e " T h e S e c o n d I n t e r n a t i o n a l S y m p o s i u m C h e m i s t r y o n O r g a n i c Selenium
a n d T e r l u r i u m c h e m i s t r y " , i n c r u d i n g B i o c h e m i s t r y . L u n d ( s u è d e ) , Lg-22, A u g u s t 1 9 7 5 .
Dans notre exposé bibliographique nous nous intéresserons particulièrement à développer deux aspects des hétérocycles organiques t e l l u r é s :
- Itun général, c o n c e r n e l e u r p l a c e p a r r a p p o r t à l e u r s a n a l o g u e s o x y g é n é s , s u l f u r é s e t s é l é n i é s
- lrautre, p a s s e e n r e v u e l e s p r i n c i p a l e s m é t h o d e s c o n n u e s permettant de synthétiser plus précisément Le squeLette telLuyophén'Lque,
simple ou plus ou moins condensé.
I, - Comparaison du développement actuel des études e n s é r i e h é t é r o c y c l i q u e o x y g é n é e , s u l f u r é e ,
s é l é n i é e e t t e l l u r é e
Une première observation se dégage irnmédiatement de 1!étude
b i b l i o g r a p h i q u e d e l a c h i m i e d e s h é t é r o c y c l e s t e l l u r é s . S i l r o n s e r é f è r e a u x s é r i e s a n a l o g u e s o x y g é n é e s r s u l f u r é e s e t s é l é n i é e s c l n n e p e u t q u ' ê t r e s u r p r i s par 1e petit nombre de recherches effectuées jusqu'à ce jour dans le domaine de la chimie des composés organiquesdu tellure.
En effet il esÈ bien connu que Ia littérature consacrée aux
hëténocycLes oæygénës$-A) est très riche et recouvre des séries très variées c e c i s ' e x p l i q u e e n r a i s o n r d ' u n e p a r t d e l r i m p o r t a n c e d e c e s s y s t è m e s
(chromones, flavones, flavanones, furannes, benzofurannes, coumarines) dans grand nornbre de substances nd.t?treLLes ,d I autre part la synthèse de nombreux hétérocycles oxygénés a été justifiée par leurs pnopriétés phay'rnaeoLogiques.
Dans la séri.e sulfuz,ée, te nonbre dthétéroeAeLes dtonigine
nahtz'elLe est nettement plus restreinÈ,
bien que certains
hétérocycles
r < \
t ^ \
( t h i o p h è n ê ' - ' ,
b e n z o t h i o p h è n e \ " /
e t s y s t è m e s p l u s complexes) aient été identifiés
dans les fracLions
aromatiques des pétroles
(t)
, d.rr" certaines
familles
de
( F l ' l / o r
Par ailleurs, compte tenu des intéressantes propriétés de
certains hétérocycles oxygénés, de très nombreux travaux ont été consacrés à L a s g n t h è s e d e l e u r s a n a l o g u e s s u l f u r é s a f i n d e m e t t r e e n é v i d e n c e 1 ' é v o l u t i o n
des propriétés phgsico-ehdmiques et phannaeologiques (9' 10) en fonction de I a n a t u r e d e I ' h é t é r o a t o m e .
' C ' e s t l a m ê m e m o t i v a t i o n q u i e s t à I ' o r i g i n e d u d é v e l o p p e m e n t des études concernant les héténocycLiques séLéndës et tellutés dont peu d e r e p r é s e n t a n t s e x i s t e n È à L ' ë t a t n a t u t , e l ( c i t o n s à t i t r e d r e x e m p l e q u e l q u e s a m i n o a c i d e s s é l é n i é s ) .
Le caractère récent de ce développement nous incite à présenter u n b r e f h i s t o r i q u e d e c e t t e q u e s t i o n .
S i l a d é c o u v e r t e d u s é l é n i u r n p a r B E R Z E L I U S d a t e d e 1 8 1 8 , l r e n s e m b l e de la littéraÈure recouvrant la chimie des composés organiciues séléniés ne c o m p o r t a i t e n 1 9 2 0 q u ' e n v i r o n 2 o o p u b l i c a t i o r , " ( 1 1 t ) e t p e n d a n t d e n o m b r e u s e s années le sélénium a été considéré conme un élément particulièrement
inintéressant du point de vue chimique et biologique. La moins grande stabitité d e s l i a i s o n s s e - S e e t C - S e c o m p a r é e à c e l l e d e s l i a i s o n s S - S e t C - S , I ' o d e u r , particulièrement désagréable de certains composés séIéniésralliée à une forte t o x i c i t é s o n t , à d e s È i t r e s d i v e r s , a u t a n t d e f a c t e u r s q u j - j u s t i f i e n t l e discrédit jeÈé sur Ia chimie orqanique du séIénir:m. La question de toxicité notamment apparut comme un véritable tabou jusqu'à ces dernières années.
Mais depuis 1950 et surtout au cours de la dernière décade, on a pu montrer que certains dérivés séléniés pr,ésents en petite quantitë
( o , o 4 à o , 1 p p m ) é t a i e n t a u c o n t r a i r e d e s f a c t e u r s e s s e n t i e l s à l a v i e ( 1 1 b ) . La question de I'activité cancérogène ou au contraire antiturnorale de dérivés s é r é n i é s e s t a c t u e l l e m e n t à r , o r d r e d u j o u r ( 1 l c , l 2 a ) . L r é v e n t u a r i t é d e 1'utilisation de composés séIéniés en chimiothérapie commence à être prise e n c o n s i d é r a t i o n ( ' , p o t e n t i a l C h e m o t h e r a p e u t i c A g e n t s , , ( 1 1 c ) r . N o u s c i t e r o n s
e n f i n l e s e s s a i s d ' u t i l i s a t i o n d r a m i n o a c i - d e s s é r é n i é s . , 7 5 r " ( t Z u )
c o m m e agents "scintillaÈeurs" pour Ia radiographie du pancréas et terminerons par l a c i t a t i o n s u i v a n t e d e S . c R o N o h r r T z ( 1 3 c ) .
"An increased interesÈ in pharmacologically active derivatives can also be noticed, after the realization that the -Loxicity of at least certain types of selenium derivatives is not as high as generally believed e a r l i - e r t ' .
o n a s s i s t e e n f a i t a c t u e r r e m e n t à u n e a u g m e n t a t i o n des travaux consacrés aux dérivés organiques séléniés notamment dont le lecteur trouvera une excerlente documentation dans les
c o n s i d é r a b I e hétérocycliques
rererence"
t t it-"i
Si la découverte du tellure éIémentaire par J. MULLER date de L782, les premiers cotnposés organ'iques teLLuu,ës ne sont signalés qu'à partir d e 1 8 4 0 . o n r e l è v e 6 0 0 p u b l i c a t i o n s d e 1 8 4 0 à 1 9 7 1 , mais le net développement de cette chimie est apparu après 1960. Nous nravons trouvé dans la littérature aucune mention de substance natunelle tellunée.
Q u a n t à l a c h i m i e d e s y n t h è s e , e l l e s ' e s t l o n g t e m p s c a n t o n n é e a u x d é r i v é s a l i p h a t i q u e s t e l s q u e t e l l u r u r e s , d i t e l l u r u r e s , s e l s d e
telluronium connus depuis longtemps. Peu de composés hétérocycliques sont encore actuellement connus. Les considérationsénumérées précédenunenÈ dans Ie c a s d u s é l é n i u m : f r a g i l i t é d e I a l i a i s o n c - h é t é r o a t o m e , t a i l t e d e I , h é t é r o a t o m e o d e u r d é s a g r é a b r e e t t o x i c i t é p o t e n t i e l l e ( 1 4 - 1 6 ) , s o n t e n c o ï e r e n f o r c é e s d a n s l e c a s d u tellure. L e s d o n n é e s b i b l i o g r a p h i q u e s c o n c e r n e n t e s s e n t i e l - l e m e n t l e s h é t é r o c y c l e s t e l l u r é s : - d" r" séri" pç"t"go""I. : t e l l u r o c y c l o p e n t . r r " ( 1 7 a - c ) , , . 7
-t e l l u r o p h u n " ( 1 8 a - d ) , b"n"o/Ë_T-t.-trrrrophène(19a,b), dibenzo-telrurophèr,.(20.,b),
" t e l r u r o a u r o n e s , , Q 7 ' ) ' t.rruroirrao*vt"l22)
.
Tellurocyclopentane : - H , - C I , - " 6 " 5Tellurophène benzo / b_/tellurophène
R
Dibenzotellurophène t ' T e l l u r o a u r o n e s t '
- d u t e l t r r . r r n . ( 2 3 ) d e 1 a t e l l u r a c y c l o h e x a d i o n e - 3 , 5 ( 2 4 )
425)
r'")
ô---â
r")
\ t " /a - \
tl
\--,,/
- de ltoxatelluranne-1 X : O , S I a t h i o t e l l u r a n n e - 14 ( 2 6 )
- des 2ttl- r
_ltellurochrorun.
(27a'b)
, I t _Tt"lrurochro*.rrrrorr"
(27b)
t e l l u r o f l a v o n e
( 2 8 )
, ar-7
t e r r u r o c o u m a r i n e
( 2 7 b ' )
, t e r l u r o i s o c h r o m a n n e Q g )
U-- t _7 t"l I urochromène
/
-
t _7 tetturochromannone
Telluroflavanone- de la dibenzo oxatellurine-1
n
( 3 O a , b )
t h i o t e l l u r i n e - 14 ( 3 1 )
X : O r S- de la terruroxanthone
( 2 7 b )
- du telluroanthrène ( 3 2 )(Y'")rf\
\-\,")l
-?
P l u s i e u r s t r a v a u x o n t f a i t I r o b j e t d e t e s t s p h a r m a c o l o g i q , r " " ( 1 6 ) e t c o m p l è t e n t c e u x f a i t s à p r o p o s d e s c o m p o s é s sérénie=(33). c i t o n s e n p a r t i c u l i e r I ' a c t i v i t é a n t i b a c t é r i e n n e d e I a È e l l u r a c y c l o h e x a n e d i o n e - 3 r 5 a l t i é e à u n e t o x i c i t é p r o n o n c é e ( 3 4 ) .II est certain que sur le plan des relations "sÉructure-aetiuitë physioLogique et phannaeoLogiquett, beaucoup drétudes restent à faire dans le
d o m a i n e d e s h é t é r o c y c l e s s é l é n i é s e t à f o r t i o r i t e l l u r é s . D a n s l r é t a t a c t u e l , ces recherches auraient un caractère nettement académique et leur application pratique éventuelle demeure hypothétique.
Par contre sur Ie plan relation "stznrcture-r,éaetiuité ehimiquet, et 'tstruettu'e-propriétés
physico-ehimiqttest', re déveroppement de ra chimie de ces composés présente un intérêt particulier dans la série des hétérocycles pentagonaux. Lrévolution des paramètres caractéristiques
des hétéroatomes
d e l a 6 è m e c o l o n n e ( o , s , s e , T e ) / - t a i t t e ( 3 5 ) , e l " c È r o n é g a t i v i t é ( 3 5 ) , t a b l e a u r Z est à 1'origine de la variation des paramètres structuraux du furanne, du
t h i o p h è n e ' d u s é l é n o p h è n e e t d u tellurophène ( T a b 1 e a u rr) etde'rùe1le
d e l e u r s propriétés physicochirniques. ces différences conditionnent également les
T a b l e a u I P a r a m è t r e s c a r a c t é r i s t i q u e s d e s h é t é r o a t o m e s d e l a 6 è m e c o l o r r r r . ( 3 5 ) T a b l e a u I I A n g l e s v a l e n t i e l s e t l o n g u e u r s d e l i a i s o n d a n s l e s h é t é r o c y c r e s p e n t a g o r r a u x ( 3 6 )
x
Rayon covalent E l e c t r o n é g a t i v i t éo
o , 6 6
3 r 5I , o 4
2 . 5
S eI , 1 7
2 r 4 TeL ,3 7
2 r 1x
x-c^ (A)
o z" 2 - t 3
"3-"a
0 ( o4 "
( 3 7 )
o
r , 3 6 2
r , 3 6 1
r , 4 3 7
1 0 6 , 5 5
1 0 , 6 , 1 2
t , 7 I 4
1 , 3 7 o
r , 4 2 3
9 2 , 1 7
9 3 , 2 4
S e1 , 8 5 5
r , 3 6 9
1 , 4 3 3
8 7 , 7 6
8 9 , 6 Te2 , o 5 5
t , 3 7 5
r , 4 3 3
8 2 , 5 3
8 5
A i n s i a é t é é t u d i é e l ' é v o l u t j - o n d e s c o n s t a n t e s p h y s i c o - c h i m J - q u e s / e x : p K a d e s a c i d e s - 2 c a r b o x y l i q u e s ( 3 8 ) , d o n n é e s s p e c t r o s c o p i q u e s u v , r R , R r * { ( l 8 b ) ( R M N d u p r o r o n l n ( 3 9 a ) e t d u 1 3 a ( 3 9 b - e ) d , , 7 7 s . ( 4 o ) ) , s p e c r r e s p h o t o é l e c t r o n i q u e s ( 4 r a ' b ) - 7 , t a n t p o u r I e s h é t é r o c y c l e s d e b a s e q u e p o u r c e r t a i n s d e l e u r s d é r i v é s - 2 substitués. D e s c o r r é l a t i o n s l i n é a i r e s o n t é t é é t a b l i e s e n t r e 1 r é l e c t r o n é g a -t i v i -t é d e s h é t é r o a t o m e s e t c e r t a i n s p a r a m è t r e s d e R I n r ( 3 9 d ) , e n t r e l e s d é p r a c e m e n t s c h i m i q u e s d e s p r o t o n s e t c e u x d u c a r b o n " 1 3 " ( 3 9 a ' c 1 e n t r e r e s p K a d e s a c i d e s - 2 c a r b o x y l i q u e s e t l a c o n s t a n t e f d ' H a m m e t t ( 3 6 ' 4 2 ) . c " = é t u d e s s y s t é m a t i q u e s o n t p o u r b u t d e d é t e r m i n e r l r i n f l u e n c e d e 1 , h é t é r o a t o m e s u r I a t r a n s m i s s i o n d . e s e f f e t s é I e c t r o n i q u e s d e s s u b s t i t u a n t s e n d i f f é r e n t e s p o s i t i o n s . E l l e s p e r m e t t e n t d e d o n n e r d e s i n f o r m a t i o n s s u r I r a r o m a t i c i t é e t I a r é a c t i v i t é c h i m i q u e d e c e s h é t é r o c y c l e s . L r e n s e m b l e d e s é t u d e s c o n s a c r é e s au criÈère d"'aromaticiÈé" (R.lfi{, rongueur et indice de riaison, moments d i p o l a i r e s ) c o n d u i s e n t a u c l a s s e m e n t s u i v a n t ( 4 3 ) .
A r o m a t i c i t é d é c r o i s s a n t e .
La transmission des effets électroniques des substituants serait pratiquement la même dans le cas des thiophène, sélénophène et telturophène
I le furanne présentant une plus grande sensibilité aux changemenÈs structuraux.
Des études analogues ont été menées dans Ie cas des benzo dérivés ( b e n z o / b_ff,rranr,., e t c . . . ) : é v o l u t i o n d e s c o n s t a n t e s d e d i s s o c i a t i o n d e s a c i d e s - 2 c a r b o x y l i q u e s ( 3 8 ) , s p e c t r e s w @ 4 ' ) , R M N ( 4 5 a , b ) , s p e c t r e s
photoérectroniques @6) , propriétés magnétooptiq,r"" (47) .
I" - Etat actuel de la chimie du tellurophène et de ses dérivés
-J
Synthèse et réactivité
Notre travail étant principalement consacré à 1rétude du noyau tellurophénique, nous ne développerons ici que les méthodes, de synthèse actuellement connues permettant lraccès à ce squelette ; pour les autres hétérocycles tellurés, nous renvoyons le lecteur à f index bibliographique
( p a g e 4 ) .
Nous aborderons ainsi la chimie du tellurophène, puis celle de ses benzodérivés (Benzo/ b_7t"l1,trophène, Dibenzotellurophène) envisagée d'abord du point de vue synthétique, puis du point de vue réactivité.
A - Synthèse
Parmi les méthodes permettant lrintroduction du tellure dans une m o l é c u l e o r g a n i q u e , l e s p l u s u t i l i s é e s f o n t a p p e l
- au tellure é l é m e n t a i r e ( f e 1
- aux chlorures de tellure (TeCl, et TeCl*) - au tellurure d e s o d i u m t ' l " r r " ( 4 8 )
' Lrune ou I'autre de ces méthodes a trouvé son application dans la synthèse du tellurophène, de ses dérivés substiÈués et de ses dérivés p l u s condensés.
A1 - Méthodes draccès au noyau tellurophénique A. . - par emploi du tellure élémentaire
I . I
Le seul eæettTple relevé dans la bibliographie concerne la synthèse
I l Q n \
d r u n t e l l u r o p h è n e t é t r a s u b s t i t u é : l e t é t r a c h l o r o È e l l u r o p h è n e , p a r W . M A C K ' ^ " " ' e n 1 9 6 5 , à p a r t i r d e I ' h e x a c h l o r o - l , I 1 2 , 3 , 4 , 4 b u b a d i è n e .
Schéma I C I C I 2 5 0 0 c
""("r"'
"rfl"t
+ T eA" ^ - par emploi du chlorure de tellure TeCl.
I c i e n c o r e , l e s e u l e x e m p l e r e l e v é c o n c e r n e l a s y n t h è s e d t u n tellurophène tétrasubstitué : le tétraphényltellurophène par BRAYE et coll. C r e s t e n f a i t l a p r e m i è r e s y n t h è s e d ' u n n o y a u t e l l u r o p h é n i q u e ( 1 9 6 1 ) . Schéma 2
" 6 " 5
recr,
"u"t.1'Vu"u
---)
\
ll
"."/1
"e"s
( 1 8 d ) L iA t . 3 - par emploi du tellurure
de sodium NarTe
W. MACK en 1966, en traitant le butadiyne par le tellurure de s o d i u m r a o b t e n u l e t e l l u r o p h è n e a v e c u n r e n d e m e n t d e 6 9 * ( 1 8 a ) . c e p r o c é d é constitue la première synthèse de l'hétérocycle non substitué ,; les essais a n t é r i e u r s p a r d ' a u t r e s m é t h o d e s a y a n t é c h o u é ( n 9 ) .
" . =
c o n d i t i o n s expérimentales de cette réaction ont été précisées ultérieurement par F R T N G U E L L T e t c o l l . ( 1 8 b ' 5 o ) q u i n r o n t o b t e n u q u r u n r e n d e m e n t d e 4 7 z .
' La même technique d i s u b s t i t u é s e n - 2 , 5 a v e c d e s p e r m e t I t a c c è s à d e s rendements variables dérivés slrmétriques ( 2 5 à 9 s % ) . Schéma 3
(7
A^ -Méthodes d'accès au benzo/-U Ttetturophène
z
-A Z . t - E n 1 9 2 8 , F . P . y t A z z A et L. MELCHTCNNA(5I) o n t e s s a y é e n vain, de préparer le benzo/ b_Tt"ttnrophène par réduction du telluroindoxyle. Leurs résultatsrnon reproductibles, ont été uris en doute ultérieurement par û , f . V . F A R R A R e t c o l l . ( 5 2 1 e t p l u s r é c e m m e n t p a r J . L . P I E T T E e t M . R E N S O N . C e u x -ci ont m1s au point une autre méthode de synthèse du benzo/ b-Ttelturophene(19a)'
elle consiste à introduire le tellure éIémentaire dans une molécule organique appropriée à savoir Ie diéthyl acétal de I'o.iodobenzaldéhyde i on o b t i e n t a i n s i I ' o . m é t h y l t e l l u r o b e n z a l d é h y d e .
N a ^ T e
R - C = C - C 4 - R +
c H 3 o H
, 2 o o c
R r.. R -H-cH2oH
- c (cH3)
2 o H
-c6"5
RdtB6 9
2 5
9 5
5 5
' Après condensation de ce dernier avec l'acide bromacétique on i s o l e l ' a c i d e o . f o r m y l p h é n y l t e l l u r o a c é t i q u e , c y c l i s é e n s u i t e e n c a r b o x y - 2 benzo/ b 7t"llr-trophène. L'hétérocycle de base est isolé après décarboxylation.
Schéma 4 : Synthèse du benzo,/-U Ttetturophène
Introduction de Te C y c l i s a t i o n
cH<i;ï;
2 L L Quinoléine<-(-cu, r )
o . néthyl te I lurobenzaldéhydecHo
TeCH,I
2cH3T
cHo
.f ,,,
""-*r*u
HCl+
Te-CH.
\
c H 3 r
ô"1":
t"",
t-$"--CHTCOTH
\
"*3
Br
BTCHTCOTHQuinoléine
( - c H r B r )
û3Çff:-G1",.","
benzo/ b /tellurophène
L ' o b t e n t i o n d e s m a t i è r e s p r e m i è r e s e s t t r è s l a b o r i e u s e , l e s réactions donnant lieu à des mélanges ou à des produits difficilernent isolables. Ainsi la préparation du diéthylacétal de I'o'iodobenzaldéhyde comporte cinq étapes à partir de lro.toluidine (rendement global de la synthèse : 36 E). A partir de ce diéthylacétal considéré conme matière première, le benzo/-n_7ætlurophène est obtenu avec un rendement drenviron
2 z r d f o ù u n r e n d e m e n t f i n a l à p a r t i r d e I ' o . t o l u i d i n e d e o ' 7 z . o Z . Z - T o u t r é c e m m e n t J ' L '
point la préparation du telluroindoxyle
produit nravait pas été obtenu par NAZZA et coll'
PIETTE Et M. RENSON ONI MiS AU
(22')
. rrs ont ainsi
démontré que ce
( 5 1 )
e t q u r i l p o u v a i t
conduire
au benzo,/-U_Ttetfurophène
par réduction
au moyen de NaBHnl avec
un rendement de 20 z. Le telluroindoxyle
est obtenu avec 80 B de rendement
à partir
de I,o.bromotelluroacétophénonersynthétisée
quant à ellerà
partir
de l,acide
o.iodobenzoique
avec 26 I de rendement ; ceci porte le rendement
de la synthèse du benzo/-n-Ttetturophène
à partir
de ce
dernier'produit'-à 4 , 2 z .
Schéma 5 : Synthèse du telluroindoxyle : accès au benzo / b_/tellurophène.
,,
-l
oz'
1 . S O C 1 2 2.Malonate 3.Hydro1ysecocH3
8 0 r
+_--KOH,/alcoo1|
"o""=""^o"
8 0 8 l
" + .
l"
Io1
J-/
| 1 , l i
' c u .
s 3 8 l 2ne
J s-cnrcrrat
â-'\arecH2cH3
ttl
\--\cocH3
|
1. arcH
2co2ulu
e o t l 2 . g u i n o l é i n e
|
- (curar)
.
\Y 3,HBr/HAc,77'-*:rent
tll
\.\**,
o
20 z
I
llaan*
î-(.")
\./-P a r e s t t r è s f a i b l e
c e s d e u x v o i e s ' I e vu le grand nombre
rendement final en benzof d'étapes intervenant dans
/tellurophène s y n t h è s e . b_
1 a
A3 - Méthodes d'accès au dibenzotellurophène A- - - par emploi du tellure élémentaire
3 . 1
La préparation du dibenzotellurophène dérivés se fait avec de bons rendements (82 t)en mercurique ci-dessous avec le tellure(2ob) t
Schéna 6
Te
A
- ou par action du tellure
sur la
t 54)
t h i a n t r è n e - 5 , 5 , 1 0 , 1 0 t é t r o x i d e '
et de certains de ses traitant Ie comPosédibenzothiophène
"rrlforr.
(53)
s u r I e
Schéna 7o
\
- S
/
o o
\ /
S
\
o
o l . z
- par emploi des chlorures de tellure
( r e c t , ou TeCln)
Le dibenzotellurophène a été préparé : - avec un faible rendement par réaction haute températut" (2ot) .
de TeCIn sur le diPhénYle
Schéma B 1- TeCl4 en traitant I'orthodilithiodiphényle, Schéma 9
* zrect,
20o0c
>
î-(
puis rédu.**V--V
- avec un a v e c T e C l ^ ( R a t : 52 z bon rendementt 1
( 2 o u )
.
A- - Accès aux dérivés tellurophéniques
substitués
4
L,introduction
de substituants
sur I'hétérocycle
au cours de
son élaboration, a été réalisée dans un petit
nombre de cas. Nous avons déjà
signalé celui
des dérivés symétriquesdi
ou tétrasubstitués
(diphényl-2,5,
tétrachloro,
tétraphényl)
du tellurophène.
Récemment/des méthodes particulières
ont été rapportées permettant
I'accès
aux dérivés halogénés en -2 et -3 en série furannique,
thiophénique
et sélénophénique par traitement
du dérivé lithié
correspondant avec
l , h e x a c h l o r o é t h a n e ( 5 5 ) .
a " a t e m é t h o d e a p p l i q u é e a u l i t h i o - 2
t e l l u r o p h è r r . ( 3 9 " ) ,
à b a s s e t e m p é r a t u r e , a p e r m i s d ' o b t e n i r
d e s d é r i v é s c h l o r é s e t b r o m é s e n - 2 ,
é v i t a n t
a i n s i l e s p r o d u i t s d e q u a t e r n i s a t i o n a v e c l e
t e l l u r e ( 1 8 a ) .
P a r c o n t r e
la méthode de synthèse de f iodo-2 et du nitro-2
thiophènerPar
atta9ue
n u c l é o p h i l e d e I ' i o n
n i t r i t e
s u r I e c h l o r u r e d e d i - t h i é n y l - 2
i o d o n i u m ( 5 6 a )
t r a n s p o s é e a u s e 1 d e d i - t e l l u r i é n y l - 2
i o d o n i u m ( 3 9 c ) n ' a c o n d u i t q u ' à d e s
I
faibles
rendements en dérivé iodé en -2, le dérivé nitré
demeurant
i n a c c e s s i b l e p a r c e t t e v o i e .
Schéma 10
( s 6 b )
Synthèse de lriodo-2 et du nitro-2 thiophène
\
/r
rcl
.c-C
*
n ' r /
|
\
I cr^
rcH-|
"
"\-/
tt
-'-'
\
/IcL2
r''
\-nlf-"r
CI/ \H|
- -
c 6 H 5 L i
H C : C H HcL/
+
I -r- rr / Y - L . F / o )I
I
\ 1 1 c - H - L i b 5-Licl
( s 6 b )
\s
"\
c L /
<_
Clivager - ( c 6 H 5 )
2
(L-(-( c 6 H 5 )
r t + c l - +
H c = c H
lc/'
C-}'{)"'-.**o1 ù'-(7-o
Récemment,
I'accès
arsx dér,iués-2 substitués
(-cN, -cocH3 , -co2c2K',
-coc6H5) du benzo/-A_7t-etlurophène a été réalisé par cyctisation
de
s u b s t r a t s a p p r o p r i é s / e n s ' i n s p i r a n t
d e s m é t h o d e s d é c r i t e s à p r o p o s d e
l ' h é t é r o c y c l e
d e b . " "
( 1 9 b )
.
Schéma 1 1 : Benzo/ b /tellurophènes substitués en -2
R ' _ H a ) p t r ^ p - c H - R , l t 3
b) B'2
R , '- - \
n
eCH3 R l /Bt TEI
-"t
c"3
Pyridine_ cHrBr
--$Br ,/fe,- , R",4-(
Y
(/
\
ll
\
z'-\
n'
L=/
R r = - HR"=-cocH3
' -cozEt, -cN, -coc6H5
Tous les autres dérivés ont été obtenus par substitution
des
hétérocycles
de base (tellurophène,
benzo/ b-ftellurophène)
ce qui nous
conduit à examiner Ia réactivité
de ces derniers.
B - Réactivité
8 1 - A p a z ' t i r d u t e L L u r o p h è n e ' l e s p r i n c i p a l e s r é a c t i o n s
permettant l'obtention de ses différents dérivés substitués ê7t -2t pwls en - Z r S , sont des réactions c l a s s i q u e s d ' a l c o y l a t i o n e t d e m é t a l l a t i o n ( 1 8 b ) , I e lithio-2 tellurophène étant le point de départ de la plupart des synthèses d é c r i t e s .
Schéma 12 : Réactivité du tellurophène
Toutes les réactions envisagées mettent en évidence la réactivité prépondérante de Ia position -2 et la grande sensibilité du noyau aux acides m i n é r a u x ( H N o 3 ) e t d e L E V ' I I S ( A I C I 3 ) ' D a n s I ' e n s e r n b l e ' l e t e l l u r o p h è n e s e
comporte doncrcorune un hétérocycle pentagonal classiq"t(36) '
1t"\
Ac2o
(*"
)y'"*"t
(cHoHcH3)
\\
| I
"--è, \\
ll
L ll
sncrn
\___y
x
1".",*":t
2.
nBuLi EE201'" \,lH:
,
(t'r)
r'on
\\
't!___y
il
\_--co^
'/"
vcozH
(co2cH3
)
\-/
(cH2oH)
1
. nBuliEt-20
"oz
c7'
ttozc=.çr7, c'r
(
r " r ' , " H o
( c H 2 o H )
\ - /
( c H 3 )
HOHCH3Les réactions sont univoques et aucun.isomère en position -3 n ' a p u ê t r e m i s e n é v i d e n . " ( t u ) .
T o u t e f o i s r l o r s q u e l e s p o s i t i o n s - 2 et -5 sont bloquées, Ia réaction p e u t s e f a i r e e n - 3 ( e t - 4 ) . A i n s i , t o u t r é c e m m e n t , L a d i c h L o r o m ê t h y l a t i o n e n - 3 r 4 du diphényI-2,5 t e l l u r o p h è n e a é t é d é c r i t e , p e r m e t t a n t I ' a c c è s a u x dialdéhydes correspo.d.rrtr (57) . S c h é m a 1 3
o
l l
H - C - H J H C lc H 3 c o 2 H
c 1 H 2
Cette réaction nontre en outre Ia plus grande réactivité des p o s i t i o n s - 3 et -4 de lrhétérocycle p a r r a p p o r t à c e l l e s d u n o y a u b e n z é n i q u e .
Des études de réactivités comparées ont été réalisées par F R T N G U E L L T e t c o l l . ( 5 8 ) ; é t u d e d e s v i t e s s e s d e f o r m y l a t i o n ( c o c l 2 , D ! - ) , d r a c é t y l a t i o n ( A c r O , SnCl4), de trifluoroacétylation d u f u r a n n e , t h i o p h è n e ,
s é I é n o p h è n e e t È e l l u r o p h è n e . L r o r d r e d e r é a c t i v i t é e s t l e s u i v a n t : furanne
La sensibilité du noyau tellurophénique aux acides mj-néraux et aux acides de LEITIIS se traduitpar f impossibilité de la nitration, les difficultés de la réaction de FRIEDEL-CRAFTS (emploi de SnCln au lieu de A l c l 3 ) . Q u a n t à I a r é a c t i o n d r h a l o g é n a È i o n , e l l e d o n n e d e s p r o d u i t s d ' a d d i t i o n s u r I ' h é t é r o a t o m e .
B2 - Par rapport à ses analogues sulfurés et séléniés, Ia
substitution électrophile au benzo,/-b-TtetLutophène s,avère plus délicate (19b) . O n p e u t r d a n s c e r t a i n s c a s r o b s e r v e r d e s r é a c t i o n s s e c o n d a i r e s a u n i v e a u d e
Ainsi, la réaction de FRIEDEL-CRAFTS se fait exclusivement en
position -2, mais avec de mauvais rendements. La réaction d'halogénation donne d e s p r o d u i t s d ' a d d i t i o n s u r I r a t o m e d e t e 1 l u r e .
Comme pour le tellurophène, la réaction de métallation au moyen du n - b u t y l l i t h i u m p e r m e t d ' a c c é d e r p a r d e s v o i e s c l a s s i q u e s , a u x d é r i v é s - 2 s u b s t i t u é s .
Schéma 14 : Réactivité du benzo/ b /tellurophène
cocH3
/ ' * " / ^
\ / / n
\ \___lJ
- H X : - C l , - B r r - I/,,_--..(t')/*
\
\\----jr
\----
,/
R : -cocl x : -cl
(/
\\
ll
-*-v/
R: -cH
x : -Br
\ l \ ' / 3\ /
-t - /
R :
- c ' r r
- c o 2 ' , - c H 2 o H , - c ' o
L e s a s p e c t s c o m p a r a È i f s d e I a c h i m i e d e s b e n z o l b _ 7 " e r c n o p h è n e
e t t e l l u r o p h è n e o n t f a i t
l r o b j e t
d ' u n e r é c e n t e m i s e a u p o i n È ( I I . R E N S O N
C h e m i c a S c r i p t a 1 9 7 5 , 8 A , p a g e 2 9 ) .
B, - Quant à la série du dibenzotellurophèneraucune étude de s u b s t i t u t i o n n ' e s t s i g n a l é e j u s q u ' à c e j o u r d a n s l a b i b l i o g r a p h i e .
CÔ\
Méralrari on,/
E/
--\\
Acérylarion
,,/
nBur,i
\
-\-*
AlcI3
y'.
EÈ2c
\
(t,Yi
\'"*"**?t)
C o n c l u s l o n :
Ce bref exposé a pu montrer qu'un nombre relativement restreint de méthodes pennet 1'élaboration du noyau tellurophénique. Parmi les systèmes plus condensés, seuls ont été abordés Le benzof-n-Ttetturophène et le dibenzotellurophène i aucun système polycyclique plus complexe ne figure dans Ia bibliographie à notre connaissance. On notera en général Ie nombre relativement important drétapes intermédiaires qui entraÎne une chute spectaculaire des rendements.
p a r substitution d i r e c t e , s e u l s l e s d é r i v é s s u b s t i t u é s e n - 2 o u -2,5 oni- pu être obtenus avec des rendements plus ou moins variables selon les conditions expérimentales. En particulier, 1a fragilité du noyau
i n t e r d i t t o u t e r é a c t i o n b r u t a l e , t e l l e c e l l e d e n i t r a È i o n .
Notre progranme de recherches a conduit à la mise au point d'une méthode génëraLe, napide, permettant la synthèse non seulement de dérivés du tellurophène mais celle d'hétérocycles tellurophéniques polycycliques
p l u s o u m o i n s c o m p l e x e s . E l l e p e r m e t e n o u t r e l ' a c c è s d i r e c t à d i v e r s c o m p o s é s f o n c t i o n n a l i s é s e n - d d e I ' h é t é r o a t o m e , e n p a r È i c u l i e r a u d é r i v é n i t r é e n - 2 .
DU NOYAU TELLUROPHENTQUE A PARTTR DES
B -cHr,onovrNyLALDEHyDES
t t l
- Introduction
,t2 - Accès aux matières premières
t t 1 - I n t r o d u c t i o n
r I y a u n e q u i - n z a i n e d ' a n n é e s , H ' F T E S S E L M A N N ( 5 9 ) d é c r i v i t u n e méthode de synLhèse d'esters d'acides thiophène-2 carboxyliques par condensation d,esters thioglycoliques sur des composés carbonylés d , p insaturés ou
s u r d e s d i c é t o n e s . S c h é m a 1 5 : S y n t h è s e d r e s t e r s d ' a c i d e s t h i o p h è n e - 2 carboxyliques
"0"5 -.
s t /
'-cocu,
7 H
"."r \ ,./s-cur-co2c'3
" ër/s
.-t',rcor"n,
+ H F c H 2 - c o 2 c H 3 -
> l
- * \
f
2
"" .
-1"",
",
/
'-"o"".
c
ll
c
""t -a
-.--....->ll
4
""3
" " \ .
/ t
tl
lr
-{- ns -"*2 --to2cn3
./ s<Hlcorc*t
"rr.. ,'/s
1.,rcorcn,
>
\ ll
\ . " o
" r
-, c .
"'r/
\no
./cHt
o : c
7",
O : C \ ' " " 3i
T"'*
{H:
r
3H{z"s
\tloz*
+
2Hs -1H2-1o2R ____-_______-
-,C _
--->
\\
ll
tnr/
|
-s-cH2-co2R
\---(
-
c H ^
S - C H * c O 2 R
r
R : - H , - " " 3Ces travaux furent repris s. HAUPTMANN et colt. (60) pour la
s y n t h è s e d r h é t é r o c y c l e s à n o y a u x t h i o p h é n i q u e s e t p y r r o l i q u e s r p a r c o n d e n s a t i o n d'un aldéhyde vinylique ft -chforé avec un halocomposé de formule générale H x - C I l 2 - C O r E t r s u i v i d e c a r b o c y c l i s a t i o n b a s e c a t a l y s é e .
Schéma 16 : Synthèse d'hétérocycles thiophéniques et pyrroliques P O C I 3
R..
'cL
- c /
'(rï"'"'
R/-
|
I
I
,l
(60)
->
ll
+ Hx cHr{o,EE
-l -l
N ( c 2 I I s ) 3
, C \R/
- cHo
P y r i d i n e X : Sc l c _ H , ,
p-e?cln*l
DMF R=-H R ' = - C U H , ( p*-.arX\
\\
tt
\ \
L Jl l
X : s ' N - c H 3
R . / R = - C H 3 R r = - C U H U R = R t = - C 6 H 5co2Er
n = 3 , 4 , 5 X = S X : N - C H , n = 3 X : N - C H , L r e x t e n s i o n d e c e t t e r é a c t i o n à I a s é r i e s é I é n i é e a é t éparticulièrement étudiée dans notre laboratoire. Dans un premier temps, a été envisagée la condensation d'un aldéhyde vinylique B -chloré avec I'acide s é l é n o a c é t i q u e o u s e s e s t e r s ; t o u s l e s e s s a i s o n t é c h o u é . P a r a i l l e u r s ,
la forte toxicité des produits réactionnels a suscité la recherche drune autre rnéthode.
U n e t e c h n i q u e a é t é m i s e a u p o i n t d ' a b o r d e n s é r i e s é I é n o p h é . r i q r r " ( 6 1 ) puis appliquée à la série thiophér,iq,-,. (62) ; elle consiste à condenser un a l d é h y d e v i n y l i - q u e p - c h l o r é s i m p l e , p o l y c y c l i q u e o u h é t é r o c y c l i q u e ( 5 3 ) , . . r " . N a r X ( X = S , S e ) r p u i s a v e c u n h a l o c o m p o s é d e f o r m u l e g é n é r a l e Y - C H 2 R , , R , é t a n t u n g r o u p e m e n t é l e c t r o a t t r a c t e u r t e l q u e - C O r E È r - C O C H 3 , - C H O , - N O 2 e t c . . . Après cyclisation base catalysée, on accède au composé hétérocyclique désiré, substitué en position -2 par Ie groupement *2. Les rendements sont de 65-808 à partir du produit de départ (alcoylcétones, cyclanones ou cétones
hétérocycliques) transformé en le ft -chlorovinylaldéhyde correspondant par chloroformylation selon vrLsMErER-HAAcK(64) .
Nous avons orienté nos recherches vers Itapplication de cette m é t h o d e à l a s é r i e t e l t u r é e / p a r 1 ' é t u d e d e l a c o n d e n s a t i o n d u t e l l u r u r e d e sodium avec les aldéhydes vinyliques p -chlorés, suivie de celle des dérivés du type Y-CH2-R2. Pour la présentation de nos résultats, nous exposerons successivement :
- la synthèse des dérivés du tellurophène
-\*Y"',
R4/-- Ia synthèse deR 2 = - H , - C H r r C O 2 E t ' - C o c H 3 ' - C H o ' - * O 2
* 4 = - " , - C 6 H 5
R 5 = - t c 4 H 9 , - " e " s
systèmes bicycliques
n = 4 , 5
(cH
R = -H, -CO2F.L' -CO2H- la synthèse de systèmes polycycliques
R = - H , - C O 2 E E , - C O 2 H
- la synthèse de système polyhétérocycliques
fu("f
\---q x>
X : O r S eR = -Hr -CO2Et' -CO2H
Au cours de cette étude, deux réactions
secondaires
particulièrement
intéressantesont
pu être mises en évidence et sont exposées
indépendanment (chapitres
III
et IV).
1 o ) a c c è s a u t e l l u r a - 9 h e x a h y d r o - 3 ,4 ,5 ,6,'7 ,8 c a r b a l d é h y d e - 1 .
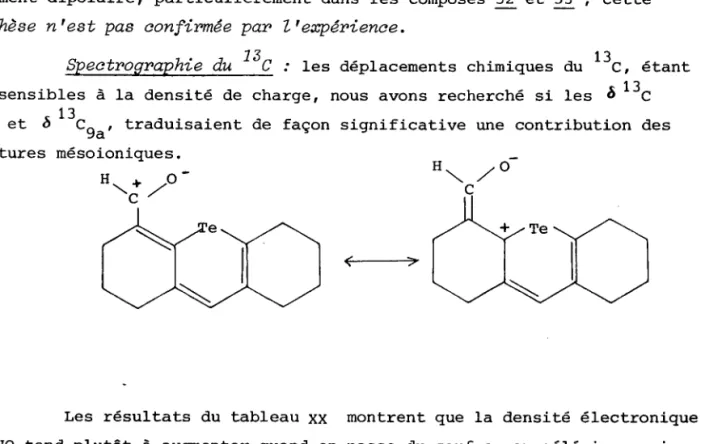
Certaines particularités spectrographiques UV et IR de ce composé ont attiré notre attention. Elles nous ont conduit à envisager les c o m p o s é s i s o l o g u e s s u l f u r é e t s é l é n i é e t s o n t à I ' o r i g i n e d e l r é t u d e q u e n o u s p r é s e n t o n s s u r l a l i a i s o n O . . . X ( X , S , S € , T e ) , d a n s c e t t e s é r i e . C e t t e é t u d e a é t é r é a l i s é e g r â c e à I a c o l l a b o r a t i o n d e M . L e P r o f e s s e u r M O L L I E R e t M . L E C O U S T U M E R d e 1 ' U n i v e r s i t é d e C a e n . 2 " ) r é a c È i o n d e " d é f o r m y l a t i o n " d ' a l d é h y d e s v i n y l i q u e s p - c h l o r é s : a p p l i c a t i o n à l a s y n t h è s e d ' h é t é r o c y c l e s h a l o g é n é s e n p o s i t i o n - 3 .
, z X t ,
\ t
/ )
\ tl
y /
-X : S
Y : - B r
t---ax\
(/ \\ tl
\,/
X : O r S r S e Y : - C 1 , - B rI I ^ - Accès aux matières Premières z
L ' é I a b o r a t i o n d e s h é t é r o c y c l e s t e l l u r é s a n é c e s s i t é l a s y n t h è s e de quelques aldéhydes vinyliques p -chlorés et du tellurure de sodium.
A - Synthèse des aldéhydes vj-nyliques Ê -chlorés
Les différents aldéhydes vinyliques B -chlorés ont été obtenus p a r c h l o r o f o r m y l a t i o n s e l o n V ï L S M E I E R - I { A A C K ( 6 4 ) à p a r t i r d e s a l c o y l c é t o n e s , cyclanones et cétones héLérocycliques suivantes, et sont répertoriés dans Ie tableau suivant :
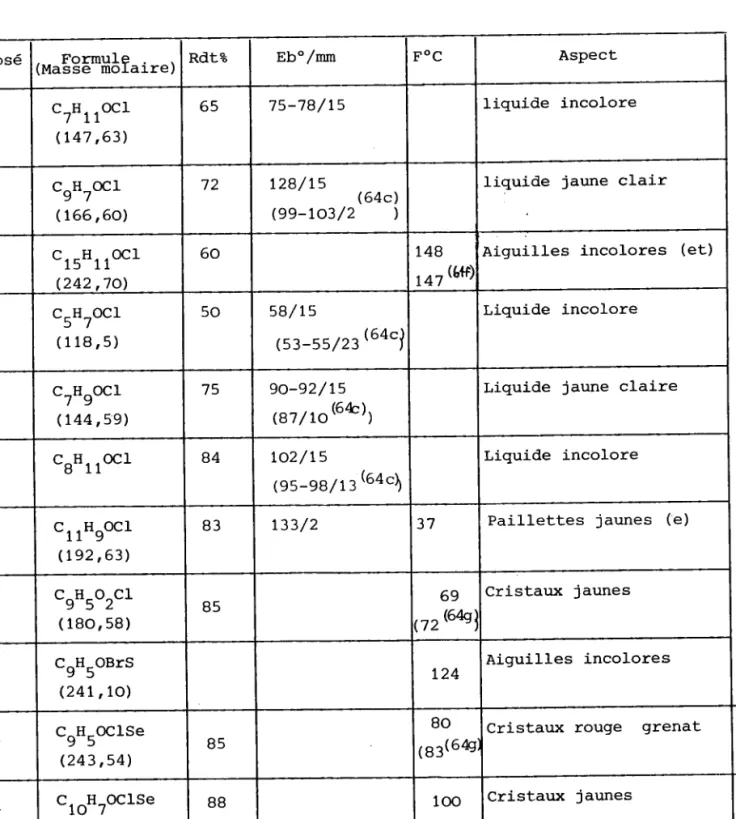
T a b l e a u I I T
Cétones Aliphatiques Dérivés chloroformylés correspondants
a l f
t-4"9\g=6
,/
c H .
" o
c.Hu-ë-cH,
I
c - H - - c - c H ^ - c - H .
t ) ) z o )I
c H 3 - c - c H 2 - c H 3
r C 4 H 9 - c ( c I )
= C H - (C H o )
1
C 6 H 5 - c (c l ) = C H
( C H o )
c 6 H 5 - C (c l ) = C (c H O ) - C O H S
C H 3 - c ( c l ) = c ( c H o ) -c H 3
( c n o ) - C H = c (c I ) - c 2 H 5
Z
l_
4 a 4bn = 5
( *
\ctto
5
n=6
6
7
X=O9.
X=S9
1 0
1 1
C
C I/=J
D \\y/,.cHo
i \
l l
( / \ \ i l
\
,z--\
n,
È / , ,
s " \
, z c * o
, / \
v
X=Se dérivé méthylé en -5 Cétones cycliques Cétones hétérocycliquesLa plupart de ces cétones sont des produits commerciaux. En ce qui concerne les cétones hétérocycligues, nous les avons préparées selon les méthodes de synthèse mises au point au laboratoir" ( 65 ) , par cycrisation des acides o. carboxyarylhétéroacétiques.
Lrapplication de Ia réaction de VILSMEIER-HAACK à ces différentes cétones, en présence de diméthylformamide (DMF) et d'oxychlorure de phosphore
(Poc13) conduit aux aldéhydes vinyliques p -chtorés correspondants avec un rendement de 50 à BO B.
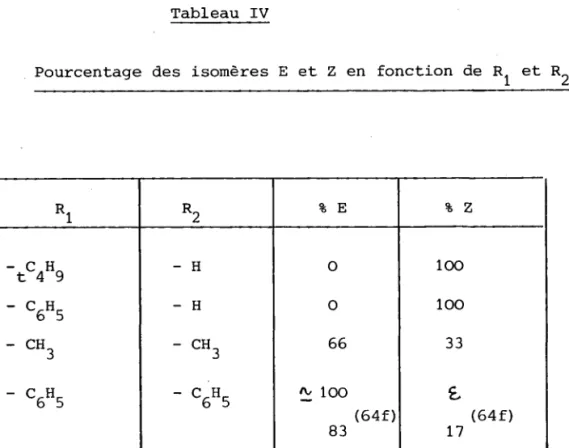
Dans le cas des cétones aliphatiques, tes aldéhydes vinyliques -chlorés correspondants peuvent être obtenus sous forme d'isomères E et Z. détermination de la structure des aldéhydes obtenus a été réalisée par RMN/ nous conduit aux observations suivantes.
Dans le cas de La t-butyLmëthyLeétone
et de L'aeétophënone on
obtient
wt seuL isomèv'e. En effet la présence drun seul doublet pour le
proton aldéhydique (ou Ie proton éthylénique)
pour chacun de ces composés
p r o u v e I'existence
d ' u n s e u l i s o m è r e de type E ou Z. La différence notable
( o , 3 5 p p m ) e n t r e l e s A t ScHo- 5H^**...,^-*-..^) (3,75 ppm et 3,4o ppm), pour ces
eEnylenrque
deux aldéhydes I et 2, nous incite
à leur attribuer
une strucEure z,
A La
e t
6 = lzopp* (s)
\
tc4Hg
\
/ " : '
c l
$ - s , z S p p m
( d )
H
/
" " r " " o
z 6 , 5 H 2
cHo
\ '
5 = g , 5 o p p r n ( d )
6 = z p p m 1 m ; 6 = 7 , , 3 p p m (m ) $ = 6 , 2 5 p p m ( d )
\,^
I
f(.-y;'"
I
\-\ ,/H-T
\
e_- c/
JH,cHo
z6FHz
H a
/
\ " n o
c l
à , . r n n *
( d )
?
I
re proton éthyténique dans Ie cas du chloro-3 phényl-3 ène -2 propanal ? s u b i s s a n t l r e f f e t d é b l i n d a n t d u n o y a u a r o m a t i q u e . D a n s l e c a s d e s i s o m è r e s E , Itenvironnement de ce proton seraiÈ pratiquement identique dans les deux a l d é h y d e s .
Nous avons cherché à confirmer cette hypothèse par effet Overhauserl
*
Qoe Monsieur le Professeur DELPUECH et Monsieur NICOLE Assistant, de la Faculté des Sciences de Nancy I, trouvent ici nos remerciements pour Ia réalisation de cette détermination / mesures effectuées sur appareil BRUKER HX 90 7.
- cas de l'aldéhyde vinylique
fi -chLoré 2
Lrirradiation des protons Ha provoque une augrmentation
dfintensité du doublet correspondant au proton éthylénique drenviron IO Zl sans altérer le si-gnal du proton aldéhydique. Ceci confirme notre hypothèse précédente et la structure Z proposée.
- cas de l'aldéhyde v i n y l i q u e B - c h l o r é I Lrirradiation du groupement
abutyre provoque à la fois une augmentation d'intensité des signaux respectifs aux protons éthylénique et aldéhydique. De même I'irradiation du proton éthylénique ou du proton aldéhydique, provoque une augrmentation d'intensité du signal du radical ,butyre. Les résultats ne sont pas concluants, nous les attribuons à I ' e n c o m b r e m e n t s p a t i a l d e c e r a d i c a l . P a r a n a l o g i e a v e c I e c a s p r é c é d e n t , nous proposons donc une structure Z pour ce produit.
Dans le cas de ta désoæybenzoine, la réaction nous a conduit de
m ê m e à u n s e u L i
s o m e r e ( à " * o = 9 , 1 7 p p m ( s ) s o l v a n È c c r 4 ) F : 1 4 7 0 . L e s
'
'
d e u x i s o m è r e s p o s s i b l e s F : B2o et F : 147o ont par contre été obtenus par
( 64fl
M . W E T S S E N F E L S ' - - - ' dans les proportions respectives de 17 et 83 B.
Compte tenu de leurs propriétés
spectrographiques
UV et surtout
R M N ' c e d e r n i e r a attribué
à l r i s o m è r e F : 82" la structvre z et à I'isomère
F : I 4 7 " l a s t r u c t u r e E .
/
t ,
t o , 4 6 p p m l s )
E : B 2 o
" 6 " 5
- - \
c - H
. / - u - - u
C = C .c*o/
\,.
X o,.* : 298 nm
î' t 7250"e"s
I
5 , g , s s p p n ( s i
F = t 4 7 o
C=C ,/ CHC I
\ c H
-o f ,E
\ *"*
: 283 nm
t : 9028
D e u x critères
sont en faveur de ce choix : - analogie avec les valeursd t e x t i n c t i o n d e s c i s e t t r a n s s t i l b è n e s stilbène Ç- z 29cJOO) r e l a t i v e s d e s c o e f f i c i e n t s c i s s t i l b è n e L , 1 O 4 5 O t r a n s q
I
- en RMN, le déplacement chimique du proton ardéhydique est plus éIevé dans Ia forme cis que dans la forme trans. Ceci serait dû à l r e f f e t p a r a m a g n é t i q u e d e l r a t o m e d r h a l o g è n e s u r l e p r o t o n a l d é h y d i q u e .
P o u r n o t r e p a r t I ' o b t e n t i o n d e I ' i s o m è r e E e s t p r a t i q u e m e n t u n i t a i r e , I ' i s o m è r e Z n r a y a n t p u ê t r e d é c e l é p a r l e s p e c t r e R M N é t a b 1 j - s u r l e p r o d u i t b r u t a v a n t r e c r i s t a l l i s a t i o n .
Avec la butanone-Z, la chloroformylation a déjà été effectuée par ( 6 4 c )
A R N O L D e t c o l l . ' - - " e t l e s a c o n d u i t a u c h l o r o - 2 f o r m y l - 3 b u t è n e - 2 4 a d e f a ç o n p r é p o n d é r a n t e , l e c h r o r o - 3 è n e - 2 p e n t a n a l 4 b n ' é t a n t d é c e r é q u r à 1 ' é t a t d e t r a c e s .
P o u r n o t r e p a r t r c e d e r n i e r n t a m ê m e p a s p u ê t r e m i s e n é v i d e n c e (absence de groupement éthyle en RMN). Par contre Ia présence drun mélange de deux chloro-2 formyl-3 butène-2, A et B/ apparaît sur le spectre de RMN.
Spectre Rlilli : CCl,
" " 3
\
""o
+
c 1
. * ,
\ " /
ll
t l
c
I
,4
c
_-___{__-r+_ff - 51 9,V
ç*
il^l
!u
l
'1 Hæ/Y",
2r71' tlr
Nous donnerons I r a \
e t t r a n s ' o o
'
: i s o m è r e c i s
I , 5 9 + o , o 3 H z .
I s o m è r e A ( 3 3 t 19 , 6 5 p p m
2 , 2 7 p p m
1 , 7 O p p m
f s o m è r e B ( 6 6 z )
9 , 5 O p p m
2 , 5 p p m ( q u a r t e t )
1 , 8 p p m ( q u a r t e t )
5 : c H o
5: cH,
5: cu,
(quartet) (quartet)t' cHo
5: CH,
f,: CH,
r c H r ,
c H , (
r H z
L r a L r : r i b u t i o n
d e I a
e t t r a n s à I ' i s o m è r e B ( " a " r r " " ,
constante de couplage 5,
t c H ,
, c H ,
" " r r r , " n , r \
r , 4 H z
s t r u c t u r e c i s à I ' i s o m è r e o , " " n r , C " : (
I H z )
/ \ - I,4 Hz\ est basée sur la valeur de la
h o n o a L L y L i q u e . r r e s t b i e n c o n n v ( 6 6 ' 6 7
)
que si cette constante est faible dans les deux cas elle permet pourtant I ' i d e n t i f i c a t i o n d e s d e u x i s o m è r e s c o m p t e t e n u d e : à t i t r e d r e x e m p l e l e c a s .1 ' C H . r C H - = I r 1 2 + O , O 4 H z ' 5 J
des bromo-2 butènes cis
i s o m è r e t r a n s JcH^rcH-=
J J
L r o b t e n t i o n d ' i s o m è r e s E e E z e n q u a n t i t é v a r i a b l e s e l o n l a nature de la cétone de départ, nous amènent à faire quelques cornrnentaires s u r I e m é c a n i s m e r é a c t i o n n e l .
D r a p r è s l e m é c a n i s m e g é n é r a l e m e n t . a r i = ( 5 9 ) I a r é a c t i o n d e forTnglation de VLLSMETER, en présence de Pocl3-DMF se fait svr LLn composé possédant un site rntelëophiLe aetioé f-pu, exemple par un groupement D d o n n e u r d ' é l e c t r o n s ( e f f e t + M ) d a n s l e c a s d u n o y a u b e n z é n i q u e 7et procède selon le schéma .suivant :
( 6 e )
Schéma 17 : Formylation selon VILSMEIER
c H ^
J îH- - - 3
.'c H ^
"rr/
N-CHO + POC13L ""3
1
I
/ o - P c L 3
+ /
" \ n _
H [ "", .--- +I z*-"
L
F", I
I \^'_a
1""(
o
I
, - 1o-Pct- |
| 5 l + t l N = Q I \ l\ H l
- c I
o
t l
/ o-PcL,
,/
Ho
t l
. o P c l ^
, / z
I
,l*
"'
-t
I
t
-l c r
l
\ , ,
hvdrolvseo
IL r i n t e r m é d i a i r e
c l é e s t l e carbocation
" " 3 _ _ _ * a O - b C t r .
- N C-cï.r/
\"
3Àctuellement la plupart des auteurs font intervenir le carbocation c H ^ c l
'--*-t-
qui dérive aisément du précédent par départ de opoCl.. C n : - " " \ H z J D
I
a\
V
cHo
l-"J
La structure du carbocaÈion du type (I) (X_Cl) par spectroscopie infrarouge, ainsi que celle des composés q u i e n d é r i v e n t ( X = - B r , - I ) .
""3
I
l*(
f""'..
.Qz
I N-C1.,,' \
,/l
\"J
( r )
Dans Le eas des cétones, substrats ne présentant pas de site nucléophile particulièrement activé dans les conditions de la réaction, I'utilisation du mélange Pocl3-DMF conduj.t généralement à la réaction
de ehloTofonmylation. Toutefois, selon les conditions expérimentales,
ra structure de la cétone, la réacti-on peut évoluer vers Ia formylation et d o n n e r l i e u à d e s r € a c t i o n s s e c o n d a i r e s ( c y c r i s a t i o n p a r e x . ).
La ehLoroforrnyLation a êEé particurièrement étudiée ( 6 4 d ) e t c o l l . ' : d e u x t y p e s d r i n t e r m é d i a i r e s r é a c t i o n n e l s ( I ) e t m i s e n é v i d e n c e . par Z. ARNOLD ( I I ) o n t é t é a été confirmée analogues suivants
\o*
" ^ (
"l
It
-l x
--J
X : C l , B r , T( r )
sur
Le deuxième adduct I r i n t e r m é d i a i r e ( I ) ( X = I )i s o l é résulte
en présence de
d e l f a c t i o n d e I ' a c é t o p h é n o n e N a c l o 4 .S c h é m a 1 8
( r )
X = ïcocH3
ç
-cH
( I I )*l"
: N _- cH3
1 6 3 0
C r O
- C H F : S c h é m a 1 9 :( 1 )
( 2 )
cUHU-i=cH,
OHl
'"{
l+
I N=CHCll Yl c H {
|
4 " ( r ) * hydrolyse = CH-CHO[
+
f"t-f
| "ons-F-cH2-cH-N
Y I
Lo'J"'[r\"rJ
tlwt
CUHU-f=cH-cH=Nl
èr
"n3
+ 'zo
( r r 1
I
I
I
I t .Y
c 6 H 5 - c ( c l )
NaOAcI /
( 6 4 e ) Très récemment, à partir de lracétophénone, PULST et !ùEISSENFELS ont proposé le mécanisme ci-dessous dans lequel interviennenÈ effectivement l e s i n t e r m é d i a i r e s ( I ) e t ( I I ) .I r )
\-/,..
tc---i3H cHo
instable
S y n t h è s e d e I ' a l d é h y d e v i n y l i q u e ô - c h t o r é d e I ' a c é t o p h é n o n e - Mécanisme réactionnelc6Hs-fi-cH3
o
coHs-;=cn,
OH( 3 )
__---_--->
( 4 )
Y =ClS i d e n o m b r e u s e s synthès€ o n t é t é e f f e c t u é e s p o u r l a c h l o r o f o r m y l a t i o n d e s c é t o n e s a l i p h a t i q u e s ( 6 4 ) , a l c o y r a r y l i q u e s ( 6 4 ) ,
t / ^ \ ( 7 c ) / " 1 \
c y c r a n i q u ê s t o * ' , s t é r o i d i q u e s \ e c n e c e r o c y c r i q u e s \ l r ) , p e u d ' é t u d e s systématiques ne semblent avoir été faites sur Ia stéréochimie des aldéhydes
t )
-v i n y l i q u e s
/ J - c h l o r é s o b t e n u s . s i g n a l o n s t o u t e f o i s , à p a r t r e c a s
p r é c é d e m m e n t c i t é de la d.ésoxybenroi.rr"(64f), les travaux de scHULzE et colr.(72 1 consacrés à la stéréochimie des p -tfriocyanate-vinyladéhydes obtenus à
p a r t i r d e s d é r i v é s c h l o r o f o r m y l é s c o r r e s p o n d a n t s .
Ayant observé la variation des pourcentages des isomères E eE Z des dérivés chloroformylés selon la nature de la cétone de départ, nous avons é t é t o u t p a r t i c u l i è r e m e n t i n t é r e s s é s p a r I ' a s p e c t s t é r é o c h i m i q u e d e I a r é a c t i o n de chloroformylation dès le début de ce travail. ParallèIement aux travaux
( 6 4 e )
cltês , nous avons été amenés à rechercher un mécanisme réactionnel rendant compte de ces observations.
L e m é c a n i s m e p r o p o s é e s t d a n s ses premiers s t a d e s , i d e n t i q u e à c e l u i d e P U L S T e t c o l l . e t f a i t i n t e r v e n i r I ' é n o l i s a È i - o n d e l a c é t o n e d e d é p a r t .