MINISTERE DE L’ENSEIGNEMENT SUPERIEUR ET DE LA RECHERCHE SCIENTIFIQUE UNIVERSITE AKLI MOHAND OULHADJ – BOUIRA -
FACULTE DES SCIENCES DE LA NATURE ET DE LA VIE ET DES SCIENCES DE LA TERRE DEPARTEMENT DE BIOLOGIE
Réf : ……./UAMOB/F.SNV.ST/DEP.BIO/2017
MEMOIRE DE FIN D’ETUDES
EN VUE DE L’OBTENTION DU DIPLOME MASTER
Domaine : SNV Filière : Sciences Biologiques
Spécialité : Eau, santé et environnement
Présenté par :
Mlle. ALIOUANE Soumia
Mlle. DERRICHE Soumia
Thème
Etude de l’élimination des colorants par adsorption sur une biomasse locale (Noyaux de jujube)
Soutenu le :
01 / 07 / 2017Devant le jury composé de :
Nom et Prénom Grade
Mr. TAFER.Mourad MAA Univ. de Bouira Président Mr. MOUNI.Lotfi MCA Univ. de Bouira Promoteur Mme. AIMEUR.Nacira Mme.BOUCHELKIA.Nasma MAA Doctorante Univ. de Bouira Univ de Bouira Examinatrice Co-promotrice
Année Universitaire : 2016/2017
Remerciement
Tous d’abord nous remercions notre Grand DIEU de nous Avoir Guidé et Donné le
courage et la force d’accomplir ce modeste travail.
Nous remerciements spéciaux vont au docteur MOUNI L. notre encadreur de
mémoire pour sa gentillesse et ses conseils.
Notre dette est également grande vis à vis de notre promotrice Mme
BOUCHELKIA Nasma par son assistance et par ces précieux conseils qui nous ont
permis d’achever ce modeste mémoire.
Nous tenons à remercier Monsieur TAFER M .de nous avoir fait le grand honneur
d'accepter la présidence du jury, qu'il trouve ici l'expression de notre profond
respect.
Un grand merci également à Mme AIMEUR N .qui a bien voulu faire partie du
jury et d'apporter sa vive contribution à l'enrichissement de ce travail par ses
commentaires constructifs.
Nos sincères remerciements à Mme BOUTAREN Saida doctorante à université de
Bouira pour son aide, ses conseils et ses encouragements et à tous les membres de
laboratoire de recherche (GVRNAQ), chercheurs et ingénieurs avec qui nous avons eu
le plaisir de travailler.
Nous voulons également exprimer notre reconnaissance à tous ceux et celles qui
nous ont soutenus, avec néanmoins une mention tout à fait particulière à nos chers
parents;
Nous tenons à remercier tous ceux et celles qui ont contribués d’une manière ou
d’une autre à la réalisation de ce travail, a eux tous et toutes, on leurs dis merci du
fond du cœur. Merci
Dédicaces
SOUMIA .D
A la mémoire de mon cher père qui est toujours présent dans mon cœur
A la chandelle de ma vie, ma très chère mère qui m’a beaucoup encouragée
A mes chers frères et sœurs,
A tous mes amis, et à tous ceux qui sont proches de mon cœur et dont je n’ai pas
cité le nom
A tous ceux qui m’ont encouragée tout au long de mes études.
SOUMIA .A
A mes chers parents, source de tendresse, de noblesse et d’affectation.
A mes sœurs et mes frères et à tous les membres de ma famille
A tous mes amis et a tous ceux et celles qui me sont chers
Avec toute mon affection
Sommaire
Introduction ……….
1Synthèse bibliographique
Chapitre I : Généralités sur les colorants
I--Introduction 2
I-1--Définition des colorants 2
I-2-l’origine des colorants 3
I-3-Classification des colorants 3
I-3-1-classification chimique 4
I-3-2-classification tinctoriale 4
I-4-Application des Colorants 6
I-5-Toxicité et impact environnemental 6
I-6-Procédés de traitements des colorants 7
I- 6 .1.Méthode physico-chimique: coagulation – floculation 7
I-6 .2.Méthodes chimiques 8
I- 6.3. Méthodes physiques 8
I-6-3-1-Filtration sur membrane 7
I-6-3-2-Adsorption sur charbon actif et déchets végétaux 7
Chapitre II : Procédés d’adsorption et les adsorbants
II-Introduction 9
II-1-Définition et intérêt de l’adsorption 9
II-2-Types d’adsorption 9
II- 2.1. L’adsorption physique 9
10 II-2.2. L’adsorption chimique
II-3-.Le mécanisme d'adsorption d’un colorant 10
II-5- Isothermes d’adsorption 11
II-5-1-modélisation des isothermes d’adsorption 13
A/ Isotherme d’adsorption de LANGMUIR 14
B/ Isotherme d’adsorption de FREUNDLICH 14
II-6-La cinétique d’adsorption 15
II-6-1- Modèle de la cinétique du pseudo premier ordre 16 II-6-2-Modèle de la cinétique du pseudo seconde ordre : 16
II-7- les adsorbants 17
II-8-Exemple d’adsorbants végétaux « Le jujube » 19 II-9-méthodes de caractérisation des adsorbants végétaux 19
Chapitre 3 : Matériels et méthodes
III-Introduction 20
III-1-Méthodologie utilisées dans la préparation et la caractérisation des noyaux
de jujube 20
III-1-1-Caractérisation physico-chimique du jujube étudié 21
III-1-1-1- Le taux d’humidité 21
III-1-1-2- La masse volumique apparente 21
III-1-1-3- La masse volumique réelle 21
III-1-1-4- Le taux de cendre 21
III1-1-2Caractérisation physiques : 22
Diffraction des rayons X (DRX) 22 Spectroscopie Infra-Rouge (IR) 22
III-1-3-Caractérisation chimiques : 23
Détermination du pH charge point zéro (pHPZC) 23
III-2-Méthodologie d’analyse du colorant étudié : le Rouge Congo 24
III-2-1- Présentation des colorants 24
III-2-2- Préparation des solutions synthétique du colorant 25 III-2-3-Préparation des solutions filles à partir de la solution mère : 25 III-2-4-Analyses du RC par spectrophotométrie dans le visible 25 III-2-5-Essais d’adsorption du RC sur les noyaux de jujube 26
Chapitre 4 : Résultat et discussion
IV-Introduction : 28
IV-1-Caractérisation des noyaux de jujube étudiés : 28
IV-1-1-Caractérisation physico-chimique du jujube étudié : 28
IV-1-2-Caractérisation physiques : 28
Diffraction des rayons X (DRX) 28 Spectroscopie Infrarouge (IR) 29
IV-1-3-Caractérisation chimiques : 31
Détermination du pH charge point zéro (pHPZC) 31
IV-2- Résultats d’analyse de colorant 31
IV-3-Résultats des essais d’adsorption 32
IV-3-1-Effet du temps de contact 32
IV-3-2-Effet de la masse d’adsorbant 34
IV-3-3-Effet du pH initial de la solution 34
IV-3-4-Effet de la taille des particules de l’adsorbant 35
IV-4- modélisation de la cinétique d’adsorption 36
IV-4-1- Modèle de pseudo-premier ordre 36
IV-4-2-Modèle de pseudo-second ordre 38
IV-5-Les isothermes d’adsorption 39
IV-5-1 La modélisation des isothermes d’adsorption 40
IV-5-1-1- Le modèle de Langmuir 40
IV-5-1-2 Le modèle de Freundlich 41
Conclusion 42
Liste des figures
Figure 23 : Effet du temps de contact sur la quantité du colorant
adsorbée sur le jujube 33
Figure 24 : Effet du temps de contact sur la quantité du colorant adsorbée sur le charbon commercial 33
Figure 25: Effet de la masse d’adsorbant sur le taux d’élimination du colorant 34
Figures pages
Figure 1: Structure moléculaire d’un colorant azoïque 4Figure 2: formule développée du Bleu Capri 4
Figure 3 : Structure moléculaire du colorant rouge Congo 5 Figure 4 : Structure moléculaire d’un colorant à mordant 5
Figure 5 : Structure moléculaire d’un Colorant de cuve 5
Figure 6: Structure moléculaire d’un colorant direct 6
Figure 7: Etapes de transfert d’un soluté lors de son adsorption 11
Figure 8: Classification des isothermes d’adsorption selon Giles et al 12
Figure 9 : Isotherme d’adsorption de LANGMUIR 14
Figure 10 : Isotherme d’adsorption de FREUNDLICH 15
Figure 11: Adsorption sur une particule de charbon actif 18
Figure 12 : Jujubier lotus L à gauche et son fruit à droite 19 Figure 13: Aire de répartition du zizyphus lotus L en Algérie 20
Figure 14: Le jujube obtenu après broyage et tamisage 20
Figure 15: Principe de la loi de Wulff-Bragg 22
Figure 16 : La solution mère préparée 25
Figure 17: spectrophotomètre UV/visible type (SP-3000nano) 26
Figure18: Diagramme de diffraction des rayons X du jujube préparée 28
Figure 19: Diagramme de diffraction des rayons X du charbon commercial 29
Figure 20 : Spectre infrarouge des deux adsorbants utilisés 29
Figure 21: Détermination du pH charge nulle des deux adsorbants utilisés. 31
Liste des figures
Figure 26 : Effet du pH sur le taux d’élimination du colorant 35 Figure 27: Effet de la taille des particules sur le taux d’élimination
du colorant 36
Figure 28: Cinétique d’adsorption du RC sur les deux adsorbants:
modèle de pseudo-premier ordre. 37
Figure 29 : Cinétique d’adsorption du RC sur les deux adsorbants:
modèle de pseudo-second ordre. 38
Figure 30 : Isothermes d’adsorption de RC sur les deux adsorbants 40 Figure 31 : Application du modèle de Langmuir à l’adsorption de RC
sur les deux adsorbants. 40
Figure 32 : application du modèle de Freundlich pour l’adsorption
Liste des tableaux
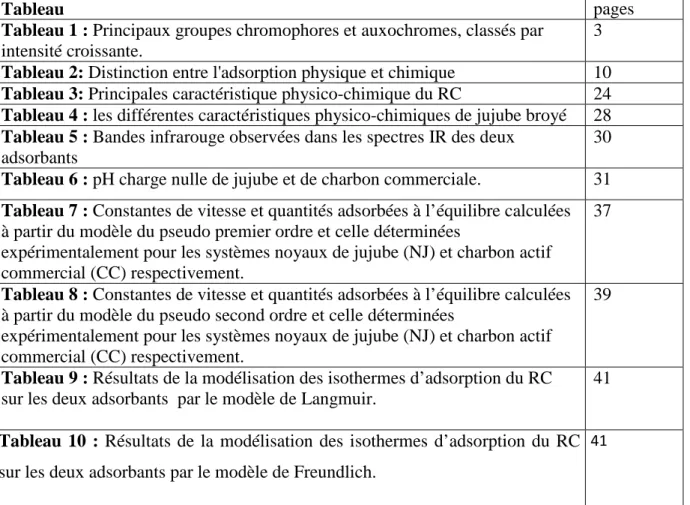
Tableau pages
Tableau 1 : Principaux groupes chromophores et auxochromes, classés par
intensité croissante. 3
Tableau 2: Distinction entre l'adsorption physique et chimique 10
Tableau 3: Principales caractéristique physico-chimique du RC 24
Tableau 4 : les différentes caractéristiques physico-chimiques de jujube broyé 28
Tableau 5 : Bandes infrarouge observées dans les spectres IR des deux
adsorbants
30
Tableau 6 : pH charge nulle de jujube et de charbon commerciale. 31
Tableau 7 : Constantes de vitesse et quantités adsorbées à l’équilibre calculées
à partir du modèle du pseudo premier ordre et celle déterminées
expérimentalement pour les systèmes noyaux de jujube (NJ) et charbon actif commercial (CC) respectivement.
37
Tableau 8 : Constantes de vitesse et quantités adsorbées à l’équilibre calculées
à partir du modèle du pseudo second ordre et celle déterminées
expérimentalement pour les systèmes noyaux de jujube (NJ) et charbon actif commercial (CC) respectivement.
39
Tableau 9 : Résultats de la modélisation des isothermes d’adsorption du RC
sur les deux adsorbants par le modèle de Langmuir.
41
Tableau 10 : Résultats de la modélisation des isothermes d’adsorption du RC
sur les deux adsorbants par le modèle de Freundlich.
Liste des abréviations
Abréviation
D
éfinitionρapp
ρréel
Masse volumique apparente Masse volumique réelle CA CC Charbon actif charbon commercial DRX Diffraction de Rayon X IR Spectroscopie infrarouge MIR NJ Infra-Rouge Moyen Noyaux de jujube pH Potentiel d’hydrogène
pHPZC Potentiel d’hydrogène au point de charge zéro
PIR Infra-Rouge proche
Introduction générale
1 L'eau est l'élément central de tous les processus socio-économiques, quel que soit le degré de développement de la société. L'augmentation des activités industrielles engendre une pression grandissante sur les réserves en eau douce de la planète. En effet, ces activités génèrent une grande diversité de produits chimiques qui se déversent dans le cycle de l'eau, mettant en péril le fragile équilibre naturel qui a permis à la vie de se développer sur la terre [1].
L’utilisation accrue de certains produits chimiques d’origine industrielle (colorants, détergents, hydrocarbures, pesticides) est à la base de nombreux cas de pollution des eaux, des sols, de l’air ou d’intoxication accidentelles ou volontaires, et, suscite à l’heure actuelle une attention particulière à l’échelle mondiale [2].
Parmi les industries qui engendrent une pollution importante, l’industrie textile dont les rejets sont surtout chargés en colorants [3] et constituent d’énormes nuisances pour la santé humaine et pour l’environnement. En fait, les différents colorants utilisés causent de sérieux problèmes en raison de leur stabilité et de leur faible biodégradabilité. Ainsi, il est nécessaire de traiter ces rejets avant qu’ils soient déversés dans le réseau d’assainissement [4].
De nombreux scientifiques de différentes disciplines s’intéressent, de plus en plus, à l’identification et à l’élimination des polluants de l’environnement. A cet effet, on recourt souvent à l’adsorption [9]. Notre travail s’inscrit dans cette optique. Il porte sur la valorisation des noyaux de jujube (Zizyphus jujuba lotus) comme adsorbant dans l’élimination des colorants.
L’objet de ce travail est, dans un premier temps, de caractériser l’adsorbant. Dans un deuxième temps, d’étudier l’adsorption de colorant rouge Congo tout en focalisant notre intérêt sur les facteurs qui ont grande influence sur le phénomène en question pour élucider son mécanisme.
Le développement de ce mémoire est articulé autour de deux grandes parties :
Une première partie intitulée « Synthèse bibliographique », subdivisée en deux principaux chapitres:
1- Le chapitre I est consacré à une étude bibliographique sur les colorants, leur classification et leur impact environnemental, puis il sera présenté une synthèse bibliographique sur les méthodes de traitement des eaux usées contaminées par les colorants de textile.
2- Dans le deuxième chapitre, nous avons décrit le processus d’adsorption, ces différents types, son mécanisme et sa cinétique ; les paramètres intervenant dans ce processus ont également été cités. Nous avons consacré une partie à d’adsorption, comme nous avons expliqué les divers adsorbants utilisés industriellement
La deuxième grande partie intitulée « étude expérimentale », dans laquelle sont présentés les résultats relatifs à:
La caractérisation du matériau utilisé.
Les essais d’adsorption des colorants sur les noyaux de jujube.
Les essais d’adsorption des colorants sur le charbon actif commercial.
Enfin le travail se termine par une conclusion générale résumant les principaux résultats trouvés.
Partie
Chapitre I :
Généralités sur les
colorants
Partie théorique Généralités sur les colorants
I-INTRODUCTION :
Le développement considérable des activités industrielles permettant de répondre aux besoins de notre société, s’accompagne inévitablement d’un accroissement important des rejets polluants. De nombreuses industries (textile, papeterie, plastique, agroalimentaire…) sont de gros consommateurs d’eau et utilisent des colorants organiques (solubles ou pigmentaires) pour colorer leurs produits. Ces colorants sont à la fois toxiques et responsables de la coloration des eaux.
La majorité de ces colorants ne sont pas biodégradables et peuvent constituer des facteurs de risques pour notre santé et de nuisances pour notre environnement. Il est donc primordial de limiter le plus possible la pollution en mettant en place un procédé de traitement adapté [5].
I-1-Définition des colorants :
Un colorant est défini comme étant un produit capable de teindre une substance d’une manière durable. Il possède des groupements qui lui confèrent la couleur: appelés chromophores et des groupements qui permettent sa fixation, auxochromes [6].
Le chromophore : désigne le groupement d’atomes au sein de la molécule responsable de sa faculté d’absorption dans l’UV/visible. Il est constitué en général d’un groupement d’atomes présentant des doubles liaisons chimiques. Les électrons des liaisons moléculaires sont capables d’absorber certaines radiations visibles.
L’auxochrome : est la partie ayant la capacité d’enrichir ou d’appauvrir le chromophore en électrons. De ce fait, il peut modifier la longueur d’onde (donc la couleur) de la radiation a7bsorbée par le groupement chromophore et/ou modifier l’intensité de l’absorption. De plus, il permet de fixer avec efficacité le colorant souhaité sur le support et peut améliorer la solubilité du colorant (tel que -COOH, -SO3H...) [7].
Les matières colorantes se caractérisent par leur capacité à absorber les rayonnements lumineux dans le spectre visible (de 380 à 750 nm). La transformation de la lumière blanche en lumière colorée par réflexion sur un corps, ou par transmission ou diffusion, résulte de l'absorption sélective d'énergie par certains groupes d'atomes (chromophores) [8].
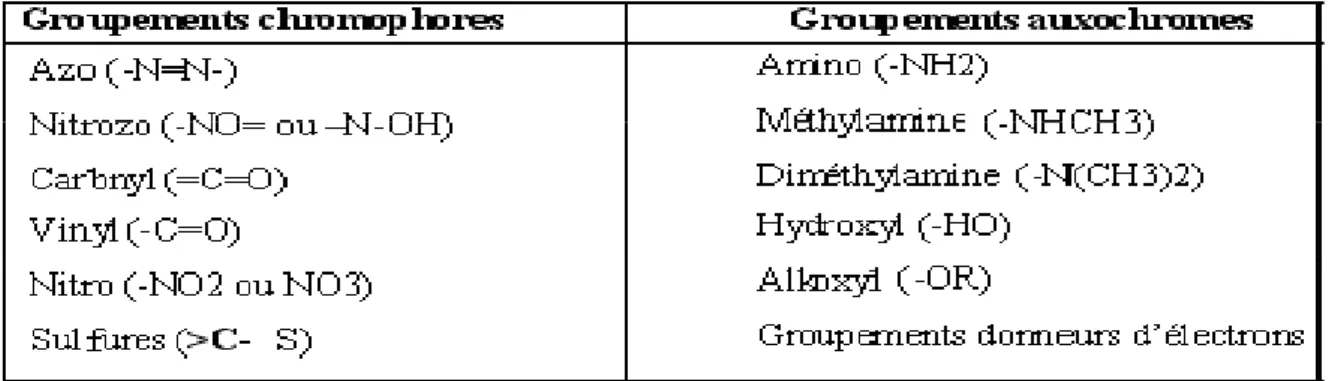
La molécule colorante est un chromogène. Plus le groupement chromophore donne facilement un électron, plus la couleur est intense. (Tableau1 représente les groupes chromophores et auxochromes classés par intensité croissante) [8].
Partie théorique Généralités sur les colorants
3
Tableau 1 : Principaux groupes chromophores et auxochromes, classés par intensité croissante.
[3]
I-2-l’origine des colorants :
Tous les colorants sont issus de 5 matières premières fondamentales, benzène, toluène, xylène, naphtalène et anthracène, initialement toutes extraites de la houille [3]
Depuis le début de l’humanité, les colorants ont été appliqués dans pratiquement toutes les sphères de notre vie quotidienne pour la peinture et la teinture du papier, de la peau et des vêtements…etc. Jusqu’à la moitié du 19èmesiècle, les colorants appliqués étaient d’origine naturelle. Des pigments inorganiques tels que l’oxyde de manganèse, l’hématite et l’ancre étaient utilisés. Par ailleurs, des colorants naturels organiques ont été appliqués, surtout dans l’industrie de textile. Ces colorants sont tous des composés aromatiques qui proviennent essentiellement des plantes, tel que l’alizarine et l’indigo. L’industrie des colorants synthétiques est née en 1856 quand le chimiste anglais W. H. Perkin, dans une tentative de synthèse de la quinine artificielle pour soigner la malaria a obtenu la première matière colorante synthétique qu’il appela "mauve" (aniline, colorant basique).Au début du 20ème siècle, les colorants synthétiques ont presque complètement supplantés les colorants naturels [9].
I-3-Classification des colorants :
On peut classer les colorants selon deux points de vue différents Chimique : qui intéresse surtout le fabricant de matière colorante.
Tinctoriale : par domaine d’application ; utilisé par le teinturier (textiles, papier, cuir, matières plastiques, etc.)
Partie théorique Généralités sur les colorants
Le classement des colorants selon leur structure chimique repose sur la n
groupement chromophore [3], qui constitue le squelette nécessaire à la coloration de la molécule [7]
Les colorants azoïques, anthraquinoniques, et polyméthiniques sont parmi les plus
aussi Les colorants du diphénylméthane, du triphénylméthane, les phtalocyanines, les colorants indigoïdes et les colorants du soufre sont aussi d’autres familles chimiques
I-3-1-1- Les colorants azoïques
Sont caractérisés par la présence au sein de la molécule d'un groupement azoïque (
reliant deux noyaux benzéniques. Cette catégorie de colorant est actuellement la plus répandue sur le plan de l’application, puisqu’ils représentent plus de 50% de la production mondiale de matières colorantes [9]
Figure 1 : Structure moléculaire d’un
I-3-2-classification tinctoriale
Si la classification chimique présente un intérêt pour le fabricant de matières colorantes, le teinturier préfère le classement par
solubilité du colorant dans le bain de teinture, son affinité pour les diverses fibres et sur la nature de la fixation. [7]
On distingue différentes catégories tinctoriales définies cette fois par les
I-3-2-1- Les colorants basiques ou cationiques
Les colorants basiques sont des sels de composés présentant des groupes amino
imino(=NH). Les liaisons se font entre les sites cationiques des colorants et les sites anioniques des fibres. Comme exemple de colorant basique fournissant des teinte
Capri (figure 2) [10]
Figure 2
Partie théorique Généralités sur les colorants
colorants selon leur structure chimique repose sur la n
qui constitue le squelette nécessaire à la coloration de la molécule
Les colorants azoïques, anthraquinoniques, et polyméthiniques sont parmi les plus
aussi Les colorants du diphénylméthane, du triphénylméthane, les phtalocyanines, les colorants indigoïdes et les colorants du soufre sont aussi d’autres familles chimiques [10
Les colorants azoïques :
résence au sein de la molécule d'un groupement azoïque (
reliant deux noyaux benzéniques. Cette catégorie de colorant est actuellement la plus répandue sur le plan de l’application, puisqu’ils représentent plus de 50% de la production mondiale de
Structure moléculaire d’un colorant azoïque [9
:
Si la classification chimique présente un intérêt pour le fabricant de matières colorantes, le teinturier préfère le classement par domaines d’application. Ainsi, il est renseigné sur la solubilité du colorant dans le bain de teinture, son affinité pour les diverses fibres et sur la nature
On distingue différentes catégories tinctoriales définies cette fois par les auxochromes
Les colorants basiques ou cationiques
Les colorants basiques sont des sels de composés présentant des groupes amino
Les liaisons se font entre les sites cationiques des colorants et les sites anioniques Comme exemple de colorant basique fournissant des teintes très brillantes,
Figure 2 : formule développée du Bleu Capri. [10]
Partie théorique Généralités sur les colorants
colorants selon leur structure chimique repose sur la nature du qui constitue le squelette nécessaire à la coloration de la molécule
Les colorants azoïques, anthraquinoniques, et polyméthiniques sont parmi les plus utilisés.il y’a aussi Les colorants du diphénylméthane, du triphénylméthane, les phtalocyanines, les colorants
[10].
résence au sein de la molécule d'un groupement azoïque (-N=N-) reliant deux noyaux benzéniques. Cette catégorie de colorant est actuellement la plus répandue sur le plan de l’application, puisqu’ils représentent plus de 50% de la production mondiale de
[9]
Si la classification chimique présente un intérêt pour le fabricant de matières colorantes, le Ainsi, il est renseigné sur la solubilité du colorant dans le bain de teinture, son affinité pour les diverses fibres et sur la nature
auxochromes [9].
Les colorants basiques sont des sels de composés présentant des groupes amino(–NH2)ou
Les liaisons se font entre les sites cationiques des colorants et les sites anioniques s très brillantes, le Bleu
Partie théorique Généralités sur les colorants
5
I-3-2-2-Les colorants acides ou anioniques
Les colorants acides sont des molécules organiques qui présentent des groupes sulfonâtes NaSO3-ou carboxylates NaCOO- [10]. Solubles dans l’eau, ils sont ainsi dénommés parce qu’ils
permettent de teindre les fibres animales (laine et soie) et quelques fibres acryliques modifiées (nylon, polyamide) en bain légèrement acide [11]. L’affinité colorant-fibre est le résultat de liaisons ioniques entre la partie acide sulfonique du colorant et les groupements amino des fibres textiles [12].
Comme élément représentatif de cette famille, on peut citer le rouge Congo (Figure 3) [10].
Figure 3 : Structure moléculaire du colorant rouge Congo [20] I-3-2-3-Les colorants à mordants :
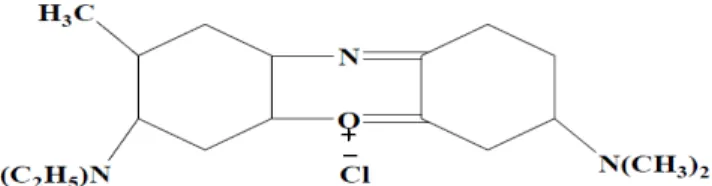
Les colorants à mordants contiennent généralement un ligand fonctionnel capable de réagir fortement avec un sel d’aluminium, de chrome, de cobalt, de cuivre, de nickel ou de fer pour donner différents complexes colorés avec le textile. [9]
Figure 4 : Structure moléculaire d’un colorant à mordant [9]
I-3-2-4-Les colorants de cuve
Les colorants de cuve sont des colorants insolubles dans l’eau, appliqués sur la fibre après transformation par réduction alcaline en leucodérivés [13].
Partie théorique Généralités sur les colorants
I-3-2-5-Les colorants directs
Les colorants directs (également appelés substantifs), tout comme les colorants acides, sont solubles dans l’eau, du fait de la présence de groupes sulfonâtes [9]. Les colorants directs contiennent ou sont capables de former des charges positives ou négatives électrostatiquement attirées par les charges des fibres [13].
Figure 6 : Structure moléculaire d’un colorant direct [9]
I-4-Application des colorants :
Les colorants présentent de nombreuses applications dans différents domaines, dont voici quelques-unes essentielles:
- Teinture et impression sur fibre et tissus de tous genres ; - Teinture du bain de filage des fibres chimiques ;
- Teinture du cuir et des fourrures, du papier et du parchemin, des feuilles et des plastiques ; - Colorants pour toutes les techniques de la peinture ;
- Préparation des couleurs à la chaux pour les pré-colorations et enduits sur bâtiments ; - Colorants pour l’impression des papiers peints et préparation des encres ;
- Colorations des denrées alimentaires, des emplois médicinaux et cosmétiques [9].
I-5-Toxicité et impact environnemental :
Les colorants sont des composés difficilement biodégradables par les micro-organismes, ils sont toxiques ou nocifs pour l’homme et les animaux [9].
I-5-1- Toxicité sur la santé humaine :
Plusieurs travaux de recherche sur les effets toxiques des colorants sur la santé humaine ont montré que les colorants aminés sont souvent aptes à provoquer des irritations de la peau et des dermites. Des effets similaires avec production d’eczéma et d’ulcération ont été observés chez les ouvriers d’usine de fabrication des colorants de la série du triphénylméthane. Des réactions allergiques, asthme quelquefois et surtout des dermites eczémateuses ont été observés
Partie théorique Généralités sur les colorants
7 avec divers colorants aminés azoïques, anthraquinoniques, ainsi qu’avec certains colorants du groupe des naphtalènes ( chelite de rouge). Les colorants de synthèse à base d’amines entraînent des risques cancérogènes, des tumeurs urinaires et plus spécialement les tumeurs bénignes et malignes de la vessie [4].
Le rouge Congo est toxique par contact avec la peau, et par ingestion et mortel à dose élevée de produit pur évidemment. .En solution à faible dose, comme c’est le cas dans les préparations, c’est simplement un irritant de la peau et des yeux [15]
I-5-2- Toxicité sur les milieux aquatiques :
Un certain nombre de colorants présente un caractère toxique sur le milieu aquatique provoquant la destruction directe des communautés aquatiques [19].
le bleu de méthylène est toxique pour les algues et les petits crustacés à partir des concentrations de 0,1 mg/l et 2 mg/l respectivement [9].
La fuchsine, en concentration supérieure à 1mg/l, exerce un effet de ralentissement sur l’activité vitale des algues [19].
I-5-3-Impacts environnementaux :
Le principal problème environnemental qui se pose dans l’industrie textile est celui des quantités d’eau rejetées et de leur charge chimique. Les autres questions importantes sont la consommation énergétique, les émissions dans l’atmosphère, les déchets solides et les odeurs qui peuvent représenter des nuisances significatives dans certains traitements. Les émissions dans l’atmosphère sont habituellement captées à la source. Ce n’est pas le cas pour les émissions dans l’eau. En effet, les flux provenant des différents procédés sont mélangés et donnent un effluent final dont les caractéristiques résultent d’une combinaison complexe [8]
I-6-Procédés de traitements des colorants :
De nombreuses techniques de dépollution des effluents chargés en colorants sont développées au cours de ces dernières années. Parmi ces techniques on peut citer quelques procédés :
I-6-1-Méthode physico-chimique: coagulation – floculation :
Sous le terme de coagulation-floculation, on entend tous les processus physicochimiques par lesquels des particules colloïdales ou des solides en fine suspension sont transformés par des floculants chimiques en espèces plus visibles et séparables (les flocs). Les flocs formés sont ensuite séparés par décantation et filtration puis évacués. Par ailleurs, la coagulation - floculation ne peut être utilisée pour les colorants fortement solubles dans l’eau. D'importantes quantités de
Partie théorique Généralités sur les colorants
boue sont formées avec ce procédé : leur régénération ou réutilisation reste la seule issue mais demande des investissements supplémentaires [13].
I-6-2-Méthodes chimiques :
I-6-2-1 Les procédés d’oxydation classique
Ces méthodes de traitement sont couramment utilisées pour l’épuration d’effluents contenant des polluants organiques, y compris des colorants, en raison de leur mise en œuvre relativement facile.
Ces procédés utilisent des oxydants puissants et variés tels que l’hypochlorite de sodium (NaClO), l’ozone (O3), ou encore le peroxyde d’hydrogène(H2O2), en présence ou non de
catalyseur [16].
I-6-2-2 Les procédés d’oxydation avancée (POA)
Les POA regroupent des méthodes chimiques, photochimiques ou électrochimiques
Leur développement est en plein essor depuis environ trois décennies. Elles consistent à dégrader les molécules de colorants en CO2 et H2O au moyen de l’UV en présence de peroxyde
d’hydrogène [16].
I-6-3-Méthodes physiques
I-6-3-1-Filtration sur membrane :
La filtration sur membrane pilotée par pression hydraulique se décline en microfiltration, ultrafiltration, nanofiltration et osmose inverse. L’effluent passe à travers une membrane semi- perméable qui retient en amont les contaminants de taille supérieure au diamètre des pores, pour produire un perméat purifié et un concentré qui reçoit les impuretés organiques. Parmi les quatre types de procédés, la nanofiltration et l'osmose inverse sont les plus adaptés à la réduction partielle de la couleur et des petites molécules organiques, mais l’osmose inverse reste la plus répandue [13].
I-6-3-2-Adsorption sur charbon actif et déchets végétaux :
Lors de l'adsorption, le polluant est transféré de la phase liquide vers la phase solide. Le charbon actif commercial est l'adsorbant le plus communément utilisé pour la réduction de la couleur [13], mais il reste très onéreux. Des recherches ont opté pour valoriser ou utiliser certaines matières naturelles (sciure, écorce et farine de bois…) moins onéreuses pour l’élimination des colorants par adsorption. [8].
Chapitre II :
Généralités sur
l’adsorption et les
Partie théorique Procédés d’adsorption et les adsorbants
II-Introduction
Malgré les récents développements dans le domaine des traitements des eaux usées, et malgré les nouvelles technologies modernes qui sont apparues dans ce domaine, l’adsorption reste encore une procédure fiable pour l’enlèvement des substances toxiques, comme les colorants textiles [12]
II-1-Définition et intérêt de l’adsorption :
D'une manière générale, L’adsorption définit la propriété de certains matériaux de fixer à leur surface des molécules extraites de la phase liquide ou gazeuse dans laquelle ils sont immergés.
La phase d'adsorption est appelée adsorbant, et le matériau étant adsorbé l'adsorbat [17].
Les procédés d’adsorption sont employés généralement dans divers domaines comme : - La séparation de composés chimiques.
- La purification de divers produits pétroliers et de matières grasses animales et végétales. - Le traitement des eaux.
- La dessiccation de produits organiques industriels. - La teinturerie…etc. [14]
II-2-Types d’adsorption
Selon la nature des forces impliquées entre les molécules de l’adsorbat et la surface d’adsorbant, l’adsorption est parfois différenciée en adsorption physique et adsorption chimique.
II-2-1- L’adsorption physique (physisorption)
Dite physisorption, est un phénomène réversible et rapide due à l'existence des forces d'attractions intermoléculaires entre les solides et la substance adsorbée d'origine électrostatique de type "VAN DER-WAALS"[21].
Ce phénomène, contrôlé par la diffusion des molécules, atteint son équilibre rapidement (quelques secondes à quelques minutes) mais peut se prolonger sur des temps très longs pour les adsorbants microporeux en raison de ralentissement de la diffusion de l’adsorbat dans ses structures de dimensions voisines du diamètre des molécules de l’adsorbant. L’adsorption physique n’est pas un phénomène spécifique, dans ce cas, l’adsorbant retient en général toutes
Partie théorique Procédés d’adsorption et les adsorbants
10 les espèces en quantités plus en moins grandes. Ces quantités étant proportionnellement à la surface réelle de l’adsorbant [22].
II-2-2 L'adsorption chimique:
La chimisorption, phénomène généralement irréversible qui fixe par liaison covalente l’adsorbat à l’adsorbant [2].
Les molécules adsorbées ont une localisation précise sur la surface de l’adsorbant due à la formation d’une liaison chimique entre la molécule d’adsorbat et un site spécifique sur la surface. L’adsorbat n’est plus libre de migrer sur la surface et ne peut se libérer de celle-ci[24]
Le tableau 2 regroupe quelque critère de distinction entre l'adsorption physique et chimique.
Tableau 2: Distinction entre l'adsorption physique et chimique [22].
Propriétés Adsorption physique Adsorption chimique
Température de processus Chaleur d’adsorption Liaisons Cinétique Spécificité Désorption Couches formées Relativement basse 5 Kcal/mol environ Physiques : van der waals Rapide, réversible
Processus non spécifique Facile Mono ou multicouches Plus élevé 10 Kcal/mol environ Chimiques Lente, irréversible Processus très spécifique Difficile Uniquement monocouches
II-3-Le mécanisme d'adsorption d’un colorant :
Il s’agit d’un transfert d’une phase liquide ou gaz contenant l’adsorbat vers une phase solide avec rétention des solutés à la surface du l’adsorbant [26].
Ce processus se déroule en quatre étapes :
Étape n°1 : Transfert de la particule de la couche externe d’hydratation vers la couche
interne. (Étape très rapide)
Étape n°2 : Déplacement de l’eau liée jusqu’au contact avec l’adsorbant. (Étape rapide) Étape n°3 : Diffusion à l’intérieur d’adsorbant sous l’influence du gradient de concentration.
(Étape lente)
Partie théorique
Figure 7: Etapes de transfert d’un soluté lors de son adsorption [27].
II-4- Facteurs influençant l’équilibre
Le transfert des polluants est régi par trois phénomènes physico thermodynamique entre les deux phases qui
l’adsorption et la compétition entre les différents adsorbats .plusieurs facteurs vont donc influer sur ces phénomènes : [23]
La température du milieu La taille des particules.
La nature des groupements fonc La surface spécifique;
La masse de l’adsorbant. La concentration
La nature et la concentration de l’adsorbat Le ph
Le temps de contact entre l’adsorbat et l’adsorbant; La nature de l’adsorbant
Polarité [23]
II-5- Isothermes d’adsorption
Le phénomène d’adsorption est généralement représenté par les isothermes d’équilibre sous forme graphique. Il rend compte de la relation entre la concentration en soluté adsorbé et la concentration en soluté dans la phase fluide
L'allure de la courbe isotherme varie selon le couple adsorbat isothermes d'adsorption de soluté
H., D. Smith, et al. (1974)) en quatre principales classes (figure
Procédés d’adsorption et les adsorbants
: Etapes de transfert d’un soluté lors de son adsorption [27].
Facteurs influençant l’équilibre d’adsorption :
Le transfert des polluants est régi par trois phénomènes physico-chimiques
thermodynamique entre les deux phases qui exprime la limite du procédé, la cinétique de l’adsorption et la compétition entre les différents adsorbats .plusieurs facteurs vont donc
: [23] La température du milieu ; La taille des particules.
La nature des groupements fonctionnels;
La masse de l’adsorbant.
La nature et la concentration de l’adsorbat
Le temps de contact entre l’adsorbat et l’adsorbant; La nature de l’adsorbant
Isothermes d’adsorption :
phénomène d’adsorption est généralement représenté par les isothermes d’équilibre sous forme graphique. Il rend compte de la relation entre la concentration en soluté adsorbé et la concentration en soluté dans la phase fluide.
isotherme varie selon le couple adsorbat -adsorbant étudi isothermes d'adsorption de soluté à solubilité limitée ont été classées par Giles et al
en quatre principales classes (figure 8) [12,49]
’adsorption et les adsorbants
: Etapes de transfert d’un soluté lors de son adsorption [27].
chimiques :l’équilibre exprime la limite du procédé, la cinétique de l’adsorption et la compétition entre les différents adsorbats .plusieurs facteurs vont donc
phénomène d’adsorption est généralement représenté par les isothermes d’équilibre sous forme graphique. Il rend compte de la relation entre la concentration en soluté adsorbé et
adsorbant étudié, les à solubilité limitée ont été classées par Giles et al (Giles, C.
Partie théorique Procédés d’adsorption et les adsorbants
12
S (Sigmoïde), L (Langmuir), H (Haute affinité) et C (partition Constante) [2].ces isothermes
ont été reliées assez précisément à divers modes de fixation [12]
Cette classification tient compte entre autre d’un certain nombre d’hypothèses :
• Le solvant s’adsorbe sur les mêmes sites que le soluté. Ceci implique l’existence d’une compétition d’adsorption entre le solvant et le soluté;
• Le nombre de sites susceptibles d’accueillir les molécules de soluté à la surface du solide diminue quand la quantité adsorbée augmente;
• L’orientation des molécules à la surface est prise en considération, le cas, par exemple, où les molécules sont adsorbées verticalement ou horizontalement sur la surface;
• Enfin, les interactions attractives ou répulsives entre les molécules adsorbées se manifestent d’une façon notable dans le phénomène d’adsorption [12].
Figure 8: Classification des isothermes d’adsorption selon Giles et al [49]
La classe L :
Les isothermes de classe L se rencontrent lorsque le solide adsorbe une seule couche d’adsorbat et en adsorption chimique. Ce type d’isotherme présente, à faible concentration en solution, une concavité tournée vers le bas qui traduit une diminution des sites libres au fur et à mesure de la progression de l'adsorption [2].
La classe S :
Les isothermes de cette classe présentent, à faible concentration, une concavité tournée vers le haut. Les molécules adsorbées favorisent l'adsorption ultérieure d'autres molécules (adsorption coopérative) [2].
La classe H :
La partie initiale de l'isotherme est presque verticale, la quantité adsorbée apparaît importante à concentration quasiment nulle du soluté dans la solution. Ce phénomène se
Partie théorique
produit lorsque les interactions entre les molécules adsorbées et la surface du solide sont très fortes [2].
La classe C :
Les isothermes de cette classe se caractérisent par une partition constante entre la solution et le substrat jusqu'à un palier. La linéarité
constant au cours de l’adsorption [
II-5.1. Modélisation des isothermes d’adsorption
Plusieurs lois ont été proposées pour l'étude de l'adsorption, et de nombreux modèles sont développés pour caractéris
La masse de soluté adsorbé se mesure par la relation:
X:masse de soluté adsorbée (mg)
Ce: concentration à l’équilibre (finale) dans la
En général, la concentration de l’adsorbat retenue par l’adsorbant est calculée par la différence entre la concentration initiale du soluté Co et la concentration finale du soluté C. La quantité du soluté adsorbée à l’équilibre (
Donc :
Avec :
V : volume de la solution (L)
l’adsorbat (mg/L) ; Ce : concentration à l’équilibre de l’adsorbat (mg/L) [30].
De nombreux auteurs ont proposé des modèles théoriques ou empiriques pour d
relation entre la masse d’adsorbat fixée à l’équilibre et la concentration sous laquelle à lieu. Il s’agit de relation non cinétique, que l’on nom
Parmi les modèles d’adsorption les plus répandus en distinguent : [
Procédés d’adsorption et les adsorbants
sque les interactions entre les molécules adsorbées et la surface du solide sont très
Les isothermes de cette classe se caractérisent par une partition constante entre la solution et le substrat jusqu'à un palier. La linéarité montre que le nombre de sites libres reste constant au cours de l’adsorption [2].
5.1. Modélisation des isothermes d’adsorption
Plusieurs lois ont été proposées pour l'étude de l'adsorption, et de nombreux modèles s pour caractériser les processus impliqués [12].
La masse de soluté adsorbé se mesure par la relation:
X = (C0 – Ce) V
:masse de soluté adsorbée (mg) ; C0:concentration initiale en soluté dans la solution (mg/l). : concentration à l’équilibre (finale) dans la solution (mg/l) ; V:volume de solution
En général, la concentration de l’adsorbat retenue par l’adsorbant est calculée par la différence entre la concentration initiale du soluté Co et la concentration finale du soluté C.
adsorbée à l’équilibre (qe :mg/g) est donnée par l’équation suivante
:
(
0)
. e e C C q V m − =: volume de la solution (L) ; m : Masse de l’adsorbant (g) ; Co : concentration initiale de : concentration à l’équilibre de l’adsorbat (mg/L) [30].
De nombreux auteurs ont proposé des modèles théoriques ou empiriques pour d
relation entre la masse d’adsorbat fixée à l’équilibre et la concentration sous laquelle à lieu. Il de relation non cinétique, que l’on nomme isotherme d’adsorption [30].
Parmi les modèles d’adsorption les plus répandus en distinguent : [12]
’adsorption et les adsorbants
sque les interactions entre les molécules adsorbées et la surface du solide sont très
Les isothermes de cette classe se caractérisent par une partition constante entre la montre que le nombre de sites libres reste
Plusieurs lois ont été proposées pour l'étude de l'adsorption, et de nombreux modèles
:concentration initiale en soluté dans la solution (mg/l). :volume de solution [29]. En général, la concentration de l’adsorbat retenue par l’adsorbant est calculée par la différence entre la concentration initiale du soluté Co et la concentration finale du soluté C.
est donnée par l’équation suivante :
: concentration initiale de : concentration à l’équilibre de l’adsorbat (mg/L) [30].
De nombreux auteurs ont proposé des modèles théoriques ou empiriques pour décrire la relation entre la masse d’adsorbat fixée à l’équilibre et la concentration sous laquelle à lieu. Il
Partie théorique
a) Le modèle de Langmuir
L’isotherme de Langmuir
l’adsorption a lieu sur les sites de même énergie et qu’il n’y a pas d’interaction entre les molécules adsorbées [9].
Il repose sous les hypothèses ci
• il existe plusieurs sites d’adsorption
• chacun de ces sites peut
couche de molécules peut être adsorbée
• chacun de ces sites à la même affinité pour les impuretés en solution
• l’activité a un site donné n’affecte pas l’activité aux sites adjacents L’équation de l’isotherme de Langmuir est la suivant
a, b : constantes déterminées expérimentalement X : quantité d’impuretés fixée (mg ou mmole /l)
Linéarisation : En inversant l’équation (1) on trouve :
• L’équation (2) est celle d’une droite d’ordonnée (
Figure 9: Isotherme d’adsorption de LANGMUIR b) Modèle de Freundlich
L’équation de Freundlich est bien formule empirique est:
Procédés d’adsorption et les adsorbants
Le modèle de Langmuir
L’isotherme de Langmuir a été proposée en 1918 [29] par Langmuir
l’adsorption a lieu sur les sites de même énergie et qu’il n’y a pas d’interaction entre les
Il repose sous les hypothèses ci-dessous :
il existe plusieurs sites d’adsorption à la surface;
chacun de ces sites peut adsorber une seule molécule ; par conséquent une seule couche de molécules peut être adsorbée ;
chacun de ces sites à la même affinité pour les impuretés en solution l’activité a un site donné n’affecte pas l’activité aux sites adjacents ; [29]
n de l’isotherme de Langmuir est la suivant :
……… (1)
constantes déterminées expérimentalement ; Ce : concentration à l’équilibre (mg/l). quantité d’impuretés fixée (mg ou mmole /l) ; m : masse du matériau adsorbant. Linéarisation : En inversant l’équation (1) on trouve :
……… (2 L’équation (2) est celle d’une droite d’ordonnée (m/X) et d’abscisse (
Isotherme d’adsorption de LANGMUIR. [27]
Modèle de Freundlich
L’équation de Freundlich est bien adaptée pour décrire l’équilibre en phase aqueuse. Sa
’adsorption et les adsorbants
14 Langmuir qui suppose que l’adsorption a lieu sur les sites de même énergie et qu’il n’y a pas d’interaction entre les
; par conséquent une seule
chacun de ces sites à la même affinité pour les impuretés en solution ; ; [29]
(1)
concentration à l’équilibre (mg/l). : masse du matériau adsorbant.
(2)
et d’abscisse (1/Ce) [29].
27]
Partie théorique
Tel que :
K (mg/g) et n : des constantes de Freundlich, indicatives de l’intensité et de la capacité
d’adsorption.
Selon Freundlich, cette équation admet les hypothèses suivantes:
1- Les sites actifs ont des niveaux d’énergie différents. 2- Chaque site actif peut fixer plusieurs molécules. 3- Le nombre de sites actifs n’est pas déterminé.
L’équation linéaire de Freundlich est donnée par
Cette équation est celle d’une droite d’ordonnée :
1/n est habituellement comprise entre 0,3 et 0,5.
L’équation de Freundlich représente assez bien la physisorption et la chimisorption sur de nombreux solides. [27].
Figure 10: Isotherme d’adsorption de FREUNDLICH
II-6-Cinétique de l'adsorption
Dans un système d'adsorption, La vitesse de réaction aboutissant à l’équilibre thermodynamique entre l’adsorbat en phase liquide et l’adsorbat fixé sur le solide
La définition de la cinétique d'adsorption est le taux d’approche de l'équilibre.
d'adsorption n'apparaît pas instantanément car le taux d'adsorption est habituellement limité par le transport de masse suivant mécanismes et dépend à la fois des propriétés de l'adsorbant et de la adsorbat [17].
Procédés d’adsorption et les adsorbants
……… (3) [31]
: des constantes de Freundlich, indicatives de l’intensité et de la capacité
Selon Freundlich, cette équation admet les hypothèses suivantes: Les sites actifs ont des niveaux d’énergie différents.
Chaque site actif peut fixer plusieurs molécules. Le nombre de sites actifs n’est pas déterminé. [27]
de Freundlich est donnée par :
……… (4 Cette équation est celle d’une droite d’ordonnée : Ln (X/m) et d’abscisse Ln Ce.
est habituellement comprise entre 0,3 et 0,5.
représente assez bien la physisorption et la chimisorption sur de
Isotherme d’adsorption de FREUNDLICH [27].
Cinétique de l'adsorption :
un système d'adsorption, La vitesse de réaction aboutissant à l’équilibre thermodynamique entre l’adsorbat en phase liquide et l’adsorbat fixé sur le solide
La définition de la cinétique d'adsorption est le taux d’approche de l'équilibre.
d'adsorption n'apparaît pas instantanément car le taux d'adsorption est habituellement limité par le transport de masse suivant mécanismes et dépend à la fois des propriétés de l'adsorbant
’adsorption et les adsorbants
: des constantes de Freundlich, indicatives de l’intensité et de la capacité
(4) [31]
Ln Ce. La valeur de
représente assez bien la physisorption et la chimisorption sur de
27].
un système d'adsorption, La vitesse de réaction aboutissant à l’équilibre thermodynamique entre l’adsorbat en phase liquide et l’adsorbat fixé sur le solide [32].
La définition de la cinétique d'adsorption est le taux d’approche de l'équilibre. L'équilibre d'adsorption n'apparaît pas instantanément car le taux d'adsorption est habituellement limité par le transport de masse suivant mécanismes et dépend à la fois des propriétés de l'adsorbant
Partie théorique Procédés d’adsorption et les adsorbants
16 Le but de cette étude est de déterminer les quantités fixées de l’adsorbat choisi depuis sa mise en contact jusqu’à l’atteinte de l’équilibre thermodynamique. Tandis que les prélèvements des échantillons sont réalisés avec des intervalles de temps variables [32].
II-6-1- Modèle de la cinétique du pseudo premier ordre :
Dans le cas de réaction d’ordre pseudo premier, La constante de vitesse est déduite à partir du modèle établi par Lagergen.
Ce modèle mathématique a été choisi d’une part pour sa simplicité et d’autre part par son application dans le domaine d’adsorption des composés organiques sur différents adsorbants [14].
La vitesse d’adsorption est proportionnellement à (qe-qt) et peut donc être décrite par la
relation suivant :
(
)
1 t e t dq k q q dt = − ……… (5)Ou : qe (mg/g) : quantité adsorbée à l’équilibre qt (mg/g): quantité adsorbée à l’instant t.
k1: constante de vitesse de Lagergren
L’intégration de l’équation (5) entre 0 et t pour le temps et entre 0 et qt pour la quantité
adsorbée permet d’obtenir la forme linéaire de Lagergren:
ln
(
qe−qt)
=lnqe−k t1 ……… (6)Le tracé la courbe ln
(
qe−qt)
en fonction de t permet de déterminer la constante K1 et laquantité adsorbée à l’équilibre qe [12].
II-6-2-Modèle de la cinétique du pseudo seconde ordre :
La vitesse de réaction pour la pseudo-second-ordre dépend de la quantité adsorbée sur la surface de l’adsorbant et de la quantité adsorbée à l’équilibre. L’équation de la cinétique de pseudo-second-ordre obéit à la relation suivant :
(
)
2 2 t e t dq k q q dt = − ……… (7)Tel que: qe (mg/g) : quantité adsorbée à l’équilibre. qt (mg/g): quantité adsorbée à l’instant t. K2: constante de vitesse du modèle cinétique du 2ème ordre (mg.g-1.min-1).
L’intégration de l’équation (7) entre 0 et t pour le temps et entre 0 et qt pour la quantité adsorbée permet d’obtenir la forme linéaire du modèle de pseudo seconde ordre:
Partie théorique Procédés d’adsorption et les adsorbants
2 2 1 1 . t e e t t q = k q + q ……… (8) Le tracé la courbe t tq en fonction de t permet de déterminer la constante K2 et la quantité
adsorbée à l’équilibre qe [12].
II-7- les adsorbants :
Tous les solides agissants comme adsorbants sont caractérisés par la structure microporeuse qui leur confère une très grande surface active par unité de masse. Les adsorbants utilisés dans la pratique sont, soit de nature minérale: argile, bauxite, alumine et gel de silice. Les autres sont d’origine organique (noir animal, charbons végétaux, résine synthétique) [27].Ils sont employés tels quels ou après un traitement d’activation ayant pour but l’augmenter la porosité [25].
Dans la pratique, il surprenant de constater que cinq types d’adsorbants seulement sont le plus couramment utilisés : le charbon active (appelé aussi charbon actif), les zéolites, le gel de silice, l’argile et l’alumine activées [34].
Les zéolithes
Constitué d’un squelette cristallin aluminosilicate, ces adsorbants se présentent sous forme de poudre, granules ou extrudes [23]. Il existe : des zéolithes artificielles possèdent la propriété de fixer les sels de métaux lourds qui se trouvent dans les eaux [35].Et des zéolites naturelles ont généralement une forte capacité d'échange de cations.
Gels de silice
Les gels de Silice (SiO2, nH2O) se présentent sous la forme de grains durs et poreux [25]Il
s’agit d’adsorbants synthétiques très hydrophiles [23] avec une surface spécifique de 600 à 800 m²/g, dont la taille des pores varie de 20 à 50 Å. Ils s’obtiennent par action de l’acide chlorhydrique sur une solution de silicate de sodium [4]. Ils sont utilisés pour ôter l’eau de divers gaz, mais aussi, parfois, pour la séparation d’hydrocarbures [25].
Alumines activées
Les alumines activées(Al2O3) disposent d’une surface de 200 à 500 m²/g avec des pores de 20
Partie théorique
Argiles
Parmi les matériaux naturels, les argiles qui sont caractérisé
spécifique, une excellente propriété d’échanges de cations, une large disponibilité dans la nature et elles sont capables d’éliminer simultanément les
inorganiques [37].
Charbon actif
Les charbons actifs (CA) sont
Leur grande surface spécifique [38], leur importante porosité, leur vaste domaine d’application et leur cout[23]. Le charbon actif
noix de coco, bois de pin, etc.)
physique ou chimique. Cependant, un processus combinant les deux étapes peut être appliqué. La carbonisation a essentiellement pour but d’enrichir la matière en carbone et créer les premiers pores, tandis que l’activa
l’influence de ce traitement, il ne subsiste que le squelette carboné et le matériau a acquis une très grande porosité, en présentant en outre une grande diversité dans la taille et la structure des pores (macropores et micropores
spécifique développée, le charbon est un adsorbant qui peut retenir à sa surface des molécules de toutes tailles[18],et très recherché
alimentaire et l’industrie de l’automobile. En particulier, le CA est largement utilisé dans la purification des eaux [38]pour améliorer les qualités organoleptiques d’une eau en éliminant les matières organiques responsables de goûts, d’odeurs et de couleur, l’élimination de nombreux polluants et micropolluants (les phénols, les hydrocarbures, les pesticides, les détergents, et même certains métaux lourds)
Le charbon peut se présenter sous la forme d’une poudre fine (en particulier pour les courants aqueux) ou de solides extrudés, de granulés, de cylindres, de billes ou de fibres
Figure 11 : Adsorption sur une particule
Procédés d’adsorption et les adsorbants
Parmi les matériaux naturels, les argiles qui sont caractérisées par une importante surface spécifique, une excellente propriété d’échanges de cations, une large disponibilité dans la sont capables d’éliminer simultanément les polluants organiques et
sont des adsorbants connus depuis longtemps se caractérisant par Leur grande surface spécifique [38], leur importante porosité, leur vaste domaine
. Le charbon actif est issu de diverses origines (houille, lignite , bois de pin, etc.) [18] et préparé par carbonisation suivie d’une activation physique ou chimique. Cependant, un processus combinant les deux étapes peut être appliqué. La carbonisation a essentiellement pour but d’enrichir la matière en carbone et créer les premiers pores, tandis que l’activation vise à développer une structure poreuse
l’influence de ce traitement, il ne subsiste que le squelette carboné et le matériau a acquis une très grande porosité, en présentant en outre une grande diversité dans la taille et la structure ores (macropores et micropores) ; grâce à cette porosité hétérogène et à la grande surface spécifique développée, le charbon est un adsorbant qui peut retenir à sa surface des molécules et très recherché dans plusieurs domaines: pharmaceutique, agro alimentaire et l’industrie de l’automobile. En particulier, le CA est largement utilisé dans la
pour améliorer les qualités organoleptiques d’une eau en éliminant ques responsables de goûts, d’odeurs et de couleur, l’élimination de nombreux polluants et micropolluants (les phénols, les hydrocarbures, les pesticides, les détergents, et même certains métaux lourds) [18].
Le charbon peut se présenter sous la forme d’une poudre fine (en particulier pour les courants aqueux) ou de solides extrudés, de granulés, de cylindres, de billes ou de fibres
Adsorption sur une particule de charbon actif [
’adsorption et les adsorbants
18 s par une importante surface spécifique, une excellente propriété d’échanges de cations, une large disponibilité dans la polluants organiques et
depuis longtemps se caractérisant par Leur grande surface spécifique [38], leur importante porosité, leur vaste domaine est issu de diverses origines (houille, lignite, carbonisation suivie d’une activation physique ou chimique. Cependant, un processus combinant les deux étapes peut être appliqué. La carbonisation a essentiellement pour but d’enrichir la matière en carbone et créer les tion vise à développer une structure poreuse [38], sous l’influence de ce traitement, il ne subsiste que le squelette carboné et le matériau a acquis une très grande porosité, en présentant en outre une grande diversité dans la taille et la structure ) ; grâce à cette porosité hétérogène et à la grande surface spécifique développée, le charbon est un adsorbant qui peut retenir à sa surface des molécules : pharmaceutique, agro-alimentaire et l’industrie de l’automobile. En particulier, le CA est largement utilisé dans la
pour améliorer les qualités organoleptiques d’une eau en éliminant ques responsables de goûts, d’odeurs et de couleur, l’élimination de nombreux polluants et micropolluants (les phénols, les hydrocarbures, les pesticides, les
Le charbon peut se présenter sous la forme d’une poudre fine (en particulier pour les courants aqueux) ou de solides extrudés, de granulés, de cylindres, de billes ou de fibres [34].
Partie théorique Procédés d’adsorption et les adsorbants
II-8-Exemple d’adsorbants végétaux « Le jujube »
Les noyaux de jujubes ou bien petit jujube provient de la variété appelée ‘Zizyphus jujuba’ [5] appelée localement (Sedra), il appartient à la famille des Rhamnacées qui est une famille des plantes dicotylédones qui comprend 900 espèces auprès de 58 genres [39].Le jujubier est largement distribué dans les forêts à feuilles caduques du centre algérien [40], dont l’abondance est importante dans notre pays et dont l’usage se limite souvent à la consommation alimentaire et médicinale pour ses vertus thérapeutiques. Il a été utilisé comme précurseur pour la fabrication du charbon actif [5], ont fait l’objet d’une application eu milieu aqueux pour des tests d’élimination d’un colorant (ionique) utilisé dans l’industrie de textile, [5].Le jujubier est peu exigeant en eau. Cet arbrisseau a une croissance très lente et commence à porter des fruits vers l’âge de 4 ans. Il peut continuer à paraitre vers 20 à 25 ans. Les fruits sont cueillis parfaitement murs en septembre-octobre. C’est la période au cours de laquelle ils se détachent facilement.
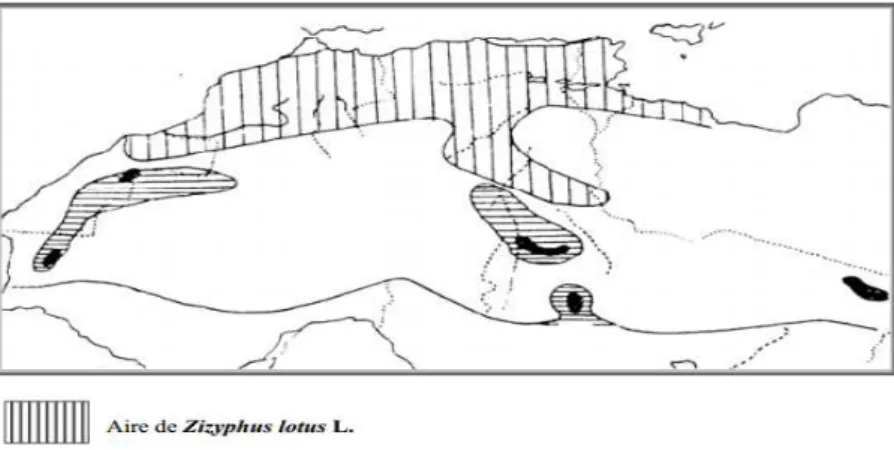
Notre étude porte sur la valorisation du Zizyphus lotus L qui est également appelé jujubier des Lotophages ou jujubier de Berbérie, il pousse sur les rives sud de la Méditerranée jusqu’en Afghanistan. L’aire de répartition du Zizyphus lotus L. s’étale sur tout le Nord du Maghreb. Zizyphus lotus L. est très répandu dans les régions arides d’Algérie du Sud, Djelfa à climat aride et Bechar à climat saharien. On peut donner quelques appellations, en Français : jujubier, dindonnier; en arabe : sedra, djerdjer, azar, n’beg [39].
Figure 12 : Jujubier lotus L à gauche et son fruit à droite
II-9-méthodes de caractérisation des adsorbants :
9-1 Les méthodes de caractérisation physiques 9-1-2- Spectroscopie Infra-Rouge (IR) 9-1-3-Diffraction de rayon X (DRX)
9-2 Les méthodes de caractérisation chimiques
Partie
Chapitre III :
Partie pratique Matériels et méthodes
20
III-Introduction
Cette partie traite les méthodes d’analyse des matériaux étudiés: les noyaux de jujube (NJ), le charbon commercial (CC) et le colorant : le Rouge Congo (RC) testé, ainsi que les essais d’adsorption de ce colorant sur les deux matériaux. Les méthodes de caractérisation des noyaux jujubes ont été décrites dans cette partie. Les propriétés physico-chimiques du RC ont également été décrites.
III-1-Méthodologie utilisées dans la préparation et la caractérisation des
noyaux de jujube
Dans cette étude, les noyaux de jujube (Zizyphus lotus) qui sont des déchets sous forme solide, très répandus dans toute l’Algérie sont valorisés.
La carte suivante montre répartition géographique du zizyphus lotus en Algérie [39].
Figure13: Aire de répartition du Zizyphus lotus L en Algérie [39]
Le jujube utilisé dans cette étude a été récupéré de la région de Bouira au centre de l’Algérie. Les noyaux de jujubes ont été lavés jusqu'à ce que l’eau de lavage soit devenue claire, ils sont ensuite rincés avec de l’eau distillée, étuvés à 105°C jusqu’à poids constant puis broyés en une fine poudre et tamisés par un tamis de 200µm et destinés à une caractérisation.
Partie pratique Matériels et méthodes
III-1-1-Caractérisation physico-chimique du jujube étudié :
Grâce à l’application de plusieurs méthodes, les caractéristiques physico-chimiques du jujube préparé sont déterminées :
III-1-1-1- Le taux d’humidité
Le taux d’humidité est un rapport exprimé en pourcentage, il est déterminé par le séchage de l’adsorbant. Une masse m1 d’adsorbant est mise dans un creuset et pesée. Elle est ensuite
séchée dans une étuve à 105°C. L’échantillon est pesé toute les 5 heures. L’opération de pesée est répétée jusqu’à ce que le poids de l’échantillon devienne constant. A sa sortie de l’étuve, il est refroidi dans un dessiccateur puis repesé.
Le taux d’humidité (% H) est calculé par la formule suivante: %H= 3 2 1
*100
m m
m
−
m1: la masse initiale d’adsorbant utilisée en (g).
m2: La masse du creuset rempli après séchage en (g).
m3: La masse du creuset rempli avant séchage en (g).
III-1-1-2- La masse volumique apparente
Une quantité d’adsorbant (m) est introduite dans une éprouvette graduée et tassée pendant une à deux minutes pour compacter l’adsorbant. Le volume précis occupé par l’adsorbant est déterminé (V). La masse volumique apparente est donnée par la formule suivante: app m
V
ρ
=[63,64]
III-1-1-3- La masse volumique réelle
Une quantité d’adsorbant est mise en étuve à 105°C pendant 24h. Une masse m de cet adsorbant est introduite dans un pycnomètre. Le volume est ensuite complété par un volume connu de méthanol. La masse volumique réelle est calculée comme suit:
reel
m V
ρ
= Tel que V=Vpicnomètre-VméthanolIII-1-1-4- Le taux de cendre
Un creuset propre est chauffé dans un four à 700°C pendant 10 minutes, refroidi ensuite dans un dessiccateur et pesé (m1). Une quantité (m2) d’adsorbant est introduite à l’intérieur du
creuset et placée dans le four à 700°C pendant 3 heures. Le creuset est ensuite refroidi et pesé à nouveau (m3).
![Figure 4 : Structure moléculaire d’un colorant à mordant [9]](https://thumb-eu.123doks.com/thumbv2/123doknet/13841057.444013/17.892.262.620.917.1063/figure-structure-moléculaire-colorant-mordant.webp)
![Figure 6 : Structure moléculaire d’un colorant direct [9]](https://thumb-eu.123doks.com/thumbv2/123doknet/13841057.444013/18.892.285.610.304.399/figure-structure-moléculaire-colorant-direct.webp)
![Tableau 2: Distinction entre l'adsorption physique et chimique [22].](https://thumb-eu.123doks.com/thumbv2/123doknet/13841057.444013/23.892.99.793.499.810/tableau-distinction-adsorption-physique-chimique.webp)
![Figure 7: Etapes de transfert d’un soluté lors de son adsorption [27].](https://thumb-eu.123doks.com/thumbv2/123doknet/13841057.444013/24.892.267.712.164.301/figure-etapes-transfert-soluté-adsorption.webp)