Osmose
anpermeablen
Membranen
I. Der
Lösungsmittel-Einfluß
auf den SrAVERMAXiv-Efiekt*Von
Hans-GeorgElias**
Institut für Chemische Technologie der Technischen Hochschule München undTechnisch-ChemischesLaboratorium derEidgenössischenTechnischen
Hochschule Zürich
Mit 7Abbildungenim Text (Eingegangenam 2. November 1960)
Theinfluenceof the solventonthe osmoticpressureatpermeablemembranes
at startingconditions wasinvestigated fora polymer homologueseries ofpoly
(ethylene oxides) in acetone, methanole, benzene, dimethyl formamide, water, dioxane, formamide and
benzyl
alcohole atcellophane
600 and glassmem-branes. The prediction of Staverman was confirmed experimentally that the
osmotic pressure at permeable membranes should be lower than the value calculatedbythe thermodynamicsof reversibleprocesses even ifno solutehas
been permeated through the membrane. In addition, it was found that the Stavermaneffectis foragivensystemthehigher,thelower the solventviscosity. The solvent influence was
explained
by the impulse transfer mechanism nearpermeablewalls.
Furthermore it is shown that the specific
permeability
of solvent 67• n isdiminishing with increasing mole refraction of solvent thus pointing on an
interchangemechanismof solventmolecules and cellulosesegments.
1.
Einleitung
undProblemstellung
Nach den
Ableitungen
derThermodynamik
reversibler Prozesse ist beiMessungen
an für das Gelöstedurchlässigen
Membranen zu*Aus der Habilitations-Schrift „Osmotische Messungen an
permeablen
Membranen", ETH Zürich, 1960. Die Arbeit kann bei der Bibliothek der ETH
eingesehen
werden.**Neue Anschrift: Technisch-Chemisches Laboratorium, Eidgenössische
erwarten,
daßmitfortschreiten der Zeit wegen der zunehmend stärkerenPermeation sich die Konzentrationsdifferenz zwischen den beiden Seiten der Membran und damit der meßbare osmotische Druck laufend
verringert.
Durchgeeignete
Methoden sollte manjedoch
den osmo-tischen Druck derAnfangskonzentration
imAnfangszustand
(zur
Zeitnull)
und damit den wahren osmotischen Druckmessenkönnen,
der der inLösung
befindlichen Teilchenzahlzuzüglich
derWechselwirkungs-effekte
entspricht.
Staverman1 konnte
jedoch
auf Basis derThermodynamik
irre-versibler Prozesse theoretischzeigen,
daß beipermeablen
Membranen durch denEntropietransport
der meßbare osmotische Druck auchdann
geringer gegenüber
dem ausMolekulargewicht,
Virialkoeffizien-ten und Konzentration berechenbaren
gefunden
werdensollte,
wenn zur Zeit derMessung
noch keinegelöste
Substanz durch die Membranpermeiert
ist.Hinweise auf die
Gültigkeit
dieserVorhersage
wurdenvonStaver-man,Pals und
Krutssink2;
Álvang
undSamuelson3und Allen und Place4gefunden,
ohne daßjedoch
alleFehlerquellen
wie Einflüsse derPolymolekularität,
verschiedene Kammervolumina undAbsorp-tion in der Membran
ausgeschlossen
werden konnten. Ritscher und Elias5 schlössen bei ihren Versuchen den Einfluß all dieser Effekte undeiniger
weiterer meßtechnischer(vgl.6)
aus und konntenzeigen,
daß dieVorhersagen
von Staverman tatsächlichexperimentell
bestätigt
werden können. Bei den von diesen Autoren an einerpolymerhomo-logen
Reihe vonPolyäthylenglykolen
inDimethylformamid
anCello-phan
600- und Glas-Membranen7durchgeführten
Messungen
wurdeferner eine Anomalie der
Konzentrationsabhängigkeit
der reduzierten osmotischen Drucken/c
beobachtet. Die Größe dieser Anomalie schien dabei vomSystem Polymer-Membran-Lösungsmittel abzuhängen.
In1A. J. Staverman,Recueil Trav. chim.
Pays-Bas
70 (1951) 344.2A. J. Staverman, D. T. F. Pals and Ch.
Kruissink, J. Polymer Sei. 23
(1957) 57.
3F.Âlvangand O. Samuelson, J. Polymer Sei. 24 (1957) 353. 4P. W.Allenand M. A.
Place, J. Polymer Sei. 26 (1957) 386.
5 Th. A. RitscherundH.-G.
Elias,Makromolekulare Chem. 30 (1959) 48.
6 H.-G.
Elias, Th. A. Ritscher und F.Patat, Makromolekulare Chem. 27
(1958) 1.
7 H.-G. Elias and Th. A.Ritscher, J.
Polymer
Sei. 28 (1958) 648; Rev.permeablen
einer weiteren Arbeit konnte dann von Elias und Männer8
gezeigt
werden,
daß der Staverman-Effektnichtadditivist und beigleichem
Zahlenmittel des
Molekulargewichtes
auch stark von der Breite derMolekulargewichtsverteilung
beeinflußt wird.Die
Systemspezifität
ließ einenLösungsmitteleinfluß
vermuten,
über dessenGröße
undRichtung
in dervorliegenden
Arbeit berichtet wird.2.
Experimentelle
Durchführung
2.1Charakterisierung
der SubstanzenAls Modellsubstanzen wurden
Polyäthylenglykole
verschiedenenMolekular-gewichtes verwendet, da diese bei
geeigneter Herstellung
recht molekular-einheitlich sind undsichzudem in einer VielzahlvonLösungsmitteln
lösen.DieSubstanzenwarenteils
Handelspräparate,
teils Labormusterder Fa.FarbwerkeHoechstAG., Werk Gendorf(Bezeichnung AG)*.
DieGewichtsmitteldesMolekulargewichtes Mwwurden über Lichtstreuungs-messungenermittelt und über
Sedimentationsgeschwindigkeits-
und Diffusions-messungen kontrolliert. Das Zahlenmittel desMolekulargewichtes
wurde über Oi?-Zahl-Analysen bestimmt. Fürexperimentelle
Einzelheiten siehe5>9. DieeinzelnenMeßwertesind in Tab. 1
gegenübergestellt.
Tabelle 1.Molekulargewichteder untersuchten
Polyäthylenglykole
Bezeichnung
Gewichtsmittel des Mol.-Gew.
M,n
Mm
(Lichtstr. ) (Sed.undDiff.)
Zahlenmitteldes Mol.-Gew. M„ (Endgruppen-Best.) AG 4000 AG 10000 AG 20000 4300 10100 23800 4350 26100 3900 12000 16000 Zur
Charakterisierung
derLösungsmittelgütewurdenbei 25°C Viskositäts-undDiffusionsmessungen ausgeführt,da eine direkteBestimmungder 2. Virial-koeffizienten über Streulichtmessungen wegen der manchmal zu geringenBrechungsindexinkremente
nicht immermöglich
war.Die
Konzentrationsabhängigkeiten
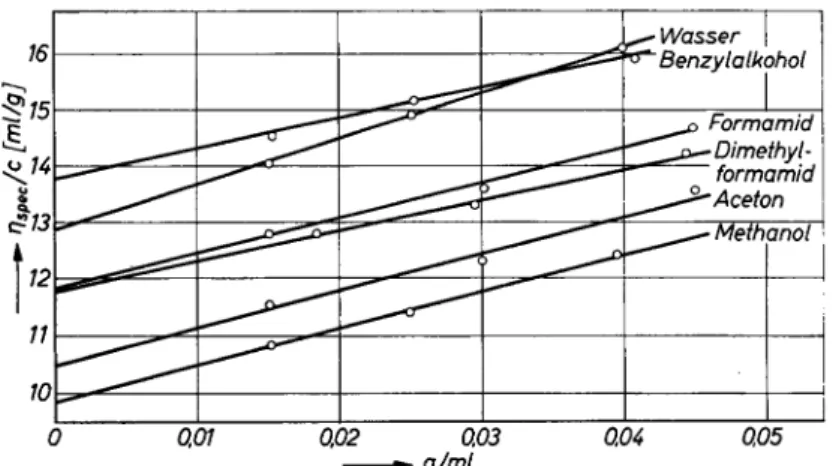
der Diffusionskoeffizienten undr¡svec/c-Werte sind in den Abb.1 und 2
wiedergegeben.
Interessanterweise wurde*Herrn Dr.
Torno, Farbwerke Hoechst, sei auch an dieser Stelle für die
freundliche
Überlassung
der Proben undEndgruppen-Analysen gedankt.
8H.-G. Elias und E.
Männer, MakromolekulareChem. 40 (1960) 207. 9H.-G. Elias,Habilitations-Schrift. ETH Zürich 1960.
bei den
Messungen
amPolyäthylenglykol
AG4000 in Methanol bei höherenKonzentrationen das von uns schon früher
aufgezeigte
10_12Minimum in denDc=
/(c)-Kurven gefunden.
40 107 30 g20 10 0 Wasser 0,005 0.010 —» g/ml 0.015 0,020Abb.1.
Konzentrationsabhängigkeit
derDiffusionskoeffizientenvonPolyäthylenglykol
AG4000 in verschiedenenLösungsmitteln
bei 25°CAbb.2. Viskositätsmessungen am
Polyäthylenglykol
AG 4000 in verschiedenenLösungsmitteln
bei 25 °C10 H.-G. Elias,Makromolekulare Chem.27
(1958)
261.11 F. Patat und H.-G.Elias,Naturwissenschaften46
(1959)
322.Die so erhaltenen Diffusionskoeffizienten bei unendlicher
Verdünnung
D0 und STAUDiNGER-Indices [r¡~\ sind zusammen mit den Viskositäten der reinenLösungsmittelinTab.2 zusammengestellt.
Tabelle2. Diffusions-Koeffizienten D0, STAUDINGER-Jwdî'ces [r/]und
Virialkoeffizienten *B von
Polyäthylenglykolen
in verschiedenen Lösungsmittelnbei 25°C Substanz
Lösungsmittel
Name cPoise D0 107cm2/sec
ml/g
*B Atm ml2• g* AG 4000 AG 10000 AG20000 Aceton Methanol BenzolDimethylformamid
Wasser Dioxan Cyclohexanon FormamidBenzylalkohol
MethanolDimethylformamid
Wasser MethanolDimethylformamid
Wasser 0,303 0,545 0,603 0,802 0,897 1,19 1,99 3,30 5,31 0,545 0,802 0,897 0,545 0,802 0,897 37,8 23,5 11,5 5,76 10,7 4,85 10,5 9,85 11,2 11,8 12,9 11,9 9,15 11,9 13,8 23,4 36,0 87 45 62 462.2 Osmometer und Membranen
DieMessungenanden
Cellophan
600-MembranenwurdenmitZweikammer-Metall-Osmometern13 ausMessing oder V 2 A ausgeführt,diean Glasmembra-nen mit Zweikammer-Glas-Osmometern* mit eingebautem Rührkern7. Die
Steighöhenwurdenüber ein
Vertikal-Meßmikroskop** (Skalenteilung
1 • 10~3cm)abgelesen.
Die Membranen wurden aus
Cellophan
600-Folien*** ausgestanzt und inWasser
angequollen,
welches sodann stufenweise durch das zurMessung
ver-wendete
Lösungsmittel
ersetztwurde.* Fa.WagnerundMünz, München,Luisenstr. 25. ** Fa.
Fuess,Berlin.
***Fa. Kalle &Co.,Wiesbaden-Biebrich.
13H.-G. Elias,
Chemie-Ing.-Techn.
29 (1957) 19.2.3. Meßtechnik
Die
Durchlässigkeit
der Membran für reineLösungsmittel
wurde durch denvon W.Kuhn14eingeführten
67-Wertn 2,303dmf*P _. G= —«n et -cm • sec g x
(1)
60gFgLM & v 'dm
= Dicke der Membranf
=Querschnittsfläche
derKapillaren
g =
Erdbeschleunigung
F = wirksame Membranfläche
qlm = Dichte des
Lösungsmittels
charakterisiert,
wobei die *P-Werte entwederausMessungen
unterdemEigendruck
derLösungsmittelsäulen
nach*P= log
(z)/t)o-1°g
(Ah)t min-i(2)
oder mit
überlagertem
Fremddruck pMan nach*P=
[i^P^H.nün-1
(3)
2,303pMan v '
bestimmt wurden
(vgl.
auch15).
Der für diedynamischen Messungen
benötigte KE-Wert
wurde überK*
=2,303*P =
-Wg-FG
=~^
g' mm ' om '
(4)
ermittelt.
Die durch den STAVERMAN-Effekt beeinflußten osmotischen
Drucke yrs zur Zeit null der
Osmometerfüllung
wurden nach drei ver-schiedenen Verfahren bestimmt(vgl.
dazu15)
:I.
Aus derRückextrapolation
desSteighöhenabfalles
nach Durch-laufen eines Maximums(Anfangsbedingung
AhA
<Ahm&x)
auf dieZeit
null,
Auftragen
der so erhaltenenZlAexp-Werte
gegen die ZeitAtmax
zumErreichen desSteighöhenmaximums
undExtrapolation
aufZlimax
= 0. Die so erhaltenen Werte werden(Ahexv)0
genannt.
II. Aus der
Einstellgeschwindigkeit
ohne Fremddruck(Anfangs-bedingung
AhA
<Ahm&x,
pMm =0).
14W.Kuhn, Z.Elektrochem.
angew.
physik.
Chem. 55 (1951) 207.permeablen
Membranen,III. Aus der
Durchtrittsgeschwindigkeit
desLösungsmittels
durchdie Membran in eine
Lösung
unter derWirkung
einesüberlagerten
Fremddruckes bei derSteighöhendifferenz AhA
= 0.Die osmotischen Drucke wurden dabei aus den Meßwerten der
beiden letzten Verfahren II und III über
nv = Ah qlm
+
hLsg
Aq
+
pMan+
KE
v g• cnr2(5)
berechnet.
hLsg
gibt
dabei dieSteighöhe
derLösung
über der Membran-mitte an 16. Verfahren III konnte selbstverständlich nur bei denstarren Glasmembranen
durchgeführt
werden,
nicht aber bei den einen schwachen Balloneffekt aufweisendenCellophanmembranen6.
Dieser
geringe
Balloneffektbeeinträchtigt
beirichtiger
Osmometer-konstruktion die Meßwerte nach dem VerfahrenII nicht15. DerAus-gleich
des Nachlaufs und derTemperatur
wurde über dieFlüssigkeits-bilanz bestimmt13. Soweit an den Glasmembranen
nachgeprüft,
waren die erhaltenen osmotischen Druckeunabhängig
von derRühr-geschwindigkeit
(<
100U/min).
An anderer Stelle konnte
gezeigt
werden,
daß die nach dem Ver-fahren I erhaltenen(AhexA0-Werte
mit dem nach dem VerfahrenIIgewinnbaren
ZlA„-Werten
identischsind,
sofern mandie beizuschnel-lem Einströmen des
Lösungsmittels
(zu
kleinezíímax-Werte)
auftreten-den anomalen Osmosen nicht
berücksichtigt15.
Über
diese anomalen Osmosen wird in einer weiteren Arbeit17 berichtet.Zur Kontrolle wurde
gelegentlich
die Konzentration derLösung
nach beendeter
Messung
gegen die derAusgangslösung
in einemDifferentialrefraktometer gemessen, die
Abweichungen
waren in derRegel
weitgeringer
als 2%.
3.
Ergebnisse
3.1.
Durchlässigkeit
und Stabilität der Membranen DieBestimmung
der osmotischen Drucke ns nachdynamischen
Verfahrensetztvoraus, daß die Membran mit dem
Lösungsmittel
über diegesamte
Meßzeit ein stabilesGelsystem
bildet. Es dürfen also keineQuellungs-
oderEntquellungserscheinungen
auftreten,
da durch diese nicht nur dieDurchlässigkeit
für dasLösungsmittel,
sondern16 G. V. Schulz in H. A. Stuart„Die
Physik
derHochpolymeren",
BandII, „Das Makromolekül inLösungen",
p. 388,Springer-Verlag,
Berlin,Göttingen,
Heidelberg,
1953.17 H.-G.Elias,Z.
auch diefür das Gelöste verändert wird. Bei solchen instabilen
Mem-bransystemen
ist somit dieHöhedesStaverman-EffektesvonMessung
zuMessung
verschieden.Eine
Untersuchung
von Ritscher und Elias5ergab
nun, daßCellophan
nurmitWasser,
MethanolundDimethylformamid
über dieerforderlichen Meßzeiten stabile
Gelsysteme
bildet,
nicht aber z.B.mit
Aromaten,
Aliphaten,
Butanon und chloriertenAliphaten.
Es erschienjedoch
wünschenswert,
außer diesen dreiLösungsmitteln
noch andereheranzuziehen,
wozu wegen ihrer chemischenÄhnlichkeit
mitDimethylformamid
bzw.Methanol Formamidbzw.Benzylalkohol
aus-gewählt
wurden. DerEinfluß
desQuellungsverhaltens
derCellophan
600-Membranen in diesen
Lösungsmitteln
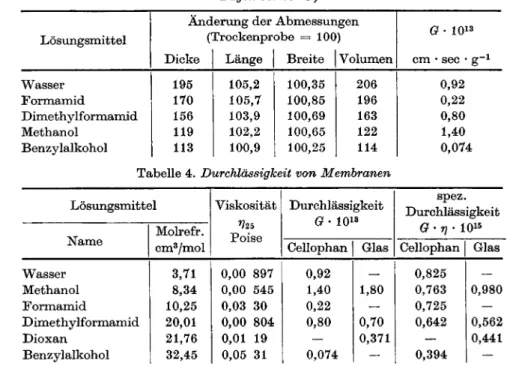
ist in Tab.3widergegeben.
Aus Tab.3
geht
hervor,
daß dieQuellung
inKalandrierrichtung
(=
Breite)
sehrgering,
stärkerdagegen
quer zurKalandrierrichtung
(=
Länge)
und außerordentlich stark in der Dickeist. DasQuellungs-verhalten ist von
Lösungsmittel
zuLösungsmittel
verschieden,
eineZuordnung
zudenMoleküleigenschaften
desLösungsmittels
kann nach denvorliegenden
Daten nichtgetroffen
werden.Tabelle 3.
Quellung
von Cellophan 600 in verschiedenen Lösungsmitteln(nach
Tagenbei25°C)Lösungsmittel
Änderung
derAbmessungen
(Trockenprobe = 100)
Dicke
]
Länge
|
Breite|
VolumenG 1013 cm • sec g" Wasser Formamid
Dimethylformamid
MethanolBenzylalkohol
195 170 156 119 113 105,2 105,7 103,9 102,2 100,9 100,35 100,85 100,69 100,65 100,25 206 196 163 122 114 0,92 0,22 0,80 1,40 0,074Tabelle 4. DurchlässigkeitvonMembranen
Lösungsmittel
Name Molrefr.cm3/mol
Viskosität PoiseDurchlässigkeit
G 1013Cellophan
Glas spez.Durchlässigkeit
G n 1015Cellophan
Glas Wasser Methanol FormamidDimethylformamid
DioxanBenzylalkohol
3,71 8,34 10,25 20,01 21,76 32,45 0,00 897 0,00 545 0,03 30 0,00 804 0,01 19 0,05 31 0,92 1,40 0,22 0,80 0,074 1,80 0,70 0,371 0,825 0,763 0,725 0,642 0,394 0,980 0,562 0,441permeablen
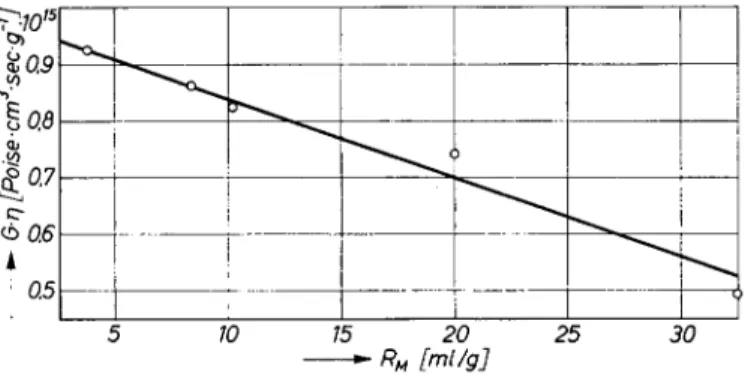
Membranen,Wie Tab.4
zeigt,
ist die„spezifische
Durchlässigkeit"
G r/ beiCellophanmembranen
nichtkonstant,
sondern nimmt mit derMolekül-größe
desLösungsmittels
ab. Als Maß dafür wurde die Molrefraktiongewählt,
dievomAggregatzustand
unabhängig
ist und daher direkt denRaumbedarfeines einzelnen Moleküles
angibt.
Aus Abb.3 entnimmt man, daß eine direkteProportionalität
zwischenspezifischer
Durch-lässigkeit
und Molrefraktion desLösungsmittels
besteht. Das Fließen vonFlüssigkeiten
durchCellophan
600(=
Cellulosehydrat) geht
daher nichtwie dasPoiSEUiLLE-Fließendurch ein NetzwerkvonMakroporen
vonstatten,
wiegelegentlich
geäußert
wurde18,
zumindestnichtbeidenI
oß-9"-^^^-r|
0.7-^->^^^-1-tí>0.6-—^^^^-05-1-(i
: I I_;_,_i_I_1 5 10 15 20 25 30 --RM [ml/g]Abb.3.
Abhängigkeit
derspezifischen
DurchlässigkeitvonCellophan
600—
Mem-branenvonderMolekularrefraktion des
Lösungsmittels
hier untersuchten stabilen
Gelsystemen.
DerLösungsmitteltransport
geschieht
vielmehrhauptsächlich,
wennnichtganz, überPlatzwechsel-prozesse imMembranmaterial und nichtüber verschieden weite Poren. Die
Tatsache,
daß diespezifische Durchlässigkeit
selbst beisehr kleinem Platzbedarf derLösungsmittelmoleküle
nicht konstantwird,
be-stätigt
denelektronenmikroskopischen
BefundvonKanig(vgl.7),
daß die„Poren"
imCellophan
600 Durchmesser vonweniger
als 20Á
haben müssen.Eine direkte
Ausmessung
der Dimensionen von Glasmembranenergab,
daß zwarvöllig
trockene Membranen stark in Wasserauf-quellen,
beimÜberführen
von an der Luftliegenden
Membranen inverschiedenen
Lösungsmitteln jedoch
keineÄnderung
desQuellungs-18 E. I.Valko in E. Ott
„High Polymers",
Vol.5 „Cellulose and Cellulose Derivatives",p. 415,Interscience Publ. Inc.,NewYork,N.Y., 1943.zustandes bei den untersuchten
Lösungsmitteln
Wasser,
Dimethyl-formamid,
Methanol,
Formamid undBenzylalkohol
auftrat. Nacheinmal
erfolgter Absättigung
der Oberfläche mit Wasser wird dieses also nicht mehr durch andereLösungsmittel verdrängt,
die Membran benimmt sich dann als reine Porenmembran.Die
spezifische Durchlässigkeit
von Glasmembranennimmt für die untersuchtenLösungsmittel
Dioxan,
Dimethylformamid
und Methanolebenfalls mit der Molrefraktion
ab,
die Charakteristik scheint dabeiausgeprägter
als beimCellophan
zu sein(Tab.
4).
Leider konnten ausäußeren Gründen nichtnoch weitere
Lösungsmittel
untersucht werden.3.2.
Zeitabhängigkeit
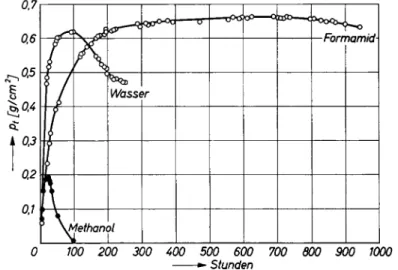
osmotischer DruckeBeginnt
man osmotischeMessungen
beigeringeren
Drucken als demAnfangszustand entsprechen
würde,
dann wachsen mitfort-schreitender Zeit die
Steighöhendifferenzen
an, durchlaufen einMaxi-mumundsinkendurch dieweitere Permeation wieder ab. Aus solchen
Messungen
versucht manhäufig
Schlüsse auf die Permeabilität der Membran für das Gelöstezu ziehen. Insbesonderedie nacheiniger
Zeitauftretende Konstanz der
Steighöhendifferenz
wird als beweisend für dieSemipermeabilität
der Membranangesehen.
Abb.4
zeigt einige
solcherMessungen
für dasPolyäthylenglykol
AG4000 in verschiedenen
Lösungsmitteln.
Die untersuchte MembranwarC
600,
derKapillardurchmesser
2mm, dieTemperatur
25°C,
dieanfängliche Steighöhendifferenz AhA
= 0cm. Die Konzentration warbeiallen
Messungen
etwagleich
(0,02
°/0),
siebetrug
bei denMessungen
in Methanol0,0204
g/100
ml,
bei deneninWasser0,0197
g/100
ml und bei denen in Formamid0,0218
g/100
ml.Wie aus Abb.4
hervorgeht,
ist derKurventyp
zwar bei allen dreiLösungsmitteln
etwagleich,
im einzelnen sindjedoch
recht erhebliche Unterschiede vorhanden. Sowirdz.B.das Maximum bei derLösung
in Methanol schon nach 22Stundenerreicht,
nach 100 Stunden istda-gegendie
Steighöhendifferenz gleich
null. Beim Formamidandererseitsist das Maximumaußerordentlich
schwierig
zulokalisieren,
esliegt
beietwa650 Stunden
(27
Tagen).
EineungenauereMessung
ohneKatheto-meternurmit
graduierten
Kapillaren
könnte sogareineKonstanz desosmotischen Druckes über 700 Stunden
vortäuschen,
also über diedoppelte
Zeit,
die bis zum Erreichen dieser Konstanz auf¿0,2
mmerforderlich ist. Zu kurze Meßzeiten und zu ungenaue
Messungen
permeablenMembranen,
Beobachtungen
verantwortlichsein,
daß eine Membran Teile einesmolekulareinheitlichen Gelösten noch zurückzuhaltenvermag
(vgl.
19).
Auch die Höhe des Maximums ist bei
jedem Lösungsmittel
ver-schieden. Sie nimmt mitsteigender
Viskosität desLösungsmittels
zu,jedoch keineswegs
proportional.
Wäre nun die Viskositätreziprok
proportional
dem Diffusionskoeffizienten und dieser wiederproportio-nal dem
Permeationskoeffizienten,
dann müßteProportionalität
zwischen maximalerSteighöhe
und Viskosität vorhanden sein. Die Nichtexistenz eines solchen Verhaltensbestätigt
also den weiter oben700 200 300 400 500 600 -•-Stunden
800 900 1000
Abb.4.Einfluß desLösungsmittelsaufdie
Zeitabhängigkeit
osmotischer Drucke an permeablen Membranen (ca. 0,02°/oige Lösungen des PolyäthylenglykolsAG4000 anCellophan 600, sieheText)
gezogenen
Schluß,
daß dieStrömung
durchCellophanmembranen
nicht durchMakroporen,
sondernüberwiegend
überPlatzwechselprozesse
im Membranmaterial
erfolgen
muß.Abb.4
zeigt
somit,
daß die maximaleHöhenicht demtheoretischenosmotischen Druck
entspricht.
Aber auch die durchAuftragen
desLogarithmus
derSteighöhendifferenz
gegen die Zeit durchExtra-polation
auf die Zeit null erhaltenen(£>exp)0-Werte
entsprechen
nichtdem theoretischen Druck. Wie Tab.5
zeigt,
inder dieentsprechenden
Drucke ing/cm2
für die drei Versuche der Abb.4zusammengestellt
19E. J.
Breton,Diss.Abstr.18(1958)822,Publ.No. 25409,réf.:Kolloid-Z.
Tabelle5.
Lösungsmitteleinfluß
aufdieosmotischen Druckwerte(AG4000, G600, r = 1mm, AhÄ = 0cm)
Lösungsmittel pm¡lx pexp ntheor
?W2W
P^Jn
Methanol 0,159 0,350 1,47 2,20 0,24
Wasser 0,627 0,746 1,42 1,19 0,52
Formamid 0,749 0,780 1,57 1,04 0,50
sind,
liegen
diepexp-Werte
viel tiefer als dietheoretischen osmotischenDrucke.
Aus den
Beobachtungen geht
hervor,
daßausderartigen Messungen
keinerlei Rückschlüsse aufdie Permeabilität einer Membran
möglich
sind. Diesewirdja
üblicherweise als nurdurchMembranstruktur undMolekülgröße
des Gelöstenbedingt
angesehen,
waseigentlich
nur bei der mechanischenAusfilterung kompakter,
kugelförmiger
Makro-moleküle an relativgrobporigen
Membranen zutreffen kann.Das bei unbekannten Substanzen
einzig experimentell zugängliche
Verhältnis
pexplpma,x
kannkein Maß für die Permeabilitätsein,
da esnicht für alle
Lösungsmittel
konstantist,
sondern mit zunehmender Viskosität desLösungsmittels
abnimmt,
um schließlich bei unendlichhoher Viskosität des
Lösungsmittels
dem Wert 1 zuzustreben. Aber auchbeiunendlich hoher Viskosität desLösungsmittels
wirdbeiden ge-wähltenBedingungen
zumindest bei endlichenKonzentrationen nichtdertheoretische osmotische Druck
erreicht,
der aus demanderweitig
bekannten Zahlenmittel des
Molekulargewichtes
und dem 2.Virial-koeffizienten unterBerücksichtigung
der Uneinheitlichkeit(vgl. 15)
ausViskositätsdaten berechnet wurde
(vgl.5).
Die
„Permeabilität"
einerMembran für Makromolekülehängt
dem-nach nicht nur von der Membran bzw. demMolekulargewicht
des Gelöstenab,
sondern auch noch vomLösungsmittel
undwahrschein-lich auchvon der Konstitution des
Polymeren.
Dazukommt,
daß derKurvenverlauf stark von der
Meßanordnung abhängen
kann,
unterUmständen wird trotz
präparativ
feststellbarer Permeation des Ge-löstenüberhaupt
keinSteighöhenmaximum
erreicht20. Ein„Aus-testen" von Membranen mit einer
Standardlösung
einesPolymeren,
wie es kürzlich wiedervorgeschlagen
wurde21,
kann somit zuvöllig
irreführenden
Ergebnissen
führen,
wenn die Resultate auf anderePolymere
in anderenLösungsmitteln
übertragen
werden.20L.H.Tung, J.
Polymer
Sei. 32 (1958) 477.21H. HelleritzundH.
permeablen
Membranen,3.3.
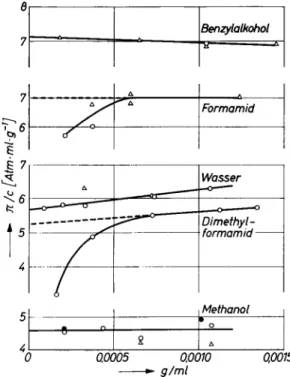
Konzentrationsabhängigkeit
osmotischer Drucke Die osmotischen Drucke bei den verschiedenen Konzentrationenwurden an
Cellophan
600-Membranen nach den Verfahren I undII,
an den Glasmembranen nach dem VerfahrenIII ermittelt.Die
Meßergebnisse
sind in den Abb.5 und 6aufgetragen.
Manent-nimmtder Abb.
5,
daß die verschiedenenLösungsmittel
anCellophan
600 ein sehr unterschiedliches Verhaltenzeigen.
Während für dieBenzylalkohol
VrJS
O) 0 Formamid Methanol 0.0005 0,0010 -»- g/ml 0,0015Abb. 5. Einfluß desLösungsmittelsauf die reduzierten osmotischen Druckevon
Polyäthylenglykol AG4000 an
Cellophan
600. (O A7¡.exp
[2mm Kapillar-durchmesser], •Ahe%v
[1,2mm Kapillardurchmesser], a Ahv)Messungen
inMethanol,
Wasser undBenzylalkohol
eine lineareAb-hängigkeit
derreduzierten osmotischen Druckevonder Konzentration auchbeisehrniedrigen
Konzentrationengefunden
wurde,
tratbei denMessungen
in Formamid undDimethylformamid
jener progressive
Abfall der reduzierten osmotischen Drucke
auf,
der bereits von denMessungen
anPolyäthylenglykolen
andererMolekulargewichte
inDas Konzentrationsverhalten scheint somit entscheidend von den
charakteristischen
Gruppen
desLösungsmittels abzuhängen.
Ohne zusätzlicheMessungen
kannjedoch
nichts über die den Effektbedin-genden
Größenausgesagt
werden.Bei den
Messungen
anGlasmembranen
ergab
sich ein ähnliches Bild(Abb.
6).
Hier wurden fürWasser,
Methanol undAceton mitab-nehmender Konzentration
progressive
Abfälle der reduzierten osmo-tischen Druckegefunden,
nichtjedoch
fürBenzol,
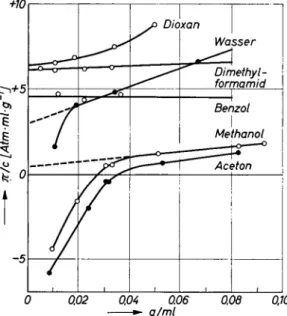
Dioxan undDime-+10r
0.06
g/ml
Abb.6. Einfluß desLösungsmittels auf dieosmotischenDruckevon
PolyäthylenglykolAG4000an Glasmembranen
thylformamid.
Schon bei ca.3°/0igen Lösungen
traten beim Acetonund beim Methanol
negative
osmotische Drucke auf.Aus der
Extrapolation
derAsymptoten
zu höheren Konzentratio-nenauf
die Konzentration null lassensich die scheinbarenMolekular-gewichte
berechnen5. Siesind
zusammenmitdemSTAUDINGER-Index
in demjeweiligen Lösungsmittel
und der Viskosität in Tab.6zu-sammengestellt.
Aus ihr
geht
zunächsthervor,
daß für ein und dieselbe Substanzan dergleichen
Membran bei den einzelnenLösungsmitteln
verschieden hoheMolekulargewichte gefunden
werden.DaanPolyäthylenglykolen
in verschiedenenLösungsmitteln praktisch gleiche
Gewichtsmittel
despermeablen
Molekulargewichtes gefunden
wurden5,
kann es sich bei diesem Effekt keinesfalls um dieAuswirkung
von in den einzelnenLösungsmitteln
unterschiedlichenAssoziationsgraden
desPolyäthylenglykols
handeln.Dagegen spricht
auch die an den einzelnenMembrantypen
gefundene
unterschiedliche Größe des Effektes.Tabelle 6. Selektivitätskoeffizienten alsFunktion desLösungsmittels beim
PolyäthylenglykolAG4000
Lösungsmittel
(c Poise)Vlmml/g
M, anCellophan
600 Glas Aceton Methanol BenzolDimethylformamid
Wasser Dioxan FormamidBenzylalkohol
0,303 0,545 0,603 0,802 0,897 1,19 3,30 5,31 10,5 9,85 11,2 11,8 12,9 11,9 11,9 13,8 5300 4500 4300 3600 3400 negativ 61000 5450 4100 8150 3 800Nach Tab.6 werden in der
Regel
um soniedrigere
Molekular-gewichte gefunden, je
höher die Viskosität desLösungsmittels
ist. Daß dieser Befund kein Einzelfallist,
zeigten
Messungen
amPolyäthylen-glykol
AG 10000 anGlasmembranen,
bei denen sich in Dimethyl-formamid(0,802
cP)
einMolekulargewicht
von 10400(Zehntausend-vierhundert),
in Methanol(0,545
cP)
dagegen
eines von 98000(Acht-undneunzigtausend)
ergab.
Auch aus den
Messungen
desAnfangszustandes geht
also ebenso wie aus denen derZeitabhängigkeit
osmotischer Druckehervor,
daß durch Austesten einer Membran mit einer Substanz bekanntenMole-kulargewichtes keineswegs
bei einem einmalgefundenen „richtigen"
Molekulargewicht geschlossen
werdenkann,
daß diese Membran nun-mehr für alle Stoffe desgleichen Molekulargewichtes
und höher denSelektivitätskoeffizienten 1 aufweist.
DieUnterschiede bei denosmotischen
Messungen
anverschiedenenLösungsmitteln
könntendurchdie verschiedenhohe Permeabilität desGelösten,
durch denLösungszustand
des Makromoleküls oder durchden Zustand des
Membransystemes
in derUmgebung
des Gelöstenbedingt
sein. Außerdem könnte dieLösungsmittelabhängigkeit
durchdie Meßtechnik
hervorgerufen
sein. Es läßt sichjedoch
zeigen,
daßzumindest beim
Cellophan
600keiner dieserEinflüsse für diegefundene
Einmal kann sie nicht durch einen Verlust an Substanz durch
Permeation,
Adsorption
oderAbsorption hervorgerufen
wordensein,
da dieÜberprüfung
der Konzentrationen und der osmotische Teststets
ergaben,
daß die Konzentrationen sich z.B. an Glasmembraneninnerhalbvon8 Stundenumnicht mehrals maximal2
°/0
änderten. Die Meßzeiten waren aber stetsgeringer.
Eine verschieden hohe Permeabilität für das Gelöste durch
Ver-änderung
desMembranmateriales,
d.h.größere
oderkleinere„Poren"
kann ebenfallsausgeschlossen
werden,
daan Glasmembranen beiver-schiedenen
Lösungsmitteln überhaupt
keineÄnderung
des Membran-zustandesgefunden
wurde. Bei denCellophanmembranen
ging
dieQuellung
auch nichtsymbat
mit derViskositätdesLösungsmittels,
wäh-renddies
jedoch
fürdie reduzierten osmotischen Druckegefunden
wurde.Als Maß für den
Lösungszustand
desPolyäthylenglykols
kann derSTAUDiNGER-Index
angesehen
werden,
derja
direkt mit dem2.Virial-koeffizienten
verknüpft
ist. EinGang
des osmotisch bestimmtenMole-kulargewichtes
mit dem STAUDiNGER-Index konntejedoch
nicht ge-funden werden(vgl.
Tab.6).
Damit istausgeschlossen,
daß der ver-schiedeneLösungszustand (z.B.
verschieden hoheSolvatation)
diegefundene Lösungsmittelabhängigkeit
hervorruft.Es konnte ferner
gezeigt
werden15'17,
daß beimCellophan
600meß-technische Effekte wie Variation des Abstandsfaktors und
anomal-positive
Osmose bei den benutzten Methoden keine Rollespielen.
Außerdem würde eineanomal-positive
Osmoseja
als um so stärkergefunden
werden,
je
höher dieGeschwindigkeit
desDurchströmens,
d.h.
je niedriger
die Viskosität ist.Gegen
dieseDeutung
stehen dieDaten der Tab.
6,
nach denenbesondersniedrige
reduzierte osmotische Druckegerade
beiniedrigen
Viskositäten und zum Teil auch Kon-zentrationengefunden
wurden.Bei den Glasmembranen läßt sich
jedoch
nicht mit Sicherheitaus-schließen,
daß Teiledergefundenen Lösungsmittelabhängigkeit
durcheine
anomal-negative
Osmosebedingt
sind. Daraufdeuten bereits dernegative
Ordinatenabschnitt beiden reduziertenosmotischen Druckender
Lösungen
in Aceton und dasverhältnismäßig
zu hochgefundene
Molekulargewicht
bei denwäßrigen
Lösungen.
4. Diskussion
Nach den im Abschnitt 3.3 beschriebenen
Ergebnissen hängen
dieDrucke bei der Konzentration null
(n/c)0,
die demMolekulargewicht
Ms reziprok proportional
sind,
zumindest im Falle derCellophan-membranen wedervonmeßtechnischen Effektennochvon
Änderungen
des Gelzustandesder MembranodervomLösungszustand
des Gelösten ab. DerBefund,
daß mit fallender Viskosität höhereMolekular-gewichte gefunden
werden,
muß somit in dem Mechanismus derOsmose an
permeablen
Membranen selbstgesucht
werden.Vom
Standpunkt
derThermodynamik
irreversibler Prozesse ist es dabei ohne weitereseinleuchtend,
daß der in der Zeiteinheit stattfin-dendeEntropietransport
um sogrößer
ist,
je geringer
dieViskositätdes Mediums ist. Für eine molekularkinetischeDeutung
muß aber offen-sichtlich der Mechanismus derImpulsübertragung
genauer diskutiertwerden,
wobei eine unendlich verdünnteLösung
vorausgesetzt
wird.Hat man aufbeiden Seiten einer Membran reines
Lösungsmittel,
sokompensieren
sich dieImpulse
völlig:
dieSteighöhendifferenz
imGleichgewicht
(der
„osmotische
Druck")
ist null. Gibt manjetzt
auf die eine Seite derMembran,
die zunächst alsstreng
semipermeabel
gedacht
seinsoll,
eineLösung,
aufdie andere reinesLösungsmittel,
so wird imGleichgewicht
den Molekülen des Gelösten in der Nähe der Membran eineBewegungskomponente
zum Innern derLösung
zu-erteilt,
da die Membran für sieja
definitionsgemäß
undurchlässig
ist. Im Innern derLösung
erfolgt
nunallerdings
einevöllige
Kompen-sation derImpulse,
nichtjedoch
an der OberflächezumfreienDampf-raum, da hier nach Eucken22 die alleroberste Schicht der
Lösungs-mittelmoleküleeinseitige,
nach außengerichtete
Impulse
von denMolekülen des Gelösten erhält.
Natürlich
erfolgt
kein direkter Stoß dergelösten
Teilchen mit derWand,
sondern eine zunehmend stärkereVerzögerung
derBewegung,
wie dies die Versuche von Careri(vgl. 23)
über die Selbstdiffusion in derNähevon Wändenzeigen.
DieseVerzögerung
wirkt also genau so, wie dieseinerzeitvonJoos24postulierten Abstoßungspotentiale.
Nach denRechnungen
von Fixman25über denTransport
von Momentenistdie
Verzögerung
beigegebenem
Abstandvon derWand
um sogrößer,
je
höher dieViskosität unddie MassenderLösungsmittelmoleküle
undje
niedriger
die Dichte und dieTemperatur
sind. Da aber bei einer22 A.
Eucken, Z.
physik.
Chem.,Abt. A 168(1933) 309.23 Erwähnt bei J. E.Mayer,
Physics Today
11 (1958) 22.24 G.
Joos, Z.
physik.
chem. Unterricht 54(1941) 65.25M.
semipermeablen
Membran außer der sichkompensierenden
Impuls-übertragung
durch dasLösungsmittel
keine weitereImpulsüber-tragung
durch die Membran stattfindenkann,
bleibt dieImpulsbilanz
auf der
Lösungsseite
erhalten. Der osmotische Druck wird daherunabhängig
von der Viskosität desLösungsmittels gefunden.
Anders
liegt
die Sachebei einerpermeablen
Membran. Hierwerdendie Moleküle in unmittelbarer Nähe der Wand
ja
nichtvöllig
ab-gebremst,
sondern können noch in die Membran eintreten und auf diese Weise durch die Membran hindurchImpulse
auf dieLösungsmittel-moleküle der
Lösungsmittelseite
übertragen.
Die soübertragene
Impulsmenge
geht
aber für dieLösungsseite
verloren. DieseImpuls-menge wird nunaber bei
gegebener
Masse desGelösten,
d. h. beigleich
großem Molekulargewicht,
um sogrößer
sein,
je größer
dieGeschwin-digkeit
dergelösten
Teilchen ist. Diese ist wiederum um sohöher,
je
niedriger
die Viskosität ist. Bei einem hochviskosenLösungsmittel
erhältman daher für die
Lösungsseite
einengeringeren
Impulsverlust
als bei einemniedrigviskosen,
mit anderenWorten,
derbei einer gege-benen Membran und beigleichem
Gelösten vorhandene osmotische Druckist um sogrößer, je
höherdieViskosität desLösungsmittels
ist. Als Maß für dieAbweichung
des gemessenen osmotischenDruckesvomtheoretischzuerwartendenkann dervonStaverman1
eingeführte
Selektivitätskoeffizient s dienen: ns = s •ntheor. Für die
Konzen-tration null kann man die reduzierten osmotischen Drucke durch die
reziproken
Molekulargewichte
ersetzen, s und beigegebenem
Mole-kulargewicht
damit auchÍ/M,
müssennach den entwickeltenVorstel-lungen
daher direktproportional
der Viskosität desLösungsmittels
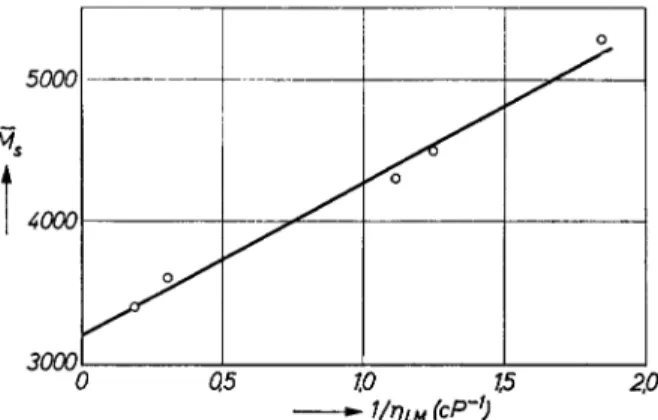
sein. InAbb.7istzurPrüfung Ms
gegenl/r¡
für dieMessungen
amPoly-äthylenglykol
AG4000anCellophanmembranen
aufgetragen,
dadieseAuftragung
eine bessereExtrapolation
auf unendliche Viskosität erlaubt.Siezeigt,
daß diegeforderte Proportionalität
tatsächlichvor-züglich
erfüllt ist. Für unendlichhohe Viskosität erhältmaneinMole-kulargewicht
vonMn
= 3200.Bei den Glasmembranenist das Verhalten
unübersichtlicher,
dochnimmt auchhier im
allgemeinen
dasgefundene Molekulargewicht
mitder Viskosität des
Lösungsmittels
ab.Allerdings zeigen
der relativ zu hochliegende
WertfürWasser und dernegative
WertfürAceton,
daß die Meßwerte hier noch durch die elektrokinetischenErscheinungen
beeinflußtsind.EineausführlicheBeschreibung
deranomalenOsmosenpermeablen
Außer für die Praxis der osmotischen
Messung
an makromole-kularen SubstanzenundfürdiekinetischeTheorie osmotischerDrucke besitzen die in dieser Arbeitaufgezeigten
Befunde auch erheblichesInteresse für die
physiologische
Chemie.Beipflanzlichen
und tierischen Zellen wurdehäufig
beobachtet,
daß einTransport
von Substanz ent-gegen demKonzentrationsgefälle
stattfindet. DieErscheinung
wird„aktiver
Transport"
genannt
(für
Literaturvgl.
z.B.26).
Zu ihrerDeutung
sind viele verschiedene Theorienaufgestellt
worden,
diejedoch
alle davonausgehen,
daß derosmotische Druckauchan perme-ablen Membranen direktproportional
der Konzentration desGelöstenist.
5000-
4000-^—-0 0.5 1,0 15 2,0
-<~1/nLM(cP-<)
Abb. 7.
Abhängigkeit
der osmotischenMolekulargewichte
vonPolyäthylenglykol AG 4000anCellophan600vonderreziproken
Viskosität desLösungsmittelsDurch den
STAVERMAN-Effekt
müssenaber die osmotischenDruckean
permeablen
Membranenvonpflanzlichen
undtierischen Zellenvielgeringer
sein,
als demKonzentrationsunterschied unterEinbezug
der klassischenthermodynamischen Wechselwirkungsglieder entspricht.
Der meßbare osmotische Druck wird ferner durch die anomalen
Osmosen beeinflußt. Zweifellosist die
Trägerwirkung
auf diese Effektezurückzuführen. Durch die in dieser Arbeit
aufgezeigten
Staverman-Effekte und die anomalen osmotischenErscheinungen17
annichtgelade-nen,
permeablen
Membranen eröffnen sichjedenfalls
ganz neue theo-retische undexperimentelle
Perspektiven
für dieWirkungsweise
bio-logischer
Membranen.Die Arbeit wurde durch Mittel der Deutschen
Forschungsgemein-schaft
unterstützt,
wofür auch an dieser Stellegedankt
sei.26H.Netter. „Theoretische Biochemie",

![Tabelle 2. Diffusions-Koeffizienten D0, STAUDINGER-Jwdî'ces [r/] und Virialkoeffizienten *B von Polyäthylenglykolen in verschiedenen Lösungsmitteln](https://thumb-eu.123doks.com/thumbv2/123doknet/14924193.663667/5.662.63.546.251.595/tabelle-diffusions-koeffizienten-staudinger-virialkoeffizienten-polyäthylenglykolen-verschiedenen-lösungsmitteln.webp)