~I ~'.J-4t..ûl L.,;ir.J14.t~I ~I ~I J ~\Ali ~I oJljj
République Algérienne Démoctatique et Populaire
Ministère de l'Enseignement Supérieur et de la RechercheScientifique
J
,
. .
J ,
~ .,.•tl....a
.
Université de Jijel
1
Faculté des Sciences de la Nature et de la VieDépartement : Microbiologie Appliquée et ôl; ,,, .J l 'Jt
hl\
e-_,L-s.
~1
Sciences Alimentaires _, l
4ê4:hïl\
~.jl.JH.J_JS..JIr ·
,,i~ja:U\ ('~
Option : Microorganismes et pathogénicité
îh{lm{l
Effet antibactérien de l'association des antibiotiques et de l'extrait
méthanolique du fruit de zaarour jaune (
Crataegus azarolus) vis-à-vis
des souches bactériennes responsables des infections nosocomiales
Membres de Jury :
Président : Dr Boudjerda D.
Examinatrice: Dr Akroum S.
Encadreur : Dr Laggoune S.
Année Universitaire 2015-2016
Présenté par:
Boufiala Imane
BounamèsSarra
Nous remercions Allah le tout puissant de nous avoir donné le courage et la volonté de mener à terme ce présent travail.
Nous adressons nos remerciements aux personnes qui nous ont aidés dans la réalisation de ce mémoire.
Nous voudrions tout d'abord adresser toute notre gratitude à la directrice de ce mémoire, Mme Laggoune Souheila, pour sa patience, sa disponibilité et surtout ses judicieux conseils, qui ont contribué à alimenter notre réflexion.
Nous tenons également nos vifs remerciements à Dr Boudjerda D. et Dr Akroum S. membres de jury qui ont accepté d'évaluer ce travail.
Aux personnels du laboratoire de bactériologie de l'hôpital de Jijel et de l'hôpital universitaire de Constantine pour leur aide appréciable.
Enfin, nous nous adressons nos plus sincères remerciements à nos familles : nos parents qui ont toujours été là pour nous, nos sœurs, nos frères et tous nos proches et amies, qui nous ont accompagné, aidé, soutenu et encouragé tout au long de la réalisation de ce mémoire.
Abréviation Désignations ATCC American Type Culture Collection
CHU Centre Hospitalier Universitaire EPH Etablissement Public Hospitalier
ECBU Examen Cyto-Bacteriologique des Urines.
MeOH Méthanol
CMI Concentration Minimal Inhibitrice. ONPG Ortho-Nitro-Phenyl-P-Galactoside
TSI Triple Sugar Iron
VP Vogues-Proskauer
RM Rouge de Méthyle
ADH Arginine Di-Hydrolase
LDC Lysine Décarboxylase
ODC Ornithine Décarboxylase
MH Muller Hinton
SARM Staphylococcus aureus Résistant à la Méthicilline NCCLS National Committee for Clinicat Laboratory Standard
DO Densité Optique SM Solution Mère AML Amoxicilline P10 Pénicilline CT Colistine Sulfate µg Micro gramme
Figures Titres Pages Figure 1.1 A : Coupe longitudinale et transversale de fruit, B : fruit du 3
C. azarolus
Figure 1.2 6
Structure chimique des majeurs flavonoïdes et procyanidol présents dans Crataegus
Figure IV.1 Procédés de l'extraction d'Emet de Crataegus azarolus 13
Figure IV.2 Protocole du test de l'aromatogramme 18
FigurelV.3 Protocole du test de la CMI 20
Figure V.1 Les observations microscopiques A : P. aeruginosa, B : S. aureus 21
Figure V.2 Les résultats de !'antibiogramme. A: E. coli, B: A. baumannii, 24 C : P. aeruginosa, D : S. aureus.
Figure V.3 Résultats de l'association de l'extrait méthanolique de 27
c.
azaro/us avec les antibiotiques, a: S. aureus,b:
Tableaux Titres Pages
Tableau IV.l Source des souches bactériennes étudiées 12
Tableau IV.2 Les différentes dilutions de la solution mère 17
Tableau V.l Les observations microscopiques 21
Tableau V.2 Résultats de l'identification biochimiques 22
Tableau V.3 Les zones d'inhibition des antibiotiques sur les souches 23 bactériennes utilisées
Tableau V.4 Les zones d'inhibition d'extrait sur les souches 24 bactériennes utilisées
Tableau V.S Résultats de l'association de l'extrait méthanolique de 25 C.
azarolus
avec l' AMLTableau V.6 Résultats de l'association de l'extrait méthanolique de 26 C.
azarolus
avec la P 10Tableau V.7 CMis en (µg/ml) de l'extrait méthanolique de 27 C.
azarolus
avec les souches bactériennes nosocomialesRemerciements Liste des abréviations Liste des figures Liste des tableaux
I11trod.11ctio11...
1 PARTIE BIBLIOGRAPIDQUEChapitre 1. Généralités sur l'espèce Crataegus azarolus
1.1. Etymologie ... .
1.2. Description ... .
1.3. Classification botanique ... .
1.4. Répartition géographique ... .
1.5. Propriétés thérapeutiques ... .
1.6. Composition chimique et valeur nutritionnelle ... .
1.7. Les métabolites secondaires élaborés par Crataegus azarolus ... ... .
1.7.1. Les flavonoïdes ... .
1.7.1.1. Définition ... .
1. 7 .1.2. Propriétés des flavonoïdes ... .
1. 7.2. Les tanins ... .
1.7.2.1. Définition ... .
1.7.2.2. Propriétés des tanins ... .
Chapitre II. Les infections nosocomiales
11.1. Définitions ... .
11.2. Sites anatomiques les plus touchés par l'infection nosocomiale ... .
11.3. Les bactéries responsables des infections nosocomiales ... .
11.4. Aspects écologiques de !'antibiothérapie ... .
11.5. Aspects économiques de !'antibiothérapie ... .
11.6. Prévention des infections nosocomiales ... .
11.7. Prophylaxie de l'infection nosocomiale ... .
11.8. Descriptions de souches bactériennes nosocomiales étudiées ... .
11.8.1. Escherichia coli ... .
11.8.2. Pseudomanas aeruginosa ... .
11.8.3. Klebseilla pneumoniae ... .
11.8.4. Acinetobacter baumanni ... .
11.8.5. Staphylococcus aureus ... .
Chapitre III. Les agents antimicrobiens
111.1. Etymologie ... .
ID.2. Définition ... .
111.3. Les agents chimiothérapeutiques ... .
111.3.1. Les antibiotiques ... .
111.3.2. Classifications des antibiotiques ... .
111.3.3. Mode d'action de principales familles d'antibiotiques ... .
m
3 4 D . . d 0b0
• ·1· '
• . • escnption es antI 1otiques utI 1ses ... . 3 3 4 4 4 4 5 5 5 5 5 5 5 7 7 7 7 7 8 8 8 8 8 8 9 9 9 10 10 10 10 10 10 11 11 11
PARTIE EXPERIMENTALE
Chapitre IV. Matériels et méthodes 12
IV.1. Matériel . . . 12
IV.1.1. Matériel végétal . . . ... 12
IV.1.2. Matériel bactériologique... 12
IV.1.2.1. Origine des souches bactériennes étudiées . .. . .. . .. . . .. . .. . . . .. . ... . . . .. . . .. . . .. . . .. 12
IV.1.2.2. Les milieux de culture utilisés... 12
IV .2. Méthodes . .. . .. . . .. . .. . .. . . .. . 13
IV .2.1. Préparation de l'extrait brute méthanolique de Crataegus azarolus .. . ... . .. ... 13
IV.2.1.1. Dépulpage... ... 13
IV.2.1.2. Procédés d'extraction... 13
IV.2.2. Etude bactériologique... 13
IV.2.2.1. Revification des souches... 13
IV.2.2.2. Identification des souches bactériennes . .. . . .. . .. . . .. . .. . . .. . .. .. . .. . .. . .. ... 14
a. Caractérisations microscopiques .. . . .. . . .. . .. . . .. . . .. . . . .. . . .. ... . 14
b. Les tests biochimiques.. . . .. . . .. . . .. 14
1. Type respiratoire... 14 1.1.Test de Catalase . .. . .. . .. .. . .. . .. . . .. . .. . .. . .. . .. . .. . .. . .. . .. . .. . . .. .. . . .. .. . . .. . . . ... .. . ... 14 2. Métabolite glucidique... .. . .. . .. . .. . . .. . .. . .. . . .. .. . .. . . .. . . ... 14 2.1.Réaction O.N.P.G . . . .. . .. . .. . . ... . . 14 2.2.Mannitol mobilité . . . .. .. . .. . .. . .. . .. . .. .. . . .. . .. . . .. . . .. . . .. . . .. . . .. .. .. .... 15 2.3.Milieu TSI . . . 15 2.4.Citrate de Simmons . . . 15
2.5.Réaction de vogues-proskauer (VP) et de rouge de méthyle
(RM)... ... ...
153. Métabolisme protéique . . . 16
4. King A et King B... 16
IV.2.3. Méthodes d'étude d'activité antibactérienne de l'extrait... 16
IV.2.3.1. L'antibiogramme par diffusion sur milieu gélosé ... ... ... .... 16
a. DéflilÏtions d' Antibiogramme... 16
b. Procédé ... ,... 16
IV.2.3.2. L'aromatogramme par diffusion sur milieu gélosé . . . .. 17
a. Définition de l'aromatogramme... ... 17
b. Préparation des disques . .. . . .. . . .. . . .. 17
c. Préparation des dilutions d'extrait méthanolique de C. azarolus.. . . .. . . .. .. ... .. .... 17
d. Procédé . . . .. . . ... . . . .. . . .. .. 18
IV.2.3.3. L'antibiogramme en association avec l'extrait brute méthanolique de Crataegus 18 azarolus IV.2.3.4. Détermination de la CMI en milieu solide... 19
a. Définition . . . .. . . .. . . .. . . .. . .. . .. . . .. . . . .. .. .. . .. . . .. . . .. . . .. . . .. . . .... .. .. 19
b. Procédé... 19
Chapitre V. Résultats et discussion 21 V.l. Résultats . . . .. . . .. . . .. . . .. . . .. . . .. . .. . . .. 21
V.1.1. Identification des souches bactériennes... 21
V.1.1.1. Caractérisation microscopique des souches bactériennes étudiées... 21
V.1.1.2. Caractérisation macroscopique des souches bactériennes étudiées... 21
V.1.1.3. Résultats des tests biochimiques... 22
V.1.2.1. Résultats de !'antibiogramme... 23
V.1.2.2. Résultats de l'aromatogramme... ... ... 24
V.1.2.3.Résultats de L'association de l'extrait méthanolique de C. azarolus avec les 25 antibiotiques a. Résultats de l'association de l'extrait méthanolique de C. azarolus et l 'Amoxicilline 25 b. Résultats de l'association de l'extrait méthanolique de C. azarolus et le Pénicilline G 26 V.1.2.4. Détermination de la CMI (Concentration minimale inhibitrice)... 27
V.2. discussion des résultats... 28
Conclusion . . . 31
Références bibliographique... 33 Glossaire
Introduction
Dans toutes les régions du monde, l'histoire des peuples montre que les plantes ont toujours occupé une place importante en médecine. On appelle plante médicinale toute plante renfermant un ou plusieurs principes actifs capables de prévenir, soulager ou guérir des maladies. Les plantes aromatiques sont utilisées comme tous les végétaux en médecine, en parfumerie, en cosmétique et pour l'aromatisation culinaire. Elles font partie de notre quotidien sans que nous le sachions. Il reste difficile de définir les molécules responsables de l'action, bien que certains effets pharmacologiques prouvés sur l'animal aient été attribués à des composés tels que les métabolites secondaires (El amri et al, 2014).
Leur utilisation en phytothérapie connait de nos jours un intérêt sans précédent. Une telle thérapie prévient l'apparition des effets secondaires observe lors de l'utilisation des médicaments de synthèse chimique. En général, le corps humain est bien mieux adapté à un traitement à base de plantes qu'à une thérapeutique exclusivement chimique (Iserin, 2001).
L'Algérie dispose d'un ensemble d'espèces naturelles cultivées a gamme importante et variée. Cette richesse naturelle reste insuffisamment connue. Une bonne partie des ressources végétales à intérêt économique, social et sanitaire n'est pas connu du grand publique, ceci concerne soit les espèces aromatiques, condimentaires ou médicinales.
Des remèdes traditionnels à base de plantes ont été longtemps employés sans savoir à quoi étaient dues leurs actions bénéfiques, il reste difficile de définir les molécules responsables de l'action, bien que certains effets pharmacologiques prouves sur l'animal était attribués à des métabolites secondaires tels que les alcaloïdes et dérivés, les terpènes, les stéroïdes et les composés polyphenoliques (Bahorun et al., 1996).
A l'heure actuelle, l'apparition des bactéries résistantes aux antibiotiques et leur diffusion dans la population humaine constituent un réel problème de santé publique. C'est ainsi que le monde scientifique à découvert de nombreux traitements qui ont permis de réduire l'indice des maladies causées par ces germes. Malgré ce succès, on ne cesse d'enregistrer la résistance des bactéries aux antibactériens. Ainsi, le développement de nouveaux agents antibactériens s'avère indispensable pour lutter contre ces fléaux.
Face à ce phénomène d'antibiorésistant (notamment les bactéries nosocomiales), il apparait donc important d'orienter les recherches vers de nouvelles voies telles les extraits de plantes médicinales pour servir de base à l'obtention de nouveaux antibactériens. Selon les estimations de l'OMS en 2002, plus de 80% de la population en Afrique utilise encore la médecine traditionnelle pour répondre à leur besoin de soin et de santé. Ainsi, pour aider ces populations à revenu modeste à tirer un réel avantage de l'usage des plantes médicinales de leur pharmacopée (Kouadio et al., 2013).
Dans ce contexte, s'inscrit ce présent travail dont le but principal est d'étudier l'activité antibactérienne de l'extrait méthanolique du fruit de Crataegus azarolus L. ou « Zaaroura »,qui est un arbuste faisant partie des ressources végétales algériennes à intérêt économique et sanitaire. Les travaux de recherche entrepris jusqu'à présent n'ont concerné que son identification, sa caractérisation et sa préservation à des fins écologiques et pharmacologiques.
Introduction
L'azerolier est considéré comme plante médicinale largement utilisée dans la médecine traditionnelle comme bon remède pour les douleurs des appareils digestifs et urinaires (Rose et Treadway, 1999). Elle régularise les rythmes cardiaques, la circulation sanguine, l'hypertension artérielle et calme le système nerveux (Belouad, 2003). D'ailleurs, elle possède plusieurs activités thérapeutiques antispasmodique, astringente, diurétique, fébrifuge, hypotensive et sédative (Fernandez, 2003), antidiabétique (Henchiri et Zidi, 2011).
Afin de contribuer à la valorisation de cette espèce, on a réalisé une étude d'effet de l'association d'extrait méthanolique de
Crataegus
azarolus
avec les antibiotiques vis-à-vis les souches bactériennes nosocomiales,Les objectifs de ce présent travail sont fixés dans les trois points suivants : 1. Préparation de l'extrait brute méthanolique.
2. Etude de l'activité antibactérienne de l'extrait (seulement avec l'extrait méthanolique ensuite en association avec les antibiotiques).
3. Détermination de la Concentration Minimale Inhibitrice en milieu solide.
Cet étude s'inscrit dans le cadre de la caractérisation et de la valorisation du patrimoine végétal algérien ainsi que de lutter contre les infections nosocomiales.
Chapitre 1
Revue sur l'espèce
Crataegus
Chapitre/ Généralités sur l'espèce Crataegus azarolus 1.1. Etymologie
Crataegus azarolus: Azerolier ou Epine d'Espagne, en arabe Zaaroura, nommé par les anglophones Azarole Hawthorne.
• Crataegus : nom générique des Aubépines de la famille des Rosacées, désignant en latin « Crataegon» ou « Crataegos», l 'Azerolier ( Crataegus azarolus L.) peut être du grec (kratos ), par allusion à la dureté du bois (Couplan, 2000). Etaïx, aïgos, chèvre, car les caprins aiment à en brouter le feuillage (Couplan, 2012).
• azarolus : de l'espagnol
«
acerola» qui désigne le fruit, lui-même emprunte à l'arabe « az-zou'rour »;ce sont donc probablement les arabes qui ont introduit l' Azerolier en Afrique du nord, puis en Espagne (épine d'Espagne), d'où il passa ensuite en France (Mazzocchi et al., 1999; Brosse, 2000).1.2. Description
Crataegus azarolus, une aubépine méditerranéenne aux fruits appréciés qui est distingué par les caractéristiques suivantes :
-Un arbuste de 4-6m, très épineux;
-Il se distingue par un gros tronc, une écorce lisse, gris clair, devenant brunâtre et griscurée; -Des rameaux pourpres foncés de 2.5m de long;
-Des feuilles caduques, alternes, en forme d'éventail, de couleur vert-blanchâtre en dessous; -Fleurs blanches roses en inflorescences denses de 16 ou plus;
-Fruit charnu sub-globuleux ou ovoïde. De 1,5 à 2cm de diamètre, jaunâtres, à goût acidulé, agréable et à deux noyaux (Ferhat et al., 2014) (Figure 1.1).
Figure 1.1. A : coupe longitudinale et transversale de fruit, B : fruit du C. azarolus (Khiari et
al,
2015).Chapitre/ Généralités sur l'espèce Crataegus azarolus
1.3. Classification botanique
D'après Messaili (1995), La position taxonomique del' Azerolier est comme suit: Règne : Végétal
Sous-règne: Cormophytes (plantes à axe ou plantes vasculaires) Embranchement : Spermaphytes (plantes à graines)
Sous-embranchement : Angiospermes (plantes à fruits) Classe : Dicotylédones
Sous-classe: Dialypétales (Choripétales) Série : Calciflores
Ordre : Rosales Famille: Rosacées Tribu : Pirées Genre : Crataegus
Espèce : Crataegus azarolus
1.4. Répartition géographique
Il est commun dans les haies, en bordure des chemins de toutes les régions tempérées d'Europe (notamment en France), de l'Asie occidentale et de l'Afrique du Nord. L'azérolier est naturalisé en Amérique du Nord et cultivé en région méditerranéenne. En Algérie, l'arbre est surtout localisé dans le tell Algéro-Constantinois où il est connu sous le nom de 'Zaâroura'
(Boudraa et
al,
2010).1.5. Propriétés thérapeutiques
- Propriétés cardiotoniques, antispasmodiques et sédatives. - Une action sur la dilatation des artères coronaires.
- Son action calmante peut aider à lutter contre l'anxiété et l'insomnie. - Utilisée contre les diarrhées et les maux de gorge.
- Traitement du diabète (Tonelli et Gallouin, 2013).
- C'est une plante idéale pour la nervosité et le stress qui manifestent surtout sur le système vasculaire.
- Calme aussi très bien les extrasystoles.
- Facilite l'efficacité des traitements contre l'hypertension artérielle (Scimeca, 2006). -Empêche également l'accumulation du cholestérol dans le foie.
- Améliore la mémoire en stimulant l'irrigation du cerveau, qui est alors mieux oxygéné (Iserin, 2001).
1.6. Composition chimique et valeur nutritionnelle
Elle contient 103 Kcal d'énergie, 75g d'eau par lOOg de matière fraiche, très riche en calcium et potassium, un grand teneur des glucides, protides et lipides, elle contient aussi les sels minéraux comme le fer, le phosphore, le sodium, elle est relativement riche en
Chapitre 1 Généralités sur l'espèce Crataegus azarolus
1. 7. Les métabolites secondaires élaborés par Crataegus azarolus
Les métabolites secondaires sont reconnus par leurs activités biologiques nombreuses qui comprennent des activités antibactériennes, anticancéreuses, antifongiques, analgésiques, anti-inflammatoires, diurétiques, gastro-intestinales et antioxydants (Bruneton, 2009).
Les métabolites secondaires majoritaires du fruit de Crataegus azarolus, se présentent des polyphénols en quantités très importantes et comprenant : les flavonoïdes (flavones, flavonols) et des dérivés de flavanols et aussi comprennent des catéchines mais les flavanols majoritaires sont des proanthocyanidines ou procyanidines ou tanins condensés (Descheemaeker, 2001).
Les majeurs métabolites secondaires de cette espèce sont des flavonoïdes (1-2%) et des proanthocyanidols (2-3%) (Figure 1.2) (Bruneton, 1999).
1.7.1. Les flavonoïdes 1.7.1.1. Définition
Sont des molécules responsables de la coloration des fleurs, des fruits et parfois des feuilles (Bruneton, 1999). Les flavonoïdes sont des pigments solubles dans l'eau, présents
dans les vacuoles ; ils présentent le plus grand groupe de composés phénoliques chez les plantes. On décrit plus de 3000 flavonoïdes différents et ce sont probablement les métabolites secondaires végétaux les mieux étudiés. On divise les flavonoïdes en plusieurs classes telles que les anthocyanes, flavones et flavonoïdes, qui sont très répondus. La plupart des flavones et flavonols sont des pigments jaunâtres ou ivoires (Raven et al., 2000).
1. 7 .1.2. Propriétés des flavonoïdes
La principale propriété initialement attribuée aux flavonoïdes, est d'être vasculo-protectrice et veinotonique (Bruneton, 1999).
Actuellement, les flavonoïdes sont connus par de remarquables activités pharmaco- biologiques comme entre autres des effets hypocholestérolémiants (Formica et Regelson, 1995), antiviraux, antimicrobiens, et anticancéreux, antiallergiques, anti-inflammatoires, anti-thrombotiques, anti-tumoraux et hépato protecteurs (Middleton et
al,
2000) (Figure 1.2).1. 7 .2. Les tanins 1. 7.2.1. Définition
Les tanins condensés sont des polymères flavaniques. Ils sont constitués d'unités de flavan-3-ols liées entre elles par la liaison carbone-carbone, résultante du couplage entre le C-4 électrophile d'un flavanyle issu d'un flavan-C-4-ol ou d'un flavan-3,C-4- diol et une position nucléophile d'une autre unité, généralement un flavan-3-ol (Bruneton, 2009).
Les tanins hydrolysables sont des esters de l'acide gallique et du glucose. Les mono- et les digalloylglucoses ne présentent pas les propriétés classiques des tanins, leur masse moléculaire étant trop faible (Bruneton, 2009).
1. 7 .2.2. Propriétés des tanins
Le rôle biologique des tanins dans la plante est lié à sa propre protection contre les infections fongiques et bactériennes, les insectes et les animaux herbivores (Khanbaba et Ree, 2001)
Les tanins sont douées d'activités pharmacologiques remarquables et des effets caractéristiques sur la santé humaine Comme anti-inflammatoire, anti-cancer-génique (Okuda, 2005).
Chapitre 1 Généralités sur l'espèce Crataegus azarolus Chung et Wei (2001) ont trouvé que l'acide tannique a inhibe la croissance des bactéries,
des aliments, et des bactéries intestinales humaines. Ces molécules ont été rapportées comme
bactériostatique ou bactéricide sur plusieurs souches bactériennes.
Hydroxybeozoic acids and derivatives
z:·
Procatochuic acid
VanillicacidHyd.cQxycinnamic
ru.id~ 1'111 0p-.coumaric
ru."idChlorogenic
acidFtavaa-3-ols aad
proru1tllocyanidia~Aavonol aglyoones and
glyooside.~Anthocyanins glycosides
Quercetln-3-0-glucosicle
Quercefü1-3-0-ga1nctosicle
Quercetin-3-5-digluooside
Kaempherol-3-0-galnctoside
Kaempherol-3-0-glUC-Oside
Cyanidin-3-0-
glucoside
Cyanidin-3-0-ru-abinoside
RI
R2 R3OH
H
Hoc
H
H
Hl
OH H H H OH HOH
H
OH
HOH
H HH
H H OH HOH
H
glucose
galactose
diglucose
galacto.~gluoose
glucQ.se
ru-abinose
Figure 1.2. Structure chimique des majeurs Flavonoïdes et Procyanidol présent dans
Crateagus azarolus (Mraihi et al., 2015).
Chapitre II
Chapitre II Les infections nosocomiales 11.1. Définitions
La définition officielle de l'infection nosocomiale est donnée dans la circulation du 13 Octobre 1988 :«On entend par infection nosocomiale:
- Toute maladie provoquée par les microorganismes;
- Contracté dans l'établissement de soin par tout patient après son admission soit pour hospitalisation ou pour y recevoir des soins ambulatoires ;
- Que les symptômes apparaissent lors du séjour ou après que l'infection soit reconnaissable au plan clinique ou microbiologique ou encore les deux àla fois ; ces caractères concernent aussi les personnels soignants hospitaliers »(Meyer et al., 2004).
11.2. Sites anatomiques les plus touchés par l'infection nosocomiale
Quatre sites anatomiques sont particulièrement exposés à l'infection nosocomiale: - Les infections urinaires (plus de 30% du total des infections nosocomiales).
- Les plaies chirurgicales qu'elles soient superficielles ou profondes (cicatrices opératoires, brûlés ... etc, toutes étiologies confondues, elles représentent environ 30% du total).
- Les infections respiratoires basses (Pneumonies ;20% du total).
- Les infections cutanées responsables de bactériémie et septicémie (5 à 10% du total) (Malek et al., 1996).
11.3. Les bactéries responsables des infections nosocomiales
• Les bactéries à Gram-négatif sont responsables de plus de 50% des infections nosocomiales notamment les infections urinaires (Escherichia co/i) ou urinaires et pulmonaires (K/ebsiel/a spp) avec ou sans bactériémie.
•Le bacille tuberculeux est également responsable d'infections nosocomiales, parfois dramatiques quand les souches sont résistantes à plusieurs antituberculeux.
•Les légionelles sont responsables d'infections nosocomiales, dont l'origine est à rechercher
dans l'environnement humide (Lortholary et Duvivier, 2013).
• Le groupe KES (K/ebsiel/a, Enterobacter, Serratia), ces bactéries sont responsables delO à 30% des infections nosocomiales, ils donnent des septicémies souvent du mauvais pronostic, du fait du terrain sous-jacent, de la fréquence des chocs endotoxinique, et a des métastases infectieuses, et de la résistance fréquentes des antibiotiques (Poyartet
al,
2003).• Les staphylocoques sont les bactéries à Gram positif le plus souvent responsables d'infections nosocomiales et depuis quelques années, S.epidermidisà un rôle croissant dans les infections nosocomiales : infections sur cathéters et divers matériels intravasculaires en particulier dans les unités d'hématologie (Lortholary et Duvivier, 2013).
11.4.Aspects écologiques de l' antibiothérapie
L'utilisation large et non contrôlée des antibiotiques a pour risque l'émergence rapide de souches résistantes. Cette donnée a un impact pour chaque patient colonisé pouvant développer une véritable infection et être à l'origine d'une épidémie.
En effet, ce phénomène concerne également les bactéries communautaires avec possibilités d'épidémies (Meyer et al., 2004).
Chapitre II Les infections nosocomiales 11.5. Aspects économiques de l'antibiothérapie
Les données économiques comprenaient le coût lié à l'hospitalisation, le coût lié à l' antibiothérapie et aux examens de laboratoire nécessaires au diagnostic et le coût lié à la prise en charge. Les données concernant le nombre d'entrée, la durée moyenne de séjour, le nombre de journées d'hospitalisation ainsi que les prix de journées en réanimation (Lepelletier
et al,
2004).11.6. Prévention des infections nosocomiales
Pour mieux prévenir des infections qui peuvent surgir au cours des frottements d'objets contagieux, il faut :
- Considérer tout patient, tout geste thérapeutique, tout prélèvement biologique comme susceptible de comporter un risque infectieux transmissible.
- Se laver les mains avant et après chaque soin et éviter de pratiquer des soins avec des mains comportant des lésions cutanées qui doivent être isolées par des pansements efficaces. - Utiliser des gants à usage unique pour tous les gestes invasifs.
- Ne jamais« récapuchonner »les aiguilles qui doivent être éliminées dans des conteneurs de sécurité imperforables et incinérables.
- En cas de risque de projection, se protéger par le port de masque, lunettes, surblouse ... etc (Mammette, 2002).
11.7. Prophylaxie de l'infection nosocomiale
La prophylaxie est l'ensemble de mesures pour prévenir la maladie. En milieu hospitalier, elle est basée sur trois mots clés : aseptise, antisepsie et stérilisation. A cela il faut ajouter les principes fondamentaux d'hygiène hospitalière (Khiati, 2004).
11.8. Descriptions de souches bactériennesnosocomiales étudiées 11.8.1. Escherichia coli
E. coli est un bacille à Gram négatif, cette bactérie est connue depuis longtemps comme banale du tube digestif de l'homme et des animaux et pathogène pour l'appareil urinaire (Dromigny, 2011).
9::> Pouvoir pathogène
E. coli peut provoquer plusieurs types d'infections avec de syndromes polymorphes: -Les infections abdominales ; suppurations péritonéales.
- Méningites de nouveau nées ou nourrisson et les syndromes diarrhéiques. - Elle est impliquée dans les infections urinaires (Lemorta
et
al., 2006). 11.8.2. Pseudomanas aeruginosaPseudomonas aeruginosa, bacille à Gram négatif, aérobie strict à flagelle polaire, ubiquitaire, l'un de ces caractéristiques sa couleur tendance fluorescente (pigments hydrosolubles) colorés en bleu (pyocyanine ), en vert (pyoverdine ), et dégagent une odeur florale (Flandrois, 1997).
9::> Pouvoir pathogène
La pathogénie de P. aeruginosa est attribuée à la production d'un vaste arsenal de facteurs de virulence (membranaires et extracellulaires) agissant à différents niveaux au cours de l'infection, lui permettant de survivre aussi bien dans différents hôtes que dans l'environnement (Khalifa
et
al., 2011).Chapitre II Les infections nosocomiales
11.8.3. Klebseilla pneumoniae
K pneumoniae est un bacille à Gram négatif, immobiles, non sporulés.Elle fait partie du groupe KES (Klebsiella, Enterobacter, Serratia) qui est d'une grande importance en clinique hospitalière (El Fertas-Aissani et al., 2013).
ro
Pouvoir pathogèneKpneumoniae est un agent majeur d'infections nosocomiales en général et néonatales particulièrement (Boukadida et
al,
2002).Elles peuvent également causer des bactériémies, d'abcès cérébral d'infections variées de l'arbre respiratoireet des maladies chroniques comme la méningite (Botelho et al., 2007).11.8.4. Acinetobacter baumannii
Acinetobacter est un coccobacille à Gram négatif, très répandu dans la nature. On le retrouve chez l'homme dans la flore normale de la peau et de la muqueuse oro-pharyngée.
(Y emault et Demedts, 1997).
ro
Pouvoir pathogèneA l'hôpital, Acinetobacter agit comme un pathogène opportuniste. Les voies urinaires et les voies respiratoires inférieures sont les localisations préférentielles des infections, surtout chez les patients ayant une trachéostomie ou porteurs d'une sonde urinaire à demeure.
(Y emault et Demedts, 1997). Elle élabore des P-lactamases, enzymes qui hydrolysent le cycle P-lactames à 4 carbones des antibiotiques de groupe de pénicilline (Panoff, 2013).
11.8.5. Staphylococcus aureus
S. aureus est responsable pour une variété d'infections, Après coloration, ils apparaissent sous la forme de cocci à Gram positif en amas (Le loir et Garantier, 2009).
La présence d'une coagulase est utilisée pour distinguer S. aureus ( coagulase positive) des autres staphylocoques (Hart et Shears, 1997).
ro
Pouvoir pathogèneS. aureus est le premier germe responsable de bactériémies nosocomiales (Forestiera et
al., 2007). La virulence de S. aureus est due à la sécrétion de multiple toxines et enzymes qui contribuant le diversement de l'expression de pouvoir pathogène (Flandrois, 1997). S.aureus résistant à la méticilline (SARM) est longtemps resté le prototype du pathogène exclusivement nosocomiale (Tattevin, 2011).
Chapitre III
Chapitre III Les agents antimicrobiens
ID.1. Etymologie
Sur base de l'étymologie du mot« antimicrobien» (du grec anti : contre, mikros : petit et bios : vie), on définit un composé de ce type comme toute substance capable d'agir contre la vie des microorganismes (Muylaert et Maînil, 2012).
111.2. Définition
Le terme antimicrobien désigne les différents agents et substances qui tuent (microbicide), ou arrêtent (microbiostatique) la croissance des microorganismes.
La stérilisation d'un milieu signifie l'élimination de tous les microorganismes et les virus, la désinfection rend compte de l'élimination dans un milieu des microorganismes pathogènes sans que pour autant le milieu ne soit stérilisé (Bousseboua, 2002).
111.3. Les agents chimiothérapeutiques
Les sulfamides, les antibiotiques, les antifongiques et les antivirales. Ils Présentent l'ensemble des substances chimiques utilisées pour le traitement des maladies dues aux infections microbiennes, à des concentrations suffisamment faibles pour éviter d'occasionner des dommages et des toxicités chez l'hôte (Prescott et al., 2003).
)i;i- Parmi ces agents antimicrobiens, on s'intéresse aux antibiotiques, qui font l'objet de
notre étude : l'activité antibactérienne des antibiotiques en association avec l'extrait méthanolique de Crataegus azarolus.
111.3.1. Les antibiotiques
L'élimination des microorganismes pathogènes fait appel à des substances dites antibiotiques, ces dernier ont la capacité soit de détruire les bactéries (effet bactéricide), ou d'inhiber leur croissance (effet bactériostatique) (Eberlin, 1994).
111.3.1. Origine des antibiotiques
Molécule d'origine microbienne dont principalement des bactéries actinomycétales du genre Streptomyces et des moisissures des genres Penicillium et des Cepha/osporium, mais par la suite du fait de l'évolution de la technologie biologique cette notion elle fut s'élargir (Eberlin, 1994). Au sens strict, les médicaments antibactériens sont :
Produits par des microorganismes (antibiotiques) ;
Entièrement synthétisés en laboratoire (agents chimiothérapeutiques ou synthétiques) ; Un hybride de deux (agents semi-synthétiques) (Page, 1999).
111.3.2. Classifications des antibiotiques
Il existe plusieurs classifications des antibiotiques, elles sont basées sur le spectre d'action, la cible, ou la famille chimique. Cette dernière celle-ci est la plus fréquemment rencontrée. Les principales familles chimiques des antibiotiques sont:
• Bêta-lactamines: pénicilline et céphalosporines.
• Aminosides: streptomycine, gentamycine; Chloramphénicol et thiamphénicol. • Cyclines: tétracyclines, doxycycline.
• Macrolides et apparentés: érythromycine, oléandomycine (Cohen et Jacquot., 2001).
Chapitre ID Les agents antimicrobiens
ID.3.3. Mode d'action de principales familles d'antibiotiques
La plupart des antibiotiques inhibent des voies métaboliques ciblent des agents infectieux, certains agissent comme antagonistes métaboliques ou anti-métabolites, ou inhibiteurs compétitifs, d'autre substances agissent en endommageant ou en entravant les fonctionnements normaux des microorganismes. Chaque famille d'antibiotiques possède son propre cite d'action.
• Les antibiotiques agissant sur la synthèse des peptidoglycanes (paroi cellulaire) comprennent les ~-lactamines, les glycopeptides et la fosfomycine.
• Les antibiotiques agissant sur la synthèse protéique comprennent les aminosides, les tetracyclines, les macro li des et l'acide fusidique.
• Les antibiotiques agissant sur les acides nucléiques comprenant le triméthoprime, les quinolones, les nitro-imidazoles et les rifamycines.
• Les polymyxines agissant au niveau des membranes plasmique (Carbon et al., 1994).
111.3.4. Description des antibiotiques utilisés };;> Pénicilline G (P10)
C'est la première pénicilline découverte (Flemig). Elle est produite par Penicillium notatum. Elle est active sur les cocci, la plupart des bacilles a Gram positif, les anaérobies et les spirochètes. Par contre elle est inactive contre les bactéries à Gram négatif (Nauciel et vildé, 2005).
};;> Amoxicilline (AML)
L' amoxicilline est un antibiotique du groupe des aminopénicillines, de la famille des béta lactamines. Outre un spectre d'activité très similaire à celui de l'ampicilline, l'amoxicilline a une biodisponibilité orale élevée ce qui permet d'obtenir des concentrations sanguines deux fois plus élevées suite à une administration per os (Geddes et al., 2007).
};;> Colistine-sulfate (CT)
La colistine est un antibiotique polypeptique à action bactériostatique et bactéricide sur les germes Gram négatif. Aucune résistance portée par des plasmides n'a été constatée, Bien que largement employé sur le terrain notamment en association avec l' ampicilline ou l'érythromycine (Renard et al., 1991).
Chapitre IV Matériel et méthodes IV.1. Matériel
IV.1.1. Matériel végétal
C'est l'extrait brut méthanolique de fruit de Crataegus azarolus est d'aspect visqueux et de couleur marron foncé (miel).
Le fruit du zaarour jaune (Crataegus azarolus L.) provient de la wilaya de Constantine. La récolte du fruit a été réalisée en Septembre-Octobre 2014.
IV.1.2. Matériel bactériologique
IV.1.2.1. Origine des souches bactériennes étudiées
Au cours de notre étude consacrée à l'évaluation de l'activité antibactérienne de l'extrait méthanolique de l'espèce Crataegus azarolus on a utilisé des souches nosocomiales provenant des prélèvements des malades hospitaliers d'EPH de Jijel et d'EPH Taher, et des souches de références (ATCC) provenant du CHU Ben Badis de Constantine (Tableau IV.1).
Tableau IV.1. Source des souches bactériennes étudiées.
Souches Source de germes Prélèvement
Staphylococcus EPHTaher
aureus (MRSA) ECBU
Escherichia coti EPHTaher pus
Acinetobacter EPH Jijel
~
baumannii Laboratoire
d'hygiène
Klebseilla pneumoniae EPHTaher Sang
(hémoculture)
Pseudomonas EPHTaher ECBU
aeruginosa
IV.1.2.2. Les milieux de culture utilisés
Les milieux de culture utilisés sont les suivants :
Gélose Héktoen: pour l'isolement des souches: E. coli, K. pneumoniae,
P. aeruginosa.
Gélose Chapman : pour Staphylococcus aureus (même but).
Gélose M-H (Mueller-Hinton) : pour tester l'effet d'extrait testé sur les souches étudiées.
Bouillon nutritif pour la revivification des souches étudiées.
Milieu de conservation, pour conserver et transporter les souches provenant d'EPH de Jijel et de Taher.
Chapitre IV
Chapitre IV Matériel et méthodes
IV.2. Méthode
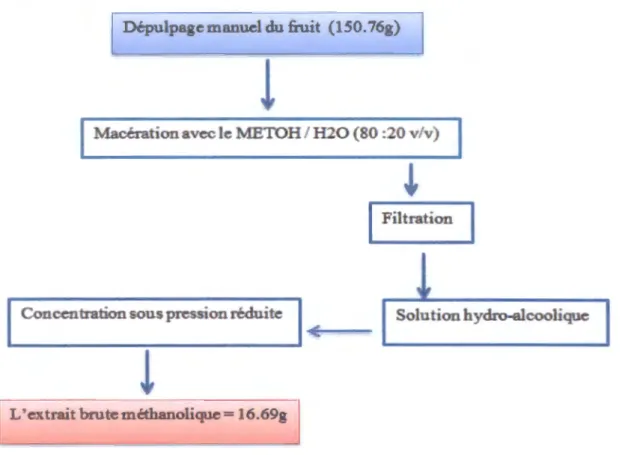
IV.2.1. Préparation de l'extrait brute méthanolique de Crataegus azarolus IV.2.1.1. Dépulpage
Cette opération a pour but de séparer la pulpe du noyau, elle a été effectuée manuellement. Ensuite, selon Mraihi et
al,
(2015), la partie charnue dénoyautée a été séchée a l'ombre et à l'abri de la lumière, dans un endroit sec et aéré à température ambiante. Devenu sec, le fruit est conservé dans des sacs en papier et stocké dans un endroit sec et aéré pour d'éventuelles utilisations.IV.2.1.2. Procédés d'extraction
150.76g de fruits (Crataegus azarolus L.) a été macéré avec de l'MeOHIH20 (80:20 v/v), dont le rapport entre plante et solvant et de 1/10, puis filtré. La solution hydro-alcoolique a été concentrée sous pression réduite pour obtenir l'extrait méthanolique de masse (m=16.69g) (Figure IV.1) (Mraihi et
al,
2015).Dépulpagemanuel du fruit (150.76g)
!
Macération avec le METOH I H20 (80 :20 v/v)
Filtration
Concentration sous pression réduite Solution hydro-alcoolique
E
!
L'extrait brute méthanolique = 16.69g
Figure IV.1. Procédés de l'extraction d'extrait méthanolique de Crataegus azarolus.
IV .2.2. Etude bactériologique
Cette étude a été réalisée en deux étapes :
./ L'association de l'extrait méthanolique de C. azarolus avec les antibiotiques .
./ La détermination de la CMI
IV.2.2.1. Revivification des souches
Dans cette opération nous avons réalisé des repiquages sur le milieu liquide (Bouillon nutritif), milieux solides sélectifs (Chapman pour S. aureus, Héktoen pour les souches
Chapitre IV
IV.2.2.2. Identification des souches bactériennes Les souches testées sont identifiées dont :
Matériel et méthodes
La provenance des souches de références (ATCC), étaient du centre Hospitalo-Universitaire de Constantine (CHU).
Les souches étudiées sont pré-identifiées au niveau du laboratoire d'hygiène (EPH de Jijel) et le laboratoire de bactériologie (EPH de Taher), et durant leur stockage, elles ont été contaminées ce qui nous a conduit à passer à la deuxième identification dans le but d'une confirmation par:
" Caractérisations microscopiques (coloration de Gram) et macroscopique (aspect de colonies sur milieu de culture).
" Les tests biochimiques.
a.Caractérisations microscopiques };;>- La coloration de Gram
C'est la coloration de référence en bactériologie. Elle est réalisée comme suit: - Réaliser un frottis et le fixer à la flamme.
- Recouvrir la lame de violet de gentiane: !minute. - Rejeter le violet de gentiane.
- Recouvrir de lugol : 1 minute. - Rejeter lugol.
- Décolorer à l'alcool.
- Stopper la décoloration par un nouveau lavage à l'eau.
- Recouvrir la lame de fuchsine diluée, 30 secondes à 1 minute. - Laver à l'eau.
- Sécher entre deux feuilles de papier filtre, puis à la chaleur. - Examiner à l'immersion (Denis et al., 2012).
b.Les tests biochimiques 1. Type respiratoire
1.1. Test de Catalase
La catalase est une enzyme présent chez les bactéries aérobies stricte et anaérobie facultatives. Elle décompose l'eau oxygénée formée, en eau et en oxygène qui se dégage.
};;>- Méthode: Sur une lame on dépose une goutte d'eau oxygénée et émulsionner un peu de la colonie suspecte ou de la culture obtenue sur gélose (Delarras, 2007).
};;>- Lecture : La réaction positive se traduit par un dégagement immédiat de bulles de gaz (02) (Delarras, 2007).
2. Métabolite glucidique 2.1. Réaction O.N.P.G
Certaines bactéries possèdent l'enzyme ~-galactosidase permet de scindée le lactose en Glucose et Galactase.
L'orthonirophényl-~-D-galactopyranoside (ONPG) est un analogue structural du lactose. Ce substrat synthétique peut être scindé en galactose et en orthonitrophénol (composé soluble jaune) en présence d'une enzyme appelée ONPG hydrolase.
Chapitre IV Matériel et méthodes ~ Méthode: Dans un tube à essai on prépare une suspension dense d'une culture bactérienne
dans 0.5ml d'eau distillée, puis on ajoute un disque O.N.P.G et incuber à 37°C pendant 24h (Denis et al, 2007).
~ Lecture
- Milieu jaune : ONPG +
- Milieu sans couleur : ONPG - (Delarras, 2007).
2.2. Mannitol mobilité
Il s'agit d'un milieu semi-solide contenant entre autres du mannitol, le rouge de phénol comme indicateur de pH.
~ Méthode : Ensemencer par piqûre centrale à l'aide du fil droit chargé de suspension de la culture à étudier puis incuber 24 heures à 37°C.
~ Lecture : La fermentation du mannitol:
- Les bactéries mannitol
+
acidifient le milieu qui vire au jaune (teinte acide du rouge de phénol).- La mobilité: du fait de la faible teneur en agar du milieu, les bactéries mobiles peuvent s'y déplacer, alors qu'une bactérie immobile ne se développe que la longue du piqueur central (Denis et al, 2007).
2.3. Milieu TSI
Ensemencer le culot du milieu par piqûre centrale et la pente par stries serrées, afin d'avoir une culture en nappe avec la souche bactérienne à tester. Incubation à 37°C/24h.
~ Lecture
- Une coloration jaune de la zone intermédiaire indique un saccharose positif. - Une coloration jaune de la pente indique un lactose positif.
- Une coloration jaune du Culot montre un glucose positif.
Ce test permet également la production de H2S (noircissement de la zone joignant la pente et le culot) et de Gaz (bulles dans la gélose) (Delarras, 2007).
2.4. Citrate de Simmons
Ce milieu ne contient qu'une seule source de carbone: le citrate. Seules les bactéries possédant une citrate-perméase sont capables de se développer sur ce milieu.
~ Méthode :Ensemencéedu milieu par strie longitudinale à l'aide d'une anse contenant une colonie et incubé à 30°C±l °C pendant 24heures.
~ Lecture
Citrate-positive: culture avec alcalinisation du milieu (virage de l'indicateur au bleu). Citrate-négative: pas de culture (coloration verte de milieu inchangée (Denis et al, 2007).
2.5. Réaction de vogues-proskauer (VP) et de rouge de méthyle (RM)
On prélève 2ml du milieu Clark et Lubs contenant la souche à étudier et déjà incubé 48 heures à 37°C puis on ajoute dans deux tubes:
Chapitre IV
r:ir le réactitVP, Agiter et attendre 15min. r:ir le rouge de méthylène,
);;> Lecture
Matériel et méthodes
-Une teinte rouge indique une réaction VP positive, couleur inchangé VP négative.
- Une teinte rouge indique une réaction RM positive et teinte jaune RM négative (Delarras, 2007).
3. Métabolisme protéique
);;> ADH, LDC, et ODC
Les enzymes ADH, LDC et ODC catalysent respectivement la décarboxylation de l' arginine, de la lysine et de l' ornithine présent dans le milieu. Cette dégradation aboutit à la formation de produits basiques ; l'alcalinisation du milieu est révélée par un virage de l'indicateur de pH (le pourpre de bromocrésol) à sa teinte basique (violette).
Ensemencer le milieu avec une goutte de suspension bactérienne dense (Delarras, 2007).
4. King Aet King B
Sont des milieux de culture pouvant être utilisés comme test de confirmation suite à la
détection de P.
aeruginosa.
};;>- Méthode : On ensemence un tube de chaque milieu en faisant une strie
médiane à la surface de la gélose en pente du milieu. Incubation 3 7°C pendant 48heures
);;> Lecture
couleur jaune-vert fluorescent sur le milieu King B (présence de pyoverdine) sous UV.
- couleur bleue sur le milieu King A (présence de pyocyanine) (Denis et al, 2007).
IV.2.3. Méthodes d'étude d'activité antibactérienne de l'extrait IV.2.3.1. L'antibiogramme par diffusion sur milieu gélosé
L' Antibiogramme est une méthode de travail microbiologique, utilisant un milieu gélosé
spécifique «la gélose Mueller Hinton » en boite de Pétri, l'épaisseur de la gélose doit être
strictement de 4mm répartie uniformément. Et disques imprégnés d'antibiotiques à des concentrations déterminées.
En mesurant les diamètres des zones d'inhibition autour des disques d'antibiotiques et on consulte les tableaux de concentrations, diamètres critiques et règles de lecture interprétative pour des familles ou des genres bactériens déterminés, on peut savoir si, pour les antibiotiques testés, une souche bactérienne est sensible, intermédiaire ou résistante (Delarras, 2014).
La technique utilisée dans notre travail est celle de NCCLS (National Committee for Clinical Laboratory Standard) (NCCLS, 1985 ; Comité OMS, 1977).
a. Procédé
Déposer les disques d'antibiotiques à la surface d'un milieu écouvillonné par une suspension microbienne d'une densité optique de 0,5McFarlend.
Les boites sont pré-séchées avant l'emploi.
A la fin de la durée d'incubation (18-24h) des souches bactériennes, des diamètres de zones d'inhibition sont mesurés en millimètre en utilisant une règle (Ericsson et Sherris, 1971).
Chapitre IV Matériel et méthodes IV.2.3.2. L'aromatogramme par diffusion sur milieu gélosé
L'aromatogramme est une méthode qui se réalise in vitro, basée sur une technique utilisée en bactériologie médicale, appelée antibiogramme. Le contact se fait par l'intermédiaire du disque de papier Whatman N°3 sur lequel on dispose d'une quantité donnée del'extrait de plante. (Fauchère et Avril, 2002).
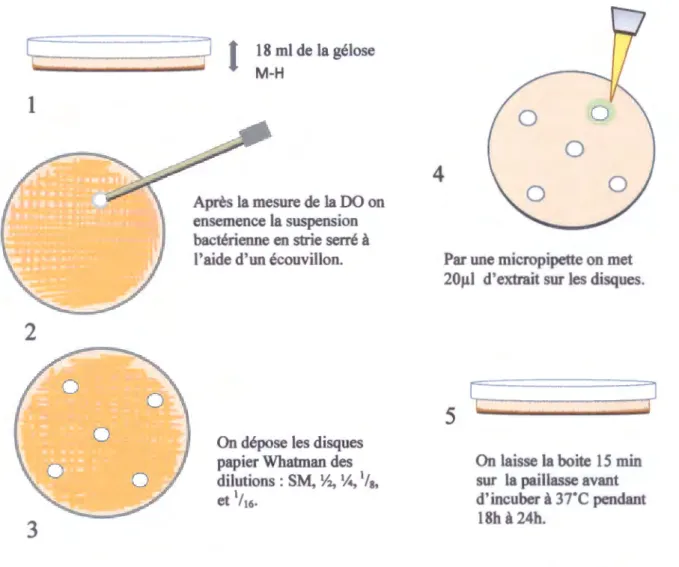
a. Préparation des disques
Couper le papier whatman N°3 en disque de 6mm, ces disques doivent posséder un contour régulier pour donner une zone d'inhibition que l'on peut mesurer facilement.Ces disques sont
stérilisés dans un autoclave pendant 20minutes àl20°C (Fauchère et Avril, 2002).
b. Préparation des dilutions d'extrait méthanolique de C. azarolus
Une solution a été préparée en solubilisant 50mg de l'extrait méthanolique de Crataegus
azarolus dans une solution de lOml d'eau distillée.
A partir de cette solution on prend 6.4ml et en ajoute 3.6ml d'eau distillé à cette dernière on l'appelle la solution mère.
A partir de cette solution mère réaliser une série des dilutions (Tableau IV.2).
Tableau IV.2 : Les différentes dilutions de la solution mère (Carbonelle et al., 1987 ;
Courvalin et al., 1988).
Concentration Volume en ml Volume d'eau Concentration f"male
initiale en µ.g/ml distillée en ml en µ.g/ml 50000 6.4 3.6 3200 3200 2 2 1600 1 3 800 0.5 3.5 400 0.5 7.5 200 200 2 2 100 1 3 50 0.5 3.5 25 0.5 7.5 12.5 12.5 2 2 6.25 1 3 3.125 0.5 3.5 1.56 0.5 7.5 0.78
Chapitre IV Matériel et méthodes c. Procédé
Différents types d'aromatogrammes, en milieu solide, liquide, sont exploitables. Cependant, en pratique, nous avons utilisé la méthode d'aromatogramme en milieu solide qui est la plus simple, pour déterminer la sensibilité ou la résistance des bactéries vis-à-vis d'extrait testé. La figure IV.2, décrit les étapes de cette méthode préconisée par Carson et al, 1995.
1
2
3
J
18 ml de la gélose M-H Après la mesure de la DO on ensemence la suspension bactérienne en strie serré à l'aide d'un écouvillon.On dépose les disques papier Whatman des dilutions: SM, lh, V.., 1/ 8, et 1/16·
0
0
4
Par une micropipette on met
20µ1 d'extrait sur les disques.
5
On laisse la boite 15 min sur la paillasse avant d'incuber à 37"C pendant
18h à 24h.
Figure IV.2: Protocole du test de l'aromatogramme (Carson et al, 1995).
IV.2.3.3. L'antibiogramme en association avec l'extrait brut méthanolique de Crataegus azarolus
)P> Méthode
- Préparer une culture en phase exponentielle en milieu liquide (1 Oml de bouillon nutritif) de la bactérie à étudier.
- Mesurer la densité optique à 0,5McFarlend d'une suspension bactérienne.
- La gélose M-H, préalablement fondue au bain marie a été coulée en boite de Pétri à une épaisseur de 4mm.
- Ensemencer en stries serrés, à l'aide d'un écouvillon toute la surface de la boite.
- Déposer cinq disques d'antibiotique (AML et P1o) dans les boites précédentes (dont chaque type d'antibiotique est mis seul en respectant l'espace entre eux).
- Mettre 20µ1 de chaque dilution de la gamme de l'extrait déjà préparé sur les disques d'antibiotique, en allant de la concentration la plus forte vers la concentration la plus faible. Les boites sont pré-séchées avant l'emploi (Ericsson et Sherris, 1971).
Chapitre IV Matériel et méthodes NB:
Deux boites sont utilisées pour chaque souche, dont une boite pour l' amoxicilline et l'autre boite pour la pénicilline G.
> Lecture
A la fin de la durée d'incubation (18-24h) des souches bactériennes, les diamètres des zones d'inhibition sont mesurés en millimètre en utilisant une règle (Ericsson et Sherris, 1971).
IV.2.3.4. Détermination de la CMI en milieu solide
La concentration minimale inhibitrice ou CMI est la concentration plus faible d'un antibiotique capable d'empêcher le développement d'un microorganisme particulier (Prescott et al., 2010).
La CMI peut être déterminée soit en milieu solide soit en milieu liquide. Nous avons choisi la première méthode parce qu'elle est plus facile à réaliser.
a. Procédé
On prépare une culture en phase exponentielle en milieu liquide (1 Oml de bouillon nutritif) de la bactérie à étudier.
- On repique O,lml (bacille à Gram négatif), 0,3ml (S.
aureus, P. aeruginosa)
de la culture de 18heures dans lOml de bouillon nutritif (Ou autre bouillon adéquat pour la bactérie à étudier).- Mettre à l'étuve à 37°C pendant 3 à 5 heures, jusqu'à l'apparition d'une légère opalescence. - Mettre 2ml de chaque dilution de l'extrait dans les boites Pétri, et on ajoute 18ml de la gélose
M-H et faire des mouvements circulaires jusqu'à l'homogénéisation, dont 20ml par boite. - Laisser les boites de Pétri quelques minutes sur la paillasse pour la solidification de la gélose. - Ensemencer en strie à la surface de la gélose les souches bactériennes étudiées (cinq bactéries
nosocomiales et trois souches de références)
- Incuber les boites pendant 18h à 37°C (Figure IV.3) (Carbonelle et al., 1987; Courvalin et al., 1988).
>Lecture
Lire les concentrations minimales inhibitrices (CMI): concentration d'antibiotique (l'extrait méthanolique de la plante
Crataegus azarolus)
pour laquelle il n'y a pas de culture bactérienne visible (Carbonelle et al., 1987 ; Courvalin et al., 1988).1 L
L
rL
L
Chapitref\1
,
1. Mettre 2 ml de dilution de la gamme d'extrait dans des boites Pétri vide.2. Couler la gélose MH et faire des mouvements circulaires jusqu'à l'homogénéisation.
Matériel et méthodes
3. Après solidification du milieu, ensemencer par strie.
Figure IV.3: Protocole du test de la CMI selon Carbonelle et al., (1987) et Courvalin et al., (1988).
Chapitre V
Chapitre V Résultats et discussion V.1. Résultats
V.1.1. Identification des souches bactériennes
V.1.1.1.Caractérisation microscopique des souches bactériennes étudiées a. La coloration de Gram
Les bactéries colorées en violet sont des bactéries à Gram positif et celles colorées en rose sont des bactéries à Gram négatif (figureV.1). Le tableau V.1 présente les observations microscopiques des souches étudiées.
Tableau V.1: Les observations microscopiques
Souches Gram A. baumannii Négatif E. coli Négatif K. pneumoniae Négatif P. aeruf(inosa Négatif S. aureus Positif
•
A
•
.
.
...
forme Coccobacille Coccobacille Bacille BacilleCocci en amas ou isolé
. r
..
- ~·Figure V.1: Les observations microscopiques A: P. aeruginosa, B: S.aureus (G:xlOO).
V.1.1.2. Caractérisation macroscopique des souches bactériennes étudiées
A. baumannii: Les colonies ont de 1 mm de diamètre, elles sont lisses, blanc-jaunâtre et
d'aspect butyreux.
E. coli : colonies Smooth de 2 à3mm acidifications du milieu Héktoen, lisse, couleur brique. K. pneumoniae : colonie de 3 à 4mm, rondes, bombée, muqueuses, translucides.
P. aeruginosa: colonies muqueuse, bombées, opaques, visqueuses parfois coulantes. S. aureus : colonies lisses, rondes, bombées, jaune doré, opaques, de lmm de diamètre.
Chapitre V Résultats et discussion V.1.1.3. Résultats des tests biochimiques
Les résultats des tests biochimiques sont résumés dans le tableau suivant (tableau V.2). TableauV.2 : Résultats de confirmation de l'identification des bactéries
~
A. baumannii E.coli K. pneumoniae P. aeruginosa S. aureuss Mannitol
-
+
+
-
+
Mobilité -+
-
+
-Glucose /+
+
-+
Lactose+
+
+
-
/ saccharose /+
+
- / Gaz+
+
+
+
/ H2S / - --
/ Citrate / -+
+
/ Test+
/ /+
+
catalase LDC /+
+
- / ODC /+
- - / ADH / -+
+
/ King A / / / Pyocyanine+
/ KingB / / / / / VP /-
+
-
+
O.N.P.G /+
+
/ / RM /+
-
--(/) : Absence de résultat, ( +) : résultat positive, (-): résultats négative.
ro
D'après les résultats on a confirmé que nos souches sont:A. baumannii, E. coli, K. pneumoniae, P. aeruginosa, et S. aureus.
Chapitre V Résultats et discussion V.1.2. Résultats d'activités antibactériennes
Nous avons analysé l'activité antibactérienne de l'extrait méthanolique de
Crataegus azarolus par la méthode de diffusion en milieu solide.
L'effet de l'extrait se traduit par l'apparition d'une zone d'inhibition autour du disque de papier imprégné d'extrait brut étudié. Le diamètre de la zone d'inhibition diffère d'une bactérie à une autre.
V.1.2.1.Résultats de l'antibiogramme
Après 24h d'incubation à 37°C, on a récupéré les boites et on a mesuré les diamètres des zones d'inhibition des antibiotiques: Colistine sulfate50µg,Amoxicilline 25µg, Pénicilline 1 Oµg, sur les différentes souches bactériennes testées, les résultats obtenus sont résumés dans le tableau V.3 (Figure V.2).
A partir des résultats obtenus, toutes les souches sont sensibles à la Colistine sulfate, mais ils présentent une résistance remarquable vis-à-vis l' Amoxicilline et la Pénicilline G, sauf S.
aureusA TCC 25923 et S. aureus (la bactérie responsable des infections nosocomiales) qui
donnent des zones d'inhibition de 40mm et 8mm avec l' AML, et 32mm et 8mm avec P10 respectivement.
TableauV.3: Les zones d'inhibition des antibiotiques sur les souches bactériennes utilisées.
~
CT AMLPm
s E. coli ATCC 25922 18 R R S. aureus ATCC25923 12 40 32 P.aeruginosa ATCC 27853 18 R R A. baumannii 14±2.82 R R P. aeruginosa 19±1.41 R R K. pneumoniae 18±2.82 R R E. coli 17±1.41 R R S. aureus 12±0 8 8NB: Les valeurs sont d'une moyenne de 2 essais± SD (les zones sont mesurées en mm).
Chapitre V Résultats et discussion
FigureV.2: Les résultats de l'antibiogramme.
A : E. coli, B : A. baumannii, C :P. aerugi,nosa, D : S. aureus.
V.1.2.2. Résultats de l'aromatogramme
Après 24h d'incubation à 37°C, on a récupéré les boites et on a mesuré les diamètres des zones d'inhibition de l'extrait méthanolique de Crateagus azarolus sur les différentes souches bactériennes testées, les résultats obtenus sont dressés dans le tableauV.4.
L'extrait méthanolique de Crataegus azaro/us donne des diamètres d'inhibition allant de 17 ±1.41 à 13 ± 1.41 pour Staphylococcus aureus ATCC25923, et de 18 ± 0 à 12 ±1.41 pour S. aureus.
TableauV.4 : Les zones d'inhibition d'extrait sur les souches bactériennes utilisées. Diamètre de zones d'inhibition en mm
SM 112 1/4 1/8 1/16 E. coli ATCC 25922 16± 0 12± 0 12±0 10± 0 9± 1.41 P. aeruginosa ATCC 27853 14± 0 13 ± 1.41 12± 0 11± 1.41 11±0 S. aureus ATCC 25923 17± 1.41 16± 0 15 ± 1.41 13 ±1.41 13± 1.41 E. coli 15 ±1.41 14 ± 2.82 13± 1.41 13 ± 1.41 11±1.41 P. aeruginosa 13± 1.41 13± 1.41 12± 0 11±1.41 9 ±1.41 A. baumannii 15 ± 1.41 14± 0 13 ± 1.41 10± 0 9 ± 1.41 K. pneumoniae 16± 0 14± 0 12± 0 10± 0 8±0 S. aureus 18 ±0 16± 0 15 ± 1.41 15 ± 1.41 12±0
NB :Les valeurs sont d'une moyenne de 2 essais± SD (les zones sont mesurées en mm).
Chapitre V Résultats et discussion V.1.2.3. Résultats de l'association de l'extrait méthanolique de C. azarolus et les antibiotiques
Après incubation des souches bactériennes étudiées (les bactéries nosocomiales et les souches de références) à 37°C pendant 24 heures on a mesuré les zones d'inhibition en millimètre (Figure V.3),et on a alors obtenules résultats montrés dans le tableau V.5 et le tableau V.6, dont le premier tableau représente les résultats de l'association de l'extrait méthanolique de C. azarolus avec l'amoxicilline (AML),et le deuxième représente les résultats de l'association de l'extrait avec la pénicilline G (PIO).
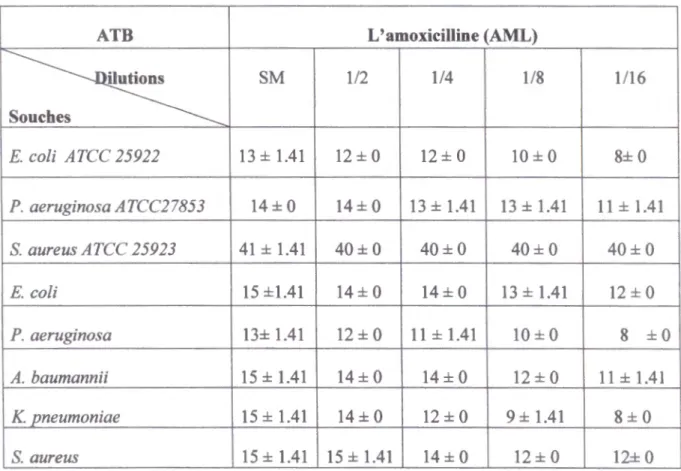
a. Résultats de l'association de l'extrait méthanolique de C. azarolus et I' Amoxicilline
À partir de tableau V.5, on remarque qu'il y a une homogénéité des résultats (dans l'intervalle de 15mm vers 8mm) pour les souches: E. coli ATCC 25922, P. aeruginosa
ATCC27853, E. coli, P. aeruginosa, A. baumannii, K. pneumoniae, dont la zone la plus petite est celle d'E. coli ATCC 25922 allant de 13 ± 1.41mm à 8 ± Ornm, et la zone la plus grande est celle de S. aureusATCC 25923 qui donne des zones d'inhibition de 41 ± 1.41 à 40 ± Ornm.
Tableau V.5: Résultats de l'association de l'extrait méthanolique de C. azarolus avec l' AML
ATB L'amoxicilline (AML)
~
SM 1/2 114 1/8 1/16 s E. coli ATCC 25922 13 ± 1.41 12± 0 12± 0 10± 0 8±0 P. aeruginosa ATCC27853 14± 0 14± 0 13 ± 1.41 13 ± 1.41 11±1.41 S. aureus ATCC 25923 41±1.41 40±0 40±0 40± 0 40±0 E. coli 15 ±1.41 14± 0 14± 0 13 ± 1.41 12± 0 P. aeruginosa 13± 1.41 12± 0 11±1.41 10± 0 8 ±0 A. baumannii 15 ± 1.41 14± 0 14± 0 12± 0 11±1.41 K. pneumoniae 15 ± 1.41 14± 0 12± 0 9 ± 1.41 8±0 S. aureus 15 ± 1.41 15 ± 1.41 14± 0 12 ± 0 12± 0NB :Les valeurs sont d'une moyenne de 2 essais± SD (les zones sont mesurées en mm)
Chapitre V Résultats et discussion b. Résultats de l'association de l'extrait méthanolique de C. azarolus et le Pénicilline G
Selon le tableau V .6, on remarque que toutes les bactéries sont sensibles à l'extrait méthanolique mais nous avons constaté aucun effet de l'association avec les antibiotiques sauf l'association de l'extrait et la pénicilline G, qui a donné une grande zone d'inhibition avec la souche S. aureus ATCC 25923 (allant de 41±Ommà40 ± Omm), suivie par S.aureus
(17 ± l.4lmm àl2 ± Omm), et la plus petite zone est celle de P. aeruginosa (de 13±
l.4lmmà9 ± l.4lmm).
Tableau V.6: Résultats de l'association de l'extrait méthanolique de C. azarolus avec la P10.
ATB Pénicilline G (P10)
~
SM 112 1/4 1/8 1/16 s E. coli A TCC 25922 13 ± 1.41 12± 0 11 ± 1.41 11±1.41 ll ± 1.41 P. aeruginosa ATCC 27853 13 ±1.41 13 ± 1.41 11± 1.41 10±0 10±0 S. aureus A TCC 25923 41±1.41 41±1.41 41±1.41 40±0 40±0 E. coli 14±1.41 13 ± 0 12± 0 12 ± 1.41 11±0 P. aeruginosa 13± 1.41 12± 2.82 11± 1.41 10± 0 9 ± 1.41 A. baumannii 15± 1.41 14± 0 13 ± 1.41 10± 0 9±0 K. pneumoniae 16± 0 14± 0 12± 0 11 ± 1.41 9 ± 1.41 S. aureus 17 ± 1.41 15± 1.41 14± 0 13 ± 1.41 12± 0NB :Les valeurs sont d'une moyenne de 2 essais± SD (les zones sont mesurées en mm)
Chapitre V Résultats et discussion
Figure V.3 : Résultats de l'association de l'extrait méthanolique de C. azarolus avec les
antibiotiques, a: S. aureus (AML), b: P. aeruginosa (PlO).
V.1.2.4.Détermination de la CMI (Concentration minimale inhibitrice)
Les résultats du test de la concentration minimale inhibitrice de l'extrait méthanoliquede
Crataegusazarolussont résumés dans le tableau V. 7.
Tableau V.7: CMis en (µg/ml) de l'extrait méthanoliquede C. azarolus avec les souches
bactériennes étudiées. Souches CMI en (µg/ml) E. coli A TCC 25922 100 P. aeruginosa ATCC 27853 100 S. aureus ATCC 25923 50 E. coli 200 P. aeruginosa 200 A. baumannii 100 K. pneumoniae 200 S. aureus 50 NB:
- Pour chaque souche testée la CMI est déterminée deux fois pour nous assurer que les résultats sont reproductibles.